Method Article
Dosage Comportements Alimentation prédatrices dans
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Behavioral assays provide powerful tools for understanding neuronal function. Here we present several protocols for quantifying predatory feeding behavior found in the model nematode Pristionchus pacificus and its relatives. Additionally, we provide methods for analyzing predatory feeding adaptations including mouth structures and teeth.
Résumé
This protocol provides multiple methods for the analysis and quantification of predatory feeding behaviors in nematodes. Many nematode species including Pristionchus pacificus display complex behaviors, the most striking of which is the predation of other nematode larvae. However, as these behaviors are absent in the model organism Caenorhabditis elegans, they have thus far only recently been described in detail along with the development of reliable behavioral assays 1. These predatory behaviors are dependent upon phenotypically plastic but fixed mouth morphs making the correct identification and categorization of these animals essential. In P. pacificus there are two mouth types, the stenostomatous and eurystomatous morphs 2, with only the wide mouthed eurystomatous containing an extra tooth and being capable of killing other nematode larvae. Through the isolation of an abundance of size matched prey larvae and subsequent exposure to predatory nematodes, assays including both "corpse assays" and "bite assays" on correctly identified mouth morph nematodes are possible. These assays provide a means to rapidly quantify predation success rates and provide a detailed behavioral analysis of individual nematodes engaged in predatory feeding activities. In addition, with the use of a high-speed camera, visualization of changes in pharyngeal activity including tooth and pumping dynamics are also possible.
Introduction
Nématodes avec leurs petits mais complexes systèmes nerveux se sont révélés de puissants outils pour la compréhension de nombreux aspects de la neurobiologie, y compris le comportement. Une grande partie de cette recherche a mis l' accent sur l'organisme modèle Caenorhabditis elegans dans lequel une multitude de comportements différents ont été disséqués avec succès et analysés. Ceux - ci comprennent mécanosensorielle 3, chimiotactique 4, thermotactic 5,6 et magnétotactiques 7 influencer l' accouplement 8,9, l' apprentissage et l' alimentation 10 comportements 11. Cependant, d' autres espèces de nématodes plus lointainement connexes affichent des comportements qui ne sont pas observés dans le rhabditid C. elegans ou encore présentent des niveaux de complexité supplémentaires, ce qui soulève des questions pertinentes concernant leur évolution et de la réglementation. Un tel exemple de ceci peut être observé dans le nématode diplogastrid lointainement liée Pristionchus pacificus, qui affiche beaucoup plus complexe d' alimentation soitportements et les rythmes que sont observés en C. elegans 1. Ceci malgré les deux espèces partageant neurones pharyngés homologues 12. Coïncidant avec ces comportements alimentaires supplémentaires, P. pacificus affiche également une gamme alimentaire élargi, car ils sont des prédateurs avides, capables de compléter leur régime alimentaire bactérienne par également l' alimentation sur les larves d'autres nématodes. Heureusement, P. pacificus a été développé comme un modèle pour la biologie évolutionniste comparative et intégrative et donc de nombreux outils moléculaires et génétiques sont maintenant disponibles. Ceux - ci comprennent un génome entièrement séquencé et annoté 13, des outils moléculaires et génétiques , y compris les transgènes 14 et CRISPR / cas9 15,16 ainsi qu'une phylogénie détaillée et annotée 17 avec plus de 25 espèces étroitement apparentées , y compris ses espèces sœurs nouvellement découvertes. En outre, l'écologie de nombreuses espèces , y compris P. Pristionchus pacificus est nousll défini avec beaucoup d' espèces ayant été décrit le partage d' une association necromenic avec des scarabées, un hôte qu'ils partagent souvent avec d' autres espèces de nématodes 18. P. pacificus fournit donc un excellent système de modèle avec lequel pour disséquer l'évolution des nouveaux comportements et de leur importance écologique.
Afin d'analyser les comportements alimentaires prédateurs dans les espèces de nématodes comme P. pacificus nous avons développé plusieurs tests comportementaux nouveaux pour l' observation et la quantification des actions prédatrices facile. P. pacificus affiche une structure de bouche dimorphisme, qui influence fortement le comportement prédateur, l' identification de la bonne morphotype est essentielle 1,2. L'étroite morph stenostomatous bouche contient une seule dorsale dent émoussé et ne se livrent à aucune alimentation prédatrice. Alternativement, la grande morph eurystomatous bouche comprend une beaucoup plus grande en forme de griffe dorsale dent et un montant supplémentaire adversedent sous-ventrale, qui fonctionnent ensemble pour ouvrir efficacement la cuticule de leurs proies. Le rapport de la eurystomatous prédateurs à la forme stenostomatous non prédateurs varie selon les espèces Pristionchus et aussi à l' intérieur P. pacificus, cependant, le pourcentage de la bouche eurystomatous morph dans le P. pacificus souche de type sauvage (pS312) est habituellement 70-90% 2. En outre, les rapports de forme de bouche peuvent fluctuer en fonction de différentes influences environnementales (à la fois connues, y compris la famine et une petite molécule de signalisation ainsi que des facteurs inconnus), l'identification ainsi correcte et l'isolement de la forme de la bouche eurystomatous prédateur est essentiel pour les essais prédateurs avec succès.
A côté de la description de la forme de la bouche d'éviction, nous avons développé un «essai de morsure» pour l'observation directe et la quantification des comportements prédateurs, y compris mordre, tuer et nourrir les événements. Voici les nématodes proies sont isolés à travers le filtretion des cultures nouvellement affamés et exposés à des adultes prédateurs P. pacificus, qui sont observés ensemble sur un court laps de temps. En outre, nous avons également développé un haut débit "essai de cadavre» pour faciliter le dépistage rapide du comportement prédateur par l'observation indirecte des événements prédateurs. Cela profite de la présence de cadavres de larves comme un outil pour le dépistage de la prédation. Les deux essais fournissent des méthodes faciles et hautement reproductibles pour observer et mesurer le comportement prédateur des espèces de nématodes tels que P. pacificus.
Protocole
1. Formulaire Mouth phénotypage
- Mouth Formulaire d' identification sur Agarose Pads
Remarque: Afin de visualiser la bouche morphes de nématodes, immobiliser les vers avec un traitement anesthésique doux sur des tampons d'agarose et d'observer comme suit.- Cultiver et maintenir des cultures de nématodes tels que P. pacificus sur 6 cm médias de croissance des nématodes standards (NGM) plaques et aliments sur une pelouse bactérienne de E. coli OP50 19.
- Faire des blocs d' agarose en ajoutant d' abord 0,06 g d' agarose à 3 ml H 2 O dans un tube de 15 ml pour préparer une solution de 3 ml d' agarose à 2%. Cela peut être stocké pendant jusqu'à un an à 4 ° C
- Mélanger et faire fondre complètement l'agarose dans un micro - ondes ou encore utiliser un bloc chauffant à> 88 ° C
- Une fois complètement fondu, ajouter 10 pl d'une solution à 10% d'azoture de sodium dans de l'agarose et bien mélanger. ATTENTION: L'azoture de sodium sec est réactif et toutes les formes sont toxiques.
- En utilisant 1 mlmicropipette, déposer une goutte de pas moins de 300 pi du liquide azoture mélange agarose sur le milieu d'une lame de microscope en verre standard.
- Avant refroidit l'agar, placez rapidement une seconde lame de microscope sur le dessus de la baisse afin d'aplatir l'agarose qui forme un tampon lors du refroidissement. Répétez l'opération pour autant de tampons que nécessaire.
- Juste avant l'utilisation, le zeste d'intervalle les lames de microscope en verre en les faisant glisser les uns les autres. Remarque: Si des tampons d'agarose sont préparés trop à l'avance, ils peuvent être trop secs et peuvent endommager les nématodes.
- Pour transférer vers les tampons d'agarose anesthésiques, placer une goutte de tampon M9 (2 - 3 pi) sur le centre du pavé. Choisissez 2 - 3 jeunes P. adultes pacificus dans la goutte de M9 avant de placer soigneusement une lamelle sur le pavé. P. nématodes pacificus seront immobilisés dans l'agarose et prêt à visualiser.
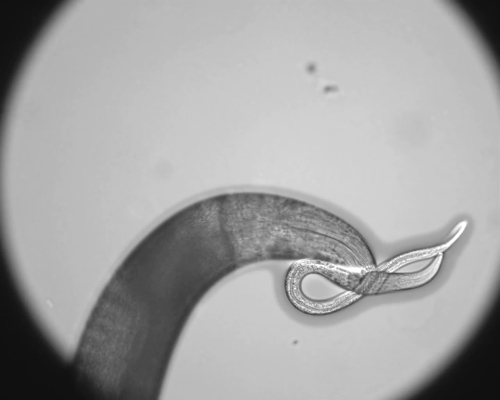
- Transférer la lame de microscope contenant le ver anesthésié à un microscope une appropriéend observer dans l'optique 63X Nomarski. Catégoriser identités de morphing sur la base des caractéristiques suivantes: la présence d'un sous-ventrale dent supplémentaire, élargie dent dorsale et grande ouverture est indicative d'une eurystomatous bouche morph animal, tandis que la présence d'une seule dent dorsale et étroite ouverture de la bouche indique un stenostomatous des animaux (Figure 1).
Remarque: Afin de maintenir la santé de l'animal, les vers devraient être maintenus sur le pad agar pour pas plus de 5 min. - Après la bouche identification de morphing, de récupérer les nématodes soit eurystomatous ou stenostomatous au besoin en enlevant la lamelle par doucement glisser le tampon d'agarose. Choisir soigneusement les animaux sélectionnés dans le tampon d'agarose (E. coli OP50 peut être utilisé sur la sélection pour aider à rendre collantes) sur des plaques NGM fraîches. Autoriser la récupération de l'anesthésie jusqu'à ce que le comportement motilité normale a repris sur lequel les animaux sont prêts pour d'autres essais prédateurs.
- Rapid Mouth phénotypage
Remarque: Vous pouvez également, avec plus d'expérience, de la bouche type de formulaire peut être testée sans la nécessité d'un traitement anesthésique par un stéréomicroscope avec un fort grossissement (150X).- La place des nématodes sur des plaques NGM standard avec une pelouse bactérienne de E. coli OP50 sur la zone de visualisation de microscope.
- Détecter des différences dans la taille de la bouche et de la largeur. Note: A ce grossissement ne dent comme les structures sont observables donc l'identification de la bouche morph est uniquement basé sur de larges bouches par rapport bouches étroites.
2. Bite Assay
Note: les essais Mordre permettent une analyse comportementale prédatrice détaillée.
- Cultiver et maintenir des cultures de nématodes sur les plaques standard NGM (6 cm) et se nourrissent sur une pelouse bactérienne de E. coli OP50 19.
- Fabriquer des plaques d'essai en cultivant une quantité importante de larves de nématodes choisis de proies telles que C. elegans ou alternatively une proie écologiquement pertinente appropriée. Note: Adulte C. elegans sont trop grands pour être une proie appropriée de sorte qu'il est important d'utiliser le stade larvaire.
- Maintenir C. elegans ou d' autres espèces de proies potentielles sur les plaques standard NGM et aliments sur une pelouse bactérienne de E. coli OP50 jusqu'à ce que la population est fraîchement faim, ce qui entraîne une abondance de jeunes larves de L1.
Remarque: L' heure de la famine dépend de nombreux facteurs environnementaux et expérimentaux, y compris le nombre de nématodes utilisés pour démarrer la culture, la quantité de E. coli OP50 ajoutée et la température ambiante.
- Maintenir C. elegans ou d' autres espèces de proies potentielles sur les plaques standard NGM et aliments sur une pelouse bactérienne de E. coli OP50 jusqu'à ce que la population est fraîchement faim, ce qui entraîne une abondance de jeunes larves de L1.
- Laver quatre ou plusieurs plaques de proies fraîchement affamés avec M9 et passer la solution à vis sans fin à travers deux 20 um filtres pour éliminer tous les gros animaux et des oeufs restants avant la collecte dans un tube de 15 ml. Seul petit larves doit rester dans la solution.
- Pour former une pastille larvaire centrifuger la proie filtrée à 377 g pendant 1 min.
- Pipette 3 pi de culot à vis sans fin pur sur une plaque de NGM 6 cm sans E. coli OP50 présent et attendre au moins 30 minutes pour les larves d'étaler suffisamment pour générer une plaque d'essai.
Note: 3 pi de culot à vis sans fin pur sur les plaques d'essai standard contiennent> 3.000 larves de proie. Cela est suffisant pour générer des contacts fréquents entre les prédateurs et les proies. - Écran nématodes prédateurs pour le morph de bouche requise (protocole 1).
- En utilisant des techniques de ver la cueillette standard et un stéréomicroscope lumière 19, transférer les prédateurs correctement classés sur la plaque d'essai. Prenez soin de transférer comme petites bactéries OP50 que possible de la plaque d'essai lors du transfert des prédateurs afin de minimiser la contamination bactérienne. Attendre 15 minutes pour permettre le ver de récupérer du stress d'être transféré et vérifier de type sauvage comportement motile pour assurer les vers ne sont pas endommagés par le transfert.
Remarque: Il n'y a pas besoin de mourir de faim P. pacificus, car ils sont des prédateurs très efficaces d'autres larves de nématodes même si bien nourris sur les bactéries. - Après la récupération, observez le prédateur en utilisant un stéréomicroscope lumière pendant 10 min. Avec cet équipement, observer et caractériser les événements d'alimentation distincts tels que mordre, caractérisé par le prédateur limitant le mouvement de la proie, tuant, où par une ouverture de la cuticule de proie est détectée; et l' alimentation, classées par une consommation observable des entrailles proies (figure 2A, B et cinéma 1).
- Répéter le dosage par criblage et en observant un minimum de 10 nématodes prédateurs individuels pour garantir la précision.
3. Corpse Assay
Note: les essais de Corpse facilitent une quantification plus rapide du comportement prédateur.
- Cultiver et maintenir des cultures de nématodes sur des plaques NGM standard et nourrir sur une l bactérienneawn de E. coli OP50 19. Générer triplicats des plaques d'essai mentionnées précédemment (protocole de 02.01 à 02.05).
- Écran nématodes prédateurs pour la bouche morph nécessaire comme décrit dans le protocole 1. En utilisant des techniques de ver la cueillette standard et un transfert de stéréomicroscope lumière 5 nématodes prédateurs avec la bouche morph nécessaire pour chaque plaque d'essai. Laissez les prédateurs ainsi que la proie pendant 2 heures.
- Après 2 h écran la plaque d'essai pour la présence de cadavres vidés (Figure 2B et C). Identifier les cadavres par l'absence de la motilité ainsi que des défauts morphologiques évidentes, y compris les fuites entrailles ou manquant des fragments de ver.
4. Analyse des pharyngée et le mouvement des dents
- Cultiver et maintenir des cultures de nématodes sur des plaques NGM standard et nourrir sur une pelouse bactérienne de E. coli OP50 19. Générer des plaques d'essai comme indiqué précédemment (protocole 2/1 à 2/5). Si standards 6 cmplaques NGM ne correspondent pas entre l'objectif et la platine du microscope, utilisez le couvercle de petits 35 mm des boîtes de Pétri contenant 2 ml NGM comme une alternative appropriée.
- Écran nématodes prédateurs pour la bouche morph nécessaire comme décrit dans le protocole 1. Utilisation de ver norme picking techniques et un stéréomicroscope lumière, transférer un seul prédateur correctement classé sur la plaque d'essai. Attendre 15 minutes pour permettre le ver de récupérer du stress d'être transféré.
- Observer les animaux prédateurs sur un microscope à 40 - 63X Normaski, avec une caméra à grande vitesse (Films 2 et 3). Enregistrement pharyngée pompage et le mouvement des dents en 15 sec, à 50 Hz dans au moins 20 animaux pour assurer une quantification précise. Replay a enregistré des films à la vitesse souhaitée pour compter les pompes individuelles et les événements de la dent.
Remarque: Le pompage est observé dans le corps, située au milieu du pharynx, tandis que le mouvement des dents est détectable dans l'ouverture de la bouche et est seulement observi de la dent dorsale.
Résultats
Après une identification réussie de la bouche morph appropriée dans P. pacificus, de nettes différences entre les animaux eurystomatous et stenostomatous peut être détectée (figure 3) avec seulement les animaux eurystomatous engageant à tuer le comportement. Chez les animaux stenostomatous ce comportement semble être supprimé entièrement. En outre, les différences dans l'activité de la dent et du pharynx pompage des animaux eurystomatous sur les bactéries et les proies (Figure 4 et films 2 et 3) sont également évidentes. Bien que l'alimentation prédatrice, le débit de pompage est réduite en dessous celle observée lors de l'alimentation bactérienne et le mouvement des dents est détectée dans un rapport un à un avec le pompage du pharynx. Ceci est une indication potentielle des mécanismes de régulation clés modulant la réponse comportementale à l'alimentation différente.
s / ftp_upload / 54404 / 54404fig1.jpg "/>
Figure 1. P. pacificus a un dimorphisme Mouth qui influe sur le comportement alimentaire. (A) La forme de la bouche eurystomatous est capable de prédation et a une grande ouverture de la bouche avec une grande forme de griffe dorsale dent (fausse couleur rouge) et (B) une grande forme de sous-ventrale de la dent de crochet opposée (bleu fausse couleur). (C) La forme de la bouche stenostomatous est seulement capable de se nourrir de bactéries et a une ouverture de la bouche plus étroite avec une forme de silex dorsale dent (fausse couleur rouge) et (D) pas de sous-ventrale dent (*). Images Normaski sont 63X et barre d'échelle représente 10 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
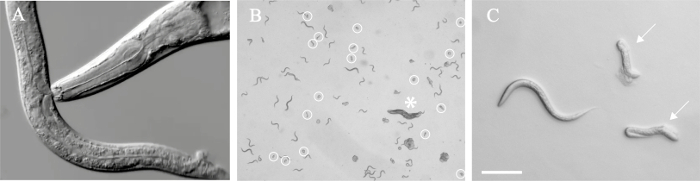
Figure 2. Prédation Assays. (A) P. pacificus mord et tue les larves d'autres nématodes tels que C. elegans. (B) Pour les analyses mordantes, le nombre de bitesby prédateurs (*) peut être observée en utilisant un stéréomicroscope lumière et mise à mort réussie et l' alimentation des événements aussi enregistrés. Cadavres sont également clairement visibles (cercles). (C) Pour les essais de cadavres, carcasses larvaires (flèches) peuvent être facilement identifiés par rapport aux larves vivantes. La barre d'échelle représente 1 mm B et 150 um C. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
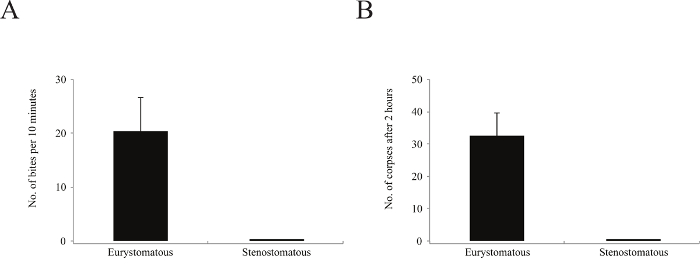
Figure 3. Résultats de Bite et Corpse Assays sur C. elegans Prey. (A) le comportement Mordre est seulement évidente sous la forme de la bouche eurystomatous avec ce comportement non affiché chez les animaux stenostomatous. Barre d'erreur représente l' écart - type de 10 répétitions. (B) Coïncidant avec aucun comportement mordant évident des animaux stenostomatous, des analyses de cadavres révèlent également que les carcasses sur des plaques d'essai d'animaux eurystomatous. Barre d'erreur représente l' écart - type de 5 répétitions. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
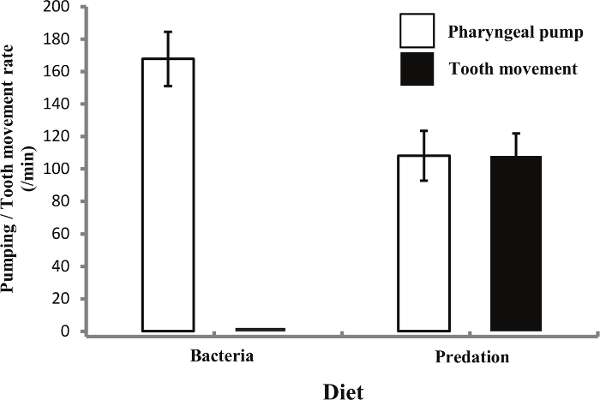
Figure 4. Eurystomatous taux de pompage et des dents Mouvement pendant l' alimentation Predatory. Mouvement des dents est observée seulement alors que les animaux eurystomatous sont engagés dans l' alimentation prédatrice. Cela coïncide avec une diminution pharyngée pompage. barre d'erreur représente l'écart-type de 10 répétitions. href = "https://www.jove.com/files/ftp_upload/54404/54404fig4large.jpg" target = "_ blank"> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Film 2. haut débit Film de P. Camera pacificus tuant C. elegans Larves. (clic pour télécharger).
ad / 54404 / 54404movie3.jpg "/>
Film 3. zoomant caméra à haute vitesse de mouvement des dents Pendant Prédation. (Clic pour télécharger).
Discussion
Nématodes fournissent un système puissant pour comprendre la neurobiologie et le comportement avec C. elegans étant jusqu'à présent le principal outil. Cependant, de nombreuses espèces de nématodes dont P. comportements d'affichage pacificus, qui sont absents ou varient en complexité de l'organisme modèle C. elegans et donc soulèvent des questions fascinantes sur l'évolution et la régulation de ces comportements. Un tel comportement supplémentaire trouvé dans de nombreuses autres espèces de nématodes dont P. pacificus est la capacité de compléter leur alimentation bactérienne en se livrant à l' alimentation prédatrice 1, 20. Nous avons donc mis au point et décrit un protocole détaillé pour la caractérisation facile et rapide de ces comportements prédateurs précédemment non analysés dans les nématodes.
Tout d'abord, nous avons fourni des procédés pour cribler des variations dans l'appareil d'alimentation dans la bouche des nématodes. L'identification du type de bouche correcte est un élément essentiel premier sTep pour les essais de prédation avec succès que, au moins dans le genre Pristionchus seuls animaux eurystomatous sont capables de l' alimentation prédatrice. Il est préférable d'identifier la bouche se transforme avec le protocole «bouche de phénotypage rapide» décrit dans le protocole 1.2 que cette méthode est beaucoup moins invasive et donc il est moins probable que les comportements prédateurs peuvent être perturbés. Toutefois, il est recommandé de commencer par se familiariser avec les différentes structures de la bouche par l'identification avec les animaux anesthésiés sur coussinets d'agar (protocole 1.1).
Après identification de la morph bouche souhaitée, nous avons décrit deux essais pour quantifier l'alimentation prédatrice. Ce sont, à haut débit "essai de cadavre» rapide (protocole 3) et un plus de temps, mais l'analyse comportementale plus approfondie par le "test de morsure" (protocole 2). Ces deux protocoles sont très souples permettant de nombreuses modifications afin d'optimiser les dosages en fonction des experimenexigences de fonds. Pour les essais de morsure en utilisant P. prédateurs pacificus sur C. elegans proie, observations d'interactions comportementales prédateurs pour une fenêtre de temps de 10 min est suffisante pour quantifier une quantité importante de morsures ainsi que d'autres événements d'alimentation. Pour les "tests de cadavre» à nouveau en utilisant P. prédateurs pacificus sur C. elegans proie, 5 prédateurs pendant 2 heures a produit nombre de cadavres facilement quantifiables et cohérents permettant l' analyse comportementale rapide. Toutefois, il convient de noter les différentes espèces de mouvement des nématodes prédateurs à des vitesses différentes, manger à des rythmes différents et généralement démontrer une grande diversité d'autres comportements 1. En outre, les différentes espèces de proies peuvent également être consommés à des taux différents pour des raisons similaires. Il est donc recommandé d'optimiser les analyses basées sur les espèces de nématodes testés à la fois comme les prédateurs et les proies, et aussi pour toutes les différences dans les conditions environnementales. Pendant les deux "morsure" et "corpse "des essais, il est essentiel que les deux proies et les prédateurs sont en bonne santé, comme stressés ou prédateurs blessés ne seront pas tuer efficacement. En outre, des plaques d'essai fraîches sont essentielles en tant que plaques âgées peuvent devenir séché qui affecte négativement la santé des nématodes menant à un faux des essais. On espère également que les futures itérations de ces essais prédateurs seront en mesure de tirer parti des progrès récents dans la technologie afin d'automatiser une grande partie de l'analyse comme cela a été accompli pour enquêter sur de nombreux comportements observés chez C. elegans 21, 22. Actuellement les problèmes sont susceptibles de survenir chez les nématodes tels que P. pacificus comme ils apparaissent beaucoup plus sensibles au contact, ce qui rend l' isolement et l' immobilisation dans des chambres microfluidiques susceptibles de mettre fin à l' alimentation prédatrice. Surmonter cela peut se révéler difficile , mais faciliterait les nématodes individuels à cribler pour subtile prédateur comportements.
Enfin, nous avons également fourni des méthodes for examiner l'appareil nématode d'alimentation lui-même faciliter les comparaisons entre les modes d'alimentation prédateurs et bactériennes en quantifiant les dents et pharyngée pompage cinétique en utilisant une caméra à grande vitesse (protocole 4). La quantification des taux de pompage du pharynx en C. elegans a été utilisé pour surveiller l' alimentation pendant de nombreuses années 23, cependant, C. elegans est dépourvu de toute forme de bouche denticle et manque aussi des comportements prédateurs. En combinant la quantification de pompage pharyngé avec celle de l'activité de la dent, toute innervation des dents spécifiques à la prédation peut également être observée. En raison de l'agrandissement nécessaire pour observer le mouvement des dents les animaux se déplacent souvent en dehors du plan focal, il est donc généralement possible d'observer la dent pour de courtes fenêtres de temps. En outre, à la différence C. elegans, le pharynx de P. pacificus ne continue pas pomper, mais plutôt se livre à des périodes de pompage et d' alimentation. Par conséquent, pour précise pharyngée pumtaux de ping alors que l'alimentation à déterminer, il est important d'enregistrer 15 secondes de l'alimentation continue.
Ces méthodes présentées ici constituent donc le premier cadre d'enquêter sur les comportements prédateurs dans les systèmes de nématodes. De plus, ils peuvent également être adaptable pour une utilisation dans les enquêtes sur d' autres interactions au sein de l'écosystème de nématodes , y compris l'influence des organismes plus écologiquement pertinents sur la prédation , y compris les micro - organismes, les champignons et les acariens . Ainsi, ils fournissent un moyen de disséquer la façon dont ces comportements prédateurs sont réglementés, la façon dont ils peuvent avoir évolué et aussi leur importance écologique.
Déclarations de divulgation
The authors declare no financial or competing interests.
Remerciements
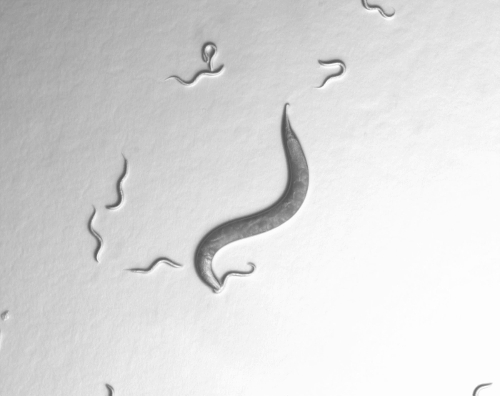
We thank Dr. Daniel Bumbarger for the predation behavior picture. This work was funded by the Max-Planck Society.
matériels
| Name | Company | Catalog Number | Comments |
| Nylon net filters (20 µm) | Merck Millipore Ltd | NY2004700 | Used to filter worms just leaving larvae for use as prey. |
| PP Funnel for filter (54 mm) | Duran | 292215003 | Used to filter worms just leaving larvae for use as prey. |
| Small petri dish (35/10 mm) | Greiner Bio-One | 627102 | For imaging on High speed camera |
| Zeiss SteREO Discovery V12 | For mouth form identificaton | ||
| Axio-Imager A1 | For mouth form identificaton | ||
| Glass Slides | Roth | H869 | |
| Cover Slips | Roth | 657 | |
| Motion Scope M3 Highspeed camera | IDT | High speed camera | |
| Video zoom 44 ENG 1/2" 0.5X to 2.4X | Zeis | 452984-0000-000 | High speed camera zoom |
| Nematode Growth Medium (NGM) ingredients: | |||
| Agar | Roth | 5210.2 | CAS-Nr. 9002-18-0 |
| Sodium chloride (NaCl) | Roth | 3957 | CAS-Nr. 7647-14-5 |
| Bacto Tryptone | BD | 211699 | Lot 4316614 |
| Calcium chloride dihydrate (CaCl2) | Sigma-Aldrich | C3306 | CAS-Nr. 10035-04-8 |
| Cholesterol from lanolin | Sigma-Aldrich | F 26732 00050 | CAS-Nr. 57-88-5 |
| Magnesium sulfate heptahydrate (MgSO4) | Merck | 1,058,861,000 | CAS-Nr. 10034-99-8 |
| Potassium dihydrogen phosphate (KH2PO4) | ACROS organics | 271080025 | CAS-Nr. 7778-77-0 |
| 6 cm petri dish | Greiner Bio-One | 628102 | |
| 3.5 cm petri dish | Greiner Bio-One | 627102 | |
| M9 ingredients: | |||
| Potassium dihydrogen phosphate (KH2PO4) | ACROS organics | 271080025 | CAS-Nr. 7778-77-0 |
| Sodium hydrogen phosphate heptahydrate (NaHPO4) | Sigma-Aldrich | S9390-500G-D | CAS-Nr. 7782-85-6 |
| Sodium chloride (NaCl) | Roth | 3957 | CAS-Nr. 7647-14-5 |
Références
- Wilecki, M., Lightfoot, J. W., Susoy, V., Sommer, R. J. Predatory feeding behaviour in Pristionchus nematodes is dependent on phenotypic plasticity and induced by serotonin. J Exp Biol. 218 (Pt 9), 1306-1313 (2015).
- Ragsdale, E. J., Muller, M. R., Rodelsperger, C., Sommer, R. J. A Developmental Switch Coupled to the Evolution of Plasticity Acts through a Sulfatase. Cell. 155 (4), 922-933 (2013).
- Goodman, M. B. Mechanosensation. WormBook. , 1-14 (2006).
- Rankin, C. H. Nematode behavior: the taste of success, the smell of danger!. Curr Biol. 16 (3), R89-R91 (2006).
- Beverly, M., Anbil, S., Sengupta, P. Degeneracy and neuromodulation among thermosensory neurons contribute to robust thermosensory behaviors in Caenorhabditis elegans. J Neurosci. 31 (32), 11718-11727 (2011).
- Kimata, T., Sasakura, H., Ohnishi, N., Nishio, N., Mori, I. Thermotaxis of C. elegans as a model for temperature perception, neural information processing and neural plasticity. Worm. 1 (1), 31-41 (2012).
- Vidal-Gadea, A., et al. Magnetosensitive neurons mediate geomagnetic orientation in Caenorhabditis elegans. Elife. 4, (2015).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Sherlekar, A. L., Lints, R. Nematode Tango Milonguero - the C. elegans male's search for the hermaphrodite vulva. Semin Cell Dev Biol. 33, 34-41 (2014).
- Sasakura, H., Mori, I. Behavioral plasticity, learning, and memory in C. elegans. Curr Opin Neurobiol. 23 (1), 92-99 (2013).
- Avery, L., You, Y. J. C. elegans feeding. WormBook. , 1-23 (2012).
- Bumbarger, D. J., Riebesell, M., Rodelsperger, C., Sommer, R. J. System-wide Rewiring Underlies Behavioral Differences in Predatory and Bacterial-Feeding Nematodes. Cell. 152 (1-2), 109-119 (2013).
- Dieterich, C., et al. The Pristionchus pacificus genome provides a unique perspective on nematode lifestyle and parasitism. Nature Genetics. 40 (10), 1193-1198 (2008).
- Schlager, B., Wang, X. Y., Braach, G., Sommer, R. J. Molecular Cloning of a Dominant Roller Mutant and Establishment of DNA-Mediated Transformation in the Nematode Pristionchus pacificus. Genesis. 47 (5), 300-304 (2009).
- Witte, H., et al. Gene inactivation using the CRISPR/Cas9 system in the nematode Pristionchus pacificus. Dev Genes Evol. 225 (1), 55-62 (2015).
- Lo, T. W., et al. Precise and Heritable Genome Editing in Evolutionarily Diverse Nematodes Using TALENs and CRISPR/Cas9 to Engineer Insertions and Deletions. Genetics. 195 (2), 331-348 (2013).
- Sommer, R. J., McGaughran, A. The nematode Pristionchus pacificus as a model system for integrative studies in evolutionary biology. Molecular Ecology. 22 (9), 2380-2393 (2013).
- Herrmann, M., et al. The nematode Pristionchus pacificus (Nematoda : Diplogastridae) is associated with the oriental beetle Exomala orientalis (Coleoptera:Scarabaeidae) in Japan. Zoological Science. 24 (9), 883-889 (2007).
- Chaudhuri, J., Parihar, M., Pires-daSilva, A. An Introduction to Worm Lab: from Culturing Worms to Mutagenesis. J Vis Exp. (47), e2293 (2011).
- Serobyan, V., Ragsdale, E. J., Sommer, R. J. Adaptive value of a predatory mouth-form in a dimorphic nematode. Proc. R. Soc. B Biol. Sci. 281, 20141334 (2014).
- Albrecht, D. R., Bargmann, C. I. High-content behavioral analysis of Caenorhabditis elegans in precise spatiotemporal chemical environments. Nat Methods. 8 (7), 599-605 (2011).
- Yeminin, E., Jucikas, T., Grundy, L. J., Brown, A. E., Schafer, W. R. A database of Caenorhabditis elegans behavioral phenotypes. Nat Methods. 9 (10), 877-879 (2013).
- Raizen, D. M., Lee, R. Y. N., Avery, L. Interacting Genes Required for Pharyngeal Excitation by Motor Neuron MC in Caenorhabditis elegans. Genetics. 141 (4), 1365-1382 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon