Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L’effet de l’Application d’huile essentielle de thym sur la charge microbienne pendant le séchage de la viande
Dans cet article
Résumé
Micro-organismes tels que Escherichia coli qui contaminent les produits carnés causent des maladies d’origine alimentaire. L’utilisation des huiles essentielles dans le processus de séchage de la viande n’a pas été étudiée profondément. Nous présentons ici une méthode originale de l’application huile essentielle de thym à la viande pendant le séchage afin de réduire la charge microbienne en viande séchée.
Résumé
La viande est un repas riche en protéines qui sert à la préparation de saccades, une collation de nourriture populaire, où la préservation et la sécurité sont importantes. Pour assurer la sécurité alimentaire et de prolonger la durée de conservation des viandes et produits carnés, l’utilisation d’agents de conservation naturelle ou synthétique ont été appliquées pour contrôler et éliminer les bactéries d’origine alimentaire. Un intérêt croissant pour l’application des additifs alimentaires naturels pour la viande a augmenté. Microorganismes, tels que Escherichia coli, contaminent les viandes et produits carnés, causant des maladies d’origine alimentaire. Par conséquent, il est nécessaire d’améliorer le processus de conservation de la viande. Cependant, l’utilisation des huiles essentielles lorsque la viande est est séchée n’a pas profondément étudiée. À cet égard, il y a une occasion d’augmenter la valeur de la viande séchée et réduire le risque de maladies d’origine alimentaire en appliquant des huiles essentielles lors du séchage. Dans ce protocole, nous présentons une nouvelle méthode d’application d’huile essentielle de thym (TEO) pendant le séchage, plus précisément sous forme de vapeur directement dans une chambre de séchage de la viande. Pour l’évaluation, nous utilisons la Concentration inhibitrice minimale (CMI) pour détecter le nombre de bactéries nocives dans les échantillons traités par rapport aux échantillons bruts. Les résultats préliminaires montrent que cette méthode est une option viable et alternative aux préservatifs synthétiques et qu’il réduit considérablement la charge microbienne en viande séchée.
Introduction
Séchage comme une méthode traditionnelle pour conserver les aliments a été utilisé depuis l’antiquité. De nos jours, il y a un intérêt croissant pour le séchage comme une méthode efficace pour aliments conservation1,2,3. Il est utilisé pour faire une variété de viandes spécialement traitées. L’un des plus connus est saccadé.
Viande séchée, une des plus anciennes méthodes de conservation des viandes, est issue de durcissement et séchage à faible activité de l’eau et donc de prolonger sa durée de vie4. De nos jours, saccadé comme une charcuterie conserve est toujours très populaire, où la sécurité alimentaire, la saveur et la texture sont essentiels. Préparation saccadée peut être utilisée pour presque tous les types de viandes, y compris le boeuf, porc, volaille ou jeu5, et il faut découper la viande en lanières maigres et en l’asséchant. Habituellement, Mariner la viande dans une solution ou un tabagisme durcissement sont utilisées avec séchage pour donner de la viande séchée sa saveur caractéristique6.
Malgré l’immense intérêt de séchage vraiment conserver les aliments, le risque d’épidémies d’origine alimentaire par e. coli mal séchées est essentiel et doit être contrôlée. Il y a quelques études rapportent des éclosions de gastro-entérite alimentaire particulièrement avec e. coli O157 : H7, attribué à la chaleur insuffisante de traitement durant le séchage à la maison. Des cas similaires survenus même dans préparé commercialement saccadé7,8,9. Levine, et al. 10 a proposé que les micro-organismes d’origine alimentaire peuvent survivre les conditions de séchage modérées (environ 60 ° C) utilisées par les producteurs commerciaux de saccadé. E. coli O157 : H7 flambées de maladies d’origine alimentaire dans le milieu des années 1990 ont été attribuées au sol séché viande produits6,11. Fait intéressant, dans tous les cas précédents, le principal risque est causé par des pathogènes bactériens reconnus comme viable mais non cultivable (VBNC). Soumis à des contraintes diverses telles que les changements de température ou à la famine, les cellules d’Escherichia coli pourraient entrer dans un état particulier appelé la VBNC état12,13. Les cellules VBNC peuvent ensuite être ressuscitées à cellules cultivables par l’exposition à des conditions appropriées et ensuite présentent une menace pour la santé humaine en raison de la contamination de toxi-infections alimentaires14,15. Cela signifie que si la viande est consommée immédiatement après le séchage du produit, c’est sûr. Toutefois, en cas de conservation inadéquate, telles que l’humidité accrue, il y a un risque élevé de réactivation des pathogènes et la croissance microbienne.
Outre les méthodes de séchage et la marinade, il y a une forte demande des consommateurs à utiliser des produits naturels comme une alternative aux additifs pour améliorer la qualité de nourriture16,17. Il y a eu un intérêt particulier pour l’application des additifs alimentaires naturels pour la viande au lieu de conservateurs synthétiques classique18,19,20,21. Même s’il y a un manque de preuves expérimentales suffisantes dans l’utilisation des huiles essentielles lors du séchage de la viande, premières recherches dans ce domaine montre déjà des résultats positifs22,23.
Depuis le moyen-âge, les gens ont reconnu composés d’huiles essentielles (cou) pour leurs caractéristiques antimicrobiennes, insecticides et antiparasitaires24,25,26. Aujourd'hui, le cou font partie d’un des groupes plus importants des composés naturels bioactifs. Parmi les différentes cou, thymol est l’une des plus connues. Il est composé de plus de 85 % de TEO23. Ce phénol empêche la dégradation microbienne et chimique lors de l’ajout à l’alimentation. En outre, ses propriétés antibactériennes pourraient être améliorées en combinaison avec d’autres conservateurs naturels2,27,28,29,30. De nos jours, le thym (Thymus vulgaris), une plante qui appartient à la famille des Lamiacées , a été reconnu comme un agent aromatisant, mais aussi une viande très efficace conservateur31. Une étude par García-Díez et al. 30 les produits carnés trouvé que TEO affiche un motif d’inhibition plus large contre les pathogènes d’origine alimentaire par rapport aux autres huiles essentielles. Par conséquent, il y a une occasion d’augmenter la valeur de la viande séchée et réduire le risque de maladies d’origine alimentaire en appliquant des huiles essentielles lors du séchage.
Dans ce protocole, nous présentons une nouvelle méthode d’application TEO pendant le séchage de la viande, plus précisément à l’aide sous forme de vapeur directement dans un séchage chamber. Pour l’évaluation, nous utilisons le MIC pour déterminer l’absence de bactéries pathogènes dans les échantillons traités par rapport à ceux de raw. Les résultats préliminaires montrent que cette méthode est une alternative très efficace aux conservateurs synthétiques et qu’il réduit considérablement la charge microbienne en viande séchée.
Protocole
1. préparation de la viande
- Obtenir un filet de boeuf (boeuf frais de biceps femoris) d’une boucherie locale et le transférer dans le laboratoire.
NOTE : Il est recommandé de transporter l’aloyau de bœuf à la température ambiante (20-25 ° C), pendant une période ne dépasse pas 20 min dans un sac scellé hermétique. - Pour stériliser la surface externe du muscle du boeuf, dans un poste de sécurité laminaire, laver le muscle par pulvérisation avec de l’éthanol 70 % (v/v) pour 10 s à l’aide d’un flacon de 500 mL. Appliquer 0,025 g d’éthanol par 1 cm2 de surface de muscle.
- Supprimer la surface extérieure de la viande aseptiquement avec un couteau pour éviter l’éthanol restant à l’intérieur du muscle. Enlever environ 3 mm de l’intérieur du muscle pour garder l’uniformité de surface du muscle.
- Emballez le muscle dans un sac en plastique scellé et transférer dans un congélateur.
- Stocker le muscle à-18 ° C pendant 1 nuit. Ensuite, décongeler le muscle congelé à 4 ° C pendant 6 h.
Remarque : Pour la décongélation, il est recommandé de déplacer le muscle du congélateur au réfrigérateur. - Dans une armoire de sécurité laminaire, coupez chaque muscle en tranches de 0,5 cm d’épaisseur avec un découpeur de viande. Puis, avec un couteau coupe en petite 5 × 2,5 cm2 échantillons rectangulaire.
- Emballer des échantillons de viande rectangulaire dans des sacs en plastique et les entreposer dans le congélateur à-18 ° C pour une utilisation ultérieure.
2. préparation de l’Inoculum standardisé et méthode d’ensemencement dans une armoire de sécurité laminaire
- Préparer l’inoculum standardisé (1,5 × 108 UFC/mL) de e. coli ATCC 25922 pour inoculer les échantillons de viande.
- Pour la préparation de l’inoculum de stock, tout d’abord passer la culture lyophilisée (livrée par le fournisseur) dans un tube de 15 mL stérile pré-remplie avec 10 mL de stérilisé tamponnée Mueller Hinton bouillon (BMHB). Cultiver cette suspension pendant 24 h à 37 ° C.
- Préparer la solution bactérienne comme suit : prendre environ 0,1 - 0,2 mL de suspension bactérienne et diluées dans un flacon de 20 mL fermé avec un bouchon en caoutchouc avec une capsule en aluminium pré-remplie avec 15 mL de BMHB stérilisé. Cultiver cette suspension pendant 24 h à 37 ° C.
- Stocker à l’intérieur du réfrigérateur à 4 ° C pour la préparation de l’inoculum standardisé.
- De la solution mère (Voir l’étape 2.1.1) de E. coli prenez environ 0,1 - 0,2 mL de suspension bactérienne et diluées dans un plastique 15 mL stérilisés tube pré-rempli avec 10 mL de stérilisé tamponnée Mueller Hinton bouillon (BMHB). Incuber les tubes à 37 ° C pendant 24 h.
- Pour la préparation de l’inoculum standardisé (1,5 × 108 UFC/mL), ajouter de petites quantités de cette suspension dans un tube de 15 mL stérilisé pré-remplie avec 10 mL de BMHB stérilisé.
- Soigneusement le vortex du mélange et mesurer la densité optique (do) à 600 nm par un densitomètre32.
- Répétez les étapes 2.1.3 - 2.1.4 jusqu'à la Division d’opposition exprimée comme la valeur de McFarland est augmentée de 0,5 par rapport à la valeur du BMHB propre.
- Pour la préparation de l’inoculum de stock, tout d’abord passer la culture lyophilisée (livrée par le fournisseur) dans un tube de 15 mL stérile pré-remplie avec 10 mL de stérilisé tamponnée Mueller Hinton bouillon (BMHB). Cultiver cette suspension pendant 24 h à 37 ° C.
- Pour la méthode d’ensemencement, placer les échantillons de viande rectangulaire à deux feuilles d’aluminium différentes (20 cm x 30 cm), un pour les échantillons de contrôle et le second pour les échantillons de viande inoculés.
- Au cours de la deuxième feuille d’aluminium, inoculer les échantillons de viande crue de rectangulaire 800 µl de la suspension de bactéries de la souche sélectionnée (ce qui correspond à 1,2 × 108 UFC par échantillon de viande) en distribuant uniformément l’inoculum sur la surface.
- Distribuer 400 µL sur un côté de l’échantillon et délicatement étalées en utilisant un séparateur de cellule stérile sur la surface. Laissez-les sécher pendant 10 min. Répétez la même procédure pour le reste de la suspension de l’autre côté de l’échantillon.
- Au cours de la deuxième feuille d’aluminium, inoculer les échantillons de viande crue de rectangulaire 800 µl de la suspension de bactéries de la souche sélectionnée (ce qui correspond à 1,2 × 108 UFC par échantillon de viande) en distribuant uniformément l’inoculum sur la surface.
3. séchage et TEO demande
- Transférer les deux feuilles d’aluminium contenant les échantillons de viande rectangulaire de l’armoire de sécurité laminaire à la sécheuse : couvrent chacun une feuille d’aluminium et ensuite placer les échantillons à l’intérieur de la sécheuse.
- Effectuer le séchage dans un séchoir de laboratoire standard.
Remarque : Tout d’abord, préchauffez le four à 55 ° C. Cette procédure peut durer pendant 20 min.- Sécher les échantillons de contrôle pendant 6 h à 55 ° C, avec séchage air humidité relative des valeurs allant de 30 à 45 %.
Remarque : Les valeurs séchage de humidité relative de l’air varient dans le temps selon le taux d’évaporation du liquide de la viande.
- Sécher les échantillons de contrôle pendant 6 h à 55 ° C, avec séchage air humidité relative des valeurs allant de 30 à 45 %.
- Calculer le volume de TEO appliquée et d’exprimer la concentration d’huile essentielle dans un volume de TEO par sèche-cheveux volume (mL/L d’air). Par exemple, la dose de 1,5 mL de TEO en 53 L (volume de la sécheuse) entraîne une concentration de 0,028 mL/L d’air. Pour déterminer la CMI de TEO pour e. coli, utiliser des doses de 1,5 mL (0,028 mL/L d’air), 1 mL (0,019 mL/L d’air) et 0,75 mL (0,014 mL/L d’air).
- Avant séchage, pour l’application de la TEO vapeurs (avec le thymol comme le principal composé 79 %), faire tremper un filtre en papier (12 x 20 cm) avec une dose de 1,5 mL de TEO et place dans la sécheuse devant le ventilateur.
- Faire sécher les échantillons de viande TEO traitée en utilisant la même procédure que les échantillons de contrôle (étapes 3.1 et 3.2).
Remarque : Après que le processus se termine et les échantillons de séchage sont supprimés, allumez le four pendant 3 h à 80 ° C et l’indication de soupape d’air la valeur 100 % d’aération afin de nettoyer les résidus d’huile essentielle du four.
4. analyse microbienne
- Avant l’inoculation de la viande par des bactéries, examiner les échantillons de viande de toute altération. L’apparition de boue et de la détection d’une odeur forte et piquante sont révélateurs de la détérioration de la viande. Si la texture est visqueuse, la bactérie peut avoir commencé à se multiplier sur la surface de la viande.
- Afin d’évaluer l’efficacité de l’inoculation, tester les échantillons inoculés raw pour la présence de e. coli ATCC 25922 et de les comparer avec les échantillons de témoins non inoculées avant la procédure de séchage. À cet effet :
- Laver chaque échantillon de viande (2 échantillons de contrôle et 2 échantillons inoculés). Suspendre chaque échantillon de viande dans un flacon stérilisé avec de l’eau peptonée tamponnée (8,5 g de NaCl, 1 g de peptone, 5 comprimés de solution saline tamponnée au phosphate et 1 g de Polysorbate 80 dans 1 L d’eau) dans un rapport de 01:10 (p/v) avec un pH allant de 7 à 7,3. Agiter à l’aide d’un agitateur à 140 tr/min pendant 10 min à température ambiante.
Remarque : Laver immédiatement après l’intervention de l’inoculation. - Évaluer le nombre de bactéries par une procédure ajusté de plaque goutte de 6 × 6 résumée par Chen, Nace et Irwin33 sur Plate Count Agar (PCA) et de MacConkey Agar (MCA).
Remarque : La méthode de drop 6 × 6 utilise la méthode de dilution micro bouillon de préparer 10 fois des dilutions de l’échantillon étudié avec une pipette multicanaux, qui est moins intense et plus économique par rapport à la méthode conventionnelle33, de travail 34. - Cultiver les dilutions d’échantillons série 10 fois par la procédure de plaque 6 × 6 goutte pour l’évaluation des e. coli.
Remarque : En particulier pour la méthode de drop 6 × 6, pour culture utilisation six 5 µL-drops, de six sélectionnés dilutions de l’échantillon étudié avec une pipette multicanaux. Le Pétri correctement séchées, les gouttes absorbent rapidement dans la gélose et la plantation de cette méthode est très pratique et maniable34. - Incuber les boîtes de Pétri à 37 ° C pendant 24 h. Après la période de culture, évaluer le nombre de colonies d’e. coli sur les boîtes de Pétri (CFU g-1 de viande séchée) tel que décrit à l’article 5.
- Laver chaque échantillon de viande (2 échantillons de contrôle et 2 échantillons inoculés). Suspendre chaque échantillon de viande dans un flacon stérilisé avec de l’eau peptonée tamponnée (8,5 g de NaCl, 1 g de peptone, 5 comprimés de solution saline tamponnée au phosphate et 1 g de Polysorbate 80 dans 1 L d’eau) dans un rapport de 01:10 (p/v) avec un pH allant de 7 à 7,3. Agiter à l’aide d’un agitateur à 140 tr/min pendant 10 min à température ambiante.
- Après le séchage, prélever deux échantillons séchés inoculées et comparez-les avec deux échantillons séchés contrôle non inoculé pour viable d’e. coli, respectivement. Pour déterminer la présence ou l’absence d' e. coli de ces quatre amples s, suivre le processus de pré-enrichissement de chaque échantillon de viande comme suit :
- Suspendre chaque échantillon de viande dans un flacon stérilisé avec de l’eau peptonée tamponnée (voir étape 4.2.1) et agiter à l’aide d’un agitateur à 140 tr/min pendant 10 min à température ambiante. Puis incuber chaque fiole à 37 ° C pendant 6 h pour pré-enrichissement.
- Pour l’évaluation et de la culture des bactéries, suivez la même procédure comme décrit aux points 4.2.2 - 4.2.4.
5. analyser les résultats
- Après que l’incubation est terminée, sortir les boîtes de Pétri de l’incubateur et examiner les résultats comme suit :
- Pour évaluer le nombre total de colonies, examiner les plaques pour la présence de bactéries aérobies mésophiles sur PCA (taches blanches) et de type e. coli colonies (rouges à rose foncé) sur MCA. Si l’agent pathogène est absent, les deux bouillons ne présentent aucune croissance.
- Compter les colonies et déterminer la quantité de e. coli (UFC/g-1 de viande séchée) présents.
Remarque : Compter le nombre de colonies (N) à deux dilutions consécutives contenant 30 ou moins colonies par goutte d’eau (Figure 1). Le nombre N d’UFC/g-1 de viande séchée est déterminé comme suit35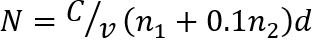
où C est la somme des colonies sur des gouttes toutes comptées, v est le volume de dilution de l’échantillon utilisé par goutte d’eau (ici, 0,05 mL), n1 est le nombre de gouttes utilisées à la première dilution, n2 est le nombre de gouttes utilisé à la deuxième dilution et d représente la dilution d'où les premiers comtes ont été capturés.
- Pour analyser les données microbiologiques, convertir le nombre de colonies à log CFU g-1 et les soumettre à l’analyse de variance (ANOVA) pour les principaux effets de traitement36.
- Effectuer le test de Tukey honnête différence significative (Tukey HSD) pour plusieurs comparaisons moyenne36 et de déterminer les différences significatives entre les traitements.
Résultats
Nous avions tout d’abord précédemment développé cette méthode en utilisant l’huile essentielle d’origan (OEO) pour améliorer la sécurité alimentaire et accroître la valeur de la viande séchée. En général, les expériences précédentes ont montré que les e. coli passe à l’État VBNC pendant le séchage comme stratégie de survie. Cela est démontré par le fait qu’il n’y a pas de bactéries cultivables après que le séchage fini22
Discussion
Recherches antérieures ont montré que les micro-organismes causant des maladies d’origine alimentaire survivraient séchage10. Il faut donc appliquer les préservatifs avant le séchage afin d’assurer la salubrité des aliments. Dans cette étude, nous nous concentrons sur l’utilisation de TEO. La raison est double : tout d’abord, il y a une forte demande des consommateurs d’utiliser des produits naturels comme additifs alternatifs pour améliorer la qualité des aliments
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par l’Agence de subvention interne de la faculté de AgriSciences Tropical, (numéro du projet : 20175013) et le 20182023 de CIGA les deux subventions, de l’Université tchèque des Sciences de la vie.
matériels
| Name | Company | Catalog Number | Comments |
| Meat cutter | Kalorik | KP 3530 | from Miami Gardens, FL, USA |
| Laminar safety cabinet | Faster s.r.l | from Italy | |
| Squeeze bottle of 500 mL | Merci | 632 524 325 025 | from CZ |
| Standard laboratory drier UFE 400 | Memmert | DE 66812464 | from Germany |
| Incubator | BT 120 | N/A | from CZ |
| Refrigerator and Freezer | Bosch | KGN34VW20G | from DE |
| Densitometer | Biosan | 220 000 050 122 | Latvia; supplier Merci, CZ |
| Escherichia coli ATCC 25922 | Oxoid | CL7050 | from CZ |
| Vortex | Chromservis | 22008013 | from CZ |
| Sterilized plastic tubes 15 mL | Gama | 331 000 020 115 | from CZ, supplier Merci |
| 20 mL injection vial | Healthy vial | hvft169 | from China |
| 20 mm sterile butyl rubber stopper | Merci | 22008013 | from CZ |
| 20 mm aluminum cap | Healthy vial | N/A | from China |
| Thyme essential oil | Sigma Aldrich | W306509 | from St Louis, MO, USA |
| Mueller Hinton Broth | Oxoid | CM0337 | from CZ |
| NaCl | Penta | 16610-31000 | from CZ |
| Peptone | Oxoid | LP0034 | from CZ |
| Phosphate-buffered saline | Sigma Aldrich | P4417 | from CZ |
| Polysorbate 80 (Tween 80) | Roth | T 13502 | from DE, supplier P-lab |
| Shaker SHO-1D | Verkon | DH.WSR04020 | from CZ, 10 - 300 rpm. 350 x 350 mm with a platform for flasks |
| Ethanol 70% | Bioferm | N/A | from CZ |
| MacConkey Agar | Oxoid | CM007 | from CZ |
| Plate Count Agar | Oxoid | CM0325 | from CZ |
| Filter paper | Merci | 480 622 080 040 | from CZ |
| Erlenmeyer flasks 250 mL | Simax | 610 002 122 636 | from CZ; supplier Merci CZ |
| Multichannel pipette | Socorex | S852820 | from Switzerland; supplier P lab, CZ |
| Microtiter plate | Gamma | V400916 | CZ |
| Microlitre pipette 100-1000 μL | Eppendorf | 333 120 000 062 | from Germany; supplier Merci, CZ |
Références
- Eklund, M. W., Peterson, M. E., Poysky, F. T., Paranjpye, R. N., Pelroy, G. A. Control of bacterial pathogens during processing of cold-smoked and dried salmon strips. J. Food Prot. 67 (2), 347-351 (2004).
- Mahmoud, B. S. M., et al. Preservative effect of combined treatment with electrolyzed NaCl solutions and essential oil compounds on carp fillets during convectional air-drying. Int. J. Food Microbiol. 106 (3), 331-337 (2006).
- Rahman, M. S., Guizani, N., Al-Ruzeiki, M. H., Al Khalasi, A. S. Microflora Changes in Tuna Mince During Convection Air Drying. Dry. Technol. 18 (10), 2369-2379 (2000).
- Faith, N. G., et al. Viability of Escherichia coli O157: H7 in ground and formed beef jerky prepared at levels of 5 and 20% fat and dried at 52, 57, 63, or 68 C in a home-style dehydrator. Int. J. Food Microbiol. 41 (3), 213-221 (1998).
- Hierro, E., De La Hoz, L., Ordóñez, J. A. Headspace volatile compounds from salted and occasionally smoked dried meats (cecinas) as affected by animal species. Food Chem. 85 (4), 649-657 (2004).
- Nummer, B. A., et al. Effects of Preparation Methods on the Microbiological Safety of Home-Dried Meat Jerky. J. Food Prot. 67 (10), 2337-2341 (2004).
- Greig, J. D., Ravel, A. Analysis of foodborne outbreak data reported internationally for source attribution. Int. J. Food Microbiol. 130 (2), 77-87 (2009).
- Eidson, M., Sewell, C. M., Graves, G., Olson, R. Beef jerky gastroenteritis outbreaks. J. Environ. Health. 62 (6), 9-13 (2000).
- Allen, K., Cornforth, D., Whittier, D., Vasavada, M., Nummer, B. Evaluation of high humidity and wet marinade methods for pasteurization of jerky. J. Food Sci. 72 (7), (2007).
- Levine, P., Rose, B., Green, S., Ransom, G., Hill, W. Pathogen testing of ready-to-eat meat and poultry products collected at federally inspected establishments in the United States, 1990 to 1999. J. Food Prot. 64 (8), 1188-1193 (1990).
- Keene, W. E., et al. An outbreak of Escherichia coli O157:H7 infections traced to jerky made from deer meat. JAMA. 277 (15), 1229-1231 (1997).
- Oliver, J. D. The viable but nonculturable state in bacteria. J. Microbiol. 43, 93-100 (2005).
- Oliver, J. D. Recent findings on the viable but nonculturable state in pathogenic bacteria. FEMS Microbiol. Rev. 34 (4), 415-425 (2010).
- Khamisse, E., Firmesse, O., Christieans, S., Chassaing, D., Carpentier, B. Impact of cleaning and disinfection on the non-culturable and culturable bacterial loads of food-contact surfaces at a beef processing plant. Int. J. Food Microbiol. 158 (2), 163-168 (2012).
- Li, L., Mendis, N., Trigui, H., Oliver, J. D., Faucher, S. P. The importance of the viable but non-culturable state in human bacterial pathogens. Front. Microbiol. 5, 258 (2014).
- Hernández, H., Claramount, D., Kučerová, I., Banout, J. The effects of modified blanching and oregano essential oil on drying kinetics and sensory attributes of dried meat. J. Food Process. Preserv. , (2016).
- García-Díez, J., et al. The Impact of Essential Oils on Consumer Acceptance of Chouriço de vinho - A Dry-Cured Sausage Made from Wine-Marinated Meat - Assessed by the Hedonic Scale, JAR Intensity Scale and Consumers' "Will to Consume and Purchase.". J. Food Process. Preserv. 41 (4), (2017).
- Govaris, A., Solomakos, N., Pexara, A., Chatzopoulou, P. S. The antimicrobial effect of oregano essential oil, nisin and their combination against Salmonella Enteritidis in minced sheep meat during refrigerated storage. Int. J. Food Microbiol. 137 (2-3), 175-180 (2010).
- Holley, R. A., Patel, D. Improvement in shelf-life and safety of perishable foods by plant essential oils and smoke antimicrobials. Food Microbiol. 22 (4), 273-292 (2005).
- Petrou, S., Tsiraki, M., Giatrakou, V., Savvaidis, I. N. Chitosan dipping or oregano oil treatments, singly or combined on modified atmosphere packaged chicken breast meat. Int. J. Food Microbiol. 156 (3), 264-271 (2012).
- Ballester-costa, C., Sendra, E., Viuda-martos, M. Assessment of Antioxidant and Antibacterial Properties on Meat Homogenates of Essential Oils Obtained from Four Thymus Species Achieved from Organic Growth. Foods. 6 (8), 59 (2017).
- Hernández, H., et al. The effect of oregano essential oil on microbial load and sensory attributes of dried meat. J. Sci. Food Agric. 97 (1), 82-87 (2017).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Chemical characterization and antimicrobial properties of herbs and spices essential oils against pathogens and spoilage bacteria associated to dry-cured meat products. J. Essent. Oil Res. 29 (2), 117-125 (2017).
- Cavanagh, H. M. A. Antifungal Activity of the Volatile Phase of Essential Oils: A Brief Review. Nat. Prod. Commun. 2 (12), 1297-1302 (2007).
- Tajkarimi, M. M., Ibrahim, S. A., Cliver, D. O. Antimicrobial herb and spice compounds in food. Food Control. 21 (9), 1199-1218 (2010).
- Nedorostova, L., Kloucek, P., Kokoska, L., Stolcova, M., Pulkrabek, J. Antimicrobial properties of selected essential oils in vapour phase against foodborne bacteria. Food Control. 20 (2), 157-160 (2009).
- Burt, S. Essential oils: Their antibacterial properties and potential applications in foods - A review. Int. J. Food Microbiol. 94 (3), 223-253 (2004).
- Ramanathan, L., Das, N. Studies on the control of lipid oxidation in ground fish by some polyphenolic natural products. J. Agric. Food Chem. 40 (1), 17-21 (1992).
- Yamazaki, K., Yamamoto, T., Kawai, Y., Inoue, N. Enhancement of antilisterial activity of essential oil constituents by nisin and diglycerol fatty acid ester. Food Microbiol. 21 (3), 283-289 (2004).
- García-Díez, J., Alheiro, J., Falco, V., Fraqueza, M. J., Patarata, L. Synergistic activity of essential oils from herbs and spices used on meat products against food borne pathogens. Nat. Prod. Commun. 12 (2), 281-286 (2017).
- Hussein Hamdy Roby, M., Atef Sarhan, M., Abdel-Hamed Selim, K., Ibrahim Khalel, K. Evaluation of antioxidant activity, total phenols and phenolic compounds in thyme (Thymus vulgaris L.), sage (Salvia officinalis L.), and marjoram (Origanum majorana L.) extracts. Ind. Crops Prod. 43, 827-831 (2013).
- Gouveia, A. R., et al. The Antimicrobial Effect of Essential Oils Against Listeria monocytogenes in Sous vide Cook-Chill Beef during Storage. J. Food Process. Preserv. 41 (4), (2017).
- Chen, C., Nace, G., Irwin, P. A 6 x 6 drop plate method for simultaneous colony counting and MPN enumeration of Campylobacter jejuni, Listeria monocytogenes, and Escherichia coli. J. Microbiol. Methods. 55 (2), 475-479 (2003).
- Herigstad, B., Hamilton, M., Heersink, J. How to optimize the drop plate method for enumerating bacteria. J. Microbiol. Methods. 44 (2), 121-129 (2001).
- . Practical food microbiology Available from: https://drive.google.com/file/d/0BzyVOLllJ0B1YmlEemZ5M1RZekU/view?ts=590d8019 (2003)
- Smith-Palmer, A., Stewart, J., Fyfe, L. Antimicrobial properties of plant essential oils and essences against five important food-borne pathogens. Lett. Appl. Microbiol. 26 (2), 118-122 (1998).
- Burt, S. a., Reinders, R. D. Antibacterial activity of selected plant essential oils against Escherichia coli O157:H7. Lett. Appl. Microbiol. 36 (3), 162-167 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon