Method Article
Manipulation de cellules vivantes pour construire Stable Assemblée cellulaire 3D sans échafaudage artificiel
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous démontrons une nouvelle méthode pour la construction d’une single-cell-based 3 Dimensions (3D) l’Assemblée sans un échafaudage artificiel.
Résumé
Médecine régénérative et ingénierie tissulaire offrent plusieurs avantages pour le traitement de maladies incurables, et plusieurs études ont démontré l’importance des assemblages cellulaires de 3 Dimensions (3D) dans ces domaines. Échafaudages artificiels ont souvent été utilisées pour construire des ensembles cellulaires 3D. Cependant, les échafaudages utilisés pour construire des ensembles cellulaires sont parfois toxiques et peuvent modifier les propriétés des cellules. Ainsi, il serait utile d’établir une méthode non toxique pour faciliter le contact cellule-cellule. Dans cet article, nous présentons une nouvelle méthode pour la construction d’ensembles cellulaires stables à l’aide de pinces optiques avec dextran. Un des avantages de cette méthode est qu’elle établit le contact de cellule-cellule stable en quelques minutes. Cette nouvelle méthode permet la construction d’ensembles cellulaires 3D dans un polymère hydrophile naturel et devrait être utile pour la construction de nouvelle génération 3D unicellulaires assemblys dans les domaines de la médecine régénérative et génie tissulaire.
Introduction
Alors que les tissus humains sont composés de plusieurs assemblages de cellules et peuvent aider à maintenir l’homéostasie du corps, les cellules individuelles par eux-mêmes aussi jouent des rôles importants via l’interaction cellule-cellule. Il est donc important d’élucider comment les cellules individuelles peuvent être stimulées par des signaux externes et comment ils cèdent ces signaux aux autres cellules adhérentes. Pour ce faire, plusieurs méthodes ont été établies pour la construction de single-cell-based 3 Dimensions (3D) assemblées1,2,3,4,5,6 ,7,8. Cependant, les matériaux qui servent à construire des ensembles cellulaires peuvent encore être améliorées. Par exemple, gels synthétiques et polymères, y compris le polyéthylène glycol (PEG) possèdent certaines propriétés physico-chimiques chimiques et peuvent affecter les cellules cibles (p. ex., toxicité).
Nous avons récemment rapporté un nouveau système qui pourrait générer un assembly 3D single-cell-based de cellules à l’aide de dextran (DEX) en établissant le contact de cellule-cellule stable9. Nous avons considéré que cette technologie pourrait être utile dans plusieurs domaines de recherche, y compris la médecine régénérative et même la biologie du cancer. Dans ce rapport, nous décrivons comment nous manipuler des cellules individuelles et construire des assemblages cellulaires de 3 Dimensions (3D) en présence de divers biomacromolecules hydrophiles dont DEX sans un échafaudage artificiel.
Protocole
1. préparation des cellules
- Maintenir la NAMRU souris glande mammaire épithéliales cellules (NMuMG) avec 5 mL de D-MEM contenant 10 % (v) foetale de sérum bovin (FBS) et 1 % (v) la pénicilline-streptomycine (P/S) dans un ballon jaugé de 25 cm3 . Supprimer Dulbecco aigle modifié (D-MEM), contenant 10 % de SVF et 1 % P/S.
- Ajouter 3 à 5 mL de solution saline tamponnée au phosphate (PBS) (-) 37 ° C dans le ballon. Notez que le pH de PBS est 7.1-7.3.
- Supprimer tous les PBS du flacon à l’aide d’un aspirateur.
- Ajouter 1,5 mL de trypsine de 37 ° C (0,25 %, p/v) dans le ballon.
- Incuber le ballon pendant environ 1 à 2 minutes à 37 ° C dans un incubateur à CO2 .
- Ajouter 3,5 mL de D-MEM contenant 10 % de SVF et 1 % P/S dans le ballon. Pipette pour mélanger.
- Transférer la suspension de cellules dans un tube à centrifuger 15 mL et il Centrifuger pendant 3 min à température ambiante. Notez que le rayon de rotation et la vitesse de rotation de la centrifugeuse sont 16,6 cm et 1500 tr/min, respectivement. Dans ces conditions, la force centrifuge relative est 417 x g.
- Ajouter 5 mL de frais D-MEM (10 % de SVF et 1 % P/S) dans le ballon après avoir aspirer le support (le cas échéant, cryopréserver des cellules avec la solution de cryoconservation, suivant les indications du fabricant).
2. préparation de Dextran (DEX)
- Préparer 80 mg/mL de solution DEX en mélangeant 10 mL de D-MEM (10 % FBS, 1%P/S) et 0,8 g de DEX. Notez que la solution DEX peut être filtrée avec un filtre de seringue (0,22 µm) après que les cellules ont mis en culture pendant un temps suffisant.
- Préparer une suspension de cellules contenant 40 mg/mL de milieu de DEX en mélangeant 200 µL de solution DEX et 200 µL de la suspension cellulaire, préparée en 2.1. Notez que la densité du nombre de cellules dans la solution est environ 2,3 × 105 cellules/mL.
3. préparation pour la microscopie optique et Laser
- Allumer l’appareil (onde continue, longueur d’onde de 1 064 nm) (Figure 1a). Notez que l’utilisation d’un faisceau laser d’une longueur d’onde dans le rouge pour la région du proche infrarouge est plus efficace ; cette région de longueur d’onde est appelée la fenêtre diagnostique et thérapeutique10 car il est très peu absorbé par les cellules.
- Double-cliquez sur l’icône du logiciel.
- Double-cliquez sur que les icônes pour la caméra ① ② diodes électroluminescentes (LED), de focus ③ ajuster et ④ déplacement stade. Les affichages correspondant à ①-④ apparaîtra (Figure 1b).
4. cellule Manipulation en utilisant le système de piégeage de Laser
- Place 20 µL de l’échantillon préparé à l’étape 2.2 sur le couvercle en verre bas (0,17 mm d’épaisseur, taille = 30 mm × 40 mm) et couvrir avec le couvercle en verre haut (0,17 mm d’épaisseur, taille = 18 × 18 mm), avec séparation fournie par deux entretoises (0,17 mm d’épaisseur taille = 10 × 24 mm), comme illustré à la Figure 2. Notez que ces lunettes n’exigent pas un revêtement spécial.
- Placer la cellule de l’échantillon préparée à l’étape 4.1 sur la lentille objectif inférieur (immersion avec env. 10 μl, grossissement de l’eau = 60 X, distance de travail = 0,28 mm, ouverture numérique = 1,2)).
- Fixez l’objectif supérieur (immersion avec env. 10 μl, grossissement de l’eau = 60 X, distance de travail = 2 mm, ouverture numérique = 1,0) au sommet de la cellule.
- Allumer la LED lumineuse en cliquant l’icône 2 (Figure 1b).
- Ajuster la distance entre l’échantillon et la lentille d’objectif inférieure en cliquant sur l’icône du panneau 3 (Figure 1b) jusqu'à ce qu’il est au point.
- Irradier les faisceaux laser à la Position 1 et 2 de Position (Figure 1B) de l’échantillon en cliquant sur les icônes I, II et III (Figure 1b).
- Régler l’intensité de chaque faisceau laser à 1 500 mW en entrant cette valeur à l’icône IV (Figure 1b).
- Déplacer la scène de l’échantillon en cliquant sur orientations indiquant icône 4 (Figure 1b) jusqu'à ce qu’une cellule est coincée en Position 1 (Figure 1b).
- Faites glisser le curseur indiquant la Position 2 (Figure 1b) jusqu'à ce qu’une autre cellule est coincé en Position 2.
5. construction d’une Structure à cellules 3 Dimensions (3D)
- Manipuler une seule cellule afin qu’il soit en contact avec une autre cellule. Maintenir cet État pour 300 s ; c'est-à-dire, chaque cellule est exposée à un laser pour 300 s.
- Enregistrer l’axe XY, illustré à la Figure 1b.
- Construire un assemblage de cellule 2D arbitraire en piégeant et en transportant une autre cellule pour les cellules.
- Construire un assemblage cellulaire 3D en déplaçant la scène en haut et en bas.
- Confirmer que l’Assemblée reste stable après que le laser est coupé.
Résultats
La figure 1 illustre le microscope et le logiciel utilisé dans cette étude. La figure 2 est une représentation schématique de la procédure de mise à la solution de l’échantillon contenant des cellules. La figure 3 montre la formation d’une structure pyramidale à l’aide de pinces optiques double-faisceau. Si l’expérience est réussie, ces assemblées cellulaires restent stables même après que le laser est coupé.

Figure 1 : (a) le système de contrôle pour le système de piégeage de Laser (NanoTracker2 (11)). Le système est activé en positionnant l’interrupteur laser suivant étapes ①-③. (b) le logiciel pour contrôler le système de piégeage de Laser. La caméra, LED lumière, mise au point de régler, et déplacement stade sont activés en cliquant sur les icônes ① ②, ③ et ④, respectivement. L’image microscopique est affichée dans le tableau 1. Le contrôle marche/arrêt pour la LED est en panneau 2. L’accent est contrôlée en panneau 3. Les faisceaux laser sont irradiés aux Positions 1 et 2 en cliquant sur les icônes I à IV. Les détails de cette Systemare de piégeage Laser sous Réf. (12). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2: Schéma représentatif pour placer le verre de la diapositive. 20 µL de l’échantillon (suspension de cellules contenant du dextran) est placé sur la lame et utilisé pour la manipulation du laser. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
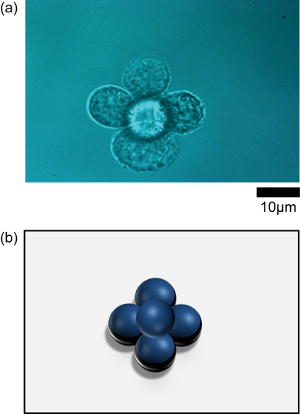
Figure 3 : un) assemblages de cellules épithéliales (NMuMG) d’une forme prévue dans un milieu avec DEX (40 mg/mL) : une pyramide est présentée comme un exemple d’un cluster de 3D. b) une figure schématique de l’Assemblée cellulaire 3D en forme de pyramide est aussi indiquée. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Cette étude montre une application concrète de nos récents rapports9,11 sur l’utilisation de polymères solubles pour la construction des ensembles de cellule unique 3D. Ces assemblys sont stablement formés dans la solution en bloc lorsque le nombre de cellules est jusqu'à 10 et pouvant être détenue par un faisceau laser unique. Assemblages de précipitent sur la surface du verre lorsqu’il y a plus de 10 éléments. Bien que les expériences sont encore à un stade primitif, nous attendons que la nouvelle méthode pourrait être un outil puissant pour la construction des assemblées de cellule unique 3D nouvelle génération, qui sont indispensables pour progresser dans les domaines de la biologie cellulaire et médecine régénérative.
Dans une solution ne contenant aucun polymère, les cellules repoussent mutuellement en raison de la répulsion électrostatique découlant de la charge de surface, la force de répulsion d’hydratation, l’effet de répulsion de glycocalyx et ondulation de la membrane. Notre étude antérieure a montré que les paires de cellules peuvent être stables pendant une longue période, lorsque les cellules sont traitées avec PEG. Plus important encore, le transport réussi d’une paire de cellules dans une région sans PEG, après que les cellules tenues en contact pendant 5 minutes dans le PEG, suggère que le contact cellulaire est maintenu de façon stable. C’est bien expliqué en ce qui concerne l' effet de déplétion11, et essentiellement le même mécanisme s’applique aux assemblys générés à l’aide de DEX9cellulaires. Nos résultats actuels suggèrent que d’autres types de macromolécules naturelles pourraient également être utilisés pour construire des assemblées cellulaires 3D stables.
Pour le transport rapide des cellules, la concentration de polymère est importante. En général, la viscosité de la solution augmente considérablement lorsque le polymère est dissous supérieure à la concentration de chevauchement. Dans ces conditions, il est difficile de manipuler des cellules à l’aide de pinces optiques. Par conséquent, l’expérience doit être effectuée inférieure à la concentration de chevauchement. Pour une solution DEX, la concentration de chevauchement est env. 50 mg/mL (la viscosité cinétique est 5,5 mm2/s). Comme le montre Réf. 9, une Assemblée cellulaire stable a été observée lorsque la concentration de DEX était de 10 mg/mL à 40 mg/mL. Ce résultat suggère que l’effet de l’appauvrissement de la couche est suffisamment grand pour maintenir le contact de cellule-cellule stable même lorsque la concentration de DEX est inférieure à la concentration de chevauchement. Il a été démontré que l’ajout de DEX n’affecte pas la viabilité cellulaire jusqu'à 40 mg/mL, 9.
La mise en place d’une méthode pour la construction d’ensembles cellulaires 3D est important dans le domaine de la médecine régénérative, depuis imitant un en vivo microenvironnement cellulaire en structurant les cellules individuelles peut-être faciliter cellules souches dérivées de tissus formation. Jusqu’ici, nous avons utilisé le présent protocole pour construire des assemblées cellulaires à l’aide de cellules Neuro2A9 en plus de cellules NMuMG. Nous espérons établir une méthode expérimentale permettant de construire des assemblées cellulaires 3D d’un plus grand nombre de cellules de morphologies différentes. Le système de pinces optiques développé par Ichikawa et al. 13 serait applicable à cet effet puisque l’orientation des cellules peut être contrôlée. De plus amples essais dans ce sens devraient être prometteurs.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient Shu Hashimoto, Aoi Yoshida et Taeko Ohta à l’Université Doshisha pour leur aide généreuse avec le montage expérimental. Ce travail a été soutenu par KAKENHI (15H 02121, 15K 05400, 25103012, 50587441) et par le programme MEXT-Supported pour la Fondation de recherche stratégique dans les universités privées. Cette étude a été également soutenue par une subvention polonaise auprès du Consortium scientifique de savoir (Leading National Research Centre) « Animal en bonne santé – alimentation sûre », décision du ministère des sciences et de l’enseignement supérieur n ° 05-1/KNOW2/2015...
matériels
| Name | Company | Catalog Number | Comments |
| Microscope IX71 | Olympus | IX71 | |
| Dextran(200,000; molecular biology-grade) | Wako | CAS.NO 9004-54-0 | |
| Laser Trapping System (NanoTracker 2) | JPK Instruments | S/N T-05-0200 | |
| Upper Objective Lens | Olympus | LUMPLFLN60XW | |
| Lower Objective Lens | Olympus | UPLSAPO60XW | |
| Top Cover Glass | MATUNAMI | C022401 | |
| Intermediate Cover Glass (Spacer) | MATUNAMI | - | custom-made (size = 10mm×10mm, thickness = 0.17mm) |
| Bottom Cover Glass | MATUNAMI | C030401 | |
| Camera | The Imaging Source | DFK 31AF03 | |
| Software | JPK Instruments | NanoTracker2 PFM software | |
| NMuMG cells | RIKEN BRC | RCB2868 | |
| PBS | Wako | 166-23555 | |
| Cell banker | Nippon Zenyaku Kogyo | ZR621 | |
| D-MEM | Wako Pure Chem. Ind., Japan | 044-29765 | |
| FBS | Cell Culture Biosci., Nichirei Biosci. Inc., Japan | 172012-500ML | |
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Penicillin-Streptomycin | Wako Pure Chem. Ind., Japan | 161-23181 |
Références
- Aloysious, N., Nair, P. D. Enhanced survival and function of islet-like clusters differentiated from adipose stem cells on a three-dimensional natural polymeric scaffold: an in vitro study. Tissue Engineering Part A. 20 (9-10), 1508-1522 (2014).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246-254 (2016).
- Kirkham, G. R., et al. Precision assembly of complex cellular microenvironments using holographic optical tweezers. Scientific Reports. 5, 8577(2015).
- Liu, Y., Rayatpisheh, S., Chew, S. Y., Chan-Park, M. B. Impact of endothelial cells on 3D cultured smooth muscle cells in a biomimetic hydrogel. ACS Applied Materials & Interfaces. 4 (3), 1378-1387 (2012).
- Liu, Z. Q., et al. Dextran-based hydrogel formed by thiol-Michael addition reaction for 3D cell encapsulation. Colloids and Surfaces B. 128, 140-148 (2015).
- McKee, C., Perez-Cruet, M., Chavez, F., Chaudhry, G. R. Simplified three-dimensional culture system for long-term expansion of embryonic stem cells. World Journal of Stem Cells. 7 (7), 1064-1077 (2015).
- Sadovska, L., et al. A novel 3D heterotypic spheroid model for studying extracellular vesicle-mediated tumor and immune cell communication. Biochemical and Biophysical Research Communications. , (2017).
- Srinivasan, P. P., et al. Primary Salivary Human Stem/Progenitor Cells Undergo Microenvironment-Driven Acinar-Like Differentiation in Hyaluronate Hydrogel Culture. Stem Cells Translational Medicine. 6 (1), 110-120 (2017).
- Yoshida, A., et al. Manipulating living cells to construct a 3D single-cell assembly without an artificial scaffold. Polymers. 9, 319(2017).
- Anderson, R. R., Parrish, J. A. Selective photothermolysis: precise microsurgery by selective absorption of pulsed radiation. Science. 220, 524-527 (1983).
- Hashimoto, S., et al. Formation of Stable Cell-Cell Contact without a Solid/Gel Scaffold: Non-invasive Manipulation by Laser under Depletion Interaction with a Polymer. Chemical Physics Letters. 655, 11-16 (2016).
- Rauch, P., Jähnke, T. Optical Tweezers for Quantitative Force Measurements and Live Cell Experiments. Microscopy Today. 22, 26-30 (2014).
- Ichikawa, M., et al. Tilt control in optical tweezers. Journal of Biomedical Optics. 13, 010503(2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon