Method Article
Une méthode directe et simple pour évaluer la viabilité du mélanogaster de Drosophilade l'embryon à l'adulte
Dans cet article
Résumé
Ce protocole est conçu pour évaluer la viabilité de la drosophile à chaque stade de développement, de l'embryon à l'adulte. La méthode peut être utilisée pour déterminer et comparer la viabilité de différents génotypes ou conditions de croissance.
Résumé
Dans Drosophila melanogaster, des tests de viabilité sont utilisés pour déterminer l'aptitude de certains milieux génétiques. Les variations alléliques peuvent entraîner une perte partielle ou totale de viabilité à différents stades de développement. Notre laboratoire a mis au point une méthode pour évaluer la viabilité de Drosophila, de l'embryon à l'adulte pleinement mature. La méthode repose sur la quantification du nombre de descendants présents à différents stades de développement, en commençant par les embryons éclos. Une fois que les embryons ont été quantifiés, d'autres étapes sont comptées, y compris L1/L2, les punes et les adultes matures. Après que toutes les étapes aient été examinées, une analyse statistique telle que le test chi-carré est utilisée pour déterminer s'il y a une différence significative entre le nombre de début de progéniture (embryons éclos) et les étapes ultérieures aboutissant au nombre observé d'adultes, rejetant ou acceptant ainsi l'hypothèse nulle (que le nombre d'embryons éclos sera égal au nombre de larves, de prud'être et d'adultes enregistrés tout au long des étapes de développement). Le principal avantage de cet analyse est sa simplicité et sa précision, car il n'est pas nécessaire qu'un rinçage embryonnaire les transfère à la fiole alimentaire, évitant ainsi les pertes dues à des erreurs techniques. Bien que le protocole décrit ici n'examine pas directement les larves de L2/L3, des étapes supplémentaires peuvent être ajoutées pour tenir compte de ces. La comparaison du nombre d'embryons éclos, de L1, de pupae et d'adultes peut aider à déterminer si la viabilité a été compromise au cours des étapes L2/L3 pour d'autres études (l'utilisation d'aliments colorés aide à l'identification visuelle des larves). Dans l'ensemble, cette méthode peut aider les chercheurs et les éducateurs de Drosophila à déterminer quand la viabilité est compromise pendant le cycle de vie de la mouche. L'évaluation courante des stocks utilisant cet analyse peut empêcher l'accumulation des mutations secondaires qui peuvent affecter le phénotype du mutant original isolé, particulièrement si les mutations originales affectent la forme physique. Pour cette raison, notre laboratoire maintient plusieurs copies de chacun de nos allèles Dm ime4 et vérifie régulièrement la pureté de chaque stock avec cette méthode en plus d'autres analyses moléculaires.
Introduction
La durée de vie est affectée par des facteurs génétiques et non génétiques. Dans des conditions de croissance de laboratoire standard à température ambiante, notre laboratoire a observé une variation significative de la condition physique et de la viabilité parmi les différents alleles Dm ime4 cultivés dans des conditions identiques (figure1 et chiffressupplémentaires). Des études de viabilité sont fréquemment faites pour étudier les effets d'une certaine combinaison d'allèle ou d'une condition de croissance dans les études génétiques de population1,2,3,4. Cependant, des analyses détaillées de la viabilité au sein d'un groupe non complémentaire de mutations sont difficiles à trouver dans la littérature scientifique. Un allèle est généralement étiqueté "non-essentiel" si le chercheur trouve quelques individus homozygous pour cet allèle dans le flacon alimentaire qui abrite le stock équilibré5,6. Cependant, les analyses précises de Chi-square pour évaluer si ces homozygotes se posent aux rapports mendéliens prévus ne sont pas rapportées5,6. La température la plus permissive pour tout stock de Drosophila est la température ambiante (22-23 oC) et, avec les nutriments appropriés, le cycle de vie des mouches de type sauvage prend environ douze jours pour terminer7,8. Comme la durée de chaque stade de développement de drosophila de type sauvage est connue7,8, la méthode décrite dans ce rapport peut être utilisée pour examiner si la souche Drosophila à l'étude est apte à chaque étape par rapport à un contrôle approprié pour le fond génétique testé. Contrairement aux études qui mettent l'accent sur un aspect spécifique du développement9, ce protocole fournit un moyen pratique d'évaluer la viabilité à différents stades de développement.
Dans notre laboratoire, ce protocole est utilisé pour évaluer la viabilité des stocks qui sont déficients pour Drosophila Inducer de La méiose 4 (Dm ime4). Dm ime4 est un gène essentiel10 qui code un méthyltransferase d'ARN avec des rôles critiques dans le métabolisme d'ARN dans Drosophila et d'autres organismes multicellulaires5,6,10, 11 Ans, états-unis ( , 12 Ans, états-unis , 13 (en) , 14 (en) . Pour évaluer rapidement les nouveaux allèles de Dm ime4 générés par CRISPR/Cas9 (Chiffres supplémentaires), un résultat de viabilité final a été effectué qui ne comptait que la progéniture adulte produite dans des flacons de stocks équilibrés (Figure 1). Certains des stocks utilisés ont été décrits dans les rapports précédents Dm ime4 5,6. Les mutants homozygotes sont apparus aux niveaux sub-mendéliens, tels que déterminés par les analyses chi-carrées (figure1 et Matériauxsupplémentaires). Pour évaluer si ces chiffres inférieurs aux prévisions étaient attribuables au nombre d'embryons pondre ou à moins d'embryons éclos ou à une perte de viabilité chez l'AL1/L2 ou les pupae, nous avons élargi le suivi pour inclure les dénombrements à chacun de ces stades de développement (figure2, Figure 3, Figure 4, Figure 5, Figure 6, Figure 7, Figure 8, et Figure 9).
Ici, nous décrivons la méthode à l'aide de mouches de type sauvage (OreR). Pour tester empiriquement cette méthode pour une utilisation avec d'autres milieux génétiques ou des espèces de Drosophila, nous recommandons d'utiliser OreR comme référence et d'ajuster les critères de temps en fonction de l'organisme expérimental. Le protocole a été évalué en outre afin d'évaluer la viabilité de la descendance générée par le croisement de femelles vierges de type sauvage avec des mâles d'un stock mutant hétérozygote Dm ime4 5,6 ( Figure4).
Protocole
1. Préparation des médias
- Préparer l'agar de raisin selon les instructions du fabricant (voir Tableau des matériaux) et verser dans un plat Petri de 35 mm à moitié plein (figure 5). Laisser se solidifier pendant environ 1 h. Après la solidifier l'agar de raisin, utiliser immédiatement ou entreposer à 4 oC.
- Faire doucement des égratignures sur la plaque d'agar à l'aide d'un petit couteau en plastique (les mouches aiment s'étendre sur des surfaces inégales) laissant le milieu de la plaque sans égratignures (Figure 5). Placer une petite quantité de pâte de levure (faite fraîche; voir Tableau des matériaux) au centre de la plaque (Figure 5).
2. Embryo Collection Mini Cage Mis en place
- Mettre en place une croix à l'aide de deux femelles vierges et d'un jeune mâle à l'intérieur de la cage de collecte d'embryons contenant la plaque d'agar de raisin complétée de pâte de levure (figure 5).
- Après 24 h, inspectez les cages pour les embryons posés sans ouvrir la cage en regardant le fond de la plaque d'agar. Si des embryons ont été pondus, retirez la plaque d'agar de la chambre et placez-la à l'intérieur d'une chambre humide pour l'observation microscopique (figure 6). Si plusieurs jours de ponte sont marqués (p. ex., tests de fertilité/longévité), gardez les parents reproducteurs et remplacez l'assiette par une plaque fraîche préparée comme décrit. Les premières collectes de moins de 24 h peuvent être faites, mais, lors de l'utilisation de femelles vierges, sachez qu'elles ne seront pas couchées jusqu'à 48 h après avoir émergé de leur cas de pupa.
- Couvrir la plaque d'agar contenant des embryons avec le couvercle du plat Petri pour éviter la déshydratation et la placer immédiatement à l'intérieur d'une chambre humide (figure 7). Observez sous un microscope disséquant et enregistrez les embryons éclos et L1. Remplacer le couvercle et le stocker à température ambiante dans une chambre humide jusqu'à ce que tous les embryons aient éclos et se soient développés en larves de L1 (figure 6).
3. Compter les embryons et les larves
- Après 48 h, observez les plaques sous le microscope disséquant et enregistrez les nombres une dernière fois avant le transfert du disque d'agar au flacon de nourriture. Les embryons fécondés/viables devraient devenir L1 d'ici là. Des périodes d'incubation plus longues avant le transfert sont possibles, mais sachez que les plaques peuvent commencer à perdre de l'humidité et que l'agar peut se fissurer, compromettant un transfert propre vers les flacons alimentaires (figure 7). Pour s'assurer que les plaques restent hydratées et que la viabilité de l'embryon n'est pas compromise pendant le comptage, évitez d'utiliser une lumière directe sur la surface de l'agar (lafigure 7E montre une distance appropriée).
- Après le comptage, couvrir la plaque et la conserver dans la chambre humide jusqu'à ce qu'elle soit prête à être transférée. Enregistrement des résultats.
4. Transférer le disque d'agar de raisin à un vial d'alimentation pour surveiller la viabilité pendant le développement
- Une fois les nombres enregistrés (embryons éclos/L1/L2), utilisez une spatule pour transférer soigneusement le disque d'agar de raisin à une fiole assez grande pour accueillir un disque de 35 mm contenant des supports alimentaires Drosophila préparés selon les instructions du fabricant (voir la liste des réactifs). Placer le disque de lagé de raisin L1-côté vers le bas sur la nourriture (Figure 7). Après avoir transféré le disque d'agar avec des larves dans le flacon alimentaire, inspectez soigneusement le plat Petri vide pour décevoir les larves laissées derrière (Figure 7E).
- Établir un calendrier pour inspecter les flacons alimentaires tous les jours, à peu près à la même heure chaque jour, afin de s'assurer que les larves de L2/L3 sont observées qui se dirigent vers la nourriture dans le flacon (figure 8).
- Enregistrez le nombre de pupae et de Drosophila adulte (figure 9). Continuez à compter jusqu'à ce qu'il n'y ait plus d'adultes et évitez de compter la génération suivante (ne comptez pas au-delà de 9 jours après avoir observé les premiers adultes).
- Observez et enregistrez les résultats. Ajuster la période de collecte, de comptage et d'enregistrement en conséquence du stock mutant utilisé.
- Effectuez une analyse carrée de chi. L'hypothèse nulle suppose une viabilité de 100 % de telle sorte que le nombre d'adultes sera égal au nombre d'embryons éclos et de L1 enregistrés et transférés à l'origine aux flacons alimentaires.
Résultats
Cette méthode permet avec précision et reproduction d'évaluer la viabilité des embryons aux adultes émergés lorsqu'ils sont couplés à des analyses carrées chi.
Dans les études initiales, après comptage des embryons et des larves, l'agar de raisin a été placé à l'intérieur de la fiole verticale sur le côté de la fiole. Malheureusement, lorsque l'agar a été placé sur le côté de la fiole beaucoup d'embryons et de larves n'ont pas mûri à des adultes. Cela était probablement dû au séchage du disque d'agar de raisin (figure 3). Ce placement a introduit une variable environnementale (hydratation du disque d'agar) qui pourrait confondre les résultats. Environ 39 % de la descendance a été perdue entre les embryons et les adultes, car seulement 61 % des adultes ont émergé. Les pertes les plus importantes se sont produites entre les larves de L1 (comptées à la surface des plaques d'agar de raisin) et les pupae (comptées sur les parois des flacons alimentaires). Cependant, lorsque la gélose de raisin a été placée face vers le bas à l'intérieur du flacon en contact direct avec la surface de la nourriture, moins de 6 % de la descendance a été perdue (figure 2). L'agar est resté hydraté pendant que le disque entier d'agar de raisin est resté en contact avec l'humidité de la nourriture instantanée à l'intérieur du flacon (figure 7, figure 8). Ces résultats indiquent que la position de l'agar à l'intérieur du flacon est importante pour obtenir des données fiables et minimiser la contribution des variables environnementales. D'autres données pour soutenir l'efficacité de la méthode ont été recueillies en comparant la progéniture de type sauvage utilisée dans la validation de la méthode initiale et la progéniture produite par la croisement de femelles vierges de type sauvage aux mâles à partir d'un stock mutant Dm ime4 équilibré ( Figure supplémentaire 2, ime4-null/TM3sb). Environ 91 % de la progéniture a mûri jusqu'à l'âge adulte, comparativement à 94 % de la descendance de type sauvage (figure 4). Cette différence n'était pas statistiquement significative.
Homozygous Dm ime4 mâles mutants5 ont également été utilisés pour fournir une validation plus poussée de la méthode. Cependant, les mutants homozygotes étaient trop malades pour se reproduire et sont morts avant que les embryons ne soient déposés. Par conséquent, l'une des limites de l'expérience est que les mâles doivent être en assez bonne santé pour se reproduire pour générer une population d'embryons débutants à suivre.
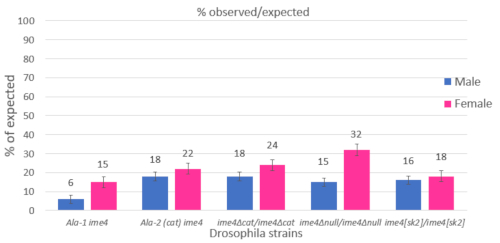
Figure 1 : Les stocks mutants d'Ime4 émergent aux niveaux sub-mendeliens. Les stocks dans lesquels des parties du domaine catalytique ou du domaine de liaison Ado-Met ont été mutées sont indiqués (voir la figure supplémentaire 1 pour plus de détails). Certains stocks avaient des parties de l'un ou l'autre domaine remplacé par Ala (mutagénèse alanine-scanning), tandis que d'autres stocks avaient soit ou les deux domaines supprimés. Le rapport entre le nombre observé d'homozygotes et les nombres attendus est représenté en pourcentages (par rapport aux contrôles hétérozygotes des frères et sœurs, se référer à la figure 3 supplémentaire pour le schéma de tri et l'analyse carrée chi). Des analyses carrées de Chi ont été effectuées pour déterminer si la différence entre observée et prévue était statistiquement significative et non due au hasard seul (p-valeurs 'lt; 0.01). Les barres d'erreur représentent une erreur standard de la moyenne (minimum de trois essais par croix indiqué). Une feuille de calcul avec toutes les données peut être trouvée dans Les Matériaux Supplémentaires. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : La position de l'agar à l'intérieur du flacon peut introduire des variables environnementales involontaires. Histogramme du nombre d'individus à différents stades de développement comptés à partir du côté de l'embryon de disque d'agar de raisin vers le bas dans le flacon ou l'agar de nourriture sur le côté du flacon de nourriture. Le fait de placer le disque d'agar côté embryon vers le bas dans le flacon a entraîné 94 % (SD - 0,02) des embryons initiaux qui ont survécu jusqu'à l'âge adulte. Le fait de placer l'agar sur le côté du flacon alimentaire n'a donné lieu qu'à 61 % (SD - 0,07) des embryons initialement comptés atteignant l'âge adulte. Une feuille de calcul avec toutes les données peut être trouvée dans les matériaux supplémentaires. Les nombres attendus à chaque étape sont fixés au fur et à mesure que le nombre initial d'embryons/L1 comptés sur le disque d'agar de raisin avant le transfert vers le flacon alimentaire (hypothèse de nullité : 100% des embryons éclos se développent). Les nombres observés sont le nombre réel d'individus comptés pour le stade de développement indiqué. Ainsi, chaque étape est comparée au nombre initial d'embryons éclos comptés sur la plaque d'agar de raisin. Des analyses carrées de Chi ont été effectuées pour déterminer si la différence entre observée et prévue était statistiquement significative et non due au hasard seul en utilisant un seuil de valeur p de 0,05. La différence était significative pour les embryons cultivés avec de l'agar sur le côté de la fiole alimentaire, mais pas pour ceux cultivés dans un côté embryon disque vers le bas. Les barres d'erreurs représentent une erreur standard (minimum de trois essais par croix indiquée). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Dessin animé montrant deux façons dont les disques d'agar de raisin portant des embryons/L1peuvent peuvent être placés à l'intérieur du flacon de nourriture. Il y avait une différence significative entre le nombre total d'embryons et la descendance adulte en fonction de la position de l'agar dans le flacon alimentaire. La différence provient d'une variable environnementale (hydratation) créée par la différence de placement du disque à l'intérieur du flacon alimentaire : il existe une différence statistiquement significative entre les nombres attendus et observés chez les larves et les pupaes lorsque l'agar le disque a été placé sur le côté de la fiole par rapport à aucune différence significative dans les nombres attendus par rapport aux nombres observés lorsque le disque d'agar était en contact avec la nourriture. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Histogramme montrant le nombre d'individus à différents stades de développement des mâles de type sauvage par rapport aux mâles d'un stock équilibré mutant Dm ime4. Les mâles équilibrés ont traversé aux femelles sauvages vierges-type comme décrit dans 2.1. Agar a été transféré côté embryon vers le bas dans les flacons alimentaires. Le rapport moyen d'adultes émergeant des embryons originaux comptés dans les disques d'agar de raisin de type sauvage X sauvage était de 94 %, SD - 0,02, tandis que ce rapport pour d'ime4 mutant s'est dit de 91 %, De DD et 0,01. L'analyse statistique a été effectuée comme décrit pour la figure2; les différences n'étaient pas significatives pour l'un ou l'autre groupe. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
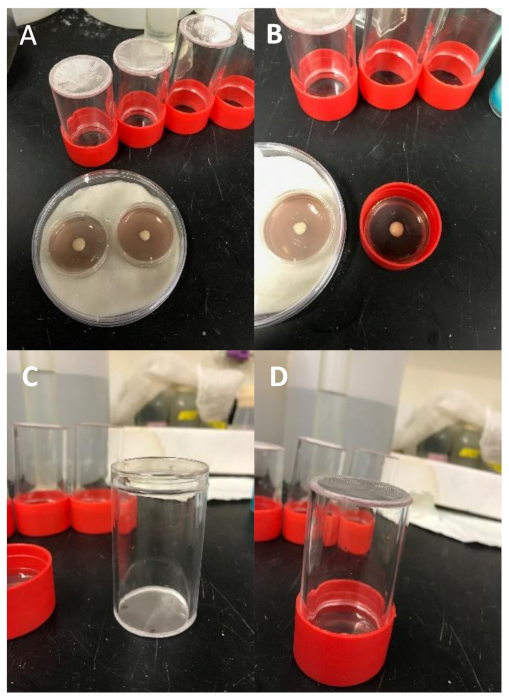
Figure 5 : Configuration expérimentale. (A) Collection d'embryons mini-cages et plats de mini-Petri de raisin-agar. Les plaques sont placées à l'intérieur d'une chambre humide (plat Petri standard avec disque de papier absorbant saturé d'eau) pour prévenir la déshydratation. Une petite quantité de pâte de levure a été placée au centre de chaque assiette de raisin-agar. (B) Détachez le couvercle du porte-plaque de collecte d'embryons (rouge) et placez une assiette préparée, côté levure vers le haut. (C) Transférer la croix dans la cage de l'embryon et placer immédiatement un couvercle de vaisselle Petri pour retenir les mouches à l'intérieur. (D) Retirez rapidement le couvercle et retournez la cage d'embryon afin que l'ouverture entre en contact avec la plaque de raisin-agar. Incuber pendant 24-48 h, en inspectant tous les jours. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 : Développement d'embryons sur des assiettes de raisin-agar. (A) Les embryons sauvages déposés sur les mini-Petri de raisin-agar sont comptés sous un microscope disséquant. Gardez les plaques à l'intérieur de la chambre humide lorsque vous ne visualisez pas et évitez la lumière directe pour prévenir la déshydratation. (B) Les plaques de raisin-agar sont conservées dans une chambre humide et des embryons de type sauvage éclos sont enregistrés. Cette photo montre trois larves sauvages de type L1 qui se sont développées à partir d'embryons présentés en A. (C) Exemple de nombres enregistrés d'embryons (jour 1) et de larves De L1 (jour 2) pour les deux plaques indiquées à la figure 5. Le « nombre prévu » pour l'hypothèse nulle est déterminé par le nombre d'embryons qui ont éclos et sont devenus des larves de L1 au moment du transfert vers le flacon alimentaire (tableau ci-dessous). Pour les mouches de type sauvage, presque tous les embryons éclosent et se développent en larves de L1. Ce n'est peut-être pas le cas pour d'autres milieux génétiques et cette méthode est utilisée pour déterminer ces différences de viabilité. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 7 : Transfert de larves. (A) Après avoir enregistré les comptes L1, les disques de raisin-agar sont soigneusement retirés du plat Petri à l'aide d'une spatule propre (à l'éthanol) (B,C) et transférés L1 latéralement vers le bas pour contacter la nourriture dans les flacons comme indiqué dans D. (E) Le plat Petri vide est soigneusement inspecté pour détecter les larves laissées derrière. Si les larves laissées derrière sont vivantes et peuvent être transférées dans le flacon de nourriture, faites-le soigneusement et immédiatement (F). Si les larves laissées derrière sont mortes ou ne peuvent pas être transférées, enregistrez ce fait pour corriger le « nombre prévu » pour les calculs ultérieurs. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 8 : Les larves de L2 font leur chemin dans lanourriture. Voyez les crevasses et les rainures entre le disque de raisin-agar et la nourriture bleue. Établiz un horaire pour observer les flacons tous les jours, de préférence à la même heure de la journée. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 9 : Émergence adulte. (A) Les larves de L3 sortent de la nourriture pour devenir des chiots. (B) Les adultes commencent à émerger le jour 11. Établissez un horaire pour observer les flacons tous les jours, de préférence à la même heure de la journée et enregistrez soigneusement vos observations. Arrêtez de compter quand toutes les pune ont émergé (comptez les caisses vides de pune) et évitez de compter la prochaine génération de mouches en arrêtant l'expérience le jour 15 et comptez les punemortes mortes le cas échéant (punes noires/séchées). Les mutants dont le cycle de vie est plus long peuvent avoir besoin de périodes plus longues, qui doivent être déterminées empiriquement. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Chiffres supplémentaires. Veuillez cliquer ici pour télécharger ces fichiers.
Matériaux supplémentaires. Veuillez cliquer ici pour télécharger ces fichiers.
Discussion
En résumé, cette méthode fournit une évaluation précise et simple de la viabilité dans Drosophila. L'ensemble du protocole prend environ 14 jours. La procédure ne nécessite pas de compétences techniques expertes; cependant, le bon moment, un calendrier d'observations quotidiennes et un transfert minutieux d'agar sont importants pour l'exactitude et la reproductibilité.
En plus de la mise en place du disque de raisin-agar côté embryon vers le bas dans le flacon alimentaire, une autre étape cruciale dans la procédure est le transfert du disque d'agar à une fiole alimentaire au plus tard 48 h après avoir retiré l'assiette d'agar de raisin des mini cages de collecte d'embryons. Le transfert de l'agar après 48 h a entraîné la perte d'embryons et de larves, probablement en raison de la déshydratation du disque d'agar. Pour compter les transitions L2/L3, la plaque doit couver pendant 72 h. Si cette étape est cruciale, les plaques d'agar de raisin doivent être versées plus épaisses et une chambre humide doit être employée pour empêcher la dessiccation. Les croix ont été installées dans des cages de collecte d'embryons pouvant accueillir des plaques de 35 mm; cependant, cette procédure peut être effectuée en utilisant de plus grandes cages de collecte d'embryons aussi bien, comme celle qui peut accueillir des plaques de 60 mm ou 100 mm Petri. Les bouteilles de nourriture doivent alors être assez grandes pour accueillir ces tailles.
Il y a des étapes qui peuvent être ajoutées à ce protocole. Comme mentionné ci-dessus, les transitions L2/L3 sont difficiles à quantifier sur les plaques en raison du temps requis et de la déshydratation potentielle de l'agar. En outre, les larves deviennent très mobiles à la surface de l'agar, ce qui pose un défi pour les compter avec précision. Placer les assiettes au réfrigérateur pendant 30 minutes ou ajouter quelques gouttes d'anesthésique doux (solution de lidocaïne) à la surface de l'agar avant de compter les larves de L2/L3 peut aider à ralentir leurs mouvements pour les compter plus précisément. Une mise en garde à ces modifications est qu'elles peuvent introduire des variables (sensibilité au froid, sensibilité anesthésique) et confondre les résultats de viabilité. Même sans ces étapes, en utilisant des aliments colorés, les chercheurs peuvent quantifier les L3/prépacaris errants lorsqu'ils s'installent sur le côté des flacons alimentaires pour initier la pupaison. Une limitation à cette méthode est qu'elle exige que les adultes utilisés dans les croix pour survivre à être anesthésiés avec co2 pour le phénotypage pour mettre en place les croix dans les cages de collecte d'embryons. Les mâles mutants homozygous homozygous d'Ime4 ne récupèrent pas bien et meurent quelques heures après le réveil du traitement de CO 2. D'autres méthodes pour immobiliser les adultes pour le tri peuvent être explorées, comme placer des flacons dans le réfrigérateur pendant quelques minutes, puis transférer des flacons sur la glace concassée pour ralentir le mouvement et trier rapidement et efficacement.
En plus de comparer les forces alléliques et leurs effets sur la viabilité, cette méthode peut être utilisée pour filtrer la sensibilité ou la résistance aux composés pharmaceutiques définis. Contrairement à d'autres méthodes qui filtrent la toxicité des composés dans la culture cellulaire15,16,17,18, cette méthode utilise des organismes entiers, ce qui rend l'évaluation des effets du développement plus facile à analyser. En résumé, en utilisant ce protocole et les modifications qui s'y plairont, permettront de mesurer les forces alléliques ainsi que les effets des facteurs environnementaux et des composés chimiques sur la viabilité de Drosophila, la fécondité, la durée de vie et la durée de cycle de développement.
Déclarations de divulgation
Il n'y a pas de conflitddal d'intérêts.
Remerciements
Nos travaux sont financés par les NIH 1R15GM1131-01 à CFH et NIH PA -12-149 À CFH.
matériels
| Name | Company | Catalog Number | Comments |
| Antimold additive | Carolina | ||
| Beaker | Fisher Scentific | S76100J | Beaker |
| Benchmark scientific digital hotplate | The Lab Depot | H3760H | Hot plate |
| Britta-filtered tap water to prepare grape agar and instant fly food | Any tap water filtration system | ||
| CO2 pistol or FlyNap | Carolina | Anesthetic to sort/count adult flies | |
| Dissecting microscope/stereoscope | Amscope | SM-1TSZ-V203 | Dissecting microscope |
| Drosophila culture vials and stoppers | Carolina | 173120 | Food vials for growing Drosophila |
| Embryo collection mini cage | Genesee Scientific | 59-105 | chamber used to gather embryos |
| Erlenmeyer flask | Sigma-Aldrich | 70980 | Erlenmeyer flask |
| Formula 4-24 Instant Drosophila Medium, Blue | Carolina | https://www.carolina.com/drosophila-fruit-fly-genetics/formula-4-24-drosophila-medium-blue/FAM_173210.pr | |
| Grape agar | Genesee Scientific | 47-102 | Media used for agar plates |
| Instant fly flood | Carolina | 173210 | Blue media for food vials |
| Large Petri dish or any clear container to be used as a humid chamber by placing wet paper towels to keep the grape-agar plates moist during incubation/pre and post microscopic observation | |||
| Metal spatula (small) | Carolina | ||
| Microwave | Any | To cook grape agar | |
| Petri dish | Kord-Valmark | 2901 | Petri dish for grape agar |
| Stir bar | The Lab Depot | 58948-981-EA | Magnetic stir bar |
Références
- Hartung, E. W. Some observations on the larval growth rate and viability of two tumor strains of Drosophila melanogaster. Science. 107 (2777), 296-297 (1948).
- Moree, R., King, J. R. Experimental Studies on Relative Viability in Drosophila Melanogaster. Genetics. 46 (12), 1732-1752 (1961).
- Da Costa, M. V. Viability of F1 and F2 generations of crossed Drosophila and Oregon previously adapted to 2 different nutrient media. Comptes rendus de l'Académie des Sciences. 242 (1), 177-180 (1956).
- Garcia-Dorado, A., Caballero, A. The mutational rate of Drosophila viability decline: tinkering with old data. Genome Research. 8 (2), 99-105 (2002).
- Lence, T., et al. m6A modulates neuronal functions and sex determination in Drosophila. Nature. 540 (7632), 304-318 (2016).
- Haussmann, I. U., et al. m(6)A potentiates Sxl alternative pre-mRNA splicing for robust Drosophila sex determination. Nature. 54 (7632), 301-304 (2016).
- Stockwer, H., Gallant, P. Getting started: An overview on raising and handling Drosophila. Methods in Molecular Biology. 420, 27-44 (2008).
- Hales, K. G., et al. Genetics on the Fly: A Primer on the Drosophila Model System. Genetics. 201 (3), 815-842 (2015).
- Gardner, M., et al. Genetic Variation for Preadult Viability in Drosophila melanogaster. Evolution. 55 (8), 1609-1620 (2001).
- Hongay, C. F., Orr-Weaver, T. L. Drosophila Inducer of MEiosis 4 (IME4) is required for Notch signaling during oogenesis. Proceedings of the National Academy of Sciences of the United States of America. 108, 14855-14860 (2011).
- Zhong, S., et al. MTA Is an Arabidopsis Messenger RNA Adenosine Methylase and Interacts with a Homolog of a Sex-Specific Splicing Factor. The Plant Cell. 5, 1278-1288 (2008).
- Wang, Y., et al. N6-methyladenosine modification destabilizes developmental regulators in embryonic stem cells. Nature Cell Biology. 16, 191-198 (2014).
- Hsu, P. J., Shi, H., He, C. Epitranscriptomics influence on development and disease. Genome Biology. 18 (197), 1-9 (2017).
- Kan, L., et al. The m6A pathway facilitates sex determination in Drosophila. Nature Communications. 8, 1-16 (2017).
- Senkowski, W., et al. Three-Dimensional Cell Culture-Based Screening Identifies the Anthelmintic Drug Nitazoxanide as a Candidate for Treatment of Colorectal Cancer. Molecular Cancer Therapeutics. 14 (6), 1504-1516 (2015).
- Ramasamy, S., Bennet, D., Kim, S. Drug and bioactive molecule screening based on a bioelectrical impedance cell culture platform. International Journal of Nanomedicine. 9, 5789-5809 (2014).
- Weltin, A., et al. Cell culture monitoring for drug screening and cancer research: a transparent, microfluidic, multi-sensor microsystem. Lab on a Chip. 14 (1), 138-146 (2014).
- Astashkina, A., Mann, B., Grainger, D. W. A critical evaluation of in vitro cell culture models for high-throughput drug screening and toxicity. Pharmacology & Therapeutics. 134 (1), 82-106 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon