Method Article
Transduction et expansion des lymphocytes T primaires en neuf jours avec maintien du phénotype de la mémoire centrale
Dans cet article
Résumé
Nous décrivons un protocole de 9 jours pour la transduction et l’expansion des cellules mononucléaires périphériques de sang de macaque de rhésus qui donne des cellules avec une excellente co-expression des gènes d’intérêt dans le nombre suffisant pour des études de perfusion de l’efficacité cellulaire.
Résumé
Les immunothérapies émergentes pour traiter les maladies infectieuses et les cancers impliquent souvent la transduction des populations cellulaires avec des gènes codant des protéines ciblant les maladies. Par exemple, les cellules des récepteurs antigènes chimériques (RCA)-T pour traiter les cancers et les infections virales impliquent la transduction des lymphocytes T avec des gènes synthétiques codant des molécules de RCA. Les molécules de RCA font que les lymphocytes T reconnaissent et tuent spécifiquement le cancer ou les cellules infectées viralement. Les cellules peuvent également être co-transduites avec d’autres gènes d’intérêt. Par exemple, les cellules peuvent être co-transduites avec des gènes codant des protéines qui ciblent les cellules à des endroits spécifiques. Ici, nous présentons un protocole pour transduire les cellules mononucléaires périphériques primaires de sang (PBMCs) avec des gènes codant un CARDIO de protéine de maladie-spécifique et la molécule de chimiokine de molécule de chimiokine de protéine de cellules B type 5 (CXCR5). Cette procédure prend neuf jours et a comme conséquence les populations transduites de cellules T qui maintiennent un phénotype central de mémoire. L’entretien d’une mémoire centrale ou d’un phénotype moins différencié s’est associé à la persistance des cellules post-infusion. En outre, les cellules produites avec cette méthode montrent des niveaux élevés de viabilité, des niveaux élevés de co-expression des deux gènes transductés, et des quantités suffisantes de cellules pour l’infusion immunothérapeutique. Ce protocole de neuf jours peut être largement utilisé pour les cellules CAR-T et d’autres approches d’immunothérapie à cellules T. Les méthodes décrites ici sont basées sur des études présentées dans nos publications précédentes.
Introduction
Les immunothérapies cellulaires apparaissent comme un nouveau moyen de traiter les maladies, y compris les cancers et les maladies infectieuses. Ces méthodes d’immunothérapie impliquent souvent la manipulation génétique des cellules thérapeutiques pour exprimer des molécules spécifiques. Par exemple, les cellules T des récepteurs d’antigène chimériques (CAR) sont conçues pour exprimer une molécule de RCA qui a un domaine extracellulaire qui lie spécifiquement les molécules sur les cellules malades et un domaine de signalisation qui déclenche les cellules immunitaires pour tuer la cellule malade. Les lymphocytes T de la RCA sont utilisés avec succès dans les immunothérapies contre le cancer et ont été particulièrement efficaces dans le traitement des leucémies à cellules B1,2,3. Des cellules CAR-T sont également en cours de développement pour traiter les infections virales telles que le VIH. Les CCR spécifiques au VIH ciblent les protéines d’enveloppe à la surface des cellules infectées viralement4. Les cellules immunothérapeutiques peuvent également être conçues pour exprimer des molécules de homing pour cibler les cellules thérapeutiques à des endroits spécifiques des tissus. Nous avons développé des vecteurs qui transduisent à la fois un CAR spécifique au virus ainsi que la molécule d’homing follicle lymphoïde CXCR55.
La réplication virale de certains virus, y compris le virus de l’immunodéficience humaine (VIH) et le virus de l’immunodéficience simienne (SIV), est concentrée dans les follicules cellulaires B dans les tissus lymphoïdes secondaires6. Les follicules cellulaires B sont des sites quelque peu immunitaires privilégiés dans lesquels de faibles niveaux de CTL spécifique au virus permettent la réplication virale en cours7,8. Pour ces raisons, le ciblage des lymphocytes T spécifiques au VIH/SIV dans le follicule par l’expression de CXCR5 est une stratégie pour l’élimination du réservoir folliculaire des cellules infectées viralement9,10. Plus précisément, nous ciblons les lymphocytes T CAR spécifiques à SIV aux follicules cellulaires B par l’intermédiaire de la co-expression CXCR5.
Dans ce protocole, nous décrivons une méthode pour transduire CAR/CXCR5 et étendre les PBMC pour produire des cellules T CAR/CXCR5 de quantités suffisantes pour l’infusion thérapeutique. Les cellules transductées avec ces méthodes maintiennent un phénotype central de mémoire. Des études ont montré que les cellules avec un phénotype moins différencié, tels que les lymphocytes T mémoire centrale et les cellules souches de mémoire T mieux persistent que les cellules plus différenciées11,12. En outre, de nombreux protocoles conçus pour produire des cellules transférées d’adoption ont des temps de culture relativement longs qui se traduisent par des cellules qui ont un phénotype plus différencié et une persistance réduite13. En outre, les cellules transférées adoptivement avec de longs temps de culture accumulés dans les poumons au lieu de cibler les tissus lymphoïdes dans le macaque rhésus14,15. Dans les méthodes que nous décrivons et démontrons ici, nous transduisons et élargissons rapidement les PBMC macaques rhésus pour produire des lymphocytes T transductés qui maintiennent un phénotype de mémoire centrale.
Les cellules T CD4 et CD8 sont incluses dans notre approche d’immunothérapie. Cette population de cellules mixtes a été choisie parce que, dans les essais cliniques, l’absence de lymphocytes T CD4MD dans le produit de cellule T CD8 a été corrélée avec un échec des lymphocytes T CD8 infusés pour persister 16. Les méthodes décrites ici commencent par activer les PBMC avec des anticorps anti-CD3 et anti-CD28 qui stimulent puissamment le récepteur des lymphocytes T et fournissent un signal co-stimulant pour éviter l’anergie clonale17,18.
Après l’activation, les cellules sont transduites avec un vecteur gammarétroviral codant un CAR spécifique au virus et la molécule de homing lymphoïde CXCR5. Les cellules transduites sont ensuite élargies à l’aide de plaques conçues pour la propagation cellulaire non adhérente qui ont une membrane perméable au gaz à la base. Cette membrane permet l’échange de gaz au fond du puits menant à une meilleure survie cellulaire et à la disponibilité des nutriments19. À l’aide de ces méthodes, des cellules fonctionnelles suffisantes peuvent être produites dans un délai de 9 jours pour les études sur l’infusion in vivo. Bien que ce protocole soit conçu pour la transduction et l’expansion des cellules T macaques rhésus, avec une légère modification des anticorps d’activation spécifiques aux espèces, il peut être utilisé avec des cellules d’autres espèces. Ces méthodes sont basées sur nos études publiées précédemment9,20.
Protocole
REMARQUE : Ce protocole de transduction rhésus PBMC nécessite l’utilisation d’un vecteur gammarétroviral. Notez que le gammarétrovirus peut être produit en laboratoire ou externalisé à une société de production virale. Dans la production de laboratoire peut être effectuée avec le protocole décrit à l’étape 1 et le virus peut être titered comme indiqué dans l’étape 2. Que le virus soit produit sur place ou par une société de production, un MOI (rapport des virions infectieuses aux cellules en culture) doit être déterminé, comme indiqué à l’étape 3, pour chaque préparation virale nouvellement produite et les cellules d’intérêt.
CAUTION : Le travail avec des vecteurs gammarétroviraux ou d’autres vecteurs rétroviraux nécessite des précautions de sécurité appropriées telles que l’utilisation de blouses de laboratoire et de doubles couches de gants. Toute manipulation du virus doit se produire dans le capot de biosécurité. Toutes les pipets doivent être décontaminées dans une solution de 10% d’eau de Javel pendant 30 min. Tous les déchets infectieux liquides doivent être décontamiés avec une concentration finale de 10 % d’eau de Javel. Le confinement secondaire, avec un joint qui empêche la libération d’aérosols microbiologiques, est nécessaire pour la centrifugation
1. Produire le stock Gammarétroviral
- Plaques 293T cellules pour la transfection. Une préparation complète du virus nécessite 12 flacons T75 à 4,5 x 106 cellules/flask dans le milieu d’aigle modifié de Dulbecco (DMEM) - 10% de sérum bovin fœtal (FBS) sans antibiotiques.
- Laisser les cellules se développer pendant la nuit à 37 oC avant la transfection.
- Diluer 60 l de réactif transfection dans un support de sérum réduit de 1,5 mL. Préparer un tube pour chaque flacon. Incuber pendant 5 minutes à RT.
- Pour chaque flacon, préparer un tube contenant 1,5 ml de support sérique réduit et les plasmides suivants : 9,0 g d’un plasmide de transfert contenant le gène d’intérêt, 3 g de RD114 et 1,2 g de VSV-G (plasmides d’enveloppe) et 3 g de gag/pol.
REMARQUE : L’enveloppe et les gènes gag/pol sont nécessaires pour l’emballage rétroviral. Pour notre production rétrovirale, nous ajoutons à la fois l’enveloppe RD114 et, pour une stabilité accrue, une petite quantité d’enveloppe VSV-G. - Ajouter les plasmides dilués (étape 1.4) au réactif transfection dilué (étape 1.3). Mélanger délicatement. Incuber pendant 20 minutes à température ambiante.
- Nourrir les cellules 5 ml de support frais complet et ajouter 3 ml de mélange transfection reagent/plasmide goutte à goutte par flacon et incuber pendant 5 à 6 h à 37 oC.
- Ajouter 5 ml de milieu frais à la flacon et incuber de 42 à 43 h à 37 oC.
- Après un temps de transfection total de 48 h, collectez les médias et la centrifugeuse à 1282 x g pendant 3 min à 4 oC pour enlever les débris cellulaires.
- Aliquot en volumes appropriés pour une utilisation future, flash geler le virus dans un bain de glace éthanol/sec et stocker à -80 oC.
2. Titering le Gammarétrovirus
REMARQUE : Plusieurs dilutions du virus peuvent être nécessaires pour obtenir un titer valide.
- Plaque 293T cellules à 600.000 cellules /puits dans une plaque de 6 puits et incuber les plaques pour 24 h à 37 oC.
- Retirer le milieu des cellules et ajouter la quantité désirée de DMEM - 10% FBS à la 293T (2 mL volume total de virus).
- Ajouter le virus au puits correspondant et tourbillonner doucement pour mélanger. Par exemple, ajoutez 200 L, 100 L, 50 L et 25 L respectivement à 4 puits. Inclure un puits sans virus pour la cytométrie des débits (échantillon fictif).
- Incuber pendant 48 h à 37 oC.
- Trypsinize les cellules 293T en ajoutant 0,5 mL de Trypsin-EDTA et incuber pendant 4 min à 37 oC. Arrêtez la trypsine en ajoutant 1,5 mL de DMEM et 10% FBS. Comptez les cellules et déterminez la viabilité avec un compteur cellulaire automatisé ou un hémocytomètre.
- Pour utiliser le compteur cellulaire, ajoutez 10 l de cellules à 10 l de bleu trypan, mélangez, chargez la diapositive de la chambre et insérez dans le comptoir. Appuyez sur le bouton "capture" pour compter les cellules.
- Recueillir 0.5-1 x 106 cellules et évaluer les niveaux de CAR et CXCR5 par cytométrie d’écoulement (voir étape 9.5). L’expression de CD4 ou MBL avec CXCR5 permettra d’identifier les cellules transductrices 293T co-exprimant le CAR et le CXCR5. Voir les anticorps réactifs dans l’étape 9.5.1.
- Calculez le titer viral.
REMARQUE : Choisissez l’échantillon avec un niveau de transduction de 20 % ou moins pour le calcul du titer.- Utilisez la formule suivante pour calculer le titer :
unités de transduction/mL (nombre de cellules en culture) (% des cellules transduites) /volume de virus ajouté à la culture
- Utilisez la formule suivante pour calculer le titer :
3. Déterminer le MOI optimal pour une préparation virale nouvellement produite et les cellules d’intérêt
- Suivez le protocole de transduction (sections 4-9) avec les PBMC primaires et deux dilutions de la préparation gammarétrovirale.
- Évaluer le niveau d’expression des gènes d’intérêt par cytométrie du débit (étape 9.5).
- Choisissez une concentration de virus qui permet une transduction maximale sans perte de viabilité cellulaire.
4. Préparation des plaques pour l’activation des lymphocytes T par des puits de revêtement avec des anticorps anti-CD3
- Préparer l’anticorps CD3 anti-macaque (FN18) en dilant le stock à 10 g/mL dans un salin tamponné par phosphate (PBS).
- Dispenser 2 ml/puits en plaques de 6 puits. Incuber à 37 oC pour 2 h. Alternativement, les plaques peuvent être incubées pendant la nuit à 4 oC.
- Aspirez le PBS et les anticorps non liés. Rincer les puits deux fois avec 2 ml de PBS et utiliser immédiatement pour plaquer les PBMC.
5. Stimuler les PBMC Rhésus avec l’anti-CD3 à assiettes et solubles anti-CD28
- Dégelez les PBMC primaires dans un bain d’eau de 37 oC, avec une douce agitation, jusqu’à ce qu’il ne reste qu’une petite quantité de glace.
- Dans le capot, doucement les cellules de pipette dans un tube conique. Rincer la fiole avec 1 ml de médium de base et l’ajouter lentement aux cellules. Ensuite, ajouter lentement 9 ml de milieu de base chaud aux cellules.
REMARQUE : Cette étape peut être mise à l’échelle, mais ne jamais décongeler plus de 4 flacons à la fois. - Centrifugeuse à 600 x g pendant 5 min à 22 oC pour pelleter les cellules. Aspirer le supernatant puis réutiliser la pastille dans un petit milieu de croissance. Choisissez un volume de telle sorte que la concentration de cellules dépassera 2 x 106 cellules/mL à ce stade puisque la concentration finale devrait être de 2 x 106 cellules/mL.
- Tacher les cellules avec le bleu trypan et compter les cellules pour déterminer le nombre de cellules viables.
REMARQUE : Cela peut être fait avec un hémocytomètre standard ou un compteur cellulaire automatisé. Nous utilisons un compteur cellulaire automatisé qui affiche la viabilité et le nombre de cellules vivantes.- Pour utiliser le compteur, ajoutez 10 l de cellules à 10 l de bleu trypan, mélangez, chargez la diapositive de la chambre et insérez dans le comptoir. Appuyez sur le bouton "capture" pour compter les cellules.
- Calculer le nombre total de cellules en multipliant la concentration cellulaire par volume, puis diluer les cellules à 2 x 106 cellules/mL dans le milieu de croissance. Avant le placage, ajoutez l’anti-CD28 à une concentration finale de 5 g/mL afin de fournir un signal co-stimulant nécessaire pour l’activation des lymphocytes T.
- Cellules pipette dans des plaques enduites anti-CD3. Ajouter 3 à 6 x 106 cellules par puits (une bonne cible est de 4 x 106 cellules dans un support de 2 ml par puits) et incuber pendant 2 jours à 37 oC en 5 % de CO2.
6. Préparation des plaques recouvertes de fibronectine
REMARQUE : Les cellules PBMC et T expriment les récepteurs d’intégrine VLA-4 ou VLA-5 et sont de bonnes cibles pour la transduction fibronectine-négociée.
- Avant d’enrober les plaques, préparez d’abord le réactif de fibronectine en la diluant 1:100 dans pbs stérile.
- Pipette 2 ml de la solution de fibronectine stérile dans chaque puits d’une plaque de 6 puits. Plaques de roche délicates pour 2 h à température ambiante.
REMARQUE : Les assiettes ou les plats de culture tissulaire non traités de qualité culture cellulaire doivent être utilisés dans cette étape. - Supprimer la solution fibronectine par aspiration, puis bloquer avec 1 mL d’albumine de sérum stérile de 2% bovine (BSA, Fraction V) dans PBS. Rochez les plaques à température ambiante pendant 30 min.
- Aspirez la solution BSA et lavez la plaque avec 2 ml de PBS. Après aspiration du PBS, les plaques recouvertes de fibronectine peuvent être scellées avec de l’enveloppe de joint et stockées à 4 oC pendant une semaine.
REMARQUE : Nous préparons habituellement les plaques un jour avant la transduction.
7. Transduction de PBMC rhésus activés
CAUTION : Travailler avec des vecteurs viraux ou avec des PBMC macaques rhésus nécessite l’utilisation de précautions de sécurité appropriées telles que l’utilisation de blouses de laboratoire et de doubles couches de gants. Toute manipulation du virus et des cellules doit se produire dans le capot de biosécurité. Toutes les pipets doivent être décontaminées dans une solution de 10% d’eau de Javel pendant 30 min. Tous les déchets infectieux liquides doivent être décontamiés avec une concentration finale de 10 % d’eau de Javel. Le confinement secondaire avec un joint qui empêche la libération des aérosols microbiologiques, est nécessaire pour la centrifugation.
- Attachez le vecteur de transduction gammarétroviral au puits recouvert de fibronectine.
- Chauffer une centrifugeuse à 32 oC en courant à 2000 x g pendant environ 30 min.
- Réchauffez à la fois les médias sans sérum et la croissance dans un bain d’eau de 37 oC.
- Décongeler le virus sur la glace ou en faisant tourbillonner doucement la fiole dans un bain d’eau de 37 oC jusqu’à ce qu’il ne reste qu’une petite quantité de glace. Pour éviter la dégradation de la préparation virale, ne laissez pas le contenu se réchauffer.
- Diluer le rétrovirus à une multiplicité optimale prédéterminée de l’infection (MOI) dans un milieu sans sérum.
REMARQUE : Avec notre gammarétrovirus et notre rhésus PBMC, nous avons constaté qu’un MOI de 0,5 est optimal.- Exemple de dilution : Pour enrober 4 puits de virus et ajouter 1,5 x 106 cellules, (4) (1,5 x 106) (0,5) à 3 x 106 TU sont nécessaires. Si le titer viral est de 1,1 TU/mL, utilisez alors le virus de 2,7 ml dans un support de 5,3 ml pour un volume total de 8 ml.
- Ajouter 2 ml de rétrovirus dilué à chaque puits de la plaque recouverte de fibronectine.
- Pour les cellules contrôlées par simulation négative, ajoutez le support seul aux puits enduits de fibronectine.
- Placer les plaques dans la centrifugeuse préchauffée de 32 oC dans les porte-microplaques avec des couvercles de biosécurité et de la centrifugeuse à 2000 x g pour 2 h.
REMARQUE : Les plaques enduites de virus peuvent être utilisées immédiatement ou stockées, avec le virus, à 4 oC pendant la nuit. - Pour une utilisation immédiate, aspirez la préparation du virus des puits et ajoutez 2 ml de milieu de croissance. Empêchez les puits recouverts de virus de s’assècher.
- Plaquez les PBMC stimulés.
- Vérifiez les cellules à l’aide d’un microscope inversé. Les cellules doivent avoir l’air saines, ce qui signifie qu’elles sont rondes, lumineuses et réfractées. Ils doivent également montrer une apparence agglomérée indiquant la stimulation.
- Recueillir les cellules cibles et les transférer dans un tube conique de 50 ml. Rincer le puits une fois avec un support de croissance de 1 ml et ajouter au tube conique. Comptez le nombre de cellules vivantes avec le compteur cellulaire automatisé comme dans l’étape 5.4.
REMARQUE : Les cellules stimulées seront agglomérées et cet agglutination peut entraîner des difficultés à compter avec précision les cellules. - Pelleter les cellules dans les tubes en centrifugeant à 600 x g pendant 5 minutes à 32 oC. Aspirer le milieu de la pastille cellulaire et réanimer les cellules dans le milieu de croissance à une concentration de 1,5 x 106 cellules/mL.
- Pour chaque virus bien enduit (préparé dans l’étape 7.1) ajouter 1 mL de suspension cellulaire pour un total de 1,5 x 106 cellules/3 mL. Notez que chaque puits contient déjà un milieu de croissance de 2 ml. Effectuez les mêmes étapes pour les cellules transduites simulées, mais plaquez-les sur des puits recouverts de fibronectine qui n’ont reçu aucun virus.
- Centrifuge les plaques à 1000 x g pendant 10 min à 32 oC.
- Incuber les plaques pour 48 h à 37 oC sous 5% de CO2.
8. Expansion des cellules transduites
- Dessiner le contenu des puits de haut en bas avec un tuyau de 5 ml afin de réanimer les cellules, puis transférer à un tube conique de 50 ml.
- Ajoutez 1 ml de support de croissance à chaque puits et établiez de haut en bas avec une pipet de transfert stérile pour enlever les cellules adhérentes.
- Comptez les cellules pour déterminer le nombre total de cellules et la viabilité à l’aide d’un compteur cellulaire automatisé comme à l’étape 5.4.
- Si désiré, retirez 1 x 106 cellules pour la cytométrie des flux afin d’évaluer l’expression et le phénotype des gènes. Voir l’étape 9.5.1 et la Table des Matériaux pour les anticorps recommandés et la stratégie de gating.
- Centrifuge les cellules à 600 x g pendant 10 min à 25 oC.
- Aspirer le support et réanimer les cellules dans les supports d’expansion à une concentration de 1 x 106 cellules/mL. Ensemencer chaque puits perméable au gaz d’une plaque de 6 puits avec 5 ml de cellules. Couchez soigneusement 25 ml supplémentaires de supports d’expansion par puits.
REMARQUE : Nous ajoutons les cellules dans un petit volume, puis superposons les supports restants afin que les cellules restent au fond du puits. - Incuber les cellules intactes à 37 oC dans l’incubateur de CO2 à 5% pendant 4 jours.
9. Collecte de cellules élargies et évaluation du phénotype de la population cellulaire transduite
- Recueillir les cellules des puits perméables de gaz en enlevant et en jetant le support de 20 ml. Il faut faire preuve de prudence pour éviter de déranger les cellules.
REMARQUE : Nous élargissons les cellules pendant seulement 4 jours et recueillons les cellules à ce stade. Cependant, si des jours supplémentaires de culture sont souhaités, retirez 20 ml de supports sans déranger les cellules et remplacez-les par 20 ml de nouveaux supports d’expansion. - Pipet les médias restants de haut en bas pour déloger les cellules. Les médias devraient être très nuageux si les cellules se sont bien développées.
- À l’aide d’un tuyau de transfert stérile, rincez-les avec un support de 3 ml pour recueillir les cellules résiduelles.
- Comptez les cellules avec le compteur automatisé ou un hémocytomètre pour vérifier la viabilité et le numéro de cellule.
- Effectuez la cytométrie d’écoulement pour déterminer l’expression transductée de gène et le phénotype de cellules.
- Dans cet exemple, déterminer le phénotype macaque PBMC rhésus à l’aide d’anticorps dirigés contre CD4 (M-T477), un clone réactif à la fois avec le rhCD4 endogène et le rhCD4-MBL CAR; contre cd3 (SP34-2) et CD8 (RPA-T8) qui colorent respectivement les lymphocytes T totaux et les lymphocytes T CD8; contre le récepteur de la mort CD95 (DX2) et la molécule co-stimulante CD28 (CD28.2) qui sont utilisées pour déterminer le phénotype de la mémoire des cellules; et contre CXCR5 (MU5UBEE) et MBL (3E7) pour détecter le CXCR5 et le CD4-MBL CAR sur les cellules transduites.
- L’évaluation de la viabilité a été évaluée avec un colorant de viabilité fixable.
- Préparer les cellules à la cytométrie des débits.
- Maquillez un mélange de maître d’anticorps pour le nombre total de tubes. Apportez jusqu’au volume total à l’aide de PBS.
- Ajouter les cellules aux tubes d’écoulement. Placer 0,5 à 1 x 106 cellules par tube. Inclure des contrôles négatifs tels que les cellules non contaminées ainsi que les cellules transductées simulées tachées.
- Ajouter 2 ml de PBS aux cellules, centrifugeuse à 400 x g pendant 5 minutes à température ambiante (RT) et décanter.
- Ajouter 100 L de mélange d’anticorps dans les tubes et incuber pendant 30 minutes à RT.
- Ajouter 2 ml de PBS, centrifugeuse à 400 x g pendant 5 minutes à RT et décanter.
- Ajouter 300 L de paraformaldéhyde de 1 % et incuber pendant 15 min.
- Centrifugeuse à 400 x g pour 5 min à RT et décanter. Ajouter 300 L de PBS et mélanger.
- Sur un cytomètre de débit, acquérir 150 000 événements pour chaque échantillon.
- Analyser les données avec un logiciel d’analyse de flux.
REMARQUE : La stratégie de gating a été précédemment publiée20.- Pour l’identification des cellules transduites, des cellules porteuses sur des lymphocytes, des singlets, des vivants, des CD3 et des MBL-CXCR5MD.
- Pour l’identification de la population de mémoire centrale, cellules porteuses sur lymphocytes, singlets, CD3 en direct, CD8MD, CD28MD CD95MD.
- Utilisez des cellules au besoin. Les cellules peuvent être utilisées pour des essais in vitro de fonction, tels qu’un essai de migration transwell9 ou des essais in vitro de tuant des cellules5,9. Les cellules peuvent être utilisées pour l’infusion chez les animaux. Alternativement, congeler les cellules restantes dans 90% FBS avec 10% de sulfoxide de diméthyle (DMSO) pour une utilisation ou une analyse ultérieure
REMARQUE : Bien qu’une dose cible pour l’infusion de cellules transférées d’adoption dans un macaque rhésus n’est pas encore établie, les études de transfert adoptif publiées chez les primates non humains ont utilisé 0,6 à 1,2 x 107 cellules/kg21, 1 à 5 x 108 cellules/kg22 et 1,4 à 8 x 108 cellules/kg10. Avec cette plage comme ligne directrice, suffisamment de cellules pour l’infusion peuvent être produites avec ce protocole de 9 jours.
Résultats
Production cellulaire
Les résultats présentés dans cette publication sont similaires à ceux de notre ouvrage publié précédemment9,20. En utilisant le protocole présenté ici, nous nous attendons à au moins une expansion de 8 fois des cellules entre les jours 5 et 9 (médiane 11,1 pli, gamme 8,7-13 pli). Les puits perméables de gaz ont été ensemencés à une densité de départ de 5 x 106 cellules et après 4 jours de croissance, nous avons atteint une densité médiane de 55,6 x 106 cellules par puits (gamme 43,5-64,8 x 106) (figure 1A). Le comptage cellulaire avec l’exclusion trypan Blue montre que les cellules maintiennent une viabilité élevée tout au long du protocole (jour 9 médiane 85,8%, gamme 83-95%) (Figure 1B). Nous trouvons la variabilité animale à animale dans la capacité des cellules à se développer; cependant, avec une population de départ de 50-100 x 106 cellules le jour 1, nous avons employé ce protocole pour produire assez de cellules pour l’infusion de macaque de rhésus de 1-2 x 108 cellules/kg.
La co-expression des gènes transduits a été surveillée avec la cytométrie du débit(figure 2A). L’expression du RAC et du CXCR5 à la surface des cellules transduites était relativement stable entre les jours 5 et 9 de ce protocole d’expansion. Le jour 5, une médiane de 42,8 % (gamme 36,5 à 46,9 %) des cellules ont été transduites avec CD4-MBL CAR et CXCR5 tandis que le jour 9, l’expression médiane était de 47,6 % (gamme 44,5-64,5 %) avec un seul tour de transduction(figure 2B). Bien que certains protocoles exigent une deuxième série de transduction, nous n’avons pas vu un avantage en termes de cellules transduites totales à la fin du protocole (données non montrées).
Phénotype cellulaire
Les cellules transduites ont été analysées par cytométrie de flux pour surveiller leur phénotype de mémoire. Avant la transduction et l’expansion, les populations naïves, de mémoire centrale et de mémoire d’effecteur sont identifiées (données non montrées), mais la population naïve est perdue avec la culture et les cellules sont principalement des cellules de mémoire centrale au jour 5(figure 3A) et le jour 9(figure 3B) tel qu’identifié par CD95- CD28- expression. L’utilisation de ce protocole de transduction et d’expansion rapide a produit des cellules qui sont principalement des cellules de mémoire centrale et seront donc plus susceptibles de proliférer et de persister lorsqu’elles sont infusées dans un animal d’essai.
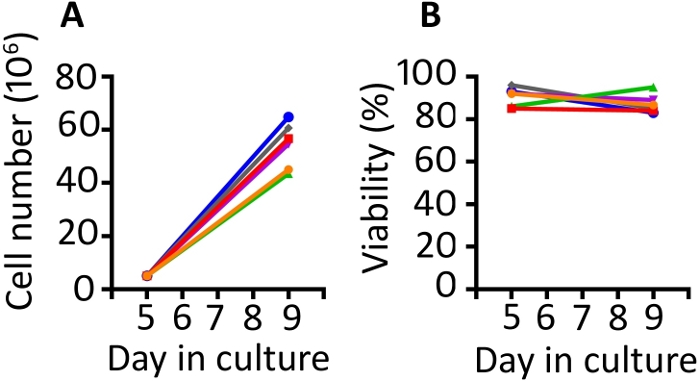
Figure 1 : Le protocole de transduction et d’expansion produit des cellules transduites abondantes qui sont très viables. (A) Expansion des cellules transduites de 6 animaux différents des jours 5 à 9 dans les récipients perméables de gaz et (B) viabilité du PBMC transduit des mêmes 6 animaux. L’exclusion bleue de Trypan utilisant un compteur automatisé de cellules a été employée pour surveiller le nombre et la viabilité de cellules. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
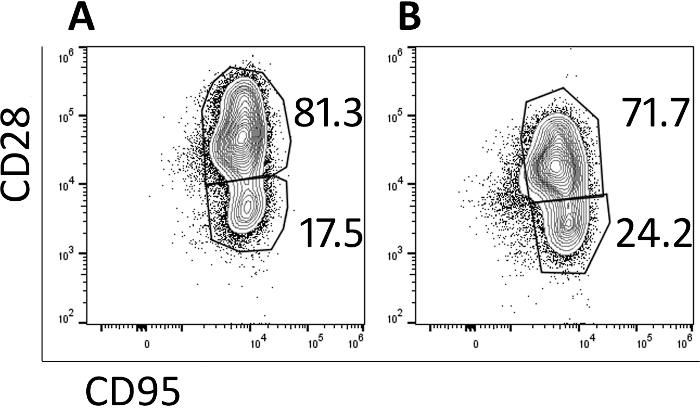
Figure 2 : Le protocole de transduction produit des cellules qui maintiennent la co-expression des deux gènes transduits. (A) Une parcelle de flux représentative de rhésus PBMC le jour 9 du protocole de transduction et d’expansion démontrant l’expression de la RCA CD4-MBL et du CXCR5. (B) Expression du CD4-MBL CAR et CXCR5 sur le rhésus transducteur PBMC de 6 animaux différents les jours 5 et 9 dans la culture mesurée par cytométrie d’écoulement. Des portes ont été placées en direct, CD3et cellules. Les cellules transduites sont identifiées comme MBLet CXCR5.+ S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
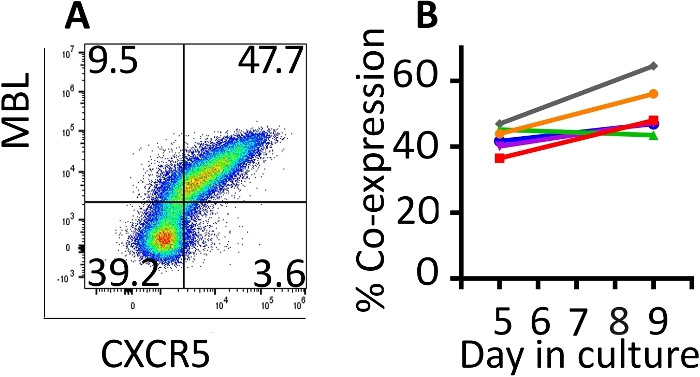
Figure 3 : La majorité des cellules produites dans le protocole de 9 jours ont un phénotype central de mémoire. Parcelles représentatives de cytométrie d’écoulement de (A) jour 5 et (B) jour 9 CAR/CXCR5-transduit rhesus PBMC. Des portes ont été mises en ligne, CD3,CD8et cellules. La mémoire centrale a été définie comme CD28' CD95'. La mémoire de l’effecteur a été définie comme CD28-, CD95. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Ce protocole décrit une stratégie de production d’immunothérapie à cellules T qui utilise un vecteur gammarétroviral pour transduire le macaque rhésus PBMC conduisant à la population de cellules T qui exprime un RCA antiviral ainsi que le récepteur folliculaire de homing, CXCR5. Avec un total de 8 jours de temps de culture ex vivo, viables, fonctionnelles cellules T CAR sont produites dans une quantité qui est dans la gamme publiée10,21,22 utilisés pour l’infusion dans les primates non humains pour le test d’efficacité préclinique.
Le succès du protocole de transduction repose à la fois sur des PBMC sains et stimulés et sur des préparations de qualité du gammarétrovirus. Afin d’obtenir une stimulation et une transduction réussies, il est essentiel que des précautions appropriées soient prises dans le gel et le transport des PBMC après la collecte. Idéalement, si les cellules sont recueillies à l’arrêt du site, elles sont expédiées dans de l’azote liquide et rapidement placées dans un stockage d’azote liquide à long terme. Les PBMC doivent être mis en œuvre par des agents mitotically afin d’être transduire avec succès par un gammarétrovirus. Il faut surveiller visuellement le regroupement des cellules après stimulation avec l’anti-CD3/anti-CD28. Un défaut d’activation correctement entraînera une faible efficacité de la transduction. Il est également important de surveiller la viabilité des cellules stimulées. Une faible viabilité après l’étape de stimulation conduit habituellement à une transduction moins réussie. Que les préparations de virus soient produites en laboratoire ou externalisées, elles doivent être stockées à -80 oC dans des aliquots à usage unique afin d’éviter les cycles de gel du dégel qui peuvent endommager le virus et nuire à l’efficacité de la transduction. Le virus doit être titered de sorte que des quantités cohérentes de virus peuvent être utilisés dans chaque expérience. Lors de l’utilisation du virus pour la transduction, décongeler le virus rapidement et se stocker sur la glace jusqu’à ce que nécessaire. Le choix des protéines de promoteur, d’exhausteur et d’enveloppe peut tous avoir un impact sur l’efficacité de transduction et l’expression du transgène dans les cellules cibles. Ainsi, un MOI doit être déterminé empiriquement. En outre, l’utilisation d’un support conçu pour soutenir les lymphocytes T et les plaques avec des puits perméables de gaz pour l’expansion ont conduit à une excellente expansion des cellules transduites. Cependant, il y a la variabilité animale à animale dans le taux d’expansion cellulaire. Nous recommandons une étude d’essai pour déterminer la capacité d’une préparation cellulaire particulière à être transductée et élargie. Les niveaux d’expansion sont constants dans les transductions à petite et à grande échelle.
Avec l’utilisation de ce protocole, nous avons produit jusqu’à 2,5 x 109 cellules pour l’infusion dans les animaux d’essai. Bien que nous ayons trouvé inutile d’étendre le protocole à l’heure actuelle, l’utilisation de 6 plaques de puits est une limitation à la préparation cellulaire à grande échelle et le protocole nécessiterait une modification pour produire un plus grand nombre de cellules. Parmi les exemples de modifications potentielles, mentionnons l’exécution de la transduction dans un sac de culture recouvert de fibronectine afin d’augmenter le nombre de cellules transduites et d’utiliser un plus grand récipient de culture perméable pour le gaz pour l’étape d’expansion. Bien que nous n’ayons pas encore apporté ces modifications, elles utilisent des produits disponibles dans le commerce et sont des modifications réalisables au protocole actuel.
À l’aide de cette méthode, nous avons produit des cellules transduites de PBMC isolées d’animaux non infectés, d’animaux infectés par le SIV et d’animaux infectés par le SIV traités par un traitement antirétroviral (TAR). Cependant, nous avons noté une réduction de l’efficacité de transduction dans les cellules traitées par art de la multithérapie20. Cette réduction est probablement due à l’inhibition de la transcriptase inverse et / ou l’integrase par les médicaments. Les transductions de cellules d’animaux traités par ART nécessiteront des modifications à ce protocole, comme la réduction des niveaux intracellulaires des médicaments antirétroviraux en arrêtant la multithérapie pendant plusieurs jours avant la collecte du PBMC ou par l’utilisation d’un vecteur alternatif qui n’est pas affecté par les médicaments antirétroviraux couramment utilisés.
Il est important que les cellules produites pour l’immunothérapie soient d’un phénotype peu différencié afin qu’elles persistent après l’infusion12. Bien que de nombreux protocoles pour le transfert adoptif des cellules nécessitent de longs temps de culture, un temps de culture ex vivo réduit a été corrélé avec à la fois une réduction de la différenciation et une amélioration de la fonction de cellules TDE 13. Le délai relativement rapide de ce protocole de transduction et d’expansion permet le maintien du phénotype de mémoire centrale souhaité tout en produisant suffisamment de cellules pour tester leur potentiel immunothérapeutique20.
L’objectif de la stratégie de production de ce produit d’immunothérapie à cellules T est de fabriquer des lymphocytes T qui reconnaîtront les cellules infectées par le SIV, qui se répercuteront vers le site de réplication virale dans le follicule cellulaire B et qui persisteront chez l’animal, ce qui entraînera un long terme traitement fonctionnel sans avoir besoin de médicaments antirétroviraux. Pour la traduction vers un produit d’immunothérapie humaine, ce protocole peut être modifié pour transduire les lymphocytes T humains grâce à l’utilisation d’anticorps et de cytokines spécifiques à l’homme et à la mise en œuvre de normes GMP dans le but ultime de produire un traitement fonctionnel pour Vih.
Déclarations de divulgation
La Dre Pamela Skinner est cofondatrice et directrice scientifique de MarPam Pharma.
Remerciements
Cette étude a été soutenue par les subventions des NIH 5R01AI0969666-06S1 (PS, EC et EB), 1UM1AI26617 (PS, EC et EB), P51OD011106/P51RR000167 (ER), MN REACH grant 5U01HL127479-03 (PS), 1R01A143380-01 (PS et EB), 1UM14126617 (PS et EC) ainsi que les fonds fournis par la Division niSAID de la recherche intra-muros et le Programme antiviral ciblé sur le sida intra-muros des NIH. Anti-CD3 et anti-CD28 utilisés dans ces études a été fourni par le NIH Nonhuman Primate Reagent Resource (R24 OD010976, U24 AI126683). L’IL-2 utilisé dans ces études a été fourni par le dépôt préclinique NCI. Nous remercions nos collaborateurs dans ce projet CD4-MBL CAR/CXCR5, la Dre Elizabeth Connick à l’Université de l’Arizona, le Dr Edward A Berger au NIAID, les NIH, la Dre Eva G Rakasz au Wisconsin National Primate Research Center et le Dr Geoff Hart et Mme Preethi Haran à l’Université du Minnesota, le Dr Leslie Kean à la Harvard Medical School et la Dre Catherine Bollard à l’Institut de recherche pour enfants. Nous remercions également le Dr Scott McIvor de l’Université du Minnesota, le Dr Christopher Peterson au Fred Hutchinson Cancer Center, le Dr Matthew Trivett aux NIH, le Dr Agne Taraseviciute à l’Hôpital pour enfants de Seattle et le Dr Conrad Russell Cruz du Children’s Research Institute pour leur aide très utile pour optimiser ce protocole. Nous remercions également Mme Chi Phan et Mme Jhomary Alegria-Berrocal de l’Université du Minnesota pour la production gammarétrovirale, et Mme Kim Weisgrau, de l’Université du Wisconsin-Madison, pour l’isolement du macaque rhésus PBMC.
matériels
| Name | Company | Catalog Number | Comments |
| Gammaretrovirus preparation | |||
| 0.025% Trypsin, 0.01% EDTA | Gibco | R-001-100 | |
| 293T cells | ATCC | CRL-3216 | |
| 6 well plates, treated | CytoOne | CC7682-7506 | |
| DMEM | Gibco | 10569-010 | |
| Heat-inactivated FBS | Hyclone | Sh30088.03 | |
| Lipofectamine | Invitrogen | 11668019 | transfection reagent |
| Opti-Mem | Invitrogen | 31985070 | reduced serum media |
| pBS-CMV-gagpol | Addgene | 35614 | A gift from Dr. Patrick Salmon |
| pMSGV1 containing CAR P2A CXCR5 | custom order from GenScript | ||
| RD114 | A gift from Dr. Ed Berger | ||
| T75 flasks | CytoOne | CC7682-4875 | |
| VSV-G | pMD.G | A gift from Dr. Scott McIvor | |
| T cell stimulation | |||
| 6 well plates, untreated | CytoOne | CC7672-7506 | |
| Anti-CD28 | NHP Reagent Resource | Clone: CD28.2 | |
| Anti-macaque CD3 | NHP Reagent Resource | Clone: FN18 | |
| Phosphate buffered saline | Gibco | 14190-144 | |
| Rhesus macaque PBMC or CD8 T cells | WNPRC | Primary cells | |
| For Fibronectin coating | |||
| 6 well plates, untreated | CytoOne | CC7672-7506 | |
| BSA (Fraction V) | HyClone | SH 30574.02 | |
| RetroNectin (1 mg/ml) | TaKaRa | T100A | |
| For T cell Expansion | |||
| G-Rex 6 Well Plate | Wilson Wolf | P/N 80240M | Plates with gas permeable wells |
| Media Components | |||
| b mercaptoethanol | Gibco | 21985-023 | |
| Heat-inactivated FBS | Hyclone | Sh30088.03 | |
| IL-2 | NCI Preclinical Repository | ||
| Penicillin/Streptomycin/Glutamine | Gibco | 10378-016 | |
| X-Vivo-15 medium | Lonza | 04-418Q | |
| Variations of Media used | |||
| Basic medium: | X-Vivo 15 medium, 10% heat-inactivated FBS, 1 x Penicillin/Streptomycin/L-Glutamine | ||
| Expansion medium: | Growth medium + 50 mM b mercaptoethanol | ||
| Growth medium: | Basic medium + 50 IU/ml IL-2 | Completion of media by addition of anti-CD28, IL-2 or b-mercaptoethanol should occur on the day of use. | |
| Cell counting | |||
| Countess cell counting chambers | Invitrogen | AMQAF1000 | |
| Countess II FL Automated Cell Counter | Invitrogen | T10282 | |
| Trypan blue, 0.4% solution | Invitrogen | T10282 | |
| Flow Cytometry | |||
| Alexa Fluor 647 Antibody Labeling Kit | Invitrogen | A20186 | for conjugation of MBL antibody |
| anti-CD28-BV605 | BD Biosciences | 562976 | |
| anti-CD3-AF700 | BD Biosciences | 557917 | |
| anti-CD4-FITC | BD Biosciences | 556615 | |
| anti-CD8-BV788 | BD Biosciences | 563824 | |
| anti-CD95-PerCP Cy5.5 | BD Biosciences | 561655 | |
| anti-CXCR5-PE | eBioscience | 12-1985-42 | |
| anti-MBL | Invitrogen | MA1-40145-S6 | |
| Flow Analysis software | FlowJo, LLC | FlowJo v10 | |
| Flow Cytometer | Beckman | CytoFlex | |
| Live/Dead Near IR | Invitrogen | L10119 | |
| Other equipment | |||
| Aerosolve canisters to contain aerosol leakage | Beckman | SX4750 | Safety equipment |
| Beckman Allegra Centrifuge | Beckman | Sterilgard e3 | |
| Cell culture incubator | Thermo Fisher | Everlast 247 | |
| Class II Laminar flow hood | Baker | Heracell Vios 160i | |
| Extra-Safe Disposable lab coat | Fisher Scientific | 359232 | Personal protective equipment |
| Microplate carriers with biocertified covers | Beckman | SX4750A | Safety equipment |
| Rocking platform | Benchmark | C10228 | |
| Swinging bucket rotor | Beckman | X13-R | |
| X-Gen Nitrile gloves | Genesee | Personal protective equipment |
Références
- Klebanoff, C. A., Rosenberg, S. A., Restifo, N. P. Prospects for gene-engineered T cell immunotherapy for solid cancers. Nature Medicine. 22 (1), 26-36 (2016).
- Lim, W. A., June, C. H. The Principles of Engineering Immune Cells to Treat Cancer. Cell. 168 (4), 724-740 (2017).
- Sadelain, M., Rivière, I., Riddell, S. Therapeutic T cell engineering. Nature. 545 (7655), 423-431 (2017).
- Kuhlmann, A., Peterson, C. W. Chimeric antigen receptor T-cell approaches to HIV cure. Current Opinion in HIV and AIDS. 13 (5), 446-453 (2018).
- Ghanem, M. H., Bolivar-Wagers, S., et al. Bispecific chimeric antigen receptors targeting the CD4 binding site and high-mannose Glycans of gp120 optimized for anti-human immunodeficiency virus potency and breadth with minimal immunogenicity. Cytotherapy. 20, 407-419 (2018).
- Folkvord, J. M., Armon, C., Connick, E. Lymphoid Follicles Are Sites of Heightened Human Immunodeficiency Virus Type 1 (HIV-1) Replication and Reduced Antiretroviral Effector Mechanisms. AIDS Research and Human Retroviruses. , (2005).
- Connick, E., Mattila, T., et al. CTL Fail to Accumulate at Sites of HIV-1 Replication in Lymphoid Tissue. The Journal of Immunology. 178 (11), 6975-6983 (2007).
- Connick, E., Folkvord, J. M., et al. Compartmentalization of Simian Immunodeficiency Virus Replication within Secondary Lymphoid Tissues of Rhesus Macaques Is Linked to Disease Stage and Inversely Related to Localization of Virus-Specific CTL. The Journal of Immunology. 193 (11), 5613-5625 (2014).
- Haran, K. P., Hajduczki, A., et al. Simian immunodeficiency virus (SIV)-specific chimeric antigen receptor-T cells engineered to target B cell follicles and suppress SIV replication. Frontiers in Immunology. 9 (MAR), 1-12 (2018).
- Ayala, V. I., Deleage, C., et al. CXCR5-Dependent Entry of CD8 T Cells into Rhesus Macaque B-Cell Follicles Achieved through T-Cell Engineering. Journal of Virology. 91 (11), e02507-e02516 (2017).
- Redeker, A., Arens, R. Improving adoptive T cell therapy: The particular role of T cell costimulation, cytokines, and post-transfer vaccination. Frontiers in Immunology. 7 (SEP), 1-17 (2016).
- Klebanoff, C. A., Gattinoni, L., Restifo, N. P. Sorting Through Subsets. Journal of Immunotherapy. 35 (9), 651-660 (2012).
- Ghassemi, S., Nunez-Cruz, S., et al. Reducing Ex Vivo Culture Improves the Antileukemic Activity of Chimeric Antigen Receptor (CAR) T Cells. Cancer Immunology Research. 6 (9), 1100-1109 (2018).
- Minang, J. T., Trivett, M. T., Bolton, D. L., Trubey, C. M., Estes, J. D., Li, Y., et al. Efficacy of Adoptively Transferred Central and Effector Memory-Derived Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones in Rhesus Macaques during Acute Infection. The Journal of Immunology. 184 (1), 315-326 (2010).
- Bolton, D. L., Minang, J. T., et al. Trafficking, persistence, and activation state of adoptively transferred allogeneic and autologous Simian Immunodeficiency Virus-specific CD8(+) T cell clones during acute and chronic infection of rhesus macaques. Journal of immunology (Baltimore, Md. : 1950). 184 (1), 303-314 (2010).
- Patel, S., Jones, R. B., Nixon, D. F., Bollard, C. M. T-cell therapies for HIV : Preclinical successes and current clinical strategies. Cytotherapy. 18 (8), 931-942 (2019).
- Chambers, C. A., Allison, J. P. Costimulatory regulation of T cell function. Current Opinion in Cell Biology. 11 (2), 203-210 (1999).
- Schwartz, R. H. A cell culture model for T lymphocyte clonal anergy. Science. 248 (4961), 1349-1356 (1990).
- Bajgain, P., Mucharla, R., et al. Optimizing the production of suspension cells using the G-Rex M series. Molecular Therapy - Methods and Clinical Development. 1, 14015(2014).
- Pampusch, M. S., Haran, K. P., et al. Rapid transduction and expansion of transduced T cells with maintenance of central memory populations. Molecular Therapy - Methods and Clinical Development. 16, 1-10 (2019).
- Taraseviciute, A., Tkachev, V., et al. Chimeric antigen receptor T cell-mediated neurotoxicity in nonhuman primates. Cancer Discovery. 8 (6), 750-763 (2018).
- Berger, C., Sommermeyer, D., et al. Safety of targeting ROR1 in primates with chimeric antigen receptor-modified T cells. Cancer Immunology Research. 3 (2), 206-216 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon