Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Chromatographie d’exclusion de taille pour analyser l’hétérogénéité des vésicules de la membrane externe bactérienne
Dans cet article
Résumé
Les vésicules bactériennes jouent un rôle important dans la pathogenèse et ont des applications biotechnologiques prometteuses. L’hétérogénéité des vésicules complique l’analyse et l’utilisation; par conséquent, une méthode simple et reproductible pour séparer les différentes tailles de vésicules est nécessaire. Ici, nous démontrons l’utilisation de la chromatographie d’exclusion de taille pour séparer les vésicules hétérogènes produites par Aggregatibacter actinomycetemcomitans.
Résumé
La paroi cellulaire des bactéries à Gram négatif est constituée d’une membrane interne (cytoplasmique) et externe (OM), séparées par une fine couche de peptidoglycane. Tout au long de la croissance, la membrane externe peut saigner pour former des vésicules sphériques de la membrane externe (OMV). Ces OMV sont impliqués dans de nombreuses fonctions cellulaires, y compris la livraison de fret aux cellules hôtes et la communication avec les cellules bactériennes. Récemment, le potentiel thérapeutique des OMV a commencé à être exploré, y compris leur utilisation comme vaccins et véhicules d’administration de médicaments. Bien que les OMV soient dérivés de l’OM, on apprécie depuis longtemps que la cargaison de lipides et de protéines de l’OMV diffère, souvent de manière significative, de celle de l’OM. Plus récemment, des preuves que les bactéries peuvent libérer plusieurs types d’OMV ont été découvertes, et il existe des preuves que la taille peut avoir un impact sur le mécanisme de leur absorption par les cellules hôtes. Cependant, les études dans ce domaine sont limitées par les difficultés à séparer efficacement les OMV de taille hétérogène. La centrifugation par gradient de densité (DGC) a traditionnellement été utilisée à cette fin; cependant, cette technique prend beaucoup de temps et est difficile à mettre à l’échelle. La chromatographie d’exclusion de taille (SEC), en revanche, est moins lourde et se prête à la mise à l’échelle future nécessaire pour l’utilisation thérapeutique des OMV. Ici, nous décrivons une approche SEC qui permet une séparation reproductible de vésicules de taille hétérogène, en utilisant comme cas de test, les OMV produits par Aggregatibacter actinomycetemcomitans, dont le diamètre varie de moins de 150 nm à plus de 350 nm. Nous démontrons la séparation des OMV « grands » (350 nm) et des OMV « petits » (<150 nm), vérifiée par diffusion dynamique de la lumière (DLS). Nous recommandons les techniques basées sur la SEC plutôt que les techniques basées sur la DGC pour la séparation des vésicules de taille hétérogène en raison de sa facilité d’utilisation, de sa reproductibilité (y compris d’utilisateur à utilisateur) et de sa possibilité de mise à l’échelle.
Introduction
Les bactéries à Gram négatif libèrent des vésicules dérivées de leur membrane externe, appelées vésicules de la membrane externe (OMV), tout au long de la croissance. Ces OMV jouent un rôle important dans la communication de cellule à cellule, à la fois entre les bactéries et l’hôte ainsi qu’entre les cellules bactériennes, en transportant un certain nombre de biomolécules importantes, y compris l’ADN / ARN, les protéines, les lipides et les peptidoglycanes1,2. En particulier, le rôle des OMV dans la pathogenèse bactérienne a été largement étudié en raison de leur enrichissement en certains facteurs de virulence et toxines3,4,5,6,7,8,9,10,11.
Il a été rapporté que la taille des OMV varie de 20 à 450 nm, selon les bactéries mères et le stade de croissance, plusieurs types de bactéries libérant des OMV de taille hétérogène8, 12,13,14, qui diffèrent également par leur composition protéique et leur mécanisme d’entrée dans la cellule hôte12. H. pylori a libéré des OMV d’un diamètre allant de 20 à 450 nm, les OMV plus petits contenant une composition protéique plus homogène que les OMV plus grands. Fait important, les deux populations d’OMV ont été observées comme faisant l’objet d’une internalisation par les cellules hôtes via différents mécanismes12. En outre, nous avons démontré qu’Aggregatibacter actinomycetemcomitans libère une population de petits OMV (<150 nm) ainsi qu’une population de grands OMV (>350 nm), les OMV contenant une quantité importante d’une toxine protéique sécrétée, la leucotoxine (LtxA)15. Bien que le rôle de l’hétérogénéité OMV dans les processus cellulaires soit clairement important, les difficultés techniques dans la séparation et l’analyse de populations distinctes de vésicules ont limité ces études.
En plus de leur importance dans la pathogenèse bactérienne, les OMV ont été proposés pour une utilisation dans un certain nombre d’applications biotechnologiques, y compris comme vaccins et véhicules d’administration de médicaments16,17,18,19,20. Pour leur utilisation translationnelle dans de telles approches, une préparation propre et monodispersée de vésicules est nécessaire. Ainsi, des méthodes de séparation efficaces et efficientes sont nécessaires.
Le plus souvent, la centrifugation par gradient de densité (DGC) est utilisée pour séparer les populations de vésicules de taille hétérogène des débris cellulaires, y compris les flagelles et les protéines sécrétées21; la méthode a également été rapportée comme une approche pour séparer les sous-populations OMV de taille hétérogène12,13,14. Cependant, DGC prend du temps, est inefficace et très variable d’utilisateur à utilisateur22 et n’est donc pas idéal pour la mise à l’échelle. En revanche, la chromatographie d’exclusion de taille (SEC) représente une approche évolutive, efficace et cohérente pour purifier les OMV21,23,24. Nous avons constaté qu’une longue colonne SEC à flux gravitaire de 50 cm, remplie de milieu de filtration sur gel, est suffisante pour purifier et séparer efficacement les sous-populations d’OMV. Plus précisément, nous avons utilisé cette approche pour séparer les OMV d’A. actinomycetemcomitans en « grandes » et « petites » sous-populations, ainsi que pour éliminer la contamination des protéines et de l’ADN. La purification a été achevée en moins de 4 h, et la séparation complète des sous-populations OMV et l’enlèvement des débris ont été réalisés.
Protocole
1. Préparation des tampons
- Pour préparer le tampon de lavage ELISA, ajouter 3,94 g de Tris-base, 8,77 g de NaCl et 1 g d’albumine sérique bovine (BSA) à 1 L d’eau désionisée (DI). Ajouter 500 μL de polysorbate-20. Ajustez le pH à 7,2 en utilisant HCl ou NaOH.
- Pour préparer le tampon bloquant, ajoutez 3,94 g de Tris-base, 8,77 g de NaCl et 10 g de BSA. Ajouter 500 μL de polysorbate-20 à 1 L d’eau DI. Ajustez le pH à 7,2 en utilisant HCl ou NaOH.
- Pour préparer le tampon d’élution (PBS), ajouter 8,01 g de NaCl, 2,7 g de KCl, 1,42 g de Na2HPO4et 0,24 g de KH2PO4 à 1 L d’eau DI. Ajustez le pH à 7,4 en utilisant HCl ou NaOH.
REMARQUE: Une solution 10x de ce tampon peut être faite et diluée avec de l’eau DI au besoin.
2. Préparation de l’échantillon OMV
- Cultiver les cellules d’A. actinomycetemcomitans jusqu’à la phase exponentielle tardive (densité optique à 600 nm de 0,7). Abreuler les cellules en les centrifugant deux fois à 10 000 x g à 4 °C pendant 10 min. Filtrer le surnageant à travers un filtre de 0,45 μm.
- Concentrez le surnageant sans bactéries à l’aide de filtres de coupure de poids moléculaire de 50 kDa. Ultracentrifugez la solution concentrée à 105 000 x g à 4 °C pendant 30 min.
- Remettre la pastille en PBS et en ultracentrifugeuse (105 000 x g à 4 °C pendant 30 min.) Resuspendez la pastille dans 2 mL de PBS.
3. Emballage de la colonne S-1000
- Mélanger le flacon type de produit de filtration de gel avec une tige d’agitation en verre et verser dans une bouteille en verre le volume nécessaire pour remplir la colonne, plus environ 50% d’excès (environ 135 mL). Laissez ces perles reposer jusqu’à ce qu’elles se soient déposées, puis décantez l’excès de liquide. Resuspendez les billes dans un tampon d’élution, de sorte que la solution finale soit d’environ 70% (en volume) de gel, 30% de tampon. Dégazez la solution sous vide.
- Montez la colonne de verre verticalement à l’aide d’un support annulaire et remplissez-la de tampon d’élution pour mouiller les parois de la colonne. Égouttez le tampon jusqu’à ce qu’il ne reste qu’environ 1 cm de tampon dans la colonne.
- Sans créer de bulles, pipettez soigneusement les perles dans la colonne, en remplissant la colonne vers le haut. Continuez à drainer l’excès de tampon tout au long de ce processus. Assurez-vous de ne pas laisser les perles s’installer complètement avant d’ajouter des perles supplémentaires en haut de la colonne. La colonne doit être emballée à une hauteur d’environ 2 cm au-dessous du fond du réservoir de la colonne.
4. Chargement de l’échantillon et prélèvement des fractions
- Dégazez le tampon d’élution sous vide. Lavez la colonne avec deux volumes de colonne (180 mL) de tampon d’élution.
- Autorisez la mémoire tampon restante à entrer complètement dans la colonne. Une fois que le tampon a atteint le sommet de la couche de gel, pipeter soigneusement un échantillon de 2 mL contenant des OMV (à une concentration lipidique d’environ 100 - 200 nmol / L) sur la surface des perles, en prenant soin de ne pas perturber les perles en haut de la colonne. Laissez l’échantillon pénétrer complètement dans le gel, c’est-à-dire lorsqu’aucun liquide ne reste au-dessus de la couche de gel.
- Ajoutez soigneusement et lentement un tampon d’élution sur le dessus de la colonne de gel. Ne pas déranger la couche supérieure du gel, car cela entraînerait une dilution de l’échantillon.
- Placez un seul tube de 50 mL sous la colonne et ouvrez la colonne. Recueillir les 20 premiers mL de l’éluant. Ajoutez un tampon d’élution supplémentaire en haut de la colonne, soigneusement, au besoin, pour vous assurer que la colonne n’est jamais sèche.
- Placez une série de tubes de 1,5 mL sous la colonne. Démarrez la colonne et prélencez une série d’échantillons de 1 mL dans chaque tube. Au fur et à mesure que les échantillons sont collectés, continuez d’ajouter un tampon d’élution en haut de la colonne, au besoin. Répétez l’opération jusqu’à ce que 96 fractions aient été collectées. Arrêtez la colonne.
REMARQUE: Les échantillons doivent être conservés à -20 °C pour un stockage à long terme ou à 4 °C pour un stockage à court terme jusqu’à une analyse plus approfondie. - Pour nettoyer la colonne, exécutez un volume de colonne (90 mL) de 0,1 M NaOH à travers la colonne. Exécutez deux volumes de colonnes (180 mL) de tampon d’élution à travers la colonne.
5. Analyse de l’échantillon
- Pour mesurer la concentration de lipides dans chaque fraction, pipeter 50 μL de chaque fraction dans un seul puits d’une plaque de 96 puits. À chaque puits, ajoutez 2,5 μL de colorant lipophile. Incuber pendant 15 s. Mesurer l’intensité de fluorescence sur un lecteur de plaques avec une longueur d’onde d’excitation de 515 nm et une longueur d’onde d’émission de 640 nm. Pour calculer la fraction de tous les lipides dans chaque échantillon, additionnez toutes les intensités d’émission et divisez chaque intensité individuelle par le total.
- Pour mesurer la concentration d’une protéine particulière, pipeter 100 μL de chaque fraction dans un seul puits d’une plaque immuno-ELISA. Incuber à 25 °C pendant 3 h.
- Décantez les échantillons. Ajouter 200 μL de tampon de lavage ELISA à chaque puits et décant. Répétez quatre fois pour un total de cinq lavages.
- Ajouter 200 μL de tampon bloquant à chaque puits et incuber pendant 1 h à 25 °C. Décanter.
- Incuber des plaques avec un tampon bloquant de 100 μL plus un anticorps primaire (1:10 000 pour les anticorps purifiés; 1:10 pour les anticorps non purifiés) pendant la nuit à 4 °C. Décanter.
- Ajouter 200 μL de tampon de lavage ELISA à chaque puits et décant. Répétez quatre fois pour un total de cinq lavages.
- Ajouter 100 μL de tampon de lavage ELISA plus un anticorps secondaire (1:30 000) à chaque puits. Incuber pendant 1 h à 25 °C.
- Ajouter 200 μL de tampon de lavage ELISA à chaque puits et décant. Répétez quatre fois pour un total de cinq lavages.
- Ajouter 100 μL de la solution en une étape de 3,3',5,5'-tétraméthylbenzidine (TMB) et incuber pendant 15-30 min ou jusqu’à ce qu’une couleur bleue se développe. Arrêtez la réaction TMB avec 50 μL de la solution d’arrêt.
- Sur un lecteur de plaques, lisez l’absorbance de chaque puits à une longueur d’onde de 450 nm.
- Pour mesurer la concentration totale en protéines, enregistrez l’absorbance à une longueur d’onde de 280 nm (A280)de chaque fraction, à l’aide d’un spectrophotomètre UV-vis.
Un schéma du protocole est illustré à la figure 1.
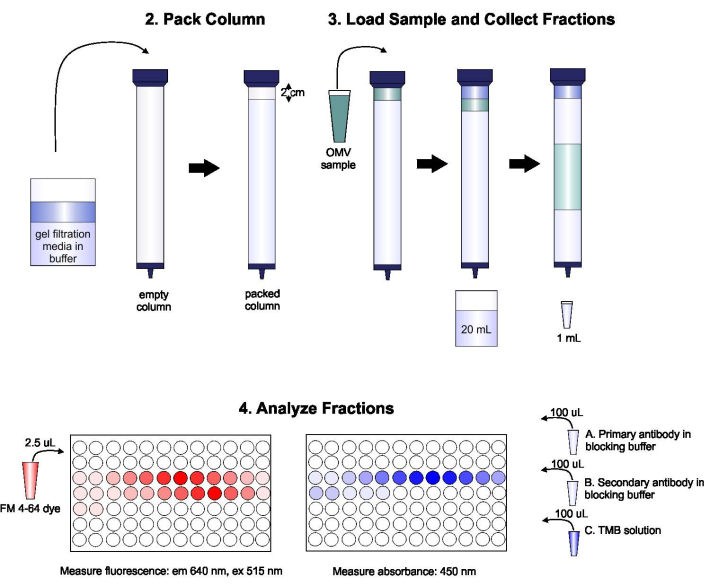
Figure 1: Schéma de la procédure SEC. La colonne est soigneusement emballée avec un milieu de filtration en gel dégazé pour éviter les bulles et les discontinuités, puis lavée avec deux volumes de colonne de tampon d’élution. Ensuite, l’échantillon est soigneusement pipeté sur le dessus du gel, sans perturber l’emballage du gel. La colonne est ouverte et exécutée jusqu’à ce que l’échantillon pénètre complètement dans le gel. À ce stade, un tampon est placé en haut de la colonne et les 20 premiers mL d’éluat sont collectés. Ensuite, une série de fractions de 1 mL est collectée. Ces fractions sont ensuite placées dans une plaque de 96 puits ou une plaque immuno de 96 puits pour l’analyse de la teneur en lipides et en protéines. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
La figure 2 montre les résultats représentatifs de cette méthode. Les OMV produits par la souche JP2 d’A. actinomycetemcomitans ont d’abord été purifiés à partir du surnageant de culture par ultracentrifugation15. Nous avons précédemment constaté que cette souche produit deux populations d’OMV, l’une avec des diamètres d’environ 300 nm et l’autre avec des diamètres d’environ 100 nm15. Pour séparer ces populat...
Discussion
Ici, nous avons fourni un protocole pour la séparation simple, rapide et reproductible des sous-populations bactériennes OMV. Bien que la technique soit relativement simple, certaines étapes doivent être effectuées avec beaucoup de soin pour s’assurer qu’une séparation efficace se produit dans la colonne. Tout d’abord, il est essentiel que le gel soit chargé dans la colonne avec soin et lentement pour éviter les bulles d’air. Nous avons observé que laisser le gel à température ambiante pendant plusieur...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à signaler.
Remerciements
Ce travail a été financé par la National Science Foundation (1554417) et les National Institutes of Health (DE027769).
matériels
| Name | Company | Catalog Number | Comments |
| 1-Step Ultra TMB-ELISA | Thermo Scientific | 34028 | |
| Amicon 50 kDa filters | Millipore Sigma | UFC905024 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9704-100 | |
| ELISA Immuno Plates | Thermo Scientific | 442404 | |
| FM 4-64 | Thermo Scientific | T13320 | 1.5 x 50 cm |
| Glass Econo-Column | BioRad | 7371552 | |
| Infinite 200 Pro Plate Reader | Tecan | ||
| Potassium Chloride (KCl) | Amresco (VWR) | 0395-500G | |
| Potassium Phosphate Monobasic Anhydrous (KH2PO4) | Amresco (VWR) | 0781-500G | |
| Sephacryl S-1000 Superfine | GE Healthcare | 17-0476-01 | |
| Sodium Chloride (NaCl) | Fisher Chemical | S271-3 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Amresco (VWR) | 0404-500G | |
| Tris Base | VWR | 0497-1KG | |
| Tween(R) 20 | Acros Organics | 23336-2500 |
Références
- Kuehn, M. J., Kesty, N. C. Bacterial outer membrane vesicles and the host-pathogen interaction. Genes and Development. 19, 2645-2655 (2005).
- Kulp, A., Kuehn, M. J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annual Reviews Microbiology. 64, 163-184 (2010).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Nice, J. B., et al. Aggregatibacter actinomycetemcomitans leukotoxin is delivered to host cells in an LFA-1-independent manner when associated with outer membrane vesicles. Toxins. 10 (10), 414 (2018).
- Haurat, M. F., et al. Selective sorting of cargo proteins into bacterial membrane vesicles. Journal of Biological Chemistry. 286 (2), 1269-1276 (2011).
- Horstman, A. L., Kuehn, M. J. Enterotoxigenic Escherichia coli secretes active heat-labile enterotoxin via outer membrane vesicles. The Journal of Biological Chemistry. 275 (17), 12489-12496 (2000).
- Wai, S. N., et al. Vesicle-mediated export and assembly of pore-forming oligomers of the Enterobacterial ClyA cytotoxin. Cell. 115, 25-35 (2003).
- Balsalobre, C., et al. Release of the Type I secreted α-haemolysin via outer membrane vesicles from Escherichia coli. Molecular Microbiology. 59 (1), 99-112 (2006).
- Donato, G. M., et al. Delivery of Bordetella pertussis adenylate cyclase toxin to target cells via outer membrane vesicles. FEBS Letters. 586, 459-465 (2012).
- Kim, Y. R., et al. Outer membrane vesicles of Vibrio vulnificus deliver cytolysin-hemolysin VvhA into epithelial cells to induce cytotoxicity. Biochemical and Biophysical Research Communications. 399, 607-612 (2010).
- Maldonado, R., Wei, R., Kachlany, S. C., Kazi, M., Balashova, N. V. Cytotoxic effects of Kingella kingae outer membrane vesicles on human cells. Microbial Pathogenesis. 51 (1-2), 22-30 (2011).
- Turner, L., et al. Helicobacter pylori outer membrane vesicle size determines their mechanisms of host cell entry and protein content. Frontiers in Immunology. 9, 1466 (2018).
- Zavan, L., Bitto, N. J., Johnston, E. L., Greening, D. W., Kaparakis-Liaskos, M. Helicobacter pylori growth stage determines the size, protein composition, and preferential cargo packaging of outer membrane vesicles. Proteomics. 19 (1-2), 1800209 (2019).
- Rompikuntal, P. K., et al. Perinuclear localization of internalized outer membrane vesicles carrying active cytolethal distending toxin from Aggregatibacter actinomycetemcomitans. Infections and Immunity. 80 (1), 31-42 (2012).
- Nice, J. B., et al. Aggregatibacter actinomycetemcomitans leukotoxin is delivered to host cells in an LFA-1-independent manner when associated with outer membrane vesicles. Toxins. 10 (10), 414 (2018).
- Stevenson, T. C., et al. Immunization with outer membrane vesicles displaying conserved surface polysaccharide antigen elicits broadly antimicrobial antibodies. Proceedings of the National Academy of Sciences. 115 (14), 3106-3115 (2018).
- Gujrati, V., et al. Bioengineered bacterial outer membrane vesicles as cell-specific drug-delivery vehicles for cancer therapy. ACS Nano. 8 (2), 1525-1537 (2014).
- Huang, W., et al. Development of novel nanoantibiotics using an outer membrane vesicle-based drug efflux mechanism. Journal of Controlled Release. 317, 1-22 (2020).
- Chen, D. J., et al. Delivery of foreign antigens by engineered outer membrane vesicle vaccines. Proceedings of the National Academy of Sciences. 107 (7), 3099-3104 (2010).
- Chen, L., et al. Outer membrane vesicles displaying engineered glycotopes elicit protective antibodies. Proceedings of the National Academy of Sciences. 113 (26), 3609-3618 (2016).
- Singorenko, P. D., et al. Isolation of membrane vesicles from prokaryotes: A technical and biological comparison reveals heterogeneity. Journal of Extracellular Vesicles. 6 (1), 1324731 (2017).
- Zeringer, E., Barta, T., Li, M., Vlassov, A. V. Strategies for isolation of exosomes. Cold Spring Harbor Protocols. 2015 (4), 319-323 (2015).
- Benedikter, B. J., et al. Ultrafiltration combined with size exclusion chromatography efficiently isolates extracellular vesicles from cell culture media for compositional and functional studies. Science Reports. 7 (1), 15297 (2017).
- Mol, E. A., Goumans, M. J., Doevendans, P. A., Sluijter, J. P. G., Vader, P. Higher functionality of extracellular vesicles isolated using size-exclusion chromatography compared to ultracentrifugation. Nanomedicine. 13 (6), 2061-2065 (2017).
- Lally, E. T., Golub, E. E., Kieba, I. R. Identification and immunological characterization of the domain of Actinobacillus actinomycetemcomitans leukotoxin that determines its specificity for human target cells. Journal of Biological Chemistry. 269 (49), 31289-31295 (1994).
- Chang, E. H., Giaquinto, P., Huang, J., Balashova, N. V., Brown, A. C. Epigallocatechin gallate inhibits leukotoxin release by Aggregatibacter actinomycetemcomitans by promoting association with the bacterial membrane. Molecular Oral Microbiology. 35 (1), 29-39 (2020).
- Klimentová, J., Stulík, J. Methods of isolation and purification of outer membrane vesicles from gram-negative bacteria. Microbiological Research. 170, 1-9 (2015).
- Dauros Singorenko, P., et al. Isolation of membrane vesicles from prokaryotes: a technical and biological comparison reveals heterogeneity. Journal of Extracellular Vesicles. 6 (1), 1324731 (2017).
- Monguió-Tortajada, M., Gálvez-Montón, C., Bayes-Genis, A., Roura, S., Borràs, F. E. Extracellular vesicle isolation methods: rising impact of size-exclusion chromatography. Cellular and Molecular Life Sciences. 76 (12), 2369-2382 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon