Method Article
Un test de neutralisation rapide et multiplex à double rapporteur IgG et IgM SARS-CoV-2 pour un système d’analyse de débit à base de billes multiplexées
Dans cet article
Résumé
Un système d’analyse de flux pour les essais multiplexés à base de billes qui fournit une lecture à deux rapporteurs a été utilisé pour le développement de tests sérologiques et de neutralisation des anticorps multiplex qui peuvent mesurer simultanément les anticorps IgG et IgM neutralisants pour le SARS-CoV-2.
Résumé
La pandémie de COVID-19 a souligné la nécessité de méthodes rapides à haut débit pour la détection sérologique sensible et spécifique de l’infection par de nouveaux agents pathogènes, tels que le SARS-CoV-2. Les tests sérologiques multiplex peuvent être particulièrement utiles car ils peuvent analyser simultanément les anticorps dirigés contre plusieurs antigènes, ce qui optimise la couverture des agents pathogènes et contrôle la variabilité de l’organisme et de la réponse individuelle de l’hôte. Nous décrivons ici un test basé sur la microsphère fluorescente 3-plex IgG 3-2 du SRAS-CoV-2 qui peut détecter à la fois les anticorps IgM et IgG dirigés contre trois antigènes majeurs du SARS-CoV-2 : la protéine spike (S), l’enzyme de conversion de l’angiotensine de pointe (ACE2) domaine de liaison aux récepteurs (RBD) et la nucléocapside (Nc). Il a été démontré que le test avait des performances comparables à celles d’un test de référence du SRAS-CoV-2 pour les IgG dans le sérum obtenu à ≥21 jours après l’apparition des symptômes, mais présentait une sensibilité plus élevée avec des échantillons prélevés à ≤5 jours après l’apparition des symptômes. De plus, en utilisant l’ACE2 soluble dans un format de test de neutralisation, l’inhibition de la liaison aux anticorps a été démontrée pour S et RBD.
Introduction
La pandémie de COVID-19 a souligné l’importance de pouvoir développer et mettre en œuvre rapidement des tests sérologiques rapides, à haut débit et très performants qui peuvent être utilisés pour le diagnostic et la surveillance de nouveaux agents pathogènes tels que le SRAS-CoV-2. Les tests sérologiques multiplex peuvent être extrêmement utiles en cas de pandémie, car ils peuvent analyser simultanément les anticorps dirigés contre plusieurs antigènes, ce qui permet une large couverture des agents pathogènes et des contrôles de la variabilité de l’organisme et de la réponse de l’hôte à l’infection. Le développement d’un test multiplex à base de billes fluorescentes, le SARS-CoV-2 IgG 3Flex (3Flex), qui peut détecter les anticorps dirigés contre la protéine spike (S), le domaine de liaison aux récepteurs (RBD) de l’enzyme de conversion de l’angiotensine (ACE2) et la nucléocapside (Nc) du SARS-CoV-2 a récemment été rapporté1. Il a été démontré que 3Flex avait des performances comparables à celles d’un test de référence sars-CoV-2 IgG pour le sérum obtenu à ≥21 jours après l’apparition des symptômes, mais présentait une sensibilité plus élevée avec des échantillons prélevés à ≤5 jours après l’apparition des symptômes. De plus, l’inhibition de la liaison des anticorps a été démontrée pour les antigènes S et RBD à l’aide d’ACE2 soluble dans un format de test de neutralisation. La technologie à base de billes multiplex a été largement adoptée comme une technologie éprouvée pour les tests sérologiques multiplex et présente des avantages distincts pour le dépistage à grande échelle, notamment un court délai d’accès aux résultats, de petits échantillons et une main-d’œuvre réduite2,3,4.
Récemment, un nouvel instrument d’analyse de débit est devenu disponible qui offre la même capacité de haut niveau et à haut débit du système démontrée dans les travauxprécédents 1, mais avec l’avantage supplémentaire de deux canaux de rapporteur. La capacité de mesurer deux signaux rapporteurs fluorescents dans une seule réaction permet d’évaluer deux résultats par analyte pour chaque échantillon et est idéale pour les applications d’isotypage, qui doivent généralement être effectuées dans des puits de réaction distincts5. La capacité de double rapporteur fournit deux fois plus de données pour chaque échantillon dans deux fois moins de puits de réaction avec la moitié du volume d’échantillon requis, et présente donc un net avantage sur les systèmes de rapporteur unique. Cette étude détaille le protocole de dosage sérologique standard et décrit l’adaptation à un test de neutralisation. De plus, le présent rapport décrit la conversion du test rapporteur unique en un essai sérologique à double rapporteur et, par la suite, un essai de neutralisation à double rapporteur, afin de mesurer simultanément les anticorps neutralisants des isotypes IgG et IgM contre les antigènes SARS-CoV-2 S, RBD et Nc. Un aperçu visuel du protocole d’essai est fourni à la figure 1.
Protocole
Des échantillons de sérum humain résiduel précédemment testés pour les analyses diagnostiques du SRAS-CoV-2 ont été utilisés dans cette étude qui a été approuvée par le Conseil d’examen institutionnel de l’Université de Rochester.
1. Réactifs et équipement
- Obtenir des antigènes du coronavirus et des IgG et IgM humaines à partir de sources commerciales.
- Procurez-vous des ensembles de billes de contrôle d’essai (AC) (45 et 220) auprès du fournisseur de l’instrument. L’ensemble de billes AC 45 surveille la collecte de l’intensité de fluorescence médiane (MFI) sur des instruments à canal rapporteur unique (RP1). L’ensemble de perles AC 220 surveille la collecte MFI sur le deuxième canal rapporteur (RP2).
- Obtenir des anticorps de détection et des sérums de lapin spécifiques à l’antigène et des anticorps utilisés pour la confirmation du couplage.
- Effectuer la détection avec des anticorps marqués à la biotine avec une streptavidine, un conjugué R-phycoérythrine (SAPE) ou un conjugué streptavidine de fluorophore Super Bright 436 (SASB; excitation à 405 nanomètres (nm) et émission à 436 nm).
- Obtenir la protéine ACE2 humaine (c.-à-d. le récepteur du SRAS). Avant utilisation, réhydradre la protéine ACE2 lyophilisée en la dissolvant à une concentration de 1 mg/mL dans de l’eau sans nucléase (non traitée au DEPC, autoclavée et filtrée stérile à 0,2 μm) et conserver à 4 °C.
- Effectuer toutes les réactions dans des plaques à fond plat noires à surface non contraignante (NBS) de 96 puits. Scellez les plaques avec du ruban d’étanchéité en aluminium à microplaques de 96 puits pour les étapes d’incubation du test. Utilisez un séparateur à plaque magnétique pour les étapes de lavage du test.
2. Préparation de billes témoins couplées à des antigènes et à des anticorps
- Coupler de manière covalente des ensembles de microsphères magnétiques, en polystyrène et à code couleur (diamètre de 6,5 μm) avec des antigènes S, RBD et Nc comme décrit dans Cameron et al.1. Les antigènes du coronavirus sont couplés à 10 pmol/106 billes (S) et 100 pmol/106 billes (RBD et Nc). Les billes de contrôle couplées à des IgG ou IgM humaines sont générées comme décrit précédemment1. IgG et IgM sont couplés à 5 μg/106 perles.
- Après couplage, déterminer les concentrations de billes et diluer chaque bouillon à 1 x 106 billes/mL en utilisant les procédures décrites6.
- Effectuer la confirmation du couplage d’antigènes avec des anticorps spécifiques à l’antigène provenant de lapins ou avec des sérums humains positifs, comme décrit dans Cameron et al.1.
- Confirmer le couplage des IgG humaines avec les réactifs de détection des IgG/SAPE anti-humains biotinylés du test et le couplage des IgM avec une IgM anti-humaine de chèvre portant la marque phycoérythrine (PE).
REMARQUE: La confirmation du couplage est effectuée à l’aide d’un titrage de sérum ou d’anticorps spécifiques à une protéine, car la concentration optimale à utiliser pour ces réactifs n’est pas connue. Pour le sérum, des dilutions de plis en série sont utilisées, tandis que pour les anticorps fournis sous forme de stocks de mg/mL, des séries de dilution en série μg/mL sont utilisées.
- Confirmer le couplage des IgG humaines avec les réactifs de détection des IgG/SAPE anti-humains biotinylés du test et le couplage des IgM avec une IgM anti-humaine de chèvre portant la marque phycoérythrine (PE).
- Diluez les billes de contrôle d’essai (AC) qui surveillent la collecte des IFD dans les deux canaux rapporteurs à une concentration de 1 x 106 billes/mL avant utilisation dans les mélanges de billes multiplex.
3. Préparation du mélange de billes multiplexes fraîches
- Préparez des mélanges de billes multiplexes fraîchement chaque jour à partir des billes couplées individuelles et contrôlez les stocks de perles à 1 x10 6 perles / mL.
REMARQUE: Les mélanges de billes multiplex sont préparés pour fournir 2 500 perles pour chaque région de perles dans un volume de 50 μL. Les calculs sur la façon de préparer des mélanges de billes multiplex pour un nombre quelconque de réactions sont décrits dans le blog publié par Angeloni (2020)6.
4. Dilution de l’échantillon
- Préparer une dilution de l’échantillon de sérum à 1:100 en mélangeant 10 μL de sérum dans 990 μL de solution saline tamponnée au phosphate (PBS) contenant 0,05 % de Tween 20, 0,02 % d’azide de sodium et 1 % d’albumine sérique bovine (BSA) (tampon PBS-TBN).
- Diluer à nouveau les échantillons 10 fois en ajoutant 20 μL de la dilution 1:100 à 180 μL de PBS-TBN.
REMARQUE: Les échantillons de sérum se composent de sérums négatifs, provenant d’échantillons prélevés en 2019 avant la pandémie de COVID-19, et de sérums positifs de patients positifs à la PCR du SARS-CoV-2, représentant des titres d’anticorps faibles et élevés. Des échantillons positifs ont été prélevés entre ≈3 et >60 jours après l’apparition des symptômes (DFSO). Tous les échantillons de sérum et les sérums témoins négatifs dépouillés d’IgG sont dilués à 1:1000 comme décrit ci-dessous. Pour les essais de neutralisation, les sérums sont dilués à 1:500 comme décrit dans les protocoles de neutralisation ci-dessous (sections 6 et 8).
5. Protocole d’essai sérologique à rapporteur unique
- Ajouter 50 μL de mélange de billes multiplex à chaque puits assigné d’une plaque de microtitrage non liante de 96 puits.
- Pipeter 50 μL de sérum 1:1000 ou PBS-TBN dans les puits appropriés; la dilution finale du sérum dans le puits est de 1:2000.
- Recouvrir la plaque d’un joint en feuille de microplaque et incuber sur un agitateur à plaque chauffante à 37 °C pendant 15 min en agitant à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez les puits de réaction comme décrit ci-dessous (premier lavage d’incubation post-échantillon).
- Retirez la plaque de l’aimant de la plaque et ajoutez 150 μL de PBS-TBN à chaque puits.
- Couvrir la plaque avec un joint d’aluminium frais et agiter à 37 °C pendant 2 min à 600 tr/min.
- Retirez la plaque de l’agitateur à plaque et placez-la sur l’aimant de la plaque pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez les puits de réaction comme décrit ci-dessous (deuxième lavage d’incubation post-échantillon).
- Retirez la plaque de l’aimant de la plaque et ajoutez 150 μL de PBS-TBN à chaque puits.
- Couvrir la plaque avec un joint d’aluminium frais et agiter à 37 °C pendant 2 min à 600 tr/min.
- Retirez la plaque de l’agitateur à plaque et placez-la sur l’aimant de la plaque pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Retirez la plaque de l’aimant.
- Faites un nouveau mélange d’IgG biotine-anti-humaine avec SAPE en diluant l’anticorps à 0,62 μg/mL et le SAPE à 1 μg/mL. Ajouter 100 μL à chaque puits.
- Recouvrir la plaque d’un joint en feuille de microplaque et incuber sur un agitateur à plaque chauffante à 37 °C pendant 15 min en agitant à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez les puits de réaction comme décrit ci-dessous (premier lavage d’incubation d’anticorps après la détection).
- Retirez la plaque de l’aimant de la plaque et ajoutez 150 μL de PBS-TBN à chaque puits.
- Couvrir la plaque avec un joint d’aluminium frais et agiter à 37 °C pendant 2 min à 600 tr/min.
- Retirez la plaque de l’agitateur à plaque et placez-la sur l’aimant de la plaque pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez les puits de réaction comme décrit ci-dessous (deuxième lavage par incubation d’anticorps après la détection).
- Retirez la plaque de l’aimant de la plaque et ajoutez 150 μL de PBS-TBN à chaque puits.
- Couvrir la plaque avec un joint d’aluminium frais et agiter à 37 °C pendant 2 min à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Retirez la plaque de l’aimant.
- Ajouter 100 μL de PBS-TBN à chaque puits.
- Couvrir avec un joint d’aluminium et agiter pendant 2 min à 37 °C.
- Retirez la plaque du shaker de la plaque. Retirez ensuite le joint d’étanchéité et lisez 50 μL de chaque puits sur l’analyseur de débit conformément au manuel de l’utilisateur. Une brève description est fournie ci-dessous.
- Sélectionnez le menu déroulant dans le coin supérieur gauche de l’écran et accédez à Configuration de la plaque.
- Sélectionnez Run Plate (Plaque de course).
- Sélectionnez l’icône Éjecter pour éjecter le support de plaque.
- Chargez la plaque sur le support de plaque et sélectionnez l’icône Rétracter pour rétracter le support de plaque.
- Sélectionnez l’icône Exécuter pour exécuter la plaque.
6. Protocole d’essai de neutralisation à rapporteur unique
- Préparez un mélange de billes multiplexes frais comme décrit à la section 3 ci-dessus.
- Diluer le patient et contrôler le sérum 1:500 comme suit.
- Diluer le sérum 1:100 en mélangeant 10 μL de sérum dans 990 μL de PBS-TBN.
- Diluer le sérum 5 fois de plus en ajoutant 40 μL de sérum 1:100 dans 160 μL de PBS-TBN.
- Ajouter 50 μL de mélange de billes multiplex à chaque puits assigné d’une plaque de microtitrage non liante de 96 puits.
- Ajouter 25 μL de dilution ACE2 de 2 μg/mL à chaque puits.
- Couvrir la plaque avec un joint en feuille de microplaque et incuber sur un agitateur à plaque chauffante à 37 °C pendant 2 min en agitant à 600 tr/min.
- Retirez la plaque de l’agitateur de plaque et retirez le joint d’étanchéité.
- Ajouter 25 μL de sérum 1:500 ou pbS-TBN aux puits assignés.
- Recouvrir la plaque d’un joint en feuille de microplaque et incuber sur un agitateur à plaque chauffante à 37 °C pendant 15 min en agitant à 600 tr/min.
- Pour le reste de la procédure d’essai, suivez les étapes 5.4 à 5.18.5 décrites ci-dessus.
7. Conversion en un double test sérologique IgG et IgM
- Préparer des billes couplées à l’antigène comme décrit à la section 2 ci-dessus.
REMARQUE: Un ensemble de perles supplémentaire, couplé à des IgM humaines, est inclus pour surveiller l’ajout de réactifs de détection anti-IgM, ainsi qu’un ensemble de perles AC supplémentaire (220) pour surveiller la collecte d’IMF pour RP2. Tous les stocks de perles sont à 1 x 106 perles / mL pour inclusion dans les mélanges de billes multiplex comme décrit ci-dessous. - Préparez des mélanges de billes multiplexes fraîches comme décrit à la section 3 ci-dessus.
- Échantillons de sérum dilué et sérum témoin négatif dépouillé d’IgG 1:1000 comme décrit à la section 4 ci-dessus.
- Ajouter 50 μL de mélange de billes multiplex à chaque puits assigné d’une plaque de microtitrage non liante de 96 puits.
- Pipette 50 μL de sérum 1:1000 ou PBS-TBN vers les puits appropriés. La dilution finale du sérum dans le puits est de 1:2000.
- Recouvrir la plaque d’un joint en feuille de microplaque et incuber sur un agitateur à plaque chauffante à 37 °C pendant 15 min en agitant à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez les puits de réaction comme décrit ci-dessous (premier lavage d’incubation post-échantillon).
- Retirez la plaque de l’aimant de la plaque et ajoutez 150 μL de PBS-TBN à chaque puits.
- Couvrir la plaque avec un joint d’aluminium frais et agiter à 37 °C pendant 2 min à 600 tr/min.
- Retirez la plaque de l’agitateur à plaque et placez-la sur l’aimant de la plaque pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez à nouveau les puits de réaction avec du PBS-TBN (deuxième lavage d’incubation post-échantillon), exactement comme décrit ci-dessus aux étapes 7.10.1 à 7.10.5.
- Retirez la plaque de l’aimant.
- Préparez un nouveau mélange de réactifs de détection avec la combinaison de réactifs requise et ajoutez 50 μL ou 100 μL à chaque puits.
REMARQUE: Des mélanges de réactifs de détection contenant les IgG anti-humaines conjuguées au colorant rapporteur Brilliant Violet 421 (BV; excitation à 405 nm et émission à 421 nm) ont été utilisés à 50 μL / puits en raison des quantités limites de réactifs disponibles. Tous les autres mélanges de réactifs de détection sont utilisés à 100 μL/puits. - Recouvrir la plaque d’un joint en feuille de microplaque et incuber sur un agitateur à plaque chauffante à 37 °C pendant 15 min en agitant à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez les puits de réaction comme décrit ci-dessous avec du PBS-TBN (premier lavage après incubation d’anticorps de détection).
- Retirez la plaque de l’aimant de la plaque et ajoutez 150 μL de PBS-TBN à chaque puits.
- Couvrir la plaque avec un joint d’aluminium frais et agiter à 37 °C pendant 2 min à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Tout en retenant la plaque sur l’aimant, retirez le joint de feuille, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez à nouveau les puits de réaction avec du PBS-TBN (deuxième lavage après incubation d’anticorps de détection), exactement comme décrit ci-dessus aux étapes 7.17.1 à 7.17.5.
- Retirez la plaque de l’aimant.
- Ajouter 100 μL de PBS-TBN à chaque puits.
- Couvrir avec un joint d’aluminium et agiter pendant 2 min à 37 °C.
- Retirez la plaque du shaker de la plaque. Retirez ensuite le joint d’étanchéité et lisez 50 μL de chaque puits sur l’analyseur de débit comme décrit ci-dessus aux étapes 5.18.1-5.18-5.
8. Conversion en essai de neutralisation à double rapporteur
- Utilisez les billes couplées comme décrit à l’étape 7.1 ci-dessus.
- Préparez un mélange de billes multiplexes frais comme décrit à l’étape 7.2.
- Les échantillons de sérum et les sérums témoins négatifs dépouillés d’IgG sont dilués à 1:500 comme suit.
- Préparer une dilution à 1:100 en mélangeant 10 μL de sérum dans 990 μL de PBS-TBN.
- Diluer les échantillons 1:100 5 fois de plus en ajoutant 40 μL des dilutions 1:100 à 160 μL de PBS-TBN.
- Ajouter 50 μL de mélange de billes multiplex à chaque puits assigné d’une plaque de microtitrage non liante de 96 puits.
- Ajouter 25 μL de dilution ACE2 de 2 μg/mL à chaque puits.
- Couvrir la plaque avec un joint en feuille de microplaque et incuber sur un agitateur à plaque chauffante à 37 °C pendant 2 min en agitant à 600 tr/min.
- Retirez la plaque de l’agitateur de plaque et retirez le joint d’étanchéité.
- Ajouter 25 μL de sérum 1:500 ou pbS-TBN aux puits assignés.
- Couvrir la plaque avec un joint d’aluminium et incuber sur un agitateur à plaque chauffante à 37 °C pendant 15 min en agitant à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Une fois la plaque retenue sur l’aimant, retirez le joint d’étanchéité, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez les puits de réaction comme décrit ci-dessous (premier lavage post-incubation de l’échantillon).
- Retirez la plaque de l’aimant de la plaque et ajoutez 150 μL de PBS-TBN à chaque puits.
- Couvrir la plaque avec un joint d’aluminium frais et agiter à 37 °C pendant 2 min à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Une fois la plaque retenue sur l’aimant, retirez le joint d’étanchéité, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez à nouveau les puits de réaction avec du PBS-TBN (deuxième lavage d’incubation post-échantillon), exactement comme décrit ci-dessus aux étapes 8.13.1 à 8.13.5.
- Retirez la plaque de l’aimant.
- Préparez un nouveau mélange de réactifs de détection avec la combinaison de réactifs requise et ajoutez 50 μL ou 100 μL à chaque puits.
REMARQUE : Des mélanges de réactifs de détection contenant les IgG anti-humaines conjuguées au colorant rapporteur BV ont été utilisés à 50 μL/puits en raison des quantités limites de réactifs disponibles (voir tableau des matériaux). Tous les autres mélanges de réactifs de détection sont utilisés à 100 μL/puits. - Recouvrir la plaque d’un joint en feuille de microplaque et incuber sur un agitateur à plaque chauffante à 37 °C pendant 15 min en agitant à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Une fois la plaque retenue sur l’aimant, retirez le joint d’étanchéité, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez les puits de réaction comme décrit ci-dessous (le premier était après la détection de l’incubation d’anticorps).
- Retirez la plaque de l’aimant de la plaque et ajoutez 150 μL de PBS-TBN à chaque puits.
- Couvrir la plaque avec un joint d’aluminium frais et agiter à 37 °C pendant 2 min à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Une fois la plaque retenue sur l’aimant, retirez le joint d’étanchéité, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Épongez la plaque sur du papier absorbant tout en maintenant la plaque sur l’aimant.
- Lavez à nouveau les puits de réaction avec du PBS-TBN (deuxième lavage après incubation d’anticorps de détection), exactement comme détaillé ci-dessus aux étapes 8.21.1-8.21.5.
- Retirez la plaque de l’aimant de la plaque et ajoutez 150 μL de PBS-TBN à chaque puits.
- Couvrir la plaque avec un joint d’aluminium frais et agiter à 37 °C pendant 2 min à 600 tr/min.
- Retirez la plaque de l’agitateur à plaques et placez-la sur le séparateur de plaques magnétiques pendant 2 minutes pour séparer les billes du mélange réactionnel.
- Une fois la plaque retenue sur l’aimant, retirez le joint d’étanchéité, inversez soigneusement la plaque au-dessus d’un conteneur à déchets et faites glisser doucement le surnageant hors des puits.
- Retirez la plaque de l’aimant.
- Ajouter 100 μL de PBS-TBN à chaque puits.
- Couvrir avec un joint d’aluminium et agiter pendant 2 min à 37 °C.
- Retirez la plaque du shaker de la plaque. Retirez ensuite le joint d’étanchéité et lisez 50 μL de chaque puits sur l’analyseur de débit comme décrit ci-dessus aux étapes 5.18.1-5.18-5.
Résultats
Optimisation du test sérologique Single Reporter.
La stratégie de couplage pour tous les antigènes du SRAS-CoV-2 est décrite dans Cameron et coll., 20201 et à l’étape 2.1 ci-dessus. La stratégie de confirmation du couplage est décrite à l’étape 2.3 ci-dessus. Pour un couplage efficace, les valeurs médianes d’intensité de fluorescence (IFG) doivent être significativement plus élevées que la ou les réactions témoins négatives sans sérum/sans anticorps et doivent démontrer une dose-réponse de signal MFI décroissant avec des quantités décroissantes de réactif de détection. Les IFM d’environ 1 000 unités d’IFM ou plus par rapport à l’IFM de fond indiquent généralement un couplage protéique efficace et dépendent de la concentration et de la spécificité du réactif de détection utilisé. À l’aide de cette méthode, la confirmation du couplage de l’antigène S, RBD et Nc a été testée pour deux lots de billes (Figure 2). Les signaux de l’IFD pour tous les antigènes étaient significativement plus élevés que l’IFG de fond et ont montré une réponse dose avec titrage des réactifs de détection. Les données ont également montré une bonne reproductibilité des niveaux d’IMF entre les deux différents lots de perles couplées.
L’optimisation du test du rapporteur unique a été effectuée comme décrit dans Cameron, et al., 20201. Chaque antigène a été testé à différentes concentrations de couplage avec différentes dilutions de plusieurs échantillons de sérum représentant des échantillons élevés, moyens, faibles et négatifs. De plus, comme le test mesure les titres d’IgG, un sérum dépouillé d’IgG a été utilisé comme échantillon négatif supplémentaire. Les résultats d’une série représentative de dilution d’échantillon avec différents niveaux de couplage d’antigène sont présentés à la figure 3. Cette série de dilution initiale a été testée avec une concentration fixe de réactifs de détection pour obtenir une gamme potentielle de niveaux représentatifs d’IFD spécifiques à l’antigène et de fond. À partir de ces données, des plages de dilution d’échantillons supplémentaires et des niveaux de couplage d’antigènes ont été déterminés et testés plus avant avec des échantillons supplémentaires (données non présentées).
Ensuite, la concentration du réactif de détection a été optimisée pour une utilisation avec les différentes dilutions sériques et les niveaux de couplage d’antigènes. Des données représentatives utilisant 6 échantillons positifs et 2 échantillons négatifs sont présentées à la figure 4. Après des tests supplémentaires avec plusieurs centaines d’échantillons de sérum négatifs avant la COVID-19, les niveaux finaux optimaux de couplage d’antigènes et les concentrations régentes de détection ont été sélectionnés pour le protocole d’essai final, tel que décrit à la rubrique 5.
Conversion en un seul essai de neutralisation de rapporteur
La conversion du test sérologique à rapporteur unique en essai de neutralisation a été obtenue en ajoutant une étape d’incubation utilisant ACE2 (en tant que réactif concurrent) avec les perles avant d’ajouter l’échantillon de sérum. En titrant la quantité d’ACE2 ajoutée, on a observé une inhibition de la liaison des IgG aux antigènes S et RBD, comme le montre la figure 5. Alors que les sérums de 11 patients avaient des titres différents d’IgG, chacun a montré une diminution significative du signal MFI avec une augmentation de la concentration d’ACE2. Comme prévu, ACE2 n’a d’impact que sur les signaux MFI de S et RBD, mais pas sur l’antigène Nc.
Le pourcentage de signal MFI résiduel par rapport à 0 μg/mL ACE2 pour tous les échantillons est illustré à la figure 6. Pour la plupart des échantillons, une perte de signal >30 % a été observée pour S et RBD avec une concentration croissante d’ACE2. Comme prévu, il n’y a eu aucun effet de l’ACE2 sur le signal Nc.
Conversion en un double test sérologique IgG et IgM
Pour le test IgG et IgM à double rapporteur, les conditions standard du test à rapporteur unique ont été utilisées pour tester différentes combinaisons d’anticorps et de rapporteurs pour les deux canaux rapporteurs. Le canal RP1 est similaire aux instruments d’analyse de débit précédents avec détection de fluorescence « orange » pour les colorants rapporteurs tels que le PE. Le deuxième canal, RP2, utilise un laser d’excitation violette qui peut être utilisé pour détecter la fluorescence « bleue » des colorants excités à 402 nm avec des pics de spectre d’émission dans la gamme 421-441 nm.
Plusieurs combinaisons différentes d’anticorps IgG et IgM anti-humains ont été testées à différentes concentrations avec les conditions standard de dilution et d’incubation de l’échantillon de 2 000 fois détaillées à la section 6. Un premier test d’anti-IgM conjugué au colorant rapporteur DyLight 405 (DL 405; excitation à 400 nm et émission à 420 nm) pour le canal RP2 a été effectué à l’aide d’un ensemble de 11 échantillons PCR positifs avec DFSO allant de 5 à >60 jours, et d’un échantillon de sérum dépouillé d’IgG. Ce réactif de détection n’a pas produit de signal élevé dans le canal RP2 comme le montre la Figure 7A,B, C. Pour les échantillons avec l’IMF IgM RP2 élevée, les signaux les plus élevés ont été observés pour RBD et Nc (Figure 7B, C). Bien que les titres d’IgM devraient être élevés à ce moment-là dans certains échantillons, les niveaux d’IFM observés n’ont pas dépassé 140 unités d’IFM avec le réactif de détection d’IgM. De plus, le bille témoin pour les IgM n’avait pas de plage dynamique significative pour l’IMF lors de l’utilisation de DL 405 conjugué à des anti-IgM par rapport à un rapporteur anti-IgM RP1 marqué PE utilisé aux mêmes concentrations(Figure 7D).
Étant donné qu’aucun réactif de détection pour les IgM marqué RP2 approprié n’était disponible, l’anti-IgG de biotine d’origine avec SASB a été testé pour une utilisation dans le canal RP2. Le signal pour Les IgG dans le canal RP2 avec SASB n’avait pas la même plage dynamique qu’avec SAPE, mais il avait toujours une plage appropriée pour mesurer les titres IgG pour S, RBD et Nc(Figure 8). Ces données ont permis de tester différentes combinaisons de réactifs de détection RP1 IgM et RP2 IgG, comme décrit ci-dessous.
Conversion en essai de neutralisation à double rapporteur
Le test sérologique à double rapporteur a été converti en test de neutralisation en ajoutant une étape d’incubation avec ACE2 et perles, avant d’ajouter l’échantillon de sérum. Une série de dilution 2 fois de l’ACE2 à partir de 16 μg/ml a été utilisée, puis testée avec des ensembles de 11 échantillons et des sérums dépouillés comme décrit ci-dessus. En outre, 3 combinaisons différentes de mélanges d’anticorps de détection RP1 IgM et RP2 IgG ont été testées sur un ensemble de 11 échantillons et des contrôles sériques dépouillés. Les combinaisons finales et les concentrations de réactifs jugées optimales sont détaillées dans le tableau 1.
Pour la détection des IgG, la biotine anti-humain IgG/SASB utilisée dans le test original à rapporteur unique a été testée avec un autre anti-IgG conjugué au colorant rapporteur BV. Alors que le conjugué BV avait des signaux MFI RP2 élevés, l’intensité du signal MFI pour le titre IgG variait d’un titrage ACE2 à l’autre(Figure 9A,C, E). La combinaison IgG/SASB anti-biotine chez l’homme a connu une diminution plus constante du signal MFI dans l’ensemble du titrage ACE2 par rapport au conjugué BV, démontrant une réponse dose-réponse, bien que les niveaux d’IMF soient plus faibles. La fluctuation du signal par le conjugué BV à travers les concentrations d’ACE2 a également interféré avec la détermination du pourcentage d’inhibition par ACE2 dans la gamme des titres d’IgG par rapport à la combinaison IgG/SASB anti-humain de biotine(Figure 9B,D,F). Les échantillons avec de faibles signaux MFI, tels que l’échantillon DFSO 3, n’ont pas de titres suffisamment élevés pour évaluer les performances de ces réactifs ou mesurer la capacité de neutralisation des IgG.
Pour déterminer les titres d’IgM dans le canal RP1, un anti-IgM conjugué PE a été comparé à un IgM anti-humain conjugué au colorant rapporteur DyLight 549 (DL 549; excitation à 562 nm et émission à 576 nm) aux concentrations indiquées dans le tableau 1. De ces deux réactifs, l’anti-IgM PE présentait des IFM plus élevés que ceux générés par les IgM anti-humaines DL 549 pour les échantillons testés(Figure 9A,C,E). La bille témoin IgM mesurant l’ajout de ces réactifs avait des IFM moyennes différentes de ≈ 17 000 pour l’anti-IgM PE et de 2 723 pour le conjugué DL 549. Même avec ces différences, l’impact des différentes concentrations d’ACE2 sur l’IFMM était mesurable avec le conjugué DL 549. Pour déterminer l’inhibition à 2 % de l’ACE2 de la liaison aux IgM, il y avait une différence légère mais insignifiante entre les deux réactifs de détection des IgM(Figure 9B,D, F).
| Combinaison | Reporter | Concentration finale dans le puits (μg/mL) | |
| RP1 | RP2 | ||
| 1 | PE anti-IgM | 2 | - |
| Biotine-Ig | - | 0.62 | |
| Le | - | 4 | |
| 2 | DyLight 549 IgM anti-humaines | 1 | - |
| IgG anti-humaines Violet 421 brillant | - | 1 | |
| 3 | DyLight 549 IgM anti-humaines | 1 | - |
| Biotine-Ig | - | 0.62 | |
| Le | - | 4 | |
Tableau 1 : Liste des combinaisons de colorants rapporteurs RP1 et RP2 testées. Plusieurs colorants rapporteurs RP1 et RP2 différents ont été évalués pour mesurer les titres IgG et IgM. Les trois combinaisons présentées ci-dessus ont été testées à différents modes de détection RP1 et pour optimiser le test de neutralisation. Pour les combinaisons RP2 utilisant le SASB, les concentrations de l’anticorps de détection biotinylé et du SASB sont indiquées. *La concentration finale représente la concentration finale dans le puits de réaction.
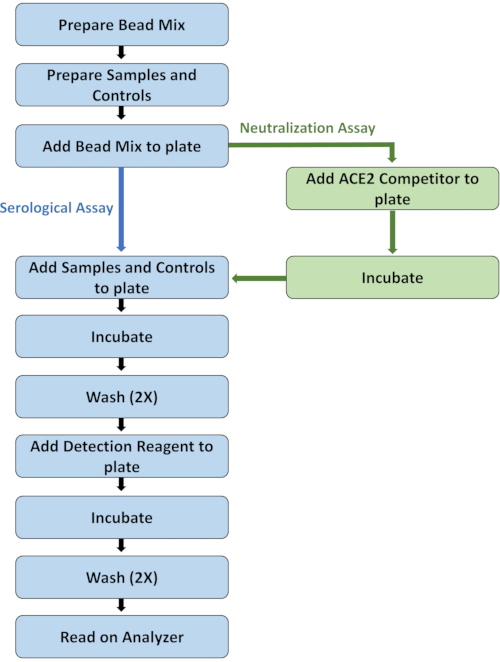
Figure 1: Organigramme mettant en évidence les principales étapes du protocole d’essai. Veuillez cliquer ici pour voir une version agrandie de cette figure.
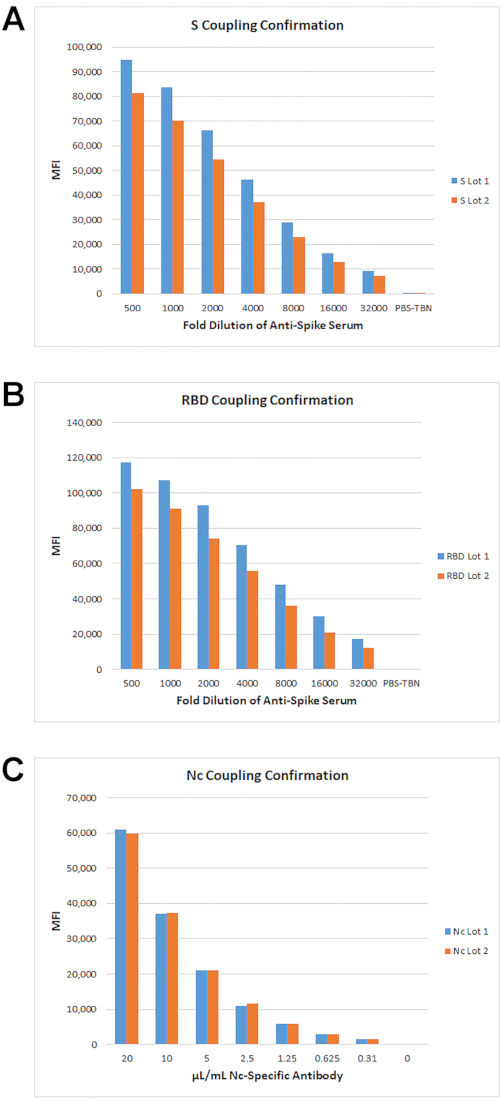
Figure 2: Confirmation du couplage antigénique. Les antigènes ont été couplés à 100, 10 et 1 pmol/106 perles. Pour les antigènes S et RBD, des sérums anti-S de lapin ont été utilisés et détectés avec des IgG anti-lapin PE. Pour nc, un anti-Nc polyclonal de lapin purifié à la protéine G a été utilisé. Les courbes de titrage pour les billes couplées à 10 pmol S (A), 100 pmol RBD (B) et 100 pmol Nc (C) sont indiquées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
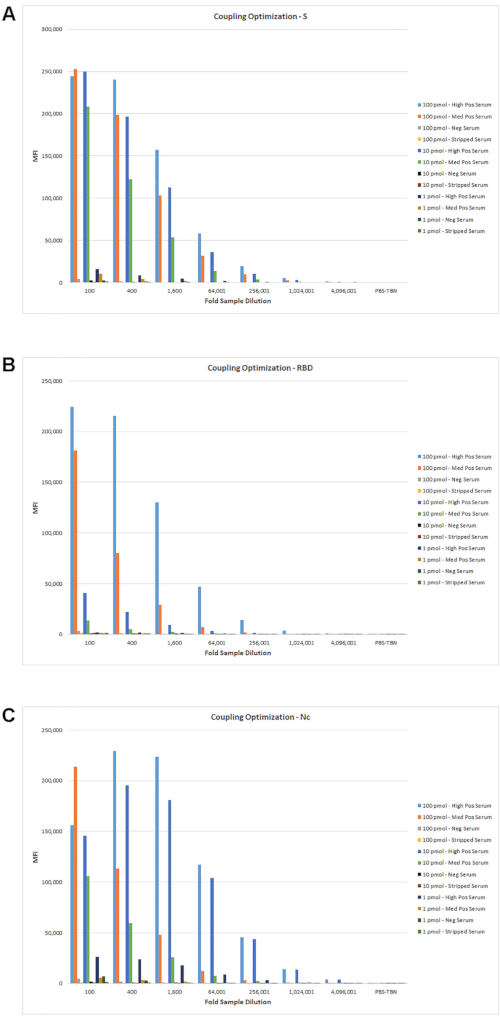
Figure 3: Optimisation de la dilution sérique avec différents niveaux de couplage d’antigènes. Des échantillons de sérum représentant des échantillons élevés, moyens, faibles et négatifs ont été testés avec les différents couplages antigène pmol /10 6 billes. Un titrage sérique 4 fois a été testé avec un mélange multiplex de billes couplées à l’antigène en utilisant le protocole de dosage décrit à la rubrique 5. Les valeurs IFD des courbes de titrage pour S (A), RBD (B) et Nc (C) sont indiquées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
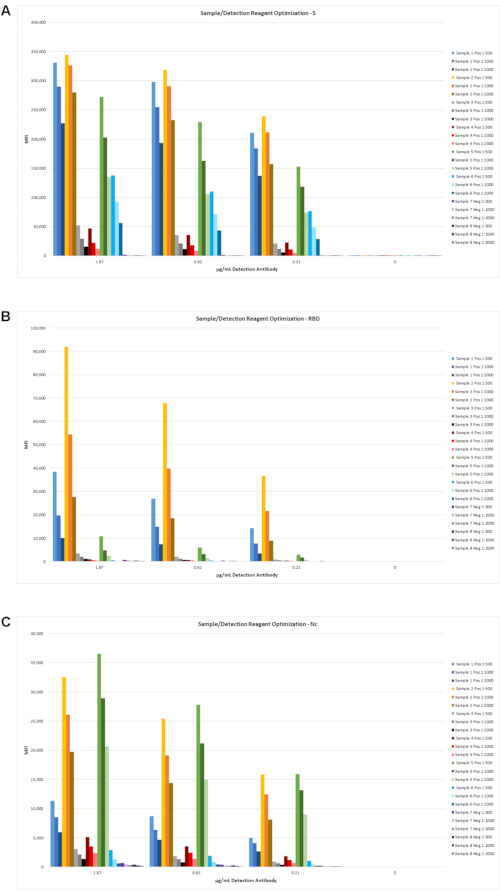
Figure 4: Détermination de la dilution sérique optimale et concentration en réactif de détection. Huit échantillons de sérum, y compris des patients négatifs (2 échantillons) et des patients faible à élevé positifs (6 échantillons), ont été testés à des dilutions sériques supplémentaires avec trois concentrations de réactif de détection différentes. Les résultats de l’IFD sont indiqués pour S (A), RBD (B) et Nc (C). Sur la base de ces données et d’autres (non présentées), une dilution de l’échantillon de 1:2 000 et une concentration d’anticorps de détection de la biotine de 0,62 μg/mL ont été sélectionnées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
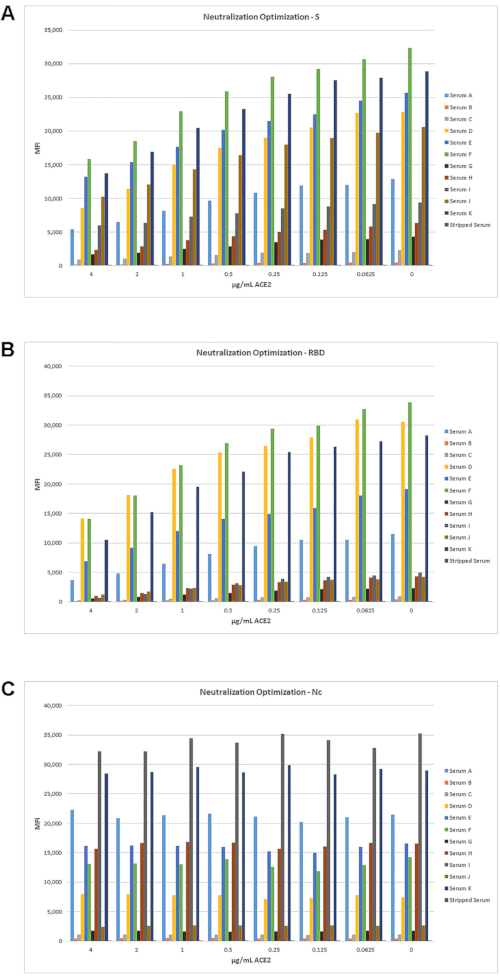
Figure 5: Optimisation du test de neutralisation à rapporteur unique. La modification du test sérologique à rapporteur unique en un test de détection d’anticorps neutralisants a été effectuée en ajoutant une étape d’incubation avec ACE2 comme concurrent, comme décrit à la section 6. Un ensemble de 11 échantillons, allant de sérums à titre faible à très positif, et un échantillon de sérum rayé IgG ont été testés avec une série de dilution en deux fois de l’ACE2 à partir de 4 μg / mL, en utilisant des conditions de dosage standard. Dans cette gamme de concentrations d’ACE2, une diminution de l’IFMM peut être observée avec une augmentation de l’ECA2 pour S (A) et RBD (B), mais pas pour Nc (C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
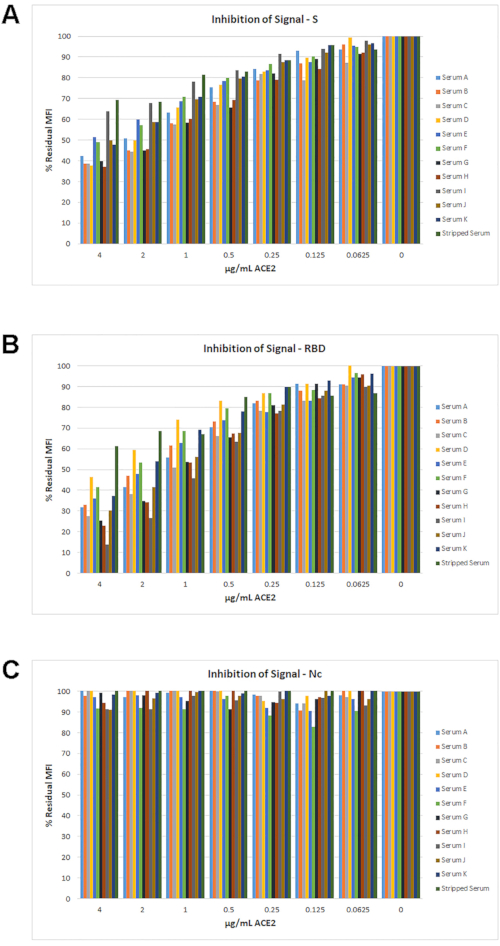
Figure 6: Pourcentage d’inhibition du signal avec ACE2. Le pourcentage de signaux résiduels pour l’ensemble de 11 échantillons (de la figure 4) est illustré. Pour chaque échantillon, quel que soit son titre IgG, une diminution maximale du signal MFI de ≥30 % a été obtenue pour S (A) et RBD (B) à la concentration ACE2 la plus élevée. Pour l’antigène Nc (C), il n’y avait pas d’inhibition significative du signal avec une quantité quelconque d’ACE2 testée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
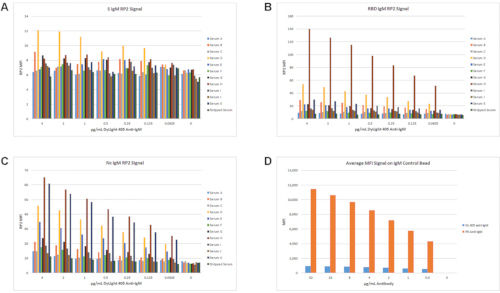
Figure 7: Test de l’anti-IgM DyLight 405 en tant que réactif de détection RP2 IgM. Un ensemble de 11 échantillons et des sérums dépouillés d’IgG ont été utilisés pour tester les anti-IgM conjugués DL 405 en tant que réactif de détection RP2. Les signaux MFI IgM RP2 pour S (A), RBD (B) et Nc (C) sont affichés. Le signal MFI le plus élevé pour tout antigène avec n’importe quel échantillon était d’environ 140 unités MFI pour RBD avec échantillon H (B). Même le signal sur l’ensemble de billes de contrôle IgM était inférieur à 1 000 MFI dans le canal RP2 sur toute la gamme de titres d’anticorps et ne montrait pas la plage dynamique accrue observée avec l’anticorps de détection PE anti-IgM dans le canal RP1 (D). Veuillez cliquer ici pour voir une version agrandie de cette figure.
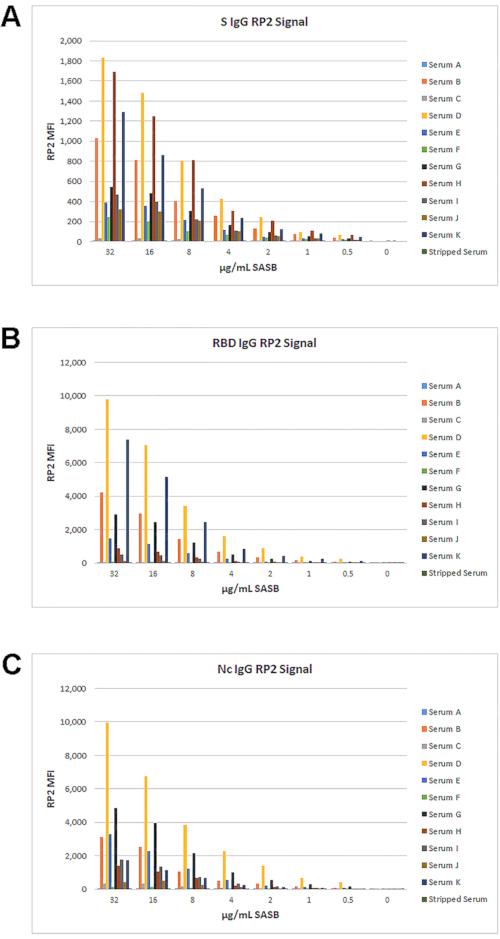
Figure 8: Optimisation du SASB en tant que rapporteur RP2 avec biotine anti-IgG. Un ensemble de 11 échantillons et des sérums dépouillés d’IgG ont été utilisés pour tester une série de dilution de SASB avec l’anti-IgG de biotine standard de 0,62 μg / mL. Les IMF Résultantes dans le canal RP2 pour S (A), RBD (B) et Nc (C) sont affichées. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 9: Comparaison de trois combinaisons différentes de mélanges de détection RP1 IgM et RP1 IgG. Trois mélanges d’anticorps de détection différents ont été testés sur 11 échantillons et des sérums dépouillés d’IgG. Les combinaisons et les concentrations finales utilisées sont décrites dans le tableau 1. Tous les échantillons ont été testés avec une dilution ACE2 de 2 fois, à partir de 16 μg/mL. Les données pour les échantillons à DFSO de 3, 12 et 30 jours sont affichées. Les signaux MFI pour RP1 IgM (orange) et RP2 IgG (bleu) sont indiqués en A (DFSO 3), C (DFSO 12) et E (DFSO 30). Les IFM résiduelles ACE2 % sont indiquées en B (DFSO 3), D (DFSO 12) et F (DFSO 30). Les signaux représentant une diminution de >30 % par rapport aux commandes No ACE2 sont mis en évidence en vert clair. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette étude a élargi la fonctionnalité d’un test de microsphère fluorescente multiplexe, 3Flex, qui évalue qualitativement la réponse des IgG à l’infection par le SRAS-CoV-21. Alors que de nombreux tests sérologiques pour COVID-19 détectent un seul antigène, ce test évalue simultanément les antigènes S, RBD et Nc, et comprend un contrôle interne de l’isotype d’anticorps7. De plus, l’ACE2 est utilisé comme indicateur pour détecter les titres d’anticorps neutralisants du SRAS-CoV-2.
Les tests multi-antigènes pourraient être particulièrement utiles à l’avenir pour discriminer les réponses immunitaires entre les personnes infectées et vaccinées. Avec le SARS-CoV-2, si seuls les anticorps S et RBD sont évalués, il serait impossible de discerner si cela est dû à une infection passée ou à une réponse vaccinale anticorps. Aucun des vaccins actuellement utilisés ne cible l’antigène Nc, de sorte qu’en évaluant les antigènes S/RBD et Nc, il est possible de distinguer une infection virale passée (Nc- et S/RBD-positive) d’une réponse vaccinale (S/RBD-positive uniquement; Nc-négatif).
Dans la présente étude, les essais sérologiques et de neutralisation 3Flex (sections 5 et 6) ont été transférés sur un nouvel instrument d’analyse de flux à double rapporteur (sections 7 et 8). Les protocoles d’immunodosage typiques pour les tests multiplex à base de billes sont similaires aux protocoles ELISA standard, suivant des étapes comparables pour l’incubation de l’échantillon, l’incubation des anticorps de détection / rapporteurs et l’analyse des résultats8. Des études antérieures ont également démontré comment les tests ELISA standard peuvent être transférés sur une plate-forme de multiplexage à base deperles 9.
Les protocoles d’essai pourraient être transférés de manière transparente de l’instrument de rapporteur unique prédécesseur au nouveau système de rapporteur double, comme le montrent les résultats obtenus pour les échantillons d’essai et les contrôles(figure 4 et figure 5). Dans le test sérologique, tous les échantillons sériques positifs ont démontré une diminution caractéristique du signal sensible à la dose correspondant à la fois à une dilution plus élevée de l’échantillon et à une concentration d’anticorps de détection plus faible, tandis que les signaux pour les échantillons négatifs sont restés aux niveaux de fond. De même, pour le test de neutralisation, la diminution des signaux pour S et RBD, mais pas Nc, correspondait à des concentrations croissantes du concurrent ACE2, tandis que le sérum dépouillé d’IgG était beaucoup moins affecté par l’ajout d’ACE2. La pré-incubation des billes avec ACE2 pendant 2 minutes avant l’ajout de l’échantillon de sérum (comme décrit dans les rubriques 6 et 8), a également été comparée à la combinaison des perles avec ACE2 et sérum en même temps et a produit peu de différence dans les résultats (données non montrées). Cependant, comme les résultats obtenus avec les billes plus l’étape de pré-incubation ACE2 étaient plus cohérents, c’était la procédure finale adoptée pour le protocole de test de neutralisation (sections 6 et 8).
Étant donné que le système de rapporteur double intègre un deuxième canal rapporteur fluorescent, les deux essais ont été convertis en essais d’isotypage pour mesurer simultanément les réponses IgG et IgM. La fonctionnalité de double rapporteur de l’analyseur de débit permet de présager des signaux fluorescents à partir de deux réactifs de détection de rapporteur pour chaque analyte dans le multiplex pour chaque échantillon, doublant ainsi les données générées par échantillon dans un essai. Pour le développement et l’optimisation des protocoles de test à double rapporteur, plusieurs colorants rapporteurs et anticorps de détection disponibles dans le commerce ont été évalués pour le nouveau canal RP2(figure 7 et figure 8)afin de déterminer la ou les meilleures options disponibles. L’anticorps anti-IgM conjugué avec le colorant rapporteur DL 405 n’a pas bien fonctionné dans le canal RP2 (Figure 7), de sorte que la biotine anti-IgG avec SASB a ensuite été évaluée pour détection dans le canal RP2 (Figure 8). Trois combinaisons de réactifs de détection RP1 et RP2 ont été comparées dans le test de neutralisation à double rapporteur(tableau 1 et figure 9)afin de déterminer les combinaisons les plus performantes pour la détection simultanée d’anticorps neutralisants IgG et IgM. Bien qu’il y ait eu des différences significatives dans l’intensité du signal entre le canal RP1 utilisant PE-anti IgM et le canal RP2 utilisant DL 549 anti-IgM, il n’y avait pas de différence significative dans la mesure du pourcentage d’inhibition de liaison par ACE2.
Plusieurs limites à la méthode actuelle et à la présente étude sont reconnues. Tout d’abord, les échantillons testés et utilisés dans le développement et l’optimisation de la méthode ont été limités à des ensembles de 8 à 11 échantillons. D’autres échantillons seront testés dans le cadre d’études approfondies pour vérifier que la méthode est entièrement optimisée. Deuxièmement, un nombre limité de fluorophores rapporteurs et de paires de rapporteurs ont été testés. Des tests supplémentaires de tous les rapporteurs disponibles dans toutes les combinaisons possibles détermineront quels réactifs peuvent être utilisés avec succès dans cette méthode. L’anticorps anti-IgG conjugué à la biotine était différent de l’anticorps anti-IgG conjugué au rapporteur BV 421. Ainsi, bien qu’il existe une variabilité de l’intensité du signal pour l’anti-IgG BV 421, elle pourrait être due à la spécificité de l’anticorps et non au colorant rapporteur. L’essai d’autres anticorps conjugués BV 421 disponibles peut identifier un autre anticorps qui fonctionnerait bien dans le canal RP2. Des études futures évalueront également la combinaison d’anti-IgM PE avec des IgG anti-humaines BV 421 pour la détection dans RP1 et RP2, respectivement. Enfin, même avec la capacité de double rapporteur de l’instrument, les essais sont limités à deux isotypes (deux paramètres) par réaction. Si des isotypes supplémentaires doivent être mesurés ou si un isotypage complet est souhaité, des réactions supplémentaires utilisant les deux mêmes canaux rapporteurs devront être exécutées dans des puits distincts.
La technologie de multiplexage à base de billes permet une conception de test rapide et flexible avec une mise en œuvre facile dans les flux de travail de laboratoire de routine3,4,10. Cette étude a démontré la facilité de transfert des tests sérologiques et de neutralisation 3Flex décrits précédemment pour le SARS-CoV-2 sur un système d’analyse de débit pour mesurer les IgG avec un seul rapporteur, ou avec une légère modification, mesurant simultanément les réponses IgG et IgM à l’aide de deux rapporteurs. L’option à double rapporteur présente des avantages évidents par rapport aux plates-formes de rapporteur unique, car elle peut fournir deux fois plus de données par échantillon, en utilisant la moitié du volume d’échantillon et la moitié du nombre de puits de réaction. Avec les colorants rapporteurs et les anticorps de détection appropriés, les tests d’isotypage peuvent être facilement développés et effectués sur l’instrument d’analyse de flux à double rapporteur.
Déclarations de divulgation
Stephen Angeloni et Sherry Dunbar sont des employés de Luminex Corporation qui produit certains des réactifs et des instruments utilisés dans cette étude. La publication en libre accès de cet article a été sponsorisée par Luminex Corporation
Remerciements
Ce rapport a été financé par Luminex Corporation (Austin, TX). Les auteurs remercient Matthew Silverman PhD (Biomedical Publishing Solutions, Delray Beach, FL) pour son aide à l’édition scientifique.
matériels
| Name | Company | Catalog Number | Comments |
| ACE2 (human) (rec.) | AdipoGen Life Sciences | AG-40B-0192-3050 | |
| Biotin-SP (long spacer) AffiniPure Goat Anti-Human IgG, Fcγ fragment specific | Jackson ImmunoResearch Laboratories | 109-065-098 | |
| Bovine Serum Albumin | MilliporeSigma | A7888 | Sigma-Aldrich |
| Branson 1800 Cleaner/water bath sonicator | Various | ||
| Brilliant Violet 421 AffiniPure Donkey Anti-Human IgG (H+L) | Jackson ImmunoResearch Laboratories | 709-675-149 | |
| Corning 96-well Black Flat Bottom Polystyrene NBS Microplate | Corning | 3650 | |
| Corning 96-well Microplate Aluminum Sealing Tape, Nonsterile | Corning | 6570 | |
| DyLight 405 AffiniPure Goat Anti-Human IgM, Fc5μ fragment specific | Jackson ImmunoResearch Laboratories | 109-475-043 | |
| DyLight 549 AffiniPure F(ab')2 Goat Anti-Human IgM Fc5μ specific | Jackson ImmunoResearch Laboratories | 109-506-129 | Discontinued but available from multiple vendors |
| eBioscience Streptavidin Super Bright 436 Conjugate | ThermoFisher Scientific | 62-4317-82 | |
| Fisherbrand Incubating Microplate Shaker | ThermoFisher Scientific | 02-217-757 | Fisher Scientific |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, PE | ThermoFisher Scientific | P-2771MP | |
| Luminex Magnetic Plate Separator | Luminex Corporation | CN-0269-01 | |
| MagPlex beads | Luminex Corporation | MC100XX-ID | |
| PE AffiniPure F(ab')2 Goat Anti-Human IgM Fc5μ specific | Jackson ImmunoResearch Laboratories | 109-116-129 | |
| Phosphate Buffered Saline | MilliporeSigma | P3813 | Sigma-Aldrich |
| SARS Nucleocapsid Protein Antibody | Novos Biologicals | NB100-56683 | Unconjugated, rabbit, polyclonal, Protein G purified |
| SARS Nucleocapsid Protein Antibody | Novos Biologicals | NB100-56049 | Unconjugated, rabbit, polyclonal, Protein A purified |
| SARS Spike Protein Antibody | Novos Biologicals | NB100-56047 | Unconjugated, rabbit, polyclonal, Protein G purified |
| SARS Spike Protein Antibody | Novos Biologicals | NB100-56048 | Unconjugated, rabbit, polyclonal, Protein G purified |
| SARS-CoV-2 (2019-nCoV) Spike S1 Antibody, Rabbit MAb | SinoBiological | 40150-R007 | |
| Sodium Azide | MilliporeSigma | S2002 | Sigma-Aldrich |
| Streptavidin, R-Phycoerythrin Conjugate (SAPE) | ThermoFisher Scientific | S21388 | premium grade |
| Tube Revolver/ Rotator | ThermoFisher Scientific | 88881001 | |
| TWEEN 20 | MilliporeSigma | P9416 | Sigma-Aldrich |
| xMAP Antibody Couplng Kit | Luminex Corporation | 40-50016 | |
| xMAP INTELLIFLEX DR-SE | Luminex Corporation | INTELLIFLEX-DRSE-RUO |
Références
- Cameron, A., et al. A multiplex microsphere IgG assay for SARS-CoV-2 using ACE2-mediated inhibition as a surrogate for neutralization. Journal of Clinical Microbiology. 59 (2), 02489 (2020).
- Waterboer, T., et al. Multiplex human papillomavirus serology based on in situ-purified glutathione s-transferase fusion proteins. Clinical Chemistry. 51 (10), 1845-1853 (2005).
- Pickering, J. W., et al. A multiplexed fluorescent microsphere immunoassay for antibodies to pneumococcal capsular polysaccharides. American Journal of Clinical Pathology. 117 (4), 589-596 (2002).
- Ayouba, A., et al. Development of a sensitive and specific serological assay based on Luminex technology for detection of antibodies to Zaire Ebola virus. Journal of Clinical Microbiology. 55 (1), 165-176 (2017).
- Hornbeck, P., Fleisher, T. A., Papadopoulos, N. M., Vastl, J. Isotype determination of antibodies. Current Protocols in Immunology. 116, 1-7 (2017).
- . Multiplex Bead Mixes Made Easy with an Excel-Based Bead Calculator Available from: https://www.luminexcorp.com/blog/mmultiplex-bead-mixes-made-easy-with-an-excel-based-bead-calculator/ (2020)
- EUA Authorized Serology Test Performance. FDA Available from: https://www.fda.gov/medical-devices/coronavirus-disease-2019-covid-19-emergency-use-authorizations-medical-devices/eus-authorized-serology-test-performance (2020)
- Indirect ELISA protocol. Abcam Available from: https://www.abcam.com/ps/pdf/protocols/Indirect%20ELISA%20protocol.pdf (2021)
- Baker, H. N., Murphy, R., Lopez, E., Garcia, C. Conversion of a capture ELISA to a Luminex xMAP assay using a multiplex antibody screening method. Journal of Visualized Experiments. (65), e4084 (2012).
- Pickering, J. W., Martins, T. B., Schroder, M. C., Hill, H. R. Comparison of a multiplex flow cytometric assay with enzyme-linked immunosorbent assay for auantitation of antibodies to tetanus, diphtheria, and Haemophilus influenzae Type b. Clinical and Diagnostic Laboratory Immunology. 9 (4), 872-876 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon