Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Acquisition de données normalisées pour l’imagerie par résonance magnétique sensible à la neuromélanine de la substance noire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole montre comment acquérir des données d’imagerie par résonance magnétique sensibles à la neuromélanine de la substance noire.
Résumé
Le système dopaminergique joue un rôle crucial dans la cognition saine (p. ex., l’apprentissage de récompense et l’incertitude) et les troubles neuropsychiatriques (p. ex., la maladie de Parkinson et la schizophrénie). La neuromélanine est un sous-produit de la synthèse de la dopamine qui s’accumule dans les neurones dopaminergiques de la substance noire. L’imagerie par résonance magnétique sensible à la neuromélanine (NM-IRM) est une méthode non invasive pour mesurer la neuromélanine dans ces neurones dopaminergiques, fournissant une mesure directe de la perte de cellules dopaminergiques dans la substance noire et une mesure indirecte de la fonction dopaminergique. Bien que l’IRM-NM se soit révélée utile pour étudier divers troubles neuropsychiatriques, elle est mise à l’épreuve par un champ de vision limité dans la direction inférieure-supérieure, ce qui entraîne la perte potentielle de données due à l’exclusion accidentelle d’une partie de la substance noire. En outre, le domaine ne dispose pas d’un protocole normalisé pour l’acquisition de données d’IRM-NM, une étape cruciale pour faciliter les études multicentriques à grande échelle et leur traduction en clinique. Ce protocole décrit une procédure étape par étape de placement du volume d’IRM-NM et des contrôles de qualité en ligne pour assurer l’acquisition de données de bonne qualité couvrant l’ensemble de la substance noire.
Introduction
La neuromélanine (NM) est un pigment foncé présent dans les neurones dopaminergiques de la substance noire (SN) et les neurones noradrénergiques du locus coeruleus (LC)1,2. Le NM est synthétisé par l’oxydation dépendante du fer de la dopamine cytosolique et de la noradrénaline et est stocké dans des vacuoles autophagiques dans le soma3. Il apparaît d’abord chez l’homme vers l’âge de 2-3 ans et s’accumule avec l’âge de 1,4,5.
Dans les vacuoles contenant NM des neurones SN et LC, NM forme des complexes avec le fer. Ces complexes NM-fer sont paramagnétiques, ce qui permet une visualisation non invasive de la MN à l’aide de l’imagerie par résonance magnétique (IRM)6,7. Les IRM qui peuvent visualiser la NM sont connues sous le nom d’IRM sensible à la NM (IRM-NM) et utilisent des effets de transfert d’aimantation directs ou indirects pour fournir un contraste entre les régions à forte concentration de NM (par exemple, le SN) et la substance blanche environnante 8,9.
Le contraste de transfert de magnétisation est le résultat de l’interaction entre les protons d’eau liés aux macromolécules (qui sont saturés par les impulsions de transfert de magnétisation) et les protons d’eau libre environnants. En NM-IRM, on pense que la nature paramagnétique des complexes NM-fer raccourcit le T1 des protons d’eau libre environnants, ce qui entraîne une réduction des effets de transfert d’aimantation, de sorte que les régions à concentration de NM plus élevée apparaissent hyperintenses sur les IRM-NM10. Inversement, la substance blanche entourant le SN a un contenu macromoléculaire élevé, ce qui entraîne de grands effets de magnétisation-transfert de sorte que ces régions apparaissent hypointenses sur les IRM-NM, offrant ainsi un contraste élevé entre le SN et la substance blanche environnante.
Dans le SN, l’IRM-NM peut fournir un marqueur de la perte de cellules dopaminergiques11 et de la fonction du système dopaminergique12. Ces deux processus sont pertinents pour plusieurs troubles neuropsychiatriques et sont soutenus par un vaste corpus de travaux cliniques et précliniques. Par exemple, des anomalies de la fonction dopaminergique ont été largement observées dans la schizophrénie; des études in vivo utilisant la tomographie par émission de positrons (TEP) ont montré une augmentation de la libération de dopamine striatale 13,14,15,16 et une augmentation de la capacité de synthèse de la dopamine 17,18,19,20,21,22 . En outre, des études post-mortem ont montré que les patients atteints de schizophrénie ont augmenté les niveaux de tyrosine hydroxylase – l’enzyme limitant le taux impliquée dans la synthèse de la dopamine – dans les noyaux gris centraux23 et SN24,25.
Plusieurs études ont étudié les modèles de perte de cellules dopaminergiques, en particulier dans la maladie de Parkinson. Des études post-mortem ont révélé que les neurones dopaminergiques pigmentés du SN sont le principal site de neurodégénérescence dans la maladie de Parkinson 26,27, et que, bien que la perte de cellules SN dans la maladie de Parkinson ne soit pas corrélée à la perte cellulaire dans le vieillissement normal28, elle est corrélée avec la durée de la maladie 29 . Contrairement à la plupart des méthodes d’étude du système dopaminergique, le caractère non invasif, la rentabilité et l’absence de rayonnement ionisant font de l’IRM-NM un biomarqueur polyvalent30.
Le protocole d’IRM-NM décrit dans cet article a été développé pour augmenter la reproductibilité de l’IRM-NM à la fois intra-sujet et entre les sujets. Ce protocole assure une couverture complète du SN malgré la couverture limitée des IRM-NM dans la direction inférieure-supérieure. Le protocole utilise des images tridimensionnelles (T1w) sagittales, coronales et axiales tridimensionnelles (3D) pondérées en T1, et les étapes doivent être suivies pour obtenir un placement correct de la pile de tranches. Le protocole décrit dans cet article a été utilisé dans de multiples études31,32 et a été largement testé. Wengler et coll. ont réalisé une étude sur la fiabilité de ce protocole dans laquelle des images d’IRM-NM ont été acquises deux fois chez chaque participant sur plusieurs jours32. Les coefficients de corrélation intra-classe ont démontré une excellente fiabilité test-retest de cette méthode pour les analyses basées sur la région d’intérêt (ROI) et voxelwise, ainsi qu’un contraste élevé dans les images.
Access restricted. Please log in or start a trial to view this content.
Protocole
REMARQUE: La recherche menée pour développer ce protocole a été réalisée conformément aux lignes directrices du conseil d’examen institutionnel de l’Institut psychiatrique de l’État de New York (IRB #7655). Un sujet a été scanné pour enregistrer la vidéo du protocole, et un consentement éclairé écrit a été obtenu. Reportez-vous au tableau des matériaux pour plus de détails sur le scanner IRM utilisé dans ce protocole.
1. Paramètres d’acquisition de l’IRM
- Préparez-vous à acquérir des images T1w haute résolution à l’aide d’une séquence d’écho à gradient d’acquisition rapide (MPRAGE) préparée par magnétisation 3D avec les paramètres suivants: résolution spatiale = 0,8 x 0,8 x 0,8 mm3; champ de vision (FOV) = 176 x 240 x 240 mm3; temps d’écho (TE) = 3,43 ms; temps de répétition (TR) = 2462 ms; temps d’inversion (TI) = 1060 ms; angle de retournement = 8°; facteur d’imagerie parallèle (ARC) dans le plan = 2; facteur d’imagerie parallèle (ARC) dans le plan transversal = 233; bande passante = 208 Hz/pixel; Temps total d’acquisition = 6 min 39 s.
- Préparer l’acquisition d’images IRM-NM à l’aide d’une séquence d’écho de rappel à gradient bidimensionnel (2D) avec contraste de transfert d’aimantation (2D GRE-MTC) avec les paramètres suivants : résolution = 0,43 x 0,43 mm2; champ de vision = 220 x 220 mm2; épaisseur de tranche = 1,5 mm; 20 tranches; écart de tranche = 0 mm; TE = 4,8 ms; TR = 500 ms; angle de retournement = 40°; bande passante = 122 Hz/pixel; Décalage de fréquence MT = 1,2 kHz; Durée de l’impulsion MT = 8 ms; Angle de retournement MT = 670°; nombre de moyennes = 5; Temps total d’acquisition = 10 min 4 s.
REMARQUE: Bien que les résultats affichés utilisent ces paramètres d’acquisition IRM, ce protocole est valide pour divers protocoles d’imagerie T1w et NM-IRM. Le protocole d’IRM-NM doit couvrir ~25 mm dans le sens inférieur-supérieur pour garantir une couverture complète du SN.
2. Placement du volume d’IRM-NM
- Acquérir une image T1w haute résolution (taille de voxel isotrope de ≤1 mm). Utilisez le reformatage en ligne directement après l’acquisition de l’image pour créer des images T1w haute résolution alignées sur la ligne de commissure antérieure-commissure postérieure (AC-PC) et la ligne médiane.
- Effectuer un reformatage en ligne à l’aide du logiciel fourni par le fournisseur (par exemple, si vous acquérez des données sur un scanner GE : reconstruction multiplanaire (MPR) en planification ; si vous acquérez des données sur un scanner Siemens : MPR dans la carte de tâches 3D ; si vous acquérez des données sur un scanner Philips : MPR dans le mode de rendu du package VolumeView).
- Créez des reconstructions multiplanaires de l’image 3D T1w dans le plan axial perpendiculaire à la ligne AC-PC pour couvrir tout le cerveau avec un minimum d’écart de tranche.
- Créez des reconstructions multiplanaires de l’image 3D T1w dans le plan coronal perpendiculaire à la ligne AC-PC pour couvrir l’ensemble du cerveau avec un minimum d’écart de tranche.
- Créer des reconstructions multiplanaires de l’image 3D T1w dans le plan sagittal parallèlement à la ligne AC-PC pour couvrir tout le cerveau avec un minimum d’écart de tranche.
- Effectuer un reformatage en ligne à l’aide du logiciel fourni par le fournisseur (par exemple, si vous acquérez des données sur un scanner GE : reconstruction multiplanaire (MPR) en planification ; si vous acquérez des données sur un scanner Siemens : MPR dans la carte de tâches 3D ; si vous acquérez des données sur un scanner Philips : MPR dans le mode de rendu du package VolumeView).
- Chargez les vues sagittale, coronale et axiale de l’image T1w haute résolution reformatée et assurez-vous que les lignes de référence représentant l’emplacement de chaque tranche affichée sont présentes.
- Identifier l’image sagittale qui montre la plus grande séparation entre le mésencéphale et le thalamus (Figure 1A). Pour ce faire, inspectez visuellement les tranches sagittales de l’image T1w reformatée jusqu’à ce que la tranche montrant cette plus grande séparation soit identifiée.
- À l’aide de l’image sagittale de la fin de l’étape 2.3, identifier visuellement le plan coronal qui délimite l’aspect le plus antérieur du mésencéphale (Figure 1B).
- À l’aide de l’image coronale de la fin de l’étape 2.4, identifier visuellement le plan axial qui délimite l’aspect inférieur du troisième ventricule (Figure 1C).
- Sur l’image sagittale de la fin de l’étape 2.3, aligner la limite supérieure du volume d’IRM-NM sur le plan axial identifié à l’étape 2.5 (Figure 1D).
- Déplacez la limite supérieure du volume d’IRM-NM de 3 mm dans la direction supérieure (Figure 1E).
- Aligner le volume de l’IRM-NM sur la ligne médiane des images axiales et coronales (Figure 1F).
- Acquérir les images NM-IRM.
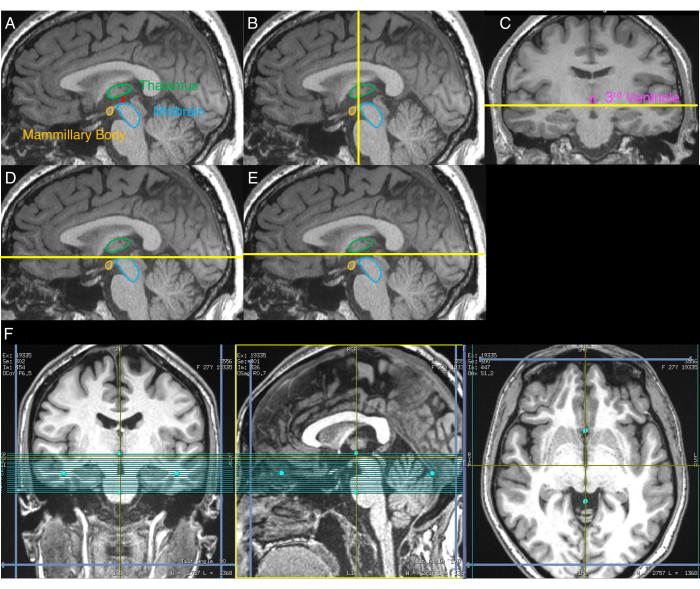
Figure 1 : Images montrant la procédure étape par étape de placement du volume NM-IRM. Les lignes jaunes indiquent l’emplacement des tranches utilisées pour le placement du volume tel que décrit dans le protocole. (A) Tout d’abord, l’image sagittale avec la plus grande séparation entre le mésencéphale et le thalamus est identifiée (étape 2.3 du protocole). (B) Deuxièmement, à l’aide de l’image de A, le plan coronal délimitant l’aspect le plus antérieur du mésencéphale est identifié (étape 2.4). (C) Troisièmement, sur l’image coronale du plan identifié en B, le plan axial délimitant la face inférieure du troisième ventricule est identifié (étape 2.5). (D) Quatrièmement, le plan axial identifié en C est affiché sur l’image sagittale de A (étape 2.6). (E) Cinquièmement, le plan axial de D est décalé de 3 mm dans la direction supérieure, et ce plan indique la limite supérieure du volume d’IRM-NM (étape 2.7). (F) Le placement final du volume d’IRM-NM où l’image coronale correspond à C, l’image sagittale correspond à A et l’image axiale correspond au plan axial dans E. Le volume d’IRM-NM est aligné sur la ligne médiane du cerveau dans les images coronales et axiales et la ligne AC-PC dans l’image sagittale (étape 2.8). Une partie de cette figure a été réimprimée avec la permission d’Elsevier à partir de 30. Abréviations : NM-IRM = imagerie par résonance magnétique sensible à la neuromélanine; AC-PC = commissure antérieure-commissure postérieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Contrôles de qualité
- S’assurer que les images d’IRM-NM acquises couvrent l’ensemble du SN et que le SN est visible dans les images centrales, mais pas dans les images les plus supérieures ou les plus inférieures du volume d’IRM-NM. Sinon, (Figure 2), répétez les étapes 2.3-2.9 pour vous assurer que le placement correct du volume de l’IRM-NM est correct. Si le participant a beaucoup bougé depuis l’acquisition du scan T1w haute résolution, répétez les étapes 2.1-2.9.
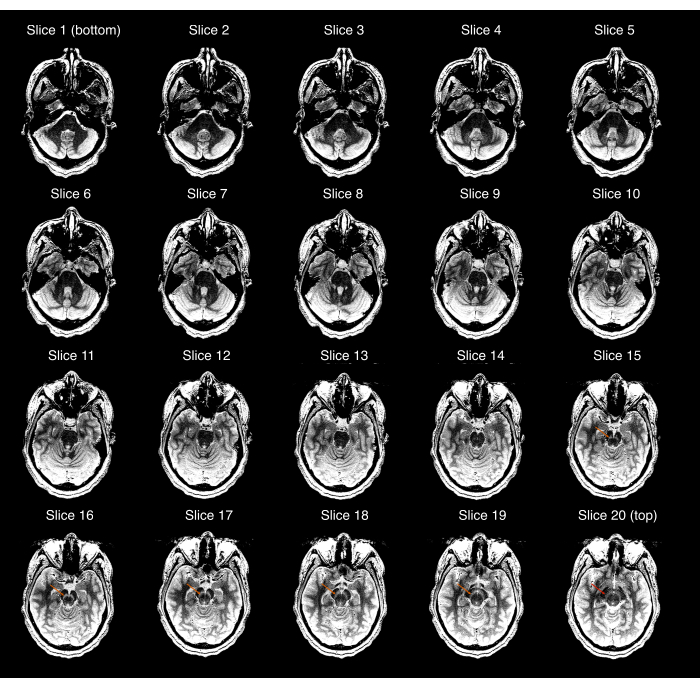
Figure 2 : Exemple d’acquisition d’IRM-NM qui a échoué au premier contrôle de la qualité (étape 3.1 du protocole). Chacune des 20 coupes d’IRM-NM affichées de la plus inférieure (image en haut à gauche) à la plus supérieure (image en bas à droite); La fenêtre/niveau de l’image a été réglée pour exagérer le contraste entre la Substantia nigra et le Crus cerebri. Les flèches orange dans les tranches 15-19 montrent l’emplacement de la substance noire dans ces tranches. La flèche rouge dans la tranche la plus supérieure (tranche 20) montre que la substance noire est toujours visible dans cette tranche, et donc, l’acquisition échoue au contrôle de qualité. Abréviation : NM-IRM = imagerie par résonance magnétique sensible à la neuromélanine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Vérifiez les artefacts, en particulier ceux qui traversent le SN et la substance blanche environnante, en inspectant visuellement chaque tranche de l’IRM-NM acquise.
- Recherchez les changements brusques de l’intensité du signal avec un motif linéaire qui ne respecte pas les limites anatomiques normales. Par exemple, cela peut apparaître comme une région de faible intensité flanquée de deux régions de haute intensité.
- Si l’artefact est le résultat de vaisseaux sanguins (Figure 3A), conservez les images IRM-NM, car ces artefacts seront probablement toujours présents.
- Si les artefacts sont le résultat d’un mouvement de la tête du participant (figure 3B), rappelez au participant de rester aussi immobile que possible et de réacquérir les images IRM-NM conformément à l’étape 3.2.5.
- Si les artefacts sont ambigus (figure 3C), réacquérir les images IRM-NM conformément à l’étape 3.2.5. Lors de la réacquisition, si les artefacts restent présents, procédez à ces images, car elles sont probablement biologiques plutôt que le résultat de problèmes d’acquisition.
- Si les images NM-IRM réussissent le contrôle qualité de l’étape 3.1, copiez le placement précédent du volume NM-IRM. Si les images IRM-NM échouent au contrôle de qualité à l’étape 3.1, répétez les étapes 2.3-2.9 pour vous assurer que le placement correct du volume de l’IRM-NM (ou les étapes 2.1-2.9 si le participant a déménagé de manière significative).

Figure 3 : Exemples d’acquisitions d’IRM-NM qui ont échoué au deuxième contrôle de la qualité (étape 3.2 du protocole). Une seule tranche représentative est affichée pour chaque cas. (A) Une acquisition d’IRM-NM qui échoue au contrôle de la qualité en raison d’un artefact de vaisseau sanguin (flèches rouges) qui est le résultat du vaisseau sanguin identifié par les flèches bleues. (B) Une acquisition d’IRM-NM qui échoue à la vérification de la qualité en raison d’artefacts de mouvement (flèches rouges). (C) Une acquisition d’IRM-NM qui échoue à la vérification du contrôle de la qualité en raison d’un artefact ambigu (flèches rouges). Abréviation : NM-IRM = imagerie par résonance magnétique sensible à la neuromélanine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
La figure 4 montre les résultats représentatifs d’une participante de 28 ans sans troubles psychiatriques ou neurologiques. Le protocole NM-IRM assure une couverture complète du SN, obtenue en suivant l’étape 2 du protocole décrit à la figure 1, et des images NM-IRM satisfaisantes en suivant l’étape 3 du protocole. On peut observer un excellent contraste entre le SN et les régions voisines de la substance blanche avec une concentration négligeable...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le système dopaminergique joue un rôle crucial dans la cognition saine et les troubles neuropsychiatriques. Le développement de méthodes non invasives pouvant être utilisées pour étudier de manière répétée le système dopaminergique in vivo est essentiel au développement de biomarqueurs cliniquement significatifs. Le protocole décrit ici fournit des instructions étape par étape pour l’acquisition d’images IRM-NM de bonne qualité du SN, y compris le placement du volume de l’IRM-NM et les con...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les Drs Horga et Wengler ont chacun déclaré avoir des brevets pour l’analyse et l’utilisation de l’imagerie de la neuromélanine dans les troubles du système nerveux central (WO2021034770A1, WO2020077098A1), concédés sous licence à Terran Biosciences, mais n’ont reçu aucune redevance.
Remerciements
Le Dr Horga a reçu le soutien du NIMH (R01-MH114965, R01-MH117323). Le Dr Wengler a reçu le soutien du NIMH (F32-MH125540).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 3T Magnetic Resonance Imaging | General Electric | GE SIGNA Premier with 48-channel head coil |
Références
- Zecca, L., et al. New melanic pigments in the human brain that accumulate in aging and block environmental toxic metals. Proceedings of the National Academy of Sciences of the United States of America. 105 (45), 17567-17572 (2008).
- Zucca, F. A., et al. The neuromelanin of human substantia nigra: physiological and pathogenic aspects. Pigment Cell Research. 17 (6), 610-617 (2004).
- Sulzer, D., et al. Neuromelanin biosynthesis is driven by excess cytosolic catecholamines not accumulated by synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 97 (22), 11869-11874 (2000).
- Cowen, D. The melanoneurons of the human cerebellum (nucleus pigmentosus cerebellaris) and homologues in the monkey. Journal of Neuropathology & Experimental Neurology. 45 (3), 205-221 (1986).
- Zecca, L., et al. The absolute concentration of nigral neuromelanin, assayed by a new sensitive method, increases throughout the life and is dramatically decreased in Parkinson's disease. FEBS Letters. 510 (3), 216-220 (2002).
- Sulzer, D., et al. Neuromelanin detection by magnetic resonance imaging (MRI) and its promise as a biomarker for Parkinson's disease. NPJ Parkinson's Disease. 4 (1), 11(2018).
- Zucca, F. A., et al. Neuromelanin organelles are specialized autolysosomes that accumulate undegraded proteins and lipids in aging human brain and are likely involved in Parkinson's disease. NPJ Parkinson's Disease. 4 (1), 17(2018).
- Chen, X., et al. Simultaneous imaging of locus coeruleus and substantia nigra with a quantitative neuromelanin MRI approach. Magnetic Resonance Imaging. 32 (10), 1301-1306 (2014).
- Sasaki, M., et al. Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson's disease. Neuroreport. 17 (11), 1215-1218 (2006).
- Trujillo, P., et al. Contrast mechanisms associated with neuromelanin-MRI. Magnetic Resonance in Medicine. 78 (5), 1790-1800 (2017).
- Kitao, S., et al. Correlation between pathology and neuromelanin MR imaging in Parkinson's disease and dementia with Lewy bodies. Neuroradiology. 55 (8), 947-953 (2013).
- Cassidy, C. M., et al. Neuromelanin-sensitive MRI as a noninvasive proxy measure of dopamine function in the human brain. Proceedings of the National Academy of Sciences of the United States of America. 116 (11), 5108-5117 (2019).
- Abi-Dargham, A., et al. Increased striatal dopamine transmission in schizophrenia: confirmation in a second cohort. American Journal of Psychiatry. 155 (6), 761-767 (1998).
- Laruelle, M., et al. Single photon emission computerized tomography imaging of amphetamine-induced dopamine release in drug-free schizophrenic subjects. Proceedings of the National Academy of Sciences of the United States of America. 93 (17), 9235-9240 (1996).
- Breier, A., et al. Schizophrenia is associated with elevated amphetamine-induced synaptic dopamine concentrations: evidence from a novel positron emission tomography method. Proceedings of the National Academy of Sciences of the United States of America. 94 (6), 2569-2574 (1997).
- Abi-Dargham, A., et al. Increased baseline occupancy of D-2 receptors by dopamine in schizophrenia. Proceedings of the National Academy of Sciences of the United States of America. 97 (14), 8104-8109 (2000).
- Hietala, J., et al. Presynaptic dopamine function in striatum of neuroleptic-naive schizophrenic patients. Lancet. 346 (8983), 1130-1131 (1995).
- Lindström, L. H., et al. Increased dopamine synthesis rate in medial prefrontal cortex and striatum in schizophrenia indicated by L-(β-11C) DOPA and PET. Biological Psychiatry. 46 (5), 681-688 (1999).
- Meyer-Lindenberg, A., et al. Reduced prefrontal activity predicts exaggerated striatal dopaminergic function in schizophrenia. Nature Neuroscience. 5 (3), 267-271 (2002).
- McGowan, S., Lawrence, A. D., Sales, T., Quested, D., Grasby, P. Presynaptic dopaminergic dysfunction in schizophrenia: a positron emission tomographic [18F] fluorodopa study. Archives of General Psychiatry. 61 (2), 134-142 (2004).
- Bose, S. K., et al. Classification of schizophrenic patients and healthy controls using [18F] fluorodopa PET imaging. Schizophrenia Research. 106 (2-3), 148-155 (2008).
- Kegeles, L. S., et al. Increased synaptic dopamine function in associative regions of the striatum in schizophrenia. Archives of General Psychiatry. 67 (3), 231-239 (2010).
- Toru, M., et al. Neurotransmitters, receptors and neuropeptides in post-mortem brains of chronic schizophrenic patients. Acta Psychiatrica Scandinavica. 78 (2), 121-137 (1988).
- Perez-Costas, E., Melendez-Ferro, M., Rice, M. W., Conley, R. R., Roberts, R. C. Dopamine pathology in schizophrenia: analysis of total and phosphorylated tyrosine hydroxylase in the substantia nigra. Frontiers in Psychiatry. 3, 31(2012).
- Howes, O. D., et al. Midbrain dopamine function in schizophrenia and depression: a post-mortem and positron emission tomographic imaging study. Brain. 136 (11), 3242-3251 (2013).
- Bernheimer, H., Birkmayer, W., Hornykiewicz, O., Jellinger, K., Seitelberger, F. Brain dopamine and the syndromes of Parkinson and Huntington Clinical, morphological and neurochemical correlations. Journal of the Neurological Sciences. 20 (4), 415-455 (1973).
- Hirsch, E., Graybiel, A. M., Agid, Y. A. Melanized dopaminergic neurons are differentially susceptible to degeneration in Parkinson's disease. Nature. 334 (6180), 345(1988).
- Fearnley, J. M., Lees, A. J. Ageing and Parkinson's disease: substantia nigra regional selectivity. Brain. 114 (5), 2283-2301 (1991).
- Damier, P., Hirsch, E., Agid, Y., Graybiel, A. The substantia nigra of the human brain: II. Patterns of loss of dopamine-containing neurons in Parkinson's disease. Brain. 122 (8), 1437-1448 (1999).
- Horga, G., Wengler, K., Cassidy, C. M. Neuromelanin-sensitive magnetic resonance imaging as a proxy marker for catecholamine function in psychiatry. JAMA Psychiatry. 78 (7), 788-789 (2021).
- Wengler, K., et al. Cross-scanner harmonization of neuromelanin-sensitive MRI for multisite studies. Journal of Magnetic Resonance Imaging. , (2021).
- Wengler, K., He, X., Abi-Dargham, A., Horga, G. Reproducibility assessment of neuromelanin-sensitive magnetic resonance imaging protocols for region-of-interest and voxelwise analyses. NeuroImage. 208, 116457(2020).
- Griswold, M. A., et al. Generalized autocalibrating partially parallel acquisitions (GRAPPA). Magnetic Resonance in Medicine. 47 (6), 1202-1210 (2002).
- vander Pluijm, M., et al. Reliability and reproducibility of neuromelanin-sensitive imaging of the substantia nigra: a comparison of three different sequences. Journal of Magnetic Resonance Imaging. 53 (5), 712-721 (2020).
- Cassidy, C. M., et al. Evidence for dopamine abnormalities in the substantia nigra in cocaine addiction revealed by neuromelanin-sensitive MRI. American Journal of Psychiatry. 177 (11), 1038-1047 (2020).
- Wengler, K., et al. Association between neuromelanin-sensitive MRI signal and psychomotor slowing in late-life depression. Neuropsychopharmacology. 46, 1233-1239 (2020).
- Biondetti, E., et al. Spatiotemporal changes in substantia nigra neuromelanin content in Parkinson's disease. Brain. 143 (9), 2757-2770 (2020).
- Shibata, E., et al. Use of neuromelanin-sensitive MRI to distinguish schizophrenic and depressive patients and healthy individuals based on signal alterations in the substantia nigra and locus ceruleus. Biological Psychiatry. 64 (5), 401-406 (2008).
- Fabbri, M., et al. Substantia nigra neuromelanin as an imaging biomarker of disease progression in Parkinson's disease. Journal of Parkinson's Disease. 7 (3), 491-501 (2017).
- Matsuura, K., et al. Neuromelanin magnetic resonance imaging in Parkinson's disease and multiple system atrophy. European Neurology. 70 (1-2), 70-77 (2013).
- Watanabe, Y., et al. Neuromelanin magnetic resonance imaging reveals increased dopaminergic neuron activity in the substantia nigra of patients with schizophrenia. PLoS One. 9 (8), 104619(2014).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon