Method Article
Un test in vitro pour étudier la migration plaquettaire à l’aide de câbles avidine-biotine fonctionnalisés par RGD
Dans cet article
Résumé
Un protocole détaillé pour l’imagerie de plaquettes migrantes uniques à l’aide de sattaches avidine-biotine fonctionnalisées par RGD avec une densité ajustable est fourni, révélant que les plaquettes génèrent suffisamment de force pour rompre la liaison avidine-biotine.
Résumé
Bien qu’il s’agisse de fragments cellulaires anulés, les plaquettes sont aujourd’hui largement reconnues pour leurs capacités à multiples facettes. Non seulement ils forment des caillots sanguins pour prévenir les saignements après une blessure, mais ils combattent également les infections et maintiennent l’intégrité vasculaire pendant les maladies inflammatoires. Alors que les bouchons hémostatiques nécessitent l’activation et l’agrégation collectives des plaquettes, leur rôle dans la protection des vaisseaux sanguins enflammés est joué au niveau de la cellule unique. Dans ce contexte, des données récentes ont montré que les plaquettes peuvent migrer de manière autonome, un processus dépendant de la mécanodétection de leur environnement adhésif. Ici, un protocole détaillé pour l’imagerie de la migration plaquettaire unique est présenté, utilisant un système de revêtement à trois couches composé d’un squelette de poly-L-lysine greffé de poly(éthylène glycol) (PLL-PEG)-biotine (1), d’un linker avidine fluorescent (2) et de Arg-Gly-Asp cyclique de biotine (cRGD) (3) comme motif de liaison à l’intégrine plaquettaire. Cette approche réductionniste permet un contrôle précis des propriétés d’adhésion du substrat et sert de test in vitro simple et standardisé pour étudier les mécanismes sous-jacents à la migration plaquettaire. Les résultats indiquent que les plaquettes migrantes qui se lient à la cRGD exercent des forces capables de perturber la liaison avidine-biotine. De plus, la densité de la biotine-cRGD influence de manière significative la propagation et la migration des plaquettes.
Introduction
Les plaquettes sont de petits fragments de cellules anulcléées dérivées de mégacaryocytes dans la moelle osseuse. Les plaquettes activées s’assemblent en agrégats qui forment la base d’un caillot sanguin pour sceller les lésions vasculaires dans l’hémostase physiologique ou pour occlure les vaisseaux sanguins malades dans la thrombose pathologique1. Au cours des dernières décennies, cependant, il est devenu clair que les plaquettes jouent également un rôle central dans la physiopathologie de l’inflammation, de l’infection et de la malignité, où les interactions multiformes avec les cellules immunitaires, les cellules cancéreuses et les agents pathogènes envahissants sont essentielles pour façonner la réponse immunitaire de l’hôte 2,3. Des données récentes ont montré que les plaquettes ont la capacité de migrer de manière autonome4. En réponse à la bactériémie systémique, les plaquettes sont recrutées dans les sinusoïdes hépatiques, où elles adhèrent et migrent. La migration permet aux plaquettes de capturer et de lier les bactéries, ce qui favorise l’activation des leucocytes. Notamment, les plaquettes restent intravasculaires pendant ce processus et ne migrent pas vers le tissu sous-endothélial4. De plus, les plaquettes sont des sentinelles de l’inflammation vasculaire, scannant les vaisseaux sanguins enflammés à la recherche de micro-lésions causées par l’extravasation des cellules immunitaires5 et utilisant la migration pour protéger les vaisseaux sanguins enflammés 6,7. Ici, les plaquettes utilisent leurs intégrines pour lier le fibrinogène déposé sur l’endothélium enflammé. Les plaquettes forment alors des protubérances lamellipodiales qui leur permettent de scanner les propriétés adhésives de leur environnement. Les plaquettes se polarisent ensuite et migrent vers des densités plus élevées de fibrinogène, un processus connu sous le nom d’haptotaxie. La migration dirigée des plaquettes favorise finalement le positionnement au niveau des microlésions endothéliales qui empêchent les saignements dans les tissus enflammés, y compris les muscles et les poumons.
La migration plaquettaire dépend de manière critique des propriétés mécaniques du substrat adhésif 4,8. La tâche de détection et de transduction des propriétés mécaniques de l’environnement est principalement médiée par les récepteurs de l’intégrine, qui sont des protéines hétérodimériques transmembranaires composées d’une sous-unité α et β, le domaine extracellulaire se liant au ligand sur la matrice extracellulaire et le domaine intracellulaire se liant au cytosquelette d’actine via des protéines adaptatrices 9,10. L’intégrine plaquettaire la plus abondante est αIIbβ3, et son ligand majeur est la fibrine (ogène)11. L’engagement intégrine-ligand déclenche des événements de signalisation qui culminent dans la formation d’un lamellipodium entraîné par Arp2/3 qui forme le bord d’attaque d’une plaquetteadhérente 7. Les plaquettes adhérentes sondent instantanément les propriétés mécaniques de leur environnement adhésif en tirant dessus4. Lorsque les forces de traction dépendantes de la myosine IIa l’emportent sur la stabilité mécanique de la matrice extracellulaire (par exemple, la fibrine(ogène)), les plaquettes rompent mécaniquement les ligands affaiblis et utilisent leurs protubérances lamellipodiales pour scanner le microenvironnement à la recherche de ligands adhésifs, établir de nouvelles liaisons de substrat et migrer loin de l’environnement appauvri en ligands6. La migration cellulaire entraînée par la déplétion mécanique non protéolytique des ligands est susceptible de jouer un rôle au-delà de la fonction plaquettaire, car elle semble être un phénomène général observé dans les cellules capables de remodeler mécaniquement leur matrice adhésive8. Le taux d’appauvrissement des ligands détermine la vitesse de migration et dépend à la fois de la stabilité des ligands et de la densité des ligands du substrat8. Les plaquettes à faible densité de ligands sont capables de perturber mécaniquement les ligands d’intégrine modifiés (Arg-Gly-Asp cyclique (cRGD))6,7 liés à des lamelles de verre avec des attaches de biotine-avidine ayant une force de déliaison d’environ 160 piconewtons (pN)12,13,14,15.
Ici, ces observations sont exploitées pour développer un protocole in vitro simple permettant de générer des surfaces adhésives ligand-labiles, facilitant ainsi l’étude des mécanismes de migration plaquettaire. Le revêtement adhésif décrit dans ce protocole se compose de trois éléments essentiels : (1) un squelette PLL-PEG-biotine et (2) un linker neutravidin-fluorescéine isothiocyanate (NA-FITC) qui facilite la liaison (3) de la biotine-cRGD (un ligand adhésif) au squelette PLL-PEG-biotine (voir également la figure 1B). La stabilité de cette construction dépend de la force de la liaison biotine-avidine, qui peut se rompre soit à l’interface (A) PLL-PEG-biotine-NA-FITC soit (B) FITC-NA-biotine-cRGD. De plus, la densité des ligands adhésifs peut être ajustée en adaptant le rapport PLL-PEG-biotine à PLL-PEG dans la couche inférieure. La rupture de la liaison (A) entraîne la libération de FITC à partir du revêtement, entraînant une diminution du signal de fluorescence sous les plaquettes en migration. L’ensemble du revêtement décrit dans ce protocole permet donc un réglage précis des propriétés mécaniques et adhésives du substrat et fournit une lecture facile par fluorescence de la migration plaquettaire.
Protocole
Les expériences sur les animaux menées dans le cadre de cette étude ont été réalisées dans le respect de toutes les réglementations éthiques pertinentes pour les études sur des souris et ont été approuvées par la législation locale sur la protection des animaux (Regierung von Oberbayern, Munich, 190-15, 2015). Des souris C57BL/6 femelles et mâles, âgées de 8 à 10 semaines (poids corporel de 20 à 25 g), ont été utilisées dans cette étude. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans le tableau des matériaux.
1. Revêtement biotine-neutravidine-biotine cRGD
- Lamelles en verre soniquate (24 mm x 24 mm ; # 1,5) à 20 % de HNO3 pendant 1 min, suivie d’une sonication à l’isopropanol, à l’éthanol et au H2O pendant 1 min. Après chaque sonication, rincez abondamment les lamelles à l’eau distillée (jjH2O) et enfin séchez-les dans l’incubateur.
- Traitez les lamelles prénettoyées avec du plasma O2 dans un nettoyeur plasma pendant 2 min, puis assemblez-les avec des lames collantes comme décrit précédemment16. Les lames collantes et les lamelles en verre formeront un canal entre elles (comme le montre la figure 1A).
REMARQUE : Un traitement au plasma efficace est important. Utilisez O2 comme source de plasma. - Remplissez le canal avec 2,5 μL de PLL-PEG-biotine (1 mg/mL) dilué dans 97,5 μL de PLL-PEG (1 mg/mL) et incubez pendant 30 min à température ambiante (RT), puis lavez trois fois avec du PBS. La biotine PLL-PEG se lie à la neutravidine à l’étape suivante, tandis que le squelette PLL-PEG forme un substrat inerte qui empêche la liaison non spécifique des protéines et des plaquettes.
REMARQUE : La concentration de PLL-PEG-biotine dans les solutions d’enrobage définit la densité finale des ligands cRGD. - Ajouter 100 μL de Neutravidin-FITC (25 μg/mL) et incuber pendant 30 minutes dans l’obscurité à RT, puis laver trois fois avec du PBS.
REMARQUE : Ajustez la concentration de Neutravidin-FITC à la concentration de biotine PLL-PEG-. Augmentez la concentration de neutravidines-FITC si des densités plus élevées de PLL-PEG-biotine sont enrobées. - Ajouter 100 μL de cyclo [Arg-Gly-Asp-D-Phe-Lys (Biotin-PEG-PEG)] (cRGD-biotine) (0,1-1 μM), incuber pendant 30 min à RT et laver trois fois avec du PBS. Les lamelles sont prêtes à l’emploi. Un schéma du revêtement est illustré à la figure 1B.
2. Isolement des plaquettes de souris à partir du sang
- Préparez le tampon de Tyrode modifié, qui contient 136,9 mM de NaCl, 12,1 mM de NaHCO3, 2,6 mM de KCl, 5,5 mM de glucose, 10 mM de HEPES, et ajustez le pH à 7,4 et 6,5.
- Anesthésier les souris (conformément aux protocoles approuvés par l’établissement) par injection intrapéritonéale de 0,5 mg/kg de fentanyl, de 5 mg/kg de midazolam et de 0,05 mg/kg de médétomidine. Après avoir confirmé la profondeur de l’anesthésie par pincement des orteils, retirez la peau thoracique avec des ciseaux.
- Préparez une seringue de 2 mL (aiguille de 26 g) avec 150 μL d’acide-citrate-dextrose (ACD) comme anticoagulant. Insérez l’aiguille entre la deuxième et la troisième côte sur le côté gauche du sternum pour prélever le sang du cœur. Ensuite, euthanasiez la souris par luxation cervicale.
REMARQUE : (1) Composition du tampon ACD : 85 mM de citrate de sodium tribasique déshydraté et 65 mM d’acide citrique monohydraté dans 111 mM de glucose. (2) La prise de sang doit être effectuée en douceur pour éviter toute formation de caillot. Environ 1 ml de sang peut être obtenu à partir de souris âgées de 8 à 10 semaines. - Mélangez le sang avec 1 ml de tampon Tyrode (pH 6,5) dans un tube FACS (polystyrène à fond rond) de 5 ml, et centrifugez à 70 x g pendant 20 min à RT avec le frein éteint.
- Après centrifugation, prélever la partie supérieure (environ 1 mL) contenant du plasma riche en plaquettes (PRP). Mélanger avec 3 ml de tampon Tyrode (pH 6,5) et ajouter 100 ng/mL de prostacycline (IGP2) pour prévenir l’activation plaquettaire.
- Centrifuger à 1200 x g pendant 5 min à RT, jeter le surnageant, remettre la pastille en suspension dans 500 μL de tampon de Tyrode (pH 6,5) et mesurer la numération plaquettaire à l’aide d’un hémocytomètre.
3. Migration plaquettaire de souris sur un revêtement cRGD biotine-neutravidine-biotine
- Complétez le tampon de Tyrode modifié (pH 7,4) avec 10 x 103/μL de plaquettes de souris, 1 mM de CaCl2, 2 μM d’U46619 et 4 μM de sel sodique d’adénosine 5′-diphosphate (ADP), et pipetez un volume total de 240 μL dans les canaux préparés à l’étape 1.
- Enregistrez la migration des plaquettes vivantes à l’aide d’un microscope inversé équipé d’un incubateur à étages. Vous pouvez également incuber le canal pendant 1 h à 37 °C dans un incubateur.
- Fixez l’échantillon avec du paraformaldéhyde à 4 % pendant 10 minutes à RT et lavez-le cinq fois avec du PBS.
- Perméabiliser les plaquettes avec du Triton-X (0,2 % dans le PBS) pendant 5 min, et les laver cinq fois avec du PBS.
- Diluez 2,5 μL de phalloïdine Alexa Fluor 594 (40x stock méthanolique) dans 100 μL de PBS. Incuber avec des plaquettes pendant 30 minutes à la tombée de la nuit, puis laver cinq fois avec du PBS.
- Imagez les lames au microscope à fluorescence.
4. Quantification
REMARQUE : Les plaquettes qui forment des filopodes (protubérances en forme de doigts) ou des lamellipodes (protubérances en forme de feuilles) ont été comptées comme des plaquettes adhérentes4. Les plaquettes dont la distance de migration est supérieure à un de son diamètre ont été définies comme des plaquettes migratrices.
- Fraction des plaquettes migrantes : Comptez les nombres d’adhésion ou de migration des plaquettes à l’aide de l’outil MultiPoint aux Fidji. Cliquez avec le bouton droit de la souris sur le menu déroulant de l’outil Point dans la barre d’outils pour sélectionner l’outil Multipoint . Calculez la fraction de plaquettes migratrices en divisant le nombre de plaquettes migrantes par le nombre de plaquettes adhésives.
- Distance moyenne de migration : Extrayez la distance de migration à partir d’échantillons fixes en mesurant la longueur du chemin de migration « imprimé » dans l’enrobage de neutravidine-FITC à l’aide de l’outil de ligne à main levée . Cliquez avec le bouton droit de la souris sur le menu déroulant de Ligne droite dans la barre d’outils pour sélectionner l’outil Ligne à main levée .
- Descripteurs de forme plaquettaire : générez des masques binaires en segmentant des plaquettes fluorescentes (Alexa594-Phalloidin) à l’aide de la fonction Threshold . Sélectionnez Image > Ajuster > seuil dans la barre d’outils.
- Des descripteurs de forme tels que l’aire, le périmètre, la circularité et le rapport d’aspect peuvent être obtenus dans l’analyse des particules. Sélectionnez des descripteurs de forme dans Analyser > Définir des mesures, puis sélectionnez Afficher les résultats dans Analyser > Analyser des particules.
Résultats
Les plaquettes activées adhèrent et se propagent facilement sur des lames enrobées de PLL-PEG-biotine-neutravidine-FITC-biotine-cRGD (figure 1C et figure 2A ; 0 min et 5 min) et se polarisent ensuite en formant un lamellipodium sur le bord d’attaque (figure 2A ; 10 min). Au cours de ce processus, le pseudonoyau (zone sombre au centre des plaquettes) s’est déplacé du centre vers l’arrière des plaquettes (Figure 2A). Les plaquettes polarisées commencent alors à migrer sans directionnalité évidente (Figure 2A ; 15 min et 20 min et Figure 2B). Nous avons observé que les plaquettes migrant sur les revêtements PLL-PEG-biotine-neutravidine-FITC-biotine-cRGD peuvent rompre la liaison neutravidine-FITC-biotine-PLL-PEG, comme en témoigne la réduction de l’intensité de fluorescence le long de la voie de migration (Figure 1C et Figure 2A,B). De plus, le complexe perturbé neutravidine-FITC-biotine-cRGD s’accumule à la surface des plaquettes (Figure 2A,B). Ce phénomène est similaire aux résultats précédents où les plaquettes migratrices ont retiré le fibrinogène du substrat et l’ont accumulé dans leur système canaliculaire ouvert (OCS)4.
Pour étudier comment la densité des ligands influence la migration plaquettaire, la densité cRGD a été ajustée en faisant varier le rapport entre PLL-PEG-biotine et PLL-PEG dans la première couche de revêtement. Ces données révèlent que les plaquettes de souris atteignent une migration optimale à une concentration de 2,5 % de biotine PLL-PEG. La migration est réduite à des concentrations plus faibles (1 %) et plus élevées (10 %) de PLL-PEG-biotine (figures 3A, B). Ces changements de comportement migratoire dépendant du substrat s’accompagnent d’altérations de la morphologie plaquettaire (Figure 3C). À de faibles densités de ligands (1 %), les plaquettes ne se propagent pas adéquatement, comme en témoigne une faible projection de la surface et du périmètre plaquettaires (Figure 3C). Cela suggère une activation insuffisante de l’intégrine et une signalisation de l’extérieur vers l’intérieur7. Par conséquent, les plaquettes sont incapables d’exercer des forces sur les ligands cRGD, ne parviennent pas à remodeler le substrat et ne migrent pas (Figure 3A,B).
À une densité de ligands intermédiaire (2,5 %), il y a une augmentation significative de la surface et du périmètre des plaquettes (Figure 3C). Les plaquettes se propagent efficacement, perturbant mécaniquement les ligands labiles de la cRGD, et migrent (Figure 3A,B). Cependant, à des densités de ligands élevées (10 %), bien que l’étalement augmente, les plaquettes ne se polarisent pas, ce qui est indiqué par un rapport d’aspect réduit (Figure 3C). Dans ces conditions, les plaquettes restent attachées au substrat collant et ne migrent pas car elles ne peuvent pas rompre les ligands labiles cRGD (Figure 3A,B).
Ces résultats démontrent que la migration plaquettaire dépend de manière critique des propriétés adhésives du substrat. Les plaquettes ne peuvent migrer que lorsqu’elles s’engagent suffisamment avec les ligands adhésifs et génèrent simultanément des forces de traction suffisamment fortes pour surmonter la tolérance à la tension du substrat adhésif 4,6,7,8.
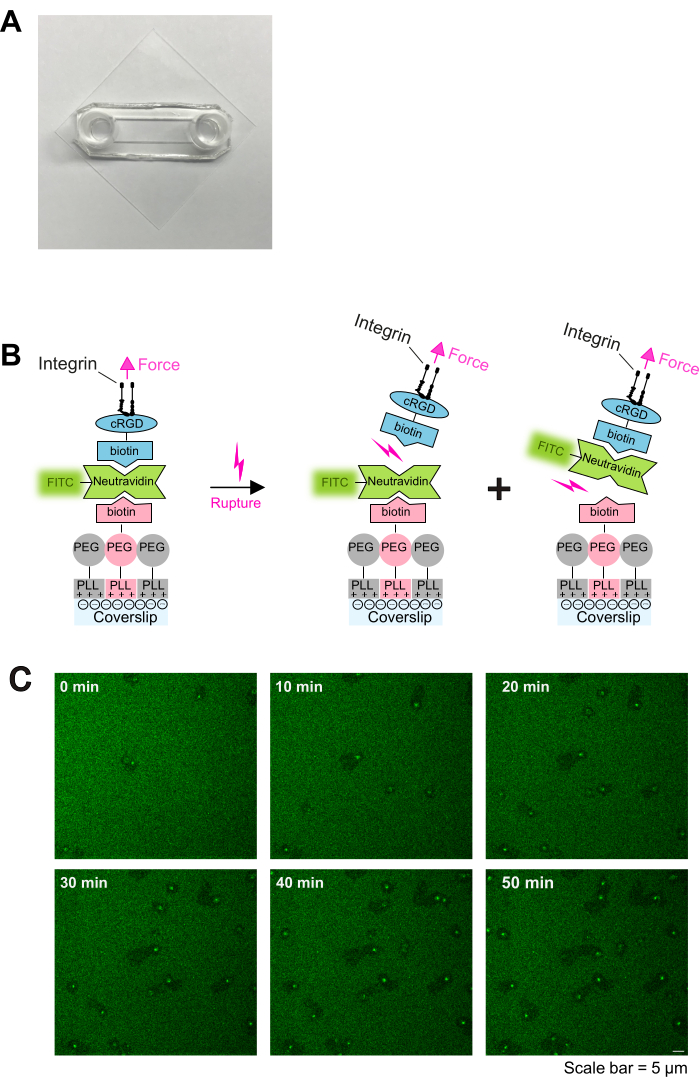
Figure 1 : Procédure d’enrobage et imagerie en direct de l’interaction plaquettes-substrat. (A) Photographie de la chambre assemblée. B) Principe du protocole. À gauche : Schéma du revêtement. Les lamelles de recouvrement en verre traité au plasma ont été recouvertes de trois couches. La première couche est le mélange de PLL-PEG et de PLL-PEG-biotine (le squelette PLL-PEG est inerte aux cellules et empêche la liaison non spécifique). La deuxième couche est constituée de neutravidine-FITC, et la troisième couche est de biotine-cRGD. Neutravidin-FITC fait le lien entre la PLL-PEG-biotine et la biotine-cRGD. Les plaquettes se lient à la biotine-cRGD via les intégrines dans la membrane plasmique. À droite : Illustration de la déliaison de la biotine-avidine par les intégrines plaquettaires. Les plaquettes exercent des forces sur le substrat par l’engagement de l’intégrine-cRGD et rompent soit la liaison supérieure cRGD-biotine - neutravidine-FITC - soit la liaison inférieure neutravidine-FITC - PLL-PEG-biotine. La rupture de la liaison inférieure entre la neutravidine-FITC et la biotine-PLL-PEG entraîne une réduction du signal fluorescent, tandis que la rupture de la liaison supérieure entre la biotine-cRGD et la neutravidine-FITC ne le fait pas. (C) Séries chronologiques montrant la migration plaquettaire et l’épuisement des ligands labiles cRGD. Les zones de fluorescence réduite indiquent les voies de migration des plaquettes (voir également la figure 2A), et les zones de fluorescence accrue indiquent l’accumulation de FTIC-neutravidine-biotine-cRGD sur les plaquettes en migration. Barre d’échelle : 5 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Imagerie par immunofluorescence de la migration plaquettaire codée par le substrat remodelé. (A) Séquence vidéo représentative de la migration plaquettaire unique. À gauche : Images en contraste de phase de plaquettes en migration. Les plaquettes se polarisent en formant un lamellipodium sur le bord d’attaque et migrent par la suite. À droite : La neutravidine-FITC a été retirée du substrat, laissant l’empreinte de la migration plaquettaire. La rupture cRGD-biotine-neutravidine-FITC s’accumule au centre des plaquettes en migration. (B) Images représentatives de la migration plaquettaire sur des revêtements ligands labiles cRGD-biotine-avidine. Supérieur : Les plaquettes colorées à la phalloïdine (Alexa FluorTM 594) présentaient une formation de lamellipodiums importants et une forme polarisée rappelant les plaquettes migratrices. Les plaquettes en migration rompent la liaison cRGD-biotine-neutravidine-FITC, générant des voies de migration sur le substrat indiquées par un signal FITC réduit. Bas : image recadrée avec un grossissement plus grand. (C) Les traces de migration ont été tracées manuellement aux Fidji avec des lignes jaunes. Barres d’échelle : 5 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Le rapport entre la PLL-PEG-biotine et la PLL-PEG détermine la migration et la forme des plaquettes. (A) Images représentatives des plaquettes sur des revêtements PLL-PEG-biotine à 1 %, 2,5 % et 10 %, barre d’échelle : 5 μm. (B) Quantification de l’adhésion plaquettaire, de l’efficacité de la migration et de la distance de migration, n = 4 expériences indépendantes ; Moyenne/ET ; ANOVA/Tukey à un facteur ; **p < 0,01 ; p < 0,001 ; p < 0,0001, ns : non significatif (C) Quantification des descripteurs de forme plaquettaire (aire, périmètre, circularité et rapport d’aspect), n = 4 expériences indépendantes ; Moyenne/Min-Max ; ANOVA/Tukey à un facteur ; **p < 0,01 ; p < 0,001 ; p < 0,0001, ns : non significatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans ce protocole, une procédure d’enrobage à trois couches est présentée composée de (1) un squelette PLL-PEG-biotine et (2) un linker neutravidin-FITC qui facilite la liaison de (3) biotine-cRGD (un ligand adhésif) au squelette PLL-PEG-biotine (voir également la figure 1B) qui permet un réglage précis des propriétés mécaniques et adhésives du substrat en faisant varier le rapport PLL-PEG-biotine à PLL-PEG et fournit une lecture facile par fluorescence de la migration plaquettaire. Bien que ce protocole utilise la neutravidine conjuguée à la FITC et la phalloïdine conjuguée à l’Alexa Fluor 594 pour suivre la migration et la forme des plaquettes, d’autres avidines et phalloïdines conjuguées au fluorophore peuvent être utilisées. Étant donné que tous les réactifs d’enrobage, y compris PLL-PEG, PLL-PEG-biotine, neutravidin-FITC et cRGD-biotine, ainsi que les activateurs plaquettaires sont disponibles dans le commerce, cette expérience peut être réalisée sans trop d’effort supplémentaire. L’étape critique est le traitement au plasma, car un traitement au plasma inefficace entraîne une liaison inadéquate de la biotine PLL-PEG/PLL-PEG-au substrat, entraînant une défaillance de l’adhésion et de la migration des plaquettes. Les performances du nettoyeur plasma sont importantes. En général, les nettoyeurs plasma équipés de générateurs de 13,6 MHz sont plus performants que ceux de 40 KHz ou 100 KHz. De plus, une source de plasma d’oxygène est plus appropriée que l’air ambiant. Après un traitement au plasma réussi, les étapes de revêtement ne sont presque pas sujettes à des erreurs.
Il a déjà été démontré que les plaquettes utilisent le mode de migration mésenchymateux, qui dépend fortement des adhérences du substrat 4,17. À l’instar des fibroblastes, les faibles densités de ligands entravent la migration lorsque les plaquettes peinent à adhérer au substrat, tandis que les densités élevées de ligands entravent la migration en empêchant le désengagement des adhérences des fermes18 (Figure 3). À des densités intermédiaires, les plaquettes adhèrent tandis que les forces de traction dépendantes de la myosine IIA par liaison intégrine sont encore suffisantes pour briser les adhésions. Il convient de noter que la forte affinité entre l’intégrine αIIbβ3 et son ligand fibrine (ogène) entraîne le désassemblage des adhérences non pas par la libération du ligand adhésif, mais plutôt par sa rupture ou son détachement du substrat sous-jacent, tel que les cellules endothéliales in vivo ou les lamelles in vitro 4,6. La force de déliaison nécessaire pour détacher le fibrinogène du substrat sous-jacent est fortement influencée par des propriétés physiques et (bio-)chimiques qui sont souvent difficiles à contrôler, ce qui peut entraîner une variabilité significative de l’efficacité de la migration. Le test présenté ici propose une approche réductionniste pour résoudre ce problème. Cependant, la force de rupture de la liaison avidine-biotine est fixée à environ 160 pN, de sorte que des capteurs de tension plus sophistiqués, tels que ceux basés sur une attache d’ADN double brin, doivent être utilisés pour étudier l’adhésion plaquettaire à des régimes de force plus faibles19.
Des études antérieures ont montré que la migration plaquettaire est impliquée dans l’infection bactérienne et l’inflammation vasculaire in vivo. Par conséquent, les plaquettes présentant des défauts de migration, tels qu’une altération de la contractilité de la myosine, une polymérisation de l’actine ou une signalisation de l’intégrine de l’extérieur vers l’intérieur, présentent une clairance bactérienne et une intégrité vasculaire altérées 4,6,7. Le test présenté ici est simple, stable et, par conséquent, adapté au criblage des inhibiteurs de petites molécules et de leurs effets sur la migration plaquettaire. Il s’agit d’un nouvel outil in vitro permettant d’explorer des cibles thérapeutiques dans l’inflammation ou la thrombose.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Deutsche Forschungsgemeinschaft (DFG ; Fondation allemande pour la recherche) numéros 514478744 et 514477451 à F.G. Le projet est financé par l’Union européenne (ERC, MEKanics, 101078110). Les points de vue et opinions exprimés n’engagent que leur auteur et ne reflètent pas nécessairement ceux de l’Union européenne ou de l’Agence exécutive du Conseil européen de la recherche. Ni l’Union européenne ni l’autorité qui les octroie ne peuvent en être tenues responsables.
matériels
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-diphosphate sodium salt (ADP) | Sigma-Aldrich | A2754 | |
| Alexa Fluor 594 phalloidin | Thermofisher | A12381 | |
| Blood counter | Sysmex | XN-1000 | |
| Bottomless 6 channel sticky slide | IBIDI, sticky slides VI0.4 | 80608 | |
| Centrifuge | Eppendorf | 5804 | |
| Confocal microscope | Zeiss | LSM880 | |
| cyclo [Arg-Gly-Asp-D-Phe-Lys(Biotin-PEG-PEG)] | Peptide international | PCI-3697-PI | |
| FACS tubes | Corning Brand | 352052 | |
| FITC conjugate neutravidin | Thermofisher | A2662 | |
| Formaldehyde | Thermofisher | 28908 | |
| HEPES solution | Sigma-Aldrich | H0887 | |
| Phase contrast and epifluorescent microscope | Olympus | IX83 | |
| Plasma cleaner | Diener | 116531 | |
| PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin(50%) | Susos | PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin (50%) | |
| Poly(L-lysine)-graft-poly(ethylene glycol) co-polymer | Susos | PLL(20)-g[3.5]-PEG(2) | |
| Prostaglandin I2 sodium salt (PGI2) | Abcam | ab120912 | |
| Sonicator | BANDELIN | SONNOREX RK514M | |
| Ttriton X-100 20% v/v | Cayman Chemical | 600217 | |
| U46619 | Enzo Life Sciences | BML-PG023-0001) |
Références
- Jackson, S. P. Arterial thrombosis--insidious, unpredictable and deadly. Nat Med. 17, 1423-1436 (2011).
- Kaiser, R., Escaig, R., Nicolai, L. Hemostasis without clot formation: how platelets guard the vasculature in inflammation, infection, and malignancy. Blood. 142 (17), 1413-1425 (2023).
- Gaertner, F., Massberg, S. Patrolling the vascular borders: Platelets in immunity to infection and cancer. Nat Rev Immunol. 19 (12), 747-760 (2019).
- Gaertner, F., et al. Migrating platelets are mechano-scavengers that collect and bundle bacteria. Cell. 171 (6), 1368-1382.e23 (2017).
- Gros, A., et al. Single platelets seal neutrophil-induced vascular breaches via GPVI during immune-complex-mediated inflammation in mice. Blood. 126 (8), 1017-1026 (2015).
- Nicolai, L., et al. Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nature Comm. 11, 5778(2020).
- Kaiser, R., et al. Mechanosensing via a GpIIb/Src/14-3-3zeta axis critically regulates platelet migration in vascular inflammation. Blood. 141 (24), 2973-2992 (2023).
- Sarkar, A., LeVine, D. N., Kuzmina, N., Zhao, Y., Wang, X. Cell migration driven by self-generated integrin ligand gradient on ligand-labile surfaces. Curr Biol. 30 (20), 4022-4032 (2020).
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 20, 457-473 (2019).
- Shattil, S. J., Newman, P. J. Integrins: Dynamic scaffolds for adhesion and signaling in platelets. Blood. 104 (6), 1606-1615 (2004).
- Yuan, C., Chen, A., Kolb, P., Moy, V. T. Energy landscape of streptavidin-biotin complexes measured by atomic force microscopy. Biochemistry. 39 (33), 10219-10223 (2000).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397, 50-53 (1999).
- Jurchenko, C., Chang, Y., Narui, Y., Zhang, Y., Salaita, K. S. Integrin-generated forces lead to streptavidin-biotin unbinding in cellular adhesions. Biophys J. 106 (7), 1436-1446 (2014).
- Fan, S., Lorenz, M., Massberg, S., Gaertner, F. Platelet migration and bacterial trapping assay underflow. Bio-Protocol. 8 (18), e3018(2018).
- Lauffenburger, D. A., Horwitz, A. F. Cell migration: A physically integrated molecular process. Cell. 84 (3), 359-369 (1996).
- Palecek, S. P., Loftus, J. C., Ginsberg, M. H., Lauffenburger, D. A., Horwitz, A. F. Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature. 385, 537(1997).
- Zhao, Y., Wetter, N. M., Wang, X. Imaging integrin tension and cellular force at submicron resolution with an integrative tension sensor. J Vis Exp. (146), e59476(2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon