Administration d'agents expérimentaux IV
Vue d'ensemble
Source : Kay Stewart, RVT, RLATG, CMAR ; Valerie A. Schroeder, RVT, RLATG. Université de Notre Dame, Indiana
Il y a beaucoup d’itinéraires couramment utilisés pour l’administration composée chez des rats et des souris de laboratoire. Protocoles peuvent, toutefois, exiger l’utilisation des routes moins couramment utilisées : intracardiaque, coussinet plantaire et les injections de rétro-orbitaire. Une formation spécialisée est indispensable pour ces procédures à accomplir avec succès. Justification pour ces routes doive être fournis pour obtenir l’approbation institutionnelle animalier et utilisation Comité (IACUC).
Principles
L’administration intracardiaque a été utilisée dans une variété d’applications, y compris l’élaboration d’un modèle animal de métastases de cancer osseux, ainsi que l’examen des effets de l’injection intracardiaque directe sur les résultats de l’infarctus du myocarde. Cette procédure se faite souvent par l’utilisation de l’échographie pour guider l’aiguille dans l’emplacement correct dans le cœur. 2 Toutefois, lorsque exécuté correctement utilisant les points de repère appropriés, cette procédure peut être effectuée sans l’utilisation de la visualisation échographique.
En raison de la nature invasive de la procédure, l’utilisation de l’injection intracardiaque doit être scientifiquement justifiée dans un protocole IACUC. Injection de seule survie devrait être autorisée. Cette procédure nécessite l’utilisation d’une anesthésie générale, soit inhalante ou injectable, conformément aux lignes directrices établies au sein d’une organisation. Sélection de l’aiguille doit être la plus petite taille possible qui permettra pour la viscosité de la matière injectée ; une aiguille de calibre 27-30 est généralement utilisée. Plage de volumes de injection de 100 µL à un maximum de 300 µL.
Injections intraveineuses dans la queue de souris sont difficiles et souvent infructueuses. Une voie d’administration intraveineuse est par le plexus rétro-orbitaire. Bien que cette technique nécessite la formation et perfectionnement à effectuer, les études ont montré qu’il y a un taux de succès plus élevé avec l’injection rétro-orbitaire qu’avec injection dans la veine latérale arrière. 3, 4, 5 L’anesthésie est nécessaire pour empêcher la souris de se déplacer au cours de la procédure. L’anesthésie générale inhalant envoyées soit par une cloche de verre ou une chambre à induction attachée à un vaporisateur de précision est efficace. Toutefois, si inhalant doit servir, sachez que l’animal va commencer à récupérer rapidement une fois qu’il est retiré de la chambre, donc il doit être prêt à effectuer l’injection. Un anesthésique topique ophtalmique (tétracaïne ou proparacaïne) est recommandé lors de multiples injections doivent être effectuées.
La structure orbitale veineuse de la souris et le rat sont différents. La souris a un sinus ou la convergence de plusieurs navires, dont la veine supraorbitale, veine nasale dorsale, la veine palpébrale inférieure et les veines temporale superficielles qui remplissent l’espace en orbite autour de le œil. Dans la zone orbitale de rat, il y a un réseau ou plexus de navires. Comme pour toutes les injections, l’aiguille sélectionnée doit être la plus petite taille possible ; aiguille de calibre généralement un 27-30. Bien qu’il y a eu des rapports de plus gros volumes, le volume maximal est de 150 µL de chaque œil. 3, 4, 5 Une injection chaque œil, par jour, est recommandée, avec un total de deux injections par oeil pour les procédures de survie. En outre, il faudrait au moins un intervalle d’une journée entre les injections. Pour une procédure nonsurvival, volumes jusqu'à 500 µL peuvent être administrés.
Malgré la controverse, l’utilisation de la garniture de pied comme un site d’injection est toujours nécessaire pour certaines études. Il a été démontré que, lorsqu’elle est injectée par le coussin, la réponse en anticorps chez certaines souches de souris a été significativement plus gros que lorsque injectées dans la pointe du jarret. 6 Tous les animaux doivent être surveillés étroitement pour signes de douleur, le niveau de consommation d’aliments et pour la déambulation normale. L’automutilation du pied peut se produire dans la mesure du pied étant détruit. Il s’agit d’un signe de douleur chronique. Tout animal démontrant l’automutilation doit être appelée à l’attention du personnel vétérinaire immédiatement.
Mesures du coussinet plantaire doivent être faites tous les jours dès le gonflement évident s’est produite. Points de terminaison doivent être en place conformément aux directives IACUC. Généralement, l’animal doit être euthanasié lorsque la lésion ou tumeur interfère avec la capacité de l’animal à se déplacer ou à atteindre nourriture et eau. Le volume maximal qui peut être injecté dans un coussinet plantaire est 50 µL. Une aiguille de calibre 29-30 est recommandé pour l’injection.
Procédure
1. intracardiaque injection
- Sites et positionnement : Position de la souris ou le rat en décubitus dorsal ou en décubitus latéral droit (avec le côté gauche vers le haut) et identifier les points de repère.
- Au cœur du poste environ niveau avec la pointe du coude et juste à gauche du sternum.
- Insérer l’aiguille entre les nervures au point du coude.
- Chez un animal en décubitus dorsal, introduire l’aiguille dans le parallèle de poitrine à la table.
- Chez un animal en décubitus latéral, introduire l’aiguille dans la poitrine, perpendiculaire à la table.
- Injection de l’article
- Ce il y a un mouvement minimal de l’aiguille lorsqu’elle est introduite dans le cœur afin d’empêcher le muscle étant déchiré et causant une hémorragie dans le péricarde, comme ce qui compromet la fonction cardiaque.
- Aspirer la seringue pour déterminer l’emplacement approprié. Il n’y a souvent un éclair de sang dans le moyeu de la seringue.
- Tenez la seringue afin que la main n’est pas repositionnée sur la seringue pour injection une fois que l’aiguille a été positionné au cœur.
- Injecter l’article d’une manière lente et régulière.
- Retirer l’aiguille lentement afin de minimiser les saignements.
- Souris qui connaissent la détresse respiratoire, saisie, cyanose, ataxie prolongée ou autres séquelles liées au traumatisme de l’injection doivent être évaluées par le personnel vétérinaire et euthanasiées selon leur recommandation.
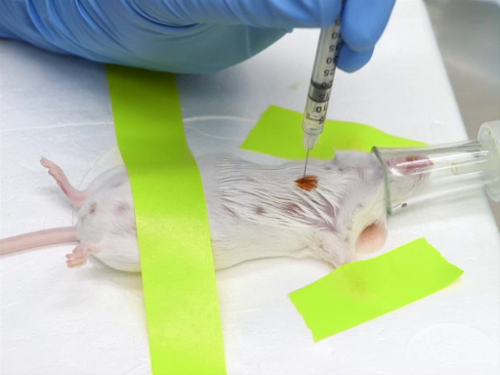
La figure 1. Injection intracardiaque chez la souris.
2. intraveineuse utilisant le plexus rétro-orbitaire
- Sites d’injection et le positionnement
- Placez l’animal sur une surface plane en décubitus latéral.
- Introduire l’aiguille dans le canthus médial de le œil à un angle de 45° vers le nez.
- La profondeur de l’aiguille doit être suffisante pour pénétrer les tissus conjonctives et avancer derrière l’orbite oculaire et dans le plexus oculaire. Lorsque vous placez l’aiguille, qu’il ne devrait pas rencontrer l’os à l’arrière de l’orbite.
- Placez l’index sur le dessus de la tête avec le pouce sur la mâchoire.
- Tirez doucement l’arrière et vers le bas pour tendre la peau et font saillie du globe oculaire.
- Prendre soin de ne pas appliquer une pression sur la trachée et de restreindre le flux d’air.
- Injection
- Placer l’aiguille derrière le œil et pas intra oculaire.
- S’assurer que l’aiguille a un minimum de mouvement une fois inséré dans le plexus rétro-orbitaire, ou les vaisseaux seront rompent causant des saignements et perte de l’agent dans les tissus derrière le œil. Tenez la seringue afin que la main n’est pas repositionnée sur la seringue pour injection une fois que l’aiguille a été positionné dans le plexus rétro-orbitaire.
- Pas aspirer avec la seringue, comme vous va s’effondrer les vaisseaux.
- Injecter l’article d’une manière lente et régulière.
- Retirer l’aiguille et appliquez une légère pression à le œil de contrôler le saignement et d’hémostase.
- Souris qui de gonflement, conjonctivite, expérience ou autres séquelles liées au traumatisme de l’injection doivent être évaluées par le personnel vétérinaire et traités ou euthanasiés selon leur recommandation

La figure 2. Retro orbitale injection chez la souris.
3. Injection de coussinet plantaire
- À la retenue, placer l’animal dans un tube de retenue avec une des pattes isolé et s’étendent en agrippant la peau au-dessus de l’articulation fémoro.
- Essuyer le pied à l’eau ou l’alcool pour enlever les débris avant l’injection.
- Injecter par voie sous-cutanée dans le centre de la patte, formant une petite cloque au site d’injection. Pour éviter le vaisseau sanguin qui court le long du pied, injecter juste à côté de la ligne médiane parallèle au bateau.
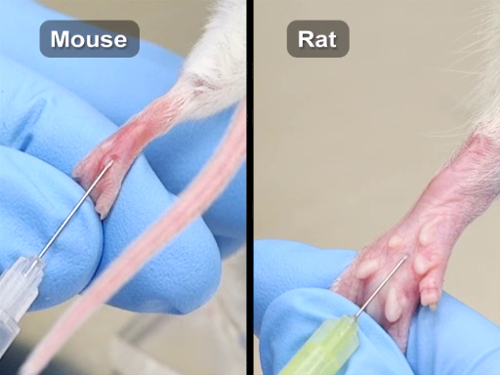
La figure 3. Injection de coussinet plantaire chez les souris et les rats.
Applications et Résumé
L’administration de composés dans des animaux peut avoir un effet significatif sur les deux le bien-être de l’animal et les résultats des données expérimentales et de valeur scientifique. La bonne méthode de livraison est essentielle à la réussite de l’expérience. Beaucoup de facteurs doit être considérés pour déterminer le meilleur itinéraire, y compris l’objectif scientifique de l’étude, le pH de la substance, le volume de la dose requise, la viscosité de la substance, ainsi que le bien-être des animaux. Expertise technique est aussi une exigence pour toutes les méthodes d’injection.
References
- Morton, D.A., Jennings, M., Buckwell, A., Ewbank, R., Godfrey, C., Holgate, B., Inglis, I., James, R., Page, C., Sharman, I., Verschoyle, R., Westall, L., and Wilson, A.B. 2001. Refining procedures for the administration of substances Report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Members of the Joint Working Group on Refinement. Laboratory Animals. 35. 1-41
- Prendiville , T.W., Qing, M., Lin, Z., Zhou, P., He, A., and Pu, W.T. 2014. Ultrasound-guided Transthoracic Intramyocardial Injection in Mice. Journal of Visualized Experiments. 90 | e51566.
- Yardeni, T., Eckhaus, M., Morris, H.D., Huizing, M., and Hoogstraten-Miller, S. 2001. Retro-orbital injection in mice. Lab Animal. 40:5. 155-171.
- Steel, C., Stephens, A., Hahto, S., Singletary, S., Ciavarra, R. 2008. Comparison of the lateral tail vein and the retro-orbital sinus as routes of intravenous drug delivery in a transgenic mouse model. Lab Anim. 37. 26-31.
- Timm, K.I. 1989. Orbital venous anatomy of the Mongolian gerbil, with comparison to the mouse, hamster, and rat. Laboratory Animal Science. 39:3. 262-265.
- Kamala, T. 2007. Hock immunization: a humane alternative to mouse footpad injections. Journal of Immunological Methods. 328. 204-214.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Administration d'agents expérimentaux IV
Lab Animal Research
52.0K Vues

Techniques de manipulation et de contention des rongeurs
Lab Animal Research
175.4K Vues

Soins de base
Lab Animal Research
28.1K Vues

Principes fondamentaux de l'élevage et du sevrage
Lab Animal Research
35.8K Vues

Techniques d'identification des rongeurs I
Lab Animal Research
55.0K Vues

Techniques d'identification des rongeurs II
Lab Animal Research
25.7K Vues

Administration d'agents expérimentaux I
Lab Animal Research
101.1K Vues

Administration d'agents expérimentaux II
Lab Animal Research
35.1K Vues

Administration d'agents expérimentaux III
Lab Animal Research
31.6K Vues

Prélèvement d'échantillons de sang I
Lab Animal Research
172.4K Vues

Prélèvement d'échantillons de sang II
Lab Animal Research
73.7K Vues

Induction et maintien de l’anesthésie
Lab Animal Research
50.9K Vues

Recommandations pour la chirurgie des rongeurs
Lab Animal Research
22.5K Vues

Autopsie et prélèvement des tissus
Lab Animal Research
58.3K Vues

Prélèvement de tissus en conditions stériles
Lab Animal Research
34.9K Vues