Administration d'agents expérimentaux III
Vue d'ensemble
Source : Kay Stewart, RVT, RLATG, CMAR ; Valerie A. Schroeder, RVT, RLATG. Université de Notre Dame, Indiana
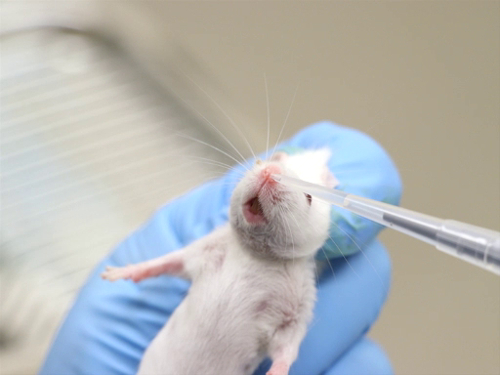
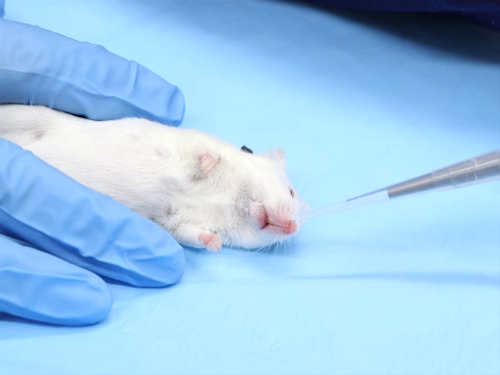
Il y a beaucoup d’itinéraires couramment utilisés pour l’administration composée chez des rats et des souris de laboratoire. Toutefois, certains protocoles peuvent nécessiter l’utilisation des itinéraires moins couramment utilisées, y compris les injections intradermiques, par voie nasale et intracrâniennes. Une formation spécialisée est indispensable pour ces procédures à accomplir avec succès. Justification pour ces routes doive être fournis pour obtenir l’approbation institutionnelle animalier et utilisation Comité (IACUC).
Procédure
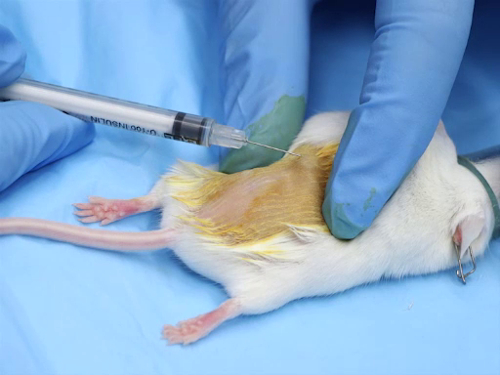
1. intradermique
- Plus les injections intradermiques sont composés à base aqueuse. Les solutions doivent être physiologiquement tamponnées pour avoir un pH neutre, afin d’éviter la nécrose au site d’injection.
- Le calibre de l’aiguille est de calibre 25-30, la plus petite possible.
- La dose par site d’injection se situe entre 50-100 µL. injection volumes excessifs peuvent entraîner la nécrose au site d’injection ou à la fuite du composé sur le site à cause de la pression.
- Pour le pl
Applications et Résumé
L’administration de composés dans des animaux peut avoir un effet significatif sur les deux le bien-être de l’animal et les résultats des données expérimentales et de valeur scientifique. La bonne méthode de livraison est essentielle à la réussite de l’expérience. Beaucoup de facteurs doit être considérés pour déterminer le meilleur itinéraire, y compris l’objectif scientifique de l’étude, le pH de la substance, le volume de la dose requise, la viscosité de la substance, ainsi que le bien-être ...
References
- Turner, P.V., Pekow, C., Vasbinder, M. A., and Brabb, T. 2011. Administration of substances to laboratory animals: equipment and considerations, vehicle selection, and solution preparation. JAALAS. 50: 614-627.
- Dhuria, S.V., Hanson, L.R., and Frey II, W.H. 2010. Intranasal delivery to the central nervous system: mechanisms and experimental considerations. Journal of Pharmaceutical Sciences. 99: 1654-1673.
- Stevens, J., Suidgeest, E, Van der Graaf, P.H., Danhof, M., and De Lange, E.C. 2008. Development and evaluation of a new, minimal-stress animal model for intranasal administration in freely moving rats. Poster presentation at American Association of Pharmaceutical Scientists Annual Meeting, Atlanta, Georgia.
- Morton, D.A., Jennings, M., Buckwell, A., Ewbank, R., Godfrey, C., Holgate, B., Inglis, I., James, R., Page, C., Sharman, I., Verschoyle, R., Westall, L., and Wilson, A.B. 2001. Refining procedures for the administration of substances Report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Members of the Joint Working Group on Refinement. Laboratory Animals. 35: 1-41.
Passer à...
Vidéos de cette collection:

Now Playing
Administration d'agents expérimentaux III
Lab Animal Research
31.6K Vues

Techniques de manipulation et de contention des rongeurs
Lab Animal Research
175.5K Vues

Soins de base
Lab Animal Research
28.1K Vues

Principes fondamentaux de l'élevage et du sevrage
Lab Animal Research
35.9K Vues

Techniques d'identification des rongeurs I
Lab Animal Research
55.0K Vues

Techniques d'identification des rongeurs II
Lab Animal Research
25.7K Vues

Administration d'agents expérimentaux I
Lab Animal Research
101.2K Vues

Administration d'agents expérimentaux II
Lab Animal Research
35.1K Vues

Administration d'agents expérimentaux IV
Lab Animal Research
52.0K Vues

Prélèvement d'échantillons de sang I
Lab Animal Research
172.5K Vues

Prélèvement d'échantillons de sang II
Lab Animal Research
73.7K Vues

Induction et maintien de l’anesthésie
Lab Animal Research
50.9K Vues

Recommandations pour la chirurgie des rongeurs
Lab Animal Research
22.5K Vues

Autopsie et prélèvement des tissus
Lab Animal Research
58.4K Vues

Prélèvement de tissus en conditions stériles
Lab Animal Research
35.0K Vues