A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח תיקון DNA פעמיים גדיל Break (DSB) בתאי יונקים
In This Article
Summary
מאמר זה מתאר GFP מבוססי פלואורסצנציה In vivo מבחני כי בנפרד לכמת הומולוגיים רקומבינציה ו nonhomologous סוף להצטרף בתאי יונקים.
Abstract
גדיל הדנ"א הכפול הפסקות הם נגעים DNA המסוכן ביותר שעלול להוביל לאובדן מסיבי של מידע גנטי ומוות התא. תאים לתקן DSBs באמצעות שני מסלולים עיקריים: nonhomologous סוף להצטרף (NHEJ) ו הומולוגיים רקומבינציה (HR). הפרעות של NHEJ ו HR הקשורים לעתים קרובות עם הזדקנות מוקדמת ו tumorigenesis, ולכן חשוב לנו דרך כמותית למדוד כל מסלול תיקון DSB. המעבדה שלנו פיתחה בונה כתב ניאון המאפשרים מדידה כמותית של רגיש NHEJ משאבי אנוש. בונה מבוססים על גן ה-GFP מהונדסים המכיל אתרים הכרה endonuclease I-SCEI נדיר חיתוך לזירוז של DSBs. בונה החל GFP הם שליליים כמו הגן GFP הוא מובטל ידי אקסון נוספת, או על ידי מוטציות. תיקון מוצלח של שוברת את I-SCEI הנגרמת על ידי NHEJ או HR משחזר את גן ה-GFP תפקודית. מספר התאים GFP חיובי נספר על ידי cytometry זרימה מספקת למדוד כמותית של NHEJ או יעילות משאבי אנוש.
Protocol
בפרוטוקול זה אנו מתארים את שיטת ניתוח לתיקון DSB-DNA משולב עם הכתב chromosomally בונה 1,2 שבו DSBs הם המושרה in vivo על ידי ביטוי חולף endonuclease חיתוך נדיר I-SCEI 3. Assay משולב מספק את היתרונות של ניתוח לתיקון DSB בהקשר כרומוזומליות. עם זאת, פרוטוקול זה מחייב תא passaging ממושך, אשר עשוי להיות בעייתי כאשר עובדים עם תאים ראשוניים.
גישה חלופית היא assay extrachromosomal שבו בונה כתב מתעכלים במבחנה עם I-SCEI או endonucleases HindIII ואז transfected לתוך התאים כמו DNA ליניארי. פרוטוקול assay exctrachromosomal 4 דומה assay המשולב המתואר להלן בשינויים הבאים. עבור assay extrachromosomal להשמיט את האינטגרציה של בונה כתב ובמקום שיתוף transfect התאים עם 0.5 מיקרוגרם של הכתב NHEJ פלסמיד לינארית במבחנה עם I-SCEI או HindIII ו 0.1 מיקרוגרם של pDsRed2-N1 כמו שליטה transfection. עבור assay משאבי אנוש שיתוף transfect 2 HR מיקרוגרם כתב פלסמיד לינארית עם I-SCEI או HindIII ו 0.1 מיקרוגרם pDsRed2-N1. נתח את התאים על ידי FACS שלושה ימים לאחר transfection. Assay extrachromosomal מאפשר ניתוח של תיקון DSB ב מבודד העיקרי, הימנעות תא נרחב passaging, והקלה על ניתוח של שורות תאים מרובים.
1. כתב בונה עבור NHEJ ו HR
קלטת כתב NHEJ 5 מכיל את הגן GFP עם מהונדסים 3 kb אינטרון מן הגן Pem1 (GFP-Pem1). אינטרון Pem1 מכיל אקסון adenoviral מוקף רצפי הכרה endonucleases HindIII ואני-SCEI (איור 1 א) לזירוז של DSBs. I-SCEI האתרים בכיוון הפוך. I-SCEI יש רצף הכרה nonpalindromic, ומכאן שני אתרים הפוכה ליצור קצוות דנ"א תואם (איור 1 ג'). ה-DNA לא תואם מסתיים הטובה ביותר לחקות את DSBs טבעי. קלטת שלם NHEJ היא GFP שלילי כמו אקסון adenoviral משבש את ORF GFP. עם הגיוס של DSBs על ידי I-SCEI, אקסון adenoviral יוסר NHEJ משחזר פונקציה של הגן GFP (איור 2). תכונה ייחודית של הכתב הזה NHEJ היא כי ניתן לזהות מגוון רחב של אירועים NHEJ מאז אינטרון יכול לסבול השמטות והוספות.
קלטת הכתב HR 1 (איור 1b) מבוססת גם על ה-GFP-Pem1. בשנת הקלטת HR, אקסון הראשון של ה-GFP-Pem1 מכיל מחיקה 22 נ"ב בשילוב עם הכניסה של שלושה אתרי הגבלה, I-SceI/HindIII/I-SceI. המחיקה מבטיחה כי ה-GFP לא ניתן מחדש על ידי אירוע NHEJ. שתי I-SCEI האתרים בכיוון ההפוך, כך אני-SCEI העיכול עלים מסתיימת עולה בקנה אחד (איור 1 ג'). העותק הראשון של ה-GFP-Pem1 מלווה אקסון אינטרון first promoter-less/ATG-less ו-GFP-Pem1. לבנות שלם GFP הוא שלילי. עם הגיוס של DSB ידי עיכול I-SCEI הגן GFP פונקציונלי הוא מחדש על ידי המרה גן intramolecular או מולקולאריים בין שני עותקים של מוטציה אקסון ה-GFP-Pem1 הראשון. מאז העותק השני של הגן GFP חסר קודון ATG הראשון, אקסון השני, מעבר מעל או גדיל יחיד חישול לא תשחזר את פעילות ה-GFP. עיצוב זה מאפשר זיהוי הבלעדית של המרה גן, המהווה את מסלול HR השולט בתאי יונקים (איור 3).
2. שילוב של כתב המבנים לתוך גנום
- הפוך הכנה באיכות גבוהה של NHEJ או כתב HR פלסמיד. לקבלת התוצאות הטובות ביותר להשתמש Qiagen ערכת אנדו חינם. מדידת ריכוז טוהר פלסמיד ועל ידי ספיגת ב 260/280 ננומטר.
- Linearize 10 מיקרוגרם של הכתב הפלסמיד על ידי לעכל עם U 50 של NheI ב μl 50 (הנפח הכולל של התגובה) במשך 6 שעות ב 37 ° C חממה (לא להשתמש לחסום יבש, כדי למנוע אידוי). לטהר DNA מפתרון העיכול עם Qiagen QiaexII קיט, ה-DNA לתוך elute μl 20 של 10 mM טריס-HCl pH 8.0. מדד ה-DNA ריכוז טוהר על ידי ספיגת ב 260/280 ננומטר. בדרך כלל, תאבד 20-30% של ה-DNA במהלך הטיהור. אשר את התשואה העיכול על ידי הפעלת aliquot קטן (2 μl) על ג'ל, יחד עם כתב מעוכלים לבנות. לבנות מטוהרים כתב לינארית ניתן לאחסן בטמפרטורה של 20 ° C.
- לקראת transfection, להביא את התאים למצב הטוב הולך וגדל. אם החל בקבוקון קפוא, לפצל את התאים פעמיים לפני transfection. אם החל צלחת של תאים ומחוברות, לפצל אותם פעם אחת.
- לגדל את התאים מפגש 70-80% (בדרך כלל יומיים, אם מצופה צלחת 5x10 cells/100 5 מ"מ, עבור fibroblasts אדם נורמלי). זה קריטי עבור יעילות transfection הטובה ביותר להביא את התאים לתוך הגידול לוגריתמי. תרבות ומתרחב מכיל תאים בשלב M (כפי שניתן לראות תאים מעוגלים המצורפת פני השטח).
- Transfect התאים באמצעות המלצות Amaxa יצרן Nucleofector של הבאים. עבור fibroblasts להשתמש בפתרון NHDF ו U20 התוכנית. עבור transfection, הקציר תאים משני 100 צלחות מ"מ (~ 2x10 6 תאים). זה קריטי לא מעל trypsinize התאים. עצור trypsinization בהקדם 80% של תאים מנותקת מן הצלחת. Resuspend התאים פתרון NHDF. תאים רגישים פתרון NHDF, אפוא, לצמצם את זמן הדגירה ומערבבים בעדינות את התאים. Transfect התאים עם 0.5 מיקרוגרם של לבנות כתב לינארית. אלה התנאים transfection, הפועל עם תוצאה fibroblasts נורמלי האדם שילוב של עותק אחד של כתב לבנות עבור רוב integrants.
- בחר את התאים עם בונה כתב משולב chromosomally ידי הוספת 1 מ"ג / מ"ל geneticin (G418) 24 שעות לאחר transfection. המשך מבחר ימים 7-10.
- בחר את עמידים מושבות G418 (ניתן לבחור מושבות בודדות או בבריכה שיבוטים עמיד). הרחב את התרבות כחמש צלחות 100 מ"מ. הקפאת שלוש צלחות לשימוש עתידי ולהרחיב הנותרים שתי צלחות למספר התא הרצוי (בדרך כלל ten 100 צלחות מ"מ מספיקים חמישה transfections).
- כאשר התאים מגיעים מפגש 70-80% (יומיים לאחר ציפוי 5x10 5 תאים לכל צלחת 100 מ"מ עבור פיברובלסטיים), התאים מוכנים transfected עם I-SCEI להביע פלסמיד.
3. אינדוקציה של DSB ידי הביטוי חלוף של Endonuclease I-SCEI
- Transfect ~ 2x10 6 תאים (שתי צלחות) של התרבות בטור לוגריתמי גדל בתערובת של 5 מיקרוגרם I-SCEI להביע פלסמיד ו 0.1 מיקרוגרם pDsRed2-N1 (Clontech) כביקורת transfection יעילות באמצעות Amaxa Nucleofector (להשתמש בפתרון NHDF ו U20 תוכנית fibroblasts ).
- במקביל להכין שלושה שולטת כיול עבור FACS ידי trasfecting ~ 2x10 6 תאים (i) 5 מיקרוגרם EGFP-לבטא פלסמיד (ii) 5 מיקרוגרם pDsRed2-N1; (ג) 5 מיקרוגרם של פקד פלסמיד שאינו להביע חלבון פלואורסצנטי (אנחנו באמצעות קידוד פלסמיד HPRT minigene).
- לגדל את התאים במשך ארבעה ימים על מנת לספק מספיק זמן ביטוי של GFP וחלבונים DsRed.
- (אופציונאלי) שלושה ימים לאחר transfection לאמת את היעילות של transfection והביטוי של ה-GFP וחלבונים DsRed על ידי מיקרוסקופ פלואורסצנטי הפוכה עם מסננים לגילוי של ה-GFP ו DsRed.
4. ניתוח של ה-GFP תאים + + ו DsRed על ידי זרימת cytometry
- ארבעה ימים לאחר הקציר transfection I-SCEI תאים transfected והתאים שליטה. Resuspend התאים μL 500 של PBS ולהעביר התאים צינורות FACS. בשלב זה הוא קריטי כדי לקצור את כל התאים יש תאים של הצורה העגולה. כדי להשיג זאת, מומלץ להשתמש trypsinization זמן ארוך יותר או חזקה יותר טריפסין. ודא כי 99% של תאים מנותקים הצלחת ויש להם צורה עגולה על ידי התבוננות בתאים תחת מיקרוסקופ. שמור את התאים על הקרח מוגן מפני אור (דלי קרח לכסות בנייר כסף). ניתן לאחסן את התאים על קרח למשך כמה שעות. לקבלת התוצאות הטובות ביותר לנתח את התאים מיד לאחר הקציר.
- כיול FACS עם GFP, DsRed, ואת שולטת שלילית. התאם את מתח פיצוי צבע על מנת לכלול את כל התאים פלורסנט בניתוח (איור 4). זכור כי עוצמת ניאון של דגימות הניסוי יהיה נמוך מזה של הביקורת.
- ניתוח I-SCEI transfected תאים על ידי FACS. אנו סופרים לפחות 20,000 תאים עבור כל טיפול. כדי למנוע הפרעה אפשרית בין ה-GFP ו DsRed הקרינה מומלץ לשמור על אחוז או DsRed GFP + + תאים מתחת 25%. אם אחוז + DsRed או GFP בתאים + גבוה להפחית את כמות pDsRed2-N1 או I-SCEI פלסמיד. בניסויים שלנו אנחנו רק צריכים להתאים את כמות pDsRed2-N1 פלסמיד, אך לא של I-SCEI פלסמיד.
- אחוז התאים ה-GFP + מתאים היעילות של תיקון DSB-DNA ואת אחוז של תאים + DsRed מציין את היעילות של transfection. חשב את היעילות היחסית של תיקון DSB-DNA כיחס בין התאים לתאי ה-GFP + + DsRed.
- צמתים סוף תוקן עשוי להיות רצף כדי לבדוק את הדיוק של תיקון. בונה כתב מכילים ממוצא E.coli של שכפול והתנגדות גנים kanamycin (איור 1). זה מאפשר הצלת בונה על ידי לעכל הדנ"א הגנומי עם EcoRI האנזים, recircularization ו והפיכתו המוסמכת תאים E.coli. פלסמידים הצילה מנותחים מכן על ידי עיכול הגבלה וסדר.
5. נציג תוצאות
אופיינית FACS תוצאות transfections מלאה של NHEJ וניסויים HR מוצגים איורים 4 ו -5. עוצמת פלורסנט ומספר תאים פלורסנט יהיה נמוך בתאים I-SCEI transfected המכיל integratעורך NHEJ ובונה HR (איור 5) בהשוואה לקבוצת הביקורת (איור 4) בגלל ההבדל במספר עותק של ה-GFP ובונה DsRed בתאים אלה. כל תא מכיל את הניסוי רק עותק אחד של לבנות את הכתב משולב, אירועים תיקון מוצלח וכך יהיה לשקם את הגן GFP בשבריר של התאים. Transfection עם 0.1 מיקרוגרם pDsRed2-N1 ב fibroblasts האנושי מספק כ 1 עותק פלסמיד לכל תא.
היעילות של NHEJ ו HR מחושב כיחס של ה-GFP + / DsRed + תאים. NHEJ הוא תהליך יעיל יותר HR בתאים אנושיים 2. ב fibroblasts האדם את היעילות NHEJ היא בדרך כלל 0.6-1.3, ויעילות HR הוא 0.05-0.3. מאז DSB יעילות נמדדת כמו GFP יחס + / DsRed + תאים וריאציות תערובת של I-SCEI DsRed2 ו-N1 פלסמידים עשויים להשפיע על התוצאה. איכות פלסמיד עשוי גם להשפיע על תוצאות על ידי שינוי יעילות transfection. לכן, כדי לקבל מדידה עקבית, חשוב להשתמש לערבב אותו בתוך פלסמיד בניסוי אחד. יתר על כן, יעילות תיקון DSB מושפע סוג התא, מחזור שלב התא, ומיקום כרומוזומליות של המבנים המשולבים.
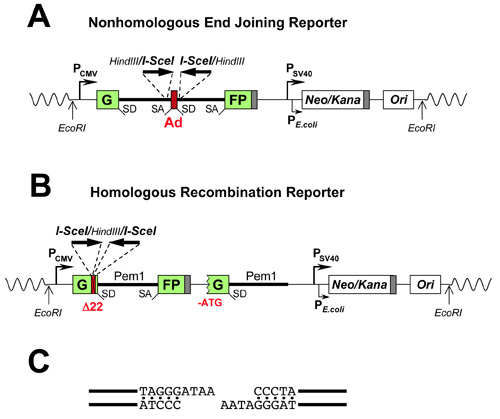
באיור 1. כתב בונה לניתוח תיקון DSB-DNA על ידי NHEJ (א) ו - HR (B). (ג) ה-DNA לא תואם מסתיים שנוצר על ידי עיכול של שני I-SCEI אתרים הפוכה SD, אחוי התורם; SA, אחוי acceptor; ריבועים מוצלות, אתרי polyadenylation; ניאו / כנא, יחיד ORF נשלט על ידי שני יזמים:. SV40 התנגדות neomycin מתייעצים יונקים תאים, ו β-lactamase התנגדות kanamicyn מתייעצים החיידק, אורי, א קולי מוצא PUC של שכפול.

איור 2. כתב לבנות לניתוח NHEJ בחודש זה לבנות את הגן GFP אינו פעיל,. אולם על אינדוקציה של NHEJ DSB ומצליח לבנות הופך GFP +. המוצג להלן הוא מוצר לתיקון כתב את זה על ידי NHEJ.

איור 3. כתב לבנות לניתוח משאבי אנוש על ידי המרה גן. עם גיוס של DSBs על ידי I-SCEI, משאבי אנוש על ידי הגן המרה (GC) reconstitutes הגן GFP פעיל. המוצג להלן המוצרים תיקון כתב את זה על ידי המסלולים העיקריים לתקן דנ"א: GC, מעבר מעל (X-over), גדיל בודד חישול (SSA), ו NHEJ. ה-X על מוצר לתקן מוצג עבור רקומבינציה intramolecular, רקומבינציה exramolecular ייתן את אותו מוצר, אך בכרומוזום אחד. גנים לבטא חלבון ה-GFP פעיל (GFP +) מסומנים על ידי הצבע הירוק.
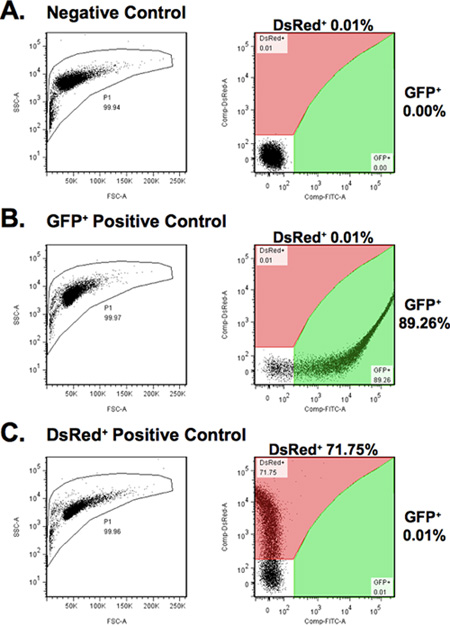
איור 4. כיול הפרמטרים לניתוח FACS. (א) Fibroblasts transfected pHPRT עם הפלסמיד, לשמש מלאה שלילי למעט תאים אוטומטי ניאון. (ב) Fibroblasts transfected עם pEGFP פלסמיד, המשמש לקביעת gating עבור ה-GFP בתאים + (שטח ירוק). (ג) Fibroblasts transfected עם pDsRed2-N1 פלסמיד, המשמש לקביעת gating עבור תאים + DsRed (אזור אדום).

איור 5. תוצאות אופייניות של ניתוח NHEJ (א) ו - HR (B) ב fibroblasts אדם נורמלי עם בונה כתב משולב chromosomally.
Discussion
NHEJ פלורסנט מבחני HR כתב לספק דרך כמותית למדוד בנפרד עבור כל מסלול תיקון DSB in vivo. מבחני רגישים מאוד, כמו FACS יכולים לזהות באופן אמין 10 + התאים GFP ב 20,000 תאים. מבחני עשוי להיות מותאם למדידת אירועים לתקן "בזמן אמת" על ידי איתור את המראה של ה-GFP בתאים + בתוך דקות או שעות ל...
Disclosures
Acknowledgements
המקורי GFP-Pem1 היה מתנה ד"ר Li Lei. עבודה זו נתמכה על ידי מענקים מ-NIH ו הרפואי אליסון קרן אל VG ו AS
Materials
| Name | Company | Catalog Number | Comments |
| EndoFree Plasmid Maxi kit | Qiagen | 12362 | |
| Qiaex II Gel Extraction Kit | Qiagen | 20021 | |
| Amaxa Nucleofector | Lonza Inc. | AAD-1001 | |
| Geneticin (G418) | Invitrogen | 11811-031 | |
| pDsRed2-N1 | Clontech Laboratories | 632406 | |
| Round bottom tubes | BD Biosciences | 352058 | FACS tubes |
References
- Mao, Z., Seluanov, A., Jiang, Y., Gorbunova, V. TRF2 is required for repair of nontelomeric DNA double-strand breaks by homologous recombination. Proc Natl Acad Sci U S A. 104, 13068-13073 (2007).
- Mao, Z., Bozzella, M., Seluanov, A., Gorbunova, V. Comparison of nonhomologous end joining and homologous recombination in human cells. DNA Repair (Amst). 7, 1765-1771 (2008).
- Rouet, P., Smih, F., Jasin, M. Expression of a site-specific endonuclease stimulates homologous recombination in mammalian cells. Proc Natl Acad Sci U S A. 91, 6064-6068 (1994).
- Mao, Z., Jiang, Y., Xiang, L., Seluanov, A., Gorbunova, V. DNA repair by homologous recombination, but not by nonhomologous end joining, is elevated in breast cancer cells. Neoplasia. 11, 683-691 (2009).
- Seluanov, A., Mittelman, D., Pereira-Smith, O. M., Wilson, J. H., Gorbunova, V. DNA end joining becomes less efficient and more error-prone during cellular senescence. Proc Natl Acad Sci U S A. 101, 7624-7629 (2004).
- Mao, Z., Bozzella, M., Seluanov, A., Gorbunova, V. DNA repair by nonhomologous end joining and homologous recombination during cell cycle in human cells. Cell Cycle. 7, 2902-296 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved