Method Article
מדידת קשיחות כיפוף של תאים חיידקיים באמצעות מלכודת אופטית
In This Article
Summary
אנו מציגים פרוטוקול עבור כיפוף תאים חיידקיים פילמנטיות מצורף מכסה משטח החלקה עם מלכודת אופטי למדידת קשיות כיפוף הסלולר.
Abstract
פיתחנו פרוטוקול למדוד את הנוקשות של כיפוף מוט בצורת חיידקים פילמנטיות. כוחות מוחלים עם מלכודת אופטי, מעיין מיקרוסקופי תלת ממדי עשוי האור נוצר כאשר גבוהה עוצמת קרן לייזר ממוקדת לנקודה קטנה מאוד העדשה המטרה של מיקרוסקופ. כדי לכופף תא, אנחנו הראשונים לאגד חיידקים לחיות coverslip כימית שטופלו. כאשר תאים אלה גדלים, באמצע תאים נשאר חייב coverslip אך מסתיים גדל חופשיים של איפוק זה. על ידי גרימת צמיחה פילמנטיות עם cephalexin את התרופה, אנו מסוגלים לזהות את התאים בהם קצה אחד של התא היה תקוע אל פני השטח ואילו הקצה השני נשאר פנוי רגישים כוחות כיפוף. כוח כיפוף מוחל מכן על ידי קשירה polylysine מצופה חרוז אל קצה של תא גדל עם מלכודת אופטי. שני כוח לבין עקירה של חרוז נרשמות ואת הנוקשות כיפוף של התא הוא השיפוע של הקשר הזה.
Protocol
- לגדל תאים E. coli במדיום לוריא-Beltrani (LB) מרק לשלב מעריכי (OD = 0.2-0.4).
- לגדל את התרבות LB בתוספת 50 מיקרוגרם / מ"ל של cephalexin במשך 15 דקות כדי לגרום לצמיחה פילמנטיות, ולאחר מכן לרכז את התרבות על ידי 5 פעמים באמצעות צנטריפוגה.
- הפוך את PEI מצופה coverslip ידי זורם polyethylenimine 1% מדולל במים לתוך תא זרימה, לשטוף עם מים לאחר דגירה של 5 דקות.
- תזרים התרבות תאים מרוכזים לתוך החדר, ושטף בתערובת של LB ו cephalexin (50μg/mL) לאחר 3 דקות כדי להסיר תאים פנויים.
- דגירה החדר ב 37 מעלות צלזיוס למשך 30 דקות, 1 שעה כדי לאפשר לתאים לגדול המצורפת לפני ההשמה על מכשיר אופטי השמנה.
- הפוך את polylysine חרוזים מצופים ידי דוגרים-0.5 מיקרומטר בקוטר חרוזי פוליסטירן (בנגס Labs) ב polylysine 0.1% מדולל במים למשך 30 דקות. ואז לשטוף את החרוזים 3 פעמים resuspend במים.
- לדלל את הפתרון חרוז בפקטור של שני לתוך LB עם cephalexin (50μg/mL), ולהוסיף אותו לתוך תא הזרימה.
- Optically מלכודת חרוז צף לגעת בו עד קצה חופשי של תא. (אנו משתמשים Mad העיר Labs בשלב piezo כדי לשלוט בתנועה של המדגם.) כאשר שילוב חרוז / תא מתאים נמצא, לשטוף את החדר עם cephalexin ב LB (50μg/mL) כדי להסיר חרוזים פנויות.
- הפעלה אישית כתוב תוכנית LabVIEW ליישם כוחות כיפוף אל התא בכוח עקירה נתונים שיא. תוכנית פרטי
- כיול הגלאי תגובה על ידי סריקה סריקת חרוז המצורפת בתוך אלומת לייזר זיהוי ורישום 3D PSD אותות מתח.
- זהה את ציר תא ארוך בתמונה מיקרוסקופ.
- העבר תא צעדים בניצב לכיוון לציר תא ארוך.
- שיא המרחק זז תזוזה ממלכודת אופטי.
- המר עקירה בכוח מיושם באמצעות קשיחות מלכודת נמדד קודם לכן ולשמור עקירה טיפ כוח לקובץ.
סודות ההצלחה: בשלב 8), צריך למצוא תא עם סוף מוגדר היטב תקוע. כמה תאים תקועים רק באחת קצה, וכוח כיפוף בקצה השני מובילה שלמה תא הציר ולא כיפוף. זוג מתאים נמצא על ידי כיפוף כל תא מהר ביד באמצעות תנועה ג'ויסטיק שבשליטת הבמה.
נציג תוצאות:
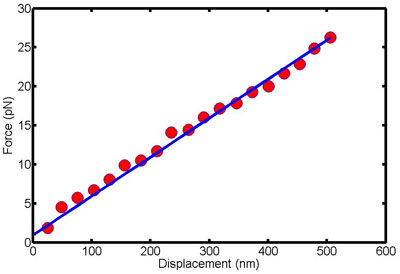
באיור 1. נתון זה מראה כוח תזוזה נתונים עבור תא בודד. השיפוע של קו זה הוא נוקשות כיפוף של התא.
Discussion
הפרוטוקול המובא כאן נועד כמותית למדוד את התכונות כיפוף של תאים חיידקיים. הגדרת הניסוי ניתן ליישם תא בצורת מוט כל שניתן לעשות כדי לגדול filamentously. השתמשנו בהצלחה התקנה זו כדי לחקור את ההשפעות של סיבים cytoskeletal על קשיחות כיפוף של E. coli תאים. טכניקה זו דומה ניתן להשתמש כדי להעריך את תפקידי, נוקשות לחץ דופן התא רכיבים תאיים אחרים בקביעת קשיחות כיפוף הכולל של תאים.
Disclosures
הפקת וידאו של מאמר זה מומן על ידי Mad העיר Labs, אשר מייצרת מכשירים המשמשים במחקרים אלה.
Acknowledgements
אנו מכירים עצות מועילות מ Mingzhai לסאן תאים מחייב משטחים. אנו מודים נד Wingreen ו זמר גיתאי לדיונים חשובים. מחקר זה מומן על ידי המכונים הלאומיים לבריאות P50GM07150 מענק, פרס הקרן הלאומית למדע קריירה PHY-0844466 ו פ אלפרד סלואן קרן.
Materials
| Name | Company | Catalog Number | Comments |
| cephalexin | Sigma-Aldrich | C4895-5G | |
| polyethylenimine | Sigma-Aldrich | 181978-5G | |
| polylysine | Sigma-Aldrich | P8920 | |
| 0.5-μm-diameter polystyrene beads | Bangs Laboratories | PS03N | |
| Nano-LP Series nanopositioning system | Mad City Labs | NanoLP series | http://www.madcitylabs.com/nanolpseries.html |
References
- Janmey, P. A., McCulloch, C. A. Cell mechanics: integrating cell responses to mechanical stimuli. Annu Rev Biomed Eng. 9, 1-34 (2007).
- Morris, D. M., Jensen, G. J. Toward a biomechanical understanding of whole bacterial cells. Annu Rev Biochem. 77, 583-613 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved