Method Article
גזירת תרבויות Oligodendrocyte מועשר Neuron Oligodendrocyte / Myelinating משותף תרבויות מן שלאחר הלידה רקמות Murine
In This Article
Summary
מאמר זה מתאר שיטות להפיק אוכלוסיות מועשר Murine של תאים מבשר oligodendrocyte (OPCs) בתרבות העיקרי, אשר להבדיל לייצר oligodendrocytes בוגרת (OLS). בנוסף, דו"ח זה מתאר את טכניקות כדי לייצר Murine myelinating שיתוף תרבויות על ידי זריעת OPCs העכבר על המיטה neurite של הגב עכבר שורש עצב הגנגליון (DRGNs).
Abstract
זיהוי המנגנונים המולקולריים שבבסיס פיתוח OL לא קריטי רק כדי לקדם את הידע שלנו על ביולוגיה OL, אבל יש גם השלכות להבנת בפתוגנזה של מחלות demyelinating כגון טרשת נפוצה (MS). פיתוח נייד הוא למד בדרך כלל עם מודלים תרבות העיקרית התא. תרבית תאים ראשונית מאפשר הערכה של סוג תא נתון על ידי מתן סביבה מבוקרת, ללא המשתנים זרים שנמצאים in vivo. בעוד תרבויות OL נגזר חולדות סיפקו כמות אדירה של תובנה בביולוגיה OL, מאמצים דומים הקמת תרבויות OL מעכברים כבר נפגש עם המכשולים העיקריים. פיתוח שיטות OLS תרבות Murine העיקרית היא הכרחית על מנת לנצל את קווי זמין עכבר מהונדס.
מספר שיטות להפקת OPCs מרקמות מכרסם תוארו, החל neurosphere גזירה, הדבקה טיהור דיפרנציאלי immunopurification 1-3. בעוד שיטות רבות מציעות הצלחה, רוב דורשות פעמים תרבות ענפה ו / או ציוד יקר / ריאגנטים. כדי לעקוף זאת, טיהור OPCs מרקמות Murine עם הסתגלות של השיטה המתוארת במקור על ידי מקארתי & דה Vellis 2 היא העדיפה. שיטה זו כרוכה פיזית OPCs הפרדת מתרבות גליה מעורבת שמקורם בקליפת המוח מכרסם הילוד. התוצאה היא האוכלוסייה OPC מטוהרים שיכול להיות מובחן לתוך התרבות OL מועשר. גישה זו מערערת בשל הזמן הקצר יחסית התרבות הדרישה מיותר עבור גורמי גדילה או נוגדנים immunopanning.
בעוד לחקור את המנגנונים של פיתוח OL בתרבות מטוהרים הוא אינפורמטיבי, הוא אינו מספק את הסביבה הרלוונטיות ביותר מבחינה פיזיולוגית להערכת היווצרות המיאלין נדן. Co-culturing OLS עם הנוירונים יעניק תובנה הבסיס המולקולרי ויסות OL בתיווך myelination של אקסונים. עבור רבים OL / נוירון שיתוף תרבות מחקרים, גנגליון השורש הגבי נוירונים (DRGNs) הוכיחו להיות סוג של נוירון בחירה. הם אידיאליים עבור תרבות בשיתוף עם OLS בשל הקלות שלהם ממוצא, כמות מזערית של זיהום תאים, היווצרות של מיטות neurite צפופה. בעוד שמחקרים באמצעות עכברוש / עכבר myelinating xenocultures פורסמו 4-6, בשיטה של גזירת כזה OL / DRGN myelinating שיתוף תרבויות מרקמות שלאחר הלידה Murine לא תוארה. כאן אנו מציגים שיטות מפורטות כיצד ביעילות תרבויות כאלה, יחד עם דוגמאות של התוצאות הצפויות. שיטות אלו יעילים לטיפול השאלות הרלוונטיות לפיתוח OL / פונקציה myelinating, הם כלים שימושיים בתחום מדעי המוח.
Protocol
הצהרת אתיקה
העכברים המשמשים בעבודה זו טופלו על פי המועצה הקנדית על טיפוח בעלי חיים (CCAC) הנחיות. אישור אתיות בניסויים שנערכו הושג מאוניברסיטת אוטווה Animal Care ועדת תחת פרוטוקול מספר OGH-119.
1. Dissection - קליפת עכבר בילוד עבור OPC מיצוי
- הקורבן P0-P2 העכבר בהתאם להנחיות מוסדיים.
- מנתחים את המוח ומניחים בצלחת פטרי המכילות קר כקרח ממ (ללא אנטיביוטיקה).
- מעבירים את המנה כדי מיקרוסקופ לנתיחה.
- באמצעות אזמל עם הצד המוח עד הגב, לעשות חתך רדוד sagittally לאורך הקצה המדיאלי ביותר של כל קליפת המוח (איור 1 א). חתך זה צריך רק לעבור את שכבת קרום המוח על מנת להקל הסרתו.
- שימוש במלקחיים היטה בסדר לקלף את קרומי המוח באופן רוחבי. אם נעשה בזהירות, שכבה זו ניתן להסיר בחתיכה אחת. במהלך שלב זה, להסיר את נורות חוש הריח.
- עם המוח הגחוני בצד למעלה, לעשות חתך עמוק sagittal שם בקליפת פוגש את האזור הגחוני של diencephalon (איור 1b).
- עם הגב המוח בצד למעלה, להפריד את קליפת המוח של המוח התיכון חטטניות על ידי רקמות המדיאלי אופנה לרוחב (איור 1 ג, ג "). הסר את כל שאריות קרומי המוח בשלב זה.
- כל הקוביות לתוך קליפת כ 4 חתיכות בעדינות להעביר צינור חרוטי 15 מ"ל המכיל 350 μL של המוח לכל עכבר ממ. שמור את הצינור על הקרח עד שכל העכברים עברו עיבוד.
- חזור על שלבים 1.1-1.8 עבור עכברים הנותרים.
2. דיסוציאציה של קליפת המוח בילוד ותחזוקה של תרבויות גליה מעורבת
הערה: המבוא של בועות לתוך ההשעיה תא יש להימנע במהלך כל השלבים הבאים.
- מוסיפים את צינור חרוטי 15 מ"ל המכיל את מוח גזור טרי כדי אמבטיה 37 מעלות צלזיוס מים 3 דקות.
- העברת מוחות כדי ברדס רקמה סטרילית תרבות.
- בעדינות לעבור דרך הקורטקס קוביות טיפ פיפטה P1000 ליצירת שברים קטנים יותר. עצור pipetting פעם אין חתיכות מוח גדול מספיק כדי לשבש זרימה חלקה של השעיה דרך קצה פיפטה.
- הוסף 75 μL של פתרון papain OPC לכל המוח לתוך הצינור חרוטי. הפתרון papain OPC חייב להיות מחומם מראש על 37 מעלות צלזיוס למשך 20 דקות לפני השימוש.
- דגירה של אמבטיה 37 מעלות צלזיוס במשך 20 דקות במים. בערך כל 2 דקות, להפוך בעדינות את הצינור כדי למנוע הצטברות רקמות. במהלך תקופה זו, להוסיף 5 מ"ל של מעורבות התקשורת בתרבות גליה זה פולי-L-ליזין (PLL) מצופה (1 מ"ג / מ"ל) T25 בקבוק (אחד לכל בקבוק במוח העכבר), וכן מקום 37 ° C רקמה תרבות החממה ב 8.5% CO 2.
- לאחר 20 דקות, להחזיר את ההשעיה רקמות למכסה המנוע סטרילית להוסיף 2 מ"ל של מעורבות התקשורת בתרבות גליה לכל המוח הצינור. בואו לשבת במשך 10 דקות בטמפרטורת החדר כדי לאפשר איון של הפתרון OPC papain.
- Aliquot רקמות ההשעיה לתוך צינורות פלסטיק 5 מ"ל. מספר צינורות צריך להתאים את מספר מוחות גזור, וכתוצאה מכך כ -2.5 מ"ל לכל צינור.
- שימוש סטרילי להבה זכוכית מלוטשת פיפטה פסטר, בעדינות triturate רקמת בצינור אחד. Triturate לאט בהתחלה, ובהדרגה להגביר את מהירות כמו חתיכות לנתק. Triturate כ 10-15 פעמים, אולם מספר זה עשוי להשתנות בהתאם ליעילות של העיכול.
הערה: תחת, טחינה דקה תגרום עניים ניתוק של הרקמה, ואילו יתר טחינה דקה יהיה להשפיע לרעה על כדאיות התא. חשוב לא להכניס בועות לתוך הפתרון, כמו זה יהיה קשה להשפיע כדאיות התא.
- ברגע שאין גושים ברקמה גלויים שנותרו ההשעיה, להעביר צינור חרוטי 50 מ"ל המכיל 4 מ"ל של מעורבות התקשורת בתרבות גליה לכל המוח (כלומר, 4 מוחות = 16 מ"ל מעורבת התקשורת גליה תרבות).
- להפוך בעדינות צינור חרוטי 50 מ"ל וחזור במשך 5 צינורות הנותרים מ"ל.
- Aliquot ההשעיה תא אספו לתוך צינורות חרוטי 15 מ"ל (כ 6.5 מ"ל לכל שפופרת 15 מ"ל). מספר 15 צינורות מ"ל צריך להתאים את מספר מוחות גזור.
- צנטריפוגה צינורות ב 1200 סל"ד (~ 300 גרם) במשך 5 דקות.
- בזהירות לשאוב supernatant ולהוסיף 1 מ"ל של מעורבות התקשורת חמים תרבות גליה אל צינור חרוטי 15 מ"ל כל אחד.
- לאט לאט resuspend את הכדור עם קצה פיפטה P1000, נזהר לא להכניס בועות. מוסיפים את ההשעיה תא מהצינור לכל בקבוקון מראש equilibrated T25 PLL מצופה, עיבוד הנפח הכולל של התקשורת תרבות מ"ל 6.
- מניחים את צלוחיות של תרבית רקמה חממה 3-4 שעות על מנת לאפשר לתאים לצרף המצע PLL. בצע שינוי התקשורת מלאה על ידי pipetting את התקשורת, והוסיף 6 מ"ל של מעורבות התקשורת טרי תרבות גליה על צלוחיות. צעד זה מסיר הרבה פסולתנגרמת על ידי טחינה דקה, ומקדם תרבות הכדאיות. אם OL / DRGN שיתוף תרבויות הם הרצויה, עיין בסעיף 3 של פרוטוקול זה.
- אחרי 3 ימים של תרבות, לבצע שינוי 2 / 3 על ידי הסרת התקשורת 4 מ"ל של התקשורת, והחלפת עם 4 מ"ל של מעורבות התקשורת טרי תרבות גליה. בשלב זה, monolayer astrocyte יש להרכיב על בסיס של צלוחיות.
- ביום 6, לבצע עוד 2 / 3 מדיה לשנות להשלים את צלוחיות עם ריכוז סופי של אינסולין מיקרוגרם / מ"ל 5. בשלב זה, monolayer astrocyte צריך להיות לעין, על גבי אשר OPCs יהיה מתרבים.
3. DRGN בידוד
הערה: כדי להפיק OL / DRGNs שיתוף תרבויות, DRGNs יש לקבוע יום אחרי דור מעורב תרבות גליה. שני הסוגים תרבות גדלים באופן עצמאי, בשילוב לאחר 9-10 ימים.
- הקורבן P5-P10 העכבר בהתאם להנחיות מוסדיים.
- חלץ את עמוד השדרה, ולהעביר בצלחת פטרי נקי.
- לחתוך כמו שרירים ועצמות הרבה מעמוד השדרה ככל האפשר (איור 1 ד ', ד), כמו זה יהיה להקל על דיסקציה של הגרעינים השורש הגבי (DRGs).
- מעבירים את עמוד השדרה כדי גזוז חדש צלחת פטרי הגחון למעלה בצד. בעזרת מספריים לנתיחה ולהתחיל caudally, לחתוך מדיאלית דרך עמוד השדרה בצורה אורכית.
- בעזרת שני זוגות מלקחיים, בעדינות לפרוץ את עמוד השדרה על מנת לחשוף את חוט השדרה.
- DRGs ניתן למצוא מתחת ו לרוחב בעמוד השדרה. בעזרת מלקחיים היטה בסדר, בעדינות להסיר את DRGs תוך הימנעות נזק בגרעיני (איור 1e).
- מעבירים את הסיר DRGs לפתרון שנאגרו קרים של האנק מלח (HBSS, ללא אנטיביוטיקה) בצלחת פטרי חדש. מבתר לשאוף לחלץ 40 DRGs לכל עכבר (איור 1f).
- לאחר DRGs הופקו, חתוך את כל השורשים של DRGs ארוך מדי (איור 1g, "ז) כדי למזער את ההקדמה של תאים מזהמים לתוך התרבות (ותאי גלייה, fibroblasts).
- מעבירים את DRGs לצינור צנטריפוגה 1.5 מ"ל המכיל 500 μL של HBSS קרח קר.
- צנטריפוגה ב 1200 סל"ד (~ 300 גרם) במשך 5 דקות ב 4 ° C עד גלולה DRGs.
- העברת צינורות צנטריפוגות כדי ברדס רקמה סטרילית תרבות להסיר את HBSS מן הצינורות.
- הוספת 500 μL של טרום התחמם (20 דקות בשעה 37 ° C) DRG פתרון papain ו דגירה צינורות אמבטיה 37 מעלות צלזיוס במשך 10 דקות במים. היפוך הצינורות כל 2 דקות כדי למנוע הצטברות רקמות.
- חזור על שלב 3.10.
- הסר את הפתרון papain DRG ולהוסיף 500 μL של (20 דקות בשעה 37 ° C) מראש חימם collagenase פתרון. מדגירים את אמבט המים 37 מעלות צלזיוס למשך 10 דקות, כל 2 דקות היפוך.
- חזור על שלב 3.10.
- הסר supernatant ולהוסיף 1 מ"ל של DRGN התקשורת. היפוך מספר פעמים צינור.
- חזור על שלב 3.10.
- חזור על שלב 3.16.
- מעיל סטרילי להבה זכוכית מלוטשת פיפטה פסטר עם אלבומין בסרום שור (BSA) על ידי pipetting פתרון של BSA 0.25% ב מספר פעמים HBSS. הציפוי עם פתרון BSA תמנע DRGs מתוך דבקות קירות פיפטה מזכוכית.
- Triturate DRGs עם פיפטה BSA מצופה בעדינות בהתחלה, בעוצמה גוברת פעם גושים להתחיל dissociating. Triturate כ 10-15 פעמים, אולם מספר זה תלוי במידת העיכול, ומספר DRGs לכל צינור.
- לאחר ניתוק מושגת, להעביר את ההשעיה עד 50 מיקרומטר לסנן לתוך צלחת פטרי סטרילית המכילה 7 מ"ל של DRGN התקשורת. סינון יבטל הרבה של פסולת מן ההשעיה התא, למרות שצעד זה לא קריטי.
- דגירה צלחת פטרי ב 8.5% CO 2 כ 1.25 שעות.
- מספר Coat 12 מ"מ coverslips עם LN2 (10 מיקרוגרם / מ"ל PBS) בצלחת 24-באר בתקופה זו הדגירה.
- לאחר דגירה נגמר, לשמור על צלחת פטרי תחת שדה בהיר. DRGNs מזוהים גדול, תאים גוף כהה שלב. מערבולת צלחת פטרי להרים בעדינות כל DRGNs דבק.
הערה: תאים מזהמים רבים יצטרכו דבק חזק צלחת פטרי, ובכך להעשיר את ההשעיה הסלולרי שלך עבור DRGNs.
- מעבירים את ההשעיה לתא צינור חרוטי 15 מ"ל. לשטוף בעדינות את המנה עם 4 מ"ל של DRGN התקשורת לאסוף כל DRGNs שיורית. העברת מ"ל נוספים עד 4 צינור חרוטי.
- צנטריפוגה במשך 5 דקות ב 1200 סל"ד (~ 300 גרם).
- לשאוב supernatant ו resuspend גלולה ב 500 μL של התקשורת DRGN טריים.
- לחשב את מספר DRGNs הניב באמצעות hemocytometer. הקפידו רק לספור את DRGNs, סוגי תאים אחרים לא. DRGNs ניתן לזהות על ידי גופים גדולים שלהם תא כדורי.
- זרעים 30,000-50,000 DRGNs כדי coverslip LN2 מצופה כל 1 מ"ל של DRGN התקשורת, מקום 37 ° C רקמה תרבות החממה ב -8.5% CO 2 לילה.
- למחרת בבוקר, לבצע שינוי התקשורת מלא על ידי החלפת DRGNהתקשורת עם התקשורת OL (מינוס CNTF) עם ריכוז סופי של 1% פן / סטרפטוקוקוס ו 10 FuDR מיקרומטר.
- בימים 3 ו - 5, לבצע 3 / 4 עם התקשורת לשנות את התקשורת כמו בשלב 3.30.
- ביום 7, לבצע שינוי בתקשורת מלא עם התקשורת OL (מינוס CNTF, פן / סטרפטוקוקוס, FuDR).
- ביום 9, DRGNs צריך יצרו מיטה neurite נרחב, וכעת הם מוכנים להיות שיתוף תרבותי עם OPCs.
4. טיהור OPCs מתרבויות גליה מעורבת להקמת OL מועשר תרבויות או OL / DRGN שיתוף תרבויות
- ביום 9 התרבות גליה מעורבת, כדי להעביר את צלוחיות שייקר מסלולית ב 5% CO 2 רקמות התרבות בחממה. מניחים את צלוחיות על גבי צלוחיות ריקות T25 למנוע החום שנוצר מן שייקר מסלולית מן להשפיע לרעה על תרבויות גליה מעורבת. אפשר התרבויות לאזן את זה חממה חדשה עבור 1 שעה.
- לאחר צלוחיות יש equilibrated, לנער את צלוחיות בסל"ד 50 דקות 45. מטרת לנער הזה היא להסיר את כל התאים לזהם חסיד רופף מ monolayer.
- הזז תאים בתרבית רקמה ברדס ולהסיר את כל אמצעי התקשורת מן הבקבוקים. החלף עם 4 מ"ל של מעורבות התקשורת טרי תרבות גליה בתוספת 5 מיקרוגרם / מ"ל אינסולין.
- מניחים את צלוחיות בחזרה אל שייקר, ומאפשרים לאזן במשך כ 3 שעות.
- לאחר צלוחיות הם equilibrated, להדק אותם היטב שייקר מסלולית, ולנער צלוחיות במשך כ 16 שעות 220 סל"ד (לילה).
- למחרת בבוקר, אם OLS יש גדל בהעדר DRGNs (כלומר, OL מועשר התרבות), מספר מעיל סטרילי 12 מ"מ coverslips עם LN2 (10 מיקרוגרם / מ"ל PBS) במשך שעה 1. מעבירים את coverslips ל 24 גם כלים, לשטוף עם PBS ואחריו לשטוף התקשורת OL. הוסף 1 מ"ל של התקשורת OL היטב כל לאזן ב 8.5% CO 2.
- לאזן 10 ס"מ רקמות מנות תרבות 5% CO 2 למשך 30 דקות. מנה אחת תידרש לכל 2 צלוחיות. אלה ישמשו את העשרת הידבקות-ההפרש של OPCs תנאי.
- לאחר 30 דקות איזון תקופת עבר, להעביר את התקשורת מן צלוחיות מזועזע אל הכלים. כל מנה צריכה לקבל מדיה 2 צלוחיות, שווה כ -8 מ"ל של השעיה תא לכל צלחת 10 ס"מ.
- דגירה את הכלים בריבית של 5% CO 2 למשך 30 דקות, תוך מתן דחיפה קלה על סימן 15 דקות. דחיפה זה יעזור למנוע OPCs מתוך דבקות צלחת 10 ס"מ.
- לאחר דגירה תושלם, לבחון את הכלים תחת שדה בהיר. OPCs מזוהים גושי תאים קטנים, בדרך כלל של 3-5 תאים אבל לפעמים בצורת אגרגטים גדול הדומה neurospheres. רבים שאינם OL תאים השושלת צריך להיות דבק בתקיפות לבסס את הצלחת. בעדינות מערבולת הצלחות לנתק כל OPCs דבק רופף, ולהעביר את ההשעיה התא כל צלחת לתוך צינור חרוטי 15 מ"ל.
- צנטריפוגה ב 1200 סל"ד (~ 300 גרם) במשך 5 דקות.
- Resuspend גלולה ב 1 מ"ל של התקשורת OL עם קצה פיפטה P1000, ואחריו resuspension עם קצה פיפטה P200.
- ספירת התאים באמצעות hemocytometer.
- בשביל מועשר-OL תרבויות, זרע 25,000 - 50,000 OPCs זה coverslip 12 מ"מ מצופה LN2 בנפח סופי של 1 מ"ל התקשורת OL.
- עבור OL / DRGN שיתוף תרבויות, לבצע התקשורת OL מלא (מינוס CNTF) שינוי על DRGNs ממדור [3], בעדינות להוסיף 50,000 תאים ההשעיה OPC מועשר התא. שימו לב שלא לשבש את המיטה neurite DRGN במהלך תוספת של OPCs.
- המקום התרבויות 37 ° C החממה ב 8.5% CO 2, ולהימנע עד הסרת קיבוע. OPCs Murine רגישים לשינויים ב-pH, והסרה של החממה תשנה את ה-pH של התקשורת OL. כן, יש לציין, תוספת של DH 2 O ל בארות ריק סביב בתרביות תאים ימנע אידוי של התקשורת והתרבות, ובכך ממזערת את תנודות מומסים בתוך ריכוזי התקשורת OL. זה יספק סביבה עקבית יותר עבור OPCs.
5. עיבוד של תרבויות עבור מיקרוסקופיה immunofluorescence
- תקן תרבויות עם מתנול 100% ב -20 מעלות צלזיוס למשך 10 דקות, או 3% paraformaldehyde בטמפרטורת החדר למשך 15 דקות.
- Permeabilize coverslips עם 0.1% Triton-X-100 במשך 10 דקות, לשטוף עם פוספט שנאגרו לחסום מלוחים (PBS) וכן במשך שעה 1 בסרום עיזים 10%.
- Coverslips דגירה עם נוגדנים העיקרי מדולל חסימת פתרון בן לילה ב 4 ° C.
- לשטוף coverslips 3 פעמים עם PBS, ו דגירה עם Alexa-פלואוריד נוגדנים משני מצומדות (Invitrogen) מדולל חסימת פתרון 45 דקות.
- Counterstain עם 4 ',6-diamidino-2-phenylindole (DAPI) ולשטוף coverslips מספר פעמים עם PBS.
- הר coverslips ב DAKO פלורסנט הרכבה בינונית.
- ניתוח שקופיות באמצעות מיקרוסקופיה immunofluorescence. בפרוטוקול זה, מגלשות נותחו גם עם Axiovert Zeiss פלואורסצנציה 200 מיליון הפוכהמיקרוסקופ או 510 LSM Zeiss לייזר META סריקת מיקרוסקופ confocal.
6. תאים שלמים חלבון חילוץ מתוך OL מועשר תרבויות
- הסר 24 גם תרבויות מן החממה מגניב על קרח דק 3.
- מוציאים בזהירות התקשורת, ולהוסיף 10-20 μL של חיץ תמוגה (50 mM טריס-HCl, 150 mM NaCl, 0.1% SDS, deoxycholate נתרן 0.5%, 1% Triton-X-100, עם pepstatin 0.1%, aprotinin, PMSF, leupeptin, orthovanadate נתרן) היטב לכל (מינימום של 8 בארות לפי המדגם הוא הציע).
- גרדו בארות שימוש רחב נשא P1000 קצה פיפטה, ולהעביר את lysate אל צינור צנטריפוגה 1.5 מ"ל.
- במעבר lysate באמצעות מזרק ½ בקוטר 30 כ -15 פעמים, צמרמורת על קרח למשך 30 דקות.
- צנטריפוגה צינורות בסל"ד 14,000 (~ 20,000 ז) במשך 15 דקות ב 4 ° C.
- העברת supernatant לצינורות צנטריפוגות חדשות, חנות ב -80 ° C.
7. SDS-PAGE ניתוח על חלבון מועשר-OL תרבות
- פתור 30 מיקרוגרם חלבון לכל מדגם בהפחתת חיץ ידי-SDS על תקן acrylamide מרובה ג'לים 12%.
- חצי יבש העברת ג'ל על ממברנות PVDF.
- ממברנות חסום במשך שעה 1 ב 5% אבקת חלב רזה TBST (10 mM טריס-HCl pH 8.0, 150 mM NaCl, 0.1% Tween-20).
- דגירה ממברנות עם נוגדנים העיקרי מדולל חסימת פתרון לשעה 1.
- לשטוף ממברנות 3 פעמים עם TBST עבור 10 דקות.
- דגירה הממברנות עם HRP-מצומדות נוגדנים משני דקות 45 בחסימת פתרון.
- לשטוף ממברנות מספר פעמים עם TBST ו דגירה עם Amersham ECL פלוס מגיב המערבי זיהוי סופג (GE Healthcare) עבור 5 דקות.
- זיהוי להקות חלבון עם סרט רגיל הדמיה מדעית.
8. נציג תוצאות:
בפרוטוקול זה, OPCs מורחבות על monolayer astrocyte בתרבות גליה מעורבת. תרבות זו גליה מעורב נגזר קליפת P0-P2 עכבר הילוד. באותו יום 1 במבחנה (DIV1), תרבות גליה מעורב מכיל תאים עם מורפולוגיות שונות כפי שניתן לראות במיקרוסקופ על ידי שלב ניגודיות (איור 2 א). בשלב DIV3, monolayer astrocyte מתחילה להיווצר על בסיס של הבקבוק, ועל DIV8, OPCs ניתן להבחין בבירור על פני השטח monolayer. בשלב DIV9, OPCs מתרבים הגיעו צפיפות מספיק להיות מטוהרים ידי ניעור מהיר לילה מסלולית. לאחר סיום תהליך הטיהור הושלם, התוצאה היא אוכלוסייה OPC מועשר התא. בשלב טיהור DIV1 פוסט, OPCs יש מורפולוגיה פשוטה, הרחבת מספר תהליכים (איור 2b). בשלב טיהור DIV3 לפרסם, תאים הרחיבו meshwork מורכב של תהליכים, מזכיר OLS בשלה. בשלב טיהור DIV6 לפרסם, OLS מטוהרים יש משוטח מוקרן עלון מבנים דמויי קרום. התפתחות זו מורפולוגיים אופייני של הבשלה חוץ גופית של OLS.
מיקרוסקופיה immunofluorescence מציין את התאים מטוהרים הם OL-השושלת (איור 3a). Seeded OPCs בתחילה להביע כונדרואיטין סולפט proteoglycan (NG2), ולהתפתח גליקופרוטאין המיאלין הקשורים (הפצ"ר) OLS בשלה חיובית תוך זריעת שלושה ימים שלאחר (איור 3 ב). בשלב DIV6, OLS רבים להביע חלבון המיאלין הבסיסי (MBP), וכן בעלי מורפולוגיה אופיינית OL בוגרת. OL-שושלת תאים אחוז היו לכמת בנקודות זמן שונות כדי לקבוע את טוהר התרבויות OL מועשר (איור 3c). בשלב טיהור DIV1 לפרסם, תרבויות הם 50 ± 14% NG2 + OPCs יש, עם יש או אין MAG + MBP + OLS יש. זה מצביע על מטוהרים OL-שושלת תאים הנמצאים בשלב מקדים בזמן זריעה, עם מספרים זניחים של OLS מובחן. בשלב DIV3, OLS רבים הבדיל לתוך תאים MAG + ve (24 ± 5.9%) בעוד כמה שומרים על הפנוטיפ מבשר, ולהישאר NG2 + (13 ± 8.0%). בשלב DIV3, חלק קטן MAG תאים + ve (3.2 1.2%) הם גם להביע MBP. בשלב DIV6, 20 ± 5.9% של OLS הם MAG + ve תוך 12 ± 7.3% להתמיד כמו NG2 + OPCs יש. בנוסף, 21 ± 9.3% של תאים בתוך התרבות הם MBP + OLS יש בנקודה זו בזמן. SDS-PAGE הניתוח מראה את הביטוי מדורגת של 2'3'-מחזורית-נוקלאוטיד 3'-phosphodiesterase (CNP) ו MBP לעומת התקופה והתרבות 6 יום, עוד הוכחת היכולת של OPCs בתרבות כדי סופני להתמיין OLS בוגרת (איור 3D ). ביחד, נתונים אלה קובע בשיטה זו כאמצעי לייצור מערכת OL מועשר התרבות מתאים ללימוד התבגרות OL מ OPCs.
פרוטוקול זה גם מתאר שיטות להקים OL / DRGN שיתוף תרבויות באמצעות Murine בלבד מקורות רקמות. עם זאת, על מנת לייצר שיתוף תרבות, DRGNs צריך קודם להיות מתורבת לבד כדי לייצר רשת neurite הולם. שלאחר הלידה אלה תרבויות נוירון Murine גדלים במשך 9 ימים בתקשורת בסרום נמוך עם תוספת של 10 מיקרומטר FuDR כדי למנוע התפשטות של זיהום fibroblasts ו gl ial תאים. במהלך 9 ימים במבחנה, DRGNs מבודד לייצר מיטה neurite צפופים (איור 4 א). זו המיטה neurite הוא immunopositive עבור neurofilament סמנים עצביים 200 (NF) ו Tuj1 (איור 4 ב). בשלב זה, OPCs מטוהרים ניתן להוסיף מיטות neurite, ותרבותי עבור 6 ימים נוספים כדי לייצר myelinating שיתוף תרבויות.
בשלב DIV6 של OL / DRGN שיתוף תרבות, MBP רבים + OLS ve ניתן להבחין בין + יש neurites NF DRGN (איור 5 א). לאחר בחינה מדוקדקת יותר, הם עדות לכך OLS ליצור קשר עם neurites DRGN רבים, לעתים קרובות ensheathing אותם עם MBP + יש קרום (איור 5 ב, ג).
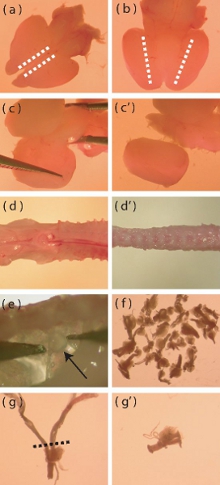
באיור 1. מיקרוסקופ Dissection תמונות של היבטים מסוימים של קליפת המוח בילוד עכבר ובידוד DRG. (א) להציג הגבי של המוח חילוץ טרי עכבר הילוד. קווים מקווקווים מצביעים על האזור שבו חתכים חייב להיעשות כדי להקל על הסרת שכבת קרום המוח. (ב) להציג הגחוני של המוח, קווים מקווקווים מצביעים על האזור שבו בקליפת פוגש את diencephalon הגחון. חתכים עמוקים חייבת להתבצע לאורך הקווים המקווקווים לסייע בבידוד של קליפת המוח. (C-c ') תיאור חזותי של כמה לחטט קליפת הרחק יתרת המוח. (ד) מבודדים טרי P5-P10 עמוד השדרה העכבר לפני זמירה משם עודף שרירים ועצמות (ד '). (ה) מיקום DRGs בתוך עמוד השדרה. (ו) המספר המשוער של DRGs כי יש לבודד עכבר אחד. (ז) DRG עם שורשים ארוכים שדורשים זמירה לפני עיכול אנזימטי. הקו המקווקו מציין את האזור בו שורשי צריך להיות trimmed. (ו ') הודעה DRG שורש זמירה.
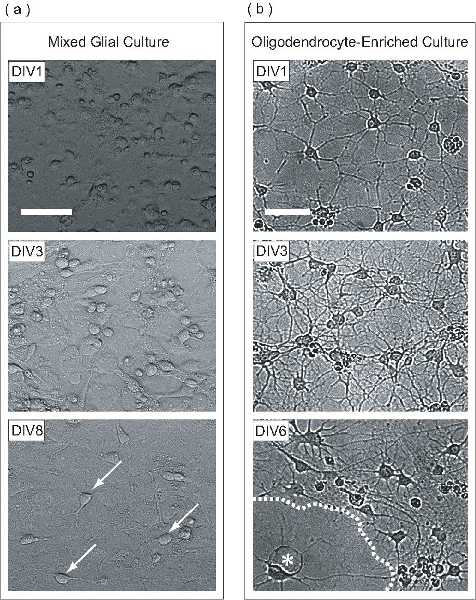
איור 2. OPCs מורחבות בתוך התרבות גליה מעורבת, מטוהרים, הבדיל לאחר מכן כתרבות OL מועשר. (א) בניגוד שלב תמונות של תרבויות גליה מעורבים בשלבים שונים של פיתוח. בשלב DIV1, תאים להופיע בסיבוב עם תאים שטוח מעט. ריבוד של התרבות גליה מעורבת מתחיל DIV3, שם צורה האסטרוציטים monolayer אחיד בבסיסו של הבקבוק, שעליו OPCs להתרבות. OPCs רבים נתפסים על DIV8 (חיצים) דבקה פני השטח של monolayer astrocyte. (ב) לאחר מטוהרים מן התרבות גליה מעורבת, DIV1 OPCs הרחיבו רק מספר תהליכים. בשלב DIV3, תאים הרחיבו תהליכים רבים, מזכיר ביניים בשלב OLS. בשלב DIV6, OLS שטוח (כוכבית) נראה יצרו גיליונות קרומי (קו מקווקו). סולם ברים, 50 מיקרומטר.
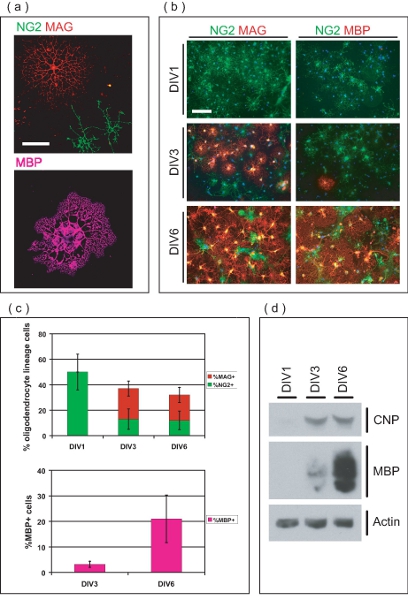
איור 3. אפיון של התרבות OL מועשר. (א) תמונות של Confocal OLS מבודדת בשלבים שונים של פיתוח. NG2 + OPCs יש יש מורפולוגיה פשוטה, בעוד MAG + OLS יש להחזיק תהליכים arborous מרובים. MBP + OLS יש הרחיבו קרומי מיאלין כמו סדינים. סרגל קנה מידה, 50 מיקרומטר. (ב) מטוהרים OL-שושלת תאים שמקורם ככל OPCs ו להתמיין MAG + ve, MBP OLS + יש מעל DIV 6. בשלב DIV1, OPCs כל NG2 + ve, בעוד שאף הם MAG + ve או MBP + ve. בשלב DIV3, MAG + ve ו MBP כמה + OLS יש כיום ברור. רוב OLS הם MAG ו MBP יש + ב DIV6, עם NG2 שנותרו + OPCs יש. סרגל קנה מידה, 100 מיקרומטר. (ג) ממוצע ערכים ± סטיית תקן של OL-שושלת תאים אחוז בשלבים שונים של פיתוח מעל DIV 6. בשלב DIV1, כל OL-השושלת תאים NG2 +, יש החשבונאי 50 ± 14% של תאים הכולל בתרבות. בשלב DIV3 ו DIV6, OL-השושלת תאים בהתאמה בחשבון 36 ± 6.8% ו - 32 ± 8.4% של תאים הכוללת, המורכבת משתנות הפרופורציות של NG2 + ve, MAG + ve ו MBP + OLS ve.) ד (SDS-PAGE שבוצעה על חלבונים שמקורם מועשר-OL תרבויות הוכחת ביטוי מדורגת של OL-סמנים CNP ו MBP במהלך תקופת 6 תרבות DIV.
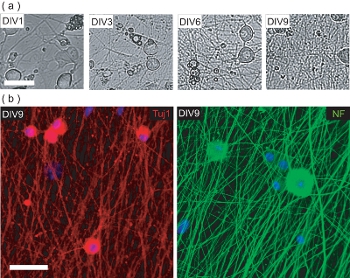
איור 4. אפיון של זריעת מראש OPC תרבות DRGN. (א) שלב תמונות ניגודיות של DRGNs במהלך התקופה 9 DIV תרבות טרום OPC זריעה. DRGNs מקורן כמו גדול גוף תאים עם כמה תהליכים, לייצר רשת neurite מורכבים יותר ויותר. סרגל קנה מידה, 100 מיקרומטר. (ב) תמונות Confocal של תרבויות DRGN קבוע DIV9 (טרום זריעה OPC) ומוכתמת עבור נוירון הסמנים הספציפיים Tuj1 ו NF200. DRGNs יצרו רשת neurite שעליו OPCs ניתן seeded לייצר OL / DRGN myelinating שיתוף תרבויות. סרגל קנה מידה, 50 מיקרומטר.
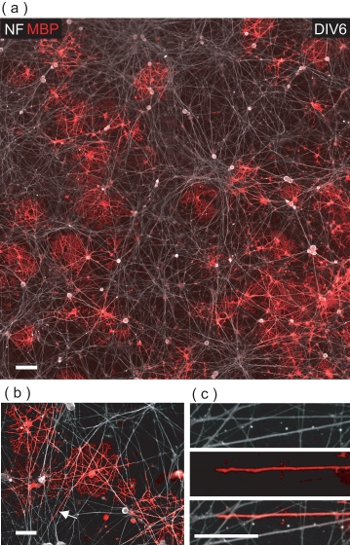
איור 5. OLS שיתוף תרבותי עם תוצאה DRGNs בעטיפה OL בתיווך של neurites DRGN עם MBP + ממברנה יש. (א) תמונה 4 שדה confocal מונטאז' של תרבות משותפת DIV6 OL / DRGN. MBP רבים + OLS ve ניתן לראות אינטראקציה עם המיטה DRGN הבסיסית neurite. סרגל קנה מידה, 100 מיקרומטר. (ב) להציג confocal מוגדל של MBP + OLS יש גלישת neurites DRGN מרובים. סרגל קנה מידה, 50 מיקרומטר. (ג) הגדלה דיגיטלית של אזור מסומן ב (ב) שבו neurite DRGN הוא להיות עטוף קרום OL. סרגל קנה מידה, 25 מיקרומטר.
Discussion
דו"ח זה מתאר שיטה לבידוד OPCs Murine לבידול בתרבויות OL מועשר או OL / DRGN שיתוף תרבויות. כאשר בתרבית לבד, OPCs להתמיין MBP + OLS יש, ייצור המיאלין כמו סדינים קרומי. כאשר נוספו DRGN מיטות neurite, OLS ללפף neurites DRGN עם MBP + ממברנה יש. מודל זה יתרונות חקירת היסודות מורכבים השולטים OL בתיווך ensheathment axonal.
בעוד בעל ערך רב, את הקמתה של תרבויות כאלה הוא מאתגר מבחינה טכנית. בפרט, בדרישה לכלול את ההיבטים לעיכול רקמת יעיל / דיסוציאציה, ותחזוקה של תרבות התקשורת pH מאוזן, DRGN שינויים התקשורת. חשוב לקחת בחשבון את אורך מערכת העיכול, כמות רקמת מתעכל וכמות טחינה דקה משפיע על התוצאה היעילות בסופו של ניתוק הרקמה. אין זה יוצא דופן עבור חוקרים מנוסים כדי להשיג תשואות הסלולר נמוך מ ניתק ברקמות מערכת העצבים. בנוסף, OPCs Murine נוטים להיות רגישים לשינויים ב-pH של התקשורת בתרבות, במיוחד בתנאים בסיסיים. תחזוקה של תרבויות ב 8.5% CO 2 נועד למנוע זאת, מאז OPCs נראה טוב יותר לסבול תנאים חומציים קצת יותר בסיסי. באשר DRGNs האכלה, שינויים התקשורת חייב להתבצע מהר ככל שלא ליבש את הנוירונים, לעומת זאת, חייב להיות עדין לא לשבש את המיטה neurite מתפתחות. פתאומית שינויים התקשורת עשוי לסלק את המיטה neurite מן המצע, והתוצאה סביר ניתוק מוחלט מן coverslip.
בזכות הפוטנציאל של מערכת מודל זה מאפיל מאוד תובענית מבחינה טכנית הטבע שלה. אחד היתרונות של המערכת הזו הוא השימוש שלאחר הלידה עכברים עבור הגזירה תרבית תאים, עקיפת הצורך להקריב את הנקבות לרבייה לקצור רקמה עוברית. יתרון נוסף הוא היעדר דרישה גורמי גדילה (GFS) להרחבת OPCs. תרבויות גליה מעורב לספק סביבה תומכת הפצת OPCs, כנראה בשל נוכחותם של astrocyte הנגזרות גורמים trophic. שיטות אחרות, כגון גזירה באמצעות neurospheres 7,8, להסתמך על המאפיינים mitogenic של GFS כגון גורם גדילה פיברובלסטים בסיסי (bFGF), גורם הגדילה באפידרמיס (EGF) ו טסיות הנגזרות גורם הגדילה (PDGF) להרחבת OPC. באופן דומה, תוך שימוש לאחר הלידה (P5-10) עכברים עבור DRGNs ימנע את הדרישה להשלים את תרבות התקשורת עם גורם הגדילה העצבי (NGF), גורם neurotrophic הנדרשת עבור ההישרדות של DRGNs עובריים במבחנה 9, 10. מעניין להימנע משימוש NGF כפי שהוא משפיע לרעה על יכולת myelinating של OLS כאשר בתרבית עם DRGNs 4. הימנעות משימוש GF-שיושלם התקשורת יש גם יתרונות כלכליים, כמו ריאגנטים אלה הופכים יקרים כאשר נעשה שימוש בקנה מידה גדול.
אולי היתרון החשוב ביותר של מודל זה בתרבות היא גזירה מן העכבר בלבד רקמות, ובכך לספק את ההזדמנויות לגזור הן OPCs ו DRGNs ממגוון רחב של קווי עכבר מהונדס. זה מאפשר לימוד והן DRGN / או OPC ספציפיים המאפיינים השולטים myelination. זה יהיה חשוב במיוחד עבור הבהרת קולטן / אינטראקציות ליגנד ויסות OL בתיווך myelination של אקסונים. בסך הכל, טכניקה זו היא בעלת ערך רב לגבי מחקר מדעי המוח עקב היישומים שלה לקראת הבנה רמזים המולקולריים שבבסיס myelination.
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
פרויקט זה מומן על ידי מענק מטעם האגודה לטרשת נפוצה בקנדה RKRWO הוא מקבל תעודת סטודנט מטעם האגודה לטרשת נפוצה בקנדה. SDR הוא הנמען של פוסט דוקטורט של האגודה לטרשת נפוצה בקנדה קנדה המכונים לחקר בריאות.
Materials
| Name | Company | Catalog Number | Comments |
| שם המוצר | חברה | מוצר מספר | |
| Dulbecco של הנשר השתנה בינוני (DMEM) | Multicell | 319-005-CL | |
| האנק של פתרון מאוזן מלח (HBSS) | Invitrogen | 14170-112 | |
| מדיה Essential Minimum (ממ) | GIBCO | 12360-038 | |
| עוברית שור סרום (FBS) | GIBCO | 10091-148 | |
| פניצילין, סטרפטומיצין (פן / סטרפטוקוקוס) | GIBCO | 15140-122 | |
| GlutaMAX | Invitrogen | 35050-061 | |
| פולי-L-ליזין | סיגמא אולדריץ | P2636 | |
| שור סרום אלבומין (BSA) | סיגמא אולדריץ | A4503 | |
| האדם merosin מטוהרים חלבון (LN2) | Millipore | CC085 | |
| רקומביננטי neurotrophic ריסי חולדה גורם (CNTF) | PeproTech | 450-50 | |
| L-תירוקסין | Biochemika | 89430 | |
| הולו-transferrin | סיגמא אולדריץ | T0665 | |
| תוסף B27 | GIBCO | 0080085-SA | |
| שור אינסולין | סיגמא אולדריץ | I6634 | |
| 3,3 ",5-Triiodo-L-thyronine | סיגמא אולדריץ | I6634 | |
| הפרוגסטרון | סיגמא אולדריץ | P8783 | |
| Putrescine | סיגמא אולדריץ | P7505 | |
| נתרן סלניום | סיגמא אולדריץ | S5261 | |
| 5-Fluoro-2'-deoxyuridine (FuDR) | סיגמא אולדריץ | F0503 | |
| Papain פתרון | וורטינגטון | LS003126 | |
| DNaseI | רוש | 1010159001 | |
| L-ציסטאין | סיגמא אולדריץ | C7352 | |
| 24 גם בתרבית רקמה מנות | Cellstar | 662-160 | |
| צלוחיות T25-רקמות תרבות עם מכסה האוורור | קורנינג | 430639 | |
| 10 רקמת ס"מ תרבות מנות | קורנינג | 430167 | |
| 10 ס"מ צלחת פטרי | פישר סיינטיפיק | 0875713 | |
| Collagenase | רוש | 103578 | |
| CellTrics 50 מיקרומטר לסנן (לא חובה) | PARTEC | 04-004-2327 | |
| המיאלין בסיסי חלבון (MBP) נוגדן | עבד Serotec | MCA409S | |
| NG2 נוגדן | Millipore | AB5320 | |
| המיאלין-Associated (הפצ"ר) גליקופרוטאין נוגדן | Millipore | MAB1567 | |
| 2 ', 3'-מחזורי-נוקלאוטיד 3'-phosphodiesterase (CNP) נוגדן | Covance | SMI-91R-100 | |
| אקטין מחבת Ab-5 נוגדן | פיצג'רלד | 10R-A106AX | |
| Neurofilament-200 (NF) נוגדן | סיגמא אולדריץ | N4142 | |
| בטא 3 טובולין שרשרת (Tuj1) נוגדן | Millipore | MAB5544 | |
| אלקסה פלואוריד 488 נגד ארנב עז IgG (H + L) נוגדנים משני | Invitrogen | A11008 | |
| אלקסה פלואוריד 555 אנטי עכבר עז IgG (H + L) נוגדנים משני | Invitrogen | A21422 | |
| אלקסה פלואוריד 647 עיזים נגד חולדה (IgG) (H + L) נוגדנים משני | Invitrogen | A21247 | |
| אנטי עכבר עיזים IgG (H + L)-HRP נוגדנים משני מצומדות | BioRad | 170-6516 | |
| אנטי עכברוש עיזים IgG (H + L)-HRP נוגדנים משני מצומדות | סנטה קרוז ביוטכנולוגיה | SC-2065 | |
| 4 ',6-diamidino-2-phenylindole (DAPI) | סיגמא אולדריץ | D9542 |
Media מתכונים
100x-OL מוסף *
| מרכיב | סכום להוסיף |
| DMEM | 100 מ"ל |
| BSA | 1.02 גר ' |
| הפרוגסטרון | 0.6 מ"ג |
| Putrescine | 161 מ"ג |
| נתרן סלניום | 0.05 מ"ג |
| 3,3 ",5-Triiodo-L-thyronine | 4 מ"ג |
* חנות ב -80 מעלות צלזיוס ב 250 aliquots μL
t "> מדיה OL| מרכיב | סכום להוסיף |
| DMEM | 23.75 מ"ל |
| 100x-OL מוסף | 250 μL |
| אינסולין שור (ממלאי מ"ג / מ"ל 1) | 125 μL |
| GlutaMAX | 250 μL |
| הולו-transferrin (ממלאי מ"ג / מ"ל 33) | 37.5 μL |
| B27 מוסף | 500 μL |
| FBS | 125 μL |
| CNTF (ממלאי ng / μL 50) | 25 μL |
מעורבות בתרבות התקשורת גליה (מורכב ב DMEM)
| מרכיב | הריכוז הסופי |
| FBS | 10% |
| פן / סטרפטוקוקוס (0.33% מהמלאי) | 33 יחידות / מ"ל ו - פניצילין 33 מיקרוגרם / מ"ל סטרפטומיצין |
| GlutaMAX | 1% |
DRGN מדיה (מורכב ב DMEM)
| מרכיב | הריכוז הסופי |
| FBS | 10% |
| פן / סטרפטוקוקוס (1% מן המניות) | 100 יחידות / מ"ל ו - 100 מיקרוגרם פניצילין / mL סטרפטומיצין |
הפתרון עיכול מתכונים:
OPC papain פתרון (מורכב מ ב)
| מרכיב | הריכוז הסופי |
| Papain פתרון | 1.54 מ"ג / מ"ל |
| L-ציסטאין | 360 מיקרוגרם / מ"ל |
| DNaseI | 60 מיקרוגרם / מ"ל |
DRG papain פתרון (מורכב ב HBSS)
| מרכיב | הריכוז הסופי |
| Papain | 1.54 מ"ג / מ"ל |
| L-ציסטאין | 360 מיקרוגרם / מ"ל |
DRG collagenase פתרון (מורכב ב HBSS)
| מרכיב | הריכוז הסופי |
| Collagenase | 4 מ"ג / מ"ל |
References
- Avellana-Adalid, V. Expansion of rat oligodendrocyte progenitors into proliferative "oligospheres" that retain differentiation potential. J Neurosci Res. 45, 558-570 (1996).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Barres, B. A. Cell death and control of cell survival in the oligodendrocyte lineage. Cell. 70, 31-46 (1992).
- Chan, J. R. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43, 183-1891 (2004).
- Camara, J. Integrin-mediated axoglial interactions initiate myelination in the central nervous system. J Cell Biol. 185, 699-712 (2009).
- Ishibashi, T. Astrocytes promote myelination in response to electrical impulses. Neuron. 49, 823-832 (2006).
- Chen, Y. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat Protoc. 2, 1044-1051 (2007).
- Pedraza, C. E. Production, characterization, and efficient transfection of highly pure oligodendrocyte precursor cultures from mouse embryonic neural progenitors. Glia. 56, 1339-1352 (2008).
- Lewin, G. R., Ritter, A. M., Mendell, L. M. On the role of nerve growth factor in the development of myelinated nociceptors. J Neurosci. 12, 1896-1905 (1992).
- Greene, L. A. Quantitative in vitro studies on the nerve growth factor (NGF) requirement of neurons. II. Sensory neurons. Dev Biol. 58, 106-113 (1977).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved