Method Article
出生後のマウス組織から培養オリゴデンドロサイトと共培養Myelinatingニューロン/オリゴデンドロサイトエンリッチドの導出
要約
この記事では、成熟オリゴデンドロサイト(OLS)を生成するために差別化初代培養におけるマウスのオリゴデンドロサイト前駆細胞体(OPC)の豊かな集団を、導出する方法を説明します。さらに、この報告書はマウス後根神経節ニューロン(DRGNs)の神経突起ベッドの上にマウスのOPCを播種によってマウスmyelinating共培養を生成する手法を説明します。
要約
OL開発の根底にある分子機構を同定することはOL生物学の知識を深めるには重要であるだけでなく、このような多発性硬化症(MS)などの脱髄疾患の病因を理解するための意味を持っています。携帯電話の開発は、一般的に一次細胞培養モデルで研究されている。初代培養細胞は、 生体内に存在する余分な変数の自由、制御された環境を提供することにより、所定の細胞型の評価を容易にする。ラット由来OLの文化がOL生物学への洞察の膨大な量を提供しているが、マウスからOLの文化を確立することで、同様の努力が大きな障害に満たされている。文化マウス一次OLSする方法を開発することは可能なトランスジェニックマウス系統を利用するために不可欠です。
げっ歯類の組織からOPCを抽出するための複数のメソッドは、ニューロスフェアの導出、差動接着精製と1-3免疫精製に至るまで、記載されている。多くのメソッドが成功を提供していますが、ほとんどは大規模な文化の時間および/または高価な機器/試薬を必要とする。これを回避するために、当初はマッカーシー&デVellis 2で説明した方法の適応とマウス組織からOPCを精製することが好ましい。このメソッドは、新生児げっ歯類皮質由来する混合グリア培養液から物理的に分離するOPCを伴います。結果は、OLに富んだ文化に分化することができる精製したOPCの人口です。このアプローチは、その比較的短い文化時間や成長因子またはimmunopanning抗体の不必要な要件のために魅力的です。
精製された文化の中でOL発展のメカニズムを探ることは有益ですが、それは、髄鞘形成を評価するための最も生理学的に関連する環境を提供していません。ニューロンとの共培養のOLSは、軸索のOLを介した髄鞘形成を制御する分子的基盤への洞察を貸すだろう。多くのOL /ニューロンの共培養の研究については、後根神経節ニューロンは(DRGNs)選択肢のニューロンのタイプであることが証明されている。彼らは、抽出、混入細胞の最小限の量、そして緻密な神経突起のベッドの形成の容易さのため、OLSとの共培養に最適です。ラット/マウスmyelinating xenoculturesを用いた研究が4-6を公開されているが、出生後のマウス組織から共培養をmyelinatingなど/ OL DRGNの導出のための方法が記載されていない。ここでは、効果的に予想される結果の例と共に、そのような文化を生産する方法に関する詳細な方法を提示する。これらのメソッドは、OL開発/ myelinating機能に関連する質問に対処するために有用であり、神経科学の分野で有用なツールです。
プロトコル
倫理に関する声明
本研究で使用したマウスは、アニマルケアに関するカナダの協議会(CCAC)のガイドラインに従って世話した。実施した実験のための倫理的な承認は、プロトコル番号OGH - 119の下オタワアニマルケア委員会の大学から得た。
1。解剖 - OPC抽出のための新生児マウスの皮質
- 制度的なガイドラインに従ってP0 - P2マウスを生け贄に捧げる。
- 氷冷したMEMを(抗生物質フリー)を含むペトリ皿の脳と場所を細かく分析。
- 解剖顕微鏡に料理を転送する。
- まで脳の背側でメスを用いて、各皮質(図1a)の最も内側の端に沿ってsagittally浅い切開を行います。この切開は、その除去を容易にするために、髄膜層を介して渡す必要があります。
- 横方向のファッションで髄膜剥離する微細な先端鉗子を使用してください。慎重に行っている場合、この層が一体的に削除することができます。このステップの間に、嗅球を除去。
- 脳腹側を上向きにして、皮質が間脳の腹側領域(図1bを)満たす深い矢状切開を行います。
- サイドアップ脳の背側で、横方向のファッション(図1C、C')に内側の組織をこじ開け中脳から皮質を分離。このステップでは、残った髄膜を取り除きます。
- 約4枚に各皮質をダイスと優しくMEMあたりのマウスの脳の350μLを含む15 mLコニカルチューブに移す。すべてのマウスが処理されるまで、チューブを氷上にしてください。
- 残りのマウスのためのステップ1.1から1.8を繰り返します。
2。新生児皮質と混合グリア培養のメンテナンスの解離
注:細胞懸濁液に気泡の導入は、次の手順のすべての間に避けるべきである。
- 3分間37℃の水浴に新鮮な解剖脳を含む15 mLコニカルチューブを追加。
- 無菌組織培養フードに脳を転送する。
- そっと小さな断片を生成するためにP1000ピペットチップを通してさいの目皮質を渡します。ピペットチップを介してサスペンションのスムーズな流れを混乱させるのに十分な大きさは脳の部分がない後、ピペッティングを停止します。
- コニカルチューブに脳あたりOPCパパイン液の75μLを加える。 OPCパパイン溶液を、37で予め温めておいたされている必要があります·使用する前に20分間。
- 20分間37℃の水浴でインキュベートする。約2分ごとに、そっとティッシュの凝集を防ぐためにチューブを反転させる。この時間の間、37℃の組織培養インキュベーター内の各ポリ- L -リジン(PLL)コーティング(1 mg / mL)はT25フラスコ(マウスの脳ごとに1つのフラスコ)、および場所でする混合グリア培養液5 mLを加える8.5パーセントのCO 2。
- 20分後、無菌フードに組織懸濁液を戻し、チューブに脳あたり混合グリア培養液2 mlを加え。 OPCパパイン液の不活化を可能にするために、室温で10分間放置します。
- 5 mLのプラスチックチューブに分注し組織懸濁液を。管の数は、試験管当たり約2.5mLの結果、解剖脳の数と一致する必要があります。
- 滅菌難研磨ガラスパスツールピペットを用いて、静かに各チューブに組織をひいて粉にする。最初はゆっくりひいて粉にする、との部分が解離するにつれて徐々に速度を増加させる。約10〜15回をひいて粉にする、しかし、この数は消化の有効性に基づいて異なる場合があります。
注:アンダー磨砕は、過剰粉砕に悪影響を細胞の生存に影響を与えるのに対し、組織の貧しい解離になります。これは深刻な細胞の生存に影響を与えるとして、溶液中に気泡を導入しないことが重要です。
- 一度懸濁液中に残っている目に見える組織塊が存在しない、脳あたり混合グリア培養培地を4mL( すなわち 、4頭= 16 mLの混合グリア培養培地)を含む50mLのコニカルチューブに移す。
- 静かに残りの5 mLチューブ用50 mLコニカルチューブと繰り返し反転。
- 15 mLコニカルチューブ(15 mLの試験管当たり約6.5 mL)中に分注し、プールされた細胞懸濁液を。 15 mLの試験管の数は、解剖脳の数と一致する必要があります。
- 5分間1200rpmで(〜300 g)でチューブを遠心する。
- 注意深く上清を吸引し、各15 mLコニカルチューブに暖かい混合グリア培養培地1 mLを加える。
- 徐々に気泡を導入しないように注意しながら、P1000ピペットチップとペレットを再懸濁します。 6 mLのために培地の総容積をレンダリングする、各チューブから予め平衡化PLLでコーティングされたT25フラスコに細胞懸濁液を追加します。
- 細胞はPLL基板に接続できるように3-4時間のために組織培養インキュベーターにフラスコを置きます。メディアをピペッティングし、フラスコに新鮮な混合グリア培養培地6 mLを添加することにより、完全なメディアの変更を行います。このステップでは、多くの破片のを削除します。粉砕によって引き起こされ、文化の生存を促進する。共培養OL / DRGNが必要な場合は、このプロトコルのセクション3を参照してください。
- 3日間培養した後、メディアを4mLを除去し、新鮮な混合グリア培養培地4mlで置き換えることにより、3分の2のメディアの変更を行います。この時点で、星状膠細胞単層は、フラスコの底に形成されるべきである。
- 6日目に、別の3分の2のメディアが5μg/ mLのインスリンの最終濃度でフラスコを変更し、補完を実行。この時点で、星状膠細胞単層は、OPCが増殖されるの上に、はっきり見えるはずです。
3。 DRGN分離
注:、共培養DRGNs / OL DRGNsを生成するためには、混合グリア培養の生成後に一日に設立されるべきである。両方の文化のタイプは独立して成長、および9-10日後に結合されます。
- 制度的なガイドラインに従ってP5 - P10マウスを生け贄に捧げる。
- 背骨を抽出し、きれいなペトリ皿に移す。
- これは後根神経節(DRGS)の解剖を容易にするので、できるだけ背骨から多くの筋肉と骨(図1dは、d')として切り落とす。
- 新しいペトリ皿腹側を上にトリミングされた背骨を転送する。解剖はさみを使用し、尾側から始まる、長手方向のファッションで脊柱を介して内側にカット。
- 鉗子の2つのペアを使用して、静かに脊髄を露出するために脊柱をこじ開けます。
- DRGSは下に見て脊髄への側方することができます。神経節(図1E)への損傷を回避しながら微細な先端鉗子を使用して、静かにDRGSを削除します。
- 新しいペトリ皿の中で氷冷ハンクスバッファ塩溶液(HBSS、抗生物質フリー)に削除さDRGSを転送する。ディセクタはマウスあたり40 DRGS(図1f)を抽出することを目指すべきである。
- DRGSが抽出されれば、文化への混入細胞の導入(グリア細胞、線維芽細胞)を最小限に抑えるために、任意の過度に長い根(図1G、G')のDRGSをトリミング。
- 氷冷HBSSを500μLを含む1.5mLの遠心チューブにDRGSを転送する。
- ペレットに4℃で5分間1200rpmで(〜300g)を° Cで遠心DRGS。
- 無菌組織培養フードに遠心管に移し、チューブからHBSSを除去。
- 予め温めておいた(37℃20分℃)DRGパパイン溶液500μLを追加し、10分間37℃の水浴中にチューブをインキュベートする。チューブの組織の凝集を防ぐためにすべての2分を反転。
- ステップ3.10を繰り返します。
- DRGのパパイン溶液を除去し、コラゲナーゼソリューション予め温めておいた(37℃で20分)を500μLを加える。 10分、反転毎に2分間37℃の水浴でインキュベートする。
- ステップ3.10を繰り返します。
- 上清を除去し、DRGN培地1 mLを加える。チューブを数回転倒。
- ステップ3.10を繰り返します。
- ステップ3.16を繰り返します。
- コートHBSS数回に0.25%BSAの溶液をピペッティングによりウシ血清アルブミン(BSA)と無菌難研磨したガラスパスツールピペット。 BSA溶液でコーティングはガラスピペットの壁に付着するDRGSを防ぐことができます。
- 塊が解離を開始すると優しく最初は、と増加する強度とBSAコートしたピペットでDRGSをひいて粉にする。約10〜15回をひいて粉にする、しかし、この数字は、消化の程度に依存し、そしてチューブあたりDRGSの数です。
- 一度解離が達成され、DRGNメディアの7 mLを含む滅菌ペトリ皿にフィルタは50μm通過サスペンションを渡します。このステップは重要ではありませんがろ過は、細胞懸濁液から多くの破片のを排除する。
- 約1.25時間の8.5%CO 2でペトリ皿をインキュベートする。
- このインキュベーション時間の間に24ウェルディッシュにLN2(PBS中の10μg/ mL)でコート、いくつかの12mmのカバースリップ。
- インキュベーションが終了すると、明視野の下にペトリ皿を観察。 DRGNsは大きなボディ、位相暗い細胞として同定されています。どんな付着DRGNsを持ち上げるために優しくスワールペトリ皿。
注:多くの夾雑細胞は強く、それによってDRGNsのために細胞懸濁液を豊かに、ペトリ皿に付着しているでしょう。
- 15 mLコニカルチューブに細胞懸濁液を移す。優しく、残留DRGNsを収集するDRGNメディアの4mlで皿を洗う。コニカルチューブにさらに4 mLを転送する。
- 1200rpmで(〜300 g)で5分間遠心する。
- 上清を吸引除去し、新鮮なDRGNメディアの500μLでペレットを再懸濁します。
- 血球計算板を用いてもたらしたDRGNsの数を計算します。 DRGNsではなく、他の細胞型をのみをカウントしてください。 DRGNsは、それらの大きな球状の細胞体によって識別することができます。
- 一晩8.5%CO 2での各LN2 -コーティングDRGN培地1 mLのカバー、および37℃の組織培養インキュベーター内の場所に種子30,000-50,000 DRGNsを。
- 翌朝、DRGNを置き換えることによって、完全なメディアの変更を実行1%pen / strepおよび10μMのFUDRの最終濃度とOLのメディアとメディア(マイナスCNTF)。
- 3日目と5日に、ステップ3.30のと同じメディアを使用した3 / 4メディアの変更を行います。
- 7日目で、OLメディア(マイナスCNTF、ペン/咽頭、FUDR)で完全なメディアの変更を行います。
- 9日目に、DRGNsは、広範な神経突起のベッドを形成し、そして今OPCはと共培養する準備が整いましたている必要があります。
4。 OL -濃縮培養物またはDRGN / OL共培養の確立のための混合グリア培養物からOPCの精製
- 混合グリア培養9日に、5%CO 2組織培養インキュベーター内オービタルシェーカーにフラスコを転送する。悪影響を混合グリア培養に影響を与えることから、オービタルシェーカーから生成された熱を防ぐために空のT25フラスコの上部にフラスコを置き。文化は1時間この新しいインキュベーターに平衡させる。
- フラスコは、平衡化したら、45分間50rpmでフラスコを振る。この揺れの目的は、単層から緩く付着混入細胞を除去することです。
- 組織培養フードにセルを移動し、フラスコからすべてのメディアを削除する。 5μg/ mLのインスリンを添加した新鮮な混合グリア培養培地4mlで置き換えます。
- バックシェーカー上にフラスコを置き、そして約3時間平衡化することができます。
- フラスコは、平衡化したら、オービタルシェーカーに確実に固定して締め、そして220rpmで(一晩)で約16時間フラスコを振る。
- 1時間翌朝、OLSはDRGNsの欠如( すなわち 、OLに富んだ文化)で栽培される場合は、コートLN2(PBS中の10μg/ mL)でいくつかの滅菌12 mmのカバースリップ。 24ウェルディッシュにカバーグラスを転送する、OLメディアの洗浄に続いてPBSで洗浄する。各ウェルにOL培地1 mlを加え、8.5%CO 2で平衡化してください。
- 30分間、5%CO 2で10 cmの組織培養皿を平衡化する。一皿ごとに2フラスコのために必要となります。これらは、中断されたOPCの差の付着濃縮に使用されます。
- 30分の平衡期間が経過したら、皿に振盪フラスコからメディアを転送する。各皿は10cmディッシュあたりの細胞懸濁液の約8 mLのに匹敵する、2のフラスコからメディアを受信する必要があります。
- 15分のマークで優しいナッジを提供しながら、30分間、5%CO 2で皿をインキュベートする。このナッジは、10cmディッシュに付着からOPCを防ぐことができます。
- インキュベーションが完了すると、明るいフィールドの下に皿を調べます。 OPCは、通常、3〜5細胞の小細胞塊、として識別時にはニューロスフェアに似た大きな凝集体を形成しています。多くの非OL系細胞は、しっかりとプレートの底に従ってください。ゆっくりと渦のプレートは、どの緩く付着したOPCをデタッチし、15 mLコニカルチューブに各プレートから細胞懸濁液を転送する。
- 5分間1200rpmで(〜300 g)で遠心する。
- P200ピペットチップで再懸濁が続く、P1000ピペットチップでOLメディア1mL中にペレットを再懸濁する。
- 血球計算板を用いて細胞を数える。
- 1 mLのOLのメディアの最終的なボリューム内の各12ミリメートルLN2でコーティングされたカバースリップ〜50,000 OPCは - 濃縮- OLの文化、シード25,000。
- 共培養DRGN / OL、セクションからDRGNsにフルOLメディア(マイナスCNTF)の変更を行うために[3]、そして穏やかにOPCに富む細胞懸濁液から50,000個の細胞を加える。 OPCの添加中DRGNの神経突起のベッドを妨害しないように注意してください。
- 場所は、8.5%CO 2で37℃インキュベーターで培養し、固定するまで削除しないように。マウスOPCはpHの変化に敏感であり、インキュベータからの除去は、OL培地のpHを変更します。また注目すべきは、培養細胞を周囲の空の井戸へのdH 2 Oの添加はこうしてOLメディア内の濃度の溶質の変動を最小限に抑え、培地の蒸発を防ぐことができます。これは、OPCより一貫性のある環境を提供します。
5。免疫蛍光顕微鏡用培養液の処理
- 15分間室温で10分、または3%パラホルムアルデヒドまで-20℃で100%メタノールで培養を固定してください。
- 0.1パーセントで10分間トリトン- X - 100でカバーグラスを透過性、10%ヤギ血清で1時間リン酸緩衝生理食塩水(PBS)とブロックで洗浄する。
- 4℃で一晩ブロッキング溶液で希釈した一次抗体とインキュベートしてカバースリップ℃に
- PBSでカバーグラスを3回洗浄し、45分間ブロッキング溶液で希釈したアレクサ - フルオロ標識二次抗体(Invitrogen)でインキュベートする。
- 4'、6 - ジアミジノ-2 - フェニルインドール(DAPI)で対比染色し、PBSでカバーガラスを数回洗浄する。
- DAKO、蛍光のマウントカバースリップは、メディアをマウント。
- 免疫蛍光顕微鏡を介してスライドを分析する。このプロトコルでは、スライドはツァイスAxiovert 200M倒立蛍光のいずれかで分析した顕微鏡または共焦点顕微鏡を走査型ツァイスLSM 510 METAレーザー。
6。 OL -濃縮培養物からの全細胞タンパク質の抽出
- 3分間氷上でインキュベーターとクールから24ウェルの培養を削除します。
- 慎重にメディアを取り出し、0.1%のペプスタチン、アプロチニン、PMSF、と溶解バッファーの10-20μL(50mMトリス- HCl、150mMのNaCl、0.1%SDS、0.5%デオキシコール酸ナトリウム、1%トリトン- X - 100を追加、各ウェルにロイペプチン、オルトバナジウム酸ナトリウム)(1サンプルあたり8ウェルの最小値が提案されている)。
- ワイドボアP1000ピペットチップを使用して井戸をかき取り、1.5 mL遠心チューブにライセートを転送する。
- 30 ½ゲージの注射器を介して約15倍、そして30分間氷上で寒さをライセートを渡します。
- 4℃で15分間、14,000 rpmで(〜20,000 g)でチューブを遠心
- 新しい遠心チューブに上清を移し、-80℃で保存します。
7。濃縮OL文化のタンパク質上でSDS - PAGE分析
- 標準の12%ポリアクリルアミドゲルでSDS - PAGEによりバッファを減らすのに、サンプルあたりのタンパク質30μgのを解決します。
- PVDF膜上にセミドライトランスファーゲル。
- TBSTで5%スキムミルクパウダー(10mMトリス- HCl pH 8.0に、150mMのNaCl、0.1%のTween - 20)で1時間膜をブロックする。
- 1時間ブロッキング溶液で希釈した一次抗体でメンブレンをインキュベートします。
- 10分間TBSTで膜を3回洗浄。
- ブロッキング溶液で45分間HRP -標識二次抗体でメンブレンをインキュベートします。
- TBSTで膜を数回洗い、5分間アマシャムECL Plusはウェスタンブロッティング検出試薬(GEヘルスケア)でインキュベートする。
- 標準の科学的イメージングフィルムでタンパク質のバンドを検出する。
8。代表的な結果:
このプロトコルでは、OPCは、混合グリア培養内アストロサイト単層上に展開されます。この混合グリア培養は、P0 - P2新生児マウスの大脳皮質から得られます。 in vitroでの 1日目(DIV1)で、混合グリア培養は、位相差顕微鏡(図2a)で見られるように様々な形態を持つ細胞が含まれています。 DIV3で、星状膠細胞単層は、フラスコの底に形成し始める、とDIV8で、OPCは、明らかに単層の表面で観察することができます。 DIV9で、増殖OPCは一夜の高速軌道振とうすることにより精製するのに十分な密度に達している。精製のプロセスが完了すると、結果はOPCに富む細胞集団です。 DIV1ポスト精製では、OPCは少数のプロセス(図2b)を拡張する、シンプルな形態を持っている。 DIV3後の精製で、細胞が未熟なOLSを連想させるプロセスの複雑な網目構造を、拡張しました。 DIV6後の精製では、精製されたOLSは、膜構造リーフレットのようなフラット化して投影している。この形態の開発は、OLSの体外成熟の典型です。
免疫蛍光顕微鏡は、精製された細胞(図3A)OL -系統のものであることを示します。シードは、最初に明示的なコンドロイチン硫酸プロテオグリカン(NG2)をOPCは、三日後に播種(図3B)内にミエリン関連糖タンパク質(MAG)正の未熟なOLSへと発展する。 DIV6で、多くのOLSエクスプレスミエリン塩基性タンパク質(MBP)、および典型的な成熟したOL形態を持っている。パーセントOL -系統細胞はOL濃縮培養(図3C)の純度を決定するために異なる時点で定量した。 DIV1後の精製では、文化は、50です± 14%NG2 + veの OPCは、無MAG + veまたはMBP + VEの OLSで。これは、精製されたOL -系統細胞は、分化OLSの無視できる数字で、播種時の前駆段階にあることを示します。いくつかは、前駆体の表現型を維持し、NG2ままDIV3で、多くのOLSは、MAG + VEの細胞(24 ± 5.9%)に分化している+(13 ± 8.0%)。 DIV3で、MAG + VE細胞 (3.2 1.2%)の小さな割合もMBPを表明している。 DIV6で、OLSの20 ± 5.9%ですMAG + 12 ± 7.3%がNG2 + VEの OPCはとして保持VEながら。さらに、文化内の細胞の21 ± 9.3%MBPです+この時点でVEの OLS。 SDS - PAGE分析では、さらに末期(図3D成熟OLSに分化する培養中のOPCの能力を示す、2'3' -サイクリック - ヌクレオチド3' -ホスホジエステラーゼ(CNP)と6日間の培養期間にわたってMBPの段階的発現を示しています。 )。総称し、これらのデータは、OPCからOL成熟の研究に適しOL -濃縮培養系を生産する手段としてこの方法を確立します。
このプロトコルはまた、マウスのみの組織源を使用してDRGN / OL共培養を確立する方法を説明します。しかし、共培養を生成するために、DRGNsは、最初に適切な神経突起のネットワークを生成するために単独で培養する必要があります。これらの出生後のマウスニューロン培養を汚染する線維芽細胞およびGLの増殖を防ぐために、10μMのFUDRの補充と、低血清培地で9日間栽培されている IAL細胞。 in vitroでの 9日間のコースで、孤立DRGNsは高密度神経突起のベッド(図4A)を生成する。この神経突起ベッドは、ニューロンのマーカーのニューロフィラメント200(NF)とTuj1(図4B)に対して免疫である。この時点で、精製したOPCは、神経突起ベッドに追加される可能性があります、と共培養myelinating生成するために追加の6日間培養した。
DRGN / OL共培養のDIV6、多くのMBPで+ VEの OLSは、NF + VE DRGNの神経突起(図5a)が間で観察することができます。内実を見ると、OLSは、多くの場合、MBP + VEの膜(図5bを、C)でそれらを鞘、多数のDRGNの神経突起と接触するために証明されています。
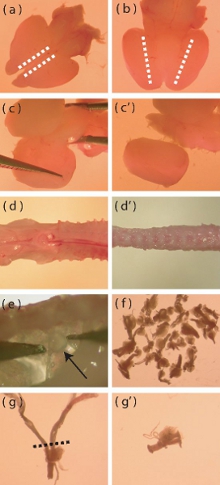
図1。新生児マウスの皮質とDRGの分離の特定の側面の解剖顕微鏡像。新鮮な抽出した新生児マウスの脳の(a)の背ビュー。点線は、切開が髄膜層の除去を容易にするために行われる必要がある領域を示している。(B)脳の腹側のビューは、点線は皮質の腹側間脳を満たす領域を示す。深い切開は、皮質の分離を助けるために点線に沿って行う必要があります。(C - C')脳の残りの部分から離れて皮質を詮索する方法の視覚的描写。(d)に新たに単離したP5 - P10マウスの脊椎前には余分な筋肉や骨を(D')離れてトリミングする。脊柱内DRGSの(e)の場所。つのマウスから隔離される必要DRGSの(f)のおおよその数値。要求する長い根を持つ(g)の DRG酵素消化する前にトリミング。点線は、根をトリミングする領域を示します。(G')後根トリミングをDRGの。
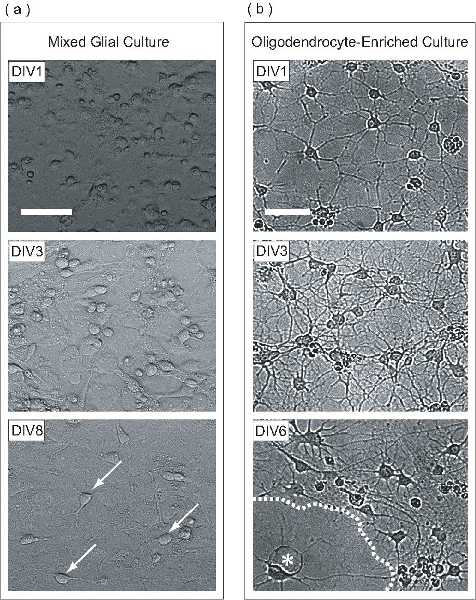
図2。 OPCは、混合グリア培養内で拡大して精製し、そして続いてOLに富んだ文化として区別されます。 (a)開発の各段階で混合グリア培養の位相コントラスト像を。 DIV1で、細胞はいくつかの平坦化された細胞と円形が表示されます。混合グリア培養の階層化は、アストロサイトはOPCは増殖している時にフラスコの底部に均一な単層を形成するDIV3、から始まります。多くのOPCは、アストロサイト単分子層の表面に付着DIV8(矢印)で見られる。一度混合グリア培養液から精製した(B)、DIV1 OPCは少数のプロセスのみを拡張した。 DIV3で、細胞は中間段階のOLSを連想させる多くのプロセスを、拡張しました。 DIV6で、平坦化されたOLS(アスタリスク)(破線)膜状のシートを生産しているように見える。スケールバーは50μm。
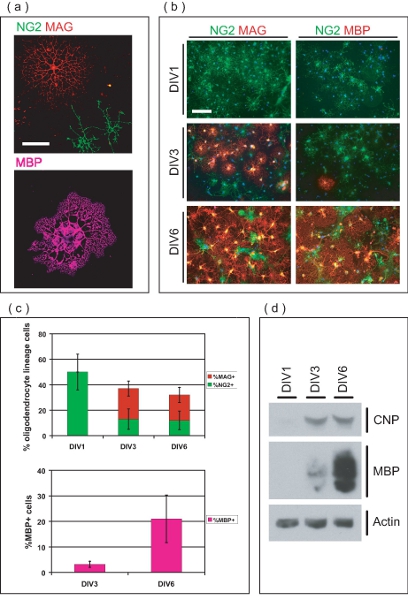
図3。 OL -濃縮文化の特性評価。開発のさまざまな段階で分離されたOLSの(a)の共焦点画像。 MAG + veの OLSは複数の樹木のプロセスを持っているのに対し、NG2 + veの OPCは、単純な形態を持っている。 MBP + veの OLSは、膜ミエリンのようなシートを拡張している。スケールバー、50μmのは。(B)精製OL -系統の細胞は、OPCとして発信、および6 DIV以上MAG + VE、MBP + VEの OLSに分化する。どれもMAG + veまたはMBP + VEない状態DIV1で、すべてのOPCは、NG2 + VEです。 DIV3で、MAG + veといくつかのMBP + veの OLSは明らかです。 OLSの大半は少数の残りのNG2 + VEの OPCのと、DIV6でMAG及びMBP + VEです。スケールバー、100μmのは。(C)の値を平均± 6 DIV上のさまざまな開発段階でのパーセントのSDは、OL -系統細胞。 DIV1で、すべてのOL -系統細胞はNG2 + VE、50会計±文化の中で全細胞の14%です。 DIV3とDIV6で、OL -系統の細胞は、それぞれ36を占めて± 6.8%、32 ±全細胞の8.4%は、NG2 + VE、MAG + veとMBP + VEの OLSの割合を変化させることから成る。(d)の SDS - PAGEを行った6 DIVの培養期間にわたってOLマーカーCNPとMBPの段階的発現を示す濃縮OL -培養物由来のタンパク質に関する。
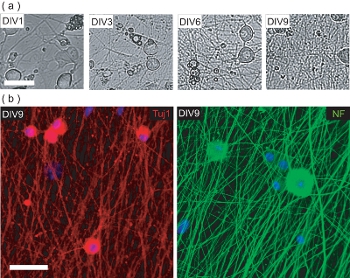
図4。 DRGN文化プリOPCの播種の特性評価。 (A)9 DIVの培養期間の事前のOPC播種以上DRGNsの位相コントラスト像を。 DRGNsは少数のプロセスを持つ大規模なボディの細胞として発信し、ますます複雑な神経突起のネットワークを作り出す。スケールバー、100μmである。(B)DIV9(プレOPC種まき)に固定されており、ニューロン特異的マーカーTuj1とNF200について染色DRGNの文化の共焦点画像。 DRGNsは、OPCが共培養myelinating DRGN / OLを生成するためにシードされるかもしれない時に神経ネットワークを作成しました。スケールバーは50μm。
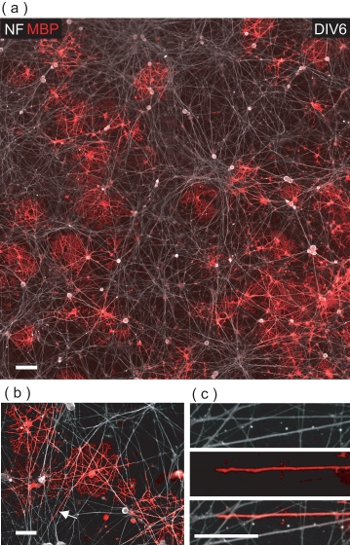
図5。 OLS MBPとDRGNの神経突起のOLを介した折り返し+ VEの膜でDRGNsの結果と共培養。 (A)DIV6 DRGN / OL共培養のモンタージュ4フィールド共焦点画像。多くのMBP + VEの OLSは、基礎となるDRGNの神経突起のベッドとの相互作用を見ることができます。スケールバー、100μmである。MBPの(b)の拡大焦点ビュー+複数DRGNの神経突起を包むVEの OLS。スケールバーは50μm。(B)DRGN神経突起がOL膜でラップされている場所に示された地域の(c)デジタル倍率。スケールバーは25μm。
ディスカッション
このレポートは、OL -濃縮培養物または共培養DRGN / OLの分化のためにマウスOPCを単離するための方法を説明します。単独で培養した場合、OPCはMBPに分化する+ VEの OLSを、膜状のシートミエリンのように生産。神経突起ベッドをDRGNに追加すると、OLSはMBPとDRGNの神経突起を包む+ VEの膜を。このモデルは、OLを介した軸索ensheathmentを支配する複雑な基盤の調査に利益をもたらします。
大きな値の間に、そのような文化の確立が技術的に困難です。特に、要求の厳しい側面が効率的な組織の消化/解離、バランスの培地のpHの維持、およびDRGNメディアの変更が含まれています。消化の長さは、組織の量を消化し、粉砕の量は組織の解離の効果と終了結果に影響されていることを考慮することが重要です。それは、経験豊かな研究者のために解離神経系の組織から、低細胞の収率を得ることが珍しくありません。さらに、マウスOPCは、特にアルカリ性の条件下で、培地のpHの変化に敏感になる傾向があります。 8.5%CO 2で培養の維持は、OPCはより基本的にやや酸性条件に耐えるように見えるので、これを防ぐことを目的としています。給餌DRGNsに関しては、メディアの変更は神経細胞を乾燥させるようにすることを迅速に実行する必要があります、しかし、発展途上神経突起のベッドを混乱させないよう穏やかにする必要があります。突然のメディアの変化は、基板からの神経突起ベッド、およびカバースリップから、その完全な解離の可能性が高い結果が外れる。
このモデルシステムの潜在的なメリットは大きく、その技術的な要求の性質を目立たなくします。このシステムの利点の一つは、胚組織を採取するために繁殖の女性を犠牲にする必要性を回避して、細胞培養の導出のための産後のマウスの使用です。もう一つの利点は、OPCの拡大のための増殖因子のための要件の欠如(GFS)です。混合グリア培養物は、アストロサイト由来の栄養因子の存在のためにおそらくOPCは、の伝播をサポートする環境を提供しています。このようなニューロスフェアを7,8を介して導出などの他の方法は、、そのような塩基性線維芽細胞増殖因子(bFGF)、上皮成長因子(EGF)とOPCの拡大のための血小板由来増殖因子(PDGF)などのGFSの分裂促進特性に依存しています。同様に、出生後(P5 - 10)DRGNsのためのマウスを使用すると、神経成長因子(NGF)、胚DRGNs 9、10のin vitroでの生存のために必要な神経栄養因子と培地を補充する要件を回避することができます。それはDRGNs 4で培養した場合にマイナスOLSのmyelinating能力に影響を与えるとして、NGFの使用を避けることは興味深い。大規模で使用すると、これらの試薬は高価になるとGF添加培地の使用を避けることにより、また、経済的利益を持っています。
おそらく、この培養モデルの最も重要な利点は、このようにトランスジェニックマウス系統の多種多様なOPCはとDRGNs両方を導出する機会を提供し、マウスのみの組織からの派生です。これはDRGNおよび/または髄鞘形成を支配するOPC固有のプロパティの両方の研究が可能になります。これは、軸索のOLを介した髄鞘形成を調節する受容体/リガンド相互作用を解明するために特に重要になります。すべてでは、この手法は、髄鞘形成の根底にある分子の手がかりを知るため、そのアプリケーションが原因で神経科学の研究に関しては大きな価値があります。
開示事項
利害の衝突は宣言されません。
謝辞
このプロジェクトは、カナダの多発性硬化症協会からRKRWOへの助成金によって賄われていたカナダの多発性硬化症協会から学生の身分の受信者です。 SDRは、健康研究のカナダとカナダの研究所の多発性硬化症協会からポストドクトラルフェローシップの受賞者です。
資料
| Name | Company | Catalog Number | Comments |
| 製品名 | 会社 | 製品番号 | |
| ダルベッコ改変イーグル培地(DMEM) | マルチセル | 319から005 - CL | |
| ハンクス平衡塩類溶液(HBSS) | インビトロジェン | 14170-112 | |
| 最小必須培地(MEM) | GIBCO | 12360-038 | |
| ウシ胎児血清(FBS) | GIBCO | 10091-148 | |
| ペニシリン - ストレプトマイシン(ペン/連鎖球菌) | GIBCO | 15140-122 | |
| グルタミン | インビトロジェン | 35050-061 | |
| ポリ- L -リジン | シグマアルドリッチ | P2636 | |
| ウシ血清アルブミン(BSA) | シグマアルドリッチ | A4503 | |
| 人間merosin精製タンパク質(LN2) | ミリポア | CC085 | |
| 組換えラット毛様体神経栄養因子(CNTF) | ぺプロ | 450から50 | |
| L -チロキシン | Biochemika | 89430 | |
| ホロトランスフェリン | シグマアルドリッチ | T0665 | |
| B27サプリメント | GIBCO | 0080085 - SA | |
| ウシインスリン | シグマアルドリッチ | I6634 | |
| 3,3',5 -トリヨード- L -チロニン | シグマアルドリッチ | I6634 | |
| プロゲステロン | シグマアルドリッチ | P8783 | |
| プトレッシン | シグマアルドリッチ | P7505 | |
| 亜セレン酸ナトリウム | シグマアルドリッチ | S5261 | |
| 5 - フルオロ-2' - デオキシウリジン(FUDR) | シグマアルドリッチ | F0503 | |
| パパインのソリューション | ワージントン | LS003126 | |
| DNaseI | ロッシュ | 1010159001 | |
| L -システイン | シグマアルドリッチ | C7352 | |
| 24ウェル組織培養皿 | Cellstar | 662から160 | |
| ベントキャップ付T25 -組織培養フラスコ | コーニング | 430639 | |
| 10cmの組織培養皿 | コーニング | 430167 | |
| 10cmペトリ皿 | フィッシャーサイエンティフィック | 0875713 | |
| コラゲナーゼ | ロッシュ | 103578 | |
| CellTrics50μmのフィルター(オプション) | PARTEC | 04-004-2327 | |
| ミエリン塩基性タンパク質(MBP)抗体 | ABD Serotec | MCA409S | |
| NG2抗体 | ミリポア | AB5320 | |
| ミエリン関連糖タンパク質(MAG)抗体 | ミリポア | MAB1567 | |
| 2'、3' -サイクリックヌクレオチド3' -ホスホジエステラーゼ(CNP)抗体 | Covance | SMI - 91R - 100 | |
| アクチンパンAB - 5抗体 | フィッツジェラルド | 10R - A106AX | |
| ニューロフィラメント- 200(NF)抗体 | シグマアルドリッチ | N4142 | |
| チューブリンβ- 3チェーン(Tuj1)抗体 | ミリポア | MAB5544 | |
| のAlexa Fluor ® 488ヤギ抗ウサギIgG(H + L)二次抗体 | インビトロジェン | A11008 | |
| のAlexa Fluor ® 555ヤギ抗マウスIgG(H + L)二次抗体 | インビトロジェン | A21422 | |
| のAlexa Fluor ® 647ヤギ抗ラット抗体(IgG)(H + L)二次抗体 | インビトロジェン | A21247 | |
| ヤギ抗マウスIgG(H + L)- HRP標識二次抗体 | BioRad社 | 170-6516 | |
| ヤギ抗ラットIgG(H + L)- HRP標識二次抗体 | サンタクルスバイオテクノロジー | SC - 2065 | |
| 4'、6 - ジアミジノ-2 - フェニルインドール(DAPI) | シグマアルドリッチ | D9542 |
メディアのレシピ
100X OL -補足*
| 成分 | 追加する量 |
| DMEM | 100mLの |
| BSA | 1.02グラム |
| プロゲステロン | 0.6mgの |
| プトレッシン | 161 mgの |
| 亜セレン酸ナトリウム | 0.05mgの |
| 3,3',5 -トリヨード- L -チロニン | 4mgを |
-80 * ° Cで保存250μL分注し
T"> OLメディア| 成分 | 追加する量 |
| DMEM | 23.75 mLの |
| 100X OL -サプリメント | 250μL |
| ウシインスリン(1 mg / mLの在庫から) | 125μL |
| グルタミン | 250μL |
| ホロトランスフェリン(33 mg / mlストックから) | 37.5μL |
| B27サプリメント | 500μL |
| FBS | 125μL |
| CNTF(50 ng /μLの在庫から) | 25μL |
混合グリア培養培地(DMEMで構成される)
| 成分 | 最終濃度 |
| FBS | 10パーセント |
| ペン/咽頭(株式から0.33%) | 33ユニット/ mlペニシリン、33μg/ mlストレプトマイシン |
| グルタミン | 一パーセント |
DRGN培地(DMEMで構成される)
| 成分 | 最終濃度 |
| FBS | 10パーセント |
| ペン/咽頭(株式から1%) | 100単位/ mlペニシリンおよび100μg/ mlストレプトマイシン |
消化溶液のレシピ:
OPCパパイン溶液(MEMで構成される)
| 成分 | 最終濃度 |
| パパインのソリューション | 1.54 mg / mLの |
| L -システイン | 360μg/ mLの |
| DNaseI | 60μg/ mLの |
DRGパパイン溶液(HBSSで構成される)
| 成分 | 最終濃度 |
| パパイン | 1.54 mg / mLの |
| L -システイン | 360μg/ mLの |
DRGコラゲナーゼ溶液(HBSSで構成される)
| 成分 | 最終濃度 |
| コラゲナーゼ | 4 mg / mLの |
参考文献
- Avellana-Adalid, V. Expansion of rat oligodendrocyte progenitors into proliferative "oligospheres" that retain differentiation potential. J Neurosci Res. 45, 558-570 (1996).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Barres, B. A. Cell death and control of cell survival in the oligodendrocyte lineage. Cell. 70, 31-46 (1992).
- Chan, J. R. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron. 43, 183-1891 (2004).
- Camara, J. Integrin-mediated axoglial interactions initiate myelination in the central nervous system. J Cell Biol. 185, 699-712 (2009).
- Ishibashi, T. Astrocytes promote myelination in response to electrical impulses. Neuron. 49, 823-832 (2006).
- Chen, Y. Isolation and culture of rat and mouse oligodendrocyte precursor cells. Nat Protoc. 2, 1044-1051 (2007).
- Pedraza, C. E. Production, characterization, and efficient transfection of highly pure oligodendrocyte precursor cultures from mouse embryonic neural progenitors. Glia. 56, 1339-1352 (2008).
- Lewin, G. R., Ritter, A. M., Mendell, L. M. On the role of nerve growth factor in the development of myelinated nociceptors. J Neurosci. 12, 1896-1905 (1992).
- Greene, L. A. Quantitative in vitro studies on the nerve growth factor (NGF) requirement of neurons. II. Sensory neurons. Dev Biol. 58, 106-113 (1977).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved