A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תגובות סידן הדמיה בנוירונים GFP-tagged של פרוסות מוח עכבר ההיפותלמוס
In This Article
Erratum Notice
Summary
בפרוטוקול זה, אנו מעדכנים את ההתקדמות האחרונה בתחום ההדמיה Ca 2 + אותות של נוירונים GFP-tagged בפרוסות רקמת המוח באמצעות ניאון אדום Ca 2 + מחוון צבע.
Abstract
למרות גידול עצום בידע שלנו על את המנגנונים בבסיס הקידוד של מידע במוח, שאלה מרכזית בנוגע לצעדים המולקולריים המדויקים, כמו גם את פעילותם של תאי עצב ספציפי בגרעינים רבים תפקודיים של אזורי מוח כגון ההיפותלמוס יישאר. בעיה זו כוללת זיהוי של המרכיבים המולקולריים המעורבים בוויסות של מפלי העברת אותות neurohormone שונים. גבהים של Ca 2 + התאי לשחק תפקיד חשוב בויסות הרגישות של תאי עצב, היא ברמה של העברת אותות ובאתרים סינפטיים.
כלים חדשים צמחו כדי לסייע בזיהוי נוירונים במספר העצום של תאי עצב במוח בהבעת חלבון פלואורסצנטי ירוק (GFP) תחת השליטה של אמרגן מסוים. כדי לפקח גם מרחב ובזמן גירוי-Induced Ca 2 + תשובות בGFP בתיוג נוירונים, שאינו ירוק זרחני Ca 2 + מחוון הצבע needs לשמש. בנוסף, מיקרוסקופיה confocal היא שיטה מועדפת של נוירונים בודדים בפרוסות הדמית רקמות בשל היכולת לדמיין נוירונים במטוסים שונים של עומק בתוך הרקמה ולהגביל פלואורסצנטי מחוץ לפוקוס. Ca 2 + ratiometric המחוון Fura-2 כבר בשימוש בשילוב עם ה-GFP מתויג-1 תאי עצב. עם זאת, הצבע הוא נרגש על ידי אור אולטרה סגול (UV). העלות של הליזר ואת עומק החדירה האופטי המוגבל של אור UV הפריעה את השימוש בו במעבדות רבות. יתר על כן, GFP פלואורסצנטי עלול להפריע Fura-2 האותות 2. לכן, החלטנו להשתמש בניאון אדום Ca 2 + צבע מחוון. השינוי הענק של הסטרוקס Fura אדום מאפשר ניתוח ססגוני של הקרינה האדומה בשילוב עם ה-GFP באמצעות אורך גל עירור יחיד. בעבר היו לנו תוצאות טובות באמצעות Fura אדום בשילוב עם ה-GFP-tagged נוירונים ריח 3. הפרוטוקולים לפרוסות רקמת הרחה נראים עובדים דוארqually גם בנוירונים ההיפותלמוס 4. Fura האדום מבוסס Ca 2 + הדמיה הייתה גם שלב בהצלחה עם β-תאי ה-GFP-tagged לבלב ואת הקולטנים של GFP מתויג-מתבטאים בתאי HEK 5,6. גחמה קטנה של Fura האדום היא שעוצמת הקרינה שלה ב 650 ננומטר מקטינה פעם המחוון נקשר סידן 7. לכן, הקרינה של נוירונים מנוחה עם Ca נמוך + 2 יש ריכוז עצמה גבוהה יחסית. יש לציין, כי אחרים האדומים Ca 2 +-צבעי חיווי קיימים או כרגע בשלבי פיתוח, שעשוי לתת תוצאות טובות יותר או שיפור בנוירונים שונים ואזורים במוח.
Protocol
1. הכנה ופתרון agarose ג'ל
- להכין תמיסת חוץ תאית על פי הטבלה במים מזוקקים כפולים. PH יהיה ~ 7.3 לאחר 10 דקות אוורור עם carbogen (95% O 2/5% CO 2), אוסמולריות 300 mOsm 8. אם אוסמולריות גבוהה נדרשת, זה יכול להיות מותאם על ידי הוספת סוכר יותר (1 מ"מ שווה mOsm 1). הפתרון מסונן פעמים באמצעות מסנן קרום מיקרומטר 0.2 לחסל חלקיקי אבק וזיהומים חיידקיים אפשריים.
| שם מגיב | נוטריקון | מול. משקל | קונצרט כלשהו. | חברה | חתול. N ° |
| נתרן כלורי | NaCl | 58.44 ג'/ mol | 120 מ"מ | VWR | 27810 |
| <פחם נתרן מימן/ Td> | 3 NaHCO | 84.01 ג'/ mol | 25 מ"מ | מרק | 106329 |
| אשלגן כלורי | KCl | 74.55 ג'/ mol | 5 מ"מ | מרק | 104936 |
| BES * | ג 6 15 H NO 5 S | 213.25 g / mol | 5 מ"מ | סיגמא | 14853 |
| מגנזיום סולפט, נטול מים | MgSO 4 | 120.37 g / mol | 1 mM | סיגמא | M7506 |
| dihydrate סידן כלוריד | CaCl * 2H 2 O | 147.02 g / mol | 1 mM | מרק | 102382 |
| monohydrate D (+)-גלוקוז | C 6 H 12 O 8 * H 2 O | 198.17 g / mol | 10 mM | מרק | 108342 |
*חומצת N, N-Bis (2-hydroxyethyl)-2-aminoethansulfonic
- הפתרון מאוחסן ב 4 ° C, אבל צריך להיות מאוורר עם carbogen (95% O 2/5% CO 2) למשך 10 דקות לפני השימוש.
- בשלב זה, להכין גם סנטימטר 1 3 בלוקים של ג'ל אגר לייצב את המוח במהלך הליך החיתוך (ראה שלב 3). ראשית, לפזר 4% (w / v) אגר (סיגמא) במים מזוקקים פעמים על ידי חימום הפתרון לכ 60 ° C. הפתרון אגר המומס המחומם הוא שפך לתוך צלחת פטרי כיכר לגובה של 1 סנטימטר. לאחר קירור והתקשות, 4% ג'ל אגר הוא לחתוך לקוביות של 1 סנטימטר 3. בלוקים אלה ניתן לאחסן לתקופה של עד 4 שבועות ב 4 ° C.
2. נתיחה של מוח העכבר
אנא ודא כי כל הליכי בעלי החיים הניסיוניים מבוצעים בהתאם להנחיות שנקבעו על ידי ועדות רווחת בעלי החיים של המוסדות המתאימים.
- לפני sacrificing החיה, ודא את אובניים ג'ל אגר הם מוכן לשימוש.
- הרדם עכבר עם isoflurane (1-4% isoflurane בחמצן שימוש במכשיר אידוי דיוק לכ 1 דקות). זה חשוב כדי למנוע ניזק היפוקסיה ולכן עצבי. חסרון של isoflurane הוא העלות והלוגיסטיקה של שימוש במכשירי אידוי דיוק. מנת יתר קטלני במערכת פתוחה יכול להיות חלופה, שכן יהיה הקריב את העכבר. בטיחות תעסוקתית היא במקרה זה דאגה רצינית. Isoflurane יש פרק אותם ישירות מן החדר. לכן, ממנת יתר במערכת פתוחה יש לבצע במנדף כימי.
- להרדים את העכבר על ידי עריפת ראש לאחר ניטור העומק של הרדמה על ידי בדיקת רפלקס הרגל האחורית. רפלקס קמצוץ דוושה או כפה זו מבוצע על ידי צביטה או כפה בין אצבעות בוהן של 1 כדי לעורר תגובת נסיגה על ידי בעלי החיים בתקיפות. בעלי חיים המציגים רפלקס הם לא ברמה כירורגית של הרדמה ובהחלט לא במדינה להרדים.
- לאחר עריפת הראש, לחתוך את הקרקפת עם סכין גילוח קצה יחיד מרכזי בכיוון sagittal, מהעצם הקדמי לבליטת קודקוד החיצונית. להעביר את שני חלקים של הקרקפת, ראשון מסוף הזנב המדיאלי בכיוון לרוחב מקורי, ואז למטה בכיוון גחון (איור 1 א, ג).
- הפוך 2 חתך אחד מקורי בנקב עם מספרי מעיין קטנים (ראה לחיתוך כיוון החיצים השחורים המקווקוים בתרשים 1C) לרוחב ו. זהירות ידבק את הגולגולת מmediocaudal לרוחב מקורי עם מלקחיים בוטים (ראה חיצים אפורים רחבים בתרשים 1C). בבעלי חיים מבוגרים חתך קטן בתפר sagittal הוא מועיל ולעתים קרובות יש צורך להימנע משכבות של קליפת מוח מזיקות של המוח.
- ברגע זה את העצמות העורפיות, interparietal והקודקודית צריכות להיות מנותקות. אם עדיין קיימים, דורת מאטר יש להסיר בזהירות באמצעות מלקחיים כדי למנוע ניזק לbrעין בשלב הבא.
- קח את עצם squamosal, נקב ethmoidal וחזיתי הקדמי (1D איור).
- המוח יכול כעת בקלות להסיר באמצעות מרית כפית מייקר הפוכה וניתוק עצבי הגולגולת (האיור 1E).
3. חיתוך סעיפי ההיפותלמוס עטרה של מוח העכבר
- מניח את המוח בצד גחונה על משטח חיתוך עמיד ולהסיר את המוח הקטן עם סכין גילוח קצה אחד (איור 2 א). פני שטח חתך ישר זה יהיו הבסיס להרכבת המוח בצלחת כדי לאפשר חיתוך של חלקי מוח עטרה.
- דבק המוח עם סעיף הקיצוץ בbaseplate של microtome (Zeiss, שפן V50) המשתמש בכמויות נמוכות של ביצועים דבק דבק מגע מהיר ריפוי גבוה cyanoacrylate (Loctite 406; איור 1 א '). בנוסף, דבק בלוק 1 3 סנטימטר אגר ג'ל (ראה 1.5) בצד הגחוני של המוח (ראה "V" ב תרשים 2B) על baseplate של microtome (Zeiss, שפן V50) כדי לתמוך ולתקן את המוח בזמן חיתוך. ודא שלא להשתמש יותר מדי דבק, להתחמק שחוצה הדבק בין המוח ובלוק ג'ל גורם לבעיות בהסרת פרוסות רקמות לאחר הקיצוץ. בלוק ג'ל יהיה ממוקם בצד הנגדי של להב החיתוך מmicrotome (איור 2 ב ').
- אחרי כמה שניות האג"ח התייבש, שם את הצלחת לאמבטיה שלך מלאה בmicrotome 6 מעלות צלזיוס פתרון תאי קר חומץ (95% O 2/5% CO 2) (ראה 1.1).
- השתמש במהירות חיתוך נמוכה מתאימה ולחתוך פרוסות עבות 300 מיקרומטר. במקרה של microtome, אנו משתמשים בתדר של 60 הרץ, המשרעת של 0.8 מ"מ ומהירות של 0.8 מ"מ / s (האיור 2C). את פרוסות מוח העטרה נאספות באופן ישיר לאחר כל חתך או ניתן להשאיר באמבטיה עד שכל המוח כבר נותח. את פרוסות מוח העטרה הם transfe זהירותrred לכוס עם תמיסת חומץ תאי קרה. כלים שונים תוכננו כדי לבצע את ההעברה (למשל פלסטיק חתוך רחב או pipettes הזכוכית פסטר או מרית כף רחבה). זה תלוי בexperimentator אשר נמצאים בתהליך העדיף. והכי חשוב, את הפרוסות צריכות להיות מטופלים כראוי כדי למזער את הניזק.
- אם ניתן לתכנת microtome לחתוך פרוסות באופן אוטומטי, אתה יכול להתחיל להכין את Ca 2 + פתרון טעינת צבע החיווי ברגע זה. אחרת, מומלץ שההכנה של פתרון זה מתבצעת לפני שמוח החיתוך הסתיים למזער עיכובים למדידת Ca 2 + תגובות בתאי העצב, כלומר לפני תחילת שלב 2.
4. הכנת Ca 2 + פתרון מחוון דאי טוען
שלב קריטי בנוירונים טעינה נותר לעתים קרובות בריאות של התאים אשר תלוי במידת הניזק שנגרמה על ידי והמהירות שלהליך הנתיחה. צעד חיוני נוסף נראה שיש פתרון ה-F-127 (ראה 4.1) השימוש בPluronic הטרי. זה להיות מומלץ כדי להפוך את הפתרון הזה במעבדה ולא להשתמש בפתרון premade מספק. תלויה בטמפרטורה, הלחות וחיי המדף של Pluronic F-127 הפתרון, שציינו שפלה של תאי עצב הרחה והמוח במהלך Ca 2 + הליך טעינה.
- הכן 20% (w / v) Pluronic F-127 (סיגמא) בsulfoxide דימתיל (DMSO) על ידי הוספת Pluronic F-127 אבקה על גבי פתרון DMSO. ישירות sonicate פתרון זה ללא מערבולת לפני או ערבוב. בתוך 2 דקות sonication Pluronic F-127 יהיה מומס. Pluronic μl 100 F-127 פתרונות מוכנים שבועי טריה.
- קח צינור אחד של 50 מיקרוגרם תא חדיר fura-red/AM (Invitrogen; הבוקר, אסתר acetoxymethyl) ולהוסיף Pluronic 5 μl 20% פתרון F-127. מערבב את הפתרון באמצעות קצה פיפטה.
- הוסף soluti תאי 45 μlב( ראה 1.1) לתערובת והמערבולת אותה בקרוב.
- הוסף פתרון תאי μl נוסף 325 וsonicate הצינור ל3 דקות.
- לאחר sonication להוסיף 1.156 מיליליטר חומץ פתרון תאי להגיע הסופי Ca 2 + הפתרון שלך מחוון טעינת הצבע (30 מיקרומטר fura-red/AM, 0.33% DMSO ו0.065% Pluronic-F-127) (5% CO 2 95% / פלט 2) . אחסן את הצינור במקום חשוך עד לשימוש (ראה 4.8).
- להעביר את פרוסות מוח העטרה לצלחת 6-גם תא תרבות (BD פלקון) מלאה בחומץ (95% O 2/5% CO 2) פתרון תאי (עד שש פרוסות לטובות).
- תמצוץ את הפתרון התאי החמצן מהתאים של הצלחת 6-גם נזהר שלא לפגוע בפרוסות המוח.
- Pipet ישירות 750 μl של Ca 2 + פתרון מחוון טעינת צבע לכל באר. את פרוסות המוח צריכות להיות מכוסות על ידי התמיסה המכילה fura-red/AM (טעינת טבילה).
- Incubatדואר פרוסות בO 2 / CO תא תרבות חממת 2 (O 2: 23.5%; CO 2: 5%) עבור 45-60 דקות ב 37 ° C.
- בתום זמן הדגירה, להחליף את Ca 2 + פתרון טעינת צבע המחוון על ידי פתרון תאי חמצן טרי כדי למנוע עומס יתר על התאים עם Fura אדום ולהשפיע בדרך עדינה Ca 2 + מדידה דרך פעולת chelating של הצבע. בפרוסות אז הוחזקו בO 2 / CO 2 חממה (ראה נקודה קודמת להגדרות) ועד לשימוש הן בנות קיימא לתקופה של עד 3-6 שעות.
5. מיקרוסקופיה וניתוח
בפרוטוקול זה, עוצמת הקרינה של ה-GFP, המזהה את התא של עניין, ושל Ca 2 + מחוון הצבע תהיה ניתן למדוד בו זמנית בפרוסות מוח. לפיכך, confocal מיקרוסקופ צריך להיות מצויד בליזר הנכון, מסננים ושני צינורות מכפילים לאסוף emissi 2על אותות. GFP והשינוי בעוצמת קרינה של Fura אדום ניתן למדוד באמצעות אורך גל עירור יחיד של 488 ננומטר. פלואורסצנטי הפליטה מfluorophores ניתן נאסף באמצעות 522/DF35 ננומטר סינון לGFP ומסנן ארוך לעבור לאורכי גל גדולים מ 600 nm לFura אדום.
- כדי להתחיל מעקב אחר שינויי גירוי מושרה באות פלואורסצנטי, שהם מדד לתאי Ca + הריכוז 2, אחת מפרוסות המוח הטעונות Fura האדומות מועבר לתא הקלטה (קאמרי כלומר ורנר מכשירי RC-27 פתוחי אמבטיה) שיכול להיות מותקן על התקנת confocal מיקרוסקופ (איור 3 א ', ב').
- אבטח את פרוסת המוח עם נבל (האיור 3C) כדי למנוע את הפרוסה לעבור בשל מהירות הטפטוף של תמיסת האמבטיה (פתרון תאי חומץ; ראה שלב 1.1). הנבל (בעל פרוסה) עשוי ממערך מקביל של חוטי ניילון (מופרד אחד מהשני על ידי ~ מ"מ 1) שנמתח עלכסף U צורה או מסגרת פלטינה. הטמפרטורה של פתרון האמבטיה בשלב זה צריכה להיות לפחות בטמפרטורת חדר. אם טמפרטורות גבוהות נדרשות, טיפול הולם יש לנקוט כדי למנוע עיבוי על עדשות המיקרוסקופ ובתנועה של המטוס של מוקד בשל הסטת חלקים במיקרוסקופ.
- תנקב את הפרוסה למשך 10 דקות בתמיסת חוץ תאית חומץ כדי להסיר כל עודף התאי Ca צבע מחוון + 2. קצב הזרימה של זלוף צריך להיות מותאם ל ~ 100 (עצות בנוגע למערכת זלוף מתאימה לראות 9) μl / s.
- תראה את הפרוסה מבעד למיקרוסקופ בהגדלה נמוכה, רשום את הכיוון של הפרוסה עבור הרשומות שלך ולמצוא תחום העניין שלך בפרוסה, במקרה שלנו באזור ההיפותלמוס במוח.
- שינוי להגדלה גבוהה ולמצוא תא של עניין בפרוסה ידי איסוף תמונות GFP ובו זמנית בדיקת עוצמת הקרינה של Fura האדוםאות (איור 4A-C). תאים הקרובים לפני השטח יכולים להיות פגומים או מת. לכן, תאים הנמצאים בעומק של יותר מ 10 מיקרומטר צריכים להיבחר להדמיה. אנחנו יכולים למדוד את אמינות תאים לעומק של 40-50 מיקרומטר, whereafter עוצמת האות התחילה לרדת. זכור כי האות Fura האדומה של תאים במנוחה עם Ca נמוך + ריכוז 2 יש עוצמות גבוהות קרינה יחסיות. עוצמת קרינה גבוהה זו היא במקרה זה אינו סימן לתאים מתים. אות GFP יכול לשמש כדי לזהות כל סחף או תנועה של פרוסת הרקמה או כמדד לשינויים בחומציות תוך תאית 10.
- התאם את עוצמת הליזר לערך המאפשר מדידות בשינוי של עוצמת קרינת Fura האדום ומונע הלבנה של שני fluorophores. לכן, תתחיל עם כוח הליזר הנמוך ביותר ולהתאים להשגת יחס מספיק אות לרעש על ידי שינוי רמה שחורה (קיזוז), צמצם גלאי, רווח ומסנן צפיפות ניטראלית ליזרs. הפרט לכוח הליזר, צריך לעשות את אותו הדבר עבור אות ה-GFP.
- התחל לרכוש תמונות במחירים בין 0.5 - 2 הרץ לאסוף אותות GFP Fura האדום ו. שיעור הרכישה צריך להיות מותאם לקצב הצפוי של Ca 2 + האות. מתח תלוי Ca 2 + קוצים עלולים לגרום מהר יותר וקצר יותר ארעיים מאשר הפעלה של כמה מפלי העברת אותות הדורשים הפעלה של שליחים 2 שונים. האורך של רכישת התמונה צריך להיות מתאים לצורך הניסוי. אות ה-GFP לאורך הזמן תעזור לקבוע אם כל תנועה של פרוסת המוח התרחשה.
- במהלך הרכישה והניסוי, כל הגדרות סריקת הראש צריכות להיות מוחזקות קבוע לרשום תוצאות אמינות שניתן להשוות.
- השינויים בפלואורסצנטי לאורך זמן ניתן לנתח באמצעות תוכניות מתמטיות שונות, כלומר ImageJ (NIH, Bethesda, MD, http:/ / Rsb.info.nih.gov / ij /), איגור Pro (Wavemetrics) או MATLAB (The Mathworks). על ידי הקפה somata של נוירון GFP מתויג-המציין האזור של עניין (ROI), אותו האזור הזה בדיוק ניתן לנתח לשינויים בCa 2 + באמצעות אות פלואורסצנציה Fura האדומה לאורך זמן.
Ca 2 + אותות יכולים להיות מוצגים כיחידות קרינה שרירותיות או כערכים (ΔF / F) של השינוי היחסי בעוצמת קרינה (ΔF) המנורמלת פלואורסצנטי תחילת המחקר (F). תוצאת ההליך בסטייה שלילית כאשר התאית Ca 2 + עליית הריכוז באמצעות Fura אדום כצבע מחוון Ca + 2. כדי להקל על הפרשנות של התוצאות, אנו ממליצים הכפלת ערכי ΔF / F עם -1 לקבל אותות קרינה חיוביים כדי להציג עלייה בCa 2 + (האיור 4C).
כדי להשוות את התוצאות בין הנוירונים משרעת והתדירות של Ca 2 + אותות בדרך כלל מנותחים. עם זאת, חלק 2 אותות + Ca אינם מתרחשים בתקופה רגילה או אמפליטודות דומה. כמה אותות עשויים להיות מושפעים במידה רב על ידי תהליכים סטוכסטיים בתוך התא. לכן, כדי לכמת את סך השינוי בCa 2 + בתא נתון וכדי לאפשר השוואה של Ca 2 + תגובות בין תאי עצב באזורים שונים של מוח, ניתוח של שטח, שמתחת לעקומה (AUC) מתאימות יותר. צעד זה עבור הסכום של Ca 2 + מקיף כל Ca 2 + ראשוני, שלבים חולפים שניים וספג גבוהות Ca 2 + תגובות ותנודות. במקרה זה טיפול יש לנקוט כדי לנתח את אותה תקופת זמן כדי לאפשר השוואה בין הנוירונים.
6. נציג תוצאות
כדי להתחיל אפיון הקולטן גונדוטרופין ההורמון משחרר (GnRHR) מבטא הנוירונים ביפותלמוס עשינו שימוש בעכברים מהונדסים שמביעים GFP לאחר exci Cre בתיווךשיאון בGnRHR-להביע תאי עצב 4,11. הנוירונים GFP ניאון זוהו באזורים שונים במוח, כולל ההיפותלמוס. כדי לחקור את התכונות הפיזיולוגיות של נוירונים GnRHR אלה, נרשמו לראשונה Ca 2 + אותות בפרוסות ההיפותלמוס באמצעות מיקרוסקופ confocal. ראשון, השיגו פרוסות מוח עטרה מעכברים אלו תוך שימוש בפרוטוקול שתואר לעיל. איור 1 מדגים את הכלים, חומרים וצעדים לגוזמים את מוח עכבר הכרחיים. את פרוסות המוח ההיפותלמוס העטרה נחתכו (איור 2) ולאחר מכן העמיסו על פי השלבים בנקודה 4 לפרוטוקול. פרוסה אחת של מוח האזור המתאים מוצבת בחדר הקלטה, מאובטחת עם נבל (איור 3) ולאחר מכן צלם באמצעות מיקרוסקופ confocal (ראה שלבים 5.1-5.9). איור 4 מראה דוגמה של שתי פרוסות מוח עטרה בודדות מזהות אחת גופי תא GnRHR-τGFP, הקרינה במנוחה לאחר loadinגרם פרוסת המוח עם fura-red/AM ותמונת confocal הממוזגת המציין כי GFP נוירון לקח את Fura האדום מספיק כדי לאפשר חקירה של גירוי-Induced Ca 2 + אותות בתאים אלה. שימוש בפרוטוקול שלנו בתחילה בדקו האם נוירונים GnRHR לנצל דומים Ca 2 + אותות לזיהוי גירוי באזורים שונים של ההיפותלמוס בתגובה להפעלה ישירה עם GnRH (4E איור). עם זאת, אותות אלה היו שונים בצורת הגל שלהם תלויה בעוצמת גירוי ו4 אזור במוח. כדי לכמת את השינוי בדינמיקה של Ca 2 + תשובות, אזור-תחת העקומה (AUC) ניתן לחשב כמדד לעלייה בCa התאי 2 + (4E איור) 4. לימודים הם כרגע בעיצומו לחקור את הבסיס המולקולרי העומד בבסיס את 2 + Ca גלים ותנודות, בתלותן במין והמצב ההורמונלי של בעלי החיים, והאם הם יכולים להיות מווסתיםעל ידי גירויים טבעיים אחרים.
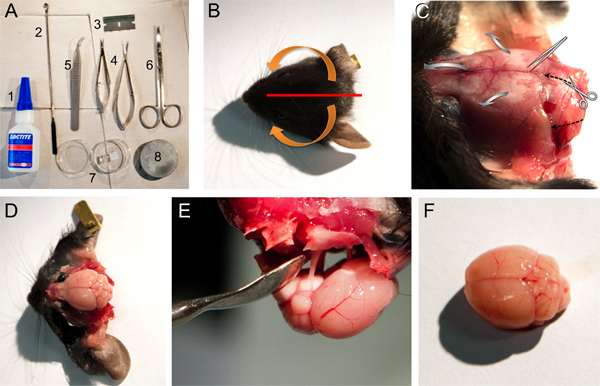
איור 1. כלים, חומרים וצעדים לגוזמים את מוח עכבר. א כלים וחומרים המשמשים לנתיחת מוח: 1, 406 Loctite דבק מגע, 2, מרית כפית מייקרו, 3, סכין גילוח קצה אחד; 4, מספרי האביב קטנים ובינוניים, 5, מלקחיים קהים; 6, מספריים; 7, צלחת פטרי המכילים אגר ג'ל לחסום; 8, צלחת בסיס להרכבה לתוך מוח microtome. BF. תמונות של כמה צעדים שמתוארים בשלב 2 של הפרוטוקול. תמונה ב 'של ראש עכבר מציין את מיקום החיתוך של הקרקפת (קו אדום) וחיצים (כתום) המצביעים על הכיוון צריך להיות מורם העור מהעצם (ראה שלב 2.4). תמונת ג ראש העכבר לאחר העור התרחק מראה את מבני העצם (ראה שלב 2.4). חיתוך כיוון המספריים והכיוון שלפרץ את הגולגולת עם מלקחיים הבוטים מצוין עם או השחורמקווקו חיצים או חיצים רחבים אפורים, בהתאמה. תמונת ד של מוח העכבר לאחר חיסול מבני העצם השונים (ראה שלב 2.5-2.7). תמונת א 'של ההסרה של המוח עדיין מחוברת לגולגולת באמצעות עצבי הגולגולת. צילום של פ מוח עכבר יחסית לא נפגע.

איור 2. חיתוך של חלקים ההיפותלמוס עטרה של מוח העכבר. א לצלם מציין את המיקום של סכין גילוח קצה אחד לחיסול המוח הקטן (ראה שלב 3.1). קבוצה ב 'של בלוק ג'ל אגר ביחס למוח הודבקה baseplate של microtome (ראה שלב 3.2). חיתוך של פרוסת המוח ג עטרה (יציין כאן את מיקומו של מוח ובעמדות לחסום ג'ל בהקשר ללהב החיתוך של microtome; ראה שלב 3.4.). ד, הגבה; v, גחון.

איור 3. פרוסת המוח ממוקמת בתא הקלטה., B. סקירה () וגבוהה יותר גדלה (ב) לתא וורנר מכשירי RC-27 פתוח אמבטית הקלטת מתן גישה רחבה לאזורי ההיפותלמוס של פרוסת מוח העטרה (ראה שלב 5.1). נבל מתכת בצורת פרסה המכיל ג מערכים מקבילים של חוטי ניילון שמחזיקים את הפרוסה בעמדה בחדר ההקלטה (ראה שלב 5.2).
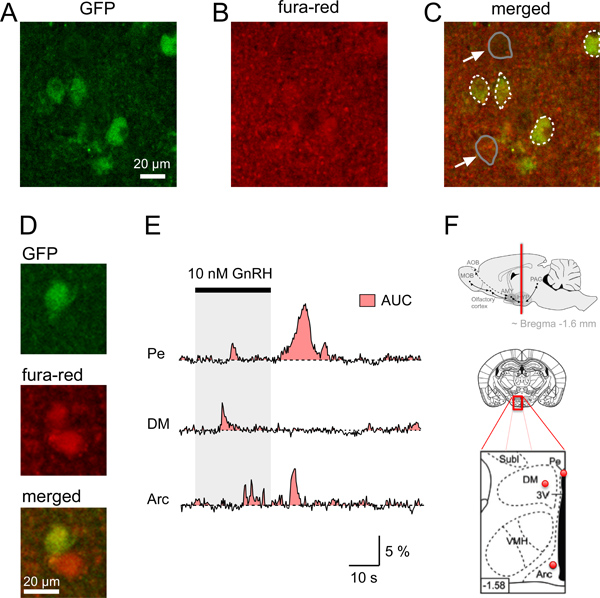
איור 4. Ca 2 + אותות בתאי עצב τGFP של פרוסות מוח ההיפותלמוס עכבר. מודעה. זיהוי של ה-GFP נוירון ורכישה סימולטנית של קרינת Fura האדום בפרוסות מוח עכבר עטרה. תמונת Confocal א פרוסת מוח עטרת זיהוי GnRHR-τGFP הנוירונים (ירוק). ב 'אות פלואורסצנציה אחידה יחסית (אדום) של האזור במוח שמוצגת בנצפה לאחר טעינה פרוסת המוח עם fura-red/AM. ג Merged תמונה מראה Neurons מתואר בעמוס Ca 2 + מחוון צבע (צהבהב). גבולות GFP נוירון somata מסומנים בקווים לבנים מקווקוים, ואילו דוגמאות של 2 somata הלא GFP (חיצים) מסומן בקווים אפורים. ד דוגמה של GFP ותא עצב אינו GFP עם כמויות גדולות יותר של קרינה אדומה בהשוואה לרקע. דוגמאות של E. סומטי גירוי-Induced Ca 2 + תגובות נוירונים בודדים GFP-tagged באזורי מוח ההיפותלמוס שונים (PE גרעין, periventricular; ההיפותלמוס DM, dorsomedial; ארק, גרעין מקושת). אזור-תחת העקומה (AUC) מתוארת על ידי האזור האדום. ברור Ca 2 + אותות בין GnRHR-להביע נוירונים מגרעיני ההיפותלמוס שונים ניתן להשוות באמצעות AUC כאומדן לשינוי המוחלט בCa 2 + בתא נתון באותה התקופה. ציורי פ Schematic ודיאגרמות המצביעים על מיקומם של הנוירונים GFP המתויג-נתחו בע"א עליון: פנל. מיקום של המוח של עטרהection המכיל אזורי מוח ההיפותלמוס (קו אדום) מזרח ופנל תחתון:. ציור סכמטי של פרוסת מוח (באמצע) וגדלה של האזור התאגרף האדום שלו (פנל תחתון) מצביעה עם נקודות אדומות מיקום המשוער של הנוירונים GFP המתויג המוקלטים מ PE, DM וארק מוצג בדואר; האזור שחור בתכנית פנל תחתונה: 3 rd חדר לב. תרשימי 2 נמוכים מעובדים מPaxinos ו12 פרנקלין. מספר הפינה שמאלי תחתון מציין את המרחק (מ"מ) מגבחת.
Discussion
שאלה מרכזית בחקר המוח היא להבין כיצד המוח מעבד מידע חברתי. מקור עיקרי של מידע נחוץ להכרה חברתית מקודד על ידי אותות ריח או מושכים. זיהוי של אותות אלה על ידי אוכלוסיות עצביות באף ומההכרה של האותות במוח, בעיקר ההיפותלמוס, לשחק תפקיד מפתח בתהליכים חברתיים רבים והורמוני הש...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
אנו מודים לחברינו שהשתתפו ביצירתו סכמו כאן. עבודה זו נתמכה על ידי מענקים מForschungsgemeinschaft דויטשה (SFB 894), "הניתוח אינטגרטיבי של olfaction 'DFG Schwerpunktprogramm 1392 ועל ידי פולקסווגן הקרן (TLZ). TLZ הוא פרופ 'ליכטנברג של פולקסווגן הקרן.
Materials
| Name | Company | Catalog Number | Comments |
| שם | חברה | חתול. N ° | |
| אגר | סיגמא | A1296 | |
| Fura-red/AM | Invitrogen | F-3021 | |
| Pluronic F-127 | סיגמא | P2443 | |
| sulfoxide דימתיל | הפישר סיינטיפיק | BP231 | |
| רטט-Blade Microtome השפן V 50 | Zeiss | 9770170 | |
| קירור ההתקנים CU 65 לMicrotome שפן V 50 | Zeiss | 9920120 | |
| O 2 / CO 2 חממה, CB210-UL | כורך | 0019389 | |
| סופר דבק, Loctite 406TM | Henckel | 142580 | |
| מריות כפולות, צורת כפית | Bochem | 3182 | |
| מריות Microspoon, צורת כפית | Bochem | 3344 | |
| מספרי האביב, מוריה-Vannas-וולף - להבי 7mm | כלי מדע פיין | 15370-52 | |
| מספרי האביב, Vannas - להבי 3mm | כלי מדע פיין | 15000-00 | |
| מספריים וגנר | כלי מדע פיין | 14071-12 | |
| רפואי מלקחיים, 7b דומון | כלי מדע פיין | 11270-20 | |
| הלשכה גדולה מלבנית פתוחה אמבטיה (RC-27) | וורנר מכשירים | 64-0238 | |
| זיו BioRad מיקרוסקופ confocal 2100 | Zeiss | נה |
References
- Almholt, K., Arkhammar, P. O., Thastrup, O., Tullin, S. Simultaneous visualization of the translocation of protein kinase Calpha-green fluorescent protein hybrids and intracellular calcium concentrations. Biochem. J. 337 (Pt 2), 211-218 (1999).
- Bolsover, S., Ibrahim, O., O'Luanaigh, N., Williams, H., Cockcroft, S. Use of fluorescent Ca2+ dyes with green fluorescent protein and its variants: problems and solutions. Biochem. J. 356, 345-352 (2001).
- Leinders-Zufall, T., Ishii, T., Mombaerts, P., Zufall, F., Boehm, T. Structural requirements for the activation of vomeronasal sensory neurons by MHC peptides. Nat. Neurosci. 12, 1551-1558 (2009).
- Wen, S. Genetic identification of GnRH receptor neurons: a new model for studying neural circuits underlying reproductive physiology in the mouse brain. Endocrinology. 152, 1515-1526 (2011).
- Hara, M. Imaging pancreatic beta-cells in the intact pancreas. Am. J. Physiol. Endocrinol. Metab. 290, E1041-E1047 (2006).
- Doherty, A. J., Coutinho, V., Collingridge, G. L., Henley, J. M. Rapid internalization and surface expression of a functional, fluorescently tagged G-protein-coupled glutamate receptor. Biochem. J. 341 (Pt 2), 415-422 (1999).
- Kurebayashi, N., Harkins, A. B., Baylor, S. M. Use of fura red as an intracellular calcium indicator in frog skeletal muscle fibers. Biophys. J. 64, 1934-1960 (1993).
- Heyward, P. M., Chen, C., Clarke, I. J. Gonadotropin-releasing hormone modifies action potential generation in sheep pars distalis gonadotropes. Neuroendocrinology. 58, 646-654 (1993).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys. J. 74, 1591-1599 (1998).
- Wen, S. Functional characterization of genetically labeled gonadotropes. Endocrinology. 149, 2701-2711 (2008).
- Paxinos, G., Franklin, J. . The mouse brain in stereotaxic coordinates. , (2001).
- Tirindelli, R., Dibattista, M., Pifferi, S., Menini, A. From pheromones to behavior. Physiol. Rev. 89, 921-956 (2009).
- Kelliher, K. R., Wersinger, S. R. Olfactory regulation of the sexual behavior and reproductive physiology of the laboratory mouse: effects and neural mechanisms. ILAR J. 50, 28-42 (2009).
- Yoon, H., Enquist, L. W., Dulac, C. Olfactory inputs to hypothalamic neurons controlling reproduction and fertility. Cell. 123, 669-682 (2005).
- Boehm, U., Zou, Z., Buck, L. B. Feedback loops link odor and pheromone signaling with reproduction. Cell. 123, 683-695 (2005).
- Wilson, J. M., Dombeck, D. A., Diaz-Rios, M., Harris-Warrick, R. M., Brownstone, R. M. Two-photon calcium imaging of network activity in XFP-expressing neurons in the mouse. J. Neurophysiol. 97, 3118-3125 (2007).
- Hu, J. Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science. 317, 953-957 (2007).
- Perez, C. A. A transient receptor potential channel expressed in taste receptor cells. Nat. Neurosci. 5, 1169-1176 (2002).
- Trollinger, D. R., Cascio, W. E., Lemasters, J. J. Selective loading of Rhod 2 into mitochondria shows mitochondrial Ca2+ transients during the contractile cycle in adult rabbit cardiac myocytes. Biochem Biophys. Res. Commun. 236, 738-742 (1997).
- Meshik, X. A., Hyrc, K. L., Goldberg, M. P. Properties of Asante Calcium Red - a novel ratiometric indicator with long excitation wavelength. , (2010).
Erratum
Formal Correction: Erratum: Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices
Posted by JoVE Editors on 10/01/2012. Citeable Link.
There was a typo in the abstract of Imaging Calcium Responses in GFP-tagged Neurons of Hypothalamic Mouse Brain Slices.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved