Method Article
Assay רובד לnorovirus Murine
In This Article
Summary
כאן אנו מתארים שיטה לכמת חלקיקים זיהומיות של norovirus העכברי (MNV), שהוא היחיד שיעילות norovirus משכפל בתרבות תא. Assay פלאק מנצל הכמיהות של MNV למקרופאגים Murine ויכול להיות מותאם לשימוש עם דגימות ביולוגיות או סביבתיות המכילות MNV.
Abstract
norovirus Murine (MNV) הוא הנציג היחיד של סוג norovirus שיעילות גדל בתרבית רקמת 1, 2. תמוגה תא והשפעת cytopathic (CPE) הם נצפו במהלך MNV-1 זיהום של תאי דנדריטים Murine או מקרופגים 1. מאפיין זה של MNV-1 יכול לשמש כדי לכמת את מספר החלקיקים מזהמים במדגם שניתן על ידי ביצוע בדיקת רובד 1. Assay פלאק מסתמך על יכולתו של MNV-1 לlyse תאים וליצור חורים בשכבת תאים מחוברת, הנקראות לוחות 3.
טכניקות מרובות יכולות לשמש כדי לזהות זיהומים נגיפיים בתרבות רקמות, רקמות נקטפו, קלינית, ודגימות סביבתיות, אך לא לכל המידה את מספר החלקיקים מזהמים (למשל qRT-PCR). אחת הדרכים לכמת חלקיקים נגיפיים מידבקים הוא לבצע assay פלאק 3, שיתואר בהרחבה בהמשך. וריאציה על assay פלאק MNV היא פלואורידassay escent מיקוד, שבו אנטיגן MNV immunostained בmonolayers הסלולרי 4. בדיקה זו יכולה להיות מהירה יותר, שכן ביטוי האנטיגן נגיפי קודמת להיווצרות הפלאק. זה גם שימושי עבור titrating וירוסים מסוגלים ליצור את הפלאק. עם זאת, בדיקת מיקוד הניאון דורשת משאבים נוספים מעבר לאלו של assay פלאק, כמו נוגדנים ומיקרוסקופ כדי לספור יחידות מוקד יוצרים. זיהומיות MNV גם ניתן לכמת על ידי קביעת 50% מינון רקמות תרבות זיהומיים (TCID 50) 3. בדיקה זו מודדת את כמות הווירוס הנדרש כדי לייצר CPE ב50% מתאי תרבית רקמה מחוסנת ידי טיטרציה נקודת הסיום 5. עם זאת, מגבלתו של גילוי היא גבוהה יותר בהשוואה ל4 assay פלאק.
במאמר זה, אנו מתארים פרוטוקול assay פלאק שניתן להשתמש בו בצורה יעילה כדי לקבוע את מספר חלקיקי MNV זיהומיות להציג בדגימות ביולוגיות או סביבתיות 1, 4, 6. שיטה זו היא based על הכנת דילולים סידוריים 10-קיפול של דגימות MNV המכילים, המשמשים לחסן monolayer של תאים מתירנית (264.7 תאי macrophage Murine RAW). וירוס מותר לצרף לmonolayer התא לתקופת זמן נתונה ולאחר מכן aspirated לפני מכסה תאים עם תערובת של agarose ותקשורת סלולרית תרבות. אגר מאפשר את התפשטות צאצאים נגיפיים לתאים שכנים תוך הגבלת התפשטות לתאים הנמצאים בריחוק. כתוצאה מכך, תאים נגועים lysed וחורי טופס בmonolayer המכונים פלאק. עם התפשטותו של הווירוס מספקת, לוחות הפכו מכתימים הבא גלויה של תאים עם צבעים כמו אדום, ניטראלי, כחול תילן, או סגול גביש. בדילולים נמוכים, כל רובד נובע מחלקיק אחד מדבק נגיפי והצאצאים שלה, שהתפשט גם לתאים שכנים. לפיכך, לספור את מספר הלוחיות מאפשר לחשב יחידות שלט יוצרים (pfu) נוכחיות במדגם החי 3.
Protocol
1. Culturing של שורת תאי macrophage 264.7 RAW
- לשמור על 264.7 תאי RAW (ATCC, קטלוג # TIB-71) ב- 10 DMEM מדיה, מורכב מגלוקוז DMEM הגבוה עם סרום שור עוברי-אנדוטוקסין הנמוך (<10 איחוד האירופי / מ"ל) 10% (v / v), 10 מ"מ HEPES , 100 U / המ"ל פניצילין, 100 מיקרוגרם / המ"ל סטרפטומיצין, 1 חומצות אמינו לא חיוני מ"מ, 2 מ"מ L-גלוטמין. תאים נשמרים בדרך כלל ב175 2 צלוחיות תרבית רקמת סנטימטר המכילים 35 מ"ל של תקשורת לבקבוק וטופחו על 37 מעלות צלזיוס ו 5% CO 2 ברקמת תרבות חממה. עם זאת, כל בקבוק גודל יכול לשמש בהיקף של מדיה שמתאימה לגודלו של הבקבוק.
- כדי לפצל תאים: לשאוב את התקשורת הישנה, להוסיף 10 מ"ל של DMEM-10 תקשורת הטריה לתאים, ולאחר מכן לגרד את התאים מתחתית הבקבוק באמצעות מגרד תא. בשלב הבא, resuspend התאים לפתרון הומוגני על ידי ציור את התאים לתוך פיפטה 10 מ"ל וכוח לסחוט את התאים באמצעות פיפטה קצה יחסי הציבורessed נגד התחתון של הבקבוק. חזור על פעולה זו לפחות 3 פעמים בכל כך תאי גוש כבר לא ביחד. אמת על ידי מיקרוסקופ אור שהשעית תא בודדה שנוצרה. לאחר מכן להעביר מ"ל 1 (דילול 1:10 או ~ 1x10 7 תאים) - 2 (דילול 01:05 או ~ 2x10 7 תאים) מ"ל של השעית התא לבקבוק 2 סנטימטר חדש 175, ולהביא עד הנפח הסופי של תקשורת 35 מ"ל.
- תאי פיצול בעת שהם כמעט מתלכדים (~ 1x10 8 תאי total/175 סנטימטר 2 צלוחיות): כל שלושה ימים במידה ומתחיל עם דילול 1:10, או כל ימים במידה ומתחיל עם דילול 1:5. השתמש במיקרוסקופ אור כדי לבדוק את המורפולוגיה של תאי תאים לפני פיצול. רוב התאים צריכים להיראות עגולים ולא הופעל. תאים הופעלו יש גרגרים ו / או מורחב, כחוש מורפולוגיה עם נספחים. אל תתנה לגדול יותר תאים כמו תאים אלה איננו בדרך כלל מהווים את הפלאק. עקוב אחר מספר המעבר ולעתים קרובות להתחיל מחדש על ידי הפשרת aliquot מעבר נמוך של תאים. (אנו משתמשים במעבר 30 כחתך).
2. להדביק תאי 264.7 RAW עם MNV בידוד
- 264.7 תאי הזרע הגולמיים לצלחות 6-כן (3.5 סנטימטרי קוטר) בצפיפות של 1x10 6 תאים / מ"ל ב- 10 DMEM מדיה קיימא, ולהוסיף 2 מ"ל של השעיה זו לכל אחד גם. חשוב להפיץ את התאים באופן שווה בבארות או על ידי נדנדת צלחות ביד לפחות 10 פעמים או באמצעות מנגנון נדנדה ל~ 10 דקות. אל מערבולת הצלחות כמו זה יהיה לגרום לתאים לאשכול במרכז הבאר. צלחות מקום לתוך רקמת תרבות חממה (ב 37 ° C ו 5% CO 2). אפשר תאים לצרף ללילה או לפחות 4 שעות ב 37 ° C. תאים צריכים להיות 60 - 80% confluent לassay פלאק ומתחלק באופן שווה לאורך הבאר.
- למחרת, להכין את בידוד הנגיף, אשר יכול להיות מתאים MNV נגועים בתרביות רקמה או מרקמות או דגימות צואת הומוגניזציה של עכברים MNV-נגועים. בעת שימוש בדגימות רקמת pi, גודל כגודל אפוןeces של הרקמה homogenized ב 2 צינורות פקק מ"ל המכילים חרוזי סיליקה סטריליים ב1 מ"ל של DMEM-10 באמצעות homogenizer רקמות (למשל MagnaLyser; רוש). לדגימות צואה, לא יותר מ 3 כדורי צואה יש homogenized בתקשורת 1 מ"ל. כל הדגימות ואז הם קפואים (ב -80 ° C) ולהפשיר פעם אחת לפני ביצוע assay פלאק.
- הכן דילולי 10-קיפול של בידוד הנגיף ב- 5 DMEM בינוני שלמה, שמורכב מDMEM / סוכר גבוה, 5% (V / v)-אנדוטוקסין הנמוך העוברי שור בסרום (<10 איחוד האירופי / מ"ל), 10 HEPES מ"מ, 100 U / מיליליטר פניצילין, סטרפטומיצין 100 מיקרוגרם / מ"ל, 1 מ"מ חומצות האמין שאינם חיונית, 2 מ"מ L-גלוטמין.
- דילולים סידוריים של פי עשר ערוכים צלחות 24 גם: פיפטה מהדר משמש לתקשורת לוותר 1.35 מ"ל לתוך בארות מרובות, 10 הדילול -1 נעשה על ידי ערבוב 1.35 מ"ל של תקשורת ו0.15 מ"ל של מדגם המכיל וירוס, ו אז 0.15 מ"ל של הדילול 10 -1 מתווסף ל1.35 מ"ל של תקשורת לעשות 10 -2 dilution וכן הלאה. חשוב לשנות את טיפים בכל פעם שאתה עושה דילול חדש. פיפטה רב ניתן להשתמש כדי להפוך את הדילולים של דגימות המרובות בו זמנית עם שתי עצות מתאימות לטיפוס אחד מוכר היטב של צלחת 24 גם העברת נפח כולל של 0.15 מ"ל לטוב (ראה איור 3 א).
- מגוון דילול טיפוסי לhomogenates רקמות ותכני צואה הוא 10 -1 ל10 -3. עם זאת, שלטים מדגימות אלה נוטים להיות קטנים יותר בהשוואה לאלו מדגימות תרבית רקמה. יתר על כן, במקרים מסוימים 1:100 דילול של דגימות צואה יש צורך במידה מספקת כדי לדלל את כל רכיבים רעילים של הצואה שעלולה לשבש את monolayer התא, ובכך מעכב את היכולת לספור את הפלאק. מגוון דילול lysates תרבית הרקמה תלויה בנקודת הזמן של ריבית במהלך מחזור החיים הנגיפי. דילולים כי לעלות עד 10 -9 ייתכן שיהיו הצורך בשיאו של זיהום.
- לאחר הדילולים הסידוריים מוכנים, לתייג את הצלחת 6-הטובה זה מכיל 264.7 monolayers RAW (מ סעיף 2.1) עם שם המדגם והדילולים להיות מצופה. צלחת אחת בכל פעם, להסיר את כל אמצעי התקשורת על ידי מנפנף אותו החוצה או aspirating. מייד לאחר מכן להוסיף 0.5 מ"ל של דגימה מדוללת לטוב, ואז לחזור עם משוכפל היטב, לפני שימשיך לדילול הבא. ברגע שכל 3 הדילולים מתווספים לצלחת, צלחת הטיה אחת הלוך ושוב ביד על מנת להבטיח שכל התאים מכוסים. טפל בצלחת אחת בכל פעם כדי לוודא שתאים לא יתייבשו.
- לאחר הוספת 0.5 מ"ל של דילולים לכל באר, לערום צלחות זקופות ודגירתם לשעה 1 בטמפרטורת חדר. משום שהנפח נוסף לכל גם הוא אינו מספיק כדי לכסות את monolayer לחלוטין, הצלחות צריכות להיות מוטות בעדינות קדימה ואחורה ביד כל 10-15 דקות או להציב על מנגנון נדנדה (~ 18 תנודות לדקה). זה מונע מתאים מהתייבשות.
3. נקודת התכה הנמוך agarose (SeaPlaque) הכנת שכבה
s = "jove_content"> הערה: רצוי לנו כמה בקבוקים עם autoclaved SeaPlaque agarose הכין מבעוד מועד. Agarose ניתן מחדש נמס במיקרוגל לפני השימוש.
- לחשב את הכמות הנדרשת לכיסוי הנפח הכולל של צלחות לפני דגירת 1 השעות תושלם. הנפח הדרוש הוא 2 מ"ל / היטב צלחת או 12 ml/6-well. הכן agarose (ראה סעיף 3.2) ותקשורת (ראה סעיף 3.3) בנפרד.
- כדי להכין את agarose, להשעות 3 גרם מSeaPlaque agarose בנפח כולל של 100 מ"ל של מים מזוקקים (3% w / v) בבקבוק זכוכית. חיטוי ל20-30 דקות. (אם agarose כבר היה מוכן לפני יד, מחדש להמס agarose במיקרוגל.) חשוב לאזן SeaPlaque agarose עד 42 מעלות צלזיוס באמבט מים לפני השימוש, כי אם agarose חם מדי, זה יהיה להרוג את התאים. ודא מפלס מים הוא שווה או מעל לרמה של agarose כדי למנוע התמצקות לא רצויה.
- כדי להכין את התקשורת: לעשות 100 מ"ל של 2x MEM תקשורת, אשר מורכבת2x מזכרות ספורט, 10% (v / v)-אנדוטוקסין נמוך בסרום שור עוברי (<10 איחוד האירופי / מ"ל), 10 מ"מ, 100 HEPES U / המ"ל פניצילין, סטרפטומיצין 100 מיקרוגרם / מ"ל, 4 מ"מ L-גלוטמין. לאזן תקשורת עד 37 מעלות צלזיוס באמבט מים.
- מערבב שני SeaPlaque agarose ותקשורת ממ 2x יחד בבקבוק סטרילי בביחס 1:1 מייד לפני שכיסה את monolayers התאים הנגועים. אם שכבה יותר מ 200 מ"ל יש צורך, נפח פיצול לתוך בקבוקים מרובים ולשמור על 37 מעלות צלזיוס אמבט מים עד מוכן לשימוש.
- בסוף דגירת 1 השעות (סעיף 2.7 לראות), לשאוב את הבידוד של כל באר. לאט להוסיף 2 מ"ל של כיסוי לקצה של כל גם על ידי נחת קצה פיפטה על הקיר של כל באר. עד 5 צלחות ניתן לטפל בו זמנית ללא תאי התייבשות.
- אפשר לבסס את הכיסוי לכ 10 דקות בטמפרטורת חדר לפני הכנסת צלחות זקופות לתוך רקמת תרבות החממה. דגירת צלחות עבור 48 שעות ב 37 ° C ב 5% CO 2.
- לאחרתקופת הדגירה, לוחות הן קלוש גלויות לעין בלתי מזוינת, כדי לבדוק צלחות בתוליים לנוכחות של פלאק. אם אין לוחות גלויים, דגירה במשך 4 שעות נוספות ולבדוק שוב. עם זאת, זמן הדגירה המרבית לא יעלה על 72 שעות.
4. ויזואליזציה של הפלאק בכתמים אדומים ניטראליים
- כדי להמחיש את הפלאק, פתרון המכתים אדום הניטראלי הוא הוכן על ידי הוספת 3 מ"ל של ניטראלי אדום (0.33% w / v בDPBS; סיגמא, קטלוג # N2889) לכל 97 מ"ל של 1x PBS (כיתת רקמות תרבות, Mg 2 + -, Ca 2 + - חופשיים; Gibco, קטלוג # 10010). לחשב את הנפח של פתרון מכתים אדום ניטראלי הדרוש לניסוי: 12 מיליליטר פתרון ניטראלי אדום מכתים נדרש לכל צלחת 6-כן. לאחר מכן יש להוסיף 2 מ"ל לכל באר. למרות שחלק מפרוטוקולי assay פלאק דורשים תקע agarose כדי להסיר מהבארות, בפרוטוקול זה הפתרון המכתים אדום הניטראלי מתווסף ישירות על גבי השכבה.
- לאחר שעה אחת בcubation על 37 מעלות צלזיוס, לבדוק אם הפלאק גלוי עם פתרון מכתים אדום ניטראלי עדיין בבארות. אם הפלאק אינו ברור מהמבט ראשון, יש לאפשר להכתמה להמשיך לשעות נוספות. המשך דוגר עד הפלאק גלוי. (הערה:. כתמים ליותר מ 3 שעות הם לא אופטימליים, ואם אין לוחיות גלויות במדגם הביקורת החיובי לאחר 3 שעות של צביעה, assay פלאק לא עבד כראוי) לאחר הצביעה היא מוחלטת, לשאוב את הפתרון המכתים אדום הניטראלי , להבטיח את תקע agarose אינו מופרע, ולאחר מכן להמשיך לספור את הפלאק.
- ספירת הפלאק ידי הצבת צלחת הפוכה על קופסא אור וסימון נקודה על הפלאק נספר כדי למנוע ספירה כפולה. בחר הדילול לספור הפלאק בבארות בי הפלאק מופרד באופן ברור (כלומר, אין עדות ראייה של פיוזינג הפלאק יחד). אם אפשר, לספור הפלאק בשני דילולים. חשוב לציין שגודל השלט עשוי להשתנות בין זני MNV, בידוד נגיף, ותלוימצבם של תאי 264.7 RAW במהלך assay פלאק.
- אם לא הפלאק גלוי בבאר, או לא הייתה קיים וירוס במדגם או את כמות הנגיף היה תחת המגבלה של זיהוי של assay פלאק. במקרה זה, בארות כתם אדום עם צבע דומה כמו בארות פלאק המכילים אחרות. לחלופין, בהעדר הפלאק הוא ציין גם כאשר יש יותר מדי חלקיקים המצויים בדילול ניתן נגיפיים. זה מוביל לתמוגה של כל monolayer ובארות תופענה כתומות / צהוב בצבע.
- חישוב titers הנגיפי. הוסף את מספר השלטים בשתי בארות בדילול אחת ולהכפיל במקדם הדילול (כלומר 1 מ"ל אם 2 בארות נגועות 0.5 מ"ל). זה יניב את כמות היחידות פלאק יוצרים (pfu) בנפח שלך הבידוד של 1 מ"ל. לדוגמה, באיור 4 בדילול -2 10, אחד טוב (מסומן "השני") יש 14 לוחות וגם השניים (מסומן "V") יש 17 לוחות. לפיכך, כייל הנגיף יהיה 14x10 2 + 2 = 17x10 3100 (3.1x10 3) pfu / מ"ל.
5. נציג תוצאות
-1 MNV חלקיקי זיהומיות ניתן לכמת באמצעות assay פלאק כפי שמתואר באיור סכמטי 1. 2A האיור מראה היטב עם monolayer של 264.7 תאי RAW רק לפני הזיהום, בעוד שהתרשים 2B מציג שלושה רבדים גלויים שצוין על ידי מספרים רומים I, II ושלישי בכן. שלביה שונים של הבדיקה מתוארים באיורי 3A באמצעות פ איור 3 א מציג את הכנת סדרת הדילול 10-הקיפול של מדגם המכיל וירוס. האיור 3B מציג את ההעברה של דילולים לשכפל בארות של צלחת 6-כן. איור 3C מראה את מנגנון הנדנדה משמש לדגירת תאי 264.7 RAW עם הבידוד בטמפרטורת חדר למשך שעת האיור 1 3D מציג תאים שכוסו בSeaPlaque:. MEMתערובת. איור 3E מראה צלחת בטמפרטורת חדר כדי לאפשר הכיסוי לביסוס, תוך 3F האיור מראה שתאים מוכתמים ב48 שעתי פתרון אדומות ניטראליות 0.01% מאוחר יותר. לאחר הכתמת תאים לשעות 1-3 וaspirating הפתרון המכתים אדום הניטראלי, לוחות גלויים וניתן לספור (איור 4).
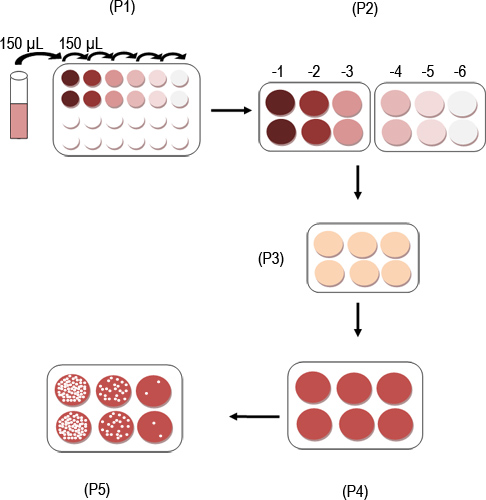
איור 1. סכמטי של פרוטוקול assay פלאק MNV.
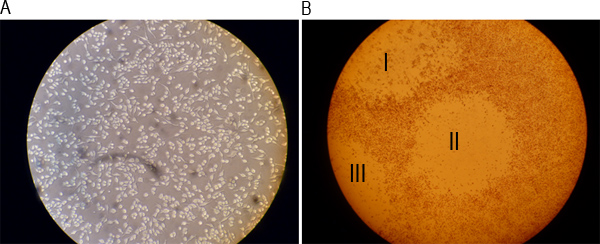
איור 2. תמונות מייצגות של היטב של monolayer לפני זיהום ולאחר היווצרות של פלאק. A 264.7 תאים) RAW היו בתרבית הלילה והדמיה תחת מיקרוסקופ אור בהגדלת 20x. B) תאים הוכתמו פתרון אדום ניטראלי 0.01% לאחר 48 שעותr של זיהום ומדמיין תחת מיקרוסקופ אור בהגדלה של פי 4. מספרים הרומי I, II ו-III לציין שלושה רבדים גלויים.
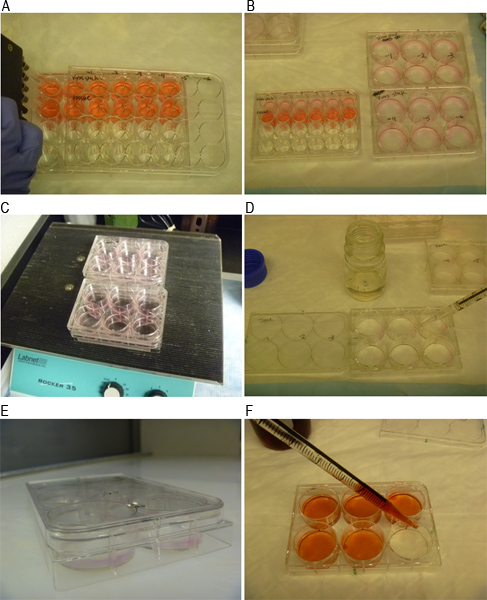
איור 3. תמונות מייצגות של צעדי assay פלאק השונים. ) MNV-1 בידוד מוכן בדילולי 10-קיפול. B) בידוד נוסף לmonolayers תאים בבארות כפולות. ג) תאים והבידוד מודגרת ידי נדנדה לשעה 1 בטמפרטורת חדר. ד) תאים הם כיסו עם תערובת ביחס 1:1 של SeaPlaque agarose ו2x MEM תקשורת. E) צלחות מודגרת למשך 10 דקות בטמפרטורת חדר כדי לאפשר הכיסוי לביסוס. F) צביעת תאים בפתרון המכתים אדום הניטראלי 48 שעות לאחר פגיעה.
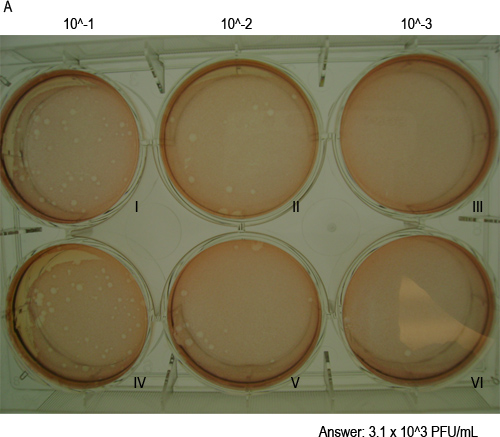
איור 4. הפלאק צורות MNV-1 בתא monolאיירס. המוצג כאן היא צלחת assay פלאק נציג 48 שעות לאחר פגיעה, מראה הפלאק מגואלים בפתרון מכתים אדום ניטראלי לאחר שעת 1 של דגירה. צלחת תערוכות בארות כפולות של שלושה דילולים 10-קיפול. ולס מסומן במספרים רומים אני וIV מתאים ל10-1 דילול; שני והחמישי מתאימים ל10-2 דילול; III ו-VI מתאים ל10-3 דילול. כייל הנגיף בדגימה מצוין בהמשך (ראה סעיף 4.5 לפרטי החישוב).
Discussion
שיטת assay פלאק לMNV-1 מוצגת כאן היא דרך של כימות חלקיקי MNV זיהומיות. על ידי ביצוע פעולות assay המאוירים באיור 3, ניתן לקבל titers הנגיפי לשעתק. המגבלה של זיהוי של assay תלויה בדילול מתחיל בשימוש. כאשר מתחילים עם דילול 1:10 של מדגם, כמתואר לעיל, המגבלה של זיהוי של assay פלאק היא 10 pfu (כלומר, לוח 1 גלוי ב10 -1 דילול). מאחר וכל רובד מייצג וירוס אחד, assay פלאק יכול לשמש גם כדי לטהר אוכלוסיות משובטות של MNV באמצעות הרמת שלטים מבודדים והפצתם כפי שתוארה לעיל 1. בנוסף, טהרת הפלאק יכולה לשמש גם כדי להפריד בין אוכלוסיית וירוס בודדה מאוכלוסיות וירוסים מעורבות. הגבלה של שימוש assay פלאק לגילוי זיהום MNV היא שלא כל זני MNV יוצרים פלאק 4. עם זאת, ייתכן שניתן יהיה להתגבר על inability של כמה זני MNV, שבודדו מבעלי חיים, ליצירת פלאק ידי passaging וירוסים אלה התוקפים בתרבית הרקמה 7. חלופה לassay פלאק היא למדוד חלקיקים מזהמים באמצעות 50 טכניקת TCID 3, 4. assay זה מכמת את כמות הווירוס הנדרש כדי לייצר CPE ב50% מתאי תרבית רקמה מחוסנת לאחר דילולי נקודתי קצה ולוקח 1 שבוע כדי להשלים לMNV 4. בנוסף להיות איטי יותר מאשר assay פלאק, 50 assay TCID הוא גם לא רגיש כמו (מגבלה של זיהוי = 200 TCID 50 / מ"ל) בשל הרעילות של דגימות רקמה לתאי 264.7 RAW 4.
אף ששלבים קריטיים בתוך הפרוטוקול תוארו לאורך הפרוטוקול, הסעיף הבא מספק סיכום כדי להקל על בעיות ירי. השלב הקריטי ביותר בפרוטוקול הוא להבטיח שתאי 264.7 RAW נשארים קיימא לאורך assay לתומך בשכפול נגיף. זה יכוללהיות במעקב בכל שלב של הבדיקה באמצעות מיקרוסקופ אור. כדאיויות תא מובטחת בשתי דרכים. ראשית, יש להיזהר לא לתת לתאים יתייבשו בזמן טיפול צלחות. לפיכך, צלחות מחוסנות אחד בכל פעם, התנדנדו בתקופת הזיהום, וצריכות להישאר סגורים כל פעם שהם לא מטופלים. שנית, הוסיפו פתרונות לתאים צריכים להיות מתאזנים ל ~ 37 ° C. יתר על כן, הוא חיוני לבריאות הכללית של 264.7 תאי RAW לשמור עליהם בתקשורת המכילה רעלן פנימי סרום נמוך (<10 איחוד האירופי / מ"ל), המגביל את ההפעלה של תאים. בנוסף, יש לנו נצפו שיעור כישלון גבוה יותר של assay פלאק בעת שימוש בתאים ממעבר 30 ומעלה. למרות שזה עשוי להשתנות ממעבדה למעבדה, חשוב לכלול ביקורת חיובית (למשל, דוגמה עם כייל נגיף ידוע) כדי להבטיח titers לשעתק, במיוחד כאשר באמצעות תאי 264.7 RAW מעבר גבוהים יותר. כדי להגביל את השימוש בתאי מעבר גבוהים יותר, מומלץ להקפיא את המבחנות של תחילת passaתאי ge עם קבלת 264.7 תאי RAW ולהתחיל תרבות חדשה מהבקבוקונים קפואים לעתים קרובות. להתחיל מחדש עם תרביות תאי מעבר נמוכות גם להיות שימושי כאשר תאים להציג מאפיינים שונו, כמו אי ספיקה לדבוק, שינויים במורפולוגיה של תאים (לדוגמה מסיבוב לדק והתפשט החוצה), או כאשר זיהום Mycoplasma זוהה. נקודה חשובה נוספת לשים לב להיא להבטיח שטיפי פיפטה משתנים בין דגימות ובמהלך הדילולים. זה יבטיח דילולים סידוריים מדויקים ולמנוע זיהום צולב בין דגימות. צעד אחד בפרוטוקול שבו ניתן להשתמש באותו קצה פיפטה שוב הוא כאשר דילולים סידוריים של אותו המדגם מתווספים לבארות. במקרה כזה, צריך להתחיל מבידוד המדולל ביותר ועד נמוך, ונמרצות פיפטה מעלה ומטה בעת עריכת דילול חדש.
פרוטוקול assay פלאק הוא amendable למספר שינויים. שינוי אחד שיכול להתבצע כאשר tכאן הם לא מספיק תאים לinoculating בארות בשתי עותקים, הוא להדביק רק טובה אחת לכל דילול. עם זאת, מאחר שנפח הבידוד הוא 0.5 מ"ל, מספר פלאק אז צריך להכפיל בפקטור של 2 לנרמל לpfu / מ"ל. Assay פלאק יכול גם להיות מותאם לשימוש עם כל שורת תאי חסיד אחרת שיכולה לתמוך בשכפול של MNV, ואת זה כבר תאר לmicroglial קו BV-2 התא העכברי 8. שינויים אחרים שניתן ליישם הם עיבודים שתוארו בפרוטוקולי assay פלאק שפותחו עבור וירוסים אחרים. במקרה של MNV, את השינויים הבאים כבר יושמו בהצלחה, השימוש בתאית מתיל במקום לוחית ים 9 agarose, וצביעת תאים בסגולים או מתילן הכחול במקום האדום ניטראלית 10, 11 גביש.
באופן כללי, פרוטוקול זה יכול בקלות להיות מותאם לפי צורך לכמת וירוסי פלאק יוצרים אחרים או שימוש לothאה וירוסים הגורמים לזיהומים בממוסס 264.7 תאי RAW, מה שהופך אותו לכלי שימושי לכמת חלקיקים נגיפיים מידבקים באופן כללי.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
אנו מודים לחברי מעבדת Wobus להערות והצעות קריטיות. העבודה במעבדה של CEW מומנה על ידי קרנות הזניקו מאוניברסיטת מישיגן, מענק פיתוח קריירה ממרכז NIH / NIAID מצוינות האזוריים לביו הגנה והמחקר העולה מחלות זיהומיות (RCE) תכנית, אזור V הגדול ' RCE 'אגמים (פרס NIH 1-U54-AI-057153) וNIH R01 AI080611. MBG-H. מומן על ידי הניסויי אימונולוגיה (NIH T32 A1007413-16) ואת המנגנונים המולקולריים בפתוגנזה של חיידקים (NIH T32 A1007528) מעניקה הכשרה לאוניברסיטת מישיגן. JBC מומן על ידי Coordenação דה Aperfeiçoamento דה דה pessoal Nível סופריור (שכמיות), ברזיליה, ברזיל.
Materials
| Name | Company | Catalog Number | Comments |
| שם המגיב | חברה | מספר קטלוגים | |
| DMEM / סוכר גבוה | Hyclone | SH30243.02 | |
| 2x MEM | Gibco | 11935 | |
| 100x פניצילין וסטרפטומיצין | Hyclone | SV30010 | |
| 10 חומצות אמינו לא חיוני מ"מ | Hyclone | SH30238.01 | |
| HEPES 1M | Hyclone | SH30237.01 | |
| 200 מ"מ (100x) L-גלוטמין | Hyclone | SH30034.01 | |
| סרום שור עוברי | Gibco, Hyclone | 10437, SH30070.02 | |
| ים הרובד agarose | Lonza | 50100 | |
| ניטראליים אדום 0.33% | סיגמא | N2889 | |
| 1x PBS | Gibco | 10010 | |
| 1.0 מ"מ חרוזי Zirconia / סיליקה | מוצרי BioSpec | 11079110z | |
| Rocker מהירות המודל 35 | Labnet | S2035 | |
| כלי Lyser Magna | רוש | 03358968001 | |
| שורת תאי גלם 264.7 | ATCC | TIB-71 | |
| רקמת תרבות חממה | סנה | MCO-18AIC |
References
- Wobus, C. E. Replication of Norovirus in cell culture reveals a tropism for dendritic cells and macrophages. PLoS Biol. 2, e432 (2004).
- Wobus, C. E., Thackray, L. B., Virgin, H. W. Murine norovirus: a model system to study norovirus biology and pathogenesis. Journal of virology. 80, 5104-5112 (2006).
- Condit, R. C., Knipe, D. M., Howley, P. M. Ch. 2. Fields Virology. 1, 25-58 (2007).
- Thackray, L. B. Murine noroviruses comprising a single genogroup exhibit biological diversity despite limited sequence divergence. Journal of virology. 81, 10460-10473 (2007).
- Reed, L. J., Muench, H. A simple method for estimating 50% endpoints. American Journal of Hygiene. 27, 493-497 (1932).
- Chachu, K. A. Antibody is critical for the clearance of murine norovirus infection. Journal of virology. 82, 6610-6617 (2008).
- Barron, E. L. Diversity of murine norovirus strains isolated from asymptomatic mice of different genetic backgrounds within a single U.S. research institute. PLoS ONE. 6, e21435 (2011).
- Cox, C., Cao, S., Lu, Y. Enhanced detection and study of murine norovirus-1 using a more efficient microglial cell line. Virology journal. 6, 196 (2009).
- Cooper, P. D. The plaque assay of animal viruses. Adv. Virus Res. 8, 319-378 (1961).
- Hyde, J. L. Mouse norovirus replication is associated with virus-induced vesicle clusters originating from membranes derived from the secretory pathway. Journal of virology. 83, 9709-9719 (2009).
- Simmonds, P. Bioinformatic and functional analysis of RNA secondary structure elements among different genera of human and animal caliciviruses. Nucleic acids research. 36, 2530-2546 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved