A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פיתוח של התקנים 3D גראפן אלקטרודה dielectrophoretic
In This Article
Summary
Microdevice עם פוטנציאל תפוקה גבוהה משמש כדי להדגים dielectrophoresis תלת ממדי (3D) (DEP) עם חומרים חדשים. נייר nanoplatelet גרפן וסרט דו צדדי נערמו לסירוגין; מיקרו היטב 700 מיקרומטר נקדח רוחבי לשכבות. התנהגות DEP של חרוזי פוליסטירן הודגמה במייקרו היטב.
Abstract
העיצוב והייצור של microdevice האלקטרודה 3D רומן באמצעות 50 מיקרומטר נייר גרפן בעובי ו100 מיקרומטר סרט דו צדדי מתואר. הפרוטוקול מפרט את ההליכים לבניית שכבה תכליתית, לשימוש חוזר, מרובה, קאמרי dielectrophoresis למינציה. באופן ספציפי, שש שכבות של 50 מיקרומטר x 0.7 ס"מ X 2 סנטימטר נייר גרפן וחמש שכבות של סרט דו צדדי נערמו לסירוגין יחד, ולאחר מכן הידק לשקופית זכוכית. אז 700 מיקרו היטב מיקרומטר קוטר נקדח דרך המבנה רבוד באמצעות מכונת קידוח מייקר מבוקרת מחשב. תכונות בידוד של שכבת הקלטת בין שכבות גרפן הסמוכות הובטחו על ידי בדיקות התנגדות. אפוקסי מוליך הכסף מחובר שכבות חלופיות של נייר גרפן ויצר קשרים יציבים בין נייר גרפן ואלקטרודות חוטי נחושת חיצוניות. המכשיר המוגמר היה אז הידק ואטום לשקופית זכוכית. שיפוע השדה החשמלי היה במתכונת בתוך tהוא מכשיר רב שכבתי. התנהגויות dielectrophoretic של 6 מיקרומטר חרוזי פוליסטירן הודגמו במייקרו העמוק היטב 1 מ"מ, עם מוליכות בינוניות החל 0.0001 S / M ל1.3 S / מ ', וכן להחיל תדרי אות מ100 הרץ ל10 MHz. תגובות dielectrophoretic שליליות נצפו בשלושה ממדים על פני רוב שטח מוליכות תדר וצולב על ערכי תדירות עולים בקנה אחד עם ערכי ספרות שדווחו בעבר. המכשיר לא מנע תזרים AC electroosmosis ואלקטרו, שהתרחש באזורים בתדר הנמוך וגבוהים, בהתאמה. נייר גרפן מנוצל במכשיר הזה הוא תכליתי, ולאחר מכן יכול לתפקד כbiosensor לאחר אפיוני dielectrophoretic הושלמו.
Introduction
גרפן הוא חומר לרומן ידוע לנכסיה באיכות גבוהה האלקטרוניים ויישומים כימיים וbiosensor פוטנציאל 1. nanoplatelets גרפן היה בשימוש במשך תמיכת זרז 2, 3, 4 biosensors, סופר קבלים 5, ומרוכבים אלקטרודות כולל גרפן / polyaniline וחומרים מרוכבים nanoparticle סיליקון / גרפן 6-8. כתב יד זה מתאר ניצול של נייר גרפן כאלקטרודות בייחודי תלת ממדים (3D), מכשיר microfluidic שכבתי. אלקטרודות נייר גראפן היו מרובדים בקלטת דו צדדית insulative וקאמרית נקדח שבתוכו dielectrophoresis 3D AC של חרוזי פוליסטירן בוצע.
Dielectrophoresis (DEP) מתייחס לתנועה של חלקיקי polarizable תחת שדות חשמליים לא אחידים. DEP החיובי (pDEP) או DEP השלילי (NDEP) מתרחש כאשר חלקיקים הם פחות או יותר polarizable מאשר הבינוני, resu מסביבlting בתנועה לכיוון השדה החשמלי החזק או חלש, בהתאמה. כלי electrokinetic קוי זו שימש להפרדה, מיון, לכידה, וזיהוי של חלקיקים ותאים ביולוגיים 9-15. כוח dielectrophoretic המנוסים על ידי חלקיקים מקוטבים הוא פונקציה של שיפוע השדה החשמלי, רדיוס חלקיקים וצורה, מאפייני דיאלקטרי חלקיקים כולל מוליכות וpermittivity, כמו גם מוליכות תקשורת וpermittivity. בDEP המסורתי דו ממדי (2D), תנועת חלקיקים היא במישור העיקרי של שיפוע השדה החשמלי שנוצר בדרך כלל בין אלקטרודות משטח microfabricated; תנועה בכיוון האנכי היא זניחה בהשוואה לכיוונים במטוס ברוב המכשירים. עם זאת, רתימת הממד השלישי הזה של הדרגות שדה חשמליות ל3D DEP מאפשרת תפוקה גבוהה יותר לדוגמה, ומגבירה את הרבגוניות לעצב הפרדות dielectrophoretic חדשות ומשופרות שבו הזרימה היא traveRSE לשדה הדרגתיים 16, 17. עיצובים ספציפיים אחרים כוללים DEP מבוסס 3D מבודד 18, פחמן אלקטרודה 3D DEP 13, 19, ו3D גלוון DEP 10. כפי שמעיד המחקר לתוך מבני 3D, יכולים להיות מופעלים על מכשירים כאלה בזרימת מצב מתמשך על מנת להשיג תפוקה גבוהה יותר. תצפית של תנועת חלקיקי 3D במכשיר 3D השכבתי שלנו מושגת כפונקציה של תדירות ומוליכות בינוניות באמצעות מיקרוסקופ אור בגבהים מוקד שונים.
Fatoyinbo et al. דווח לראשונה DEP ב3D למינציה מבנה אלקטרודה / בידוד באמצעות נייר כסף נערם לחלופין 30 מיקרומטר אלומיניום ו150 סרטי שרף אפוקסי 20 מיקרומטר. הובנר ואח'. לאחר מכן נועד אלקטרודות למינציה 3D דומות עם 35 מיקרומטר סרט נחושת ו118 מיקרומטר דבק polyimide 21. עבודה זו לווה עיצוב 3D היטב 22, 23, ומנצל באופן ייחודי את הנוחות של 50 נייר מיקרומטר גרפן כשכבות ניהול ו100 מיקרומטר קלטת דו צדדית כמו שכבות הבידוד, אשר השיגו איטום ומיגון חשמל מספיק. צדדיות נייר גראפן הוא יתרון מובהק לmicrodevices האלקטרודה 3D כי יש לי nanoplatelets גרפן היכולת לפעול במקביל כbiosensors, שקבוצה זו הפגינה 24 בעבר.
הדרגות השדה הושגו תוך נייר / פולימר גרפן למינציה microdevices 3D תלוי בממדי מיקרו היטב, שכבות נייר גרפן, והשדה החשמלי מיושם. ממדים קריטיים כוללים את המרווח האנכי אלקטרודה (ניצוח ובידוד עובי שכבה) וקוטר מיקרו היטב וגובה (נקבע על ידי שכבות שנערמו). האות החשמלית יכולה להיות מכוונת באמצעות המשרעת ותדירות. מבנה המכשיר הנוכחי הוא לפעולה אצווה, אבל יכול להיות מותאם למכשיר זרימה רציף. Fab המכשירטכניקת rication המתוארת כאן היא מתאימה לפיתוח 3D למינציה אלקטרודות עם מגוון רחב של נכסי nanoplatelet גרפן פשוט על ידי החלפת נייר גרפן מנוצל. יתרונות של ניצול נייר גרפן הם רבגוניות של תכונות פיסיקליות וכימיות, הוצאות מופחתות, וnanoplatelets גרפן במקביל יכול לשמש biosensors כדי לזהות מגוון רחב של bioanalytes 24. מטרות ארוך טווח של מערכות DEP 3D תפוקה גבוהה הן לזהות במהירות סוגי תאי 25-27, או להשיג ללא תווית, מיון תא בתיווך חשמלי של תאים חולים מאוכלוסיות של תאים בריאים 28. מסמך זה מדגים אופטימיזציה של חומר והכנה ותפעול מכשיר ואחריו המחשה וניתוח של תוצאות טיפוסיות.
Protocol
1. לפברק מבנה 3D רבודה אלקטרודה / בידוד
- לשכבה 6 גרפן, 5 מכשיר שכבת קלטת, לחתוך נייר גרפן עם אזמל או סכין גילוח דומה ושליט ישר קצוות לשישה 0.7 סנטימטר x 1.5 מלבנים סנטימטר ולהשתמש במספריים לחתוך קלטת דו צדדית רגיש ללחץ לחמישה 1.3 סנטימטר x ~ 5 פסי סנטימטר.
הערה: כפי שמוצג באיור 1 א, זה מניב אלקטרודה 3 אדמה, 3 מכשיר אלקטרודה אות AC. מ"מ 7 ניצוח רוחב שכבה צר מספיק כדי להתאים על גבי זכוכית, עדיין רחב מספיק לקידוח קל. אורך 2 מ"מ לא בקלות לשבור בעת שימוש החוזר ויש לו מספיק מקום לצרף חוטי נחושת. עומק המכשיר הוא מוגבל על ידי מעמקי טחנת הסוף. - הנח את השכבה הראשונה של נייר גרפן בשקופית זכוכית נקייה. לאט לאט לכסות את הקצה אחד של נייר גרפן עם פס אחד של קלטת, ומשאיר מרווח מ"מ ~ 2 כדי להבטיח בידוד בין שתי שכבות נייר גרפן הסמוכות (איור 1b ).
- הנח את השכבה השנייה של נייר גרפן על גבי הקלטת לקזז את השכבה הראשונה של נייר גרפן (איור 1 א). החל לחץ מתון (לחץ באופן אחיד עם אצבע, ~ 100 N מעל 0.7 2 סנטימטר באזור) לאחר תוספת של כל שכבת ניהול, כדי להבטיח אטימה טובה בין שכבות.
- חזור על שלבים 1.2 ו1.3 לשכבות שנותרו, משאירים את שני העליונה ונייר גרפן שכבות תחתונה. לחתוך לאורך הקו המקווקו מוצג באיור 1b כדי להסיר את הסרט העודף מקצות המכשיר משאירים מרווח מ"מ ~ 1 קטן כדי להבטיח בידוד אטום בין שכבות נייר גרפן (איור 1b).
הערה: קלטת דו צדדית אינה מנוצל כשכבות העליונה ותחתונים, כדי למנוע איסוף פסולת כמבנה מרובד זה היא קדח, רכוב על שקופיות, ומלא במדגם. - לבצע בדיקת בידוד מהירה עם מודד (במצב התנגדות). מקם את הבדיקות החיוביות ושליליות בשני צדדים שונים של המכשיר אלקטרוני (A ו-B באיור 1 ג); עמידות גבוהה (קילו למגה אוהם) מצביעה על בידוד טוב בין שכבות. הסר את המבנה מרובד משקופיות הזכוכית להיערך לקידוח מיקרו היטב.
הערה: מכשיר בדרך כלל לא מצליח במבחן הבידוד כאשר שכבות נייר גרפן סמוכות ליצור קשר במהלך שלבי 1.2 דרך 1.4. בטל מכשירים כאלה.
2. מקדחה מיקרו היטב במבנה רבודה
- השתמש במכונת כרסום מיקרו מכאנית מבוקר מחשב ולבחור טחנת סוף עם מיקרומטר 700 בקוטר 2.1 אורך מ"מ של חתך. לשתק את המבנה רבוד על הבמה כרסום מיקרו באמצעות מהדק מתאים (2a דמויות ו ב). הפעל את כישור מכונת הטחינה ב8,600 סל"ד, ואז להנמיך את טחנת הסוף ללאט ובדרך מרכז המבנה רבוד. הזז את טחנת הסוף מסתובבת מעלה ומטה באמצעות מיקרו היטב כדי להחליק את הקיר הפנימי.
- בחר מיקרו היטבקטרים, שמוגבלים על ידי קוטר / אורך טחנת הסוף זמין של היבט ratios לחתוך. ודא שהמשטח הפנימי של מיקרו גם הוא אנכי ונקי ככל האפשר עבור הדרגתיים שדה חשמלי אופטימלי ומעבר אור דרך מיקרו היטב.
- פסולת נקייה ממייקרו טוב עם אוויר דחוס. בצע בדיקת בידוד אחרת, כמתואר ב1.5.
3. צרף מוביל חשמל למבנה רבודה
- מקפלים את שני 3 סנטימטר 32 חוטי נחושת G ארוכים לזווית נכונה ב2 סנטימטר. מערבבים ~ 1.5 מיליליטר של חלק A ו-B של אפוקסי מוליך הכסף.
הערה: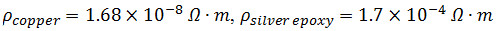
- החלתי באופן ידני אפוקסי כסף מעורב לראש והטיפים מכל 3 שכבות נייר גרפן כדי להבטיח קשר טוב בין שכבות בצד של המבנה רבוד (איור 1 ג'), ואז למקם את קצה חוט נחושת 1 סנטימטר באפוקסי ובין כל שתי שכבות. ברכות מרובעיםueeze השכבות להסיר אפוקסי עודף ולהבטיח מגע חשמלי טוב. חזור על פעולה עבור צד ב 'של המבנה רבוד.
- הנח את המכשיר כולו במדף תנור, לייבוש C למשך לילה 70 מעלות ובכספומט 1.
4. היכונו לדוגמא ומדיה
- הכן תקשורת איזוטוני של ספקטרום של מוליכות באמצעות מד המוליכות, פתרון מניות מניטול 290 מ"מ ותוספות סדרתי של תמיסת מלח חיץ פוספט איזוטוני (PBS).
הערה: קשר לינארי קיים בין ריכוז המוליכות ונפח של ~ 290 mOsm / L-PBS (ניצוח) ב~ 290 פתרון מניטול mOsm / L (שאינו מנהלים). וידאו תכונות מדיום של 0.01 מוליכות S / M. - מערבבים חרוזי פוליסטירן עם תקשורת מוכנה מוליכות או מים דואר טהור (~ 5 x 10 -6 S / M) לכרך 1:50: יחס כרך. פרוטוקול זה הוא להתאמה בקלות לתאים ביולוגיים גם כן.
5. ניסוי ההתקנה ולהפעיל מכשיר
- הצמד את מכשיר on כדי שקופיות זכוכית עם לחץ מתון (איור 2) באמצעות מהדק נייר שונה או שווה ערך. Footings צריך להיות קרוב מספיק למייקרו גם לאטום את המבנה מרובד לשקופית זכוכית מניעת דליפת מדגם. המהדק צריך להתאים בתוך הבמה מיקרוסקופ עם לחץ מותאם ל) למנוע עיוות של המבנה מרובד, ב) להבטיח מיקרו גם הנוזל לא ידלוף. עיוות משנה את הגיאומטריה וגם נתיב אור צמצום שחזור ניסוי.
- באמצעות מזרק או שווה ערך מיקרו, להזריק לאט ~ μl 1 של המדגם למייקרו היטב ולהימנע מהחדרה כל בועות. חזור על זריקה במידת צורך ולהשתמש בטיפול שלא לפגוע בקירות מיקרו היטב עם המחט החדה. מעט תמלא יותר מדי מיקרו היטב ולהחליק באופן מיידי כיסוי זכוכית מעל מיקרו היטב כדי להסיר את הנוזלים עודפים, למנוע אידוי, ולהבטיח כרכי שחזור עבור כל ניסוי.
הערה: טיפ יהלום glasscutter עובד היטב כדי SCORדואר וסדק מכסה זכוכית לגודל. - Secure microdevice למינציה המוכן לבמה מיקרוסקופ ולצרף את חוטי האלקטרודה מחולל אותות לשני הנחושת מוביל במכשיר. בAxioVision (תוכנת Zeiss), לחץ על כפתור כדי להתחיל את הקלטת המצלמה במצב רכישה רב ממדי. ליזום פונקצית מחולל אותות בפרק זמן קבוע לאחר תחילת הקלטת מצלמת CCD לתעד את תגובות עם ובלי השדה החשמלי מיושם.
הערה: כאן 100 הרץ ל10 תדר MHz עם השיא של אות שיא 15 V יושמו וניסויים נצפו בהגדלה 10x ב1-200 מעל פני השטח שקופיות זכוכית במשך 2 שניות בלי שדה ו ~ 5 דקות עם שדה מוחלים. תמונות שנשמרו באופן דיגיטלי ב1 עד 5 פריימים לשנייה (fps) לניתוח נוסף. - עם השלמת ניסוי, הסר את ההתקן ולפרק את מהדק. לטבול את שני שקופיות הזכוכית והמכשיר במים וסבון, ולאחר מכן לשטוף היטב. התקני שימוש חוזר על 30 זמןים עם ביצועים עקביים.
6. ניתוח נתונים ועיבוד תמונה
- לנתח את נתוני תמונה עם תוכנה מועדפת, כגון ImageJ. חישוב מהירות מעקירת החלקיקים בין תמונות רצופות בצעד זמן נתון.
- חישוב עוצמת כוח ושדה DEP ניסיונית המבוססת על מהירות לקמפל מגמות ולהשוות עם התאוריה 29.
- מדד מהירות חלקיקים רדיאלית בגיאומטרית מיקרו גם עולה בקנה אחד עם הצורה של שיפוע השדה החשמלי. מקצה מיקרו גם למרכז, לזהות 8 קווי המתאר קונצנטריים איזואלקטרית (350, 300, ... 50, 0 מיקרומטר), שתוצאתה 7 אזורים.
הערה: הזמן לחלקיקים לעבור את מרחק 50 מיקרומטר שימש לחישוב מהירות. כאשר וריאציות גיאומטריות חייבו אותו, את קווי המתאר איזואלקטרית הותאמו במקצת.
תוצאות
ניסויי dielectrophoretic ב -6 בחרוזי פוליסטירן מיקרומטר נערכו ב0.38 מ"מ 3 מיקרו היטב גלילי. תוצאות מראות כי 3D למינציה מכשיר המבוסס על נייר גרפן יכול להמחיש חתימות dielectrophoretic דומות כמו מכשירי למינציה לסכל 3D מתכת 20, 21, 2D מתכת האלקטרודה מסורתית 26, 27, והתקנים מבודד 2...
Discussion
כתב יד זה מפרט פרוטוקולים לבודת שכבת גרפן רומן 6 ו -5 microdevice שכבת קלטת. יתר על כן, פעולת מכשיר מודגמת באמצעות התנהגויות DEP נצפות של 6.08 מיקרומטר חרוזי פוליסטירן יחד עם גישה ייחודית, רלוונטית גיאומטרי ניתוח מהירות חלקיקים. גישה תכליתית זו כדי לבנות מכשירי electrokinetic קוי היא פ...
Disclosures
יש הסופרים אין קונפליקטים לחשוף.
Acknowledgements
תודה למדעי XG לתרומות נדיבות של נייר גראפן. תודה לד"ר ג פרידריך לנדיבות ומאפשרות לנו להשתמש בציוד קידוח המיקרו. תודה מיוחדת מורחבת Tayloria אדמס למספרת הווידאו.
Materials
| Name | Company | Catalog Number | Comments |
| Polystyrene Beads | Spherotech, Inc. | PP-60-10 | 6.08 μm diameter |
| Graphene paper | XG Sciences, Inc. | XG Leaf B-072 | |
| Double sided tape | 3M | N/A | 136 office tape |
| Silver conductive epoxy | MG chemicals | 8331-14G | Part A & B included |
| Mannitol | Sigma Aldrich | 091M0020V | |
| Phosphate buffer saline | OmniPur | 0381C490 | |
| Microscope (CCD Camera) | Zeiss | Axiovert 200M | |
| Function/waveform generator | Agilent | 33250A | |
| Syringe | Hamilton | 84505 | |
| Paper Clamp | ADAMS | 3300-50-3848 | |
| Oven | Fisher Scientific | 280A | |
| Multimeter | OMEGA | HHM25 | |
| Micro-milling machine | AEROTECH | ABL1500 stages/A3200 Npaq controller | |
| End mill | ULTRATOOL | 708473 | |
| AxioVision | Zeiss | Version 4.8 |
References
- Geim, A. K., Novoselov, K. S. The rise of graphene. Nature Materials. 6 (3), 183-191 (2007).
- Jafri, R. I., Rajalakshmi, N., Ramaprabhu, S. Nitrogen doped graphene nanoplatelets as catalyst support for oxygen reduction reaction in proton exchange membrane fuel cell. Journal of Materials Chemistry. 20 (34), 7114-7117 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Graphene Nanoplatelets Outperforming Platinum as the Electrocatalyst in Co-Bipyridine-Mediated Dye-Sensitized Solar Cells. Nano Letters. 11 (12), 5501-5506 (2011).
- Aravind, S. S. J., Baby, A. T. T., Arockiadoss, T., Rakhi, R. B., Ramaprabhu, S. A cholesterol biosensor based on gold nanoparticles decorated functionalized graphene nanoplatelets. Thin Solid Films. 519 (16), 5667-5672 (2011).
- Si, P., Ding, S. J., Lou, X. W., Kim, D. H. An electrochemically formed three-dimensional structure of polypyrrole/graphene nanoplatelets for high-performance supercapacitors. Rsc Advances. 1 (7), 1271-1278 (2011).
- Wang, D. -. W., et al. Fabrication of Graphene/Polyaniline Composite Paper via In Situ Anodic Electropolymerization for High-Performance Flexible Electrode. ACS Nano. 3 (7), 1745-1752 (2009).
- Lee, J. K., Smith, K. B., Hayner, C. M., Kung, H. H. Silicon nanoparticles-graphene paper composites for Li ion battery anodes. Chem Commun (Camb). 46 (12), 2025-2027 (2010).
- Kavan, L., Yum, J. H., Gratzel, M. Optically Transparent Cathode for Dye-Sensitized Solar Cells Based on Graphene Nanoplatelets. ACS Nano. 5 (1), 165-172 (2011).
- Martinez-Duarte, R. Microfabrication technologies in dielectrophoresis applications--a review. Electrophoresis. 33 (21), 3110-3132 (2012).
- Yamamoto, M., et al. Patterning with particles using three-dimensional interdigitated array electrodes with negative dielectrophoresis and its application to simple immunosensing. Electrochimica Acta. 82, 35-42 (2012).
- Doh, I., Kim, Y., Cho, Y. H. A particle trapping chip using the wide and uniform slit formed by a deformable membrane with air bubble plugs. Current Applied Physics. 13 (5), 902-906 (2013).
- Lin, S. C., Lu, J. C., Sung, Y. L., Lin, C. T., Tung, Y. C. A low sample volume particle separation device with electrokinetic pumping based on circular travelling-wave electroosmosis. Lab on a Chip. 13 (15), 3082-3089 (2013).
- Martinez-Duarte, R., Camacho-Alanis, F., Renaud, P., Ros, A. Dielectrophoresis of lambda-DNA using 3D carbon electrodes. Electrophoresis. 34 (7), 1113-1122 (2013).
- Yang, S. M., Tseng, S. Y., Chen, H. P., Hsu, L., Liu, C. H. Cell patterning via diffraction-induced optoelectronic dielectrophoresis force on an organic photoconductive chip. Lab on a Chip. 13 (19), 3893-3902 (2013).
- Srivastava, S. K., Gencoglu, A., Minerick, A. R. DC insulator dielectrophoretic applications in microdevice technology: a review. Anal Bioanal Chem. 399 (1), 301-321 (2011).
- Liao, S. H., Cheng, I. F., Chang, H. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 1-4 (2012).
- Bajaj, P., Marchwiany, D., Duarte, C., Bashir, R. Patterned three-dimensional encapsulation of embryonic stem cells using dielectrophoresis and stereolithography. Adv Healthc Mater. 2 (3), 450-458 (2013).
- Braff, W. A., Pignier, A., Buie, C. R. High sensitivity three-dimensional insulator-based dielectrophoresis. Lab Chip. 12 (7), 1327-1331 (2012).
- Martinez-Duarte, R., Gorkin 3rd, R. A., Abi-Samra, K., Madou, M. J. The integration of 3D carbon-electrode dielectrophoresis on a CD-like centrifugal microfluidic platform. Lab Chip. 10 (8), 1030-1043 (2010).
- Fatoyinbo, H. O., Kamchis, D., Whattingham, R., Ogin, S. L., Hughes, M. P. A high-throughput 3-D composite dielectrophoretic separator. Ieee Transactions on Biomedical Engineering. 52 (7), 1347-1349 (2005).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. Iee Proceedings-Nanobiotechnology. 152 (4), 150-154 (2005).
- Abdul Razak, M. A., Hoettges, K. F., Fatoyinbo, H. O., Labeed, F. H., Hughes, M. P. Efficient dielectrophoretic cell enrichment using a dielectrophoresis-well based system. Biomicrofluidics. 7 (6), (2013).
- Hughes, M. P. . O. S., Hoettges, K. F., Wattingham, R. . Device for Dielectrophoretic Manipulation of Particles. , (2005).
- Heldt, C. L., et al. Stacked graphene nanoplatelet paper sensor for protein detection. . Sensors and Actuators B-Chemica. 181, 92-98 (2013).
- Srivastava, S. K., Artemiou, A., Minerick, A. R. Direct current insulator-based dielectrophoretic characterization of erythrocytes: ABO-Rh human blood typing. Electrophoresis. 32 (18), 2530-2540 (2011).
- Leonard, K. M., Minerick, A. R. Explorations of ABO-Rh antigen expressions on erythrocyte dielectrophoresis: Changes in cross-over frequency. Electrophoresis. 32 (18), 2512-2522 (2011).
- Srivastava, S. K., Daggolu, P. R., Burgess, S. C., Minerick, A. R. Dielectrophoretic characterization of erythrocytes: Positive ABO blood types. Electrophoresis. 29 (24), 5033-5046 (2008).
- Minerick, A. R. The rapidly growing field of micro and nanotechnology to measure living cells. AIChE Journal. 54 (9), 2230-2237 (2008).
- Garza-Garcia, L. D., Perez-Gonzalez, V. H., Perez-Sanchez, O. A., Lapizco-Encinas, B. H. Electrokinetic Mobilities Characterization and Rapid Detection of Microorganisms in Glass Microchannels. Chemical Engineering & Technology. 34 (3), 371-378 (2011).
- Lopez-de la Fuente, M. S., et al. An electric stimulation system for electrokinetic particle manipulation in microfluidic devices. Rev Sci Instrum. 84 (3), (2013).
- Chen, D. F., Du, H., Li, W. H. A 3D paired microelectrode array for accumulation and separation of microparticles. Journal of Micromechanics and Microengineering. 16 (7), 1162-1169 (2006).
- Chu, H., Doh, I., Cho, Y. H. A three-dimensional (3D) particle focusing channel using the positive dielectrophoresis (pDEP) guided by a dielectric structure between two planar electrodes. Lab on a Chip. 9 (5), 686-691 (2009).
- Millet, L. J., Park, K., Watkins, N. N., Hsia, K. J., Bashir, R. Separating beads and cells in multi-channel microfluidic devices using dielectrophoresis and laminar flow. J Vis Exp. , (2011).
- Weiss, N. G., et al. Dielectrophoretic mobility determination in DC insulator-based dielectrophoresis. Electrophoresis. 32 (17), 2292-2297 (2011).
- Auerswald, J., Knapp, H. F. Quantitative assessment of dielectrophoresis as a micro fluidic retention and separation technique for beads and human blood erythrocytes. Microelectronic Engineering. 67-8, 879-886 (2003).
- Park, S., Zhang, Y., Wang, T. H., Yang, S. Continuous dielectrophoretic bacterial separation and concentration from physiological media of high conductivity. Lab on a Chip. 11 (17), 2893-2900 (2011).
- Sun, T., Holmes, D., Gawad, S., Green, N. G., Morgan, H. High speed multi-frequency impedance analysis of single particles in a microfluidic cytometer using maximum length sequences. Lab on a Chip. 7 (8), 1034-1040 (2007).
- Hughes, M. P., Morgan, H. Dielectrophoretic Characterization and Separation of Antibody-Coated Submicrometer Latex Spheres. Analytical Chemistry. 71 (16), 3441-3445 (1999).
- Liang, W. F., et al. Simultaneous separation and concentration of micro- and nano-particles by optically induced electrokinetics. Sensors and Actuators a-Physical. 193, 103-111 (2013).
- White, C. M., Holland, L. A., Famouri, P. Application of capillary electrophoresis to predict crossover frequency of polystyrene particles in dielectrophoresis. Electrophoresis. 31 (15), 2664-2671 (2010).
- Wu, J., Ben, Y. X., Battigelli, D., Chang, H. C. Long-range AC electroosmotic trapping and detection of bioparticles. Industrial & Engineering Chemistry Research. 44 (8), 2815-2822 (2005).
- Zhou, H., White, L. R., Tilton, R. D. Lateral separation of colloids or cells by dielectrophoresis augmented by AC electroosmosis. J Colloid Interface Sci. 285 (1), 179-191 (2005).
- Green, N. G., Ramos, A., Gonzalez, A., Morgan, H., Castellanos, A. Fluid flow induced by nonuniform ac electric fields in electrolytes on microelectrodes I. Experimental measurements. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 61 (4 Pt B), 4011-4018 (2000).
- Green, N. G., Ramos, A., Gonzalez, A., Castellanos, A., Morgan, H. Electrothermally induced fluid flow on microelectrodes. Journal of Electrostatics. 53 (2), 71-87 (2001).
- Gonzalez, A., Ramos, A., Morgan, H., Green, N. G., Castellanos, A. Electrothermal flows generated by alternating and rotating electric fields in microsystems. Journal of Fluid Mechanics. 564, 415-433 (2006).
- Park, S., Koklu, M., Beskok, A. Particle trapping in high-conductivity media with electrothermally enhanced negative dielectrophoresis. Anal Chem. 81 (6), 2303-2310 (2009).
- Sin, M. L., Gau, V., Liao, J. C., Wong, P. K. Electrothermal Fluid Manipulation of High-Conductivity Samples for Laboratory Automation Applications. JALA Charlottesv Va. 15 (6), 426-432 (2010).
- Liao, S. -. H., Cheng, I. F., Chang, H. -. C. Precisely sized separation of multiple particles based on the dielectrophoresis gradient in the z-direction. Microfluidics and Nanofluidics. 12 (1-4), 201-211 (2012).
- Gencoglu, A., Minerick, A. Chemical and morphological changes on platinum microelectrode surfaces in AC and DC fields with biological buffer solutions. Lab on a Chip. 9 (13), 1866-1873 (2009).
- Bocchi, M., et al. Dielectrophoretic trapping in microwells for manipulation of single cells and small aggregates of particles. Biosensors & Bioelectronics. 24 (5), 1177-1183 (2009).
- Li, P., Stratton, Z. S., Dao, M., Ritz, J., Huang, T. J. Probing circulating tumor cells in microfluidics. Lab on a Chip. , (2013).
- Rimmele, T., Kellum, J. A. Clinical review: Blood purification for sepsis. Critical Care. 15 (1), (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved