A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניצול לשכות Galvanotaxis המעוצב מותאמות אישית לחקר כיוונית נדידה של תאי ערמונית
In This Article
Summary
We present a method to apply a physiological electric field to migrating, immortalized prostate cells in a custom-made galvanotaxis chamber. Using this method, we demonstrate that 2 lines of non-tumorigenic prostate cells demonstrate different degrees of migration directionality in the field.
Abstract
השדה החשמלי הפיזיולוגי משרת פונקציות ביולוגיות ספציפיות, כגון בימוי נדידת תאים בפיתוח עובר, תולדה עצבית וריפוי פצע אפיתל. הפעלת שדה חשמלי של זרם ישיר לתאים בתרבית במבחנה גורמת הגירה כיוונית תא, או galvanotaxis. שיטת galvanotaxis 2-ממדית אנחנו מדגימים כאן היא שונה עם פולי מחוייט (ויניל כלוריד) (PVC) תאים, משטח זכוכית, אלקטרודות פלטינה והשימוש בבמה ממונעת שבו התאים הם צילמו. תאי PVC ואלקטרודות פלטינה להציג cytotoxicity נמוך והם סבירים ומחדש שמישים. משטח הזכוכית והבמה מיקרוסקופ הממונעת לשפר את האיכות של תמונות ומאפשרים שינויים אפשריים למשטח הזכוכית וטיפולים לתאים. אנחנו צילמנו את galvanotaxis של שני קווים שאינם סרטניים-הונצח SV40 ערמונית תא, pRNS-1-1 וPNT2. שתי שורות תאים אלה מראות מהירויות הגירה דומות ושניהם נודדים לעברהקתודה, אבל הם עושים להראות במידה שונה של יווניות בgalvanotaxis. התוצאות שהתקבלו באמצעות פרוטוקול זה מצביעים על כך שpRNS-1-1 ושורות תאי PNT2 עשוי להיות מאפיינים מהותיים שונים המסדירים תגובות הנדידה כיוונית שלהם.
Introduction
שדות חשמליים אנדוגני מתגלים ברקמות שונות, כגון עור 1, 32, 33 ומוח 2. השדה החשמלי הפיזיולוגי משרת פונקציות ביולוגיות ספציפיות, כוללים פיתוח בימוי עובר 3, 4, המנחה את תולדה של תהליכים עצביים 5, 6 וקידום סגירת אפיתל קרני ופצע 1, 7. במבחנה, יישום של שדה חשמלי נוכחי ישיר לתאים בתרבית מחקה את השדה החשמלי הפיזיולוגי וגורם הגירה כיוונית תא, או galvanotaxis. Galvanotaxis נחקר בfibroblasts 8, קרטינוציטים דגים 9, אפיתל אדם וקרטינוציטים קרנית 10-12, לימפוציטים מסוג 13, neuroblasts 2, ובתאים עצביים 14. כאשר נחשפו לשדה המופעל, רוב התאים למדו להעביר directionally כלפי cathodal (-) הקוטב. ובכל זאת, כמה תאי סרטן, כוללים מאוד גרורתיתאי סרטן השד אנושיים ושורת תאי סרטן הערמונית האנושית PC-3M, לעבור לanodal (+) קוטב 15, 16. מספר מנגנונים מוצעים לתווך galvanotaxis או להסביר את היכולת של התאים לחוש את השדה החשמלי, כולל הפעלה של EGF קולטני 12, ערוץ נתרן אפיתל 17, PI3K וPTEN 18, ושחרורו של סידן יונים 15, 19. המנגנון הוא עדיין לא הבין באופן מלא וזה אפשרי, כי מסלולי איתות מרובים מעורבים בgalvanotaxis.
שיטת galvanotaxis 2-ממדית אנחנו מדגימים כאן היא שימושית כדי לאפיין את ההגירה כיוונית של חסיד, תאי ניעתי, או כדי לפקח על הגירת תאים בודדת 10, 12, 17 או הגירה של גיליון של תאים ומחוברות 18, 20. טכניקה זו שונה מ פנג והיפה 21, וNishimura et al. 10 עם, תאי PVC ברורים מחוייט, עם coversl הנשלףשב"ס מאפשר לאחזור תא קל לאחר galvanotaxis לניתוח משני, כגון הדמיה חיסונית הקרינה. משטח הזכוכית של תאי galvanotaxis הוא אופטי תואם, המאפשר לצלם בהגדלה גבוהה ועם תאי fluorescently שכותרתו. זה גם מאפשר עיצוב ניסיוני עם שינוי של משטח הזכוכית, כגון שינוי ציפוי פני השטח או חיובים. מפרידי עשויים מס '1 coverglass משמשים בתאי כדי למזער את הזרימה הנוכחית על התאים; לכן חימום ג'אול, שהוא פרופורציונאלי לריבוע של הזרימה הנוכחית, לא לחמם יותר מדי את התאים במהלך הניסוי. הגשרים אגר החיבור למנוע מגע ישיר של אלקטרודות עם התאים ולמנוע שינוי של pH הבינוני או ריכוז יון בgalvanotaxis.
שתי שורות תאי ערמונית אנושית שאינם סרטניות נבדקו לתגובת galvanotaxis במחקר זה. PRNS-1-1 22 וPNT2 23 שניהם SV40-הונצחו, שורות תאי גורם תלוי צמיחה המבטאות את סמני אפיתל cytokeratin 5, 8, 18 ו -19 עם ביטוי נמוך או לא של אנטיגן הספציפי לערמונית (PSA). שני שורות התאים לשמור על מורפולוגיה המצולעים של תאי האפיתל נורמלים, אבל הנורמליות של כרומוזום נצפתה בkaryotyping 22, 24. למרות שpRNS-1-1 וPNT2 לשתף התנהגויות דומות ברוב הניסויים, הם עושים להראות הבדלים במבנה של מבנה acinar וב galvanotaxis. על מטריצת 3-D, Matrigel, pRNS-1-1 תאים ליצור מבני acinar חלולים עם לומן הדומה לרקמת בלוטת הערמונית הרגילה 25. עם זאת, תאי PNT2 יוצרים spheroids המוצק ללא לומן או אפיתל המקוטב 26. תאי pRNS-1-1 גם להפגין תגובת galvanotactic גבוהה מPNT2 במחקר הנוכחי. המתאם בין ההיווצרות של מבנה acinar וgalvanotaxis בpRNS-1-1 מצביע על כך שאותות galvanotactic עשויים לשחק תפקיד בארגון יחסי הציבורתנועות ostate בלוטת רקמה בתגובה לשדות חשמליים אנדוגני, ומספקת מאפיינים נוספים להפלות בין 2 שורות תאים אלה.
Protocol
1. תאי culturing ערמונית
- תרבות pRNS-1-1 וערמונית PNT2 תאים על 100 מנות תרבות מ"מ במדיום RPMI 1640 בתוספת 10% FBS ואנטיביוטיקת antimycotic על 37 מעלות צלזיוס עם 5% CO 2. רענן מדיום התרבות בכל יום עד שהתאים מגיעים 80% confluency לניסויי galvanotaxis.
2. צ'יימברס Galvanotaxis הרכבה
- הרכבת תאים תחתון
- נגב קאמרי galvanotaxis פלסטיק עם 2-propanol. החל אוטם סיליקון הכיתה הימי סביב הפתחים עגולים בצד התחתון של קאמרי עם מזרק ולצרף coverglass גדול (איור 1). השתמש בצד האחורי של המוליך כותנה לדחוף את coverglass ולנגב את הדבק העודף עם צמר גפן. הפתחים עגולים יאפשר בינוני והזרם חשמלי לזרום על התאים הממוקמים בין שני המאגרים בינוניים הפנימיים.
- חותך coverglass קטן כדי להפוך את 6 מ"מ x 25 מפרידי מ"מ עם סמן נקודת יהלומים.
- הפוך את התא. החל 2 פסים של דבק סיליקון עם מזרק ו / או מרית מתכת, כדי ליצור משטח ערוץ x 25 מ"מ 10 מ"מ לקובץ מצורף תא בין 2 הפתחים עגולים על הזכוכית התחתונה. דבק 2 חתיכות של spacer זכוכית בין 2 הפתחים עגולים. השתמש בצד האחורי של החלת מהכותנה לדחוף את מפרידי ולנגב את הדבק העודף עם צמר גפן ו / או קיסמים.
- ייבש את התא למשך 24 שעות עד שדבק סיליקון הוא נרפא. משרים את התא בלילה מים מזוקק כדי להסיר את שאריות חומצה אצטית מהדבק. ייבש את התא לשימוש מיידי, או לאחסן את התא לשימוש מאוחר יותר במכל נקי.
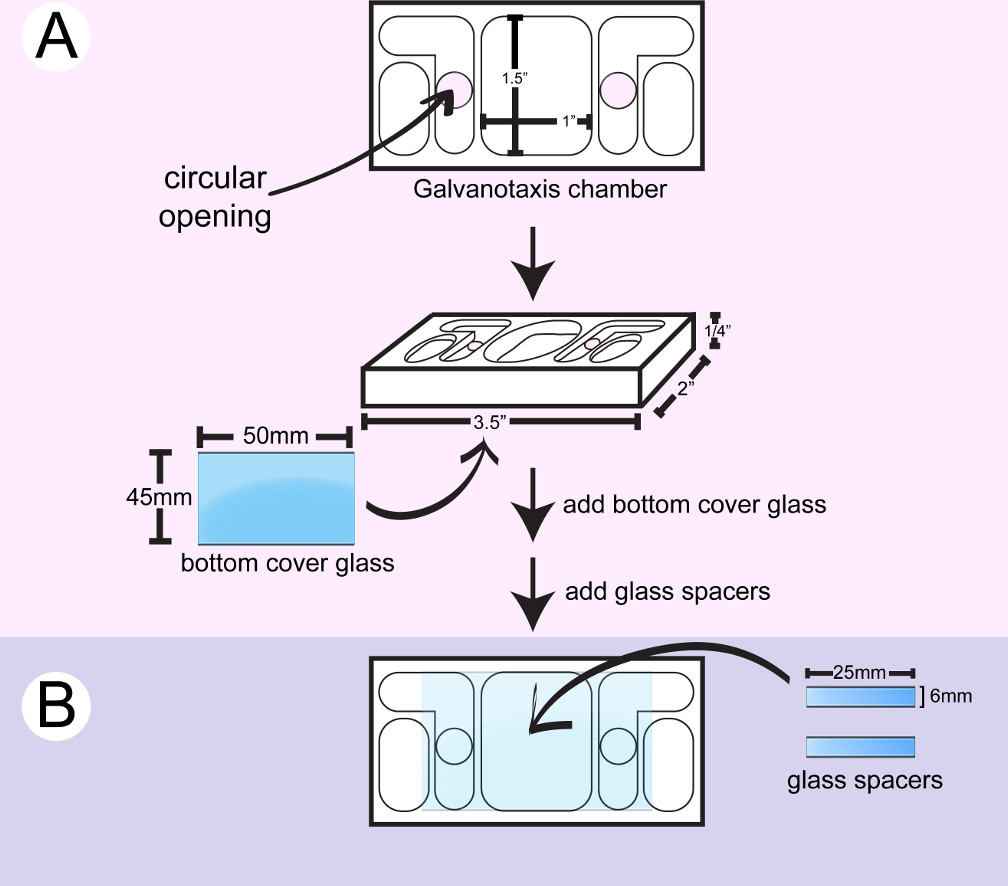
איור 1: עצרת של תא galvanotaxis התחתון. ) Coverglass גדול מחובר לחלק התחתון של חדר נקי. B) Tוו חתיכות של מפרידי זכוכית מודבקות בין 2 הפתחים עגולים כדי ליצור x 25 מ"מ ערוץ 10 מ"מ לתאים לצרף.
- זריעת תאים בתאי galvanotaxis
- הכן את מספרם של התאים דורשים galvanotaxis הדרושים לניסוי. שורת תאים כל טיפול או דורשת קאמרית galvanotaxis יחיד. נגב את תאי galvanotaxis עם 2-propanol. לשטוף את התאים עם PBS 3 פעמים סטריליים ולבדוק את זרימת הנוזל בין 2 הפתחים עגולים בתאי.
- הקף את התאים בצלחות תרבית תאים סטריליים ולאפשר להם לאזן על 37 מעלות צלזיוס למשך 15 דקות. לנתק את תאי ערמונית ממנת התרבות שלהם באמצעות 5 מיליליטר 0.25% טריפסין-EDTA על 37 מעלות צלזיוס למשך 5 דקות. לנטרל את טריפסין-EDTA עם FBS 5 מיליליטר של 10% בPBS.
- להעביר את תאי 15 מיליליטר צינורות וצנטריפוגה התאים למשך 5 דקות ב 200 XG, 37 ° C. לשאוב supernatant מחדש להשעות את התאים ב 1 מיליליטר של מדיום התרבות.
- קח 20 μl של פתרון תא לטעון לחדר ספירה ולחשב את מספר התא. התאם את ריכוז התא עד 8 x 10 4 תאים / מיליליטר עם מדיום התרבות.
- קח את תאי galvanotaxis מתוך 37 ° C החממה. זרעי 350 μl של ההשעיה התא אל תא אחד.
- דגירה התאים בתאי הלילה בצלחת התרבות עם Kimwipe הרטוב או בתא לחות בחממה על 37 מעלות צלזיוס עם 5% CO 2.
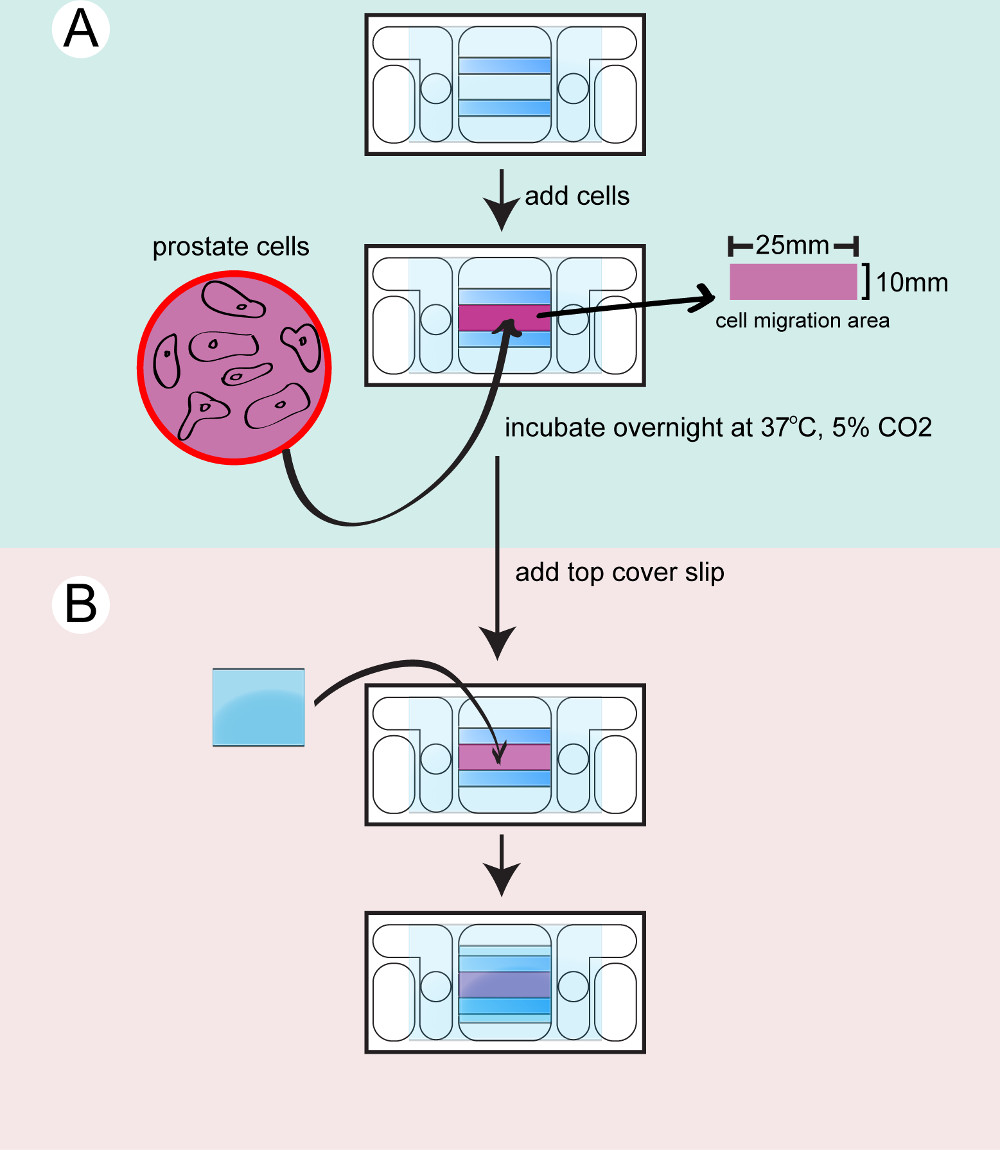
איור 2:. מתזמן את התאים לתא התא התחתון הוא מיובש וניקה תאי ערמונית) הם trypsinized, נספרו ומועברים לתא וטופחו לילה B) coverglass עליון מחובר ללאטום את החדר לפני צילומים...
- ssembling תאים העליונים
- להרכיב את התא העליון לפני צילומים. מיקרוסקופ יכול להכיל רק הדמיה קאמרית galvanotaxis אחת בכל פעם. להתחמם 10 מיליליטר של מדיום התרבות ב 37 מעלות צלזיוס במשך כל תא galvanotaxis. העבר את תא galvanotaxis מהחממות לצלחת התחממות 37 ° C.
- יש לשטוף את התאים עם מדיום התרבות להסיר את התאים הפנויים. השאר 400 μl של מדיום בתא. השתמש במזרק ללמרוח משחה ואקום גבוהה על גבי שני מפרידי הזכוכית.
- הוסף coverglass קטן לאטום את החדר. לחץ בעדינות במורד coverglass עם הצד האחורי של המוליך כותנה. נגב את המדיום העודף עם צמר גפן.
- ייבש את משטח הזכוכית ולמרוח משחה ואקום גבוהה כדי לאטום את הפער בין coverglass והקאמרי. השתמש במרית מתכת כדי להפיץ את השומן. הוסף 4 מיליליטר של מדיום התרבות למאגרים הפנימיים ולבדוק את זרימת הנוזל בין המאגרים.
- הפוך אגרגשרים
- חותך זוג צינורות PVC הארוך 2 אינץ '(503/16 ID x 5/16 OD x 1/16 כותל), להפוך ולהכניס אותם לתוך כוס מיליליטר 100.
- למדוד 200 מ"ג Bacto-אגר ולהוסיף אותו בבקבוק 50 מיליליטר עם מדיום תרבות 10 מיליליטר כדי להפוך 2% ג'ל אגר. מיקרוגל למשך 30 שניות. טען את הג'ל אגר לצינורות פלסטיק עם pipet העברה. השאר את אגר גשרים בטמפרטורת חדר למשך 10 דקות כדי לחזק את אגר.
- הוסף בינוני תרבות 2 מיליליטר למאגרים החיצוניים של תא galvanotaxis. הכנס את אגר גשרים למאגרים בינוניים הפנימיים וחיצוניים לנהל הנוכחי.
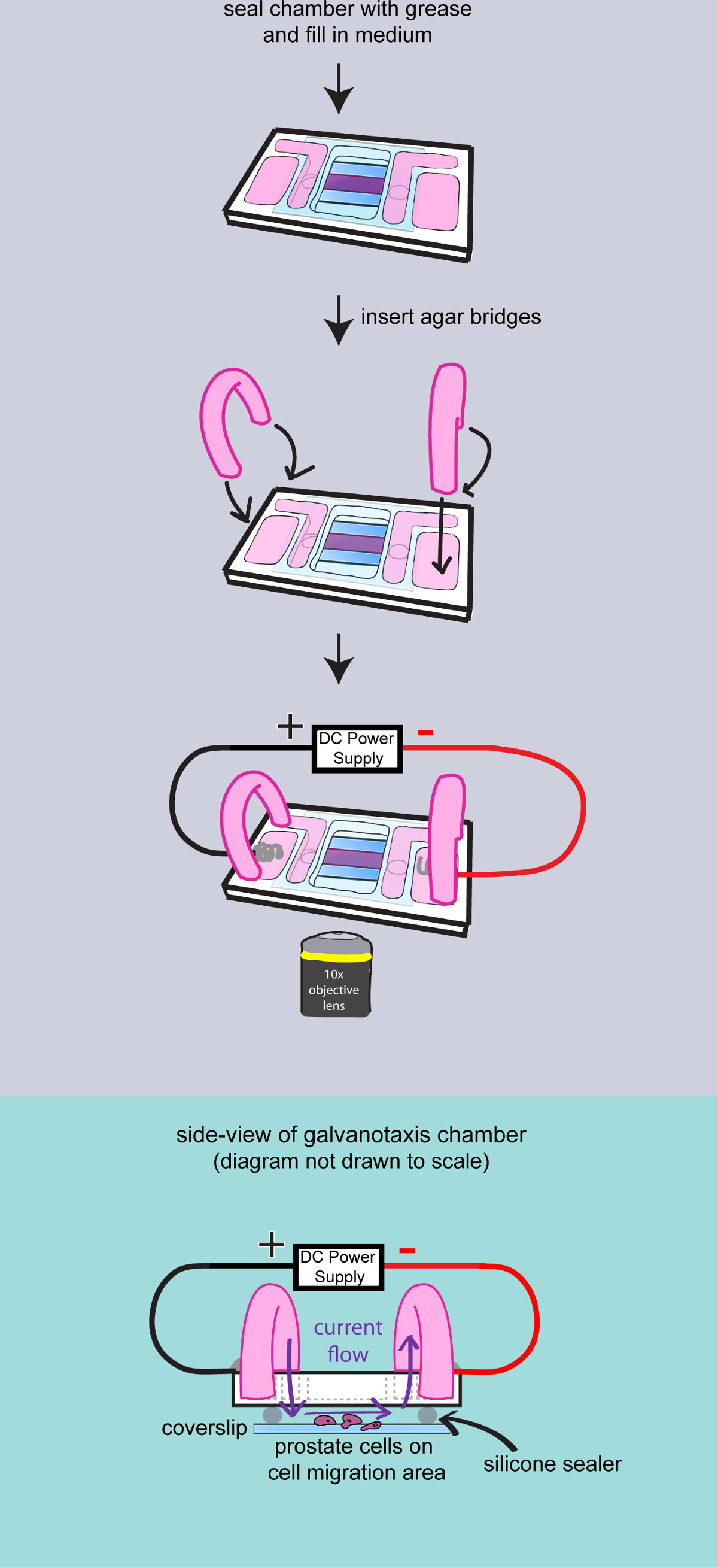
איור 3:. צילומי התאים בתא תרשים כדי להדגים את ההרכבה הסופית של חדר galvanotaxis. התא אטום לחלוטין עם גריז ואקום גבוה. בינוני מתווסף to למלא את המאגרים, ושני גשרים אגר מוכנסים לתוך התא. אז קאמרי galvanotaxis מועבר לבמה מיקרוסקופ ואלקטרודות מחוברות ליישם השדה החשמלי. צדתי להציג של חדר galvanotaxis התאסף מוצג על מנת להוכיח כי הזרם החשמלי זורם על התאים באמצעות הגשרים אגר והרווח בין הזכוכית המכסה.
הדמיה 3. זמן לשגות
- הפעל את התא הסביבתי על 37 מעלות צלזיוס עם 5% CO 2 בשעת האוויר במחזור 2 לפני ההדמיה.
- לעבור על המיקרוסקופ וליזום את תוכנת רכישת התמונה. כייל את הבמה מיקרוסקופ ובחר את מטרת 10X.
- העבר את תאי galvanotaxis לבמה מיקרוסקופ, לאבטח את החדר עם קלטת ולהתמקד בתאים. הכנס את האלקטרודות galvanotaxis למאגרים החיצוניים עם קתודה בצד ימין. לאבטח את החוט ואלקטרודות עם קלטת.
- הפעל את bo הכחx ליישם שדה חשמלי לתא. מדוד את מתח הפלט עם מד המתח על פני התא להגיע 2.5 וולט לתא 25 מ"מ הארוך (100 mV / מ"מ). לשמור על עוצמת השדה במהלך הניסוי על ידי התאמת התפוקה הנוכחית.
- בחר 10 נקודות על פני התא לצלם בתוכנה כדי ליצור עשרה זמן לשגות סרטים. להגדיר את תנאי רכישה במרווחים של 10 דקות לשעה 2.
- התחל צילומים ולהתאים את התפוקה הנוכחית במידת הצורך.
- בסופו של הניסוי, להסיר את התא מהבמה ולתקן את התאים עם אלכוהול 95%. לפרוץ את החדר עם סכין גילוח לנקות מחדש להשתמש בו.
4. כימות Galvanotaxis
- סובב את הזמן לשגות הסרטים ורי-אוריינט הקתודה לחלק העליון של התמונות. לייצא את הסרטים לתוכנת המעקב הסלולרי.
- באופן ידני לעקוב (x, y) העמדה של 10-20 תאים בכל נקודת זמן מכל סרט (4 איור, B).מרחקי ההגירה והזוויות ביחס לכיוון צפון-דרום, באותו הכיוון של השדה החשמלי, יחושבו בתוכנת מעקב תא (איור 4C).
הערה: מהירות ההגירה הממוצעת מומרת ממרחק ההגירה הכולל וכולל זמן צילומים. כיווניות מומרת מהזוויות לערך קוסינוס. אם תאים לנדוד עם יווניות אקראיות, הממוצע של קוסינוס נטו יהיה קרוב לאפס. אם התאים להעביר ישירות לכיוון הקתודה, ערך קוסינוס יהיה +1. אם התאים להעביר ישירות לכיוון האנודה, ערך קוסינוס יהיה -1.
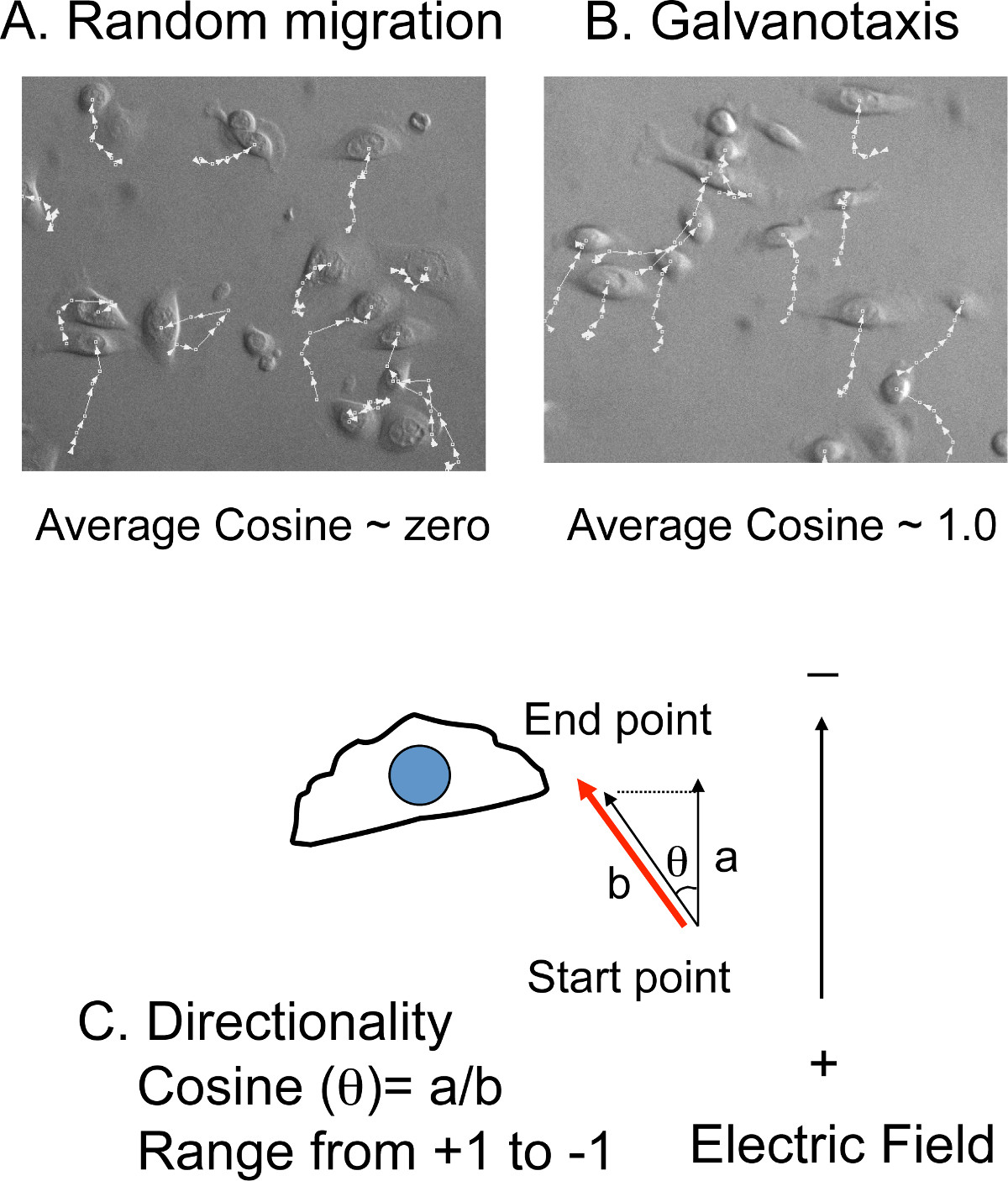
איור 4: מעקב סלולארי למדוד יווניות) כיסוי של קווי מעקב עם תמונות תא.. העמדות (x, y) של התאים manuaמעקב lly בזמן לשגות הסרטים. . אם התאים לנדוד באופן אקראי, קוסינוס הממוצע הוא קרוב לאפס B) עם זאת, אם התאים נודדים לעבר הקתודה או האנודה, הערך של קוסינוס הממוצע הוא קרוב ל+ (קתודה) או -. (האנודה) 1.0 C ) כיווניות מוצגות על ידי ערך קוסינוס, אשר מומר מזוויות ההגירה (θ). קוסינוס (θ) שווה את היחס של המרחק (מרחק הגירה) לb מרחק (המרחק המוקרן לכיוון השדה החשמלי).
- שמור את המדידות. לייבא את הנתונים ליישום מסד נתונים כדי לחשב את התוצאות המשולבות.
- לייצא את הנתונים בשילוב של מהירות הגירה ממוצעת וערך קוסינוס הממוצע לגיליון אלקטרוני כדי לתכנן את הגרפים בר (איור 5).
תוצאות
שתי שורות של תאי ערמונית (pRNS-1-1 וPNT2) נחקרו בשיטה זו. תאים בשני הקווים להעביר במהירויות דומות של 1.0 +/- 0.3 מיקרון / min במהלך 2 שעות (איור 5 א). עם זאת, כיווניות לשדה החשמלי היא 0.7 +/- 0.3 לpRNS-1-1 הקו, ו -0.2 +/- 0.8 לקו PNT2 (איור 5). התוצאות מראות הבדל משמעותי בgalvanotaxis של שתי ש...
Discussion
הניתוח של תגובת galvanotaxis של תא היה חיווי פונקציונלי חשוב עבור רבים נודדים או צמיחה סלולריות מעבד 27, 28. כאן אנו משתמשים קאמריים מחוייט עם משטח זכוכית לצלם את שתי שורות תאי ערמונית. שורות תאים אלה הפגינו דרגות שונות של galvanotaxis, ואנחנו משערים כי הלוקליזציה תאית או ההפ?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
שורות תאי ערמונית ניתנות באדיבות על ידי ד"ר לינג-יו וואנג וינג אי-ד"ר Jien קונג במרכז לחקר הסרטן, UC Davis. פרויקט זה נתמך על ידי מענק galvanotaxis NIH 4R33AI080604.
Materials
| Name | Company | Catalog Number | Comments |
| Cells | |||
| pRNS-1-1 prostate cells | Lee, et al. (1994) | ||
| PNT2 prostate cells | Sigma-Aldrich | 95012613-1VL | Berthon, et al. (1995) |
| Medium and solutions | |||
| RPMI 1640 medium | Invitrogen | 11875-093 | warm up to 37 °C before use |
| Fetal Bovine Serum - Premium | Atlanta Biologicals | S11150 | 10% in PBS, warm up to 37 °C before use |
| Antibiotic-Antimycotic (100x) | Life Technologies | 15240 | add 5 ml to 500 ml medium |
| 2-propanol | VWR | BDH1133-5GL | |
| PBS | - | - | 137 mM NaCl, 2.7 mM KCl, 4.3 mM Na2HPO4 and 1.5 mM KH2PO4 in 1,000 ml of H2O, pH to 7.4 and autoclaved, warm up to 37 °C before use |
| 0.25% Trypsin-EDTA | Invitrogen | 25200-056 | warm up to 37 °C before use, treat cells for 3-5 min at 37 °C |
| Galvanotaxis device | |||
| Galvanotaxis chambers | Precision Plastics Inc, CA | Custom-designed (1/4" x 2" x 3.5"), non-toxic, clear PVC chambers. Please contact the authors for the design specs. | |
| Galvanotaxis electrodes | UCD electric shop | platinum coiled electrodes with flexable cords | |
| Galvanotaxis power box | Substrate Engineering, CA | custom-designed DC power output with voltmeter | |
| Microscope Cover Glass, Large, 45 x 50 mm, No. 1.5 | Fisher | 12-544-F | |
| Microscope Cover Glass, small, 25 x 25 mm, No. 1 | ThermoScientific | 3307 | |
| Diamond point marker | ThermoScientific | 750 | |
| Marine grade silicon sealer, clear | 3M | 051135-08019 | |
| High vacuum grease | Dow Corning | 2021846-0807 | |
| 6 ml syringe | Fisher Scientific | 05-561-64 | |
| Nichiryo Syringe, 1.5 ml | Nichiryo | SG-M | |
| Cotton applicators | Purtian Medical Products | 806-WC | |
| Qtips | Johnson & Johnson | 729389 | |
| Nalgene 180 PVC tubing | Nalgene | 8000-9030 | 503/16 ID x 5/16 OD x 1/16 Wall |
| Bacto-Agar | Difco | 0140-01 | make 2% agar solution |
| Razor Blade | Personna | 74-0001 | |
| Equipments and Software | |||
| Benchtop Centrifuge | Eppendorf | 5810R | operated with an A-4-62 rotor |
| Cellometer Auto T4 | Nexcelom | Auto T4 | |
| Cellometer counting chambers | Nexcelom | CHT4-SD100-002 | load 20 μl cell solutions to count |
| Culture Temp Warming plate | Bel-Art Scienceware | 370150000 | to keep the galvanotaxis chambers at 37 °C |
| Eclipse TE-2000 microscope with motorized stage and environmental chamber | Nikon | ||
| Plan Fluor 10X/0.30 objective len | Nikon | ||
| Retiga EX CCD camera | Qimaging | Cooled CCD camara, mono-color, 12-bit | |
| Compressed air with 5% CO2 | Airgas | special order | |
| Volocity 6.3 | PerkinElmer | Image acquiring software | |
| Improvision OpenLab 5.5.2 | PerkinElmer | Cell tracking software and customized to measure migration angles | |
| FileMaker Pro Advanced, 8.0 | FileMaker | ||
| Microsoft Excel 2008 for Mac | Microsoft | ||
References
- Reid, B., Nuccitelli, R., Zhao, M. Non-invasive measurement of bioelectric currents with a vibrating probe. Nat Protoc. 2 (3), 661-669 (2007).
- Cao, L., et al. Endogenous electric currents might guide rostral migration of neuroblasts. EMBO Rep. 14 (2), 184-190 (2013).
- Hotary, K. B., Robinson, K. R. Endogenous electrical currents and voltage gradients in Xenopus embryos and the consequences of their disruption. Dev Biol. 166 (2), 789-800 (1994).
- Hotary, K. B., Robinson, K. R. Evidence of a role for endogenous electrical fields in chick embryo development. Development. 114 (4), 985-996 (1992).
- Yamashita, M. Electric axon guidance in embryonic retina: galvanotropism revisited. Biochem Biophys Res Commun. 431 (2), 280-283 (2013).
- Wood, M. D., Willits, R. K. Applied electric field enhances DRG neurite growth: influence of stimulation media, surface coating and growth supplements. J Neural Eng. 6 (4), 046003 (2009).
- Kucerova, R., et al. The role of electrical signals in murine corneal wound re-epithelialization. J Cell Physiol. 226 (6), 1544-1553 (2011).
- Sillman, A. L., Quang, D. M., Farboud, B., Fang, K. S., Nuccitelli, R., Isseroff, R. R. Human Dermal fibroblasts do not exhibit directional migration on collagen I in direct-current electric fields of physiological strength. Exp Dermatol. 12 (4), 396-402 (2003).
- Allen, G. M., Mogilner, A., Theriot, J. A. Electrophoresis of cellular membrane components creates the directional cue guiding keratocyte galvanotaxis. Curr Biol. 23 (7), 560-568 (2013).
- Nishimura, K. Y., Isseroff, R. R., Nuccitelli, R. Human keratinocytes migrate to the negative pole in direct current electric fields comparable to those measured in mammalian wounds. J Cell Sci. 109 (1), 199-207 (1996).
- Farboud, B., Nuccitelli, R., Schwab, I. R., Isseroff, R. R. DC electric fields induce rapid directional migration in cultured human corneal epithelial cells. Exp Eye Res. 70 (5), 667-673 (2000).
- Fang, K. S., Ionides, E., Oster, G., Nuccitelli, R., Isseroff, R. R. Epidermal growth factor receptor relocalization and kinase activity are necessary for directional migration of keratinocytes in DC electric fields. J Cell Sci. 112 (12), 1967-1978 (1999).
- Li, J., et al. Activated T lymphocytes migrate toward the cathode of DC electric fields in microfluidic devices. Lab Chip. 11 (7), 1298-1304 (2011).
- Meng, X., Arocena, M., Penninger, J., Gage, F. H., Zhao, M., Song, B. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp Neurol. 227 (1), 210-217 (2011).
- Wu, D., Ma, X., Lin, F. DC Electric Fields Direct Breast Cancer Cell Migration, Induce EGFR Polarization, and Increase the Intracellular Level of Calcium Ions. . Cell Biochem Biophys. 67 (3), 1115-1125 (2013).
- Martin-Granados, C., et al. A role for PP1/NIPP1 in steering migration of human cancer cells. PLoS One. 7 (7), 40769 (2012).
- Yang, H. Y., Charles, R. P., Hummler, E., Baines, D. L., Isseroff, R. R. The epithelial sodium channel mediates the directionality of galvanotaxis in human keratinocytes. J Cell Sci. 126 (9), 1942-1951 (2013).
- Zhao, M., et al. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442 (7101), 457-460 (2006).
- Shanley, L. J., Walczysko, P., Bain, M., MacEwan, D. J., Zhao, M. Influx of extracellular Ca2+ is necessary for electrotaxis in Dictyostelium. J Cell Sci. 119 (22), 4741-4748 (2006).
- Zhao, M., Agius-Fernandez, A., Forrester, J. V., McCaig, C. D. Directed migration of corneal epithelial sheets in physiological electric fields. Invest Ophthalmol Vis Sci. 37 (13), 2548-2558 (1996).
- Peng, H. B., Jaffe, L. F. Polarization of fucoid eggs by steady electrical fields. Dev Biol. 53 (2), 277-284 (1976).
- Lee, M., et al. Characterization of adult human prostatic epithelial-cells immortalized by polybrene-induced DNA transfection with a plasmid containing an origin-defective sv40-genome. Int J Oncol. 4 (4), 821-830 (1994).
- Berthon, P., Cussenot, O., Hopwood, L., Leduc, A., Maitland, N. Functional expression of sv40 in normal human prostatic epithelial and fibroblastic cells - differentiation pattern of non-tumorigenic cell-lines. Int J Oncol. 6 (2), 333-343 (1995).
- Aurich-Costa, J., Vannier, A., Grégoire, E., Nowak, F., Cherif, D. IPM-FISH, a new M-FISH approach using IRS-PCR painting probes: application to the analysis of seven human prostate cell lines. Genes Chromosomes Cancer. 30 (2), 143-160 (2001).
- Tyson, D. R., Inokuchi, J., Tsunoda, T., Lau, A., Ornstein, D. K. Culture requirements of prostatic epithelial cell lines for acinar morphogenesis and lumen formation in vitro: role of extracellular calcium. Prostate. 67 (15), 1601-1613 (2007).
- Lang, S. H., Sharrard, R. M., Stark, M., Villette, J. M., Maitland, N. J. Prostate epithelial cell lines form spheroids with evidence of glandular differentiation in three-dimensional Matrigel cultures. Br J Cancer. 85 (4), 590-599 (2001).
- Babona-Pilipos, R., Popovic, M. R., Morshead, C. M. A galvanotaxis assay for analysis of neural precursor cell migration kinetics in an externally applied direct current electric field. J Vis Exp. (68), (2012).
- Meng, X., et al. Electric field-controlled directed migration of neural progenitor cells in 2D and 3D environments. J Vis Exp. (60), (2012).
- Pullar, C. E., Isseroff, R. R. Cyclic AMP mediates keratinocyte directional migration in an electric field. J Cell Sci. 118 (9), 2023-2034 (2005).
- Sheridan, D. M., Isseroff, R. R., Nuccitelli, R. Imposition of a physiologic DC electric field alters the migratory response of human keratinocytes on extracellular matrix molecules. J Invest Dermatol. 106 (4), 642-646 (1996).
- Feng, J. F., et al. Guided migration of neural stem cells derived from human embryonic stem cells by an electric field. Stem Cells. 30 (2), 349-355 (2012).
- Mukerjee, E. V., Isseroff, R. R., Nuccitelli, R., Collins, S. D., Smith, R. L. Microneedle array for measuring wound generated electric fields. Conf Proc IEEE Eng Med Biol Soc. 1, 4326-4328 (2006).
- Nuccitelli, R., Nuccitelli, P., Li, C., Narsing, S., Pariser, D. M., Lui, K. The electric field near human skin wounds declines with age and provides a noninvasive indicator of wound healing. Wound Rep. and Reg. 19, 645-655 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved