Method Article
שיטות להערכת subcellular תאים של שריר ב
In This Article
Summary
שריר שלד הוא חיוני לתנועה, והוא חנות החלבון העיקרית של הגופים. מדידות בריאות שרירים בתוך סי אלגנס מתוארות. שינויים פוטנציאליים למבנה שרירים ובתפקודם הוערכו באמצעות ה- GFP מקומי וצבעים קטיוני.
Abstract
שריר הוא רקמה דינמית המגיבה לשינויים בתזונה, פעילות גופנית, ומצב מחלה. אובדן מסת שרירים ובתפקוד עם מחלה וגיל הוא עול משמעותי על בריאות ציבור. בשלב זה אנו מבינים קצת על הרגולציה הגנטית של בריאות שרירים עם מחלה או גיל. סי אלגנס נמטודות הוא מודל שהוקם להבנת הרגולציה הגנומי של תהליכים ביולוגיים של עניין. קיר שרירי גוף של תולעת זו להציג מידה רבה של הומולוגיה עם השרירים של מינים מטזואניים גבוהים יותר. מאז סי אלגנס הוא אורגניזם שקוף, הלוקליזציה של ה- GFP למיטוכונדריה וsarcomeres מאפשרת הדמיה של מבנים אלה in vivo. באופן דומה, האכלת בעלי חיים צבעים קטיוני, אשר מצטברים על בסיס קיומו של פוטנציאל הממברנה של המיטוכונדריה, מאפשר ההערכה של תפקוד המיטוכונדריה in vivo. שיטות אלה, כמו גם הערכה של homeosta חלבון השריראחות, בשילוב עם הערכה של תפקוד שרירים בעלי החיים שלם, בצורה של מבחני תנועה, כדי לאפשר התאמה של פגמי משנה הסלולר עם פעולות פונקציונליות של ביצועי שרירים. כך, סי אלגנס מספק פלטפורמה רבת עוצמה שבה להעריך את ההשפעה של מוטציות, מציאה גן, ו / או תרכובות כימיות במבנה שרירים ובתפקוד. לבסוף, כGFP, צבעי קטיוני, ומבחני תנועה מוערכים הלא פולשני, ניתן לבצע מחקרים פרוספקטיביים של מבנה שרירים ובתפקוד בכל רחבי כמובן חיים וזה כיום לא ניתן לחקור בקלות in vivo בכל אורגניזם אחר.
Introduction
שריר הוא רקמה רב תכליתי, להערכה גם לתפקידה בתנועה, תמיכה וחילוף חומרים יציבות. הפיתוח והתחזוקה של שרירים בריאים דורשים התיאום של תהליכים תאיים רבים ורכיבים. או דרך נזק או מחלה, חוסר ויסות יכול להתרחש, וכתוצאה מכך מבנה שריר שינה ו / או בתפקוד. ירידת גיל הקשורים בתפקוד שרירים מציגה נטל משמעותי לתקציבי בריאות בעולם המערבי, שכן מסת שריר 1,2 ובמיוחד כוח וסבולת שרירים 3-5 מתואם שלילי עם תמותה. המדידה של היבטים הקשורים בתפקוד שרירים מתדרדר כגון מיטוכונדריה שינו או שיבוש sarcomere, יכולה לאפשר הבנה טובה יותר של המנגנונים שבבסיס פיתוח שרירים כללי ובריאות.
elegans aenorhabditis C (סי אלגנס) הוא BES נמטודות מיקרוסקופילא ידוע כי זה היה אורגניזם רב-תאי הראשון שיש כל הגנום שלו רצף 6, הראשון לגנים המושתקים באמצעות 7 RNAi, ומטזואניים רק כדי elegans 9 נקבע. ג השושלת כל תא 8 וneuroanatomy הוצע לראשונה כ מודל ללימוד הבקרה הגנטית של התנהגות בשנת 1974 על ידי סידני ברנר 10 ואת החשיבות של זה ואת העבודה שלאחר מכן הוכר עם הראשון של שלושה פרסי הנובל שהוענק לחוקרי C. elegans. כ -35% מC. elegans גנים זיהו orthologues בבני אדם, עם סי אלגנס להיות האורגניזם מפתח המשמש להבנת הבקרה הגנטית של התפתחות שרירים 11. כמעט בכל גן בגנום סי אלגנס יכול להיות שברה באמצעות RNAi 7,12. כך, על ידי דריסה גנים בשרירים מפותחים במלואו, מרכיבים גנטיים תורמים למחדשgulation בריאות שרירים יכול להיחקר עם פשטות היחסית 13.
היכולת המשולבת לשימוש, מוטציות, ותרכובות כימיות RNAi עושה C. elegans מערכת מובילה לחקר הרגולציה הגנטית 7,14,15 של מבנה שרירים ובתפקוד עם גיל 16 ובמודלים של מחלות 17. ההשפעה של מציאה גן, מוטציה, ו / או חשיפה לחומרים כימיים במבנה שריר ו / או תפקוד ניתן למדוד באמצעות היבטים רבים. כאן אנו מתארים בקצרה טכניקות פשוטות להערכת מבנה C. elegans שרירים ובתפקוד, שרבים מהם יכולים לשמש במחקרים פרוספקטיביים של בריאות שרירים.
הפיתוח של חלבון פלואורסצנטי ירוק (GFP) 18 אפשר להדמיה של שני היישוב של חלבונים ספציפיים והמבנה הכללי של האברונים ב C. elegans. כאן אנחנו מסבירים כיצד ה- GFP הביע ספציפיfically בתוך המיטוכונדריה קיר שרירים גוף, ניתן להשתמש בגרעינים, או sarcomeres כדי לקבוע אם ניוון של מבנים תת-תאיים אלה הוא הווה. כמבנה הוא לא תמיד תחליף אמין לפונקציה, אנחנו גם מסבירים כיצד השימוש בצבע קטיוני in vivo מאפשר הערכת פוטנציאל קרום המיטוכונדריה פגום שבתוך שריר. כאשר הצבעים משמשים בשילוב עם ה- GFP, שמתירים ללימודי אדריכלות ולתפקד באופן זמני לאורך כל חיים. לבסוף, אנחנו גם מסבירים כיצד הומאוסטזיס חלבונים בתוך שריר ניתן להעריך וכיצד כל אלו, ניתן להשתמש כדי לתאם שינויים בבריאות שרירים בעלי החיים שלמים באמצעות שימוש במבחני תנועה. טכניקות אלו, בשילוב עם מציאה גן, מוטציות, ו / או תרכובות כימיות לספק ארסנל רב עוצמה ללימוד כיצד גנים או תרכובות מסוימים להשפיע על בריאות שרירים בגוף חי. המקבילות במבנה, חילוף חומרים ותפקוד ברוטו של שריר בין סי אלגנס ויונקים אומר סי אלגנס הוא אורגניזם מודל מצטיין להבנת הרגולציה של שריר באורגניזמים שונים, לרבות בני אדם.
Protocol
1. זנים, תרבות, ומיקרוסקופי
- זנים לטפל ולשמור על של C. elegans כפי שתוארו לעיל 19. זנים זמינים ממרכז Caenorhabditis הגנטיקה (CGC).
הערה: הזנים המשמשים בניסויים אלה היו CB5600 (ccIs4251 (Pmyo-3 :: Ngfp-lacZ; Pmyo-3 :: Mtgfp) אני;-8 (e1489 IV)) עם חלבוני היתוך GFP המקומיים למיטוכונדריה וגרעין; PJ727 (jls01 (מיו-3 :: GFP, רול-6 (su1006)); UNC-54 :: lacZ V) עם חלבוני היתוך GFP המקומיים למנגנון ההתכווצות וPD55 (ccIs55 (sup-7 (st5); unc- 54 :: lacZ V)) עם חלבוני היתוך β-galactosidase המקומיים לcytosol. - ניסויי RNAi מלאים כפי שתואר לעיל עבור ניסויי RNAi דורית 13 ולקבל חיידקי RNAi מהרצף מאומתים ספריית ORF-RNAi שנבנתה על ידי מארק ואח ידאל אל. 12.
- לבנות זנים המכילים < em> ccIs 4251, jls01 או ccIs 55 תוך שימוש בטכניקות סטנדרטית 20. השתמש transgenes אלה כדי ליצור מתח כדי להעריך מבנה המיטוכונדריה רשת, ארגון שרירן או מדינת פרוטוסטאזיס, בהתאמה. לחצות את הזנים למוטציה בי מסתכל על אחד מהתאים תת-התאיים אלה בכל בעל חיים הוא רצויים.
- השתמש במעכב PtdIns-3-kinase, LY-294,002 (LY) כפי שתוארו לעיל 21. בקצרה, להוסיף LY-294,002 בריכוז סופי של 160 מיקרומטר על גבי צלחות NGM OP50 הזרע יבשות.
- ללכוד את כל התמונות באמצעות מסנן ה- GFP לניסויים מבוסס-GFP ומיקרוסקופ עם מסנן משולש עוקף המאפשר הדמיה של ערוצים אדומים, ירוק וכחול במקביל להערכה בפוטנציאל הממברנה vivo עם C 32 H 32 Cl 2 N 2 O, נפוץ משווק כMitoTracker האדום CMXRos. לבצע ניתוח תמונה והכנת דמות בתוכנת עיבוד תמונה.
s = "jove_title"> 2. סנכרון של בעלי חיים הזחל L1 שימוש הכבידה הנפקה
- לפחות יום 1 צורך לפני, לעשות חיץ M9 - 22.04 מ"מ KH 2 PO 4, 42.27 מ"מ Na 2 4 HPO, 85.56 מ"מ NaCl (ריכוזים סופיים), ולעקר ידי מעוקר. ברגע שהתקרר עד 45 מעלות צלזיוס, להוסיף סטרילי MgSO 4 עד 1 מ"מ לאחר מעוקר כדי למנוע משקעים 22. לאפשר M9 להתקרר על 4 מעלות צלזיוס וaliquot לתוך צינורות 50 מיליליטר.
- ביום של הניסוי, להוסיף 3 מיליליטר חיץ M9 לצלחת 9 סנטימטר בודד עם מספרים גבוהים של זחלי L1. לשטוף את הצלחת שוב ושוב על ידי aspirating נוזל M9 וpipetting נגד פני השטח של אגר עם הצלחת שנערכה בזווית.
- שטוף את L1 של מהצלחת ולאחר מכן להעביר את M9 למבחנת 10 מיליליטר בעזרת פיפטה.
- השאר למשך 2.5 דקות, כדי לאפשר למבוגרים ולבעלי חיים בשלב זחל מאוחר יותר הגדולים יותר ליפול לתחתית המבחנה ובעלי החיים L1 הקטנים יותר להישאר ליד top של חיץ M9.
- הסר את 500 μl העליון של M9 במבחנה באמצעות פיפטה. אז פיפטה זחלי L1 M9 המכילים לצלחת NGM חדשה שנזרע עם 500 OP50 μl מתחת היקף לנתח.
- בדרך כלל, שואף להעביר ~ 200-300 זחלי L1 לכל צלחת. צג צלחות יומיים מבגרות ובמידת צורך, לאסוף בעלי חיים על צלחות NGM OP50 טריות כדי למנוע להישרף מקור מזון OP50.
הערה: זה בדרך כלל 1-3 טיפות של M9 באמצעות פיפטה P1000, אם כי זה משתנה במידה רבה בהתאם למספר L1 של על הצלחת המקורית. - אם מחקרים פרוספקטיביים בבעלי חיים בודדים רצויים, ברגע שבעלי חיים מגיעים לבגרות, לאסוף בעלי חיים בודדים להפריד צלחות NGM זרע. העברת בעלי חיים בכל שעות 24-48 להיפרד מבעלי החיים זחל.
3. מבחני תנועה 19
- מינימום של 2 שעות לפני תחילת ניסויים, להסיר aliquot 50 מיליליטר של M9 ולאפשר לאזן לטמפ 'החדרerature.
- בחר חיה מבוגר יחידה למאגר M9 50 μl על שקופיות מיקרוסקופ.
- לספור את מספר העיקולים גוף השמאלי וימינה ב 10 שניות, שבו שמאלה אחד ועיקול אחד ימינה שווים למכה אחת.
- חזור על הספירה של תנועות גוף כדי לתת כולל של לפחות 5 מדידות שממנו ניתן לקחת ממוצע. להכפיל מספרים אלה על ידי שש לתת שיעור התנועה לדקה.
- בעזרת פיפטה, להעביר את בעל החיים חזרה לצלחת פטרי. שיטה זו מאפשרת מדידה זמנית של תנועה לאורך כל תוחלת החיים בים elegan ג.

איור 1: מבחני תנועה. ברגע שתולעים נאספים למאגר, שמאלה אחד () וימינה עיקול אחד (B) מתווספים יחד כדי לתת תנועה אחת מלאה(שבץ).
4. הדמיה של מיטוכונדריאלי רשתות וSarcomeres בגוף קיר שרירים
- הערה: הפרוטוקול זהה חל על הדמיה של שתי המיטוכונדריה וsarcomeres.
- לסנכרן תולעים כפי שתואר לעיל (סעיף 1) ולגדול ל48-60 שעות בטמפרטורה של 20 מעלות צלזיוס, כאשר הם מגיעים לבגרות צעירה.
- בחר 20 תולעים (נציג של הצלחת) מהצלחות אל 20 μl M9 על שקופיות מיקרוסקופ.
- החל להחליק את המכסה ולהמשיך תמונה באמצעות מיקרוסקופ פלואורסצנטי תחת מסנן GFP (460-500 ננומטר, עירור אור הכחול) ב40X הגדלה.
5. הערכת ממברנה פוטנציאלית על ידי שימוש צבירה Assay in vivo עם MitoTracker האדום CMXRos (C 32 H 32 Cl 2 N 2 O)
- לסנכרן CB5600 (סעיף 1), כל שכותרתו עם GFP במיטוכונדריה של שרירים, ולגדול לבגרות מוקדמת על OP50 מכיל NGM ל48-60 שעות בטמפרטורה של 20 מעלות צלזיוס.
- הוספת 100 μl DMSO לaliquot 50 מיקרוגרם של 32 C H 32 Cl 2 N 2 O כדי להפוך את פתרון מניות של 940.692 מיקרומטר.
- קח 1 μl של פתרון מניות 940.692 מיקרומטר וresuspend לתוך 199 μl M9 ליצור פתרון עבודה של 4.70 מיקרומטר (4.70346 מיקרומטר). להכין את זה בצינורות 1.5 מיליליטר חומים כי C 32 H 32 Cl 2 N 2 O הוא רגיש לאור.
- הכן 20 aliquots μl של מיקרומטר 4.70 פתרון עובד (20 תולעים בוגרות לכל 20 aliquot μl).
- בחר 20 בעלי חיים מבוגרים ל -20 μl של C 4.70 מיקרומטר 32 H 32 Cl 2 N 2 O בצינורות 1.5 מיליליטר החומים. לדגור על 20 מעלות צלזיוס במשך שעה 1.
- לאחר הדגירה 1 שעה, להוסיף 1 מיליליטר M9 לצינורות 1.5 מיליליטר החום המכילים תולעים, צנטריפוגה XG ב 2000 עבור 10 שניות ולאחר מכן להסיר את supernatant. חזור על שלב זה לשטוף לפני resuspending גלולה התולעת והעברת 20 μ שנותרl (המכיל תולעים) לשקופית הדמיה.
- קח תמונות של המיטוכונדריה עם 40X הגדלת שימוש במסנן מעביר משולש שמאפשר הדמיה של שני הערוצים האדומים, כחולים וירוקים בו זמנית. הדמיה באמצעות המסנן המשולש העוקף תערוכות שיתוף לוקליזציה של 32 C H 32 Cl 2 N 2 O עם GFP המקומי למיטוכונדריה מופיעה ככתום.
- לאחר שלקח תמונה של המיטוכונדריה הכתומה, צילום להלבין את בעלי החיים במשך 10 שניות באמצעות אור באורך הגל 540/25 ננומטר על הגדרות מקסימום עם כל המסננים הוסרו. זה להלבין אדום בתוך המיטוכונדריה ולחשוף את ה- GFP המיטוכונדריה לבד כדי לאשר colocalization במיטוכונדריה שרירים.
6. הערכה של פירוק חלבוני שריר ב C. elegans
- PD55s לסנכרן (או כל זן המכיל את גן lacZ) על צלחות NGM זרע עם OP50 (סעיף 1). לגדול לבגרות צעירה ל48-60 שעות ב20 מעלות צלזיוס.
- בחר 20 תולעים בוגרות ל -20 μl DDH 2 O על שקופיות מיקרוסקופ. להיות זהיר כדי לנסות ולבחור רק את התולעת ולא כל חיידקים עם הבחירה. תווית שקופית מיקרוסקופ בעיפרון.
- הנח בתא הייבוש למשך 30 דקות לייבוש ולפצח את הציפורן של בעלי החיים. להבטיח חותם חזק על הייבוש באמצעות שומן סביב החותם.
- בדקו את ההתייבשות היה יעיל תחת בהיקף לנתח (איור 2).
- להטביע את שקופיות מיקרוסקופ באצטון קר כקרח ל3.5 דקות לאחר מכן לעזוב את שקופית מיקרוסקופ על מגבת נייר בטמפרטורת חדר למשך 15 דקות, כדי לאפשר אצטון בשקופית להתאדות. בשלב זה להפשיר את חיץ X-gal וחמצון ולאפשר equilibrating לטמפרטורת חדר.
- להוסיף X-gal 2 μl 100 μl חיץ חמצון ומערבולת בעדינות כדי להבטיח זאת היא הומוגנית. זהו תמהיל אב חיץ X-gal / החמצון.
- הוסף 20 μl של מיקס מאסטר חיץ X-gal / חמצון לכל oאזור riginal של 20 תולעים. בדוק תחת בהיקף לנתח על מנת להבטיח את תערובת האב מכסה לחלוטין את כל בעלי החיים לחלוטין. בעדינות להטות את שקופית מיקרוסקופ כדי להעביר את תערובת האמן על אזורים שבם בעלי חיים אינם מכוסים.
- מניחים את שקף מיקרוסקופ בתא לחות ל1-2.5 שעות בטמפרטורה של 20 מעלות צלזיוס. בעלי חיים תמונה כאשר צבע כחול כהה נמצא בקיר שרירי גופם של בעלי החיים שליטה. להעריך חיות שליטה לפי היקף לנתח כל 15 דקות כדי לקבוע מתי צריכים להיות צילמו בעלי חיים.
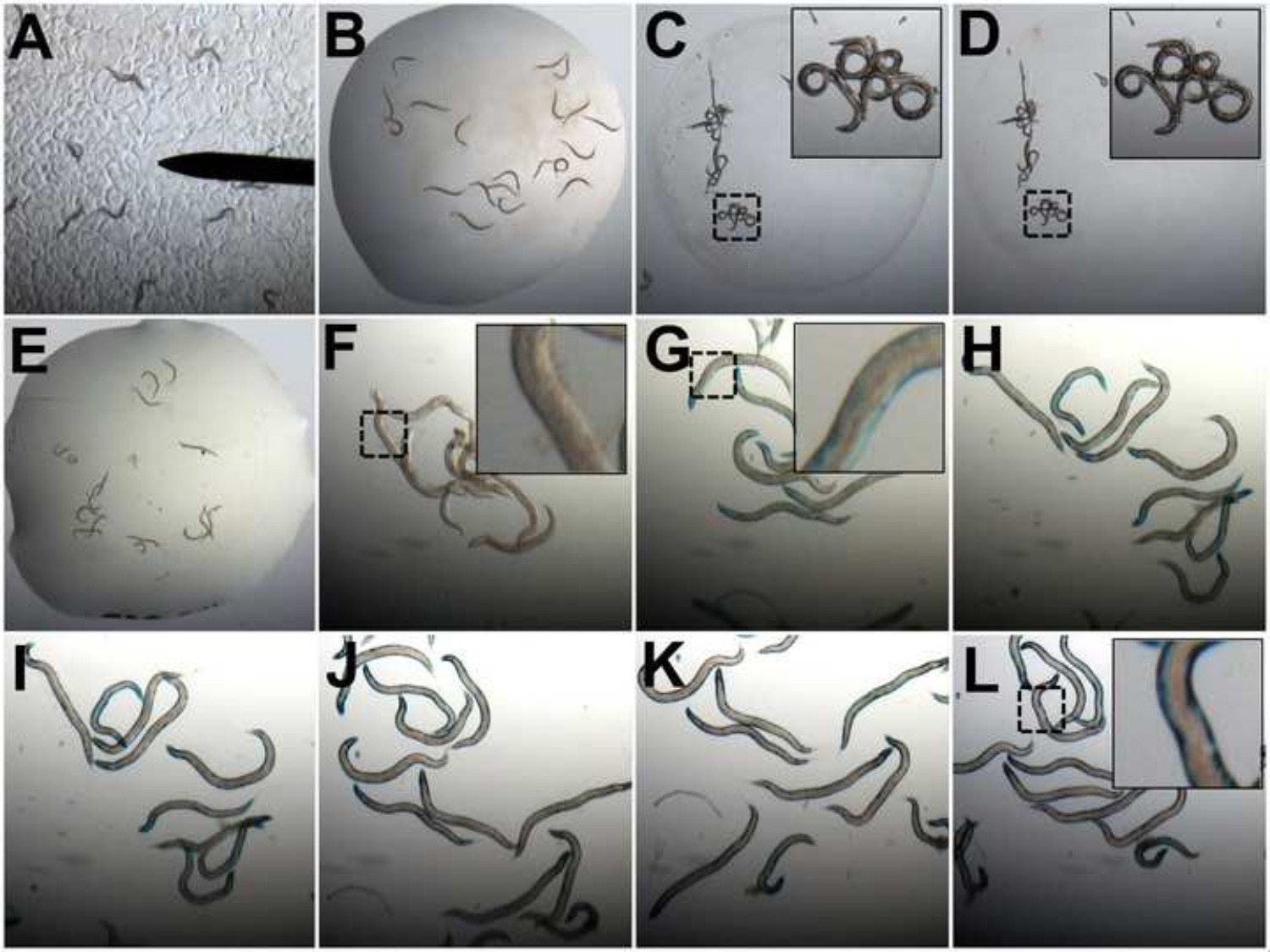
איור 2: הערכה של פירוק חלבוני שריר תוך שימוש במבחני β-galactosidase. בעלי חיים (א) המכילים transgene lacZ נקטפים מצלחות פטרי 20 μl DDH 2 O בשקופית מיקרוסקופ (ב '). בעלי החיים מיובשים ולהיות בורה (C). אז בעלי חיים נשטפים באצטון (ד '). ברגע שאצטון מתאדה תערובת אמן חיץ X-gal / חמצון נוספת (E). הפיתוח של צבע הכחול בבעלי החיים שליטה נבחנים במרווחים של 15 דקות (FL) מt = 0 דקות (F) ועד צבע כחול כהה מתקבל על פני האורך של בעלי החיים (L). תמונות של תולעים נלקחות בהגדלה 2.5x ב AE ו 8X בפלורידה. מתקרב C, D, F, G, ו- L הוא 4X ההגדלה המקורית.
תוצאות
מבחני תנועה לכמת פגמי תנועה
ירידת תנועה היא מנבא טוב לתמותה בג elegans 16, עם ירידה בשיעורים המצביעים על בעיות במערכת העצבית-שהרירית. שינויים בתנועה, כפי שהוערך על ידי מבחני תנועה, יכולים לנבוע מRNAi נגד גן ספציפי או טיפול תרופתי (איורים 3-5) או בבעלי חיים שעברו מוטציה 13, 23. ירידה בתנועה יכולה לנבוע מפיתוח שינה לדוגמא הבאה דפיקה התפתחותית מטה של גני הובלת אלקטרונים קידוד אני מורכב, III, IV או V 24. בנוסף, ניתן לבדוק התערבויות ספציפיות על סי אלגנס מבוגרים רק כדי לחקור את ההשפעה על פיזיולוגיה פוסט-התפתחותית. לדוגמא, בעלי חיים שטופלו בRNAi נגד UNC-112, המקודדים את C. elegans orthologue של Kindlin-1 אשר מותאם לintegrin מכילהמתחמי קובץ מצורף שריר (איורים 3 ו -4), או גז-1, אשר מקודד מרכיב שלי מורכב של שרשרת העברת אלקטרונים (איור 4), להציג מתווית הפחתה בתנועה לעומת שליטה מתפקיד בגרות-48-72 שעות. זה עשויה להצביע על בעיות עם פיזיולוגיה של שרירים. באופן דומה, הפסד של תנועת 24-72 שעות הוא ציין בתגובה לטיפול במבוגרים בדרך כלל פותח עם טיפול במעכב PI3K LY-294,002 (איור 5). אפשר גם לבדוק את ההשפעה של טיפול שני RNAi, מוטציה, או תרופה בשיקום תנועה בבעלי חיים בו מוצגות תנועה מופחתת בתגובה להתערבות ראשונית. לדוגמא, 112 מוטציות unc- להציג ירידה לכימות בתנועה בהשוואה לבעלי חיים מסוג בר שמוחלש בנוכחות מוטציה שנייה ב 1 לעמעם-13. לכן, מבחני תנועה יכולים לזהות שתי ההתערבויות שמשנות neuromuscuפיתוח LAR ו / או בתפקוד, כמו גם אלה המשפרים ו / או לשקם את התפקוד עצבי-שרירית.
הערכה של שיבוש sarcomere
לאחר שזיהה את פגם תנועה, הוא לעתים קרובות רצוי לקבוע אם הגורם לפגם התנועה יכול להיות מוסבר על ידי בעיות בעצבים, שרירים, או שניהם. Sarcomeres הם קומפלקסים רב-חלבון בתוך שריר המאפשרים התכווצות וכך להכריח את הדור ותנועה. על ידי בעלי חיים תוך ניצול להביע חלבוני היתוך GFP שרירן מקומיים למנגנון ההתכווצות, לחוטי שרירן וsarcomeres מידת השיבוש יכולה להיות שנצפתה יחסית הלא פולשני ולהבא בבעלי חיים בודדים באמצעות פיתוח ו / או בבגרות. חיות בר-סוג להציג sarcomeres ערוך המופיעים מספר שורות הירוקות מקבילות ישר בתוך כל גוף קיר שרירים (איור 3). הפרעה למערכים הרגילים אלה עשויות להיות קטנה יחסית עםsarcomeres ערוך מופיע להתאחד, במקום שנותר במקביל. פנוטיפ זה, גלוי עם UNC-112 RNAi בזמן t = 24 שעות או 48 שעות (איור 3), דומה להזרמת Z-קו של אתרים מצורפים אקטין בשריר של יונקים. באופן דומה, מנות קטנות של המערכים יכולות להתמוטט או שהם יכולים להיעלם כגון לחלוטין כטיפול בUNC-112 RNAi בזמן t = 48 שעות או t = 72 שעות (איור 3). הנוכחות של פגמי sarcomere בתוך השריר של בעלי חיים המציגים פגם תנועה (איור 3) די בכך כדי להסביר את פגם התנועה אך לא בהכרח לשלול בעיות אחרות עם שרירים, עצבים, ו / או רקמות אחרות בתגובה להתערבות .
הערכה של מבנה מיטוכונדריאלי רשת
בנוכחות פגם תנועה זה לפעמים רצוי לבחון שרירים לפגמים אחרים שעלולות לגרום או לתרום לדה התנועהfect. המיטוכונדריה מספקת את חלק הארי של אנרגיה בתאים וירידה בתנועה עשויה להיות התוצאה של מתן ATP מופחת, צמצום זמינה להתכווצות שריר האנרגיה. כך המבנה של המיטוכונדריה יכול להיבחן על ליקויים. חשוב לא לטשטש חיות עם אזיד הנתרן כפי שגורם לפיצול במיטוכונדריה מהיר; בעלי חיים בניסויים אלה היו משותקים על ידי הלחץ המופעל על ידי להחליק את המכסה. בתוך סי אלגנס wild-type קיר שרירים גוף, מיטוכונדריה נמצאות בתוך רשתות מאורגנות (איור 4) ומיטוכונדריה קיימות ופועלת כרשתית 25. שיבוש של הרשת של המיטוכונדריה מציג כפיצול של הרשת (גז-1 RNAi, איור 4) 26. פיצול עשוי להיות חמור מספיק שלא מראית עין של רשתות מאורגנות נשארה כגון טיפול עם UNC-112 RNAi (איור 4 ב ו-ג) 13. כwiשיבושי ה במבנה sarcomere, פגמים במבנה המיטוכונדריה שרירים בבעלי המציגים פגם תנועה עשויים להיות מספיק כדי להסביר את פגם התנועה אבל זה לא בהכרח לשלול בעיות אחרות עם שרירים, עצבים, ו / או רקמות אחרות. לדוגמא, UNC 112-מוטציות 13 וטיפול בUNC-112 RNAi (איורים 3 ו -4) תצוגת שני sarcomeres שיבש ושבשו מבנה המיטוכונדריה.
הערכה של תפקוד המיטוכונדריה Vivo
פוטנציאל הממברנה של המיטוכונדריה קובע את היכולת של המיטוכונדריה כדי ליצור כוח המניע של פרוטונים וליצור 27 ATP, ולכן היכולת להעריך את פוטנציאל הממברנה של המיטוכונדריה in vivo מציין את היכולת של בעלי החיים כי כדי לייצר ATP. כשיבושים מבניים המיטוכונדריה יכולים או לא יכולים לשנות יכולת התפקודית של המיטוכונדריה, זה עשוי להיות desirable כדי להעריך את התפקוד המיטוכונדריה בבעלי חיים בו מוצגות מבנה המיטוכונדריה שינה. C 32 H 32 Cl 2 N 2 O מצטבר במיטוכונדריה, בכל סוגי התאים, שבו פוטנציאל קרום הוא בהווה ובמכתים את המיטוכונדריה 28 (איור 4C). במיוחד כדי להעריך את התפקוד המיטוכונדריה בשריר, אפשר להשתמש 32 C H 32 Cl 2 N 2 O ומיטוכונדריה השרירים GFP שכותרתו כדי להדגים את ההשפעות של התערבות באופן ספציפי על המיטוכונדריה שריר (איור 4C). לדוגמא, אובדן טיפול המיטוכונדריה קרום פוטנציאלי הבא עם UNC-112 RNAi מונע C 32 H 32 Cl 2 N 2 O מלהיכנס למטריקס. המיטוכונדריה לכן להראות מעט, אם בכלל כתמים אדומים של המיטוכונדריה בנוסף לתיוג GFP של המיטוכונדריה (איור 4C). גם צילום הלבנה ניתן להשתמש כדי לוודא שנצפהמיטוכונדריה הן דווקא אלה בשריר (איור 4C). זיהוי של קיבולת מופחתת כדי לייצר ATP די בכך כדי להסביר את פגם תנועה שנצפה אך לא לשלול בעיות אחרות בתוך שריר, עצב, ו / או רקמות אחרות. ללא קשר, כמו כושר ייצור ATP המופחת קשור למצבי מחלה בבני אדם 29 והזדקנות 30, זיהוי פגם כזה בתגובה להתערבות מספק במה להקרנה לתרכובות ו / או טיפולי RNAi המשפרים את כושר ייצור ATP ולאחר מכן רשאית אלה תחקור יותר לעומק לפוטנציאל טיפולי.
הערכה של פירוק חלבונים
בנוכחות פגם תנועה וsarcomeres והמיטוכונדריה נורמלים זה לפעמים רצוי לבחון שרירים לפגמים אחרים שעלולות לגרום או לתרום לפגם התנועה. היכולת לשמור על הומאוסטזיס חלבון היא חתימה של לאבריאות mal, ואילו ירידה בסינתזה של חלבונים ו / או עלייה בפירוק חלבונים היא תוצאה של הזדקנות 31 ומצבי מחלה מרובים 32,33. לכן זה עשוי להיות רצוי לבחון את השרירים של בעלי חיים עם מום תנועה להומאוסטזיס חלבון שונה. ניתן לעשות זאת באמצעות הערכה של רמות של חלבוני שריר cytosolic. השימוש בחלבונים המקודדים על transgenically מאפשר הערכה של פרוטוסטאזיס הספציפי שרירים. לדוגמא, שימוש בבעלי החיים המכילים β-galactosidase, התמזגה לחלק N-terminal של שרירן, שמסונתזים תחת שליטתו של אמרגן שרירן ומשפרים מאפשר הערכה של תכולת חלבון שריר cytosolic 19. הנוכחות של כתם הכחול במבוגרים wild-type מדגימה את הנוכחות של β-galactosidase הפעיל והעדר פירוק חלבוני cytosolic פתולוגיים. הפסד של מכתים בתגובה לטיפול מצביע על פירוק חלבונים פתולוגיים מתרחש (איור 5 ), כβ-galactosidase יציב במשך 72 - לאחר בגרות 96 שעות במבוגרים wild-type 13,14,19. לדוגמא, בעלי חיים שלא טופלו wild-type להציג כתם כחול 72 שעות אינטנסיביות אחרי הבגרות, ואילו LY-249,002 חיות שטופלו להציג חוסר הכתם (איור 5). כמו בפגמים במבנה sarcomere ותפקוד המיטוכונדריה, הנוכחות של פירוק חלבוני שריר פתולוגיים די לחשבון לפגם תנועה נצפית אך לא בהכרח לשלול בעיות אחרות עם שרירים, עצבים, ו / או רקמות אחרות.
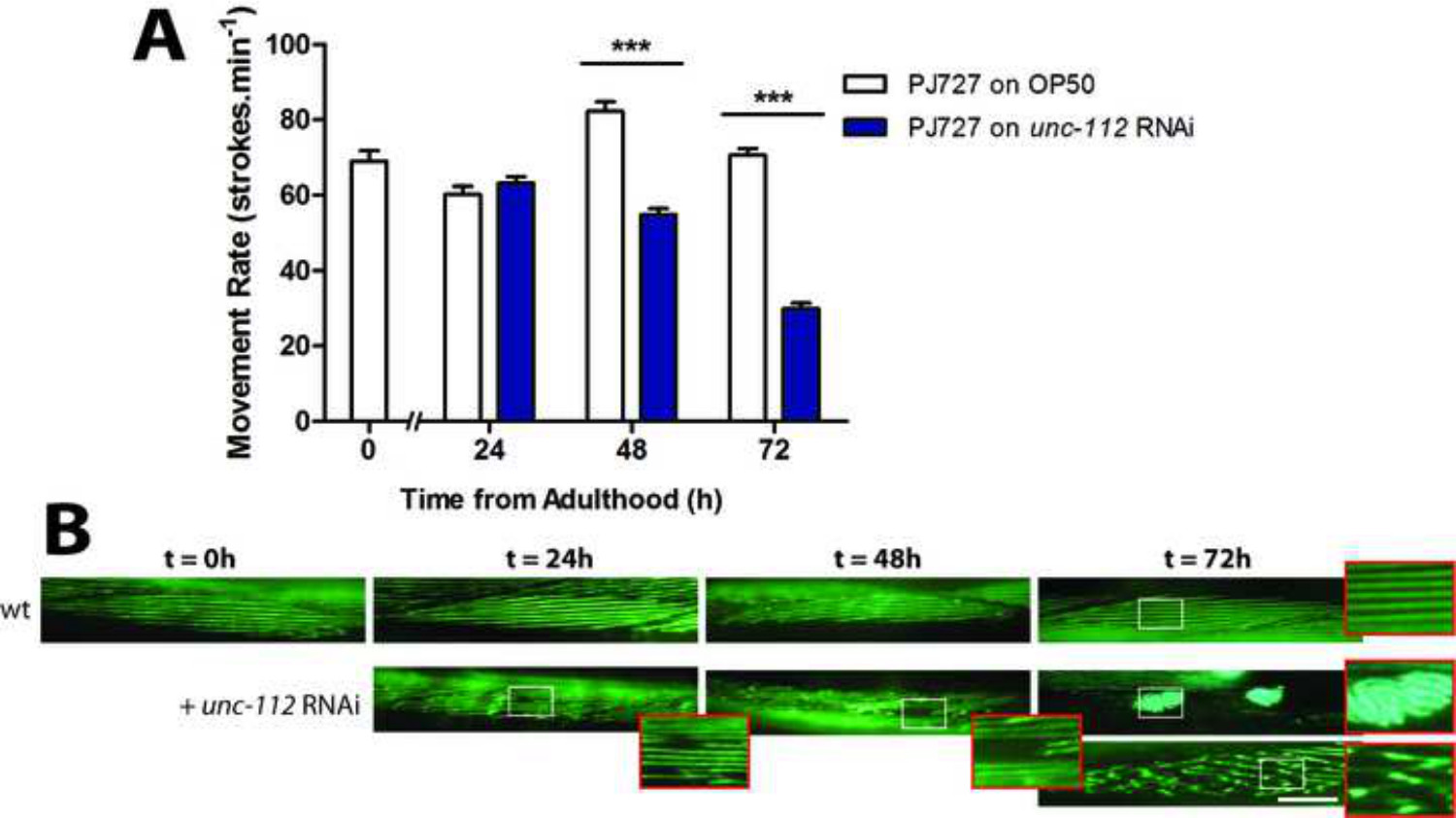
איור 3: (א) UNC-112 RNAi גורם פגם תנועה משמעותי בזמן t = 72 שעות הערכה (B) של מבנה להקה ערוך בתוך קיר גוף שרירים.. בwלא, להקות בשריר מופיעים קווים ישרים כמו בבגרות צעירה (t = 0 hr) ונותרו במידה רבה אחיד עד מעבר 72 שעות של בגרות (ראה זום WT). UNC-112 RNAi גורם sarcomeres לאבד ארכיטקטורה באזורים קטנים של השריר (t = 24 שעות), התמוטט וsarcomeres החסר (t = 48 שעות), צבירה (פנל העליון t = 72 שעות וזום) ואיבוד הליניאריות של sarcomeres (פנל תחתון t = 72 שעות וזום). ברים סולם מייצגים 25 מיקרומטר ומתקרב הם 2.5x.
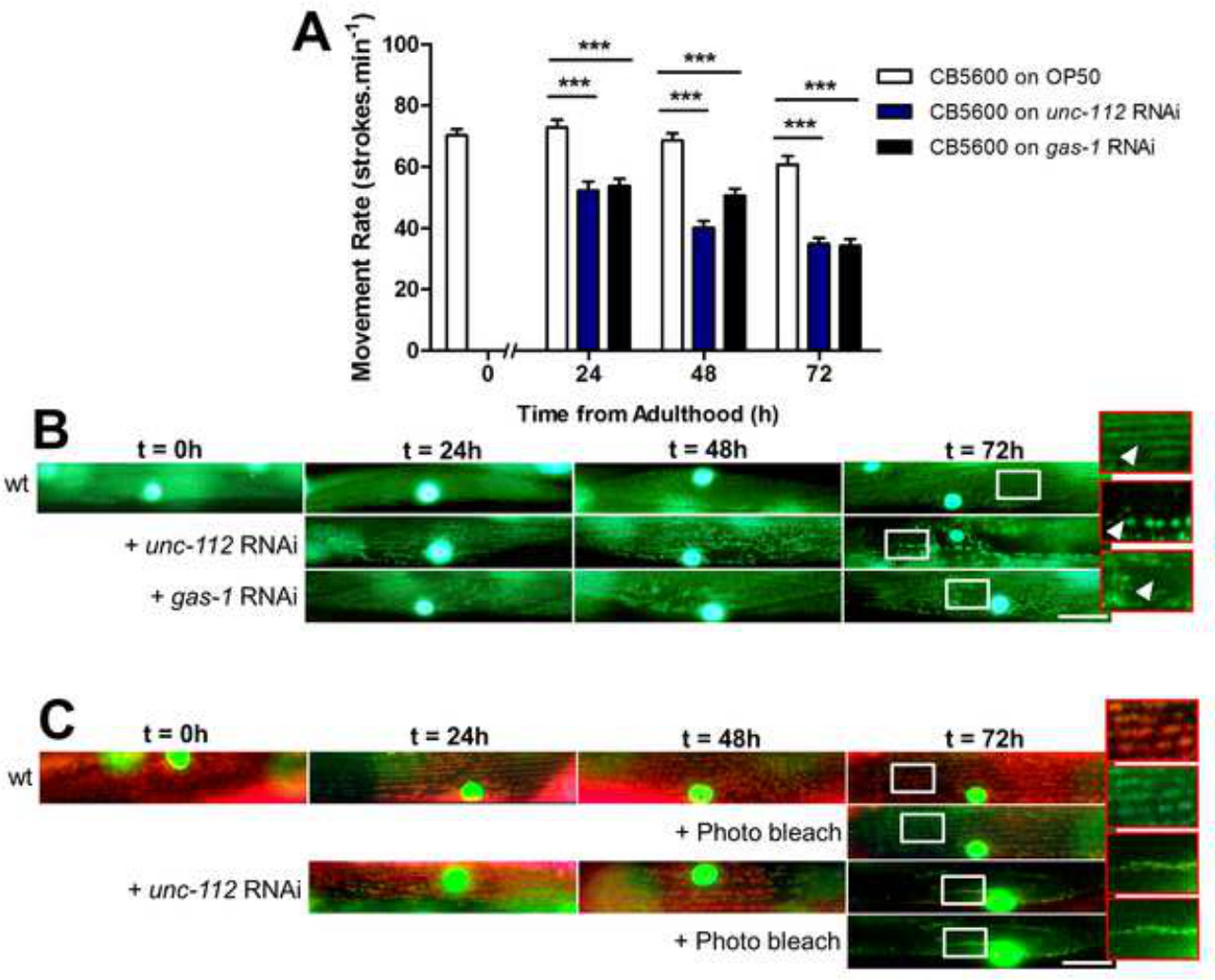
איור 4: () UNC-112 או גז 1 RNAi גורם פגם תנועת הערכה (B) של מבנה המיטוכונדריה בתוך קיר גוף שרירים.. המיטוכונדריה בשרירים מופיעה קווים ישרים ברשת כבבגרות צעירה (WT). טיפול בבעלי החיים עם UNC-112 RNAi התוצאה mitochondrפיצול ial כפי שנצפה בעבר בין 24 שעות ו -72 שעות של בגרות (מתקרב וחץ) 13. כמו כן, RNAi נגד גז -1 תוצאות בפיצול של רשתות המיטוכונדריה כפי שנצפו בעבר 26. אלה נמצאים כפערים קטנים ברשת של המיטוכונדריה בזמן t = שעה 24 והתקדמות לחוסר ארגון נרחב ב 72 שעות (ראה זום וחץ). הערכה (C) של פוטנציאל הממברנה של המיטוכונדריה in vivo. בבעלי חיים המכילים גם GFP מקומי למיטוכונדריה, C 32 H 32 Cl 2 N 2 O מצטבר במיטוכונדריה שריר קיר גוף ומופיעים כתומים תחת מסנן משולש הגבהה מבגרות צעירה (t = 0 שעה) עד שלאחר בגרות 72 שעות. טיפול עם UNC-112 RNAi גורם לאובדן הדרגתי של פוטנציאל הממברנה כפי שמוצג ב 72 שעות שבו המיטוכונדריה שנותרה להראות פחות הצטברות של C 32 H 32 Cl 2 N 2 O לעומת WT. Photobleaching 10 seג באמצעות מלביני 540/25 ננומטר אור האדום מMitoTracker ומגלה GFP המקומי למיטוכונדריה שריר (+ אקונומיקה תמונה). ברים סולם מייצגים 25 מיקרומטר ומתקרב הם 2.5x.
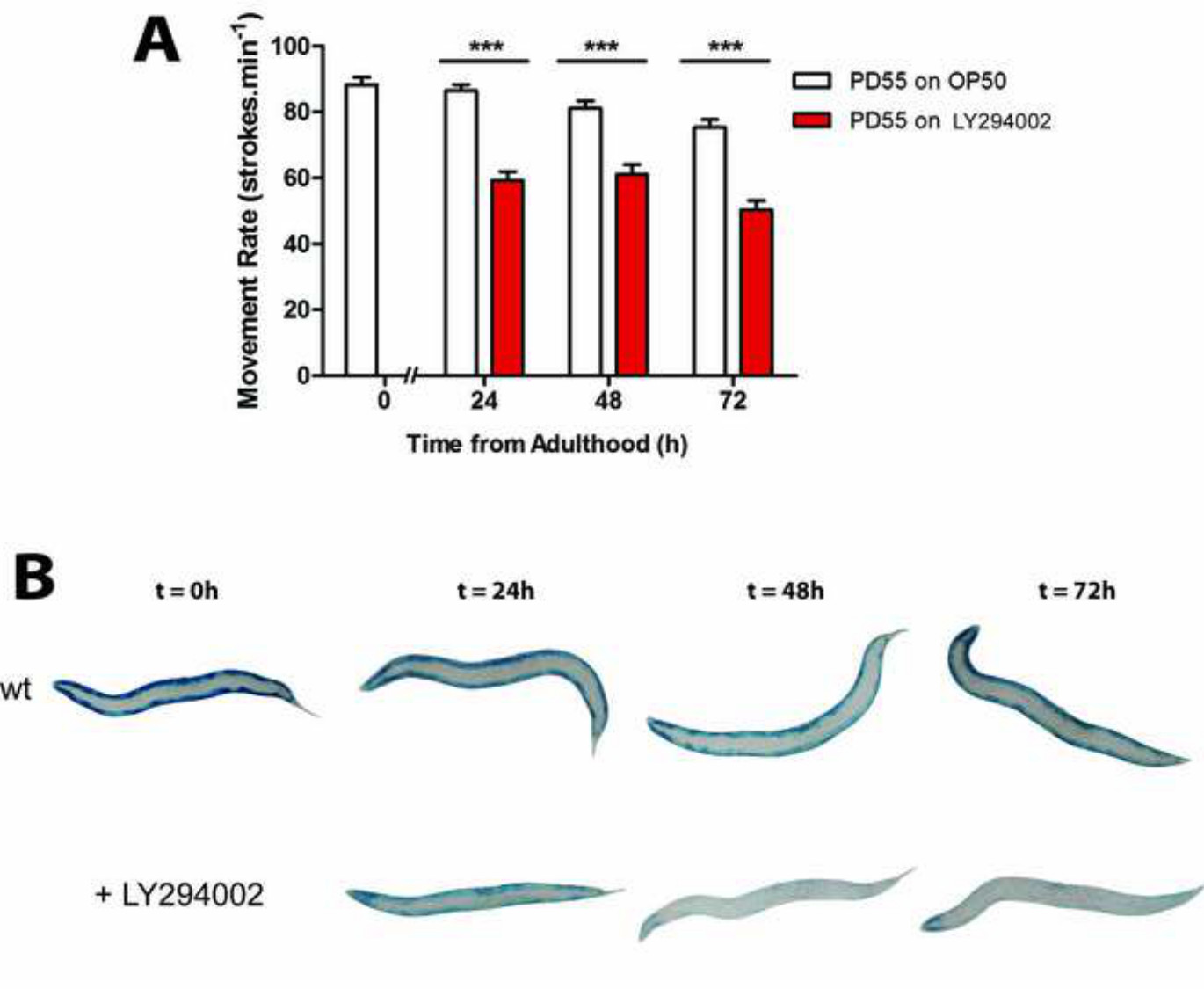
איור 5: (א) טיפול בLY-294,002 בעלי חיים גורם פגם תנועת הערכה (B) של פירוק חלבונים באמצעות assay β-galactosidase.. הגיל המסונכרן WT זחלי L1 גדלים לבגרות צעירה ב 20 ° C (t = 0 שעה) לפני העברה לNGM זרע עם OP50 (שליטת WT) או NGM זרע עם LY-294,002 (טיפול מעכב PI3K) למשך 24 שעות בטמפרטורה של 20 מעלות צלזיוס . ב, כ 20-30 בעלי חיים מוכתמים עבור פעילות β-galactosidase (הכחול) בשעה t = 0 שעה ולאחר 24 שעות, 48 שעות ו -72 שעות.
Discussion
שיטות אלה מאפשרות חקר של שריר מ macrophysiology של תנועה לזיהוי פגמי subcellular שיש בם כדי לגרום לפגם תנועה. בשילוב שיטות אלה יאפשרו ניתוח מפורט של שרירים. תובנה שנרכשו מאפשרת בדיקות נוספות של השערות בכיוון שרירים הקשורים לפיזיולוגיה כללית, הפתופיזיולוגיה והזדקנות.
מבחני תנועה
פגם תנועה מציין הפרעה בתפקוד עצבי-שרירית נורמלית. זה עשוי להיות ספציפי לעצבים או שרירים או שהוא עשוי להיות משותף בין כמה רקמות. השלבים הקשים ביותר של מבחני תנועה השלימו בוחרים תולעים שהם מייצג של האוכלוסייה ו / או הטיפול, וגם להבטיח כי הניסוי אינו פוגע בבעלי החיים בעת ההעברה לM9. חשוב להיות בגודל מדגם גדול לקבל הערכת נציג ומדויקת של תנועה. כאשר מנסים לאמוד מאוד עטהשפעות etrant, למשל ראו בתדירות גבוהה במוטציות, גודל מדגם של עשרה בעלי חיים כל העריך לתנועה פי עשרה הוא מספיק כדי למצוא הבדלים משמעותיים מבחינה סטטיסטית לעומת wild-type. עם זאת, הפשטות של מבחני תנועה וקלות של C. elegans culturing אומרת שמאות תולעים יכולים במהירות להיות מוערכות על מנת להבטיח תוצאות כמותית חזקות. כאשר מנסים לאמוד את ההשפעות המופיעות כיום רק בחלק של אוכלוסייה חשוב כדי לקבוע מה חלקה של האוכלוסייה מופיעה להיות מושפע, כמו גם את חומרת הפגם בבעלי החיים המושפעים ביותר. במצבים כאלה מספרים גדולים יותר של בעלי חיים צריכים להיות מוערכים על מנת לספק נתונים מינימאליים לשיעור האוכלוסייה שנפגעה. לעתים קרובות הן תרופה וטיפולי RNAi יפיקו פגמי תנועה חמורים בחלק קטן מהאוכלוסייה. במקרים מסוימים להגדיל את המינון של הטיפול ואו את שיטת המשלוח יגדיל את חלקם של AFFבעלי חיים השתקפו ועקומות מינון תגובת ריצה עשויים להיות שימושיים בקביעת הריכוז האופטימלי של תרופה או RNAi. מגבלה שנייה של assay תנועה זו היא שהתולעים הם מניפולציה כדי להעריך תנועה. כך, התולעים הם גירוי והן חשופים למידה מסוימת של לחץ האוסמוטי, כאשר הרים לנוזל. מידת לחץ האוסמוטי יכולה להיות מוגבלת על ידי שימוש M9 או BU חיץ 19 בניגוד למים. חלק מהמגבלות הללו נעלמות על ידי מדידת תנועה רגילה על צלחות באמצעות מערכות זמינות מסחרי מעקב 34 או תוספות תוסף חינם עבור 35 ImageJ. מדידת קצב התנועה של בעלי חיים יכול לספק מידע חשוב לגבי בריאות שרירים כללית, ובכלל זה שינויים בתפקוד שניתן למדוד לאורך חיי ואינה הפולשנות של שיטה זו היא מפתח ללימודים לכל חיים פוטנציאליים של תפקוד שרירים.
הדמיה של מכשירי ההתכווצות
מתח התולעת משמש כאן למבנה מנגנון התכווצות תמונה היה PJ727 36 המבטא חלבון היתוך GFP שרירן שהוא מקומי לsarcomeres בתוך קיר שרירי גוף. שימוש בזן זה מאפשר הדמיה של מבנה sarcomere בבעלי חיים. בדומה לassay התנועה שתואר לעיל, יתרון מרכזי של שימוש בsarcomeres GFP שכותרתו להעריך מבנה sarcomere הוא שהשיטה היא יחסית לא פולשנית, ולכן ניתן להשתמש בו כדי לעקוב אחר מכאן ולהבא מבנה sarcomere בבעלי חיים בודדים במהלך החיים. הקושי הגדול ביותר בשיטה זו הוא שהתולעים שלהיות הדמיה עדיין בחיים, ולכן נעו, מה שהופך את זה קשה לקבל תמונות ממוקדות היטב. יכולים להיות מועסקים במספר שיטות כדי להפחית את התנועה ולהפוך את ההדמיה פשוטה; אלה כוללים הרדמה או לשתק את התולעים והקיבוע באמצעות לחץ, יניקה, או שימוש בפתרון צמיגות גבוה. כל אחת משיטות של immobiliz אלהיש ation החסרון שהוא יכול לשנות את התפקוד עצבי-שרירית עצמו. לכן, זה חיוני לכלול פקדים שלא טופלו מתאימים בניתוח. זה יכול להיות גם נבון לנצל לפחות שתי שיטות עצמאיות של חוסר תנועה כדי לאשר את התוצאות הן לא בגלל בעיות בשיטת הקיבוע, תלוי איך שימוש נרחב בשיטת הקיבוע שנבחרה היא לשאלה הנחקרת. כאן השתמשנו בלחץ פשוט מcoverslip לתולעת כדי לגרום לתנועה מופחתת. לאחר שהניח את coverslip, הנוזלים מתחת coverslip יתאדו וcoverslip כתוצאה מכך יתחיל לייצר יותר לחץ על התולעים, בדרך כלל זה לוקח 2-5 דקות כדי לייצר תנועה מופחתת מספיק כדי לאפשר הדמיה קלה.זה חיוני כדי לפקח על התולעים מקרוב אחרי coverslip כבר הציג כלחץ יגדיל סופו של דבר מספיק כדי לגרום לתולעים להתפוצץ מלחץ מוגזם, בדרך כלל 10-15 דקות לאחר שיתוףבנוסף verslip. מאגר נוסף יכול להיות הציג בסיוע pipet קצה מסביב לקצוות של coverslip כדי למנוע פגיעה למעוך לתולעים. לכה לציפורניים יכול לשמש כדי לאטום את הקצוות של להחליק את המכסה ולמנוע אידוי, אם כי זה מונע שליפה של בעלי חיים מתחת להחליק את המכסה, אם תרצה בכך. באופן דומה, השימוש בחרוזי סיליקון בפתרון יכול לעזור להפחית את כמות לחץ מקומות coverslip על התולעים.
בדיוק כמו עם ההערכה לפגם תנועה, חשוב לשקול את החדירות של השפעה. חדירות יכולות להיחשב גבוהות אם בעלי חיים 80-100% להציג פנוטיפ על צלחת NGM, חלקיים, אם 21-79% ונמוכים אם ≤20% מתצוגת האוכלוסייה משפיעים. להשפעות penetrant מאוד, ניתן להשתמש בגודל מדגם קטן יותר כדי לייצר נתונים כמותיים באופן משמעותי על פגמי sarcomere. במקרים בהם את ההשפעה שיש חדירות נמוכות, מבחר של בעלי חיים המציגות פגם תנועה ברור בתגובה לתרופהאו טיפול RNAi עשוי להיות שימושי במנסה לאמוד פגמי sarcomere בבעלי החיים המושפעים ביותר על ידי הטיפול. עם זאת, זה לא בהכרח המקרה שעל תנועה ומבנה התת-תאי מידת השפעת הטיפול היא אותו. כך, זה עשוי להיות רצוי לבחון את מידת הפגמים קיימים באוכלוסייה גדולה, למשל 100 בעלי חיים. זה מאפשר הבנה של חלוקת פגמים בכל אוכלוסייה. זה יכול להיות גם רצוי לבחון את מידתו של הפגם בבעלי החיים שנפגעו בצורה חמורה ביותר ו / או לבחון את הקשר בין המידה של פגם sarcomere ושל פגם תנועת מידה. קשיים פוטנציאליים בצד, בשיטה זו היא מהירה וקלה יותר מאשר שיטות אחרות של הערכת מבנה sarcomere. מהירות וקלות זהו, עם זאת, בכפוף למגבלה עיקרי, sarcomeres המכיל חלבוני היתוך GFP הוא לא לגמרי נורמלי 37, ולכן הערכה של sarcomeres שיבש צריכה להיות מאושרת תוך שימוש בשיטות עבודה אינטנסיבית יותר נוספות.שיטות אלה כוללות שימוש באור מקוטב 38, phalloidin מכתים 39, וimmunofluorescence העקיף 40. שיטות אלה, רק אור מקוטב הוא יחסית לא פולשנית; השיטות האחרות דורשות קיבוע ולכן לא ניתן להשתמש במחקרים פרוספקטיביים של בעלי חיים בודדים, ולא שהם יכולים לשמש רק כדי לאשר, לחצות sectionally, תוצאות ממחקרים כאלה.
הדמיה של מיטוכונדריאלי רשתות
זן התולעת המשמש לניסויי הדמיה המיטוכונדריה היה CB5600 7 המבטא חלבון היתוך GFP המקומי למיטוכונדריה וחלבון היתוך GFP β-galactosidase המקומי לגרעינים, הן בקיר שרירי גוף. כמו בשימוש בPJ727 לsarcomeres הדמיה, שימוש בזן זה מאפשר הדמיה של מבנה רשת של המיטוכונדריה בבעלי חיים. כך, זן זה יכול לשמש כדי להעריך את השינויים דינמיים המתרחשים, לדוגמא mitocho המופחתתהיתוך ndrial ו / או ביקוע של המיטוכונדריה מוגברת 41. גם כעבור sarcomeres הדמיה, הקושי הגדול ביותר בשיטה זו הוא שהתולעים להיות הדמיה עדיין בחיים ומרגשים, שהופך אותו קשה כדי לקבל תמונות ממוקדות היטב. בעוד כמה שיטות, כפי שנדון ביתר פירוט לעיל, יכולות להיות מועסקות על מנת להפחית את התנועה, המיטוכונדריה מופיעה רגישה במיוחד להתערבויות שגורמות לתנועה מופחתת. לדוגמא, נפוץ ביותר רכיבי יעד הרדמה של שרשרת הנשימה במיטוכונדריה ולכן יש להשתמש בזהירות במחקרים של מבנה המיטוכונדריה נורמלי ותפקוד. בדומה לכך, רוב סוכני שיתוק יש להשתמש בזהירות במחקרים של מבנה המיטוכונדריה נורמלי ותפקוד, כמו רוב סוכני שיתוק לגרום פחות אות תעבור דרך הצומת העצבית-שהרירית וdenervation התפקודי של השריר מספיק כדי לגרום לפיצול של המיטוכונדריה. הניסויים במחקר זה מועסקים לחץ כדי לשתק בעלי חייםשל אבל אחרים השתמשו בהצלחה levamisole 42, למרות שזה חיוני לבעלי חיים תמונה באופן מיידי.
לבסוף, מזהמים שונים בקטריאלי בתרבויות, לsubtilis דוגמא ב ', יכולים לגרום לפיצול במיטוכונדריה; לכן זה חיוני לכלול פקדים שלא טופלו מתאימים בניתוח. להשפעות penetrant מאוד, ניתן להשתמש בגודל מדגם קטן יותר כדי לייצר נתונים כמותיים באופן משמעותי על פגמי רשת המיטוכונדריה. עם זאת, בשל השכיחות של ליקויים קלים ברשת של המיטוכונדריה, מספר הקטן של בעלי חיים עשוי להיות פי שניים מהמספר הדרוש להערכה של מבנה sarcomere. במקרים בהם את ההשפעה שיש חדירות נמוכות, מבחר של בעלי חיים באופן ברור בו מוצגות פגם תנועה בתגובה לתרופה או טיפול RNAi עשוי להיות שימושי במנסה לאמוד פגמים במיטוכונדריה בבעלי החיים המושפעים ביותר על ידי הטיפול. עם זאת, כאמור לעיל, זה לא בהכרח המקרה שמידת השפעת הטיפול בתנועה ומבנה התת-תאים זהה. כך, זה עשוי להיות רצוי לבחון את מידת הפגמים קיימים באוכלוסייה גדולה, למשל 150-200 בעלי חיים, כמו גם את מידת ההפרעה בבעלי החיים שנפגעו בצורה קשה ביותר ונוכחות או עדר של הפרעה המידה עם של מידה פגם תנועה. זנים אחרים עם המיטוכונדריה שכותרתו fluorescently ניתן להשתמש כדי לאשר את התוצאות שהושגו בCB5600, לעומת זאת, השימוש בחלבוני ניאון שונים יכולים להשפיע על הרשת בנקודת ההתחלה של המיטוכונדריה. לדוגמא, השימוש בחלבון היתוך RFP-20 tomm לדמיין המיטוכונדריה נראה לגרום להגברת פיצול המיטוכונדריה בסיסית לעומת השימוש של ה- GFP המקומי mitochondrially 17. בעוד שניתן להשתמש בשיטות אחרות כגון immunofluorescence במיקרוסקופ אלקטרונים כדי להעריך מבנה המיטוכונדריה, הם לא מאפשרים הערכת vivo של דינמיקה במיטוכונדריה כי צעד קיבעון הוא מחייבד. שיטות אחרות כגון שימוש בצבעים מקומיים mitochondrially ניתן להשתמש ללא קיבעון ולכן יכולות לשמש גם במקום שימוש של ה- GFP המקומי mitochondrially. כפי שנדון בסעיף הבא, שימוש בצבע כזה גם מאפשר הערכה גסה של in vivo תפקוד המיטוכונדריה.
הערכת פוטנציאל מיטוכונדריאלי ממברנה in vivo ב C. elegans
מגוון של צבעים זמינים למיטוכונדריה תיוג 28. צבעים אלה מספקים שיטה חלופית לדמיין מבנה רשת של המיטוכונדריה ב C. elegans החי. רבים מצבעים אלה גם לאפשר הערכה גסה של פונקציונליות של המיטוכונדריה in vivo, כי הם מצטברים במיטוכונדריה המבוססת על פוטנציאל הממברנה של המיטוכונדריה. כאן השתמשנו H C 32 32 Cl 2 N 2 O שנצרך דרךמערכת עיכול, עם כמה בנוסף נכנס התולעת באמצעות הציפורן בגלל permeabilization המוענק על ידי להיות מומס ב0.5% DMSO. בעקבות כניסתו לתא C 32 H 32 Cl 2 N 2 O מתחמצן ומוחרם על ידי המיטוכונדריה שם הוא נקשר גופרית המכילה חומצות אמינו (לדוגמא: מתיונין וציסטאין). ההיווצרות של קומפלקסי צבע-פפטיד אלה משמעות C 32 H 32 Cl 2 N 2 O נשאר במיטוכונדריה שכותרתו 28 פעם. קושי עיקרי עם השימוש בצבעי המיטוכונדריה הוא שהם יהיו תווית כל המיטוכונדריה בבעלי החיים. לכן יש לנו לבצע תיוג בCB5600, אותו הזן שתואר לעיל להערכת מבנה רשת של המיטוכונדריה שרירים. על ידי שימוש בצבע אדום במיטוכונדריה, זן של תולעים להביע GFP במיטוכונדריה שרירים, ולעבור סינון משולש, זה הוא יחסית פשוט לתמונת מיטוכונדריה רק בשריר על ידי מציאת המיטוכונדריה שoטווח על ידי colocalization של צבע אדום ומיטוכונדריה GFP שכותרתו. הצעד הקשה ביותר בביצוע גישת colocalization זה הדמיה כי הצבע הוא בתוך שניות תחת אור הניאון בעוצמה גבוהה-מולבן תמונה. השפעה זו יכולה להיות מוגבלת על ידי שמירה על הקרינה בעצמה נמוכה עד הנסיין מוכן תמונה ולאחר מכן להתאים את עוצמת הקרינה בהתאם. ברגע אחד הוא חווה עם השימוש בצבעי גישה אחרת היא להשתמש במיקרוסקופ confocal עם Z- ערימות לתמונה מיטוכונדריה בלבד ברקמה תקין; רשתות המיטוכונדריה בשרירים הן די ברורות בהשוואה לרקמות אחרות. לרוע המזל, חוסר היכולת של C 32 H 32 Cl 2 N 2 O לעזוב המיטוכונדריה 28 משמעות הדבר היא כי, בניגוד לטכניקות sarcomere וההדמיה של המיטוכונדריה שנדונו לעיל, אין היא יכולה להשתמש בהם כדי לעקוב מכאן ולהבא אובדן תפקוד המיטוכונדריה עם זמן, אלא אם כן C 32 H 32 Cl 2 N 2 Oהוא הוסיף בנקודות זמן בדידות להפריד בין אוכלוסיות בעלי חיים. מגבלה זו ניתן להתגבר על ידי שימוש בצבעים כגון JC-10 שעושים לעזוב את המיטוכונדריה על קריסה של קרום פוטנציאלי 43. יכולה גם להיות מבודדת המיטוכונדריה מג 30 elegans עבור ניתוחים ביוכימיים שלאחר מכן. חילוץ כזה מאפשר כימות של פוטנציאל קרום המיטוכונדריה על ידי כימותי שיעור ספיגת lipophilic צבע קטיוני באמצעות cytometry זרימה או צלחת קורא ניאון 44. לאחר שבסס את פוטנציאל קרום המיטוכונדריה פגום, אפשר גם לקבוע אם אובדן שיפוע פרוטון מתורגם לאובדן של ייצור ATP באמצעות שיטה המבוססת על לוציפראז bioluminometric רגישה 45.
הערכת פירוק חלבונים בג elegans
זן התולעת משמש כאן להערכת פירוק חלבוני שריר היה PD55, המכיל β ספציפי שרירים-galactosidase שמסונתז ברציפות לאורך התפתחות עד שתגיע לבגרות ואשר נשארה יציב בcytosol ל72-96 שעות הבאות 19. כך, מדידה של רמות β-galactosidase במהלך פיתוח בעיקר מציינת את ההשפעה של התערבויות על סינתזה מאמרגן שרירן ואילו ההפסד של β-galactosidase במהלך הבגרות מצביעה על התערבות ביאה מוגברת פירוק חלבוני cytosolic 19. צעד מפתח בהערכת פעילות β-galactosidase הוא להבטיח התייבשות יעילה. אי לייבש ביעילות בעלי החיים תוצאות בהפרשה לקויה של מצע X-gal וצבע כחול עני ולכן בגוף קיר שרירים של בעלי החיים. כדי להבטיח התייבשות טובה החותם על הייבוש צריך להיבדק והמדגם צריך להיבדק ב5-10 דקות במרווחים לאורך התייבשות כדי להעריך את ההתקדמות (כלומר, מדגם 20 μl צריך מיובש בתוך 10 דקות ו -20 דקות שנותרוהוא להבטיח התייבשות מקיפה). Assay β-galactosidase הוא assay פעילות לכן בקרה נאותה חיונית. בנוסף, ירידה בהכתמה של מבוגרים במצב טיפול ביחס לשליטה אינו מוכיח השפלה שמתרחשת; אלא מציין ירידה בפעילות האנזימטית בתגובה לטיפול. כדי לאשר השפלה, יותר ניתוח כתם מערבי עתירת עבודה חייב להסתיים נגד β-galactosidase 13 וזה מאפשר פירוק חלבוני כימות באוכלוסיות קטנות של תולעים נספרים. ניתן לכמת צפיפות להקת כתם מערבית באמצעות ImageJ 46. מגבלה נוספת של שיטה זו היא כי השימוש בחלבונים מהונדסים אינו מודיע כלמטרות פיזיולוגיות של השפלה ותשובות כגון כתמים מערביים השערה מונעת proteomic ו / או ממוקדים חייבים להיות מועסקים 13. לבסוף, כסינתזה של החלבון המהונדס המועסק במחקרים אלה סוגרים את בבגרות המוקדמת 19 , שיטות אחרות חייבים להיות מנוצלים כאשר מבקשים לבחון שינויים בסינתזה של חלבוני שריר בג המפותח במלוא elegans שרירים; לדוגמא, שיטות איזוטופ יציבים או רדיואקטיבי.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by a grant from the US National Institutes of Health National Institute for Arthritis and Musculoskeletal and Skin Diseases (AR-054342) to NJS. CJG was funded by a Doctoral training studentship funded by the University of Nottingham. JJB was funded by an MRC Doctoral training award (J500495). The funders had no role in study design, data collection and analysis, decision to publish, or preparation of the manuscript.
Materials
| Name | Company | Catalog Number | Comments |
| MitoTracker Red CMXRos (C32H32Cl2N2O) | Invitrogen | M-7512 | Red mitochondrial dye which accumulates based on a negative membrane potential |
| DMSO | Thermo Scientific | 67-63-5 | |
| KH2PO4 | Sigma | 7778-77-0 | |
| Na2HPO4 | BDH | 301584L | |
| NaCl | Sigma-Aldrich | 7647-14-5 | |
| MgSO4 | Sigma | M-7506 | |
| Microscopy Slides | Starfrost | K220 | |
| Microscopy Cover Slips | VW2 International | 631-0124 | |
| 1.5 ml Eppendorph Tubes | Fisher Scientific | FB74031 | |
| Dessicator | Nalgene | D2672 | |
| Nikon Microscope | Nikon | H600L | Nikon H600L microscope with proprietary software |
| Nikon Camera | Nikon | DS-Fi1 | Nikon Digital Sight DS-Fi1 digital camera |
| Zeiss Microscope | Zeiss | Ax10 | Zeiss AX10 microscope with an Axiocam MRC digital camera and Axiovision LE software and a triple-pass filter |
| Plates 9 cm | Starstedt | 82-1473 | |
| Plates 6 cm | Gosselin | BP53-01 | |
| Potassium Ferrocyanide | Sigma-Aldrich | 14459-95-1 | |
| MgCl2 | Sigma-Aldrich | 7786-30-3 | |
| Na3PO4 | Sigma-Aldrich | 7601-54-9 | |
| 5-Bromo-4-chloro-3-indolyl β-D-galactopyranoside | Sigma-Aldrich | 7240-90-6 | |
| N,N-dimethylformamide | Sigma-Aldrich | 68-12-2 |
References
- Wannamethee, S. G., Shaper, A. G., Lennon, L., Whincup, P. H. Decreased muscle mass and increased central adiposity are independently related to mortality in older men. The American Journal of Clinical Nutrition. 86, 1339-1346 (2007).
- Marquis, K., et al. Midthigh Muscle Cross-Sectional Area Is a Better Predictor of Mortality than Body Mass Index in Patients with Chronic Obstructive Pulmonary Disease. American Journal of Respiratory and Critical Care Medicine. 166, 809-813 (2002).
- Metter, E. J., Talbot, L. a. u. r. a. A., Schrager, M., Conwit, R. Skeletal Muscle Strength as a Predictor of All-Cause Mortality in Healthy Men. Journal of Gerontology: Biological Sciences. 57, 359-365 (2002).
- Hairi, N. N., et al. Loss of Muscle Strength, Mass (Sarcopenia), and Quality (Specific Force) and Its Relationship with Functional Limitation and Physical Disability: The Concord Health and Ageing in Men Project. JAGS. 58, 2055-2062 (2010).
- FitzGerald, S. J., et al. Muscular Fitness and All-Cause Mortality: Prospective Observations. Journal of Physical Activity and Health. 1, 7-18 (2004).
- Consortium, C. e. S. Genome sequence of the nematode C. elegans: a platform for investigating biology. Science. 282, 2012-2018 (1998).
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395, 854-854 (1998).
- Sulston, J. E., Horvitz, H. R. Post-embryonic cell lineages of the nematode. Caenorhabditis elegans Dev Biol. 56, 110-156 (1977).
- White, J., Wood, W. B. . The Anatomy. In The nematode C. elegans. , (1988).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Moerman, D. G., Williams, B. D. Sarcomere assembly in C. elegans muscle. The C. elegans Research Community, WormBook. , (2006).
- Rual, J. F., et al. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14, 2162-2168 (2004).
- Etheridge, T., et al. Calpains Mediate Integrin Attachment Complex Maintenance of Adult Muscle in Caenorhabditis elegans. PLoS Genet. 8, 1002471 (2012).
- Shephard, F., Adenle, A. A., Jacobson, L. A., Szewczyk, N. J. Identification and Functional Clustering of Genes Regulating Muscle Protein Degradation from amongst the Known C. elegans Muscle Mutants. PLoS ONE. 6, e24686 (2011).
- Lehmann, S., Bass, J. J., Szewczyk, N. J. Knockdown of the C. elegans Kinome identifies Kinases required for normal protein Homeostasis, Mitochondrial network structure, and Sarcomere structure in muscle. Cell Communication & Signaling. 11, (2013).
- Herndon, L. A., et al. Stochastic and genetic factors influence tissue-specific decline in ageing. C. elegans. Nature. 419, 808-814 (2002).
- Munoz-Lobato, F., et al. Protective role of DNJ-27/ERdj5 in Caenorhabditis elegans models of human neurodegenerative diseases. Antioxid Redox Signal. 5, 5 (2013).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W., Prasher, D. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Zdinak, L. A., et al. Transgene-coded chimeric proteins as reporters of intracellular proteolysis: starvation-induced catabolism of a lacZ fusion protein in muscle cells of Caenorhabditis elegans. J Cell Biochem. 67, 143-153 (1997).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J Vis Exp. 18, e833 (2008).
- Szewczyk, N. J., Peterson, B. K., Barmada, S. J., Parkinson, L. P., Jacobson, L. A. Opposed growth factor signals control protein degradation in muscles of Caenorhabditis elegans. The EMBO Journal. 26, 935-943 (2007).
- Stiernagle, T. . The C. elegans Research Community, WormBook. , 1551-8507 (2006).
- Gaud, A., et al. Prednisone reduces muscle degeneration in dystrophin-deficient Caenorhabditis elegans. Neuromuscular Disorders. 14, 365-370 (2004).
- Dillin, A., et al. Rates of Behavior and Aging Specified by Mitochondrial Function During Development. Science. 298, 2398-2401 (2002).
- Bakeeva, L., Chentsov, Y., Skulachev, V. Mitochondrial framework (reticulum mitochondriale) in rat diaphragm muscle. Biochimica et Biophysica Acta. 501, 349-369 (1978).
- Ichishita, R., et al. An RNAi screen for mitochondrial proteins required to maintain the morphology of the organelle in Caenorhabditis elegans. J Biochem. 143, 449-454 (2008).
- Mitchell, P. Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. Nature. 191, 144-148 (1961).
- Chazotte, B. Labeling mitochondria with MitoTracker dyes. Cold Spring Harb Protoc. 1, 990-992 (2011).
- Seo, A. Y., et al. New insights into the role of mitochondria in aging: mitochondrial dynamics and more. J Cell Sci. 123, 2533-2542 (2010).
- Brys, K., Castelein, N., Matthijssens, F., Vanfleteren, J. R., Braeckman, B. P. Disruption of insulin signalling preserves bioenergetic competence of mitochondria in ageing Caenorhabditis elegans. BMC Biol. 8, 1741-7007 (2010).
- Dorrens, J., Rennie, M. J. Effects of ageing and human whole body and muscle protein turnover. Scandinavian Journal of Medicine & Science in Sports. 13, 26-33 (2003).
- Rennie, M. J., et al. Depressed protein synthesis is the dominant characteristic of muscle wasting and cachexia. Clinical Physiology. 3, 387-398 (1983).
- Mitch, W. E., Goldberg, A. L. Mechanisms of muscle wasting. The role of the ubiquitin-proteasome pathway. N Engl J Med. 335, 1897-1905 (1996).
- Husson, S. J., Costa, W. S., Schmitt, C. . The C. elegans Research Community, WormBook. , 1551-8507 (2012).
- Kawano, T., et al. An imbalancing act: gap junctions reduce the backward motor circuit activity to bias C. elegans for forward locomotion. Neuron. 72, 572-586 (2011).
- Fostel, J. L., Benner Coste, L., Jacobson, L. A. Degradation of transgene-coded and endogenous proteins in the muscles of Caenorhabditis elegans. Biochemical and Biophysical Research Communications. 312, 173-177 (2003).
- Meissner, B., et al. An integrated strategy to study muscle development and myofilament structure in Caenorhabditis elegans. PLoS Genet. 5, (2009).
- Rogalski, T. M., Gilbert, M. M., Devenport, D., Norman, K. R., Moerman, D. G. DIM-1, a novel immunoglobulin superfamily protein in Caenorhabditis elegans, is necessary for maintaining bodywall muscle integrity. Genetics. 163, 905-915 (2003).
- Gieseler, K., Grisoni, K., Segalat, L. Genetic suppression of phenotypes arising from mutations in dystrophin-related genes in Caenorhabditis elegans. Curr Biol. 10, 1092-1097 (2000).
- Wilson, K. J., Qadota, H., Benian, G. M. Immunofluorescent localization of proteins in Caenorhabditis elegans muscle. Methods Mol Biol. 798, 171-181 (2012).
- Chan, D. C. Mitochondrial Fusion and Fission in Mammals. Annual Review of Cell and Developmental Biology. 22, 79-99 (2006).
- Ray, A., Martinez, B. A., Berkowitz, L. A., Caldwell, G. A., Caldwell, K. A. Mitochondrial dysfunction, oxidative stress, and neurodegeneration elicited by a bacterial metabolite in a C. elegans Parkinson's model. Cell Death Dis. 9, 513 (2014).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50, 98-115 (2011).
- Scaduto, R. C., Grotyohann, L. W. Measurement of mitochondrial membrane potential using fluorescent rhodamine derivatives. Biophys J. 76, 469-477 (1999).
- Wibom, R., Hagenfeldt, L., von Döbeln, U. Measurement of ATP production and respiratory chain enzyme activities in mitochondria isolated from small muscle biopsy samples. Analytical Biochemistry. 311, 139-151 (2002).
- Gassmann, M., Grenacher, B., Rohde, B., Vogel, J. Quantifying Western blots: Pitfalls of densitometry. Electrophoresis. 30, 1845-1855 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved