Method Article
Snapshot הגנום של רגולטורי הכרומטין והברית ב
In This Article
Summary
השאלה כיצד הכרומטין רגולטורים ומדינות הכרומטין משפיעה על הגנום in vivo הוא מפתח להבנה של איך מוקדם החלטות גורל התא נעשות בעובר המתפתח שלנו. שבב Seq-הגישה הפופולרית ביותר לחקור תכונות הכרומטין ברמה-הוא גלובלית המפורטים כאן לעוברי צפרדעים.
Abstract
The recruitment of chromatin regulators and the assignment of chromatin states to specific genomic loci are pivotal to cell fate decisions and tissue and organ formation during development. Determining the locations and levels of such chromatin features in vivo will provide valuable information about the spatio-temporal regulation of genomic elements, and will support aspirations to mimic embryonic tissue development in vitro. The most commonly used method for genome-wide and high-resolution profiling is chromatin immunoprecipitation followed by next-generation sequencing (ChIP-Seq). This protocol outlines how yolk-rich embryos such as those of the frog Xenopus can be processed for ChIP-Seq experiments, and it offers simple command lines for post-sequencing analysis. Because of the high efficiency with which the protocol extracts nuclei from formaldehyde-fixed tissue, the method allows easy upscaling to obtain enough ChIP material for genome-wide profiling. Our protocol has been used successfully to map various DNA-binding proteins such as transcription factors, signaling mediators, components of the transcription machinery, chromatin modifiers and post-translational histone modifications, and for this to be done at various stages of embryogenesis. Lastly, this protocol should be widely applicable to other model and non-model organisms as more and more genome assemblies become available.
Introduction
The first attempts to characterize protein-DNA interactions in vivo were reported about 30 years ago in an effort to understand RNA polymerase-mediated gene transcription in bacteria and in the fruit fly1,2. Since then, the use of immunoprecipitation to enrich distinct chromatin features (ChIP) has been widely adopted to capture binding events and chromatin states with high efficiency3. Subsequently, with the emergence of powerful microarray technologies, this method led to the characterization of genome-wide chromatin landscapes4. More recently, chromatin profiling has become even more comprehensive and high-resolution, because millions of co-immunoprecipitated DNA templates can now be sequenced in parallel and mapped to the genome (ChIP-Seq)5. As increasing numbers of genome assemblies are available, ChIP-Seq is an attractive approach to learn more about the genome regulation that underlies biological processes.
Here we provide a protocol to perform ChIP-Seq on yolk-rich embryos such as those of the frog Xenopus. Drafts of the genomes of both widely used Xenopus species—X. tropicalis and X. laevis—have now been released by the International Xenopus Genome Consortium6. The embryos of Xenopus species share many desirable features that facilitate and allow the interpretation of genome-wide chromatin studies, including the production of large numbers of high-quality embryos, the large size of the embryos themselves, and their external development. In addition, the embryos are amenable to classic and novel manipulations like cell lineage tracing, whole-mount in situ hybridisation, RNA overexpression, and TALEN/CRISPR-mediated knockout technology.
The following protocol builds on the work of Lee et al., Blythe et al. and Gentsch et al.7-9. Briefly, Xenopus embryos are formaldehyde-fixed at the developmental stage of interest to covalently bind (cross-link) proteins to their associated genomic DNA. After nuclear extraction, cross-linked chromatin is fragmented to focus subsequent sequencing on specific genomic binding or modification sites, and to minimize the contributions of flanking DNA sequences. Subsequently, the chromatin fragments are immunoprecipitated with a ChIP-grade antibody to enrich those containing the protein of interest. The co-immunoprecipitated DNA is stripped from the protein and purified before creating an indexed (paired-end) library for next-generation sequencing (NGS). At the end, simple command lines are offered for the post-sequencing analysis of ChIP-Seq data.
Protocol
הערה: כל עבודת Xenopus עומדת באופן מלא עם בעלי חיים בבריטניה (הליכים מדעיים) Act 1986 כמיושמים על ידי המכון הלאומי למחקר רפואי MRC.
1. הכנות
- להעריך את מספר העוברים הנדרשים לניסוי השבב (ראה דיון).
- הכן את הפתרונות הבאים אשר מאוחסנים בRT: 500 מיליליטר של 10x Ringers השתנה של מארק (MMR) ללא EDTA, pH מותאם ל7.5 ומעוקר על ידי מעוקר (1 M NaCl, 20 מ"מ KCl, 20 מ"מ CaCl 2, 10 מ"מ MgSO 4, 50 מ"מ HEPES pH 7.5) 10, 1 מיליליטר של חיץ SDS elution (50 מ"מ טריס-HCl pH 8.0, 1 mM EDTA, 1% SDS) ו 1 מיליליטר של חיץ טעינת 5x DNA (0.2% אורנג 'G, גליצרול 30%, 60 mM EDTA pH 8.0).
- הכן את הפתרונות הבאים אשר מאוחסנים על 4 מעלות צלזיוס: 50 מיליליטר של חיץ HEG (50 מ"מ HEPES KOH-pH 7.5, 1 mM EDTA pH 8.0, גליצרול 20%), 500 מיליליטר של מיצוי מאגרי E1 (50 מ"מ HEPES KOH-pH 7.5, 150 מ"מ NaCl, 1 מ"מ EDת"א. גליצרול 10%, 0.5% Igepal CA-630, 0.25% Triton X-100), E2 (10 מ"מ טריס-HCl pH 8.0, 150 מ"מ NaCl, 1 mM EDTA, 0.5 מ"מ EGTA), וE3 (10 מ"מ טריס-HCl pH 8.0, 150 מ"מ NaCl, 1 mM EDTA, 1% Igepal CA-630, 0.25% Na-Deoxycholate, 0.1% SDS), 500 מיליליטר של חיץ Ripa (50 מ"מ HEPES KOH-pH 7.5, 500 מ"מ LiCl, 1 mM EDTA , 1% Igepal CA-630, 0.7% Na-deoxycholate) ו -50 מיליליטר של TEN חיץ (10 מ"מ טריס-HCl pH 8.0, 1 mM EDTA, 150 מ"מ NaCl).
- ציון וקליפ 15 מיליליטר צינור קלקר חרוטי בסימן 7 מיליליטר. השתמש בצינור זה מכיל תמציות גרעיניות עוברות sonication.
- ניתוח שלאחר רצף-, להשתמש במחשב הפעלה בסגנון Unix מרובה ליבות עם לפחות 8 GB זיכרון RAM ושטח דיסק פנוי 500 GB. התקן את התוכנה הבאה באופן מקומי אשר רובם משמשים בשורת הפקודה: FastQC, מסנן איכות 1.8 CASAVA Illumina, 11 Bowtie, 12 SAMtools, 13 הומר, 14 MACS2, IGV 15,16, Cluster3 17, Java TreeView, תפציץ 18 +, וb2g4pipe 19. בדוק את הוראות ההתקנה ודרישות למהדרים ותוכנות צד שלישיים.
- לבנות מדד Bowtie ליישור NGS הקצר קורא להגנום Xenopus. דוגמא מוצגת כאן X. v7.1 tropicalis הגנום (נובמבר 2011), אשר ניתן להוריד כקובץ FASTA (genome.fa) מהשרת ftp Xenbase (/ פאב / Genomics / JGI). להעביר את קובץ FASTA לספריית משנת מדד Bowtie.
- השתמש בשורת הפקודה הבאה (כאן אחרי תו הפקודה>) כדי ליצור קבצי אינדקס xenTro7:
> XenTro7 /path/to/bowtie/index/genome.fa עניבת פרפר-לבנות
> יצוא BOWTIE_INDEXES = / נתיב / ל/ עניבת פרפר / מדד /
- השתמש בשורת הפקודה הבאה (כאן אחרי תו הפקודה>) כדי ליצור קבצי אינדקס xenTro7:
- הורד את קובץ ביאור הגן (GTF) מהדפדפן הגנומי של האוניברסיטה קליפורניה או באתר מראה שעל שרת נימר עבור הגרסאות האחרונה של הגנום (genomes.nimr.mrc.ac.uk) באמצעות דפדפן כלים / לוח. השתמש בקובץ FASTA הגנום וקובץ GTF כדי להתאים אישית Hעומר לXenopus (למשל, X. tropicalis v7.1 הגנום, - שם xenTro7).
- לחלופין, להשתמש בחבילות הומרו שנבנה מראש עבור חלק מגרסות ישנות יותר של הגנום Xenopus.
> LoadGenome.pl -name xenTro7 -org null -fasta /path/to/genome.fa -gtf נתיב / ל/ genes.gtf
- לחלופין, להשתמש בחבילות הומרו שנבנה מראש עבור חלק מגרסות ישנות יותר של הגנום Xenopus.
- ליצור מסלול הגנום (.genome קובץ) לדפדפן הגנום IGV על ידי העלאת קובץ אינדקס FASTA (genome.fa עם קובץ genome.fa.fai באותה התיקייה) ואת קובץ הביאור (genes.gtf). צור מדד פיגום הגנום (genome.fa.fai) להגנום Xenopus כדלקמן:
> Samtools faidx /path/to/genome.fa - השתמש תפציץ + לעבור Gene אונטולוגיה (GO) תנאים מכמה מיני מודל (אדם, עכבר, דג הזברה, זבוב פירות ושמרים) על גני Xenopus כדלקמן:
- הורד את כל רצפי הקידוד (CDS) כקובץ FASTA הבודד (cds.fa) מהדפדפן הגנומי של האוניברסיטה קליפורניה באמצעות כלים/ דפדפן שולחן ויפציץ עדכון + עם מסד הנתונים תפציץ מעוצב מראש של חלבונים שאינם מיותרים (ע"נ):
> Update_blastdb.pl ע"נ - חיפוש לאדם (txid9606), עכבר, דג הזברה (txid7955) (txid10090), זבוב פירות (txid7227) ושמרים (txid4932) חלבונים מאתר צמח השדה באמצעות הפונקציה המתקדמת שלה חיפוש (http: //www.ncbi.nlm.nih. gov / חלבון / מתקדם) ולשלוח את רשימת GI התוצאה (מזהה רצף) (sequence.gi.txt) למחשב.
- הקצאת גני Xenopus לחלבונים דומים ביותר מרשימת GI על ידי ביצוע BLASTx עם הפסקת ערך מצפה (E) מסוימת (כאן 10 -20). ודא שתבנית הפלט היא xml (-outfmt 5 אאוט פרטי blastx_results.xml). לעשות שימוש באשכולות חיסכון בזמן (-num_threads) שתואמים את מספר ליבות מחשב הזמינים.
> Blastx -db / נתיב / ל/ ע"נ -gilist /path/to/sequence.gi.txt -query / נתיב / to / cds.fa -evalue 1e-20
-outfmt 5 אאוט פרטי /path/to/blastx_results.xml -num_threads [# נושאים] - פתח את קובץ b2gPipe.properties של תיקיית b2g4pipe עם עורך טקסט ולעדכן את מאגר הנכסים לDbacces.dbname = b2go_sep13 וDbacces.dbhost = publicdb.blast2go.com. b2g4pipe להפעיל מתיקיית ההתקנה.
> Java Xmx1000m -cp *: שלוחה / *: es.blast2go.prog.B2GAnnotPipe ב-/path/to/blastx_results.xml
תוצאות אאוט פרטיות / xenTro7 -prop b2gPipe.properties -v -annot
הערה: תמציות תכנית זו GO תנאים לכל פיצוץ פגע ומקצה להם גנים מקבילים Xenopus (xenTro7.annot). ניתן למצוא הגדרות בסיס הנתונים המעודכנים ביותר תחת כלים / הגדרות כלליות / DataAccess הגדרות של יישום Blast2GO Java Web Start (ראה 9.11.1).
- הורד את כל רצפי הקידוד (CDS) כקובץ FASTA הבודד (cds.fa) מהדפדפן הגנומי של האוניברסיטה קליפורניה באמצעות כלים/ דפדפן שולחן ויפציץ עדכון + עם מסד הנתונים תפציץ מעוצב מראש של חלבונים שאינם מיותרים (ע"נ):
הכרומטין 2. cross-linking
- להפרות ביציות Xenopus, דה-ג'לי ו תרבותbryos על פי פרוטוקולים סטנדרטיים 20.
- מעביר את עוברי dejellied (tropicalis laevis X. 2,500 או 10,000 X. המרבי) בשלב ההתפתחותי של עניין לבקבוקון זכוכית מדגם 8 מיליליטר עם פקק ולשטוף אותם בקצרה פעם אחת עם MMR 0.01x.
- תקן את העוברים עם פורמלדהיד 1% ב0.01x MMR (למשל, להוסיף 225 μl של פורמלדהיד 36.5-38% עד 8 מיליליטר MMR 0.01x) במשך 15 עד 40 דקות ב RT (ראה דיון בפעם הקיבעון ומספר העוברים הנדרש לכל ניסוי שבב).
הערה: פורמלדהיד הוא מאכל ורעיל ביותר. זה מסוכן במקרה של עין ומגע עם עור, בעיות עיכול, ושאיפה. השתמש במנדף בעת הוספת פורמלדהיד לבקבוקון. - לעצור את הקיבעון על ידי שטיפה בקצרה את העוברים שלוש פעמים עם MMR 0.01x הקר. אל תתנו os אמברי ליצור קשר עם משטח הנוזל בגלל מתח פנים גורם להם להתפקע.
- Aliquot את העוברים לתוך 2 מיליליטר צינורות microcentrifuge על קרחעם מקסימום של 250 עוברים לכל צינור, אשר תופסים נפח של כ -250 μl (tropicalis X.) או 600 μl (laevis X.) לפני הבקיעה.
- משם כמה שיותר MMR 0.01x פיפטה ככל האפשר. לדלג על השלב הבא, אם תמשיך מייד לסעיף 3.
- לאזן עוברים ב250 μl של חיץ HEG הקר. ברגע שעובר התיישב לחלק התחתון של הצינור להסיר כמה שיותר נוזלים ככל האפשר וsnap-הקפאה בחנקן נוזלי. חנות ב -80 מעלות צלזיוס.
3. הכרומטין הפקה
הערה: החילוץ הבא של הכרומטין הצולב מעוברי Xenopus פועל באופן מיטבי עם זמן הקיבעון שצוין בשלב 2.3 ו50-80 X. tropicalis או 25 עד 40 X. laevis עובר לכל מיליליטר של חיץ חילוץ E1, E2 ו- E3. כל צעד חילוץ חוזר על עצמו, כך שנדרש פעמיים הנפח המחושב של חיץ. לupscaling, להשתמש microcentri מיליליטר 2 מרובהצינורות fuge או 50 מיליליטר צינורות צנטריפוגה. שמור דגימות ומאגרים על קרח במהלך חילוץ הכרומטין.
- להשלים כרכים מספקים של מאגרי E1, E2 ו- E3 עם 1 מ"מ DTT וטבליות מעכב פרוטאז. אם ביצוע שבב עם נוגדן ספציפי phospho, מאגרי תוספת נוספים עם 5 מ"מ NAF 2 מ"מ וNa 3 4 VO.
- Homogenize עוברים קבועים עם E1 על ידי pipetting מעלה ומטה. homogenates צנטריפוגה בצנטריפוגה בקירור (4 ° C) XG ב 1000 למשך 2 דקות (או 5 דקות במקרה של שימוש בצינורות 50 מיליליטר). לשאוב supernatant וכל שומנים צמודים לקיר.
- Resuspend כדורים בE1. שמור על דגימות קרח למשך 10 דקות. צנטריפוגה ונזרק supernatants כמו בשלב 3.2.
- Resuspend כדורים בE2. צנטריפוגה ונזרק supernatants כמו בשלב 3.2.
- חזור על שלב 3.4, אבל לשמור על דגימות קרח למשך 10 דקות לפני צנטריפוגה.
- Resuspend כדורים בE3. שמור על דגימות קרח במשך לפחות 10 דקות. צנטריפוגה וזורקי supernatants כמו בשלב 3.2.
הערה: בשלב זה, resuspensions צריך להיות די שקוף. חומרי ניקוי anionic בE3 לחלץ גרעינים צולבים על ידי טיוח רוב לוחיות החלמון שנותרו מסיסה. - כדורי Resuspend ובריכה של גרעינים צולבים (בדרך כלל בצבע חום מגרגירי פיגמנט insolubilized) בהיקף כולל של 1 מיליליטר של E3. לדלל מדגם עם E3 עד 2 או 3 מיליליטר אם היא נראית מאוד צמיגה וקשה לפיפטה. שמור על קרח או על 4 מעלות צלזיוס להמשיך בשלב 4 באותו היום או הבא. Snap-הקפאה בחנקן נוזל חנות ב -80 ° C לשימוש מאוחר יותר.
4. פיצול הכרומטין
הערה: Sonication משמש הוא לsolubilize וגזירת הכרומטין הצולב. הנה פרמטרים לרוץ Misonix sonicator 3000 מצוידים בmicrotip מחודד 1/16 אינץ 'ומתחם קול. אם אתה משתמש sonicators אחר, בצע את ההמלצות של היצרנים לגזירההכרומטין או להשתמש 6 עד 12 W ל4-8 דקות בסך הכל צולב.
- להעביר את המדגם הגרעיני מצעד 3.7 לתוך צינור שהותקן עבור sonication (שלב 1.4). שמור המדגם המקורר במהלך sonication על ידי בעל הצינור המחובר לכוס פלסטיק 800 מיליליטר מלא במי קרח באמצעות מהדק מדחום קצר.
- מניחים את הכוס על שקע מעבדה. התאם את השקע כך שmicrotip sonicator הוא טבל במדגם לכשני שלישים מעומק הנפח ומרוכז בלי לגעת בקיר הצינור.
- Sonicate את המדגם עבור 7 דקות בסך הכל, הפסיק את כל 30 שניות עם הפסקות 1 דקות. להגדיר כוח 1.0. התחל sonication ולהגדיל באופן מיידי את כוח ההגדרה (בדרך כלל 2 עד 4) כדי להגיע לקריאה של 9 עד 12 W. השהה באופן מיידי אם המדגם מתחיל להקציף. מיקום מחדש צינור והפעלה מחדש עם הקצף נעלם לחלוטין.
- העבר את הכרומטין טעון לתוך צינורות 1.5 מיליליטר מראש צונן microcentrifuge וספין במלוא מהירות (> 15,000 XG) במשך 5 דקות ב 4 מעלות צלזיוס.
- מעביר את supernatant מראש צונן צינורות 1.5 מיליליטר microcentrifuge. לאסוף 50 μl של supernatant (באופן אידיאלי המכיל את הכרומטין של כ 400,000 או יותר גרעינים) כדי להמחיש את מידת פיצול הכרומטין (סעיף 5). השתמש בשאר supernatant לשבב (סעיף 6).
- דגימות חנות ב 4 מעלות צלזיוס למשך היום עד אחת. דגימות Snap-הקפאה כaliquots (אחד לכל ניסוי שבב) בחנקן נוזלי לאחסון לטווח ארוך ב -80 ° C.
פיצול 5. ההדמיה הכרומטין
- הוסף 50 μl של חיץ elution SDS, 4 μl של 5 M NaCl ו1 μl של proteinase K (20 מיקרוגרם / μl) 50 μl של supernatant משלב 4.6.
- דגירה של 6 עד 15 שעות (O / N) בהכלאת תנור ל -65 מעלות צלזיוס.
- לטהר DNA באמצעות ערכת טיהור PCR מסחרית. במידת צורך, להשתמש 3 M של נתרן אצטט (pH 5.2) כדי להתאים את pH כפי שהומלץ על ידי היצרן. EluteDNA פעמיים עם 11 μl של חיץ elution (10 טריס-HCl pH 8.5 מ"מ).
- להוסיף 0.4 μl של RNase (20 מיקרוגרם / μl) ו -5 μl של חיץ טעינת 5x DNA לפני הפעלת המדגם כולו לצד נ"ב 100 וסולם DNA kb 1 על 1.4% agarose ג'ל אלקטרופורזה על ידי. לקבלת תוצאות אופטימליות, ג'ל כתם עם פתרון מכתים חומצות גרעין בטוח לאחר אלקטרופורזה.
6. Immunoprecipitation הכרומטין
הערה: בסעיף זה, השתמש נמוך שימור 1.5 מיליליטר צינורות microcentrifuge ולפחות 1 מיליליטר של חיץ המצוין לכל צינור לשטוף חרוזים מגנטיים במשך 5 דקות ב 4 מעלות צלזיוס. לפני הסרת החיץ מהחרוזים, לעזוב את הצינורות במעמד המגנטי במשך 20 עד 30 שניות בכל פעם, או עד הפתרון הוא ברור.
- העברה 10 עד 30 μl של supernatant (הכרומטין טעון) משלב 4.6 לצינור חדש שתשמש מאוחר יותר כמדגם קלט, אשר תואם את כ -1% מהכרומטין הכולל המשמש לשבב. חנות ב 4° C עד דגימות שבב מוכנות להיפוך קישורים צולבים.
- העבר את הכרומטין נותר לצינור חדש. בניסויים שבב qPCR דורשים שליטת נוגדן, להפיץ כמויות שווה של הכרומטין לשני צינורות.
- הוסף את הנוגדן ברמת השבב (או שליטת הנוגדן המקבילה) להכרומטין. כמדריך גס, להשתמש על 1 מיקרוגרם של נוגדן לכל מיליון תאים המבטאים את epitope של עניין.
- למדויק יותר להעריך את כמות הנוגדנים הנדרשים לניסוי שבב, הפעל אותו השבב עם כמויות שונות של נוגדן (למשל, 0.25 מיקרוגרם, מיקרוגרם ו -1 2.5 מיקרוגרם) ולהשוות את התשואה בלוקוסי ביקורת שליליות וחיוביים על ידי שבב qPCR (ראה סעיף 10). כשליטת נוגדן, להשתמש בסרום נורמלי של אותו אלוטיפ ובעלי חי מארח מינים כנוגדן.
- דגירה על O מסובב (10 סל"ד) / N ב 4 ° C.
- לשטוף כמות מספקת של חרוזים מגנטיים נוגדן תואם פעם אחת עם E3 למשך 5 דקותt 4 מעלות צלזיוס. בדוק המפרט של היצרן עבור הקיבולת מחייבת הנוגדן של חרוזים (בדרך כלל 5 עד 20 μl של חרוזים לאגד 1 מיקרוגרם של נוגדני IgG).
- להוסיף חרוזים כדי לרחוץ את הכרומטין מראש מודגרות-הנוגדן. בהמשך דגירה על הכתף (10 סל"ד) במשך 4 שעות.
- לשטוף חרוזי ארבעה פעמים (שבב-qPCR) או עשר פעמים (שבב Seq) עם חיץ Ripa טרום צונן, ולאחר מכן פעם בעשר חיץ מראש צונן.
- לשאת רק את הצעד הזה אם ביצוע ניסוי שבב Seq.
- Resuspend שטף חרוזים ב -50 μl של TEN חיץ לכל צינור. הבריכה כל חרוזים מניסוי שבב יחיד בהעברתם לצינור חדש. השתמש במתלה המגנטית וצנטריפוגה בקירור (4 מעלות צלזיוס) XG ב 1000 כדי לאסוף חרוזים בחלק התחתון של הצינור. בטל כנוזל כמה שניתן מבלי לשבש את גלולה של חרוזים.
- חומר הרצועה לקלף את החרוזים על ידי resuspending את החרוזים 50 עד 100 μl של חיץ elution SDS ווארטexing באופן רציף עם thermomixer (1,000 סל"ד) במשך 15 דקות על 65 מעלות צלזיוס. לאחר צנטריפוגה שבמלוא מהירות (> 15,000 XG) במשך 30 שניות. מעביר את supernatant (eluate שבב) לצינור חדש.
- לחזור על השלב האחרון ולשלב eluates השבב.
7. הפוך הכרומטין cross-linking וטיהור DNA
- הוסף מספיק חיץ elution SDS מדגם הקלט (שלב 6.1) כדי להגיע להיקף מדגם השבב, שהוא 100 עד 200 μl (שלב 6.10). להשלים שני דגימות השבב וקלט עם 1/20 נפח של 5 M NaCl. דגירה הדגימות עבור 6-15 שעות (O / N) על 65 מעלות צלזיוס בתנור הכלאה.
- הוסף 1 נפח מאגר TE וRNase ב 200 מיקרוגרם / מיליליטר. דגירה עבור שעה 1 על 37 מעלות צלזיוס.
- להוסיף K proteinase ב 200 מיקרוגרם / מיליליטר. דגירה של 2-4 שעות על 55 מעלות צלזיוס.
- לטהר DNA על ידי פנול: כלורופורם: מיצוי אלכוהול isoamyl אחריו משקעים אתנול כפי שתואר קודם לכן 9. לשבב Seq, להוסיף 32μl של חיץ elution (10 מ"מ טריס-HCl, pH 8.5) לפזר את גלולה DNA. השאר על דגימות קרח למשך 30 דקות על מנת להבטיח כי ה- DNA הוא נמס לגמרי.
יש לי מסחרי ערכות טיהור PCR DNA התאוששות נמוכה יותר, אך נוחות יותר, ויכולות לשמש לדגימות שבב qPCR: הערה. - לשבב Seq, לקבוע את הריכוז של 1 μl של DNA שבב והקלט תוך שימוש בשיטות המבוסס על fluorometry. בצע את הוראות היצרן ולוודא שריכוז של DNA נופל בטווח זיהוי אמין של fluorometer.
8. שבב Seq ספריית בנייה ואישור ב
הערה: שיטות נוכחי להכנת ספריית DNA מאפשרות בנייה של ספריות גבוהות מורכבות לNGS 1-2 ng. על חשבון כמה מורכבות, יכולות להתבצע ספריות מ קטן כמו 50 pg של ה- DNA (ראה טבלה של חומרים / ציוד ספציפי). משתמש באותה הכמות של DNA לשני שבב וספריית קלט. בקצרה, לMakדואר באינדקס (לזווג-end) ספריות שבב Seq, שבב וDNA הקלט צריכים להיות תוקן סוף, ligated למתאמים מיוחדים (ראה טבלה של חומרים ספציפיים / ציוד), וPCR מוגבר שנבחר גודל.
- פעל לפי ההנחיות של היצרן כדי להפוך את ספריות שבב Seq. ראה דיון להמלצות נוספות.
- Elute כל ספרייה ב -12 μl של חיץ elution ולקבוע את הריכוז של 1 μl של כל ספריית שבב וקלט באמצעות fluorometer. מצפה ריכוזים של 5 עד 25 ng / μl. לשקול את צמצום מספר מחזורי PCR (פחות מ 18 מחזורים) אם ריכוזים גבוהים יותר מאשר 25 ng / μl.
הערה: כימות מדויק הוא מפתח להשגת תוצאות אופטימליות NGS. ספריות עם ריכוזים נמוכים כמו 1 ננוגרם / μl לאחר 18 מחזורי PCR יכולות להיות רצף, אבל לעתים קרובות הן מורכבות נמוכה יותר. - השתמש 1 μl של ספרייה כדי לקבוע את התפלגות גודל שבר ולבדוק עבור כל זיהום דימר מתאם (להקה כ -120 נ"ב) על ידי גהמבוסס על ירך אלקטרופורזה נימים. חזור על טיהור הקיבוע הפיך שלב המוצק עם יחס חרוזים-למדגם של 1: 1 (במקום 1.6: 1) אם הספרייה מכילה הדימרים מתאם.
- לבצע qPCR על לוקוסי ביקורת חיוביים ושליליים תקפים (ראה סעיף 10) כדי לבדוק אם מגמות העשרת DNA דומות הם נצפו לפני ואחרי הכנת ספרייה. שלח ספריות אושרו בקרת איכות על רצף.
9. ניתוח פוסט-רצף ונתונים להדמיה
הערה: כיום, NGS מתבצעת לעתים קרובות על ידי in-house או מתקני רצף מסחריים (ראה דיון לכמה הנחיות NGS). הפלט הסטנדרטי הם קבצים בודדים או מרובים-דחוס gzip FASTQ (* .fastq.gz) אחסון מיליונים רצף קורא. בדרך כלל, ריבוב קורא כבר מופרד על פי המדד שלהם וכל קריאה מכילה מזהה רצף וציון בקרת איכות (Phred + 33 לIllumina 1.8+) עבור כל basשיחת דואר. גישה זו כאן היא רק אחד מתוך דרכים רבות כיצד לנתח נתונים NGS. הקורא מוזמן לבדוק אם כל אחד משורות הפקודה הבאות דורש שינויים כתחום זה במהירות קידום והעדכונים מתרחשים באופן קבוע.
- לשרשר קבצי FASTQ-דחוס gzip ולבדוק את איכות נתוני הרצף באמצעות סקריפט FastQC. ביצוע הזה ורוב הפקודות לשני נתונים השבב ורצף הקלט הבאים (דוגמאות שמוצגים לשבב) מהמסוף:
> חתול /path/to/*.fastq.gz> ChIP.fastq.gz
> Fastqc ChIP.fastq.gz
הערה: נתוני גלם מהרצף המוצלח של ספריית שבב Seq גבוהות מורכבות צריכים לעבור הבדיקות ביותר. כישלונות נובעים בעיקר מריצות רצף עניות וחפצים ניסיוניים כגון הגברה PCR מוטה או זיהום מתאם. מידה מסוימת של כפילות (יתירות) צפויה כמיותר קוראת יכול לייצג בתום לב העשרת DNA 21. עם זאת, אחד יכול מאוחר יותר להגביל את תגי קריאה - סוף '5 או קורא - לאחד לכל זוג בסיס לחסל את כל מיותר קורא מבלי להשפיע על רגישות זיהוי של פסגות (שלב 9.4) 21. - נתוני רצף טרום תהליך להסרת זיהום מתאם (homerTools לקצץ -3 <רצף מתאם>) המאפשר התאמה אחת (-mis 1). השתמש 20 הבסיסים הראשונים של המתאם (אינדקס) (5 'ל 3') הפרוקסימלי לקטע DNA של עניין על קשירה (מוצג למתאם המופיע בטבלה של חומרים ספציפיים / ציוד).
> Gzip -cd ChIP.fastq.gz | fastq_illumina_filter -vN> ChIP.fastq
> HomerTools לקצץ -3 GATCGGAAGAGCACACGTCT -mis 1 -min 36 ChIP.fastq
הערה: קוראת הסרת מסוננת (-N) נדרש רק כברירת מחדל בקבצי FASTQ שנוצרו על ידי Illumina 1.8. להשמיט את פקודת fastq_illumina_filter (כלומר,. '| Fastq_illumina_filter -vN')אם גרסה ישנה יותר מ -1.8 נוצרה מזהה רצף. - יישרו מעובד מראש קורא לגנום ההתייחסות (xenTro7) באמצעות Bowtie. רק לשמור ממופה באופן ייחודי קורא (-m 1) תוך שימוש בהגדרות ברירת מחדל, כלומר, שתי חוסר התאמה מקסימלי ב-28 הבסיסים הראשונים ו+ 33 ציון איכות כוללת Phred של כל חוסר ההתאמה לקריאה מהמשקל מקסימאלי של 70. דווח יישור בפורמט SAM (-S) . להגדיל את מספר מגה בייט לחוט (--chunkmbs) אם זיכרון הנתח הוא מותש:
> עניבת פרפר -m 1 -S -p [# אשכולות] --chunkmbs [למשל 200] xenTro7 ChIP.fastq.trimmed> ChIP.sam
הערה: Bowtie מצפה Phred + 33 ציוני איכות כברירת מחדל. כולל את האפשרות - phred64-quals אם קובץ FASTQ נוצר עם Phred + 64 ציוני איכות של Illumina מבוגרים מ -1.8. - השתמש בשתי פקודות הומרו להפוך את היישור (SAM) קובץ לקובץ את רם-ראש (.bw):
> MakeTagDirectory שבב / -single -tbp ChIP.sam 1
> MakeUCSCfile שבב /-bigWig / נתיב / ל/ genome.fa.fai -fsize 1e20 -norm 1e7 -o ChIP.bw
הערה: השינוי דורש מדד הפיגום (genome.fa.fai) של הגנום ההתייחסות (שלב 1.8). הנה הפרופיל מוגבל לתג אחד לכל זוג בסיס (-tbp 1) ומנורמל 10 מיליון קורא (1e7 -norm). רם-הראש, הוא אחד מהפורמט המועדף לדמיין דינמי פרופילי הכרומטין עם דפדפן הגנום כגון IGV (שלב 9.12). - לקבוע את חלוקת התגים (שבב -d /) בציוני דרך הגנומי (למשל, +/- 10 kb עם 25 פחים נ"ב, -si ze 20000 -hist 25) כגון תחילת השעתוק (TSS, דוגמא שמוצגת כאן) וסיום ( אתרי TTS). הפעל את annotatePeaks.pl סקריפט Perl הומר עם ביאורי Xenopus xenTro7 (שלב 1.7):
> AnnotatePeaks.pl 20000 -hist 25 -d שבב xenTro7 -size TSS /> ChIP_tagDensity.tss - מצא את הפסגות משמעותיות של העשרת DNA בין השבב(-t ChIP.sam) וקלט (Input.sam -c) בX. tropicalis הגנום באמצעות MACS2 עם 1% הפסקת FDR (-q 0.01) ושברי DNA (לאחר sonication) של 200 נ"ב (--bw = 200) לבניית מודל. הוסף את --broad הדגל לשורת הפקודה זה כאילו ציפה הפצה רחבה של תכונת הכרומטין של עניין, כגון סימני היסטון או RNA פולימראז.
> Macs2 callpeak -t ChIP.sam -c Input.sam -f -n SAM שבב -g 1.4376e9 -q 0.01 --bw = 200
הערה: הגודל האפקטיבי של X. v7.1 ההרכבה הגנום tropicalis הוא כ 1437600000 נ"ב (1.4376e9 -g). MACS2 מייצר קובץ BED (ChIP_peaks.bed) גיוס פסגות עם המקומות הגנומי שלהם. - השווה בין מספר פרופילי הכרומטין בצורה של Heatmap התקבצה:
- צור מטריצת הפצת תג מספריות צפיפות תג של עניין (-d שבב / other_ChIP /) בפסגות MACS2 (למשל, +/- 1 kb עם 25 פחים נ"ב, 2000 -hist -size 25 -ghist):
> AnnotatePeaks.pl ChIP_peaks.bed xenTro7 -size 2,000 -hist 25 -ghist -d שבב / other_ChIP /> ChIP.matrix - השתמש בממשק המשתמש הגרפי של Cluster3 להעלות קובץ ChIP.matrix והיררכי אשכול צפיפויות תג אלה בהתבסס על מרחק אוקלידי המינימלי לcentroid הקרוב ביותר. פתח את הקובץ שנוצר בCTD Java TreeView לדמיין את האשכולות.
- צור מטריצת הפצת תג מספריות צפיפות תג של עניין (-d שבב / other_ChIP /) בפסגות MACS2 (למשל, +/- 1 kb עם 25 פחים נ"ב, 2000 -hist -size 25 -ghist):
- מצא את הרומן ומוטיבים המחייבים ידועים קודם לכן, אשר מועשרים בפסגות שיא +/- 100 נ"ב (-size 200). השתמש annotatePeaks.pl למפות מופעי מוטיב ולתכנן צפיפויות מוטיב:
> FindMotifsGenome.pl ChIP_peaks.bed xenTro7 ChIP_motifs / -size 200 -p [# נושאים]
> AnnotatePeaks.pl ChIP_peaks.bed xenTro7 -m motif1.motif> ChIP_peaks.motif1
> AnnotatePeaks.pl ChIP_peaks.bed xenTro7 -m motif1.motif -size 800 -hist 25> motif1.density
הערה: infe תסריט findMotifsGenome.plrs ההעשרה מההשוואה לנבחר באופן אקראי רצפי רקע גנטיים ממוקדת. מוטיב הרומן המועשר ביותר נשמר תחת motif1.motif במתכונת של מטריצת משקל עמדה. הקורא מוזמן לאמת תוצאות אלה עם שיטות דה נובו גילוי מוטיב אחרות כגון cisFinder 22 ומם 23. - סמן בפסגות על ידי חישוב מרחקם לגן הקרוב ביותר ועל ידי קביעת ספירת הקריאה המנורמלת שלהם בתוך 400 חלונות נ"ב (-size 400):
> AnnotatePeaks.pl ChIP_peaks.bed xenTro7 -size 400 שבב / קלט /> ChIP_peaks.genes -d - סכם את הפלט באמצעות פקודת awk הבאה לרשימת המספר (N), מיקום וספירת קריאה מנורמלת של פרט (R) וכל (LR) הפסגות לגן הקרוב ביותר (היעד).
> Awk 'יתחיל {= FS' t '} 7 $> = -5000 && $ 7 <= 1000
{[8 $] N + = 1; R [$ 8] + = 9 $; LR [$ 8] = LR [$ 8] ", ו# 39; 7 $ END "('9 $') '} {לט (בN)
{ההדפסה i ' t' N [i] " t" R [i] " t" substr (LR [i], 2)}} 'ChIP_peaks.genes> ChIP_peaks.summary
הערה: המספר אחרי $ מתייחס למספר העמודה, שייתכן שיצטרכו לשנות כדי להתאים את קובץ ChIP_peaks.genes נוצר בשלב הקודם. מופת סקריפט זה מסננת את פסגות מעבר 5 kb במעלה הזרם ו1 kb במורד הזרם של TSS. 7 $, 8 $ ו$ 9 מתייחסים למרחק לTSS, מזהה הגן וספירת הקריאה המנורמלת לשיא, בהתאמה. - לבצע את הניתוח של מונחי GO מועשרים בין גני המטרה כדלקמן:
- התחל ממשק המשתמש הגרפי של Blast2GO משורת הפקודה באמצעות Java Web Start (javaws) 19.
> Javaws http://blast2go.com/webstart/blast2go1000.jnlp - עקוב אחר ההוראות של המפתחים להעלות הביאורלהגיש לגנים Xenopus (xenTro7.annot) שכנוצר ב1.9.4 וקובץ שטוח של גני המטרה מזוהות. ודא שאותו מזהה הגן נמצא בשימוש בשני הקבצים.
- התחל ממשק המשתמש הגרפי של Blast2GO משורת הפקודה באמצעות Java Web Start (javaws) 19.
- דמיינו פרופילי הכרומטין על ידי הוספה רמה-הראש, קבצי BED (ChIP.bw, Input.bw) ו- (ChIP_peaks.bed) לIGV כמסלולים. נתונים משלימים עם RNA-Seq עוקבים אם זמינים לאותו השלב של התפתחות. שמירת תוצאות כמושב.
- השתמש R פלטפורמות תכנות (www.r-project.org) או MATLAB לתמרן נוסף ולדמיין נתונים שכנוצר מעל. לחלופין, העלילה מערכי נתונים קטנים עם Excel.
10. שבב qPCR לבדיקה שבב ומאשר שבב Seq
- השתמש בפלטפורמה המקוונת Primer3 לתכנן פריימרים המקיפים כ -100 נ"ב DNA ב 60 ° C (T מ ') עבור שני לוקוסי שליטה (שיא ספציפי) והשליליים חיוביים. לאשר ספציפי פריימר באמצעות בסיליקון ו חיפוש PCR מיושם לתוך הדפדפן הגנומי של האוניברסיטה קליפורניה.
- צור עקומה סטנדרטית 8 נקודות של דילולים פי שלושה החל מקלט כ 1% או להשתמש 2 - 8,24 ΔΔC שיטה (T) לכימות של העשרת DNA.
- ביצוע בזמן אמת PCR בtriplicates הטכני עבור כל הדגימות, כלומר, שבב, שליטה ו, אם יהיה בכך צורך, דגימות עקומה סטנדרטית.
- העשרת DNA עלילה כאחוז מה- DNA קלט או כיחס של שבב לעומת מדגם שליטה בשני לוקוסי ביקורת חיוביים ושליליים.
תוצאות
תוצאות שווה ערך לאלו שהוצגו כאן צפויות אם הפרוטוקול מבוצע היטב והנוגדנים בשימוש הוא באיכות כיתה שבב (ראה דיון). פרוטוקול זה מאפשר מיצוי של גרעינים מעוברי Xenopus-קבוע פורמלדהיד וגז יעיל של הכרומטין ידי sonication (איור 1 א-ג). הכרומטין טעון תערוכות הפצת א-סימטרית של שברי DNA בעיקר נע בין 100 ל -1,000 נקודות בסיס והגיעו לשיא בין 300 ל -500 נ"ב (איור 1 ג). 50 pg מינימאלי של DNA immunoprecipitated נדרש כדי להפוך את ספריית שבב Seq לזווג-סוף באינדקס עם מוסיף בגודל דומה DNA (איור 2 א) בהצלחה. הספרייה צריכה להיות נטול במידה רבה של הדימרים מתאם, אשר ניתן לראות על electropherogram בכ -120 נ"ב.
על הרצף-ידי-סינתזה, מראש מעובד-קורא ממופה הגנום (איור 2 ב, ג). בניסוי מוצלח עם X. עוברי tropicalis, בדרך כלל 50 עד 70% מאחת-הסוף קוראים של 40 נ"ב יכולים להיות ממופים באופן ייחודי להרכבת הגנום של v7.1 עם שני חוסר התאמה מקסימאלי. בעוד קלט קורא ליישר די אחיד על פני הגנום, היישור של שבב קורא תוצאות במוספים לגדיל ספציפי כי האגף תכונת הכרומטין של עניין. זאת משום שכל שברים הם רצף מהקצה 5 '(איור 2 ג) 25. הארכת היישור בקריאת כיוון לגודל שבר ממוצע מייצרת פרופילים מדויקים לתכונות הכרומטין בודדות כגון אירועים גורם שעתוק מחייבים. תפוסות DNA אלה מופיעים כפסגות כאשר דמיינו בIGV או כל דפדפן הגנום תואם אחר. מתקשרי שיא כמו MACS משמשים כדי לקבוע את המיקום של הפסגות הללו (איור 3 א). בדרך זו עשרות אלפי אתרי קישור נקבעה בX. tropicalis הגנום לגורמי שעתוק T-box כגון VegT 26. התנסות שבב qPCRמפעלים צריכים לאשר את ההעשרה המקומית שנמצאה על ידי שבב Seq (איור 3).
ניסויי שבב Seq מאפשרים לחקור מאפייני הגנום של תכונות הכרומטין. לדוגמא, חישוב חלוקת הקריאה מעל אלמנטים הגנומי כגון תחילת שעתוק ואתרי סיום עשוי לסמן כל העדפות מרחבי מחייבות סביב גנים (איור 3 ג). באופן דומה, Heatmap של הפצות קריאה במקומות שיא משמשת להשוואת תכונות הכרומטין שונות בקנה מידת הגנום (איור 3D). גורמי שעתוק מסוימים להיקשר רצף במיוחד. ניתוח מוטיב DNA De novo של פסגות שבבסיס הדנ"א הגנומי יכולים לאחזר מידע כוללים מוטיבים מועשרים שיתוף של שיתוף גורמים פוטנציאליים (איור 3E) מסוג זה. הרוב הגדול של גני המטרה להראות תפוסת DNA בנמוך ולא ברמה גבוהה יותר (איור 3F). נראה תכונה ללא קנה מידה זה להיות די נפוץ בקרב trהגורמים וanscription מצביעים על כך שרק חלק קטן של גני המטרה מוסדרים ישירות עם הרלוונטיות ביולוגיות 27,28. הניתוח של תנאים מועשרים GO או תכונות אחרות כגון ביטוי ההפרש של גני המטרה עשויה לחשוף עוד תובנות הפונקציה הביולוגית של תכונת הכרומטין בעובר Xenopus (איור 3G).
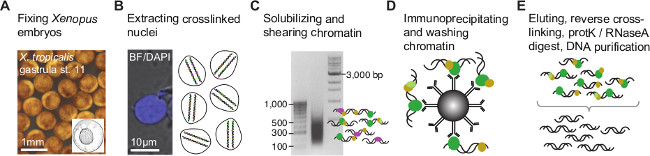
איור 1. הליך immunoprecipitation הכרומטין לעוברי צפרדעים. עוברים () נמצאים בשלב ההתפתחותי של עניין לאגד קוולנטית (קישור צולב) כל חלבונים הקשורים להדנ"א הגנומי-קבוע פורמלדהיד. על המיצוי גרעיני (B), הכרומטין הצולב מפוצל כדי לצמצם את הדנ"א הגנומי מחייב או אתרי שינוי הכרומטין ידי מזעור DN האיגוףרצף (C). בהמשך לכך, שברי הכרומטין הם immunoprecipitated עם נוגדן כיתה שבב להעשיר אלה המכילים epitope של עניין (D). DNA-immunoprecipitated שיתוף הוא פשט את החלבון ומטוהר (E) לפני יצירת ספריית בר השבב לNGS (איור 2). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. הכנת ספריית שבב Seq, רצף-ידי-סינתזה, מיפוי ושיחות שיא. (א) electropherogram מציג ספריית שבב Seq טובה עם תבניות DNA של 250-450 נקודות בסיס. תבניות אלה כרוכות להכניס DNA של העניין מוקף (נ"ב 58) האוניברסלי ומתאם באינדקס (63 נ"ב). (ב) מיליוני אשכולות, עם כל אשכול המכיל תבניות זהות, הם בסיס רצף של בסיס בנוכחות כל ארבעת נוקלאוטידים בעלי fluorophore הפיך, מובחן ומאפייני סיום זהים. תמונות ניאון מעובדות בזמן אמת לקרוא בסיסים מקבילים, שסופו של דבר הם התאספו לקוראים. (C) קורא רק שהמפה ייחודית להגנום Xenopus נשמרות. כפי שכולם שברי רצף מהקצה '5, המיפוי של שבב קורא תוצאות בפסגות גדיל ספציפי כי האגף תכונת הכרומטין של עניין. וכך, למתקשרים שיא לזהות את ההעשרה שמקורו בimmunoprecipitation ולהאריך את קורא לאורך קטע ממוצע למקם במדויק תכונות הכרומטין. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. דוגמא של ניתוח שלאחר רצף-ונתונים להדמיה באמצעות גורם שעתוק T-תיבת zygotic VegT (zVegT). כל קריאת סעיפים המוצגים כאן הם מנורמלים 10 מ'ייחודיים ממופה ולא מיותר קורא. () קטע של פרופיל הגנום של zVegT מחייב בX. עוברי gastrula tropicalis (שלב 11-12.5 לאחר Nieuwkoop וFaber 29). שיא כל, ערימה-מהוארך קורא, מייצג אתר אחד מחייב. פסגות אלה נקראות על ידי MACS2 עם שיעור גילוי שווא (FDR) של פחות מ -1%. כל גן mesp תערוכות zVegT מאוד הפרוקסימלי ובמעלה הזרם מחייב, אבל רק mespa וmespb באים לידי ביטוי בשלב זה (נתוני RNA-Seq 30). (ב) רמות תפוסת DNA של zVegT כפי שנקבעו על ידי שבב qPCR בכמה לוקוסים (כולל לא confi אזור -bound 0.5 kb במעלה הזרם של -actin β)RM ההעשרה הספציפית שנמצאה על ידי שבב Seq. להשוות את התוצאות לmespa עם שיא נקרא (פס אדום) ב (א). רמת תפוסת DNA היא מדמיין כאחוז מקלט עבור שניהם, השבב עם נוגדן VegT (ארנב polyclonal של אלוטיפ IgG) והשבב עם שליטת הנוגדנים (IgG ארנב הרגיל). ברים שגיאה משקפים את סטיית התקן של שני משכפל ביולוגי. (C) Metagene ניתוח מראה zVegT המועדף המחייב (תגים זרקו לפח מעל 25 נ"ב) לאמרגן ביחס לכל אזור גנומי אחר סביב ובתוך גופי גן. (ד) Heatmap תערוכות k-ממוצע רמות (k = 5) תפוסת DNA התקבצו (תגים זרקו לפח מעל 25 נ"ב) של (נתונים שבב Seq 31) zVegT וSmad2 / Smad3 ביחס לכל האזורים מחויבים-zVegT בשלב gastrula. Heatmap היא להיכנס 2 מבוססים ומרוכז בשעה 5 תגים לנ"ב. (E) De novo ניתוח המוטיב מגלה גורם שעתוק הקנונית T-התיבה מחייב מוטיב ב -38% מzVegT-אזורים מחויבים אם ציון המוטיב הבסיסי הוא מנורמל לשיעור גילוי של 5% ברצפי רקע. מפת צפיפות תערוכות ההעשרה הגבוהה ביותר למוטיב T-התיבה במרכז אתרי קישור zVegT, ואילו מוטיב Smad2 / Smad3 מחייב הקנונית כמעט ואינו מועשר. (F) היסטוגרמה מראה רמות תפוסת DNA של zVegT, אשר מחושבות עבור כל גן היעד מכל הפסגות (+/- 200 נ"ב) בין 5 kb במעלה הזרם [-]. ו[ +] 1 kb במורד הזרם של מקביל אתרי תחילת שעתוק (G) 300 גנים למעלה עם הרמות הגבוהות ביותר תפוסת DNA בתוך -5 קילו ו+1 kb הם מועשר לתהליכים ביולוגיים של התפתחות עוברית המוקדמת. אלה GO מונחים עולים בקנה אחד עם התפקוד המשוער של zVegT. FDR מבוסס על בדיקה המדויקת של פישר שני זנב ותיקן לבדיקה מרובה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
הפרוטוקול שלנו מתאר כיצד לבצע ולנתח פרופילי הכרומטין הגנום מעוברי צפרדעים. היא משתרעת על כל צעד מחלבונים cross-linking ללוקוסי אנדוגני in vivo לעיבוד מיליוני כניסות המייצגים אתרים הגנומי מועשרות בסיליקון ו. מכיוון שמספרים גדלים והולכים של טיוטות הגנום זמינים, פרוטוקול זה צריך להיות ישים לאורגניזמים מודל ולא מודל אחרים. הסעיף הניסיוני החשוב ביותר, הקובע פרוטוקול זה מלבד העבודה קודמת 8,31,33,34, הוא ההליך שלאחר הקיבוע-לחלץ גרעינים צולבים. זה מקל solubilisation יעיל הכרומטין וגז וupscaling קל. יחד עם יעילות משופרת של הכנת ספריית פרוטוקול זה מאפשר הבנייה של ספריות שבב Seq גבוהות מורכבות מחצי עד שני מיליון תאים המבטאים את epitope הקשורים הכרומטין של עניין. בניסויים שבב qPCR, כמה עשרה אלף תאים אלה הם בדרך כלל מספיקכדי לבדוק להעשרת DNA באולי שישה לוקוסים הגנומי מובחנים. מספרים אלה הם הערכות שמרניות, אך עשוי להשתנות בהתאם לרמת ביטוי חלבון, איכות נוגדן, cross-linking יעילות, ונגישות epitope. כמדריך, עובר Xenopus אחת מכיל כ -4,000 תאים בשלב אמצע blastula (8.5 לאחר Nieuwkoop וFaber 29), 40,000 תאים בשלב gastrula מאוחר (12) ו100,000 תאים בשלב מוקדם tailbud (20).
זמן הקיבעון המדויק לimmunoprecipitation היעילה צריך להיקבע באופן אמפירי על ידי שבב qPCR (סעיף 10). באופן כללי, פעמים קיבעון יותר נדרשות אם הניסוי כרוך X. laevis עוברים, שלבי התפתחות מוקדמים, ומאפיינים המחייבים DNA חלשים (או עקיפים). עם זאת, זה לא מומלץ תיקון עוברי Xenopus יותר מ -40 דקות, או עיבוד נוסף עוברי מכפי שצוין (סעיף 3), כגז הכרומטין הופך להיות פחות יעיל. חשוב לאלהשתמש בכל גליצין לאחר הקיבוע כצעד משותף זה למרווית פורמלדהיד יכול לעשות מיצוי גרעיני מעוברי חלמון עשיר מאוד קשים. נכון לעכשיו, הסיבה לכך אינה ידועה. זה מתקבל על הדעת כי adduct פורמלדהיד-גליצין מגיב נוסף עם N-מסוף אמינו-קבוצות או שאריות ארגינין 35.
הנוגדן הוא מפתח לכל ניסוי שבב ובקרות מספיקות צריכה להתבצע כדי להראות את ייחודה לepitope של עניין (ראה הנחיות בLandt et al. 36). אם אין נוגדני כיתה שבב נגיש, כניסתה של מקביל חלבוני היתוך מתויג epitope עשויה להיות חלופה לגיטימית כחלבונים אלה יכולים לכבוש endogeneous אתרי קישור 37. במקרה זה, עובר uninjected הם הטובים ביותר לשימוש כביקורת שלילית ולא שבב עם סרום שאינו ספציפי. אסטרטגיה זו יכולה גם להיות מיושמת אם החלבון של העניין בא לידי ביטוי ברמות נמוכות וכתוצאה מכך עני ההתאוששות של enriDNA CHED.
כלהכנת ספריות שבב Seq, בגלל הכמות הנמוכה של ה- DNA בשימוש, מומלץ לבחור בנהלים המפחיתים את מספר צעדי ניקוי ולשלב תגובות כדי לשמור על כל אובדן של DNA במינימום. המתאמים ופריימרים צריכים להיות תואם עם רצף זמנית ופלטפורמת NGS (ראו טבלה של חומרים / ציוד ספציפי). אם אתה משתמש Y-מתאמים (המכיל נשק חד-גדילים ארוכים), זה הוא קריטי מראש להגביר את הספרייה עם 04:57 סבבים של PCR לפני מוסיף DNA בחירה בגודל (למשל., 100 עד 300 נ"ב) על ידי ג'ל אלקטרופורזה. קצוות חד-גדילים לגרום שברי DNA להעביר הטרוגני. מבחנים שנערכו עם כמויות שונות של DNA קלט (למשל, 0.1, 0.5, 1, 2, 5, 10 ו -20 ng) מומלצים לקבוע את המספר הכולל של מחזורי PCR (פחות או שווה ל -18 מחזורים) הנדרש כדי להפוך את גודל ספריית -selected של 100 עד 200 ng. צמצום מספר מחזורי PCR הופך את הרצף של redundant קורא פחות סביר. חרוזים קיבוע הפיכים שלב מוצק טובים לנקות ריאגנטים לשחזר ביעילות את ה- DNA של עניין ובאמינות להסיר כל מתאמים והדימרים חופשיים מקשירה ותגובות PCR.
במונחים של מספר, סוג ואורך של קורא, סביב 20-30,000,000 חד-הסוף קורא של 36 נ"ב הוא מספיק עבור רוב ניסויי שבב Seq כדי לכסות את הגנום Xenopus השלם עם עומק מספיק. מכונות NGS הנפוצות ביותר הן מסוגלים לעמוד בקריטריונים אלה באופן שוטף. עם זאת, זה עשוי להיות מועיל כדי להגדיל את מספר קורא אם הפצות רחבות של קורא צפויות, כפי שנצפה בשינויים היסטון, ולא בפסגות חדות. בניסויים שבב Seq רבים, ניתן ונקווה 4-5 ספריות שונות צמודות ורצף בנתיב תא זרימה חד באמצעות מכונה NGS עתיר ביצועים. לפעמים כן, מומלץ להאריך את אורך הקריאה ורצף בשני הקצוות של תבנית ה- DNA (לזווג-end) כדי להגדיל את mappability wניתוח תרנגולת הכרומטין בתוך אזורים הגנומי חוזר על עצמו.
פרוטוקול זה יושם בהצלחה במגוון רחב של תכונות הכרומטין כגון גורמי שעתוק, מתווכי איתות ושינויי היסטון לאחר translational. עם זאת, עובר לרכוש תואר הולך וגדל של ההטרוגניות סלולרית כפי שהם מפתחים ופרופילי הכרומטין להיות קשים יותר לפרש. צעדים מבטיחים נעשו בארבידופסיס ותסיסנית לנופי הכרומטין רקמות ספציפי פרופיל על ידי מיצוי גרעיני סוג ספציפי תא 38,39. הפרוטוקול שלנו כולל שלב חילוץ גרעיני, אשר יכול לסלול את הדרך לרקמות ספציפיות שבב Seq בעוברים אחרים.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
We thank Chris Benner for implementing the X. tropicalis genome (xenTro2, xenTro2r) into HOMER and the Gilchrist lab for discussions on post-sequencing analysis. I.P. assisted the GO term analysis. G.E.G and J.C.S. were supported by the Wellcome Trust and are now supported by the Medical Research Council (program number U117597140).
Materials
| Name | Company | Catalog Number | Comments |
| 1/16 inch tapered microtip | Qsonica | 4417 | This microtip is compatible with Sonicator 3000 from Misonix and Q500/700 from Qsonica. |
| 8 ml glass sample vial with cap | Wheaton | 224884 | 8 ml clear glass sample vials for aqueous samples with 15-425 size phenolic rubber-lined screw caps. |
| Adaptor | e.g., IDT or Sigma | NA | TruSeq universal adaptor,
AATGATACGGCGACCACCGAG ATCTACACTCTTTCCCTACAC GACGCTCTTCCGATC*T. TruSeq indexed adaptor, P-GATCGGAAGAGCACACGTC TGAACTCCAGTCAC ‐NNNNNN‐ ATCTCGTATGCCGTCT TCTGCTT*G. *, phosphorothioate bondphosphate group at 5' end. NNNNNN, index (see TruSeq ChIP Sample Preparation Guide for DNA sequence). Order adaptors HPLC purified. Adaptors can be prepared by combining equimolar amounts (each 100 µM) of the universal and the indexed adaptor and cooling them down slowly from 95 °C to room temperature. Use 1.5 pmol per ng of input DNA. Store at -20 °C. |
| b2g4pipe (software) | Blast2GO | non-commercial | http://www.blast2go.com/data/blast2go/b2g4pipe_v2.5.zip |
| BLAST+ (software) | Camacho et al. | non-commercial | http://blast.ncbi.nlm.nih.gov/Blast.cgi?PAGE_TYPE=BlastDocs& DOC_TYPE=Download |
| Bowtie (software) | Langmead et al. | non-commercial | http://bowtie-bio.sourceforge.net/index.shtml |
| cisFinder (software) | Sharov et al. | non-commercial | http://lgsun.grc.nia.nih.gov/CisFinder/ |
| Chip for capillary electrophoresis | Agilent Technologies | 5067-1504 | Load this chip with 1 µl DNA for library quality control. Store at 4 °C. |
| Chip-based capillary electrophoresis system | Agilent Technologies | G2940CA | The Agilent 2100 BioAnalyzer is used to check the quality of ChIP-Seq libraries. Keep reagents at 4 °C. |
| ChIP-Seq library preparation kit (KAPA Hyper Prep Kit) | Kapa Biosystems | KK8504 | Kit contains KAPA end repair and A-tailing enzyme mix, end Repair and A-tailing buffer, DNA ligase, ligation buffer, KAPA HiFi HotStart ReadyMix (2X), and KAPA library amplification primer mix (10X) (see also PCR primers). Adaptors are not included. Store at -20 °C. |
| ChIP-Seq library preparation kit (alternative, ThruPLEX-FD Prep Kit) | Rubicon Genomics | R40048 | Kit uses their own stem-loop adaptors and primers. This kit eliminates intermediate purification steps and is as sensitive as the KAPA Hyper Prep Kit. Store at -20 °C. |
| Cluster3 (software) | de Hoon et al. | non-commercial | http://bonsai.hgc.jp/~mdehoon/software/cluster |
| FastQC (software) | Simon Andrews | non-commercial | http://www.bioinformatics.babraham.ac.uk/projects/fastqc |
| Fluorometer | life technologies | Q32866 | Qubit 2.0 Fluorometer |
| Fluorometer reagents | life technologies | Q32851 | The kit provides concentrated assay reagent, dilution buffer, and pre-diluted DNA standards for the Qubit fluorometer. Store DNA standards at 4 °C, buffer and dye at room temperature. |
| Formaldehyde | Sigma | F8775-4X25ML | Formaldehyde solution, for molecular biology, 36.5-38% in H2O, stabilised with 10-15% methanol. Store at room temperature. CAUTION: Formaldehyde is corrosive and highly toxic. |
| Gel (E-Gel EX agarose , 2%) | life technologies | G4010 | Pre-cast gel with 11 wells, openable format. Leave one lane between ladder and library empty to avoid cross-contamination. Store gels at room temperature. |
| Gel electrophoresis system | life technologies | G6465 | E-Gel iBase and E-Gel Safe Imager combo kit for size-selecting ChIP-Seq libraries. |
| Gel extraction kit | Qiagen | 28706 | Store all reagents at room temperature. Use 500 µl of QG buffer per 100 mg of 2% agarose gel slice to extract DNA. Use MinElute columns (from MinElute PCR purification kit) to elute DNA twice. |
| HOMER (software) | Chris Benner | non-commercial | http://homer.salk.edu/homer/index.html |
| Hybridization oven | Techne | FHB1D | Hybridizer HB-1D |
| IGV (software) | Robinson et al. | non-commercial | http://www.broadinstitute.org/igv/home |
| Illumina CASAVA-1.8 quality filter (software) | Assaf Gordon | non-commercial | http://cancan.cshl.edu/labmembers/gordon/fastq_illumina_filter |
| Java TreeView (software) | Alok Saldanha | non-commercial | http://jtreeview.sourceforge.net |
| Laboratory jack | Edu-Lab | CH0642 | This jack is used to elevate sample in sound enclosure for sonication. |
| Ladder, 100 bp | New England BioLabs | N3231 | Keep 1x solution at room temperature. Store stock at -20 °C. |
| Ladder, 1 kb | New England BioLabs | N3232 | Keep 1x solution at room temperature. Store stock at -20 °C. |
| Low-retention 1.5-ml microcentrifuge tubes | life technologies | AM12450 | nonstick, RNase-free microfuge tubes, 1.5 ml |
| MACS2 (software) | Tao Liu | non-commercial | https://github.com/taoliu/MACS |
| Magnetic beads | life technologies | 11201D | These Dynabeads are superparamagnetic beads with affinity purified polyclonal sheep anti-mouse IgG covalently bound to the bead surface. Store at 4 °C. |
| Magnetic beads | life technologies | 11203D | These Dynabeads are superparamagnetic beads with affinity purified polyclonal sheep anti-rabbit IgG covalently bound to the bead surface. Store at 4 °C. |
| Magnetic beads | life technologies | 10001D | These Dynabeads are superparamagnetic beads with recombinant protein A covalently bound to the bead surface. Store at 4 °C. |
| Magnetic beads | life technologies | 10003D | These Dynabeads are superparamagnetic beads with recombinant protein G covalently bound to the bead surface. Store at 4 °C. |
| Magnetic rack | life technologies | 12321D | DynaMag-2 magnet |
| MEME | Bailey et al. | non-commercial | http://meme.nbcr.net/meme/ |
| Na3VO4 | New England BioLabs | P0758 | Sodium orthovanadate (100 mM) is a commonly used general inhibitor for protein phosphotyrosyl phosphatases. Store at -20 °C. |
| NaF | New England BioLabs | P0759 | Sodium fluoride (500 mM) is commonly used as general inhibitor of phosphoseryl and phosphothreonyl phosphatases. Store at -20 °C. |
| NGS machine | Illumina | SY-301-1301 | Genome Analyzer IIx |
| NGS machine (high performance) | Illumina | SY-401-2501 | HiSeq |
| Normal serum (antibody control) | Santa Cruz Biotechnology | sc-2028 | Use as control for goat polyclonal IgG antibodies in ChIP-qPCR experiments. Store at 4 °C. |
| Normal serum (antibody control) | Santa Cruz Biotechnology | sc-2025 | Use as control for mouse polyclonal IgG antibodies in ChIP-qPCR experiments. Store at 4 °C. |
| Normal serum (antibody control) | Santa Cruz Biotechnology | sc-2027 | Use as control for rabbit polyclonal IgG antibodies in ChIP-qPCR experiments. Store at 4 °C. |
| Nucleic acid staining solution | iNtRON | 21141 | Use RedSafe nucleic acid staining solution at 1:50,000. Store at room temperature. |
| Orange G | Sigma | O3756-25G | 1-Phenylazo-2-naphthol-6,8-disulfonic acid disodium salt. Store at 4 °C. |
| PCR primers | e.g., IDT or Sigma | Primers to enrich adaptor-ligated DNA fragments by PCR: AATGATACGGCGACCACCGA*G and CAAGCAGAAGACGGCATACGA*G, phosphorothioate bond. Primers designed by Ethan Ford. Combine primers at 5 µM each. Use 5 µl in a 50 µl PCR reaction. Store at -20 °C. | |
| MinElute PCR purification kit | Qiagen | 28006 | for purification of ChIP-qPCR and shearing test samples. Store MinElute spin columns at 4 °C, all other buffers and collection tubes at room temperature. |
| Phenol:chloroform:isoamyl alcohol (25:24:1, pH 7.9) | life technologies | AM9730 | Phenol:Chloroform:IAA (25:24:1) is premixed and supplied at pH 6.6. Use provided Tris alkaline buffer to raise pH to 7.9. Store at 4 °C. CAUTION: phenol:chloroform:isoamyl alcohol is corrosive, highly toxic and combustible. |
| Primer3 (software) | Steve Rozen & Helen Skaletsky | non-commercial | http://biotools.umassmed.edu/bioapps/primer3_www.cgi |
| Protease inhibitor tablets | Roche | 11836170001 | cOmplete, Mini, EDTA-free. Use 1 tablet per 10 ml. Store at 4 °C. |
| Protease inhibitor tablets | Roche | 11873580001 | cOmplete, EDTA-free. Use 1 tablet per 50 ml. Store at 4 °C. |
| Proteinase K | life technologies | AM2548 | proteinase K solution (20 µg/µl). Store at -20 °C. |
| RNase A | life technologies | 12091-039 | RNase A (20 µg/µl). Store at room temperature. |
| Rotator | Stuart | SB3 | Rotator SB3 |
| SAMtools (software) | Li et al. | non-commercial | http://samtools.sourceforge.neta |
| Solid phase reversible immobilisation beads | Beckman Coulter | A63882 | The Agencourt AMPure XP beads are used to minimise adaptor dimer contamination in ChIP-Seq libraries. Store at 4 °C. |
| Sonicator 3000 | Misonix/Qsonica | Newer models are now available. Q125, Q500 or Q700 are all suitable for shearing crosslinked chromatin. | |
| Sound enclosure | Misonix/Qsonica | optional: follow the manufacturer's recommendation to obtain the correct sound enclosure. | |
| Thermomixer | eppendorf | 22670000 | Thermomixer for 24 x 1.5 mL tubes. Precise temperature control from 4 °C above room temperature to 99 °C. |
References
- Gilmour, D. S., Lis, J. T. Detecting protein-DNA interactions in vivo: distribution of RNA polymerase on specific bacterial genes. Proc Natl Acad Sci U S A. 81 (14), 4275-4279 (1984).
- Gilmour, D. S., Lis, J. T. In vivo interactions of RNA polymerase II with genes of Drosophila melanogaster. Mol Cell Biol. 5 (8), 2009-2018 (1985).
- Solomon, M. J., Larsen, P. L., Varshavsky, A. Mapping protein-DNA interactions in vivo with formaldehyde: evidence that histone H4 is retained on a highly transcribed gene. Cell. 53 (6), 937-947 (1988).
- Ren, B., et al. Genome-wide location and function of DNA binding proteins. Science. 290 (5500), 2306-2309 (2000).
- Johnson, D., Mortazavi, A., Myers, R., Wold, B. Genome-wide mapping of in vivo protein-DNA interactions. Science. 316 (5830), 1497-1502 (2007).
- Hellsten, U., et al. The genome of the Western clawed frog Xenopus tropicalis. Science. 328 (5978), 633-636 (2010).
- Lee, T. I., Johnstone, S. E., Young, R. A. Chromatin immunoprecipitation and microarray-based analysis of protein location. Nature Protocols. 1 (2), 729-748 (2006).
- Blythe, S. A., Reid, C. D., Kessler, D. S., Klein, P. S. Chromatin immunoprecipitation in early Xenopus laevis embryos. Dev Dyn. 238 (6), 1422-1432 (2009).
- Gentsch, G. E., Smith, J. C. Investigating physical chromatin associations across the Xenopus genome by chromatin immunoprecipitation. Cold Spring Harb Protoc. 2014 (5), (2014).
- Ubbels, G. A., Hara, K., Koster, C. H., Kirschner, M. W. Evidence for a functional role of the cytoskeleton in determination of the dorsoventral axis in Xenopus laevis eggs. J Embryol Exp Morphol. 77, 15-37 (1983).
- Langmead, B., Trapnell, C., Pop, M., Salzberg, S. L. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome. Genome Biol. 10 (3), R25 (2009).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Heinz, S., et al. Simple combinations of lineage-determining transcription factors prime cis-regulatory elements required for macrophage and B cell identities. Mol Cell. 38 (4), 576-589 (2010).
- Zhang, Y., et al. Model-based analysis of ChIP-Seq (MACS). Genome Biol. 9 (9), R137 (2008).
- Robinson, J. T., et al. Integrative genomics viewer. Nat Biotechnol. 29 (1), 24-26 (2011).
- Thorvaldsdottir, H., Robinson, J. T., Mesirov, J. P. Integrative Genomics Viewer (IGV): high-performance genomics data visualization and exploration. Brief Bioinform. 14 (2), 178-192 (2013).
- Imoto, S., Nolan, J., Bioinformatics Miyano, S. . 20 (9), 1453-1454 (2004).
- Camacho, C., et al. BLAST+: architecture and applications. BMC Bioinformatics. 10, 421 (2009).
- Conesa, A., et al. Blast2GO: a universal tool for annotation, visualization and analysis in functional genomics research. Bioinformatics. 21 (18), 3674-3676 (2005).
- Sive, H., Grainger, R., Harland, R. . Early development of Xenopus laevis: A laboratory manual. , (2000).
- Chen, Y., et al. Systematic evaluation of factors influencing ChIP-seq fidelity. Nat Methods. 9 (6), 609-614 (2012).
- Sharov, A. A., Ko, M. S. H. Exhaustive search for over-represented DNA sequence motifs with CisFinder. DNA Res. 16 (5), 261-273 (2009).
- Bailey, T. L., et al. MEME SUITE: tools for motif discovery and searching. Nucl Acids Res. 37 (2), W202-W208 (2009).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Park, P. J. ChIP-seq: advantages and challenges of a maturing technology. Nat Rev Genet. 10 (10), 669-680 (2009).
- Gentsch, G. E., et al. In vivo T-box transcription factor profiling reveals joint regulation of embryonic neuromesodermal bipotency. Cell Rep. 4 (6), 1185-1196 (2013).
- Barabasi, A. L., Oltvai, Z. N. Network biology: understanding the cell's functional organization. Nat Rev Genet. 5 (2), 101-113 (2004).
- Biggin, M. D. Animal transcription networks as highly connected, quantitative continua. Dev Cell. 21 (4), 611-626 (2011).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin): a systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1994).
- Akkers, R. C., et al. A hierarchy of H3K4me3 and H3K27me3 acquisition in spatial gene regulation in Xenopus embryos. Dev Cell. 17 (3), 425-434 (2009).
- Yoon, S. J., Wills, A. E., Chuong, E., Gupta, R., Baker, J. C. . HEB and E2A function as SMAD/FOXH1 cofactors. Genes Dev. 25 (15), 1654-1661 (2011).
- Jallow, Z., Jacobi, U. G., Weeks, D. L., Dawid, I. B., Veenstra, G. J. Specialized and redundant roles of TBP and a vertebrate-specific TBP paralog in embryonic gene regulation in Xenopus. Proc Natl Acad Sci U S A. 101 (37), 13525 (2004).
- Buchholz, D. R., Paul, B. D., Shi, Y. -. B. Gene-specific changes in promoter occupancy by thyroid hormone receptor during frog metamorphosis. Implications for developmental gene regulation. J Biol Chem. 280 (50), 41222-41228 (2005).
- Wills, A. E., Guptaa, R., Chuonga, E., Baker, J. C. Chromatin immunoprecipitation and deep sequencing in Xenopus tropicalis and Xenopus laevis. Methods. 66 (3), 410-421 (2014).
- Metz, B., et al. Identification of formaldehyde-induced modifications in proteins: reactions with model peptides. J Biol Chem. 279 (8), 6235-6243 (2004).
- Landt, S. G., et al. ChIP-seq guidelines and practices of the ENCODE and modENCODE consortia. Genome Res. 22 (9), 1813-1831 (2012).
- Mazzoni, E. O., et al. Embryonic stem cell-based mapping of developmental transcriptional programs. Nat Methods. 8 (12), 1056-1058 (2011).
- Deal, R. B., Henikoff, S. A simple method for gene expression and chromatin profiling of individual cell types within a tissue. Dev Cell. 18 (6), 1030-1040 (2010).
- Bonn, S., et al. Tissue-specific analysis of chromatin state identifies temporal signatures of enhancer activity during embryonic development. Nat Genet. 44 (2), 148-156 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved