A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח תזרים Cytometric של תא הטבעי Killer ממס פעילות דם מלא אנוש
In This Article
Summary
This work describes an advanced workflow for the accurate and fast determination of NK (Natural Killer) cell count and NK cell cytotoxicity in human blood samples.
Abstract
cytotoxicity תא NK הוא מדד בשימוש נרחב כדי לקבוע את ההשפעה של התערבות חיצונית על תפקוד תאי NK. עם זאת, את הדיוק ואת השחזור של assay זה יכולים להיחשב יציב, אם בשל טעויות של המשתמש או בגלל הרגישות של תאי NK כדי מניפולציה ניסויית. כדי למנוע בעיות אלה, עבודה המפחיתה אותם למינימום הוקמה ומוצגת כאן. לשם המחשה, השגנו דגימות דם, בנקודות זמן שונות, מן הרצים (n = 4) שהוגשו התקף אינטנסיבי של פעילות גופנית. ראשית, תאי NK מזוהים בו זמנית ומבודד באמצעות תיוג CD56 ומיון מגנטי מבוסס, ישירות דם שלם מ קטנה כמו למיליליטר אחד. תאי NK המסודרים יוסרו מכל נוגדנים מגיבים או מכסה. הם ניתן לספור על מנת להקים ספירת תאי NK מדויקת למיליליטר דם. שנית, תאי NK המסודרים (תאי effectors או E) ניתן לערבב עם 3,3'-Diotadecyloxacarbocyanine פרכלורט (DIO) מתויג K562 תאים (תאים היעד או T) לעבר assay-אופטימלית 1: 5 T: יחס E, ונותחו באמצעות cytometer זרימה הדמיה המאפשרת הדמיה של כל אירוע חיסול כל חיובי כוזב או שלילי שגוי (כגון כפילויות או תאי מפעיל). עבודה זו יכולה להסתכם בערך 4 שעות, ומאפשרת תוצאות יציבות מאוד גם כאשר עובדים עם דגימות אנושיות. תאריך הכניסה, צוותות מחקר יכול לבדוק התערבויות ניסיון כמה בבני אדם, ולהשוות מדידות על פני מספר נקודות זמן מבלי להתפשר על השלמות של הנתונים.
Introduction
תאי הרג טבעיים הם מרכיב חיוני של מערכת החיסון המולדת. למרות שהם מוסדרים מאוד, יש להם את היכולת לזהות ולסלק תאים חריגים באמצעות מגע תא אל תא וללא לפני ההפעלה 1. ככזה, הם יוצרים קו מהיר של הגנה מפני זיהומים. אינטנסיבי תרגיל, במיוחד, מוכיח לדכא את המערכת החיסונית 2 זמני, 3, 4, 5. תאי NK הם רגישים במיוחד את האפקט הזה 4, 6, 7, ובכך נפתח חלון של רגישות משופרת באופן יעיל למחלות. לפיכך, במחקר של התערבויות לפני, במהלך או אחרי פעילות גופנית אינטנסיבית במטרה להפחית את השפעתה על תפקוד תא NK הוא בעלת עניין מיוחד עבור רווחתם של ספורטאים-תחרויות פוסט.
= "jove_content"> עם זאת, המחקר של התערבויות כאלה מסתבך בשל גורמים רבים: 1) תאי NK הם דלילים 8, בסביבות 1% של תא תא דם לבן; 2) תאי NK רגישים מאוד ללחץ ולהסתמך על חשיפה מתמדת בתנאים פיסיולוגיים להישאר קיימא ויציב במהלך ניסויים; מבחני תקן 3) לקבוע cytotoxicity תא NK, כגון הדרגתי Ficoll 9 ולשחרר מבחנים 10, הם אמינים ובלתי עקביים. ההשתנות הטבועה של דגימות אנושיות רק תחריף את הנושאים הללו. דגימות אנושיות טריות שנאספו במהלך התערבויות למדי מוסדרות וקשים להשיג, לפחות בהשוואת דגימות מן החי או שורות תאים הונצחו. פעולה זו מפחיתה הזדמנויות לשחזר ניסויים או להוספת משתתפים עוקבת המחקר להגיע ספי סטטיסטיים מובהקים. ביחד, הנושאים הללו תומכים בצורך פרוטוקול יעיל המאפשר FOr היא תפוקה גבוהה ניתוח אמינות גבוהה של פעילות ממס תא NK בדגימות אדם.
הקמנו עבודה המקצרת את הזמן הדרוש כדי לזהות, לבודד תאי NK מבחן מהדם האנושי כולו תוך מזעור החשיפה גורמים חיצוניים. השיטה מייעלת את השימוש בשני מכשירים, סדרן תא מגנטי מבוסס וזרימת הדמית cytometer, וחולצת assay הספציפי, אופטימיזציה: יחס E כדי לאפשר זיהוי של ירידות או עליות של cytotoxicity תא NK.
Protocol
הערה: כל הנהלים איסוף דם נערכו בהתאם להנחיות שנקבעו על ידי אוניברסיטת מדינת האפלצ'ים (ASU) הדירקטוריון סקירה מוסדיים (IRB).
1. איסוף דם מלא
- שיהיה לך phlebotomist מוסמך להקיז דם על פי הנחיות של ארגון הבריאות העולמי.
- להקיז דם לתוך צינור איסוף דם אחד 4 מ"ל המכיל חומצה די-אשלגן Ethylenediaminetetraacetic (K 2 EDTA). היפוך צינור איסוף דם על פי הוראות היצרן. שמור צינור איסוף הדם בטמפרטורת החדר על כיסא נדנדה הספסל העליון עד ההפרדה.
2. הכנת תאי יעד שכותרתו DIO
- לגדול K562 התאים השלם Iscove של Modified מדיה של Dulbecco (IMDM) השלימו עם 10% בסרום שור עוברית (FBS) ו סטרפטומיצין פניצילין 1% במשך כמה שבועות לפני assay כדי להבטיח את בריאותם של תאים. התאם את התרכיזיםיון של תאים עד 3 x 10 5 תאים / מ"ל יומי באמצעות השלמת תא לספור מעבר עוקבות של תאים. בצע שינוי תקשורת מלא כל 2 עד 3 ימים.
- ביום של assay, לבצע ספירת תאים באמצעות 1: hemocytometer 1.
- הסר 10 μL מהבקבוק K562 ומקום לתוך 1.5 צינור מ"ל.
- הוסף 10 μL של צבע כחול trypan לתוך הצינור 1.5 מ"ל זהה עבור גורם לדילול של 1: 1.
- צינור קפיצי בעדינות לתערובת K562 תאים Trypan צבע כחול.
- אפשר לצבוע בכחול תא-trypan K562 כדי לדגור במשך 1 דקות בטמפרטורת החדר.
- סור 15 μL של תאי K562 מוכתמים מצינור.
- פיפטה על hemocytometer עבור ספירת תאים.
- ספירת תאים בכיכרות הפינתית וכן בריבוע האמצעי עבור סכום כולל של חמישה ריבועים.
- חישוב ספירת תאים באמצעות המשוואה:
סה"כ תאים / מ"ל = סה"כ תאים נספר X (גורם לדילול / מספר ריבועים) X 10,000 / מ"ל
- Resuspend K562 תאי יעד בצפיפות סופית של 1 x 10 מיליליטר 6 תאים / במדיום תרבות IMDM החופשית בסרום.
- עבור תאים היעד K562 בלא כתם, להוסיף 10 מ"ל של תאים היעד K562 לאחד 15 צינור מ"ל בצפיפות של 1 x 10 6 תאים / מ"ל עבור סכום כולל של 10 x 10 6 תאים K562. מניחים לתוך 37 ° C חממה עם 5% CO 2 עד מוכן לשימוש.
- עבור תאים היעד DIO מוכתם K562, להוסיף 10 מ"ל של K562 מטרות התאים שפופרת 15 מ"ל אחד בצפיפות של 1 x 10 6 תאים / מ"ל עבור סכום כולל של 10 x 10 6 תאים K562.
- הוסף 1 μL של Dio פתרון התא תיוג לכל מ"ל של ההשעיה תא צינור 15 מ"ל המיועדים מכתים DIO מערבולת בעדינות. לדוגמה, להוסיף 10 μL של פתרון התא תיוג Dio עד 10 x 10 6 K562 תאים / מ"ל בהיקף של 1 x 10 6 תאים / מ"ל.
- דגירה פתרון K562-DIO במשך 20 דקות ב 37 מעלות צלזיוס עם 5% CO 2 בתוך שפופרת 15 מ"ל.
- לעקוב אחרing הדגירה, להוסיף 3 מ"ל של תמיסת מלח שנאגרו פוספט בטמפרטורת החדר (PBS) פתרון K562-DIO המכיל צינור 15 מ"ל.
- צנטריפוגות במשך 10 דקות ב 135 XG בטמפרטורת החדר.
- מוציאים בזהירות supernatant מבלי להפריע גלולה התא עם טפטפת נפח מתכוונן μl 1,000.
- הוסף 10 מ"ל של IMDM טרי גלולה התא המכיל צינור 15 מ"ל.
- בעדינות צינור מערבולת כדי resuspend התאים.
- חזור על שלבים 2.7 כדי 2.10 עוד פעמיים.
- חנות תאים בתוך 37 ° C חממה עם 5% CO 2 עד מוכן לשימוש.
הערה: ניתן לאחסן תאים בחממה במשך עד 24 שעות אבל עדיף להשתמש בהם באותו יום.
3. הכנת בקרות
- מעבירים את הבאים לתוך צינורות נפרדים שכותרתו כראוי 1.5 מ"ל:
- הוספת 500 μL של IMDM טרי המכיל resuspended שכותרתו DIO K562 תאים לתוך "חיובי כפול" שכותרתו 1.5 צינור מ"ל.
- הוספת 500 μL של IMDM טרי המכיל resuspended Dio שכותרתו K562 תאים לתוך "Dio רק" שכותרתו 1.5 צינור מ"ל.
- הוספת 500 μL של IMDM טרי המכיל תאים K562 ללא תווית resuspended לתוך "יודיד Propidium (PI) בלבד 'שכותרתו צינור 1.5 מ"ל.
- מניח את הזוגי החיובי PI רק צינורות באמבט מי C ° 55 במשך 5 דקות.
- לאחר 5 דקות שחלף, להסיר צינורות ולנגב עם 70% אתנול.
- הוסף 10 ליטר של PI אל הזוגי החיובי PI רק 1.5 צינורות מיליליטר.
- מניח את כל בקרות תא המטרה השלוש K562 בחממה ב 37 מעלות צלזיוס למשך 30 דקות.
- לאחר דגירת 30 דקות שחלף, כל צנטריפוגות השלוש שולטת תא מטרת K562 עבור 2 דקות ב 163 x ז.
- מוציאים בזהירות supernatant מבלי להפריע גלולה התא.
- Resuspend כל שליטה עם 20 μL של תקשורת תרבית תאים הטריה IMDM, ולהשאיר את 37 ° C חממה עם 5% CO 2 לפחות30 דקות עבור אות DIO אופטימלית.
הערה: בקרה מוכנה כעת שיופעל באמצעות זרימת הדמית cytometer.
4. הפרדה אוטומטית תא NK
- הפעל מפריד תא ולאפשר המחזור הזנק לסיים.
- ודא שכל תאורות בקבוקי הנוזל ירוקות ושהבקבוק פסולת ריק.
- השג מתלה צינור מ"ל 15 בטמפרטורת החדר.
הערה: בחירה הוא מבוסס על כרכים מדגמים. לדוגמה, עבור נפח פחות מ -3 מ"ל להשתמש מתלה צינור 15 מ"ל ובמשך יותר נפח 3 מ"ל להשתמש מתלה צינור מ"ל 50. - דוגמיות לייבל בהתאם (חזור לדגימה / משתתף): משתתף 1 כל דגימת דם; חלק שלילי משתתף 1; משתתף 1 חלק חיובי.
- בעדינות פיפטה 1.5 מ"ל של דם מלא משלב 1.2 לתוך "דם מדגם כללי" צינור 15 מ"ל.
- מניחים שכותרתו כראוי 15 מ"ל צינור "כל דגימת דם" משלב 4.5 ומסומן 15 מ"ל "שבר שלילי" ו"חיובי הפרקציה" צינורות משלב 4.4 מתלה צינור. השתמש מתל מדגם thefollowing הגדרה: בטור א '(R1): כל דגימת דם, שורה (R2) B: שלילית, חלק ללא תווית, שורה (R4) C: חיובית, חלק שכותרתו מגנטית.
- הכנס את המתלה מפריד על MiniSampler עבור autolabeling.
- בחר "מגיב" בתפריט ולהאיר את המיקום שאליו הבקבוקון יוצב המדף המפריד.
- בחר "קרא מגיב" כדי להפעיל את קורא קוד 2D.
- מניחים את הצנצנת מגיב המתאים מול הקורא קוד 2D בין 0.5-2.5 ס"מ מכיסוי קורא ברקודים.
הערה: לדוגמה, מגיב הדרוש להפרדת תאים נ"ח היא CD56. - החזק בקבוקון מגיב בזווית מול קורא קוד 2D לקריאה אופטימלית.
- מניח את הצנצנת מגיב למצב המתלה מפריד הנכון.
- סמן את העמדות הרצויות תחת לשונית ההפרדה על המסך.
- מתפריט משנה התיוג, להקצות auתוכנית tolabeling.
- הקצה את microbeads CD56 מגיב תא ההפרדה כדי לצבור עמדות 1, 2, 3, ו -4.
- בחר את תוכנית ההפרדה "posselwb".
- בחר "לשטוף" את התוכנית לשטוף.
- הכנס נפח דגימה של 1,500 μL בתת-תפריט "Volume" באמצעות לוח המקשים המספרי.
- בחר באפשרות "Enter" בלוח המקשים.
- בחר "הפעל" כדי להתחיל את הפרדת התא.
- בחר "אישור" כדי לאשר חיץ מספיק זמין לעיבוד כל הדגימות.
5. הפרדת Cell בעקבות Cell Count NK
- מייד לאחר הפרדת תא עם מפריד התא, לאחזר את השבר החיובי. השאירו בטמפרטורת החדר. חלק זה כולל את אוכלוסיית תאי NK הטהורה הרצויה.
- עבור כל דגימה בודדת, לבצע ספירת תאים באמצעות hemocytometer לפי שלב 2.2.
- לאחר חישובים, להקליט את ספירת התאים.
6. הכנת דוגמאות Assay Cytotoxicity
- להכין תווית 1.5 צינורות מ"ל עבור כל דגימה / משתתף בהתאם.
- פיפטה הרצויה יחס של תאי NK ותאי K562-הנקרא DIO לתוך צינור אחד.
הערה: לדוגמה, היחס הרצוי של תאי יעד K562 ותא מפעיל NK הוא 1: 5. - צנטריפוגה במשך 5 דקות ב g 135 x.
- מוציאים בזהירות supernatant מבלי להפריע גלולה התא.
- Resuspend NK-Dio שכותרתו תערובת תאי K562 ב 500 μL של תקשורת תא NK ללא אינטרלויקין -2 (IL-2) ו 2-mercaptoethanol (2-ME) (מדיה NK תרבית תאים שלמה).
ההערה: המדיה תרבית תאים השלמה נ"ח היא מינימום הכרחי בינוני נשר עם סודיום ביקרבונט, ללא L- גלוטמין, ribonucleosides ו deoxyribonucleosides. - הוסף 5 μL של PI על צינור אחד.
- צנטריפוגה במשך 2 דקות ב g 163 x.
- דגירת תאים ב 37 מעלות צלזיוס למשך 2 שעות.
- בעקבות 2 הדגירה h, centrifuge עבור 2 דקות ב g x 163.
- מוציאים בזהירות supernatant מבלי להפריע גלולה התא.
- תאי Resuspend ב 25 μL שלם תקשורת תרבית תאי NK.
הכנת 7. ספונטנית ( "S") לדוגמא
- פיפטה 500 μl של תאים K562 שכותרתו DIO (בריכוז של 1 x 10 6 תאים / מ"ל) לתוך צינור 1.5 מ"ל.
- הוסף 10 μL של PI על צינור אחד.
- צינור צנטריפוגה במשך 2 דקות ב g 163 x.
- דגירת תאים ב 37 מעלות צלזיוס למשך 2 שעות.
- לאחר דגירה h 2, צנטריפוגות במשך 2 דקות ב g x 163.
- מוציאים בזהירות supernatant מבלי להפריע גלולה התא.
- תאי Resuspend ב 25 בינוני Essential אלפא-מינימום השלמה μl (α-MEM) תרבית תאי תקשורת.
8. קליטת נתונים עם Cytometer זרימת ההדמיה
- לחץ על הכפתור הירוק ליד דלת הכניסה של ההדמיה לזרום cytometer כדי להפעיל את המכשיר.
- הפעל אלמחשבים l הקשורים הדמיה לזרום cytometer.
- הפעל את זרימת הדמיה cytometer תוכנה.
- לחצו על כפתור "הפעלה" כדי לרוקן את המערכת ולהכין את קו המדגם.
- לאחר "אתחול" הושלם, לסגור את החלון "כיולים".
- הקצאת ערוצים: בצד השמאלי העליון, לחץ על כל ערוץ כדי להקצות אותם.
- בצד הימני, לחץ על הכפתור העלילה פיזור ליצור 4 scatterplots: גלם מקס פיקסל _MC_6 vs Area_M06, Raw מקס פיקסל _MC_2 vs Area_M02, Raw מקס פיקסל _MC_5 vs Area_M05 ו FieldArea_M01 vs AspectRatio_M01.
- בגין ניתוח דגימות באמצעות הראשונה "החיובית הכפול" השליטה.
- לחץ על "טען."
- מניחים את הצינור 1.5 מ"ל עם מדגם "זוגי חיובי" מ שלבים 3.4 כדי 3.9 לתוך מטעין מדגם.
- בחר את מטרת 40X תחת לשונית "הגדלה".
- הפעל את 405 mW ו642 לייזרים mW.
- הפעל את ערוץ "Brightfield".
- לחץ על "עצמה בוחרת."
- בהתבסס על מדגם שליטה "חיובי כפול", לקבוע את עוצמת הרצויה עבור לייזר 405 mW כך הגלאי אינו עמוס מדי.
הערה: לדוגמה, העוצמת האופטימלית עבור ניסוי זה נקבעה ל 11 mW.
- לאחר הגדרת הרצויה מושגת, לרכוש נתונים.
- בכרטיסיית "קובץ רכישה", להזין טקסט שמות מותאם אישית. בחר תיקייה לשמירת קובץ הנתונים (ים).
- הזן את מספר התאים לרכוש ליד "אסוף". בדרך כלל מספר זה משתנה בין 1,000 ל -10,000.
- לחץ על "לרכוש."
הערה: לאחר המספר הרצוי של תאים נרכש, קובץ הנתונים נשמר באופן אוטומטי בתיקייה הנבחרת בעבר.
- לאחר הרכישה מסיימת, טען את המדגם לשלוט הבא - שליטת DIO בלבד.
- לחץ על "טען."
- מניחים את הצינור מ"ל 1.5 עם מדגם "Dio רק" לתוך מטעין מדגם.
- השאר את מטרת 40X תחת לשונית "הגדלה" שנבחרה.
- השאירו את לייזר 405 mW מופעלת.
- כבה את לייזר 642 mW וערוץ "Brightfield".
הערה: עכשיו כי ההגדרה הרצויה הושגה, ניתן לרכוש נתונים. - בכרטיסייה "קובץ הרכישה", להזין טקסט שמות מותאם אישית ובחר תיקייה לשמירת קובץ הנתונים (ים). הזן את מספר התאים לרכוש ליד "אסוף.". בדרך כלל מספר זה הוא 1,000.
- לחץ על "לרכוש."
הערה: לאחר המספר הרצוי של תאים נרכש קובץ הנתונים נשמר באופן אוטומטי בתיקייה הנבחרת בעבר.
- חזור על שלב 8.10 למדגם שליטה "PI בלבד". דגימות הניסוי מוכנות כעת שייגבה.
- טפלו remaining דגימות ניסוי, כולל "הדוגמות הספונטניות 'S'" כדלקמן:
- השאר את מטרת 40X תחת לשונית "הגדלה" שנבחרה.
- הפעל את 405 mW ו 642 לייזרים mW.
- הפעל את ערוץ "Brightfield".
- לחץ על "עצמת גדר."
- בכרטיסייה "קובץ הרכישה", להזין טקסט שמות מותאם אישית ובחר תיקייה לשמירת קובץ הנתונים (ים). זן בטקסט שמות מותאם אישית.
- הזן את מספר התאים לרכוש ליד "אסוף".
- לחץ על כפתור "לרכוש".
הערה: לאחר המספר הרצוי של תאים נרכש קובץ הנתונים נשמר באופן אוטומטי בתיקייה הנבחרת בעבר.
- חזור על שלב 8.12 עבור כל דגימות הניסוי.
- אחרי הכל נאספו נתונים וקבצים הניסיוניים, לחץ על כפתור "כיבוי" כדי לעקר את המערכת.
9. Imaginניתוח מדגם Cytometer זרימת g
- פתח את זרימת הדמיה cytometer יישום תוכנת ניתוח.
- תחת "קובץ", לפתוח קובץ .RIF ניסיוני.
- לבנות מטריצה חדשה באמצעות קבצי .RIF צבע אחד (Dio-רק שליטה ולשליטה PI בלבד, שנוצרו במהלך השלבים 8.10 ו 8.11) על ידי בחירת "צור מטריקס חדש" תחת הלשונית פיצוי בזרימת הדמיה cytometer תוכנה.
הערה: התוכנה תנחה לבחירת הקבצים צבע אחד ולמזג אותם כדי ליצור קובץ מטריקס (סיומת הקובץ .ctm), כי הוא להיבחר להחיל פיצוי ערוץ. - צור מגרשים נקודה באמצעות הפונקציה "אבני הבניין" של התוכנה.
- צור-עלילת נקודה (BrightFieldGradient_RMS vs תדר) לשער התאים הממוקדים. התקשר השער "פוקוס" (איור 1 א).
- שימוש שער "הפוקוס", ליצור עלילת נקודה של פינת שדה המוארת vs יחס ממדים מואר שדה כדי g אכול תאי הגופייה. התקשר השער "היחיד" (איור 1 ב).
- שימוש השער "יחיד", ליצור עלילה נקודה של Intensity_MC_Ch02 vs Intensity_MC_Ch5. השתמש עלילה זה כדי לזהות שער DIO-חיובי יחיד תאים (מטרות, חי) ו PI-DIO כפול תאים חיוביים (מטרות, מתים) (תרשים 1C).
הערה: בכל החלקות כמתואר בשלבים 9.4.1, 9.4.2, ו 9.4.3 ניתן ליצור על ידי שימוש בפונקציית "אבני הבניין" של התוכנה.
- הקש על פונקצית הסטטיסטיקה של עלילת הנקודה לגשת מספרים סלולריים של כל שער.
- חישוב אחוזי המטרות מתות במדגם הספונטני דגימות ניסוי באמצעות הנוסחא הבאה:
מטרות מתות% במדגם = (מטרות #dead x 100) / (# לחיות מטרות + #dead מטרות) - חישוב cytotoxicity באמצעות הנוסחה הבאה:
cytotoxicity% = [(מת ספונטני מתה-ניסיוני) / (מת 100-ספונטני)] x100
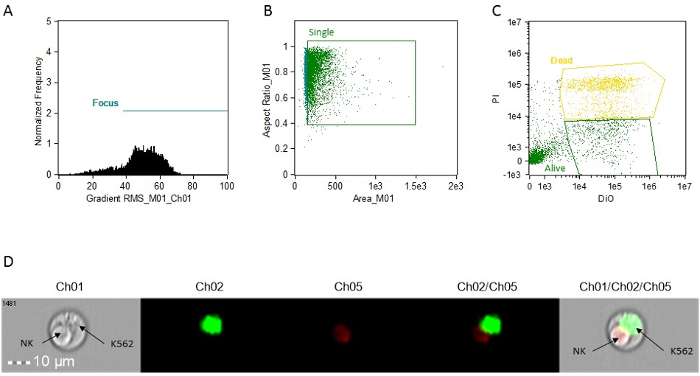
איור 1: היסטוגרמות נציג, מגרשי פיזור ותמונות לניתוח פעילות ציטוטוקסית. (א) ניתוח תא פוקוס. (ב) ניתוח תא בודד. (ג) ניתוח מכתים תא המטרה. כל הקביעות מבוצעות באמצעות התמונה מצורפת לכל אירוע. זה ניתן לגשת תוכנת ניתוח פשוט על ידי לחיצה על האירוע על הגרפים. (ד) תמונה מייצגת של אירוע כפיל, מראה תא NK אפופטוטיים ויעד K562 חי. Ch01, Brightfield. Ch02, Dio. Ch05, PI. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
תוצאות
קביעת ספירת תאי NK
ההשפעה של ריצה כבד על ספירת תאי NK בדם כולו נמדדה, באמצעות פרוטוקול התרגיל כמתואר באיור 2. דגימות דם נלקחו לפני האימון, מיד לאחר האימון, 1.5 שעות לאחר פעילות גופנית, ולבסוף 24 ו -48 שעות לאחר לקיחת הדם הראשונית. ריכוז תאי NK למי?...
Discussion
השיטה המתוארת במחקר זה ישירות מודדת את הפעילות הספציפית של תאי NK של פרט בתגובה לגירויים (במקרה המסוים הזה, פעילות הגופנית ממושכת). בדרך כלל, תאי NK מבודדים מהדם של אחד על ידי מפלי צפיפות או מיון התא באמצעות שילוב של סמנים. בעוד שיטות אלה נמצאים בשימוש נרחב, יש להם חסרונו?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
This project was supported by Agriculture and Food Research Initiative Competitive Grant no. 2100-68003-30395 from the USDA National Institute of Food and Agriculture.
Materials
| Name | Company | Catalog Number | Comments |
| K-562 lymphoblasts | ATCC | CCL-243 | |
| Iscove's Modified Dulbecco's Media | ATCC | 30-2005 | High glucose, with L-Glutamine, with HEPES, Sterile-filtered |
| Alpha Minimum Essential medium | ATCC | CRL-2407 | Without ribonucleosides and deoxyribonucleosides but with 2 mM L-glutamine and 1.5 g/L sodium bicarbonate |
| Trypan Blue Solution 0.4% | Amresco | K940-100ML | Tissue culture grade |
| Propridium Iodide Staining Solution | BD Pharmingen | 51-66211E | |
| Vybranto DiO cell-labeling solution | Vybranto | V-22886 | |
| autoMACS Pro Separator | Miltenyi Biotec | 130-092-545 | |
| autoMACS Running Buffer | Miltenyi Biotec | 130-091-221 | |
| autoMACS Washing Buffer | Miltenyi Biotec | 130-092-987 | |
| autoMACS Columns | Miltenyi Biotec | 130-021-101 | |
| Whole Blood CD56 MicroBeads, human | Miltenyi Biotec | 130-090-875 | |
| ImageStream X Mark II Imaging Flow Cytometer | EMD Millipore | ||
| Speedbeads | Amnis Corporation | 400030 | |
| 0.4-0.7% Hypochlorite (Sterilizer) | VWR | JT9416-1 | |
| Coulter Clenz | Beckman Coulter | 8546929 | |
| 70% Isopropanol (Debubbler) | EMD Millipore | 1.3704 | |
| D-PBS (Sheath fluid) | EMD Millipore | BSS-1006-B (1X) | No calcium or magnesium |
| INSPIRE Software | EMD Millipore | Version Mark II, September 2013 | |
| Ideas Application Software | EMD Millipore | Version 6.1, July 2014 |
References
- Cerwenka, A., Lanier, L. L. Natural killer cells, viruses and cancer. Nat Rev Immunol. 1 (1), 41-49 (2001).
- Nieman, D. C. Exercise, infection, and immunity. Int J Sports Med. 15, 131-141 (1994).
- Romeo, J., Warnberg, J., Pozo, T., Marcos, A. Physical activity, immunity and infection. Proc Nutr Soc. 69 (3), 390-399 (2010).
- Nieman, D. C. Marathon training and immune function. Sports Med. 37 (4-5), 412-415 (2007).
- Simpson, R. J., Kunz, H., Agha, N., Graff, R. Exercise and the Regulation of Immune Functions. Prog Mol Biol Transl Sci. 135, 355-380 (2015).
- Walsh, N. P., et al. Position statement. Part one: Immune function and exercise. Exerc Immunol Rev. 17, 6-63 (2011).
- Timmons, B. W., Cieslak, T. Human natural killer cell subsets and acute exercise: a brief review. Exerc Immunol Rev. 14, 8-23 (2008).
- Westermann, J., Pabst, R. Distribution of lymphocyte subsets and natural killer cells in the human body. Clin Investig. 70 (7), 539-544 (1992).
- Boyum, A. Isolation of leucocytes from human blood. Further observations. Methylcellulose, dextran, and ficoll as erythrocyteaggregating agents. Scand J Clin Lab Invest Suppl. 97, 31-50 (1968).
- McMillan, R., Scott, J. L. Leukocyte labeling with 51-Chromium. I. Technic and results in normal subjects. Blood. 32 (5), 738-754 (1968).
- Berk, L. S., et al. The effect of long endurance running on natural killer cells in marathoners. Med Sci Sports Exerc. 22 (2), 207-212 (1990).
- McAnulty, L. S., et al. Effect of blueberry ingestion on natural killer cell counts, oxidative stress, and inflammation prior to and after 2.5 h of running. Appl Physiol Nutr Metab. 36 (6), 976-984 (2011).
- Millard, A. L., et al. Brief Exercise Increases Peripheral Blood NK Cell Counts without Immediate Functional Changes, but Impairs their Responses to ex vivo Stimulation. Front Immunol. 4, 125 (2013).
- Janeway, C. A., Travers, P., Walport, M., Shlomchik, M. J. . Immunobiology: The Immune System in Health and Disease. 5th edn. , (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved