Method Article
זיהוי העדינה של סמנים ביולוגיים באמצעות הטבעה מולקולרית מבוסס ביוסנסור קיבולי
In This Article
Summary
כאן, אנו מציגים פרוטוקול זיהוי, כימות של מולקולות בשפע נמוך פתרונות מורכבים באמצעות מולקולרית החתמה בשילוב ביוסנסור קיבול.
Abstract
היכולת לזהות quantitate מולקולות בפתרונות מורכבים תמיד היה מאוד מבוקש בתוך מדעי הטבע; בשימוש עבור זיהוי סמנים ביולוגיים, מזהמים, מולקולות אחרות של עניין. טכניקה נפוץ למטרה זו הוא מקושרים-אנזים Immunosorbent Assay (אליסה), שבו סוג נוגדן אחד לעיתים קרובות מכוונת מולקולה יעד ספציפיות, נוגדן שכותרתו השני משמש לאיתור נוגדן ראשוני, המאפשר כימות מוחלטת של biomolecule במחקר. עם זאת, השימוש של נוגדנים כרכיבים זיהוי מגביל את היציבות של השיטה; כמו גם הצורך של שימוש בתווית מולקולות. כדי להתגבר על מגבלות אלה, הטבעה מולקולרית יושם, ביצירת אתרים מלאכותי זיהוי משלים המולקולה תבנית ולאחר obsoleting את נחיצות באמצעות נוגדנים עבור איגוד הראשונית. עוד יותר, רגישות גבוהה יותר, הנוגדן שכותרתו משני יכול להיות מוחלף על ידי ביולוגיים להסתמך על קיבול עבור כימות של מולקולת המטרה. ב פרוטוקול זה, אנו מתארים שיטה לשם במהירות, ללא תווית זיהוי של quantitate מולקולות נמוך-בשפע (חלבונים ווירוסים) בדגימות מורכבים, עם רגישות באופן משמעותי יותר. מערכות הזיהוי בשימוש נפוץ, כגון אליסה. זה כל מתווך על ידי הטבעה מולקולרית בשילוב ביוסנסור קיבוליות.
Introduction
כימות של מולקולות משמש בתחומים שונים מחקר רבים בתוך המדע, באמצעים כמו רדיו אימונולוגי (RIA) או אליסה1. חלק שיטות אלו דורשות שכותרתו מגיב כמו radioisotope או אנזים הנקרא נוגדן/אנטיגן, מה שהופך אותם מהגידולים ולגזול עם הליכים מורכבים2. עוד יותר, החוסן, סלקטיביות ורגישות של שיטות אלה אינן מספיקות עבור כל ניתוח; בפרט הם לא מספיק כאשר כמויות attogram צריך להיות מנותח, ולא pictogram כמויות3. למטרה זו, ביולוגיים השיגו עניין רב4,5, במיוחד בשילוב עם הטבעה מולקולרית עבור חוסן מוגברת.
הטבעה מולקולרית מסתמך על יצירת חללים על-ידי polymerizing מונומרים פונקציונלי סביב התבנית6, ביצירת אתרים מלאכותי זיהוי הדומים באופן מושלם את תבנית7. טכניקה זו שימש עבור מספר יישומים, כולל מערכות והפרדה אנליטית, אלא גם biorecognition אלמנטים ביולוגיים8,9,10. עם זאת, יש עדיין קשיים בעיצוב של פולימרים הדומיננטיות מולקולרי (מיליוני הוראות בשניה) עבור תבניות macromolecular11,של חלבונים ותאים -12. בגלל זה, חוקרים רבים התמקדו החתמה החלבון תבנית ישירות על גבי מצע, ובכך ליצור משטח תוכר על ידי חלבון המטרה12. טכניקה זו ציפוי פני השטח המשמש עבור העסקת זיהוי חללים עבור מולקולות גדולות וההרכבות כולל חלבונים נקראת החתמה13,14microcontact. ההליך הכללית של השיטה תלויה הפילמור בין משטחים שני - חותמת תבנית, תמיכה פולימר - שעליו התבנית הספוחה על פני15,אחד16, והוא הביא במגע פני השטח שטופלו מונומר. על ידי כך נוצר סרט פולימרי דק על התמיכה באמצעות UV-הפילמור. לבסוף, התבנית מוסר, כשמאחוריו תבנית חללים מסוימים על פני השטח של האלקטרודה הדומיננטיות. בשיטה זו יש כמה יתרונות כולל אובדן פעילות מופחתת של המולקולה הדומיננטיות, כמו גם דרישת גם בכמויות קטנות מאוד של תבנית מולקולות של החתמה לעבד16,17. לפיכך, משטחים אלה חסכונית, יציבה, רגיש, סלקטיבי יכולים להיווצר על משטחים חיישן, מיקוד כל תבנית לבחירה של המשתמש.
זיהוי חלבונים יחיד, הרבה יותר גדול ובמקרו-מולקולות ביולוגיות, כולל וירוסים יכול לשמש את החיישן. קבוצה מסוימת של וירוסים צובר ריבית האחרונות הוא bacteriophage, אשר הוא וירוס שמדביק חיידקים. זיהוי מהיר ורגיש bacteriophages חשוב במהלך ביוטכנולוגי ותהליכים ביולוגיות על מנת לקבוע זיהומים חיידקיים תרבויות עם bacteriophages18. וזמינותו הביולוגית הנפוצות ביותר לגילוי bacteriophage היא שכבה כפולה אגר שיטת19, שהיא מייגעת וצורכת זמן. נעשו מספר נסיונות לפתח הרומן כלי אבחון לאיתור וירוסים (bacteriophages כולל) כגון כוח אטומי (AFM) מיקרוסקופיה20, אינטרפרומטריה21, אלקטרוכימיה22חיישן מערכת23, 24. הרבה עבודה התמקדו ביולוגיים בשל יתרונות כמו להיות קלה לתפעול, רגישה מאוד, מסוגל בזמן אמת מידה15,25. סוג מסוים של ביוסנסור מבוסס על שינויים קיבול. אלה ביולוגיים קיבולי הם החיישנים אלקטרוכימי למדוד שינויים במאפייני מבודד כאשר analyte אינטראקציה עם רכיב biorecognition על פני חיישן, גרימת ירידה קיבול2,4 . ביולוגיים קיבולי שימשו איתור analytes שונים כמו אנטיגנים, נוגדנים, חלבונים ו מטאל יונים6,26,27,28. סוגים אלה של ביולוגיים יש יתרונות רבים כמו במהירות הטבועה, רגישות גבוהה, פשטות, עלות נמוכה, קל מניפולציה מדידה בזמן אמת ללא תיוג29.
השיטה המתוארת במסמך זה נועד לאפשר זיהוי, כימות של מולקולות נמוך-שופע בדגימות מאוד מורכבים, ללא הצורך בשימוש כל תיוג. בפרט, הטכניקה שימושית ביותר בטווח אטו-picogram של מולקולות, איפה מסחרית קיימים כלים אחרים להיכשל באופן מדויק quantitate היעד שלהם.
Protocol
1. שינוי של זכוכית שער גולשת (תבנית בולים)
- כדי לנקות את פתקי כיסוי זכוכית, לטבול אותם ברצף 10 מ"ל של 1.0 M HCl, מים יונים ו- 1.0 M של NaOH, בהתאמה, 10 דקות בכל שלב בניקוי אולטראסוני בטמפרטורת החדר.
- יבש את פתקי כיסוי זכוכית עם גז חנקן.
הערה: שער גולשת עוברות ייבוש על ידי אידוי תחת זרם של חנקן גזי.
- יבש את פתקי כיסוי זכוכית עם גז חנקן.
- לטבול את פתקי כיסוי מיובשים והשלמת ב 10% (v/v), 10 מ ל תמיסת 3-אמינו-propyl-triethoxysilane (APTES) אתנול עבור h 1 כדי להציג את קבוצות אמינו על פני השטח כיסוי זכוכית, בטמפרטורת החדר.
- יש לשטוף את שער גולשת עם מים יונים.
- יבש את שער גולשת עם גז חנקן.
- לטבול את פתקי כיסוי APTES-השתנה ב- 5% (v/v), 10 מ ל תמיסת גלוטראלדהיד במאגר פוספט 10 מ מ (pH 7.4) כבר שעתיים על מנת להפעיל את הקבוצות אמינו על פני השטח,6,בטמפרטורת החדר15.
- יש לשטוף את שער גולשת עם מאגר פוספט 10 מ מ (pH 7.4) כדי להסיר את עודפי גלוטראלדהיד מפני השטח.
- יבש את שער גולשת עם גז חנקן.
- להכין 1.0 מ"ל של תבנית (חלבון/bacteriophage) פתרון במאגר פוספט 10 מ מ (pH 7.4) בריכוז 0.1 מ"ג/מ"ל.
הערה: להמיס 0.1 מ"ג חלבון ב- 1.0 מ"ל של מאגר פוספט (10 מ מ, pH 7.4). אם יש צורך, ספקטרופוטומטרים (280 ננומטר) יכול לשמש כדי לקבוע ריכוז חלבון.- ירידה µL 200 של פתרון זה תבנית על גבי פתקי כיסוי שונה, דגירה ב 4 מעלות צלזיוס למשך הלילה.
הערה: הפתרון תבנית עודף יכול לשמש כדי להכין חותמות תבנית יותר 1-2 כדי לשמש ללימודי אפיון. - יש לשטוף את שער גולשת עם מאגר פוספט 10 מ מ (pH 7.4) כדי להסיר את התבנית לא מאוגד מפני השטח.
הערה: כדי לשטוף את האלקטרודות, לשטוף אותם עם מאגר פוספט (10 מ מ, pH 7.4) ב-30 s. - יבש את שער גולשת עם גז חנקן.
הערה: שער גולשת לאחסן ב 4 ° C עד שהם משמשים שלב הפילמור.
- ירידה µL 200 של פתרון זה תבנית על גבי פתקי כיסוי שונה, דגירה ב 4 מעלות צלזיוס למשך הלילה.
2. שינוי של אלקטרודות זהב קיבולי
- כדי לנקות את האלקטרודות, לטבול האלקטרודות בגביע, קטן באופן רציף, המכיל 5 מ של אתנול (70%), יונים מים אצטון, יונים, פתרון פיראניה חומצי (H 3:1,2וכו4:2O H2, וי/v), ויונים מים, בהתאמה במשך 10 דקות בכל שלב, בניקוי אולטראסוני בטמפרטורת החדר.
- יבש האלקטרודות עם גז חנקן.
- על מנת לבצע את electropolymerization של tyramine, הכן 8 מ של פתרון tyramine 10 מ 10 מ מ פוספט מאגר (pH 7.4) המכיל אתנול (2 מ"ל)15.
הערה: הנפח הכולל של הפתרון tyramine חייב להיות 8 מל בסך הכל כולל 2 מ"ל אתנול.- לבצע סריקות voltammetric מחזורית (15 מחזורים) בפתרון זה באמצעות potentiostat של כיסוי פוטנציאלי בטווח של 0 - 1.5 V (Ag/AgCl) ושיעור סריקה של mV/s 5030.
- לשטוף עם מים יונים האלקטרודות.
- יבש האלקטרודות עם גז חנקן.
- לטבול את האלקטרודות בתמיסה המכילה 30 מ מ acryloyl כלוריד, trimethylamine 30 מ מ בטולואן (Vסה כ = 5 מ"ל) בטמפרטורת החדר למשך הלילה6,15,30.
- לשטוף עם מים יונים האלקטרודות.
הערה: כדי להבטיח הסרה טוב יותר של unreacted acryloyl כלוריד, trimethylamine שאריות, זה גם אפשרי לשטוף את השטח עם NaOH לאחר מים יונים. - יבש האלקטרודות עם גז חנקן.
- לשטוף עם מים יונים האלקטרודות.
3. הכנת תבנית טבוע קיבולי אלקטרודות זהב
-
הכנת bacteriophage טבוע קיבולי אלקטרודות זהב
- לפני הפילמור, להכין פתרון מונומר המכילה מונומר (N-hydroxymethyl אקרילאמיד) ו מחדש (פוליאתילן גליקול-400-dimethacrylate) על יחס של 1:5 (מול/mol) ב 1 מ"ל של 10 מ מ פוספט מאגר (pH 7.4).
הערה: הפתרון מונומר מכיל מונומר מחדש ניתן להשתמש ביחס שונה, או הסוגים של מונומר, מחדש יכול להשתנות על פי התבנית עבור אופטימיזציה של אינטראקציה מסוימת. - להוסיף 1 מ ג של צילום-יוזם לתוך פתרון זה.
הערה: אם הפילמור מבוצע תחת אור UV, לשמש לאחר מכן היוזם צילום חייב ליזום את הפילמור. אם הפילמור מתבצע על ידי רדיקלים חופשיים פלמור, יש לשנות את הסוג של היוזם. - פיפטה 1.5 µL של פתרון זה על פני האלקטרודה ששונה זהב זהב.
הערה: משטח זהב של האלקטרודה מוצג סכמטי באיור1. - להביא את החותמת תבנית בקשר עם הפתרון מונומר על פני האלקטרודה זהב.
- ליזום את הפילמור UV (365 nm, 400 W) וימשיכו למשך 15 דקות31.
הערה: UV הפילמור מתבצע בתוך ארון הקירור אשר מוגדר--25 ° C לפני ביצוע הפילמור. לאחר מכן, האור האולטרה סגול לריפוי המערכת מופעלת, הפילמור נמשך למשך 15 דקות לפני לכבות את האור UV לריפוי המערכת. - הסר את תבנית חותמת פני השטח באמצעות מלקחיים.
הערה: בעת הסרת תבנית החותמת מפני השטח, הסרט פולימריים על פני עלולים להינזק. לכן, החותמת יש להסיר מן השטח מאוד לאט ובזהירות ללא שימוש בכוח. - לשטוף את השטח אלקטרודה עם מים יונים, לייבש אותו עם גז חנקן.
- לטבול האלקטרודות ב 1 מ"ל של 1 מ מ 10-מוכן אתנול במשך 20 דקות על מנת לכסות pinholes על פני האלקטרודה dodecanethiol.
- לשטוף את האלקטרודות עם מים יונים ויבש האלקטרודות עם גז חנקן.
- לפני הפילמור, להכין פתרון מונומר המכילה מונומר (N-hydroxymethyl אקרילאמיד) ו מחדש (פוליאתילן גליקול-400-dimethacrylate) על יחס של 1:5 (מול/mol) ב 1 מ"ל של 10 מ מ פוספט מאגר (pH 7.4).
-
הכנה של חלבון טבוע קיבולי אלקטרודות זהב
- לפני הפילמור, להכין פתרון מונומר המכיל מונומרים (אקרילאמיד: 54 מ ג; N-hydroxymethylacrylamide: µL 140; N-isopropylacrylamide: 85.6 מ ג), מחדש (methylenebisacrylamide: 9.5 מ ג) בשנת 820 µL של מים אולטרא טהורים30,32.
- להכין 5% (v/v) N, N, N', N'-tetramethylethyldiamine (TEMED) במים אולטרא טהורים.
- להוסיף 20 µL של הפתרון TEMED הפתרון מונומר ולטהר עם גז חנקן במשך 5 דקות.
- הכינו 10% (w/v) אמוניום persulphate (APS) במים אולטרא טהורים.
- הוסף 20 µL של הפתרון APS בתוך תמיסת מונומר.
- פיפטה µL 1.5 של הפתרון מונומר על גבי המשטח ששונה אלקטרודה זהב.
- להביא את החותמת תבנית במגע עם המשטח שטופלו מונומר.
- ומתחילים הפילמור בטמפרטורת החדר במשך 5 שעות.
הערה: עבור הכנת טבוע חלבון אלקטרודות זהב, במקום UV-פלמור, חינם-רדיקלי הפילמור בטמפרטורת החדר (25 ° C) מתבצע באמצעות APS-TEMED כזרז היוזם. - הסר את תבנית חותמת פני השטח בקפידה באמצעות מלקחיים.
- לשטוף את האלקטרודה עם מים יונים ויבש עם גז חנקן.
- לטבול האלקטרודות ב 1 מ"ל של 1 מ מ 10-מוכן אתנול במשך 20 דקות על מנת לכסות pinholes על פני האלקטרודה dodecanethiol.
- לשטוף את האלקטרודות עם מים יונים ויבש האלקטרודות עם גז חנקן.
4. אפיון של המשטח אלקטרודה בסריקת מיקרוסקופ אלקטרונים (SEM)
- הר דגימות על מחזיקי אלומיניום עם סרט דביק פחמן.
- מעיל האלקטרודות עם פלדיום nm 10/גולד....
- לבחון את האלקטרודות עם-SEM.
5. בזמן אמת קיבולי מדידות עם תבנית טבוע קיבולי אלקטרודות זהב
- הכנס את הדומיננטיות אלקטרודות זהב קיבולי בתא אלקטרוכימי זרימה משולב של ביוסנסור קיבולי.
- להכין 100 מ של התחדשות מאגר (25 מ מ גליצין-HCl, pH 2.5, כולל 50 מ"מ Tween-20), מאגר הפעלה 1 ליטר (עבור bacteriophage טבוע המערכת: 10 מ מ פוספט, pH 7.4; למערכת טבוע חלבון: 50 מ מ טריס-HCl, pH 7.4).
- להתחיל את הניתוח עם ההזרקה של התחדשות מאגר לחדש את המערכת ואת מאגר פועל כדי equilibrate מחדש את המערכת במשך 25 דקות.
- להכין את התבניות התקנית פתרונות בטווח ריכוז הרצוי בניהול מאגר.
הערה: להכין מלאי של הפתרון תבנית תחילה על ידי המסת 0.1 מ ג חלבון, או כ 108 pfu bacteriophages, במאגר פוספט 1.0 מ"ל (10 מ מ פוספט, pH 7.4). לאחר מכן, הכן את פתרונות סטנדרטיים עבור עקומת כיול על ידי עשר דילולים 10-fold רציפים מהפתרון מניות. פתרונות אלה ינותחו עם החיישן קיבולי בשלב 5.5. ריכוז החלבון ניתן למדוד באמצעות ספקטרופוטומטרים (280 ננומטר). על מנת למדוד את ריכוז bacteriophage, שיטה אגר שכבה כפולה יכול לשמש, אשר מתואר ב פרטים בעבר19. - מזריקים µL 250 של אלה פתרונות סטנדרטיים ברצף למערכת התנאים האופטימליים (קצב הזרימה: 100 µL/min, טמפרטורה: 25 ° C).
הערה: ביישום זה, הפתרונות חלבון סטנדרטית הוכנו בטווח ריכוז של 1.0 x 10-4 - 1.0 x 10-14, בעוד הריכוזים bacteriophage היו טווח 1.0 x 101 - 1.0 x pfu5 10/mL.... הפתרונות היו להציב את השסתום הזרקה, ברצף מוזרק לתוך המערכת, הזרקת הדגימות ב triplicates באמצעות המשאבה המזרק השסתום מרובה. הירידה קיבול לאחר הזרקת פתרונות סטנדרטיים הנובעים הכריכה של התבנית כדי חללים הדומיננטיות מנוטרת באופן אוטומטי על ידי התוכנה של המכשיר.
תוצאות
לפי הפרוטוקול, לפי איור 1, אלקטרודה זהב חשופות יוטבע עם תבנית, המייצג את מבנה biomacromolecule. אלקטרודה זו ניתן ליישם ביוסנסור קיבולי (איור 2), המאפשר יישום יציב של תבנית אל האלקטרודה, מדידת שינויים קיבול על הכריכה של התבנית.
ייצוג סכמטי של החיישן קיבולי מוצג באיור2. המשאבה centris, האחראית על הזרקת רציפה של המאגר המצטבר (10 מ מ פוספט, pH 7.4), המאגר התחדשות (25 מ מ גליצין-HCl, pH 2.5) במהלך התחדשות לתוך התא זרימה, ניתן לראות בבירור הדמות. התא זרימה מורכב עבודה, הפניה, מונה אלקטרודות. השסתום הזרקת מורכב של חלבונים רגיל/bacteriophage פתרונות, אשר עוברים degasser קודם, לאחר מכן מוזרק ברצף לתוך המערכת. ברגע הפתרונות מגיעים האלקטרודה עובד נוסף בתא זרימה, התוצאה נעשה בזמן אמת. הערכים קיבול יכול להיות רשום על-ידי ביצוע את sensorgrams על מסך המחשב.
איור 3 ו- 4 איור מתארים את ההבדלים בין פני השטח של אלקטרודות זהב ולא מוטבעים. שלב אפיון זה חשוב לוודא כי ישנם חללים פולימריים, רואים חספוס על פני האלקטרודה לאחר ההטבעה. מלבד SEM, ישנן גם שיטות אחרות אפיון כולל AFM, מדידות זווית מגע, ellipsometry וכדומה, אשר יכול לשמש כדי לאפיין את השטח לאחר ההטבעה. מאת בדרך זו, זה יכול להיות הבטיחו כי תהליך החתמה היא מוצלחת, כי תבנית חללים נוצרות על פני השטח. בתוך חללים אלו, באפשרותך לאגוד התבנית עם ירידה לפרטים גבוה ואהדה.
אחרי הזרקת פתרונות סטנדרטיים למערכת קיבולי, ממוצע של שני המקראות מחושב באופן אוטומטי על ידי התוכנה, כיול הגרפים התקבלו על ידי מתכנן שינוי קיבוליות לעומת הריכוז analyte. הירידה רשום קיבול עלתה מן הכריכה של התבנית. מולקולות נוספות אשר נקלטות על האלקטרודה זהב על פני השטח, גבוה יותר הקטנת קיבוליות הכולל, על פי העיקרון הכללי של מדידות קיבולי. איור 5 ו- 6 איור להראות כי עם הגדלת ריכוז analyte, ΔC מגביר כצפוי. על ידי ניתוח גרפים אלה ניתן להעריך את הטווח הדינמי (שביניהן הוא הטווח ריכוז איפה המערכת שימושית לצורך זיהוי מטרה ספציפית), המגבלה של זיהוי (לוד). על פי איור 6, החיישן קיבולי bacteriophage טבוע יכול לזהות bacteriophages בטווח ריכוז של 101 - pfu5 10/mL, שערכו לוד pfu/mL 10 במחקר זה. איור 5 ו- 6 איור האר בצורך של מדידת עקומת כיול באותו מרווח נדרש גם ריכוז תבנית אמור, מאז ליניאריות של הרגרסיה עשויים להשתנות על פני ריכוז ( איור 5), או יש מדרונות שונים (איור 6). יש גם לציין כי בשל ריכוזים נמוכים בשימוש המערכת היא מאוד רגיש לתנודות (עכירות, לדוגמה, אוויר טיוטה, וכו '), לכן מומלץ לרוץ לפחות triplicates כדי להפחית את הפוטנציאל של כולל ליניאריים . מאותה סיבה, סטיית התקן יכול להיות משמעותי למדי עבור דגימות מדולל מאוד, כפי שניתן לראות באיור 6.
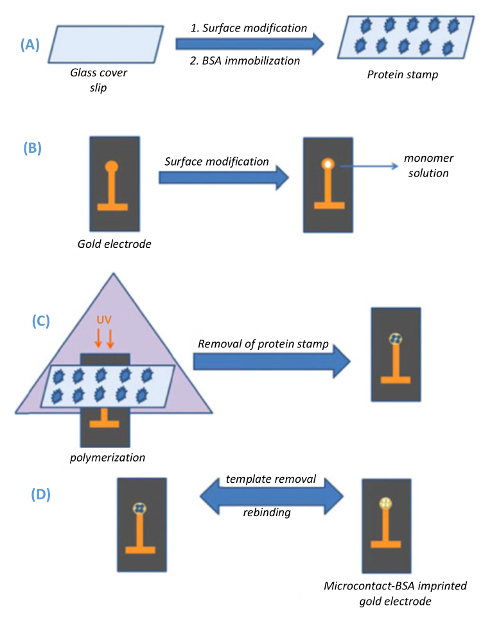
איור 1 . ייצוג סכמטי microcontact החתמה שיטה. (א) הכנת פתקי כיסוי זכוכית (תבנית בולים), (B) הכנת האלקטרודות זהב קיבולי, (ג) microcontact החתמה של התבנית על גבי משטח זהב אלקטרודה דרך UV-פלמור, ו- (ד) הסרת תבנית מהמשטח אלקטרודה (לשכפל מ Ertürk. et al., ביוטכנולוגיה דוחות 2014 (3): 65-72 עם הרשאה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
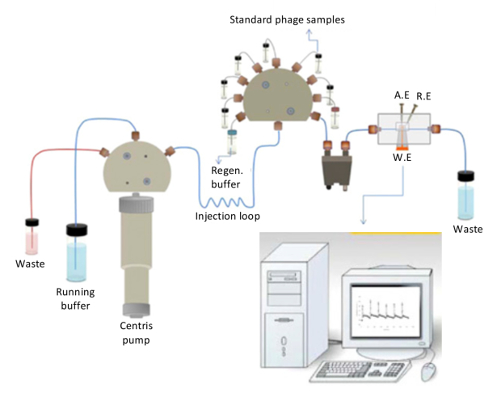
באיור 2. ייצוג סכמטי של החיישן קיבולי. הפריסה הכללית של החיישן קיבולי השתמשו במחקר זה (לשכפל מ Ertürk. et al., ביוטכנולוגיה דוחות 2014 (3): 65-72 עם הרשאה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3. מיקרוסקופ אלקטרונים סורק של חלבון טבוע אלקטרודות. תמונות SEM של (A) אלקטרודה זהב חשופות (סולם בר = 20 מיקרומטר), וחרוטות (B) חלבון קיבולי אלקטרודה זהב (מידה בר = 10 מיקרומטר). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

באיור 4. מיקרוסקופ אלקטרונים סורק של bacteriophage טבוע אלקטרודות. תמונות SEM של אלקטרודה זהב חשופות (סולם בר = 20 מיקרומטר) (A), וחרוטות bacteriophage קיבולי אלקטרודה זהב ב רמות הגדלה שונות (6600 x, סולם בר = 10 מיקרומטר) (B), ו 11, 500 X, סולם בר = 5 מיקרומטר) (ג); החיצים מציינות מודבקת bacteriophages). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
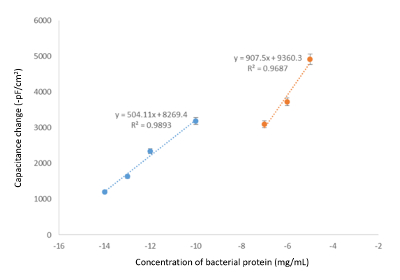
איור 5. אפקט של מאגר הרכב לתרשימים כיול. כיול גרף המציג את השינוי בקיבול לעומת ריכוז חלבון בתנאים אופטימליים (הפעלת מאגר: 50 מ מ טריס-HCl, pH 7.4; התחדשות מאגר: 25 מ מ גליצין-HCl, pH 2.5 כולל 50 מ"מ Tween-20; קצב הזרימה: 100 µL/min, נפח דגימה: 250 µL; T: 25 ° C). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 6. עקומת כיול נציג עבור ובמקרו-מולקולות ביולוגיות גדולות. גרף כיול המציגות את השינוי קיבוליות לעומת ריכוז bacteriophage בתנאים אופטימליים (הפעלת מאגר: 10 מ מ פוספט, pH 7.4; התחדשות מאגר: 25 מ מ גליצין-HCl, pH 2.5 כולל 50 מ"מ Tween-20; קצב הזרימה: 100 µL/min, נפח דגימה: 250 µL; T: 25 ° C) אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
כאשר שיטה זו מתבצעת, ישנם כמה צעדים קריטי כי יש לקחת בחשבון בעת בעקבות הפרוטוקול. צעד קריטי הוא הצעד ניקוי עם פתרון פיראניה חומצי. שלב 2.1 אינו יכול להיות יותר מ- 10 דקות. הפתרון תבנית עבור שלב 1.4 יחרוג מ- 0.1 מ"ג/מ"ל, מאז ערכים אלה מוטבו בעבר. Voltametric מחזורית סריקות אינו יכול לחרוג 15 מחזורים על מנת לקבל את העובי האופטימלי. עבור שלב 3.1.3, 1.5 µL הוא ערך מיטבי. ערך זה אינו יכול להיות גבוה יותר עבור הסוג המסוים הזה של האלקטרודה. אם UV לריפוי מערכת יש כוח של 400 W, ואז הפילמור יש לבצע לכל היותר 10-15 דקות. ברגע APS (היוזם) מתווסף הפתרון לאחר TEMED, השלב שלאחר מכן חייב להתבצע מהר מאוד להימנע הפילמור מיידית (שלב 3.2.5).
אחד השלבים הקריטיים ביותר הוא הסרת תבנית החותמת מפני השטח לאחר הפילמור UV. אם שלב זה לא מתבצע כהלכה, קיים סיכון כי הסרט פולימריים על פני האלקטרודה ניתן להסיר עם החותמת. לכן, מומלץ לטבול האלקטרודה ואת החותמת חלבון על גבי בתמיסה של מים לאחר הפילמור, ולאחר מכן להסיר את החותמת באיטיות ובזהירות מפני השטח (שלב 3.1.6).
מבוסס על התבנית המשמשת, שינויים ב ' סוג ' יחס של מונומרים בשימוש (מונומר תפקודית ו מחדש) עשויים להידרש, מבחינת יצירת רגישות גבוהה יותר. זה חייב להיקבע מדעית. עוד יותר, הכריכה זיקה של המולקולה תבנית בדרך כלל כרוך במספר אינטראקציות שונות בו זמנית. לכן, זה עלול להוביל לבעיות במהלך השלבים התחדשות. אם התבנית מאוגד אינו משתחרר מפני השטח כראוי, זה עשוי להשפיע על שימושית של האלקטרודה לצורך ניתוח נוסף. אלה הזיקות רב-נקודתי עלול לגרום גם מ מחייב דרך האינטראקציות החלשות. במערכות כאלה, שאינם ספציפיים האיגוד יכול להתרחש, אשר יכולים להשפיע באופן שלילי על סלקטיביות של מערכת ה-16. אלו הם נפוצים, גנרל, מגבלות של השיטה.
מלבד אלה מגבלות מסוימות, יש המון יתרונות השיטה דנו על פני שיטות קיימות. בעוד RIAs ELISAs, מדידות fluorometric רגישים מאוד, הם דורשים השימוש של חומר עם תוויות (תבנית או גלאי), בעוד החיישן הוא לחלוטין ללא תווית. שיטות אלה הם גם יותר יקרים ולגזול. בגישה ביוסנסור מאפשר מהירה, במקביל סינתזה של מיליוני הוראות בשניה בקומפוזיציות שונות בה זמן זהה16. מאז רק כמה microliters של מונומר פתרון נדרשת הכנה, השיטה היא נוחה בעת שימוש מונומרים מוגבל יקר או אחרת. אלקטרודות MIP עוד, יחיד יכול לשמש כ- 80 ניתוחים ללא ירידה משמעותית הביצועים, אשר גבוה משמעותית מאשר אחרים בשיטות הקיימות30. שיטות קיימות גם סובל, בדרגות שונות, של רגישות נמוכה, סלקטיביות, בעוד השיטה המתוארת מאפשר זיהוי, כימות של מולקולות בטווח pM עם סלקטיביות גבוהה.
בשל עלות-תועלת, להקל על הפעלת המכשיר, זיהוי רגיש בזמן אמת תוך זמן קצר לעומת שיטות קיימות, ביולוגיים הם מאוד מבטיח נקודת-של טיפוח מערכות זיהוי בתנאי שדה; למשל, עבור ניטור סביבתי, יישומים במדינות מתפתחות. ביישומים רבים בתוך האבחון של המחלה, זיהוי בזמן אמת, רגיש, סלקטיבי, מהירה של סמן בתערובת מורכבת כגון סרום הוא נדרש15,25. כאן, ביולוגיים נעלים על שיטות קיימות, בפרט, בשל החוסן ואת הרגישות שלהם. במיוחד עבור זיהוי מדבקים, bacteriophages נחשבים לאחרונה רכיב biorecognition חלופי עבור ביולוגיים עקב שלהם מארח חיידקים ירידה לפרטים33,34,35. החלפת נוגדנים עם bacteriophages הוא מבטיח מאוד על מנת להפחית את העלות, להגדיל עוד יותר את יציבות36. מערכת כזו גם יאפשר זיהוי, כימות מסוים phages הסביבה, מדגימות קליניים. בשל השכיחות של bacteriophages, ואת יכולתם מגלי חיידקים עמידות לאנטיביוטיקה גנים37,38, השיטה עשוי להיות יקר ללמוד את התפשטות בקטריאלי עמיד.
Disclosures
המחברים אין לחשוף.
Acknowledgements
מריה באומגרטן (IQ ביוטכנולוגיה פלטפורמה, זיהום ברפואה, אוניברסיטת לונד) הוא הודה עבור ביצוע ואספקת סריקה micrographs אלקטרון. עבודה זו נתמך על ידי מענקים שוודית המחקר המועצה Formas (2017-00100) במסגרת האירופית השלישית משותפת תכנות היוזמה בשיחה ההתנגדות מיקרוביאלית (JPIAMR) "דינמיקה שידור". התורמים שחיים היה אין תפקיד תכנון המחקר, פרשנות, כתיבה, הכנה של כתב היד, ההחלטה להגיש, או ההחלטה לפרסם את עבודותיהם.
Materials
| Name | Company | Catalog Number | Comments |
| Glass Cover slips | ThermoFisher | 102222 | protein stamp |
| HCl | Sigma-Aldrich | H1758-500ML | cleaning |
| NaOH | Sigma-Aldrich | 72068-100ML | cleaning |
| Ultrasonic cleaner | Branson Ultrasonic | BRANSONIC M1800- E | cleaning |
| 3-amino-propyl-triethoxysilane (APTES) | Sigma-Aldrich | A3648-100ML | modification |
| EtOH | Sigma-Aldrich | 1009836010 | rinsing/cleaning |
| glutaraldehyde | Sigma-Aldrich | G5882-100ML | cross-linker |
| acetone | Sigma-Aldrich | 34850-1L-M | cleaning |
| H2SO4 | Sigma-Aldrich | 339741-100ML | piranha solution |
| H2O2 | Sigma-Aldrich | H1009-500ML | piranha solution |
| tyramine | Sigma-Aldrich | T90344-5G | modification |
| CompactStat | Ivium Technologies | CompactStat.h: 30mA@10V/3MHz | potentiostat |
| Platinum Counter Electrode Kit | Equilabrium | AFCTR5 | potentiostat |
| Reference Electrode | Equilabrium | RREF0021 | potentiostat |
| acryloyl chloride | EMD Millipore | 8.00826.0100 | modification |
| triethylamine | EMD Millipore | 8.08352.0100 | modification |
| toluene | Sigma-Aldrich | 244511-100ML | modification |
| N-hydroxymethyl acrylamide | Sigma-Aldrich | 245801-100G | functional monomer |
| poly ethylene glycol-400-dimethacrylate | Sigma-Aldrich | 409510-250ML | cross-linker |
| 2-Hydroxy-4′-(2-hydroxyethoxy)-2-methylpropiophenone | Sigma-Aldrich | 410896-50G | functional monomer |
| UV polymerizator | Dymax | Dymax 5000ECE | UV-polymerization |
| forceps | Sigma-Aldrich | Z168777-1EA | consumable |
| 1-dodecanethiol | Sigma-Aldrich | 471364-100ML | blocking agent |
| acrylamide | Sigma-Aldrich | A3553-100G | functional monomer |
| N-hydroxymethylacrylamide | Sigma-Aldrich | 245801-100G | functional monomer |
| N-isopropylacrylamide | Sigma-Aldrich | 415324-50G | functional monomer |
| methylenebisacrylamide | Sigma-Aldrich | 146072-500G | cross-linking monomer |
| N,N,N',N'-tetrametyhlethyldiamine (TEMED) | Sigma-Aldrich | T9281-25ML | catalyst |
| ammonium persulphate | Sigma-Aldrich | A3678-25G | initiator |
| Capacitive biosensor | CapSenze | Equipment | |
| Glycine | Merck | 1042011000 | regeneration buffer |
| Tween-20 | Sigma-Aldrich | P9416-50ML | regeneration buffer |
| Trizma base | Sigma-Aldrich | 93352-1KG | running buffer |
| Na2HPO4 • 2H2O | Calbiochem | 567547-1KG | running buffer |
| NaH2PO4 • 2H2O | Calbiochem | 567549-1KG | running buffer |
| DELPHI correlative light and electron microscope | Phenom-World | equipment | |
| Capacitive gold electrodes | CapSenze Biosystems | consumables | |
| 2,2'-azobis(2-methypropionitrile) | Sigma-Aldrich | 441090-25G | photo-initiator |
| CapSenze Smart Software | CapSenze Biosystems | software program |
References
- Lin, T. Y., Hu, C. H., Chou, T. C. Determination of albumin concentration by MIP-QCM sensor. Biosensors and Bioelectronics. 20 (1), 75-81 (2004).
- Berggren, C., Bjarnason, B., Johansson, G. Capacitive Biosensors. Electroanalysis. 13 (3), 173-180 (2001).
- Zhang, S., Garcia-D'Angeli, A., Brennan, J. P., Huo, Q. Predicting detection limits of enzyme-linked immunosorbent assay (ELISA) and bioanalytical techniques in general. The Analyst. 139 (2), 439-445 (2014).
- Mattiasson, B., Teeparuksapun, K., Hedström, M. Immunochemical binding assays for detection and quantification of trace impurities in biotechnological production. Trends in Biotechnology. 28 (1), 20-27 (2010).
- Limbut, W., Hedström, M., Thavarungkul, P., Kanatharana, P., Mattiasson, B. Capacitive biosensor for detection of endotoxin. Analytical and Bioanalytical Chemistry. 389 (2), 517-525 (2007).
- Ertürk, G., Berillo, D., Hedström, M., Mattiasson, B. Microcontact-BSA imprinted capacitive biosensor for real-time, sensitive and selective detection of BSA. Biotechnology Reports. 3, 65-72 (2014).
- Arshady, R., Mosbach, K. Synthesis of substrate-selective polymers by host-guest polymerization. Macromolecular Chemistry and Physics. 182 (2), 687-692 (1981).
- Andersson, L. I. Molecular imprinting: developments and applications in the analytical chemistry field. Journal of chromatography. B, Biomedical sciences and applications. 745 (1), 3-13 (2000).
- Li, X., Husson, S. M. Two-dimensional molecular imprinting approach to produce optical biosensor recognition elements. Langmuir: the ACS Journal of Surfaces and Colloids. 22 (23), 9658-9663 (2006).
- Alexander, C., Davidson, L., Hayes, W. Imprinted polymers: artificial molecular recognition materials with applications in synthesis and catalysis. Tetrahedron. 59 (12), 2025-2057 (2003).
- Kryscio, D. R., Peppas, N. A. Surface imprinted thin polymer film systems with selective recognition for bovine serum albumin. Analytica Chimica Acta. 718, 109-115 (2012).
- Inerowicz, H. D., Howell, S., Regnier, F. E., Reifenberger, R. Multiprotein immunoassay arrays fabricated by microcontact printing. Langmuir. 18 (13), 5263-5268 (2002).
- Lin, H. Y., Hsu, C. Y., Thomas, J. L., Wang, S. E., Chen, H. C., Chou, T. C. The microcontact imprinting of proteins: The effect of cross-linking monomers for lysozyme, ribonuclease A and myoglobin. Biosensors and Bioelectronics. 22 (4), 534-543 (2006).
- Liao, P. C., Tyan, Y. C., Wang, C. Y., Hsu, J. F., Chou, T. C., Lin, H. Y. Assessing the binding selectivity of molecularly imprinted polymer artificial antibodies by mass spectrometry-based profiling system. Journal of Biomedical Materials Research Part A. 91 (2), 597-604 (2009).
- Ertürk, G., Hedström, M., Tümer, M. A., Denizli, A., Mattiasson, B. Real-time prostate-specific antigen detection with prostate-specific antigen imprinted capacitive biosensors. Analytica Chimica Acta. 891, 120-129 (2015).
- Ertürk, G., Mattiasson, B. From imprinting to microcontact imprinting-A new tool to increase selectivity in analytical devices. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences. 1021, 30-44 (2016).
- Ertürk, G., Mattiasson, B. Molecular Imprinting: The Creation of Biorecognition Imprints on Biosensor Surfaces. Advanced Molecularly Imprinting Materials. , 523-560 (2017).
- Janczuk-Richter, M., et al. Long-period fiber grating sensor for detection of viruses. Sensors and Actuators B: Chemical. 250, 32-38 (2017).
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. Enumeration of bacteriophages by double agar overlay plaque assay. Methods in Molecular Biology. 501, 69-76 (2009).
- Meillan, M., et al. Self-assembled monolayer for AFM measurements of Tobacco Mosaic Virus (TMV) at the atomic level. RSC Adv. 4 (23), 11927 (2014).
- Ymeti, A., et al. Fast, ultrasensitive virus detection using a Young interferometer sensor. Nano Letters. 7 (2), 394-397 (2007).
- Wei, Y., Wong, L. P., Toh, C. -. S. Fuel cell virus sensor using virus capture within antibody-coated nanochannels. Analytical Chemistry. 85 (3), 1350-1357 (2013).
- Guliy, O. I., et al. Immunodetection of bacteriophages by a piezoelectric resonator with lateral electric field. Applied biochemistry and microbiology. 52 (4), 457-463 (2016).
- Reta, N., Michelmore, A., Saint, C., Prieto-Simón, B., Voelcker, N. H. Porous silicon membrane-modified electrodes for label-free voltammetric detection of MS2 bacteriophage. Biosensors & Bioelectronics. 80, 47-53 (2016).
- Ertürk, G., Özen, H., Tümer, M. A., Mattiasson, B., Denizli, A. Microcontact imprinting based surface plasmon resonance (SPR) biosensor for real-time and ultrasensitive detection of prostate specific antigen (PSA) from clinical samples. Sensors and Actuators B: Chemical. 224, 823-832 (2016).
- Lebogang, L., Mattiasson, B., Hedström, M. Capacitive sensing of microcystin variants of Microcystis aeruginosa using a gold immunoelectrode modified with antibodies, gold nanoparticles and polytyramine. Microchimica Acta. 181 (9-10), 1009-1017 (2014).
- Loyprasert, S., Hedström, M., Thavarungkul, P., Kanatharana, P., Mattiasson, B. Sub-attomolar detection of cholera toxin using a label-free capacitive immunosensor. Biosensors & Bioelectronics. 25 (8), 1977-1983 (2010).
- Teeparuksapun, K., Hedström, M., Wong, E. Y., Tang, S., Hewlett, I. K., Mattiasson, B. Ultrasensitive detection of HIV-1 p24 antigen using nanofunctionalized surfaces in a capacitive immunosensor. Analytical Chemistry. 82 (20), 8406-8411 (2010).
- Labib, M., Hedström, M., Amin, M., Mattiasson, B. A capacitive biosensor for detection of staphylococcal enterotoxin B. Analytical and Bioanalytical Chemistry. 393 (5), 1539-1544 (2009).
- Ertürk, G., Hedström, M., Mattiasson, B. A sensitive and real-time assay of trypsin by using molecular imprinting-based capacitive biosensor. Biosensors & Bioelectronics. 86, 557-565 (2016).
- Ertürk, G., Uzun, L., Tümer, M. A., Say, R., Denizli, A. Fab fragments imprinted SPR biosensor for real-time human immunoglobulin G detection. Biosensors & Bioelectronics. 28 (1), 97-104 (2011).
- El-Sharif, H. F., Phan, Q. T., Reddy, S. M. Enhanced selectivity of hydrogel-based molecularly imprinted polymers (HydroMIPs) following buffer conditioning. Analytica Chimica Acta. 809, 155-161 (2014).
- Wang, F., et al. Detection of Salmonella Typhimurium on Spinach Using Phage-Based Magnetoelastic Biosensors. Sensors (Basel, Switzerland). 17 (2), (2017).
- Chin, B. A., et al. Rapid detection of small quantities of specific bacteria using phage-based wireless biosensors. 2016 10th International Conference on Sensing Technology (ICST). , 1-5 (2016).
- Park, M. -. K., Chin, B. A. Novel Approach of a Phage-Based Magnetoelastic Biosensor for the Detection of Salmonella enterica serovar Typhimurium in Soil. Journal of Microbiology and Biotechnology. 26 (12), 2051-2059 (2016).
- Mack, J. D., Yehualaeshet, T., Park, M. -. K., Tameru, B., Samuel, T., Chin, B. A. Phage-Based Biosensor and Optimization of Surface Blocking Agents to Detect Salmonella typhimurium on Romaine Lettuce. Journal of food safety. 37 (2), 12299 (2017).
- Colomer-Lluch, M., Jofre, J., Muniesa, M. Antibiotic resistance genes in the bacteriophage DNA fraction of environmental samples. Plos One. 6 (3), 17549 (2011).
- Lood, R., Ertürk, G., Mattiasson, B. Revisiting antibiotic resistance spreading in wastewater treatment plants - bacteriophages as a much neglected potential transmission vehicle. Frontiers in microbiology. 8, (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved