A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טיטור אליסה כשיטה לקבוע את קבוע דיסוציאציה של קולטן ליגנד אינטראקציה
In This Article
Summary
פרוטוקול מפורט לביצוע טיטור אליסה מתואר. יתר על כן, באלגוריתם הרומן מוצג כדי להעריך טיטור ELISAs וכדי להשיג קבוע דיסוציאציה של איגוד של ליגנד מסיסים לקולטן צלחת. מרותק למיטה microtiter.
Abstract
קבוע דיסוציאציה מתאר את האינטראקציה בין שני השותפים בשיווי משקל מחייב והיא מידת הזיקה שלהם. זה פרמטר קריטי כדי להשוות שונים, למשל, מעכבי תחרותי, חלבון איזופורמים של ליגנדים מוטציות, שלהם כוח האיגוד שותף מחייב. קבועי דיסוציאציה נקבעים לפי התוויית ריכוזי מאוגד לעומת ליגנד חופשי כמו איגוד עקומות. לעומת זאת, עקומות טיטור, שבו אות פרופורציונלי לריכוז ליגנד מאוגד מותווים כנגד ריכוז מוחלט של ליגנד נוסף, הם הרבה יותר קל להקליט. האות ניתן להבחין spectroscopically ועל ידי מקושרים-אנזים immunosorbent assay (אליסה). דוגמה לכך הוא פרוטוקול עבור טיטור אליסה המודד את הכריכה של rhodocetin נגזר ארס נחש שלה לתחום היעד קיבוע של אינטגרין α2β1. טיטור ELISAs הינם מגוונים בשימוש נרחב. לכל זוג של חלבונים שמעצבת יכול לשמש גם קיבוע קולטן וליגנד מסיסים, ובלבד שני חלבונים טהורים, ריכוזים שלהם ידועים. הקושי כה היה לקבוע את קבוע דיסוציאציה של עיקול טיטור. במחקר זה, הוא הציג פונקציה מתמטית שבבסיס טיטור עקומות. ללא שום הערכה לשגיאות גרפי של תשואה רוויה, אלגוריתם זה מאפשר עיבוד הנתונים הגולמיים (עוצמות האות בריכוזים שונים של ליגנד נוסף) ישירות על-ידי הערכה מתמטי באמצעות רגרסיה ליניארי. לפיכך, מספר עקומות טיטור יכול להיות המוקלטת בו זמנית והפך סט של פרמטרים אופיינית, ביניהם את קבוע דיסוציאציה, הריכוז של קולטן איגוד-פעיל, ו הם ניתן להעריך סטטיסטית. בשילוב עם אלגוריתם זה, טיטור ELISAs להשיג את היתרון בהצגת ישירות על קבוע דיסוציאציה. לכן, הם עשויים לשמש ביעילות רבה יותר בעתיד.
Introduction
קבוע דיסוציאציה K הוא פרמטר מפתח כדי לתאר את זיקתו של קולטן (R) עבור שלה ליגנד (L). בהתבסס על חוק המסות, K מוגדר עבור האיזון, שבה RL מורכבים קולטן-ליגנד dissociates לתוך הקולטן R של ליגנד l:
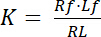 משוואה 1
משוואה 1
עם מדדי f המציין את מצב חינם/לא מאוגדים של קולטן וליגנד. הריכוז של המתחם קולטן-ליגנד, RL, זהה לריכוז ליגנד לקולטן מכורך Lb כמו ריכוז מוחלט של קולטן Rt הוא הסכום של קולטן חינם Rf וליגנד מכורך קולטן Rb = Lb, קבוע דיסוציאציה יכולה להיכתב גם בתור:
 משוואה 2
משוואה 2
לכן, הרוויה תשואות Y, הגדיר את השבר של ליגנד מאוגד Lb ביחס של ריכוז מוחלט של קולטן Rt,
 משוואה 3
משוואה 3
תלוי הריכוז של ליגנד חופשי Lf:
 משוואה 4
משוואה 4
יחס היפרבולי זה מתאר עקומת קשירה של אינטראקציה קולטן-ליגנד ומראה העלילה שלו את הריכוז של ליגנד מאוגד Lb כפונקציה של הריכוז של ליגנד חופשי Lf. מן העקומה מחייב, ניתן לגזור את קבוע דיסוציאציה K כמו הריכוז של ליגנד חופשי-חצי-מקסימלי רוויה התשואה. יתר על כן, אלגוריתמים שונים כדי linearize מחייב עקומות הוקמו, כגון העלילה הכפולה-הדדיים מאת קלוץ1,2, או שינויי צורה בהתאם Scatchard או היינס (נבדקה ע י Bisswanger3). עם זאת, כל האלגוריתמים סובלים הבעיה שבה הערך המרבי של התשואה רוויה, אשר שקוורקים ניגשה בריכוזים גבוהים של ליגנד חופשי בתוך עקומת קשירה, חייב להיות מוערך בהערכה טרום גרפי, לכן הוא מועדת לטעויות.
בנוסף, הקביעה של עקומת קשירה דורשת כימות של ליגנד בחינם, מאוגד במהלך האיזון מחייב. למטרה זו, ליגנד חופשי צריך להיות הופרדו של ליגנד לקולטן מכורך לכמת. לכן, ליגנד לקולטן יש נבדלים בתכונותיהם, כגון ליגנד-חלבון לעומת חלבון קולטן. אם שני בני הזוג מחייב חלבונים, הם חייבים להיות להבדיל לגודלן, חיובים או תכונות אחרות מולקולרית. למרות זאת, כימות של ליגנד ריכוזים ב גישות איגוד בקנה מידה קטן הוא משימה קשה. תיוג רדיואקטיבי של ליגנד לעיתים קרובות כבר צורך לזהות את הריכוז נמוך של ליגנד מאוגד, במיוחד אם כמויות ניכרות של קולטנים לא היו זמינות או במחירים סבירים. יתר על כן, ליגנד לקולטן מכורך ייתכן מביצועם במהלך ואחרי בידוד באופן שעצירת. לפיכך, שיטות מורכבות, כגון שיווי משקל ג'ל סינון4, אלקטרופורזה נימי5הדופק proteolysis6, נדרשים לכמת ליגנד לקולטן מכורך ולהפריד אותו מן ליגנד חופשי.
בניגוד אלה מבחני הכריכה, ניסויים טיטור אינם דורשים ההפרדה כמותית של ליגנד כבול וחופשי. למטרה זו, הוא קולטן על ריכוז קבוע של טיטרציה עם ריכוזים שונים של ליגנד נוסף. באמצעות קשירה לקולטן, ליגנד מאוגד כוללת מאפיין biophysical אשר מבדיל ליגנד חופשי היא מדידה באמצעות, למשל, photometry, fluorometry או זיהוי נוגדנים. כך, האות S, אשר הוא יחסי הרוויה תשואות Y, וכתוצאה מכך גם לריכוז ליגנד לקולטן מכורך (Lb), ומתגלה כפונקציה של ריכוז מוחלט של ליגנד נוסף (Lt). פרמטרים, האות S וגם ריכוז מוחלט של ליגנד נוסף הם לכמת באופן ישיר וקל יותר מאשר הריכוזים של ליגנד כבול וחופשי. במיוחד, זיהוי הקולטן מכורך ליגנד מאת מקושרים-אנזים immunosorbent assay (אליסה) מותרות ההפחתה של אמצעי אחסון מדגם אל מתחת 100 µL וכן מדידות במקביל של מספר ריכוזים ליגנד צלחות רב טוב microtiter. ב טיטור אליסה, קולטן פיזית הספוחה על צלחת microtiter-ריכוז זהה, טיטרציה עם ליגנד מסיסים. הקולטן הוא מתאושש השטח פלסטיק בעיקרו של דבר על ידי ספיחה הידרופובי. ריכוז משטח של קולטן קיבוע בקורלציה עם הריכוז ציפוי של הקולטן ביחס לא לינארית, סביר על-פי Langmuir´s ספיחה איזותרמה7. בנוסף שהמספר הכולל של קולטן הספוחה מולקולות, מצב הפעילות שלהם היא פרמטר חשוב נוסף עבור מבחני טיטור. רק ללא יכולת תנועה קולטנים אשר שמרו ליגנד מחייב פעילות, הרלוונטיים עבור טיטור וזמינותו, בסופו של דבר לתרום ריכוז מוחלט של קולטנים הפעיל Rt של וזמינותו טיטור, אשר לא ניתן לקבוע באופן ישיר.
אתרים על פני השטח פלסטיק, אשר לא מכוסים על ידי רצפטור קיבוע נוטים לספוח חלבונים אחרים, כגון ליגנד. ספיחה פיסיקלית של ליגנד לאתרים משטח פלסטיק כזה יגרום ב אות דומה כמו ליגנד לקולטן מאוגד, עדיין באופן ספציפי. כדי להפחית את האות לא ספציפית, האתרים משטח פלסטיק של הלוחות microtiter אשר לא מצופה עם חלבון עדיין ייחסמו עם אלבומין שור (BSA). עם זאת, עבור כמה מבחני טיטור קולטן-ליגנד, רקע ספציפי אותות עלולים להיות שנצפו. ואז, סוכנים אחרים, חסימה, כגון פתרון של 0.2% ג'לטין או של 0.04% Tween 20, מומלץ.
לאחר הכריכה לקולטן ליגנד חופשי יוסר על ידי שני צעדים כביסה. ליגנד המאוגד נשארת עם הקולטן, שהוא מתאושש השטח פלסטיק של הבאר microtiter, לחלופין מחוזק על ידי קיבוע כימי. עבור העוקבים קוולנטיות הצלב הצמדה של ליגנד מאוגד, קולטן קיבוע עם גלוטראלדהיד, מוחלף החומר מאגר טריס עבור HEPES, ללא כל שינוי מחייב ליגנד. HEPES, בניגוד טריס, לא הפוך ללא פעיל גלוטראלדהיד. הצמדה הצלב קוולנטיות עם גלוטראלדהיד פותר את ליגנד מאוגד עם הקולטן שלו ומונע שלה דיסוציאציה במהלך הכביסה, דגירה והשלבים. לפיכך, האינטראקציה קולטן-ליגנד מוקפא מבחינה כימית, צווי עיקול טיטור אשר מושפע והשלבים של כביסה, דגירה. אולם, גלוטראלדהיד קיבוע עשוי כימית לשנות את ליגנד לקולטן באופן כזה כי האינטראקציה שלהם מצומצמת או ביטל. יתר על כן, שינוי של epitopes בתוך ליגנד עשוי להשתנות על זיקה מחייבת של הנוגדן גילוי, במיוחד אם נוגדן חד שבטי משמש לכמת ליגנד מאוגד. למרות וגם של אלה תופעות לוואי של קיבעון גלוטראלדהיד מתרחשת ב טיטור זו אליסה, הרגישות של הבדיקה לכיוון גלוטראלדהיד חייב להיבדק על כל אינטראקציה קולטן-ליגנד לפני הניסוי טיטור. לאחר קיבוע, גלוטראלדהיד עודף מוסר בשלושה צעדים כביסה עם מאגר המכיל טריס. טריס חלבונית קבוצות אלדהיד הנותרים, אשר עשוי להגיב nonspecifically עם זיהוי נוגדנים בשלב שלאחר מכן.
הכמות של ליגנד מאוגד לכמתו מקושרים-אנזים נוגדנים, המספקים אות אליסה בהשוואת ס זה מותווים לעומת ה ליגנד הכולל ריכוז L-t הוסיף את כל טוב. למרות הרכישה לקל יותר, העקומה טיטור אינה פונקציה היפרבולית בניגוד העקומה מחייב. יתר על כן, זה כבר לא ברור כיצד לחשב את קבוע דיסוציאציה K מ עיקול טיטור. למרות אלגוריתמים כדי linearize spectroscopically רכשה טיטור עקומות דווחו באופן עצמאי על-ידי Stockell8 ו- היי, Weischet9, הם התמוטטו עקב חוסר הבהירות של הערכת האות המרבי ערך התשואה רוויה ניגש בריכוזים גבוהים של ליגנד נוסף.
כאן, טיטור אליסה, באלגוריתם רגרסיה ליניארי מתוארים להפיק את קבוע דיסוציאציה K לאינטראקציה ליגנד קולטן של עיקול טיטור. פרוטוקול זה הוא דוגמה עבור האינטראקציה של קולגן מחייב A-התחום של α2β1 אינטגרין עם מעכב נגזר ארס הנחש. אינטגרינים הם מולקולות אדהזיה התא, אשר לתווך המעגנה תאים של מטריצה חוץ-תאית שמסביב או כבסיס קרום המרתף10,11. יתר על כן, אינטגרינים להעביר חשוב אותות בין תאים של מטריצה חוץ-תאית על-ידי גיוס נוספים מולקולות איתות ויוצרים האברונים חדש, adhesomes, עם תא-מטריצת אינטראקציה12,13, 14. קולגן, ליגנד של אינטגרין α2β1, הוא החלבון הנפוץ ביותר בגוף האדם, הוא מרכיב קריטי פיגומים של רקמת חיבור ה-15. האינטראקציה בין α2β1 אינטגרין קולגן מתווך על ידי A-התחום של יחידת משנה α2 אינטגרין. אינטגרין α2A-התחום מכיל הקטיון כלט, אשר נדרש עבור איגוד קולגן ומייצב את המבנה שלה. טופס פראי-סוג, כמו גם מוטציות של מתחם α2A, כמו זו שבה שאריות השטח החשופים Y216 הוחלף עבור גליצין, בקלות ניתן המיוצר recombinantly במערכת הביטוי חיידקי, מבודדים באמצעות שלהם oligo-שלו-תגיות עם נינטה superflow טורים דיאליזה הבאים נגד באגירה טריס תמיסת מלח (TBS; 50 מ"מ טריס/HCl, pH 7.4, 150 מ מ NaCl) המכילה 2 מ מ MgCl216. ריכוזים שלהם היו נחושים עם וזמינותו חומצה bicinchoninic (BCA), purities שלהם נבדק על ידי מרחביות קונבנציונלי-דף, מוכתם R250 כחול Coomassie-מבריק.
האינטראקציה בין α2β1 אינטגרין קולגן חסומה על-ידי איגוד של הרכיב ארס הנחש, rhodocetin, מ ה16,בור צפע (Calloselasma rhodostoma)17. משמש של ליגנד מסיס ב טיטור זו אליסה, rhodocetin היה טהור מן גולמי ארס כפי שתואר לעיל16. זה הוא מומס באגירה HEPES תמיסת מלח (HBS; 10 מ מ HEPES/NaOH, pH 7.4, 150 מ מ NaCl) ומאוחסן קפוא ב-20 ° C. הריכוז שלו נקבע על ידי BCA, הטוהר שלו הוכח על ידי עמודים מרחביות. כמו אנטגוניסט, rhodocetin לא רק חוסם קולגן איגוד אינטגרין α2β1 A-מחשבים, אבל גם מייצבת את קונפורמציה לא פעיל אינטגרין ובכך מונע כל איתות של קולגן לתוך תאים או טסיות18. זה חשיבות הביו-רפואית לקבוע את קבוע דיסוציאציה של rhodocetin עם המטרה הקולטן שלו, ובכך לפענח את המנגנון המולקולרי ואת תרופות פוטנציאליות למשל, כסוכן בשבץ antithrombotic. למטרה זו, טיטור אליסה מתואר כולל את ההערכה שלו, אשר חל כמעט כל קולטן-ליגנד אינטראקציה עם סטויכיומטריה אינטראקציה עם 1:1.
Protocol
1. מלאי פתרונות
- כדי להכין 100 מ של 10 x TBS pH 7.4 פתרון, להמיס 6.06 g של טריס ו- g 8.77 של NaCl ב 90 מיליליטר מים יונים, להתאים את ה-pH ל 7.4 עם פתרון HCl 37%, למלא את אמצעי האחסון עד 100 מ"ל מים יונים, לסנן את הפתרון.
- להכין 100 מ של 1 מ' HEPES/NaOH, פתרון ה-pH 7.4, להמיס 23.83 g של HEPES ב- 90 מיליליטר מים יונים להתאים את ה-pH ל 7.4 עם NaOH 1.5 מ', למלא את אמצעי האחסון עד 100 מ"ל מים יונים, לסנן את הפתרון.
- כדי להכין 100 מ של 5 מ' NaCl פתרון, להמיס 29.2 g של NaCl ב- 90 מיליליטר מים יונים. למלא את אמצעי האחסון עד 100 מ"ל מים יונים ולסנן את הפתרון.
- כדי להכין 100 מ של 1 מ' MgCl2 פתרון, להמיס 20.33 גר' MgCl2 · 6-אייץ '2O ב- 90 מיליליטר מים יונים. למלא את אמצעי האחסון עד 100 מ"ל מים יונים ולסנן את הפתרון.
- כדי להכין 5% לא פעיל חום BSA במים, שוקל 2.5 גר' BSA (שבר V, pH 7.0) צינור 50 מ ל, לפזר זאת בתוך 45 מ של מים יונים. למלא את הפתרון 50 מ ל מים יונים, וחום הפתרון באמבט מים ב 68 מעלות צלזיוס במשך 45 דקות להירגע באמבט קרח ואחסן אותו ב-20 ° C.
- הכן תמיסה מימית של גלוטראלדהיד 25%.
התראה: גלוטראלדהיד מזיק אם נבלע, רעילים באמצעות אינהלציה, וגורמת לכוויות. ללבוש ביגוד מגן, כפפות, ובפנים העין/הגנה. - להעלות לאוויר ארנב כמו שתואר לעיל19. כייל של תרופת-נגד נקבע על-פי פרוטוקולים סטנדרטיים20.
- להכין נוגדן אנטי-ארנב-נוגדנים מן העז מצומדת עם phosphatase אלקליין.
- כדי להכין 100 מ של 0.1 M גליצין פתרון, להמיס 0.75 גר' גליצין ב 90 מיליליטר מים יונים. להתאים את ה-pH ל- 10.4 עם פתרון NaOH 1.5 M, למלא את אמצעי האחסון עד 100 מ"ל מים יונים, לסנן את הפתרון.
- כדי להכין 100 מ של M 0.5 Zn (II)-אצטט פתרון, להמיס 10.98 g Zn (II)-אצטט · 2H2O ב- 90 מיליליטר מים יונים. למלא את אמצעי האחסון עד 100 מ"ל מים יונים ולסנן את הפתרון.
- כדי להכין 100 מ של פתרון NaOH 1.5 M, להמיס 6.0 גר' NaOH ב 90 מיליליטר מים יונים. למלא את אמצעי האחסון עד 100 מ"ל מים יונים ולסנן את הפתרון.
2. מכינים מאגרי ועבודה פתרונות
- לדלל 5 מ של 10 x TBS pH 7.4, עם 45 מ ל יונים מים ולהוסיף 100 µL MgCl 1 מ'2 מניות לפתרון. . שמור את זה בטמפרטורת החדר. ה-TBS, pH 7.4, 2 מ מ MgCl2 פתרון זה מיועד הנייח של הקולטן, לשטוף את הצלחת microtiter.
- לדלל 10 מ"ל של 5% של BSA להשבית חום במים ו 5 מיליליטר 10 x TBS, pH 7.4 עם מים יונים כדי 50 מ. להוסיף 100 µL של 1 מ' MgCl2 מניות פתרון ומערבבים היטב את הפתרון. להשאירו על הקרח ואחסן אותו לניסויים נוספים ב-20 ° C. הערה את 2.5 מ של 1% BSA ב- TBS, pH 7.4, 2 מ מ MgCl2 נדרשים עבור כל עקומה טיטור.
- למהול 2.5 מ של 1 מ' HEPES/NaOH, pH 7.4 ו- 1.5 מ ל 5 מ' NaCl לפתרון 50 מ עם מים יונים, להוסיף 100 µL MgCl 1 מ'2 פתרון ומערבבים את הפתרון באופן יסודי כדי להכין 50 מ של HBS, pH 7.4: 50 מ מ HEPES/NaOH , 150 מ מ NaCl.
- להוסיף 5 µL של 1 מ' MgCl2 מניות פתרון ו 2 µL 0.5 M Zn (II)-אצטט פתרון מניות מ ל 0.1 M גליצין פתרון, pH 10.4 להכין מאגר phosphatase אלקליין (AP) (0.1 M גליצין פתרון, pH 10.4, מ מ 1 MgCl2, 0.2 מ מ Zn(II)-acetate).
3. בטקטיקות של הקולטן (Integrin α2A-תחום) על צלחת Microtiter
- לדלל את הפתרון מניות של אינטגרין α2A-התחום ב- TBS, pH 7.4, 2 מ מ MgCl2 עבור ריכוז הסופי של 5 µg/mL.
הערה: הנפח של הפתרון ציפוי היא 650 µL על עקומת טיטור אחת הכוללת 12 באר-שורה של צלחת אזור חצי-microtiter. - מלא בכל טוב של שורה על צלחת אזור-microtiter חצי µL 50/טוב של הפתרון ציפוי µg/mL 5 של אינטגרין α2A-תחום (פראי-סוג או מוטציה). לבצע כל שורה טיטור לפחות ב כפילויות (בדוגמה זו כמו הרביעייה; ראה פריסת צלחת microtiter באיור1).
- חותם לצלחת עם נייר כסף או לסגור אותו עם מכסה. להשאיר את הצלחת 4 מעלות צלזיוס למשך הלילה.
4. שטיפת מצופה בארות צלחת פעמיים עם TBS, pH 7.4, 2 מ מ MgCl2
- כדי להסיר מסיסים קולטן מולקולות, אשר יש לא היה מרותק למיטה על משטח הפלסטיק על ידי ספיחה פיסיקלית, להסיר את הפתרון ציפוי, למלא כל אחד טוב עם µL 50 של TBS, pH 7.4, 2 מ מ MgCl2.
- הסר את הפתרון לשטוף. ודא כי הבארות לא יהפכו יבש. לכן, לא הקש את הצלחת microtiter על גבי מטלית רקמה כדי להסיר שאריות נוזלים. השתמש פיפטה רב-שלבי או פיפטה רב ערוצית כדי למלא את הבארות במהירות.
- חזור על שלב זה כביסה פעם אחת.
5. לחסום אתרי קישור ספציפי
- להוסיף 50 µL של 1% פתרון BSA TBS, pH 7.4, 2 מ מ MgCl2 כדי מכל קידוח.
- לאטום מחדש את בארות בנייר כסף או לסגור עם מכסה.
- דגירה הבארות לשעה בטמפרטורת החדר.
הערה: כל אחד מהשלבים דגירה של פרוטוקול זה יכול להתבצע על פלטפורמה נדנדה או חזק. עם זאת, זה לא נדרש, אינו משנה את תוצאת הניסוי.
6. הכנת שורה דילול טורי של ליגנד, Rhodocetin
- להשתנות הריכוז התחלה של rhodocetin הגורם דילול של דילול טורי, כדי לקבל טווח המתאים של ליגנד ריכוזים וכדי לרשום עיקול טיטור מלא עם קליטה מינימום ומקסימום. בניסוי זה, מעסיקים ריכוז התחלה של 243 rhodocetin ננומטר, גורם לדילול של 2.3. לדלל הפתרון מניות rhodocetin הריכוז הגבוה ביותר של ליגנד של השורה דילול טורי. עבור כל עקומה טיטור עם גורם לדילול של 2.3, להכין µL 115 nM (כלומר, µg 15,2/mL) 243 rhodocetin פתרון 1% BSA/TBS, pH 7.4, 2 מ מ MgCl2 מבחנה #1.
- מלאו 65 µL של 1% פתרון BSA TBS, pH 7.4, 2 מ מ MgCl2 10 מבחנות, שכותרתו #2 באמצעות #11.
- להעביר 50 µL של דילול rhodocetin מבחנה #1 כדי מבחנה #2, לערבב שני פתרונות (נפח כולל: 115 µL; גורם לדילול: 1:2. 3) trituration, ולאחר מכן העברת 50 µL מן תערובת זו על מבחנה #3, וכו '.
- המשך זה דילול טורי עד מבחנה #11.
הערה: אמצעי האחסון שניתנו בשלבים 6.1-6.4 מספיקים עבור אחד עקומת טיטור. אמצעי אחסון אלה להכפיל המספר של משכפל. במקרה זה, לבצע טיטור 8 עקומות (הרביעייה של שתי צורות α2A-תחום) ולהכין את אמצעי האחסון הבאים: 920 µL של פתרון rhodocetin הריכוז הגבוה ביותר של מבחנה #1; 520 µL של BSA 1% ב- TBS, pH 7.4, 2 מ מ MgCl2 למלא בכל אחת המבחנות #2 #11; µL 400 אמצעי העברה של שפופרת אחת בפעם הבאה.
7. איגוד של ליגנד (Rhodocetin) בריכוזים שונים כדי. מרותק למיטה קולטן (Integrin α2A-תחום)
- הסר את הפתרון חסימה הבארות צלחת microtiter על-ידי קו ואקום.
- מיד להוסיף 50 µL של הפתרון rhodocetin 1% BSA/TBS, pH 7.4/MgCl2 פתרון של מבחנה #1 לתוך בארות של עמודה 1, פתרון של מבחנה #2 כדי בארות של עמודה 2, µL להוסיף 50וכו של BSA 1% ב- TBS, pH 7.4 , 2 מ מ MgCl2 (מאגר חסימה וללא דילול) כפקד ליגנד חופשי כדי בארות של עמודה 12 (ראה פריסת צלחת microtiter, איור 1).
- לאטום מחדש את בארות בנייר כסף או לסגור עם מכסה.
- דגירה הבארות עבור h 1.5 בטמפרטורת החדר (בסביבות 20-22 מעלות צלזיוס).
8. שטיפת בארות של צלחת פעמיים עם HBS, pH 7.4, 2 מ מ MgCl2
- כדי להסיר את מולקולות ליגנד שאינו מאוגד, להסיר את הפתרון איגוד ומלא כל טוב עם µL 50 של HBS, pH 7.4, 2 מ מ MgCl2. לאחר מכן, הסר את הפתרון לשטוף.
- תשמרי את הבארות לא יהפכו יבש. לכן, לא הקש את הצלחת microtiter על גבי מטלית רקמה כדי להסיר שאריות נוזלים. השתמש פיפטה רב-שלבי או פיפטה רב ערוצית כדי למלא את הבארות במהירות.
- חזור על שלב זה כביסה פעם אחת.
9. לתקן את ליגנד לקולטן מכורך עם 2.5% גלוטראלדהיד ב- HBS, pH 7.4, 2 מ מ MgCl2
- להכין פתרון גלוטראלדהיד 2.5% טרי על ידי ערבוב חלק 1 של 25% גלוטראלדהיד פתרון וחלקים 9 HBS, pH 7.4, 2 מ מ MgCl2.
- מלא בכל טוב של צלחת microtiter µL 50 של הפתרון גלוטראלדהיד 2.5% ב- HBS, pH 7.4, 2 מ מ MgCl2. דגירה את הצלחת microtiter 10 דקות בטמפרטורת החדר.
10. שטיפת בארות של צלחת שלוש פעמים עם µL 50/טוב של TBS, pH 7.4, 2 מ מ MgCl2
- כדי להסיר בטל עודף גלוטראלדהיד, להסיר את הפתרון קיבוע ומלא כל טוב עם µL 50 של TBS, pH 7.4, 2 מ מ MgCl2. ואז להסיר את הפתרון לשטוף.
הערה: שופכים את הפתרון קיבוע המכילות גלוטראלדהיד מהצלחת microtiter לתוך תבשיל ולמחוק את הפתרון קיבוע אחרי זה יש כבר מומת על ידי אמצעי שווה של TBS, pH 7.4. - תשמרי את הבארות לא יהפכו יבש. לכן, לא הקש את הצלחת microtiter על גבי מטלית רקמה כדי להסיר שאריות נוזלים. השתמש פיפטה רב-שלבי או פיפטה רב ערוצית כדי למלא את הבארות במהירות.
- חזור על שלב זה כביסה פעמיים.
11. כימות של ליגנד לקולטן מכורך מאת אליסה
- הוסף µL 50/טוב של הפתרון נוגדן ראשוני ב- BSA 1% ב- TBS, pH 7.4, 2 מ מ MgCl2. הפתרון נוגדן העיקרי הוא נסיוב ארנבת יותקף rhodocetin19, מדולל 1:2,000 ב- BSA 1% ב- TBS, pH 7.4, 2 מ מ MgCl2.
- דגירה את הצלחת. בשביל 75-90 דקות בטמפרטורת החדר. לשטוף כל בארות של הצלחת שלוש פעמים עם µL 50/טוב של TBS, pH 7.4, 2 מ מ MgCl2. במהלך שלושת שלבי הכביסה, הקשה של צלחת microtiter על גבי רקמה בד אינה נדרשת.
- להוסיף µL 50/טוב של הפתרון נוגדנים משניים BSA 1% ב- TBS, pH 7.4, 2 מ מ MgCl2. לשם כך, לדלל את נוגדנים משניים, ארנב פילוח בנוגדנים עז נוגדנים מצומדת עם phosphatase אלקליין, כדי 1:2,000 ב- BSA 1% ב- TBS, pH 7.4, 2 מ מ MgCl2. דגירה את הצלחת. בשביל 75-90 דקות בטמפרטורת החדר.
- להכין פתרון AP-זיהוי על ידי המסת לוח 5 מ"ג המכיל 4-nitrophenyl פוספט ניתרן מלח hexahydrate (פוספטאז המצע) ב 5 מ של מאגר AP (0.1 M גליצין פתרון, pH 10.4, המכיל 1 מ MgCl2 ו- 0.2 מ מ Zn(II)-acetate).
- רחץ בארות כל צלחת שלוש פעמים עם µL 50/טוב של TBS, pH 7.4, 2 מ מ MgCl2, מיד לפני ביצוע השלב הבא. הקש את הצלחת microtiter על גבי מטלית רקמה לאחר השלב האחרון כביסה כדי להסיר כל עקבות של נוזל.
- להוסיף µL 50/טוב של הפתרון AP-גילוי הבארות של צלחת microtiter. להוסיף פתרון זיהוי-AP מיד כל בארות כדי לבצע את ההמרה אנזימטי בו-זמנית ככל האפשר. לפיכך, משתמשים פיפטה רב ערוצית.
- דגירה את הצלחת בטמפרטורת החדר עד הפתרון בבארות עם הריכוז הגבוה ביותר של ליגנד צהוב.
הערה: זמן הדגירה עשויים להשתנות בין 5 דקות ל- h 1 בהתאם עוצמת האות. - לעצור את ההמרה של המצע פוספטאז על-ידי הוספת µL 50/טוב של פתרון NaOH 1.5 M. להשאיר את צלחת עומד למשך מספר דקות להבטיח רצף ללא ערבוב של שני פתרונות. כדי להצדיק את תקופת הדגירה באותו בבארות כל, להשתמש פיפטה רב ערוצית ולהוסיף את NaOH M 1.5 באותו סדר נוסף לבארות כמו זה של המצע AP-זיהוי בשלב 11.8.
- מודדים את צפיפות אופטית (OD)-405 ננומטר של כל טוב חלבונים.
12. הערכת האותות טיטור
- פתח את הטבלה נתונים גולמיים, ערכי405nm OD, עם Excel. כמו ערכים אלה אותות של עקומות טיטור הקראת בשורות לשקף את ערכי עמודה ו תווית עם הריכוזים של ליגנד נוסף בעמודה אחרת.
- פתח את המנסרה Graphpad 5 (גרסה 5.0). פתח קובץ פרוייקט חדש בתפריט הראשי. בחר בתבנית XY תחת נתונים חדשים וגרף. בחר באפשרות Enter ומגרש נקודה אחת עבור כל ערך עבור ציר ה-y.
- להעתיק את שתי העמודות, ריכוז של ליגנד נוסף, לסמן ערכים (OD405nm ערכים) excel קובץ ולהדביק אותם לגליון נתונים GraphPad מנסרה כמו X ו- Y ערכים, בהתאמה.
- פתח את התוכנית ניתוח תת GraphPad מנסרה 5 ובחר את האפשרות רגרסיה ליניארית תחת XY-אנליזה. לבחור משוואה על-ידי המשתמש , לחץ על הלחצן ' חדש ' כדי ליצור משוואה חדשה.
- הקלד את המשוואה עקומת טיטור בטופס: Y =(Smax-Smin)*((X+R+K)-sqrt((X+R+K)^2-4*R*X)) /(2*R) + Smin + B * X לתוך הגיליון תבנית שנפתח לאחרונה, עם Y להיות ערך האות S, X להיות הריכוז של ליגנד נוסף L , R להיות הריכוז מתאושש קולטן, K להיות קבוע דיסוציאציה, ו B להיות הרקע המדרון. להגדיר את האילוצים המתאים, כגון K > 0 ו- R > 0.
הערה: המשוואה הזו היא מאותה משוואה של משוואת 9 בצורה שונה. - לנתח את הערכים של גליון נתונים על-ידי בחירת המשוואה על-ידי המשתמש, אשר נוצר לאחרונה. פתח את הטבלה עם הערכים המחושבים קירוב (K, Rt, Sמקס, Sminו- B) אשר מוצגים תחת המקטע תוצאה בצד שמאל של המסך תוכנה.
הערה: התוכנה קובע את הפרמטרים 5 על-ידי הזזת איטרטיבי של רגרסיה ליניארי רק אם העיקול טיטור מורכב נתונים לפחות 5 נקודות. - להעריך את הפרמטרים K, Rt, Sמקס, Sminו- B עבור כל קבוצה של עקומות טיטור סטטיסטית, לתאם את הפרמטרים עם תכונה ספציפית של הקבוצה (ליגנד מוטציה או שינוי כימי או קולטן).
תוצאות
לאחר אליסה פותחה, הצבע הצהוב של המצע המומר phosphatase אלקליין, פארא- nitrophenolate, מציין כי הסכום של ליגנד rhodocetin מאוגד מקטינה להפחתת ריכוזי rhodocetin הוסיף מ עמודות 1 עד 11 (איור 1). הבארות השקופה בבארות ללא rhodocetin בעמודה 12 הצג אות רקע נמוך.
Discussion
טיטרציה אליסה היא מערכת מבחן תכליתי כדי לקבוע את הדיסוציאציה של אינטראקציה קולטן-ליגנד. כמו טיטרציה אליסה עוקף את הצורך להפריד ליגנדים בחינם, מאוגד ביעילות וכדי לנתח ריכוזים שלהם באופן כמותי, מחקרים באופן משמעותי יותר, פרסומים המועסקים טיטור ELISAs במקום הקלטה איגוד עקומות . יתר על כן, טיטור ...
Disclosures
המחבר אין לחשוף.
Acknowledgements
הפרוטוקול ואת אלגוריתם פותחו במסגרת פרוייקט במימון פתוח (DFG גרנט SFB1009 A09 ו- EB177/13-1). המחבר תודה ברברה Schedding, פליקס Schmalbein לתמיכה טכנית, דוקטור נילנד עבור אנושות לקרוא את כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
References
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection--a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved