Method Article
מערכת BW כתב ללמוד אינטראקציות קולטן-ליגנד
In This Article
Summary
פרוטוקול זה מתאר כיצד ליצור מערכת כתב כי ניתן להשתמש כדי לזהות ולכמת קולטן-ליגנד אינטראקציות.
Abstract
אינטראקציות בין קולטני ליגנדים מהווים תהליך ביולוגי בסיסי. אולם, ישירה ניסויים עם תאים המבטאים את הקולטן מקורית, ליגנד מאתגרת כיוון ליגנד של קולטן מסוים עשוי להיות לא ידוע בצרות עם ליגנד מקורי יכול להיות מסובך טכנית. כדי לטפל מכשולים אלה, נתאר מערכת הכתב כדי לזהות את איגוד והפעלה של קולטן ספציפי ליגנד עניין. מערכת זו כתב, המחשבים חוץ-תאי של קולטן מסוים היא מצומדת העכבר CD3ζ, חלבון chimeric זה מתבטא ואז העכבר BW תאים. אז יכול להיות מודגרות תאים אלה-BW transfected עם מטרות שונות (למשל, תאים או נוגדנים). הפעלה של קולטן transfected מוביל הפרשת interleukin-2 העכבר (mIL-2) אשר ניתן להבחין מקושרים-אנזים immunosorbent assay (אליסה). מערכת הכתב הזה יש את היתרונות של להיות רגיש וספציפי על קולטן בודד. בנוסף, רמת ההפעלה של קולטן ספציפי בקלות ניתן לכמת והוא יכול לשמש גם במקרים בו ליגנד של הקולטן אינו ידוע. מערכת זו יושמה בהצלחה ברבות מן המחקרים שלנו לאפיון אינטראקציות קולטן-ליגנד. יש לנו עובדים לאחרונה מערכת זו כדי ללמוד את ההפעלה של רצפטורים Fcγ האנושית (FcγRs) באמצעות נוגדנים anti-CD20 monoclonal שונים בשימוש קליני.
Introduction
מערכת הכתב BW היא שיטת לימוד אינטראקציות קולטן-ליגנד1. מערכת זו היא יתרון במיוחד כאשר ליגנד של קולטן מסוים אינו ידוע או ניסויים ליגנד אנדוגני קשים מבחינה טכנית. זה יכול לשמש גם ללמוד את הכריכה של נוגדנים חד-שבטיים FcγRs האנושי. השיטה מבוססת על ביטוי חלבון chimeric בתאים העכבר BW. חלבון chimeric זה מורכב תחום חוץ-תאי של הקולטן עניין דבוקה על התחומים transmembrane, תאיים של הרשת אפי ' עכבר '. איגוד של ליגנדים המתאים של הקולטן מוביל הפרשת il-2 העכבר, אשר ניתן לאתרם בקלות על ידי אליסה, כמופיע באיור1. שיטה זו היא רגיש ואת ספציפי לקולטן בודדים, קלה לתפעול, במיוחד לשחזור. זה יכול ובכך משלימים כלים נוספים ללמוד אינטראקציות קולטן-ליגנד. לדוגמה, ניתן להשתמש למסך מספר שורות תאים לנוכחות של ליגנד על קולטן ספציפי (גם אם ליגנד עצמה לא זוהתה) או כדי לזהות את ההפעלה של האדם FcγRs על ידי נוגדנים חד-שבטיים או בנסיוב אדם המכילים אנטי-ויראליות נוגדנים. למרות ראשי תאים חיסוניים אקספרס FcγRs אנדוגני, הם בדרך כלל קשה להתמודד עם ולבטא בדרך כלל מספר הקולטנים Fc.
השתמשנו במערכת זו בהצלחה ברבות מן המחקרים שלנו לאפיון אינטראקציות קולטן-ליגנד. אלה כוללים זיהוי haemagglutinin ליגנד של הקולטן התא NK NKp462, זיהוי PVR ו- nectin-2 ליגנדים עבור האדם והעכבר TIGIT3,4, ומאגד להראות את זה nucleatum fusobacterium את החיידק, הפעלת TIGIT האנושי5. בנוסף, BW תאים המבטאים קולטנים Fc שימשו בהצלחה לזהות נוגדנים אנטי ויראלית של המטופלים סרה6,7,8. באופן ספציפי, לאחרונה הקמנו BW תאים המבטאים FcγRs האנושית לזהות הפעלת ה-FcR דיפרנציאלית של נוגדנים אנטי-CD20 המשמש לטיפול של לוקמיה לימפוציטית כרונית (CLL)9. חשוב, יש התוצאות של מערכת הכתב BW מאומתים בניסויים משלימים.
Protocol
1. דור של פלסמיד המבטאת את Chimeric לבנות
הערה: המטרה היא ליצור פלסמיד המבטאת את התחום חוץ-תאי של הקולטן עניין דבוקה על התחומים transmembrane, תאיים על העכבר שרשרת CD3ζ (איור 2 א).
- אחזר את הרצף של התחום חוץ-תאי של הקולטן כולל את האות פפטיד. להשיג חומר ה-DNA אשר צפוי לבטא את הקולטן (למשל, cDNA או על פלסמיד).
- להשיג חומר DNA המבטאת את transmembrane, את התחומים תאיים של העכבר שרשרת CD3ζ (למשל., cDNA או על פלסמיד).
- לעצב את הרצף של החלבון פיוז'ן בהתבסס על המבנה הכללי שמוצג באיור 2A. ודא כי הרצף כולו הוא בתוך המסגרת codon הקריאה. רצף זה משמש כדי לעצב תחל המתאים ולוודא את המוצר הסופי.
- עיצוב שתי תגובות PCR כדי להגביר את כל הרסיסים של החלבונים פיוז'ן בנפרד (איור 2B, 2 C)10.
הערה: התנאים הספציפיים עבור תגובות PCR (למשל., חישול טמפרטורה וזמן התארכות) תלויים הטבע של תחל אשר תוכננו עבור קולטן ספציפי.- להגביר את המקטע חוץ-תאי של הקולטן.
- עיצוב 5' פריימר הכוללת חלק האות פפטיד של הקולטן, רצף קונצנזוס קוזאק אתר הגבלה מתאימה (איור 2B).
- עיצוב 3' פריימר זה יפתיע את שני החלקים של החלבון פיוז'ן (איור 2B). לדוגמה, עבור העיצוב הראשוני הזה פריימר 3' יכולים לכלול זוגות בסיס-20 של המקטע חוץ-תאי של הקולטן, זוגות בסיס ראשון 9 של קטע CD3ζ.
הערה: יש צורך להוסיף אתר ההגבלה פריימר 3' כיוון פריימר זה ישמש כדי להפיק את רצף מאוחה, אינם משמשים מצדו.
- להגביר את המקטע CD3ζ.
- עיצוב 5' פריימר אשר אגפים בשני חלקי החלבון פיוז'ן (איור 2C). לדוגמה, עבור העיצוב הראשוני פריימר 5' יכולים לכלול זוגות בסיס 9 אחרונה של המקטע חוץ-תאי של הקולטן ואת הראשון 20 זוגות בסיס של המקטע CD3ζ.
הערה: יש צורך להוסיף אתר ההגבלה פריימר 5' כיוון פריימר זה ישמש כדי להפיק את רצף מאוחה, אינם משמשים מצדו. - עיצוב 3' פריימר הכוללת בסוף הרצף CD3ζ, כמו גם אתר הגבלה מתאימה (איור 2C).
- עיצוב 5' פריימר אשר אגפים בשני חלקי החלבון פיוז'ן (איור 2C). לדוגמה, עבור העיצוב הראשוני פריימר 5' יכולים לכלול זוגות בסיס 9 אחרונה של המקטע חוץ-תאי של הקולטן ואת הראשון 20 זוגות בסיס של המקטע CD3ζ.
- תקן את רצפי תחל בכל אחד שתי תגובות אלו כך הטמפרטורה מחזק דומה כל זוג (שים לב פריימר, הכולל רצף של שני חלקי החלבון פיוז'ן, anneals רק עם החלק של הרצף בתגובה לכל).
- להגביר את המקטע חוץ-תאי של הקולטן.
- ביצוע של PCR נוספים בהם תערובת של מוצרי ה-PCR של תגובות שני הראשונים משמש את תבנית ה-DNA עם פריימר 5' של המקטע חוץ-תאי קולטן (שלב 1.4.1.1), את 3' של המקטע CD3ζ (שלב 1.4.2.2) (איור דו-ממדי)10 . תגובה זו עשויה ליצור את הרצף הסופי מאוחה.
- להמשיך כרגיל לקראת שיבוט.
- מאתרים ומפסיקים את המוצר הסופי PCR אל המטרה לחתוך וקטור (וקטור המטרה בדרך כלל pcDNA3 אשר מביע התנגדות G418, אמפיצילין).
- להפוך את הווקטור מחוברים חיידקים המוסמכת11.
- הפשרת 50 µL של החיידק המוסמכת על קרח.
- להוסיף את הווקטור מחוברים של חיידקים, דגירה על קרח למשך 20 דקות.
- דגירה ב 42 מעלות צלזיוס במשך 45 s.
- להוסיף 200 µL של ק ג ללא אנטיביוטיקה.
- תקופת דגירה של h 1 ב 37 מעלות צלזיוס ברעידות רציפה.
- הזרעים בצלחת ליברות עם האנטיביוטיקה המתאימה (למשל, אמפיצילין פתרון עם ריכוז סופי של 0.1 mg/mL).
- לאסוף ולגדול מספר מושבות חיידקים ב 5 מ של ליברות (במנורות 15 מ"ל).
- למחרת, לחלץ פלסמידים עם ערכת ההכנה מיני.
- לנתח את תותב ג'ין עם אנזימי הגבלה.
- רצף המושבות הרלוונטיים, ודא את הרצף, את מסגרת הקריאה נכונים (כפי שמצוין ב- 1.3 שלב).
- להפוך את פלסמיד מאומת חיידקים המוסמכת11.
- הפשרת 20 µL של החיידק המוסמכת על קרח.
- להוסיף 1 µL של פלסמיד החיידק, דגירה על קרח למשך 20 דקות.
- דגירה ב 42 מעלות צלזיוס במשך 45 s.
- להוסיף 200 µL של ק ג ללא אנטיביוטיקה.
- תקופת דגירה של h 1 ב 37 מעלות צלזיוס ברעידות רציפה.
- זרע על צלחת התפתחות חיידקים עם האנטיביוטיקה המתאימה (למשל, אמפיצילין פתרון עם ריכוז סופי של 0.1 mg/mL).
- למחרת, לגדול מושבת חיידקים במיכל LB גדול עם 0.1 מ"ג/מ"ל אמפיצילין (~ 250 מ ל).
- למחרת, לבצע הכנה מקסי לפי ההוראות הספציפיות שמספק הערכה.
הערה: עבור ההליך אלקטרופורציה, כמות גדולה של פלסמיד נדרש, כפי שיפורט להלן.
2. תקנים של פלסמיד המבטאת את החלבון Chimeric לתאי BW
הערה: שיטות שונות יכול גם להיות מועסק על תרביות תאים (למשל., על-ידי זיהום lentiviral). לפני אלקטרופורציה, לבצע אתנול משקעים של ה-DNA כפי שמתואר להלן. הפעולות הבאות דורשות בתנאים סטריליים.
- יום לפני כן, להכין את התאים BW5147 ("תאים BW") אלקטרופורציה. צלחת 10 צלחות (10 ס מ) עם 10 מ"ל של 100,000 BW5147 תאים למ"ל (קרי, סך של 10 x 106 תאים) עם RPMI בתוספת 10% עגל עוברית סרום (FCS), 1% נתרן פירובט, 1%-גלוטמין, חומצות אמינו שאינם חיוניים 1%, 1% פניצילין-סטרפטומיצין ("בינוני מלא").
- מקום µg 100 של פלסמיד pcDNA3 המבטאת את חלבון כימרי צינור 1.5-2 מ"ל ולהוסיף 3 מ' סודיום אצטט ב- 5.3-5.5 pH אליו. הנפח של סודיום אצטט צריכה להתאים את 0.1 (10%) של היקף פלסמיד µg 100; titrate ה-pH של סודיום אצטט עם מד pH על-ידי הוספת NaOH או HCl.
- להוסיף 2.5 בנפחים של 100% אתנול לתערובת את פלסמיד, של סודיום אצטט כפי שמתואר בשלב 2.2 (2.5 x הנפח הכולל של פלסמיד, סודיום אצטט). דגירה בין לילה ב-20 ° C או עבור 2 h ב- 70 מעלות צלזיוס.
- 2.4. 24 שעות אחרי שיש כבר מצופה התאים BW, לאסוף את כל BW התאים (~ 100 מ"ל) בצינורות 2 50 מ"ל. Centrifuge את התאים עבור 5 דקות ב x 515 גרם וזורקים את תגובת שיקוע.
- מחדש להשעות בגדר משפופרות שני ב 25 מ של RPMI - צינור בודד 50 מ. לדוגמה, מחדש להשעות בגדר של שפופרת אחת עם 25 מ של RPMI - ולאחר מכן השתמש נוזל זה להשעות מחדש את הנוזלים לשפופרת 50 מ ל אחרים, כך בגדר הכולל את התאים BW מושהה מחדש ב 25 מיליליטר בינוני צינור יחיד.
הערה: המדיום צריך להיות ללא תוספות, שכן הסרום עשויים להפריע אלקטרופורציה. - Centrifuge את התאים שוב עבור 5 דקות ב x 515 גרם. מחדש להשעות את צניפה ב 1 מ"ל של RPMI, להעביר את התוכן cuvette 0.4 ס מ על קרח.
- Centrifuge את פלסמיד שעברו אתנול משקעים (שלב 2.3) במשך 30 דקות ב- 16,000 x g ו- 4 מעלות צלזיוס.
- לשטוף פעם עם 1 מ"ל של 70% אתנול וביו -צנטריפוגה עוד כעשרים דקות ב- 16,000 x g ו- 4 ° C (לשטוף את המלח).
- הסר כל האתנול ולתת בגדר יבשה במקצת (קרי, צינור פתוח בשכונה תרביות רקמה). מחדש להשעות את גלולה עם µL 100 RPMI-בעבר מחומם ל 60 מעלות צלזיוס.
- הוסף את פלסמיד מחדש על תנאי (שלב 2.8) תאים cuvette ' תקופת דגירה של 5 דקות על קרח.
- Electroporate התאים ב- 0.23 kV, 250 capacitation. זה צריך לקחת ~ 4 ms.
- להעביר את התאים electroporated צינור 50 מ ל, להוסיף 50 מ של בינוני מלא, צנטריפוגה עבור 5 דקות ב x 515 g...
- למחוק את תגובת שיקוע והשהה מחדש את התאים עם 50 מ של מדיום מלאה.
- צלחת התאים electroporated במנות 24-ובכן התרבות (1 מ"ל לכל טוב, עבור סכום של ~ 50 בארות), דגירה-37 מעלות צלזיוס ו-5% CO2 במשך 48 שעות.
- בחר את התאים transfected עם אנטיביוטיקה. לאחר 48 שעות להוסיף 1 מ"ל של מדיום מלאה בתוספת 10 מ"ג/מ"ל G418 כדי מכל קידוח (בשלב זה עוצמת הקול הסופי בכל טוב הוא 2 מ"ל ו הריכוז הסופי של G418 בכל טוב הוא 5 מ"ג/מ"ל).
הערה: אם פלסמיד מכיל של עמידות לאנטיביוטיקה שונים, לקבוע את הריכוז לאנטיביוטיקה. דרשו ממני להרוג את התאים BW untransfected לפני צעד זה. - כל 48 שעות, למחוק היטב 1 מ"ל נפח העליונה של כל טוב ללא ערבוב המדיום בבאר (התאים BW נוטים להיות בתחתית הבאר). להוסיף בינוני מלא בתוספת 5 מ"ג/מ"ל G418 עד כל טוב, כך שאמצעי האחסון הסופי כל היטב שוב 2 מ"ל.
- לבחון את הצלחות תרבות לצמיחה תא בבארות כל באופן קבוע.
הערה: שינוי צבע של המדיום לצהוב עשוי לעזור לזהות תאים הולך וגדל; עם זאת, בתחילת המדיום יהיה צהוב בגלל G418 עצמה. זיהוי חיובי וולס (וולס עם גידול תאים). הבארות הללו G418 עמיד, ולכן צפויים להביע את החלבון פיוז'ן. תהליך זה בדרך כלל לוקח ~ 3 שבועות.
3. אימות של הביטוי של הקולטן Transfected בתאים הבארות חיובי.
- כתם התאים BW transfected עם נוגדנים ספציפיים כנגד הקולטן אשר היה transfected.
- להשוות את רמת הביטוי של הקולטן על-ידי cytometry זרימה כביטוי של תאי בקרה (untransfected BW תאים).
- לאחר אימות של בארות אחד או יותר, להשתמש בתאים ומיד למטרות ניסוי, לגדול בתרבות או להקפיא עבור יישומים עתידיים.
- ודא את הביטוי של הקולטן transfected לפני ביצוע ניסוי חדש. אחרי כמה שבועות של צמיחה, התאים עם G418 עם ביטוי הקולטן יציבה, G418 יכול להיות מושמט של המדיום תרבות.
4. דגירה של התאים Transfected BW עם מטרות
הערה: בעת שימוש התאים BW transfected בפעם הראשונה, עדיף לבדוק אותם על מטרות המבטאים של ליגנד הידוע של הקולטן של עניין או על צלחת מכורך נוגדנים במיוחד מכוונת כנגד הקולטן עניין (cross-linking ניסויים; ראה להלן, סעיף 4.2.1.3).
- רצוי, לפצל את התאים BW 24 שעות לפני הניסוי (לדוגמה, על-ידי הוספת 10 מ"ל של מדיום מלאה עד 2 מ"ל של תאים בתרבות בצלחת תרבות חדשה 10 ס מ).
- דגירה התאים BW transfected עם המטרות שלהם. לבצע את הניסוי בו זמנית על תאים שליטה BW המבטאים וקטור ריקה (או תאים BW הורים). לוחות 96F עדיפים (אך צלחות 96U יכול לשמש גם). לבצע את הניסוי דולר. להשעות את כל התאים בטווח הבינוני מלאה.
- הכינו את המטרות. סוג היעד משתנה כפונקציה של המטרה, וניתן תאים, התאים יש כבר מתפשט מראש עם נוגדנים, או נוגדנים לבד. מערכת זו גם שימש עם חיידקים כמו מטרות5.
- אם המטרות הן חלוקת תאים (קרי, שורות תאים), להאיר אותם ב 6,000 rad לפני וזמינותו. 50,000 המקום של תאי היעד בטוב יחיד של צלחת 96 (בנפח של 100 µL).
- עבור ניסויים עם נוגדנים ותאים BW לבטא FcγRs האנושי, דגירה תאי היעד עם נוגדן על קרח לתוך צלחת טוב 96 (לדוגמה, 50 µL של תאי היעד ו- 50 µL של הנוגדן; מינונים נוגדנים שונים יכול להיבדק).
- אם באמצעות נוגדנים לבד כמטרות (cross-linking ניסויים), הם צריכים להיות מאוגד-צלחת. למטרה זו, תחילה דגירה הנוגדנים במדיום מלאה בצלחת 96F עבור h 1-2-37 מעלות צלזיוס ו-5% CO2 (מנה טיפוסית ההתחלתי הוא 0.5 μg של נוגדנים ספציפיים ב- 50 μL). לשטוף את הצלחת להסיר נוגדנים לא מאוגד.
הערה: במקרה זה, צלחת 96F יאפשר קשירה של הנוגדן לצלחת, אשר לאחר תוספת של התאים BW transfected יוביל להפעלה של הקולטן transfected.
- הוסף את התאים BW (אפקטור תאים). מקום 50,000 תאים BW טוב יחיד של צלחת 96 (בנפח של 100 µL).
- להשלים את עוצמת הקול של כל טוב µL 200 במידת הצורך.
- דגירה הלוחות-37 מעלות צלזיוס ו-5% CO2 במשך 48 שעות (יכול להיות מכויל פרק זמן זה).
- הכינו את המטרות. סוג היעד משתנה כפונקציה של המטרה, וניתן תאים, התאים יש כבר מתפשט מראש עם נוגדנים, או נוגדנים לבד. מערכת זו גם שימש עם חיידקים כמו מטרות5.
- לאחר 48 שעות, להקפיא את הצלחות ב-20 ° C, להפשיר לפני אליסה, או להשתמש מיד על אליסה (ראה השלבים הבאים).
5. אליסה
- המעיל צלחת אליסה עם נוגדן אנטי עכבר il-2 (אנטי-mIL-2). מקום µg 0.05 של אנטי-mIL-2 נפח של 50 µL ל- PBS 1 x לכל טוב. דגירה לצלחת ELISA מצופה עם נוגדן אנטי-mIL-2-4 מעלות צלזיוס למשך הלילה או ב- 37 מעלות צלזיוס במשך שעתיים.
הערה: כדי לבצע דיאגנוסטיקה ישירות לאחר שלב הדגירה, הצלחת אליסה צריכה להיות מצופה 24 שעות לפני תום תקופת הדגירה של התאים BW. - למחוק את הנוזלים בצלחת אליסה ולהוסיף פתרון חסימה (200 µL לכל טוב) המורכב משילוב של 1 x PBS ו- 1% אלבומין שור (BSA). דגירה לצלחת אליסה כבר שעתיים בטמפרטורת החדר.
- לשטוף את הצלחת אליסה שלוש פעמים עם 0.05% PBS Tween פתרון (קרי, 0.5 מיליליטר Tween-20 1 ליטר 1 x PBS).
- לוקח את הצלחת 96 אשר התאים BW היו מודגרות עם המטרות שלהם (4.3). אם הצלחת היה קפוא, לגמרי להפשיר אותו (למשל., דרך אגב קצר הדגירה ב 37 מעלות צלזיוס). Centrifuge את הצלחת 96 (5 דקות, x 515 גרם) ולהעביר בזהירות µL 100 של תגובת שיקוע היטב כל לצלחת ELISA מצופה מראש וחסומים.
הערה: עליך לאסוף את תגובת שיקוע ומהצדדים של כל טוב להימנע התאים. - במידת הצורך, הוסף mIL-2 רקומביננטי עם ריכוזים מוגדרת לאחד השורות הריקות של צלחת ELISA מצופה ליצירת עיקול רגיל של מיליון-2. לדוגמה, להתחיל מריכוז mIL-2 של 2,500 pg/mL, ואז ירידה של 50% לכל העוקבים היטב; אל תוסיף mIL-2 האחרון טוב.
- דגירה את הצלחת ELISA ב 4 מעלות צלזיוס למשך הלילה או ב- 37 מעלות צלזיוס במשך שעתיים.
- לשטוף את הצלחת אליסה ארבע פעמים עם PBS Tween.
- הוספת il-2 העכבר אנטי ביוטין לצלחת אליסה. השתמש ריכוז נוגדן µg 1 ב 1 מ"ל של PBS 1 x עם 1% BSA, לחלק µL 100 לכל טוב.
- דגירה בטמפרטורת החדר מאובטח.
- לשטוף את הצלחת אליסה שש פעמים עם PBS Tween.
- הוסף streptavidin HRP מצומדת. להשתמש ריכוז של 1 µL streptavidin 1 מ ל PBSX1 עם 1% BSA, מחלקים אותו µL 100 לכל טוב.
- דגירה בטמפרטורת החדר למשך 30 דקות.
- לשטוף את הצלחת אליסה שש פעמים עם PBS Tween.
- הוסף µL 100 לכל טוב של שוייץ המצע פתרון. להשלים שלב זה במהירות כדי למזער את ההבדלים בין הבארות עקב הפרשי זמן בעת הוספת את שוייץ.
- לקרוא את הצלחת אליסה בקורא צלחת אליסה-650 nm (הקריאה ניתן לחזור אם האות חלש).
תוצאות
איור 3 ממחיש את התוצאות של ניסוי עם מערכת הכתב BW. בניסוי זה, תאים CLL מודגרות מראש עם נוגדנים anti-CD20 שונים (rituximab ו- obinutuzumab), ואז מתפשט במשותף עם transfected BW תאים המבטאים CD16a-CD3ζ. ניסויים דומים נערכו שלנו לימוד9. איור 3A מציג תמונה של צלחת אליסה raw איפה עוצמת הצבע המתאים ריכוז של מיליון-2. הניסוי בוצע דולר. ניסוי זה כלל מספר פקדים: תאים CLL מודגרות עם הורים untransfected BW תאים (בשורה העליונה), תאים CLL מודגרות עם תאים BW אקספרס CD16a-CD3ζ אבל בלי נוגדן או עם נוגדן של שליטה (שש בארות בשורה השנייה משמאל) . הדגירה של תאים BW לידי ביטוי CD16 עם תאים CLL היו מודגרות מראש עם נוגדנים anti-CD20 המושרה על הפרשת mIL-2 לעומת רמת mIL-2 מן הבארות שליטה משמעותית. חשוב, דגירה מראש של תאים CLL עם obinutuzumab anti-CD20 מופעל CD16 בצורה חזקה יותר מאשר rituximab, ידוע מציאת אשר היה recapitulated על ידי המערכת שלנו. השורה האחרונה מראה יורד ריכוז מוגדרים מראש של מיליון-2 רקומביננטי (ללא התוספת של תאים). הבאר נכון בשורה האחרונה אין מיל-2 ומייצג הקריאה רקע המופיע הדומה הבארות שליטה. איור 3B מציג כימות של התוצאות של צלחת אליסה שמוצג באיור 3 א. רמות צפיפות אופטית (OD) הומרו mIL-2 ריכוזים בהתבסס על העקומה סטנדרטי עם מיליון רקומביננטי-2. איור 3C מציג ניסוי תגובת המינון בו מינונים שונים של נוגדנים היו מודגרות מראש עם תאים CLL, ואז מתפשט עם תאים BW לבטא CD16.
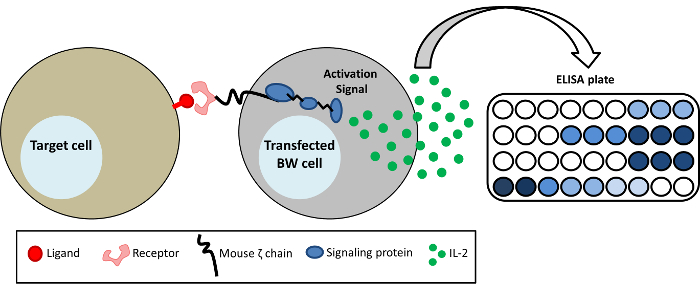
איור 1: ייצוג סכמטי של מערכת הכתב BW- BW5147 התאים הם stably transfected עם החלק חוץ-תאי של קולטנים שונים דבוקה על התחומים transmembrane, cytoplasmic של העכבר שרשרת CD3ζ (chimeric recptor-CD3ζ). הפעלה של CD3ζ-קולטן ספציפי על-ידי ליגנד התוצאה הפרשת mIL-2 אשר יכולים להתגלות על ידי אליסה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
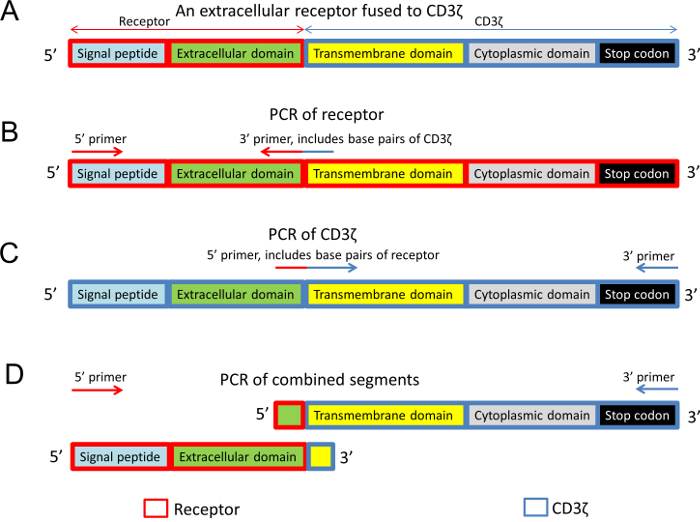
איור 2: המבנה של הקולטן-CD3ζ chimeric את העיצוב של ה-PCR תחל. (א) מבנה כללי של קולטן חוץ-תאית התמזגו לתחומים transmembrane, תאיים של העכבר CD3ζ. (ב) התחום חוץ-תאי של הקולטן היה מוגבר עם 3' פריימר אשר כללה גם את נוקלאוטידים של CD3ζ. (ג) דומיינים תאיים ו transmembrane של CD3ζ היו מוגבר עם 5' פריימר שכלל גם קולטן נוקלאוטידים. (ד), בעקבות תגובות PCR הסופי, שני המקטעים, אשר יש חפיפה רצפים, שימשו את תבנית ה-DNA. כל דמות פאנלים, חלבונים שונים תחומים קטגוריות מקודדות לפי צבעים, לכוד מלבנים כחול (רצף CD3ζ) ומלבנים אדום (הרצף קולטן). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
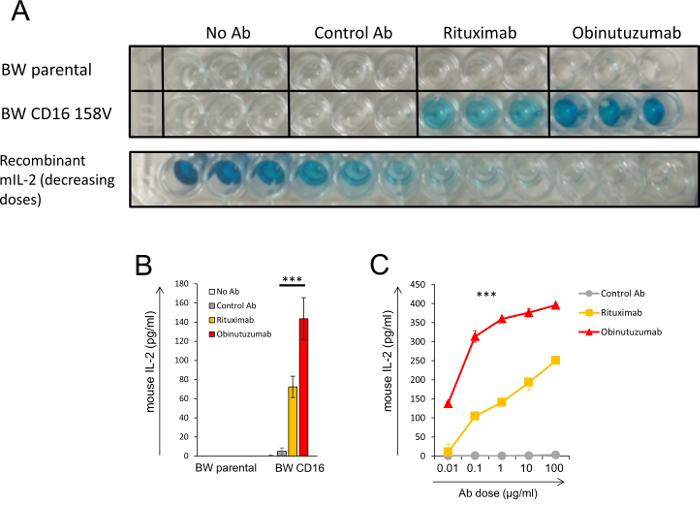
איור 3: איור של המוצר הסופי של מערכת הכתב BW- (A, B, C) תאים CLL היו מראש incubated עם או בלי שני נוגדנים anti-CD20 (rituximab ו- obinutuzumab) או של נוגדן שליטה. לאחר מכן, התאים נוגדן מכורך היו מודגרות עם תאים BW הורים או תאים BW המבטאות CD16a-CD3ζ. הרמה של 2 מיליון ב- תגובת שיקוע נקבע על ידי אליסה. (א) תמונה של צלחת אליסה raw. עוצמת צבע מציין את ריכוז mIL-2 ב- תגובת שיקוע. הניסוי בוצע דולר. השורה התחתונה מציגה את המדידה אליסה להפחתת ריכוזי רקומביננטי mIL-2 אשר נותחו באותה הצלחת. (ב) כימות של אליסה קריאת באיור (א). רמות mIL-2 חושבו באמצעות עיקול רגיל של מיליון-2. (ג) ניסוי של תגובת המינון שבו היו מינונים שונים של נוגדנים מודגרות מראש עם תאים CLL, ואז מתפשט עם תאים BW לבטא CD16a-CD3ζ. , P < 0.001; מבחן t של סטודנט (B) או ANOVA עם השוואות מרובות (C). ההשוואה היחידה ב (ג) ולא היה שונה באופן משמעותי היה rituximab ו אל פקד Ab הריכוז הראשון (0.01 µg/mL). קווי שגיאה לייצג סטיית התקן של triplicates. ניסויים דומים נערכו כחלק אחד של המחקר האחרונה שלנו9. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
כאן אנו מציגים פרוטוקול ליצירת מערכת הכתב לחקור אינטראקציות קולטן-ליגנד (ראה צורה מקוצרת של פרוטוקול זה1). הפרוטוקול מורכב משלושה חלקים עיקריים: שיבוט של חלבון chimeric, הכולל את תחום חוץ-תאי קולטן ספציפי התמזגו לתחום תאיים של CD3ζ, תרביות תאים של פלסמיד המבטאת את חלבון כימרי לתאים BW (למשל , מאת אלקטרופורציה), וזיהוי כמותי של העכבר il-2 מאת אליסה. המוצר הסופי של כל אחד מחלקים אלה צריך לאמת באופן עצמאי: תהליך השיבוט צריך להיות מאומת על ידי רצף שלם של החלבון פיוז'ן של פלסמיד היעד, תרביות תאים של תאי BW צריך לאמת על ידי בחינת הביטוי של קולטן עניין ב BW התאים (למשל, על ידי cytometry זרימה), ואת התהליך אליסה צריך לאמת על-ידי פקדים חיובי הכללית (למשל, 2 מיליון recombinant), כמו גם עם פקדים ספציפיים עבור התאים BW transfected; קרי, מטרות המבטאים של ליגנד הידוע של הקולטן עניין (לדוגמה, תאים CD48 אקספרס ניתן כפקד חיובי עבור תאים BW המבטאים את NK תא קולטן 2B4). למשל, תהליך השיבוט יכול להיות מוצלח, אבל חלבון כימרי אינו מתבטא על ידי תאים BW. במקרה כזה, יש לחזור על אלקטרופורציה. לחלופין, אם אין סימן מעל פני הרקע של צלחת אליסה (במיוחד עבור הפקדים חיובי) התאים BW transfected עשוי נכשלו להביע את הקולטן (או הביטוי אבד) או בעיה טכנית ייתכן שאירעה במהלך התהליך אליסה.
מספר שינויים יכול להתבצע על פרוטוקול זה תוך שמירה על עקרונות כלליים של ההליך. שינויים אלה כוללים את הווקטור המשמש כדי לבטא את חלבון כימרי, שיטת העבודה transfecting את פלסמיד לתאים BW ו פרמטרים ספציפיים הקשורים הדגירה אליסה כגון סוג היעד (למשל, התאים, נוגדנים, וכו ') , מספר התאים היעד או ריכוז נוגדן אם רלוונטי (אנו משתמשים 50,000 תאים לכל טוב, נוגדן מתחיל במינון של µg 0.5/טוב), זמן הדגירה (אנו משתמשים זמן הדגירה של 48 שעות) ונפח supernatant שמועבר לצלחת אליסה.
שיטה זו היא רגישה, ספציפית ולא ניתן לכמת בקלות. זה אידיאלי לסינון לנוכחות של ליגנדים עבור קולטני מסוימים (במיוחד אם ליגנד עצמה לא הוכר). לאחר הכנת transfected BW תאים המבטאים קולטן ספציפי, תאים אלה יכולים להיות קפוא, המשמש בעת הצורך לניסויים נוספים. אנחנו ואחרים השתמשו במערכת זו בהצלחה במחקרים קודמים כדי לחקור את קולטן-ליגנד אינטראקציות (לדוגמה2,3,5,12,13,14 15,16) ואת התוצאות המתקבלות על-ידי מערכת זו אומתו על ידי טכניקות אחרות. בשיטה זו יכול לשמש גם כדי ללמוד את ההפעלה של רצפטורים שונים FcγR האנושי באמצעות נוגדנים, כפי שעשו עבור נוגדנים אנטי-ויראליות בסרום-6,-7,-8 או עם נוגדנים חד-שבטיים כנגד CD20 9.
מאחר שזוהי מערכת הכתב שבו מבוטא רק על קטע חוץ-תאי של הקולטן, הממצאים שבידי מערכת זו יש השלמה על ידי ניסויים נוספים עם הקולטן אנדוגני, כגון מבחני cytotoxicity עם הטבע תאים הרוצח (NK) ללמוד אינטראקציות עם NK התא קולטנים. יתר על כן, אינטראקציות ליגנד/קולטן מסוים עלולה לא הפרשת mIL-2 על ידי מערכת הכתב, לכן אולי אפשר להתעלם. בנוסף, כמו כל הגדרת הניסוי, התוצאות צריך לאמת עבור פרמטרים שונים כפי שתואר לעיל. הדבר חשוב במיוחד במקרים בהם השוואה של שני תנאים נדרשים (למשל, הפעלת הקולטן Fc אותו באמצעות נוגדנים שונים). חשוב גם לוודא הרגישות של אינטראקציה ליגנד מסוים-קולטן הוא בתוך הטווח. ליניארית של המערכת. אחרת זה יכול להוביל ערכי הרוויה אשר עשוי למנוע השוואה תקפה בכל התנאים. זו יכולה להיות מושגת באמצעות עיקול תקן mIL-2, כמו גם על ידי יצירת עקומת מנה-תגובה עם ליגנד שנבדקו (במקרה של קולח ערכים, הפרמטרים ניסיוני צריך להיות שונה; למשל, נפח קטן יותר של תגובת שיקוע צריך להיות מנותח על ידי אליסה). עוד מגבלה אפשרי של מערכת זו הוא השימוש של התאים היעד עם הפרשות אנדוגני של מיליון-2 (למשל, העכבר T תאים) אשר יסתיר את הפרשת il-2 תאים BW. כדי להתגבר על התרחשויות אלה יוצאת דופן אשר מרותקים לתאים העכבר, מערכת זו כתב יכולים להשתפר באמצעות עיתונאי שונים (למשל, ה-GFP) אשר לא בא לידי ביטוי על-ידי תאי היעד.
Disclosures
המחברים מצהירים אין אינטרסים כלכליים מתחרים.
Acknowledgements
המחברים מודים אסתר זמר על עריכת שפה. מחקר זה נתמך על ידי המועצה האירופית למחקר תחת תכנית המסגרת השביעית של האיחוד האירופי (FP/2007-2013) / הסכם גרנט ERC מספר 320473-BacNK. תמיכה נוספת סופק על ידי אני-ליבת התוכנית התכנון ואת ועדת תקציב הקרן הלאומית למדע על ידי אני-הליבה-כרומטין ו- RNA הכונה, קרן GIF, הקרן המשפחתית על לואיס, המענק פרופסורה ICRF, הלמהולץ ישראל גרנט, הקרן Rosetrees (הכל כדי וכך). מחקר זה נתמך גם על ידי הקרן הלאומית למדע (גרנט 502/15), פרס מחקר רפואי קס ומענק מחקר של האגודה ישראל להמטולוגיה ורפואה עירוי (כדי חווה). O.M הוא פרופסור הכתר של אימונולוגיה מולקולרית.
Materials
| Name | Company | Catalog Number | Comments |
| AccuPrep, Plasmid Mini Extraction Kit | Bioneer | K-3030 | |
| Anti-mouse IL-2 | BioLegend | 503702 | |
| Biotin anti-mouse IL-2 | BioLegend | 503804 | |
| ELISA plates | De-groot | 60-655061 | |
| Fetal Bovine Serum | Sigma | F7524-500ml | |
| G418 | Mercury | MBS3458105GM | |
| Gene Pulser II | Bio-Rad | 165-2105, 165-2106, 165-2107, 165-2108, 165-2109, 165-2110 | |
| L-Glutamine | Biological industry | 03-020-1B | |
| MEM Non-Essential Amino Acids Solution | Biological industry | 01-340-1B | |
| Penicillin-Streptomycin Solution | Biological industry | 03-031-1B | |
| peroxidase streptavidin | Jackson ImmunoResearch | 016-030-084 | |
| PureLink HiPure Plasmid Filter Maxiprep Kit | ThermoFisher Scientific | K210016 | |
| RPMI-1640 Medium | Biological industry | 30-2001 | |
| Sodium Pyruvate | Biological industry | 03-042-1B | |
| TMB | SouthernBiothech | 0410-01 |
References
- Mandelboim, O., Lankry, D., Gazit, R. Natural Killer Cell Protocols. , Second edn, Humana Press. 258-262 (2010).
- Mandelboim, O., et al. Recognition of haemagglutinins on virus-infected cells by NKp46 activates lysis by human NK cells. Nature. 409 (6823), 1055-1060 (2001).
- Stanietsky, N., et al. The interaction of TIGIT with PVR and PVRL2 inhibits human NK cell cytotoxicity. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17858-17863 (2009).
- Stanietsky, N., et al. Mouse TIGIT inhibits NK-cell cytotoxicity upon interaction with PVR. European Journal of Immunology. , (2013).
- Gur, C., et al. Binding of the Fap2 protein of Fusobacterium nucleatum to human inhibitory receptor TIGIT protects tumors from immune cell attack. Immunity. 42 (2), 344-355 (2015).
- Corrales-Aguilar, E., et al. A novel assay for detecting virus-specific antibodies triggering activation of Fcgamma receptors. Journal of Immunoogical Methods. 387 (1-2), 21-35 (2013).
- Corrales-Aguilar, E., et al. Highly individual patterns of virus-immune IgG effector responses in humans. Medical Microbiology and Immunology. 205 (5), 409-424 (2016).
- Radinsky, O., et al. Sudan ebolavirus long recovered survivors produce GP-specific Abs that are of the IgG1 subclass and preferentially bind FcgammaRI. Scientific Reports. 7 (1), 6054(2017).
- Elias, S., Kahlon, S., Kotzur, R., Kaynan, N., Mandelboim, O. Obinutuzumab activates FcgammaRI more potently than other anti-CD20 antibodies in chronic lymphocytic leukemia (CLL). Oncoimmunology. 7 (6), e1428158(2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments. (63), e3998(2012).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), 253(2007).
- Bar-On, Y., et al. NKp46 Recognizes the Sigma1 Protein of Reovirus: Implications for Reovirus-Based Cancer Therapy. Journal of Virology. 91 (19), (2017).
- Glasner, A., et al. Expression, Function, and Molecular Properties of the Killer Receptor Ncr1-Noe. Journal of Immunology. 195 (8), 3959-3969 (2015).
- Glatzer, T., et al. RORgammat(+) innate lymphoid cells acquire a proinflammatory program upon engagement of the activating receptor NKp44. Immunity. 38 (6), 1223-1235 (2013).
- Gur, C., et al. The activating receptor NKp46 is essential for the development of type 1 diabetes. Nature Immunology. 11 (2), 121-128 (2010).
- Markel, G., et al. Pivotal role of CEACAM1 protein in the inhibition of activated decidual lymphocyte functions. Journal of Clinical Investigation. 110 (7), 943-953 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved