Method Article
Um sistema BW repórter para estudar interações ligante-Receptor
Neste Artigo
Resumo
Este protocolo descreve como estabelecer um sistema de repórter que pode ser usado para identificar e quantificar as interações ligante-receptor.
Resumo
Interações entre receptores e ligantes constituem um processo biológico fundamental. Direto no entanto, experimentos com células que expressam o receptor nativo e o ligante são difíceis, desde que o ligante de um receptor específico pode ser desconhecido e procedimentos experimentais com o ligante nativo podem ser tecnicamente complicados. Para lidar com esses obstáculos, descrevemos um sistema de repórter para detectar a ligação e ativação de um receptor específico por um ligante de interesse. Neste sistema de repórter, o domínio extracelular de um receptor específico é conjugado com o rato CD3ζ e esta proteína quimérico então é expressa em células de rato BW. Estas células transfectadas de BW podem então ser incubadas com diferentes alvos (por exemplo, células ou anticorpos). Ativação de um receptor transfectada leva à secreção de rato interleucina-2 (mIL-2) que pode ser detectado por ensaio imunoenzimático (ELISA). Este sistema de repórter tem as vantagens de ser sensível e específico para um único receptor. Além disso, o nível de ativação de um receptor específico pode ser facilmente quantificado e pode ser usado mesmo em casos onde o ligante do receptor é desconhecido. Este sistema foi implementado com sucesso em muitos dos nossos estudos para caracterizar as interações ligante-receptor. Recentemente nós empregamos este sistema para estudar a ativação dos receptores de Fcγ humanos (FcγRs) por anticorpos diferentes anticorpo monoclonal anti-CD20 no uso clínico.
Introdução
O sistema de repórter de BW é uma técnica para o estudo de interações ligante-receptor1. Este sistema é especialmente vantajoso quando o ligante de um receptor específico é desconhecido ou experimentos com o ligante endógeno são tecnicamente difícil. Também pode ser usada para estudar a ligação de anticorpos monoclonais para o FcγRs humano. O método baseia-se em expressar uma proteína quimérico em pilhas do rato BW. Esta proteína quimérico é composta do domínio extracelular do receptor de interesse fundido aos domínios transmembrana e intracelular da cadeia ζ rato. Vinculação de ligantes apropriadas do receptor leva a secreção de Il-2 do mouse, que pode ser facilmente detectada por ELISA, conforme ilustrado na Figura 1. Este método é sensível e específica para um receptor individual, fácil de operar e altamente reprodutíveis. -Assim, pode complementar as ferramentas adicionais para estudar interações ligante-receptor. Por exemplo, ele pode ser usado para várias linhas de célula para a presença de um ligante para um receptor específico da tela (mesmo se o ligante em si não foi identificado) ou detectar a ativação de FcγRs humana por anticorpos monoclonais ou por soro humano contendo anti-viral anticorpos. Embora células imunes primárias expressam FcγRs endógena, eles são geralmente difíceis de tratar e geralmente expressar vários receptores de Fc.
Usamos este sistema com sucesso em muitos dos nossos estudos para caracterizar as interações ligante-receptor. Estas incluem a identificação de hemaglutinina como o ligante do receptor de célula NK NKp462, identificando PVR e nectin-2 como ligantes para humanos e mouse TIGIT3,4, e mostrando que o fusobacterium nucleatum bactéria vincula e ativa o humano TIGIT5. Além disso, as células de BW que expressam receptores Fc têm sido utilizadas com sucesso para detectar anticorpos antivirais em soros da6,7,8 pacientes. Especificamente, nós recentemente estabelecido de células de BW que expressam FcγRs humano para detectar diferencial FcR ativação de anticorpos anti-CD20, usado para o tratamento da leucemia linfocítica crônica (CLL)9. Importante, os resultados do sistema BW repórter foram validados em experiências complementares.
Protocolo
1. a geração de um plasmídeo que expressa a construir quimérico
Nota: O objectivo é gerar um plasmídeo que exprime o domínio extracelular do receptor de interesse fundido aos domínios transmembrana e intracelular do mouse CD3ζ cadeia (Figura 2A).
- Recupere a sequência do domínio extracelular do receptor de interesse, incluindo o peptídeo sinal. Obter material de DNA que é esperado para expressar este receptor (por exemplo, cDNA ou um plasmídeo).
- Obter material de DNA que expressa o transmembrana e os domínios intracelulares do mouse CD3ζ cadeia (EG., cDNA ou um plasmídeo).
- Desenha a sequência da proteína de fusão com base na estrutura geral, mostrada na Figura 2A. Certifique-se de que a sequência inteira é dentro do mesmo quadro de leitura de códon. Esta sequência é usada para projetar primers apropriados e verifique se o produto final.
- Desenha duas reações de PCR para amplificar cada um dos fragmentos das proteínas de fusão separadamente (Figura 2B, 2C)10.
Nota: As condições específicas para as reações de PCR (ex., tempo de alongamento e a temperatura do recozimento) dependem da natureza dos primers, que são projetados para um receptor específico.- Amplifica o segmento extracelular do receptor.
- Desenha uma cartilha 5' que inclui parte do peptídeo sinal do receptor, uma sequência de consenso Kozak e um sítio de restrição apropriada (Figura 2B).
- Desenha uma cartilha 3' que flancos de ambas as partes da proteína de fusão (Figura 2B). Por exemplo, o desenho inicial esta cartilha 3' pode incluir os últimos 20 pares de bases do segmento extracelular do receptor e os primeiros 9 pares de bases do segmento de CD3ζ.
Nota: Não há nenhuma necessidade de adicionar um site de restrição para o 3' primer, desde que esta cartilha será usada para gerar a sequência fundida e não é utilizada para a ligadura.
- Amplifica o segmento CD3ζ.
- Desenha um primer 5' que flancos de ambas as partes da proteína de fusão (Figura 2). Por exemplo, o desenho inicial 5' primer pode incluir os última 9 pares de bases do segmento extracelular do receptor e os primeiros 20 pares de bases do segmento CD3ζ.
Nota: Não há nenhuma necessidade de adicionar um sítio de restrição para o 5' primer desde esta cartilha será usada para gerar a sequência fundida e não é utilizada para a ligadura. - Desenha uma cartilha 3' que inclui o fim da sequência de CD3ζ, bem como um sítio de restrição apropriada (Figura 2).
- Desenha um primer 5' que flancos de ambas as partes da proteína de fusão (Figura 2). Por exemplo, o desenho inicial 5' primer pode incluir os última 9 pares de bases do segmento extracelular do receptor e os primeiros 20 pares de bases do segmento CD3ζ.
- Corrigi as sequências de primer em cada uma destas duas reações para que a temperatura do recozimento é semelhante em cada par (note que o primer, que inclui sequências de duas partes da proteína de fusão, apenas anneals com parte da sequência em cada reação).
- Amplifica o segmento extracelular do receptor.
- Realizar um PCR adicional em que uma mistura dos produtos das duas primeiras reações do PCR é usada como o modelo de DNA com o primer 5' do segmento extracelular do receptor (etapa 1.4.1.1) e a 3' do segmento CD3ζ (etapa 1.4.2.2) (Figura 2D),10 . Esta reação deve gerar a sequência final do fundido.
- Proceda como de costume para clonagem.
- Ligar o produto final do PCR para o destino cortou vector (vetor alvo é geralmente pcDNA3 que expressa a resistência G418 e ampicilina).
- Transforme o vetor ligado em bactérias competentes11.
- Descongele 50 µ l de bactérias competentes no gelo.
- Adicione o vetor ligado à bactéria e incubar no gelo por 20 min.
- Incubar a 42 ° C por 45 s.
- Adicione 200 µ l de LB sem antibióticos.
- Incube durante 1 h a 37 ° C, com agitação contínua.
- Sementes em um prato LB com os antibióticos apropriados (por exemplo, ampicilina solução com uma concentração final de 0,1 mg/mL).
- Coletar e crescer várias colónias bacterianas em 5 mL de LB (em tubos de 15 mL).
- No dia seguinte, extrair plasmídeos com um mini kit de preparação.
- Analise a inserção de gene com enzimas de restrição.
- Sequenciar as colônias relevantes e verifique se a sequência e o quadro de leitura (conforme indicado na etapa 1.3).
- Transforme o plasmídeo verificado em bactérias competentes11.
- Descongele a 20 µ l das bactérias competentes no gelo.
- Adicionar 1 µ l do plasmídeo para as bactérias e incubar no gelo por 20 min.
- Incubar a 42 ° C por 45 s.
- Adicione 200 µ l de LB sem antibióticos.
- Incube durante 1 h a 37 ° C, com agitação contínua.
- Sementes em uma placa de crescimento bacteriano com os antibióticos apropriados (por exemplo, ampicilina solução com uma concentração final de 0,1 mg/mL).
- No dia seguinte, cresce uma colônia bacteriana em um grande recipiente LB com ampicilina 0,1 mg/mL (~ 250 mL).
- No dia seguinte, realize prep maxi de acordo com as instruções específicas fornecidas pelo kit.
Nota: Para o procedimento de eletroporação, uma grande quantidade de plasmídeo é exigida, conforme detalhado abaixo.
2. a transfeccao do plasmídeo que expressa a proteína quimérico em células de BW
Nota: Diferentes métodos também podem ser empregados para transfeccao (EG., por infecção lentivirus). Antes o electroporation, execute a precipitação do álcool etílico do DNA conforme descrito abaixo. As próximas etapas exigem condições estéreis.
- No dia anterior, prepare as BW5147 células ("BW") para eletroporação. 10 placas (de 10 cm) com 10 mL de 100.000 BW5147 células/mL (ou seja, um total de 10 x 106 células) da placa com RPMI suplementado com soro fetal bezerro de 10% (FCS), piruvato de sódio 1%, 1% L-glutamina, 1% não aminoácidos essenciais e 1% penicilina-estreptomicina ("meio completo").
- Coloque 100 µ g do plasmídeo pcDNA3 que expressa a proteína de fusão em um tubo de 1,5-2 mL e adicionar o acetato de sódio 3M pH de 5,3-5,5 a ele. O volume do acetato de sódio deve corresponder a 0,1 (10%) do volume da 100 µ g plasmídeo; titular o pH do acetato de sódio com um medidor de pH pela adição de NaOH ou HCl.
- Adicione 2,5 volumes de etanol 100% a mistura do plasmídeo e o acetato de sódio, conforme descrito no passo 2.2 (2.5 x volume total de plasmídeo e sódio acetato). Incubar durante uma noite a-20 ° C ou por 2 h a 70 ° C.
- 2.4. 24h após tem sido banhadas às células de BW, coletar todas as BW células (~ 100 mL) em tubos de 2 50 mL. Centrifugar as células durante 5 min à 515 x g e descartar o sobrenadante.
- Ressuspender o pellet de ambos os tubos em 25 mL de RPMI - em um tubo único de 50 mL. Por exemplo, Ressuspender o sedimento de um tubo com 25 mL de RPMI - e em seguida, use este líquido para re-suspender o fluido no tubo de 50 mL, para que o sedimento total das células BW é re-suspenso em 25 mL do meio em um único tubo.
Nota: O meio deve ser sem adições, desde que o soro pode interferir com a eletroporação. - Centrifugar as células novamente por 5 min em 515 x g. Ressuspender o pellet em 1 mL de RPMI e transferir o conteúdo para uma cubeta de 0,4 cm no gelo.
- Centrifugue o plasmídeo que foi submetido a precipitação do álcool etílico (passo 2.3) por 30 min em 16.000 x g e 4 ° C.
- Lave uma vez com 1 mL de etanol a 70% e centrifugar por mais 20 min em 16.000 x g e 4 ° C (para lavar o sal).
- Remover todo o etanol e deixar o sedimento secar ligeiramente (ou seja, em um tubo aberto do capuz de cultura de tecidos). Ressuspender o sedimento com 100 µ l de RPMI-previamente aquecida a 60 ° C.
- Adicionar o plasmídeo re-suspenso (2.8 passo) para as células a cubeta e incubar durante 5 min no gelo.
- Electroporate as células em 0.23 kV, 250 capacitação. Isso deve levar ~ 4 ms.
- Transfira as células electroporated para um tubo de 50 mL, adicionar 50 mL de meio completo e centrifugar por 5 min em 515 x g.
- Desprezar o sobrenadante e ressuspender as células com 50 mL de meio completo.
- As células electroporated em pratos de cultura bem-24 (1 mL por bem, para um total de ~ 50 poços) da placa e incubar a 37 ° C e 5% CO2 por 48 h.
- Selecione as células transfectadas com antibióticos. Depois de 48 h adicionar 1 mL de meio completo, suplementado com 10 mg/mL G418 a cada poço (nesta fase o volume final em cada bem é 2 mL e a concentração final de G418 em cada bem é de 5 mg/mL).
Nota: Se o plasmídeo contém uma resistência aos antibióticos diferente, determine a concentração do antibiótico, necessária para matar as células de BW untransfected antes desta etapa. - Cada 48h, cuidadosamente descartar 1 mL do volume superior de cada poço sem agitando o meio no poço (as células de BW tendem a estar no fundo do poço). Adicione completo suplementado com 5 mg/mL G418 para cada poço, para que o volume final em cada poço é novamente 2 mL.
- As placas de cultura para o crescimento de células em todos os poços Examine regularmente.
Nota: Uma mudança na cor do meio para amarelo pode ajudar a identificar o crescimento de células; no entanto, no início o médio será amarelo devido a G418 em si. Identifica positivos poços (poços com o crescimento de células). Esses poços são G418 resistente e, portanto, são esperados para expressar a proteína de fusão. Este processo normalmente leva ~ 3 semanas.
3. verificação da expressão do Receptor Transfectada nas células dos poços positivos.
- Mancha de células transfectadas com um anticorpo específico contra o receptor que foi transfectado BW.
- Compare o nível de expressão do receptor por citometria de fluxo para a expressão das controle células (untransfected BW).
- Após a verificação de um ou mais poços, usar células imediatamente para fins experimentais, crescer em cultura ou congelar para aplicações futuras.
- Verifique se a expressão do receptor transfectada antes de executar uma nova experiência. Após algumas semanas de crescimento, as células com G418 com uma expressão de receptores estável, G418 pode ser omitida do meio de cultura.
4. incubação das células transfectadas BW com alvos
Nota: Quando utilizar células transfectadas BW pela primeira vez, é preferível para testá-los em alvos que expressam um conhecido ligante do receptor de interesse ou na placa-limite anticorpos especificamente dirigidos contra o receptor de interesse (cross-linking experiências; Veja abaixo, secção 4.2.1.3).
- De preferência, dividi as células BW 24 h antes do experimento (por exemplo, adicionando 10 mL de meio completo a 2 mL de células em cultura em uma nova placa de cultura de 10 cm).
- Incube as celulas transfectadas de BW com seus alvos. Realizar o experimento simultaneamente nas células de controle BW que expressam um vetor vazio (ou células de BW parentais). 96F placas são preferíveis (mas 96U placas também podem ser usadas). Realizar o experimento em triplicado. Suspenda todas as células no meio de completa.
- Prepare os alvos. O tipo de alvo varia em função do objectivo e pode ser células, as células que têm sido pré-incubadas com anticorpos, ou anticorpos sozinhos. Este sistema também tem sido usado com bactérias como metas5.
- Se as metas estão dividindo pilhas (isto é, linhas de células), eles irradiam em 6.000 rad antes do ensaio. Lugar de 50.000 das células alvo em um único poço de uma placa de 96 (em um volume de 100 µ l).
- Para experimentos com anticorpos e células de BW que expressam a FcγRs humana, incubar as células alvo com um anticorpo no gelo em um prato bem 96 (por exemplo, 50 µ l das células alvo e 50 µ l do anticorpo; doses diferentes de anticorpo podem ser testados).
- Se usando anticorpos sozinhos como alvos (cross-linking experimentos), devem estar ligados a placa. Para esta finalidade, primeiro incube os anticorpos em um meio completo em uma placa de 96F para 1-2 h a 37 ° C e 5% CO2 (uma típica dose inicial é de 0.5 μg de um anticorpo específico em 50 μL). Lave a placa para remover anticorpos não acoplados.
Nota: neste caso, uma placa 96F permitirá a ligação do anticorpo para a placa, que após a adição das células transfectadas BW levará a ativação do receptor transfectada.
- Adicione as células de BW (células efetoras). Coloque 50.000 células BW em um único poço de uma placa de 96 (em um volume de 100 µ l).
- Complete o volume em cada poço a 200 µ l, se necessário.
- Incube as placas a 37 ° C e 5% CO2 por 48 h (este período pode ser calibrado).
- Prepare os alvos. O tipo de alvo varia em função do objectivo e pode ser células, as células que têm sido pré-incubadas com anticorpos, ou anticorpos sozinhos. Este sistema também tem sido usado com bactérias como metas5.
- Após 48 h, congelar as placas a-20 ° C e degelo antes da ELISA, ou usá-lo imediatamente para ELISA (ver próximos passos).
5. ELISA
- Revesti uma placa de ELISA com um anticorpo de IL-2 anti-rato (anti-mIL-2). Coloque 0,05 µ g de mIL-2 em um volume de 50 µ l de PBS 1x por bem. Incube a placa de ELISA revestida com o anticorpo anti-mIL-2 a 4 ° C durante a noite ou a 37 ° C por 2 h.
Nota: Para executar ELISA diretamente após a etapa de incubação, a ELISA deve ser revestida 24 h antes do final do período de incubação das células BW. - Descartar o líquido na placa de ELISA e adicionar uma solução de bloqueio (200 µ l por alvéolo) que é composta de 1X PBS e 1% albumina de soro bovino (BSA). Incube a placa de ELISA para 2 h à temperatura ambiente.
- Lave a placa de ELISA três vezes com solução de PBS Tween 0,05% (ou seja, 0,5 mL de Tween-20 em 1 litro de 1X PBS).
- Pegue a placa de 96 que tem as células de BW que foram incubadas com seus alvos (4.3). Se a placa foi congelada, derretê-lo completamente (EG., por curto de incubação a 37 ° C). Centrifugue a placa 96 (5 min, 515 x g) e com cuidado transferir 100 µ l do sobrenadante em cada poço para a placa de ELISA pré-pintados e bloqueada.
Nota: O sobrenadante deve ser coletado dos lados de cada poço para evitar tomar as células. - Se desejar, adicione mIL-2 recombinante com concentrações definidas para uma das linhas vazias da placa de ELISA revestida para gerar uma curva padrão de mIL-2. Por exemplo, iniciar a partir de uma concentração de 2 mIL de 2.500 pg/mL e depois diminuir em 50% em cada poço subsequente; Não adicione mIL-2 para o último bem.
- Incube a placa de ELISA a 4 ° C durante a noite ou a 37 ° C por 2 h.
- Lave a placa de ELISA quatro vezes com PBS Tween.
- Adicione biotina anti-rato IL-2 para a placa de ELISA. Usar uma concentração de 1 µ g de anticorpo em 1 mL de 1X PBS com 1% de BSA e divida em 100 µ l por bem.
- Incube a temperatura ambiente durante 1 h.
- Lave a placa de ELISA seis vezes com PBS Tween.
- Adicione streptavidin HRP conjugado. Usar uma concentração de 1 µ l streptavidin em 1 mL de PBSX1 com 1% de BSA e dividi-lo em 100 µ l por bem.
- Incube a temperatura ambiente por 30 min.
- Lave a placa de ELISA seis vezes com PBS Tween.
- Adicione 100 µ l por poço da solução de substrato TMB. Complete esta fase rapidamente para minimizar as diferenças entre os poços devido desfasamentos temporais ao adicionar o TMB.
- Leia a placa ELISA com um leitor ELISA a 650 nm (a leitura pode ser repetido se o sinal é fraco).
Resultados
A Figura 3 ilustra os resultados de uma experiência com um sistema de repórter de BW. Neste experimento, células CLL foram previamente incubadas com anticorpos diferentes anti-CD20 (rituximab e obinutuzumab) e então co incubadas com células transfectadas de BW que expressam CD16a-CD3ζ. Experimentos semelhantes foram realizados em nosso estudo9. Figura 3A apresenta uma imagem de uma placa de ELISA cru onde a intensidade da cor corresponde a uma concentração de 2 mIL. O experimento foi realizado em triplicata. Esta experiência inclui vários controles: células CLL incubadas com células de BW untransfected parentais (linha superior) e células CLL incubadas com células de BW que expressam CD16a-CD3ζ, mas sem um anticorpo ou com um anticorpo de controlo (seis poços na segunda fila à esquerda) . A incubação de células de BW que expressa CD16 com células CLL que foram previamente incubadas com anticorpos anti-CD20 induzida uma secreção significativa de mIL-2 em comparação com o nível 2 mIL dos poços de controle. Importante, pré-incubação das células CLL com o obinutuzumab de anti-CD20 ativado CD16 mais fortemente do que o rituximab, um conhecido achando que foi instaurada pelo nosso sistema. A última linha mostra decrescente concentrações pré-definidas de mIL-2 recombinante (sem a adição de células). O poço certo na última linha não tem mIL-2 e representa a leitura de plano de fundo, que parece semelhante aos poços de controle. Figura 3B apresenta a quantificação dos resultados da placa ELISA mostrado na Figura 3A. Os níveis de densidade óptica (OD) foram convertidos em concentrações de mIL-2, com base na curva padrão com mIL-2 recombinante. A Figura 3 apresenta um experimento de resposta de dose onde diferentes doses de anticorpos foram previamente incubados com células CLL e então incubadas com células de BW expressando CD16.
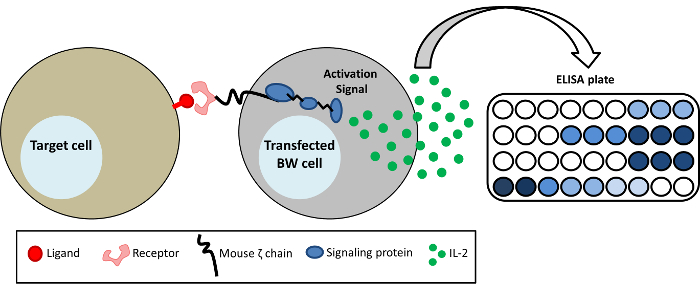
Figura 1: representação esquemática do sistema BW repórter. BW5147 células são estàvel transfected com a porção extracelular de diferentes receptores fundidos aos domínios transmembrana e citoplasmática do mouse CD3ζ cadeia (quimérico recptor-CD3ζ). Ativação de um receptor específico-CD3ζ por um ligante resulta em uma secreção de mIL-2, que pode ser detectados por ELISA. Clique aqui para ver uma versão maior desta figura.
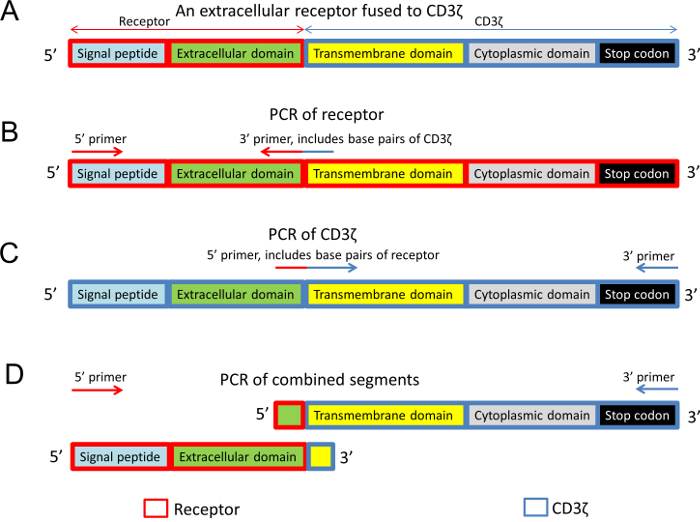
Figura 2: estrutura do receptor quimérico-CD3ζ e o desenho de iniciadores de PCR. (A) estrutura geral de um receptor extracelular fundidos aos domínios transmembrana e intracelular de rato CD3ζ. (B) o domínio extracelular do receptor era amplificado com uma cartilha 3' que também incluía nucleotídeos de CD3ζ. (C) os domínios transmembranares e intracelulares de CD3ζ foram ampliados com um 5' primer que também incluía a nucleotídeos do receptor. (D) na reação de PCR do final, ambos os segmentos, que têm sobreposição de sequências, foram usados como o modelo de DNA. Em todos os painéis de figura, domínios diferentes da proteína são codificados por cores e encaixotados em retângulos azuis (sequência de CD3ζ) e vermelhos retângulos (a sequência do receptor). Clique aqui para ver uma versão maior desta figura.
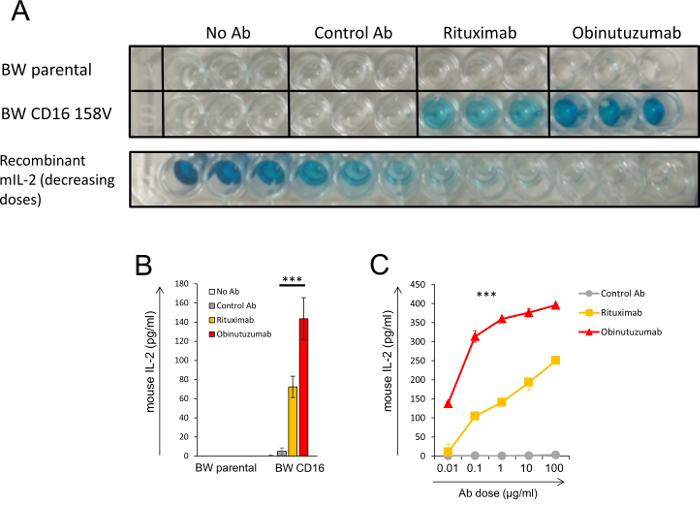
Figura 3: ilustração do produto final do sistema BW repórter. (A, B, C) Células CLL foram pré-incubado com ou sem dois anticorpos anti-CD20 (rituximab e obinutuzumab) ou um anticorpo de controle. Depois disso, as células de anticorpos ligados foram incubadas com parental BW de células ou células de BW que expressam CD16a-CD3ζ. O nível de mIL-2 no sobrenadante foi determinado pelo ELISA. (A) uma imagem de uma placa de ELISA cru. Intensidade de cor indica a concentração de 2 mIL no sobrenadante. O experimento foi realizado em triplicata. A linha inferior mostra a leitura de ELISA na diminuição da concentração de mIL-2 recombinante que foram analisadas no mesmo prato. B quantificação do ELISA lendo mostrada em (A). Os níveis de mIL-2 foram calculados utilizando uma curva padrão de mil-2. (C) um dose resposta experimento onde diferentes doses de anticorpos foram previamente incubados com células CLL e então incubadas com células de BW expressando CD16a-CD3ζ. , P < 0,001; Teste t de Student (B) ou ANOVA com comparações múltiplas (C). A única comparação em (C) que não foi significativamente diferente foi para rituximab e o controle Ab na primeira concentração (0,01 µ g/mL). Barras de erro representam o desvio padrão da triplica. Experimentos semelhantes foram realizados como parte de um dos nosso recente estudo9. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui nós apresentamos um protocolo para a geração de um sistema de repórter para investigar interações ligante-receptor (ver a forma abreviada do presente protocolo em1). O protocolo é composto de três partes principais: clonagem de uma proteína quimérico, que inclui o domínio extracelular de um receptor específico fundido ao domínio intracelular de CD3ζ, transfection de um plasmídeo que expressa a proteína de fusão de células de BW (por exemplo, , por eletroporação) e a detecção quantitativa de rato IL-2 por ELISA. O produto final de cada uma destas peças deve ser verificado de forma independente: o processo de clonagem deve ser verificado por sequenciação completa da proteína de fusão em plasmídeo o alvo, o transfection das células BW deve ser verificado, examinando a expressão da receptor de interesse nas células BW (por exemplo, por citometria de fluxo) e o processo de ELISA deve ser verificada por controles positivos gerais (por exemplo, mIL-2 recombinante), bem como com controles específicos para as células transfectadas de BW; ou seja, metas que expressam um conhecido ligante do receptor de interesse (por exemplo, células que CD48 express pode ser usado como um controle positivo para células de BW que expressam o NK 2B4 receptor de células). Por exemplo, o processo de clonagem pode ser bem sucedido, mas a proteína de fusão não é expresso pelas células BW. Neste caso, deve ser repetida a eletroporação. Como alternativa, se não houver nenhum sinal acima do nível do fundo da placa de ELISA (especialmente para os controles positivos) podem ter falhado as células transfectadas de BW expressar o receptor (ou a expressão foi perdida) ou um problema técnico pode ter ocorrido durante o o processo de ELISA.
Diversas modificações podem ser feitas ao presente protocolo, preservando os princípios gerais do processo. Essas modificações incluem o vetor usado para expressar a proteína de fusão, o método para transfecting o plasmídeo para células de BW e parâmetros específicos relacionados com a incubação e ELISA, tais como o tipo de destino (por exemplo, células, anticorpos, etc.) , número de células-alvo ou a concentração de anticorpos se relevantes (nós usamos 50.000 células por poço e um anticorpo começando a dose de 0,5 µ g/poço), tempo de incubação (usamos um tempo de incubação de 48 h) e o volume sobrenadante que é transferido para a placa de ELISA.
Este método é sensível, específico e podem ser facilmente quantificadas. É ideal para triagem para a presença de ligantes para receptores específicos (especialmente se o ligante em si não foi reconhecido). Depois de preparar células transfectadas de BW que expressam um receptor específico, estas células podem ser congeladas e usadas quando necessário para as experiências adicionais. Nós e os outros têm usado este sistema com sucesso em estudos anteriores para explorar interações ligante-receptor (por exemplo2,3,5,12,13,14 15,,16) e os resultados obtidos por este sistema têm sido verificados por outras técnicas. Esse método também pode ser usado para estudar a ativação dos diferentes receptores de FcγR humanas por anticorpos, como tem sido feito para anticorpos antivirais no soro6,7,8 , ou com anticorpos monoclonais contra CD20 9.
Uma vez que este é um sistema de repórter em que apenas o segmento extracelular do receptor é expresso, os resultados obtidos por este sistema devem ser complementados por experiências adicionais com os receptores endógenos, tais como ensaios de citotoxicidade com natural receptores de células células assassinas (NK) para estudar as interações com o NK. Além disso, certas interações ligante/receptor não podem resultar em uma secreção de 2 mIL pelo sistema de repórter e, portanto, podem ser negligenciadas. Além disso, como em qualquer instalação experimental, os resultados devem ser verificados para vários parâmetros como descrito acima. Isto é especialmente importante nos casos em que uma comparação das duas condições necessárias (por exemplo, ativação do receptor Fc mesmo por anticorpos diferentes). Também é importante verificar se a sensibilidade de uma interação ligante-receptor específico está dentro da escala linear do sistema. Caso contrário, isso pode levar a valores de saturação que podem impedir uma comparação válida em condições. Isto pode ser conseguido por meio de uma curva padrão mIL-2, bem como gerando uma curva de dose-resposta com o ligante testado (no caso de saturar os valores, os parâmetros experimentais devem ser modificados; por exemplo, um menor volume de sobrenadante deve ser analisada por ELISA). Outra possível limitação deste sistema é a utilização de células-alvo com secreção endógena de mIL-2 (por exemplo, pilhas do rato T) que iria mascarar a secreção de IL-2 das células de BW. Para superar essas ocorrências altamente incomuns que ficam confinadas em células de rato, este sistema de repórter poderia ser melhorado usando um repórter diferente (por exemplo, GFP) que não é expresso pelas células alvo.
Divulgações
Os autores declaram não concorrentes interesses financeiros.
Agradecimentos
Os autores agradecer Esther Singer para o idioma de edição. Este estudo foi suportado pelo Conselho Europeu de investigação no âmbito do sétimo programa-quadro da União Europeia (FP/2007-2013) / Convenção de subvenção ERC número 320473-BacNK. Apoio adicional foi fornecido pelo eu-núcleo programa do Comité de orçamento e o planejamento e a Israel Science Foundation e pelo eu-núcleo na cromatina e RNA na regulação gênica, o GIF Foundation, Fundação da família Lewis, a concessão de professor Paulo, o Helmholtz Israel grant e a confiança de Rosetrees (todos de O.M.). Este estudo foi suportado também pela Israel Science Foundation (grant 502/15), o prêmio de pesquisa médica Kass e uma bolsa de investigação da sociedade de Israel de Hematologia e medicina transfusional (para samarone). Okoda é um professor de coroa de Imunologia Molecular.
Materiais
| Name | Company | Catalog Number | Comments |
| AccuPrep, Plasmid Mini Extraction Kit | Bioneer | K-3030 | |
| Anti-mouse IL-2 | BioLegend | 503702 | |
| Biotin anti-mouse IL-2 | BioLegend | 503804 | |
| ELISA plates | De-groot | 60-655061 | |
| Fetal Bovine Serum | Sigma | F7524-500ml | |
| G418 | Mercury | MBS3458105GM | |
| Gene Pulser II | Bio-Rad | 165-2105, 165-2106, 165-2107, 165-2108, 165-2109, 165-2110 | |
| L-Glutamine | Biological industry | 03-020-1B | |
| MEM Non-Essential Amino Acids Solution | Biological industry | 01-340-1B | |
| Penicillin-Streptomycin Solution | Biological industry | 03-031-1B | |
| peroxidase streptavidin | Jackson ImmunoResearch | 016-030-084 | |
| PureLink HiPure Plasmid Filter Maxiprep Kit | ThermoFisher Scientific | K210016 | |
| RPMI-1640 Medium | Biological industry | 30-2001 | |
| Sodium Pyruvate | Biological industry | 03-042-1B | |
| TMB | SouthernBiothech | 0410-01 |
Referências
- Mandelboim, O., Lankry, D., Gazit, R. . Natural Killer Cell Protocols. , 258-262 (2010).
- Mandelboim, O., et al. Recognition of haemagglutinins on virus-infected cells by NKp46 activates lysis by human NK cells. Nature. 409 (6823), 1055-1060 (2001).
- Stanietsky, N., et al. The interaction of TIGIT with PVR and PVRL2 inhibits human NK cell cytotoxicity. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17858-17863 (2009).
- Stanietsky, N., et al. Mouse TIGIT inhibits NK-cell cytotoxicity upon interaction with PVR. European Journal of Immunology. , (2013).
- Gur, C., et al. Binding of the Fap2 protein of Fusobacterium nucleatum to human inhibitory receptor TIGIT protects tumors from immune cell attack. Immunity. 42 (2), 344-355 (2015).
- Corrales-Aguilar, E., et al. A novel assay for detecting virus-specific antibodies triggering activation of Fcgamma receptors. Journal of Immunoogical Methods. 387 (1-2), 21-35 (2013).
- Corrales-Aguilar, E., et al. Highly individual patterns of virus-immune IgG effector responses in humans. Medical Microbiology and Immunology. 205 (5), 409-424 (2016).
- Radinsky, O., et al. Sudan ebolavirus long recovered survivors produce GP-specific Abs that are of the IgG1 subclass and preferentially bind FcgammaRI. Scientific Reports. 7 (1), 6054 (2017).
- Elias, S., Kahlon, S., Kotzur, R., Kaynan, N., Mandelboim, O. Obinutuzumab activates FcgammaRI more potently than other anti-CD20 antibodies in chronic lymphocytic leukemia (CLL). Oncoimmunology. 7 (6), e1428158 (2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments. (63), e3998 (2012).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), 253 (2007).
- Bar-On, Y., et al. NKp46 Recognizes the Sigma1 Protein of Reovirus: Implications for Reovirus-Based Cancer Therapy. Journal of Virology. 91 (19), (2017).
- Glasner, A., et al. Expression, Function, and Molecular Properties of the Killer Receptor Ncr1-Noe. Journal of Immunology. 195 (8), 3959-3969 (2015).
- Glatzer, T., et al. RORgammat(+) innate lymphoid cells acquire a proinflammatory program upon engagement of the activating receptor NKp44. Immunity. 38 (6), 1223-1235 (2013).
- Gur, C., et al. The activating receptor NKp46 is essential for the development of type 1 diabetes. Nature Immunology. 11 (2), 121-128 (2010).
- Markel, G., et al. Pivotal role of CEACAM1 protein in the inhibition of activated decidual lymphocyte functions. Journal of Clinical Investigation. 110 (7), 943-953 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados