A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מבצע ספקטרוסקופיית על חלקיקי פלמונית עם מיקרוסקופ ניגוד מבוסס שידור מסוג Nomarski הפרעות דיפרנציאליות
In This Article
Summary
המטרה של פרוטוקול זה היא לפרט גישה מוכחת להכנת דגימות הפלמונית ננו-חלקיק ולביצוע ספקטרוסקופיית חלקיקים בודדים עליהם בעזרת מיקרוסקופ בניגוד להפרעות דיפרנציאליות (DIC).
Abstract
מיקרוסקופ ניגודיות הפרעות דיפרנציאלי (DIC) הוא כלי דימות רב עוצמה הנפוץ ביותר עבור אובייקטים של מיקרוגוני דימות באמצעות אור גלוי לטווח. מטרת פרוטוקול זה היא לפרט שיטה מוכחת להכנת דגימות פלננו-חלקיק וביצוע ספקטרוסקופיית חלקיקים בודדים עליהם עם מיקרוסקופ DIC. יש לעקוב אחר מספר צעדים חשובים על מנת לבצע ניסויים ספקטרוסקופית הניתנים לשחזור. ראשון, ציוני דרך יכולים להיות חרוט לתוך המצע לדוגמה, אשר מסייע באיתור משטח המדגם לעקוב אחר אזור העניין במהלך ניסויים. לאחר מכן, על המצע להתנקות כראוי מפסולת ומזהמים שעלולים להפריע או לטשטש בדיקה אחרת של המדגם. לאחר שמדגם מוכן כראוי, הנתיב האופטי של המיקרוסקופ חייב להיות מיושר, באמצעות תאורה קוסלר. עם תקן Nomarski בסגנון מיקרוסקופ DIC, סיבוב של המדגם עשוי להיות נחוץ, במיוחד כאשר חלקיקים פלמונית מציגים תכונות אופטיות תלויי אוריינטציה. מכיוון שמיקרוסקופיה הDIC מכיל שני שדות פולריזציה מנוגדים, תבנית הניגודיות הDIC התלויה באורך הגל חושפת את כיוון הננו-חלקיקים מפלסטיק בצורת מוט. לבסוף, יש לבצע בקפידה את רכישת הנתונים וניתוחי הנתונים. מקובל לייצג נתוני ספקטרוסקופיה מבוססי DIC כערך ניגודיות, אך ניתן גם להציג אותו כנתוני עוצמה. בהפגנה זו של DIC עבור ספקטרוסקופיית חלקיקים בודדים, המוקד הוא על כדורי חלקיקי זהב בצורת מוט.
Introduction
מאז שנות השמונים, מיקרוסקופ הפרעות הדיפרנציאליות (DIC) הוצג בעיקר כשיטת דימות חשובה השמורה לאובייקטים מיקרוקשקשים בתוך המדעים הביולוגיים. עם זאת, במהלך התפתחותו בשנות ה-50 וה-60, היא נועדה להיות טכניקה של מדעי החומרים1. עם הפיתוחים האחרונים במדעי החומרים הקשורים לחלקיקי פלמונית, התרחש עניין מוגבר באפיון חומרים עם מיקרוסקופ אופטי.
טכניקות אופטיות רבות זמינות בהחלט עבור אפיון ננו (למשל, שדה חשוך, ברייטפילד, אור מקוטב, זריחה, וכו '). השדה האפל פופולרי מאוד במחקר ננו-חלקיק, אבל הוא מסתמך אך ורק על אוסף של פיזור ומספק מידע מוגבל על דגימות מורכבות2. הקרינה הפלואורסצנטית יכול להיות שימושי, אבל רק עם דגימות כי האור או זה יכול להיות מוכתם כראוי. מיקרוסקופ DIC יש מספר תכונות העושות את זה כלי רב ערך לניתוח של חלקיקים. היתרונות הבולטים ביותר של DIC בהשוואה לשיטות אחרות ולגבי חלקיקי פלמונית הם: אין צורך בצביעת מדגם, אין השפעות ההילה, עומק שדה רדוד ורזולוציה גבוהה לרוחב3. DIC כולל עוצמות נוספות החשובות לחקר הפלמונית ננו-חלקיק. קודם כל, שני שדות הפולריזציה הטבועים והאנכיים נמצאים, וניתן למדוד אותם בו למטרות ספקטרוסקופיה2. שנית, האות מקוטב של חלקיקי חלקיקים לא נלכד בתמונה הסופית2, אשר יכולה להיות סיבה לדאגה רצינית במדידות בשדה הכהה ספקטרוסקופיית.
מטרתה של מאמר זה היא לספק מתודולוגיה ברורה לשימוש במיקרוסקופיה DIC של נוארסקי משודרים לביצוע ספקטרוסקופיה על חלקיקי פלמונית. למרות DIC היא טכניקה רבת עוצמה אשר ניתן להחיל על חומרים מגוונים מאוד, היא גם טכניקה הדורשת מיומנות גדולה והבנה כדי להפעיל אותו כראוי כאשר הדמיה חלקיקים. מיקרוסקופיה DIC מבוססת שידור יש מסלול אור מורכב1 שייבדק רק בקצרה כאן. הרכבת האופטית של DIC מוצגת באיור 1. אור מועבר דרך המיקרוסקופ על ידי הראשון עובר דרך מקטפה ומנסרה הקרן הפיצול Nomarski לפני ההתמקדות על ידי הקבל על המטוס לדוגמה. לאחר שעבר דרך המטרה, האור נתקל בקרן-שילוב של פריזמה Nomarski ומנתח לפני היציאה לגלאי. שני מקטני הקיטוב והפריזנוארסקי הינם קריטיים להיווצרות הדימוי הDIC, והינם אחראים להפקת שדות הפולריזציה האורתוגונתיים של DIC1. עבור הקורא המעוניין לדעת יותר על עקרונות העבודה והנתיב האופטי של מיקרוסקופים DIC של נוארסקי, או ההבדלים בין נוארסקי DIC וסגנונות אחרים של DIC, עיין בחשבונות אחרים הנכתבים בנושאים הבאים1, ד , מיכל 5 , מיכל בן 6 , 7. לאחר מכן
חשוב באותה מידה להבין את האופי הבסיסי של חלקיקי הפלמונית לפני שמנסים לבצע ספקטרוסקופיה עליהם, בין אם מדובר בנוארסקי DIC, בשדה החשוך או בכל טכניקה מיקרוסקופית אחרת. בתחום הפלמונניקס, חלקיקי חלקיקים מוגדרים כחלקיקים עם ממדים בקנה מידה של 10-100 ננומטר8,9. חלקיקים יכולים לקחת על צורות רבות (למשל, כדורים, מוטות, כוכבים, מטומטם, וכו '), ואת רוב התכונות החשובות שלהם נובעים אינטראקציות עם אור אולטרה סגול-גלוי ליד טווח אינפרא אדום של הספקטרום האלקטרומגנטי. המונח "פלמונית" אינו מוגבל לחלקיקים10; עם זאת, כאשר דנים חלקיקים, הוא משמש התייחסות מקומי פלמון משטח תהודה (LSPR). LSPR היא תופעה שבה אלקטרונים ההולכה ב ננו-חלקיק נדנוד בשל האינטראקציה עם הקולון עם קרינה אלקטרומגנטית של להקה בתדר מאוד ספציפי וצרה יחסית8. באותם תדרים, חלקיקים פלמונית התערוכה הגדילו את ספיגת האור ופיזור האורות, מה שהופך אותם להיות נצפה עם מיקרוסקופ אופטי. במקרים רבים, מעדיפים להתבונן חלקיקים תוך הצבת מסננים bandpass לפני העבה2, כדי לשפר את הניגודיות הדמיה כדי לחסל את האור שנכשל לגרום לאפקט LSPR. שימוש במסננים גם מאפשר לבצע ניסויים ספקטרוסקופית חלקיקים בודדים.
התנהגות אופטית הקשורה ל-LSPR תלויה מאוד בגודל ובצורה של חלקיקי החלקיקים, והיא יכולה להיחקר עם טכניקות רבות של מיקרוסקופ אופטי. עם זאת, כדי לפענח מידע כיוון של חלקיקים פלמונית עם הצורה אניסוטרופי (כלומר, לא כדורי), יש צורך להשתמש בקיטוב של השדה האור. על-ידי סיבוב בזהירות של שדה הקיטוב או המצע לדוגמה בקפיצות קטנות, ניתן לנטר את תכונות הספקטרוסקופיות תלויי האוריינטציה של חלקיקים בודדים. סיבוב ופולריזציה יכול גם לסייע בקביעה אם תכונה ספקטרלית בשל תנודה בסדר קשר קואורדינטיבי או גבוה יותר של אלקטרונים השטח של ננו-חלקיק. עם זאת, במקרה של איזוטרופי (כלומר, כדורי) חלקיקי חלקיקים, הפרופיל הספקטרלי נותר במהותו ללא שינוי בעת סיבוב המדגם תחת אור מקוטב.
כאשר מתבוננים דרך מיקרוסקופ DIC (איור 2), לחלקיקים יש דיסק אוורירי עם מראה לבן ושחור של עופרת-יצוקה כנגד רקע אפור. חלקיקים כדוריים ישמרו זה מראה תחת סיבוב עם שינוי של מסנני bandpass; עם זאת, החלקיקים ייעלמו בהדרגה מן התצוגה כמו אורך הגל המרכזי של הפילטר הופך להיות מופרד עוד יותר הספרה היחידה של LSPR הספירה של הדור11. הופעתו של nanorods יכול לשנות באופן דרמטי למדי כפי שהם מסובבים2. Nanorods יש שתי להקות lspr עם התנהגות קשר קואורדינטיבי, המיקום של אשר מבוססים על הממדים הפיזיים של nanorods. כאשר ציר האורך של nanorod מונחה במקביל לאחד השדות הפולריזציה DIC, הדיסק האוורירי יופיע כולו לבן או כל שחור אם הוא מוצג עם מסנן מעבר בנדנה המשויך לאורך הגל זה LSPR. לאחר סיבוב המדגם 90 °, זה יהיה לקחת על הצבע הנגדי. לחילופין, מאז ציר רוחבי של nanorod ניצב לציר האורך, המוט ייקח על הצבע המנוגד בעת מעבר בין מסננים התואמים את אורכי גל LSPR עבור שני הצירים. בכיוונים אחרים והגדרות מסנן, nanorods יופיע יותר כמו כדורים, הצגת מגוון רחב של דפוסי הצללה של דיסק אוורירי. עבור nanorods עם ציר רוחבי < 25 ננומטר, זה יכול להיות קשה לזהות את האות ב-אורך הגל של LSPR באמצעות מיקרוסקופ DIC.
כדי לבצע ספקטרוסקופיית חלקיקים בודדים, חשוב להשתמש ברכיבים האופטיים הנכונים וליישר אותם כהלכה. יש להשתמש במטרה לבצע מיקרוסקופ DIC. עבור ניסויים חלקיקים בודדים, 80 x או 100x יעדי הנפט הם אידיאליים. נוארסקי מהפריזאים בדרך כלל מגיעים בשלושה זנים: סטנדרטי, ניגודיות גבוהה ורזולוציה גבוהה. הסוג האידיאלי תלוי מאוד במטרת הניסוי ובגודל של חלקיקי חלקיקים. הפריסמות הרגילות הן בסדר לניסויים רבים; אבל כאשר עובדים עם חלקיקים קטנים יותר (< 50 ננומטר), מפריזחדות גבוהה יכול להועיל, מאז ניגודיות החלקיקים פוחתת כאשר החלקיקים יורדים בגודל11. התאמת הניגודיות DIC מושגת על-ידי סיבוב מקטפה או על-ידי תרגום אחד מהפריזמות הDIC, בהתאם למותג המיקרוסקופ או לדגם6.
לאחר הגדרת התאורה של קולר והגדרות הקיטוב, חיוני שלא לקרוא הגדרות אלה בלבד בעת איסוף נתוני ספקטרוסקופיה. יתרה מזאת, יש לשמור על אות רקע ממוצע קבוע בכל עת במהלך איסוף הנתונים, גם בעת מעבר בין מסננים והגדרות זווית. ערך הרקע האידיאלי בפועל תלוי בטווח הדינמי של המצלמה המדעית, אך באופן כללי, הרקע אמור להיות בטווח של 15%-40% מרמת הזיהוי המירבית של המצלמה. זה מפחית את הסבירות של השבת חיישן המצלמה תוך הפיכת ניגודיות החלקיקים אופטימלית. לאיסוף נתוני ספקטרוסקופיית, יש צורך לעבוד עם מצלמה מדעית הלוכד תמונות בשחור-לבן, בניגוד למצלמת צבע.
הכנה לדוגמה היא היבט קריטי נוסף של חלקיקי פלמונית הדמיה. הכרחי שמפעילים של מיקרוסקופ DIC מבינים את המאפיינים האופטיים של המדגם ושל מצע המדגם. "ניקוי מראש" זכוכית מיקרוסקופ אינו מוכן מספיק עבור חלקיקי הדמיה, וזה חייב להיות מחדש כראוי ניקה לפני לדוגמה התצהיר כדי להבטיח התבוננות ללא השגחה של המדגם. פרוטוקולי ניקוי רבים עבור שקופיות מיקרוסקופ תועדו בעבר12, אבל זה לא צעד שבדרך כלל מדווח במחקרים ניסיוניים.
לבסוף, שיטות ניתוח נתונים הן הרכיב הסופי לספקטרוסקופיית חלקיקים בודדים. את העוצמות המרביות והמינימליות של כל ננו-חלקיק יש למדוד, כמו גם את ממוצע הרקע המקומי. חלקיקים של עניין צריך להיות ממוקם באזורים ללא שרידים ברקע, פגמים במצע, או תאורה מחוספס. שיטה אחת לקביעת פרופיל ספקטרלי של ננו-חלקיק היא על ידי חישוב ניגודיות החלקיקים בכל אורך הגל, באמצעות המשוואה מתחת11,13,14,15:

לחילופין, ניתן לפצל את הספקטרום של חלקיק יחיד לרכיבי האות המרביים והמינימליים הבודדים, המייצגים את שני השדות הפולריזציה של DIC, ובכך מציגים את שני הספקטרום התלוי-בו של המנהל, דרך שתי המשוואות:
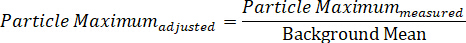
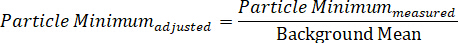
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכנה לדוגמא בעזרת שקופיות מיקרוסקופית זכוכית סטנדרטיות
- הכינו שקופיות של מיקרוסקופ זכוכית. לקבלת עדות לדוגמא
הערה: בנסיבות מסוימות, זה עשוי להיות מתאים יותר לאחסן את הזכוכית במים באולטרסאונד במקום אתנול. עם זאת, אחסון במים או באוויר גורם הידרופובי זכוכית לאורך זמן.- לקבלת התוצאות הטובות ביותר, לרכוש מיקרוסקופ זכוכית או קוורץ וכיסוי זכוכית.
- באמצעות עט שרבוטים, מניחים סימן שריטה רדוד וקצר על המרכז של כל שובר כיסוי זכוכית.
- נקה את כל זכוכית המיקרוסקופ, גם אם הוא נרכש "מנוקה מראש", כדי להסיר רסיסי זכוכית, אבק, אבקה, שאריות אורגניים, וכל מזהמים אחרים המשפיעים על איכות ההדמיה או לדוגמה תצהיר.
הערה: שיטת הניקוי הבאה פועלת היטב עבור סוגי הדגימות המתוארות כאן ונמנעת השימוש בכימיקלים קשים. כימיקלים בעלי כימיה חמורה יותר יכולים לחרוט את הזכוכית ודורשים טיפול נוסף בטיפול וסילוק.- להניח זכוכית מיקרוסקופ על ארונות אחסון ולאחר מכן לתוך גביע, או לתוך צנצנת מכתים. אין למקם זכוכית מיקרוסקופ בחלק התחתון של כוסות וכלי מעבדה אחרים ללא שברי, כי כל פיסת משטח של זכוכית מיקרוסקופ צריך להיות חשוף לחלוטין לסוכני ניקוי.
- יוצקים ~ 1 מ ל של נוזל ניקוי נוזלי (טבלה של חומרים) לתוך המיכל ולמעלה את המיכל עם מים. . Sonicate במשך 30 דקות
הערה: לאחר שתהליך הניקוי מתחיל, יש לטפל רק בזכוכית תוך כדי לבישת כפפות, כדי למנוע השארת שאריות טביעות אצבע על הזכוכית. - יוצקים את התוכן הנוזלי של מיכל הניקוי לכיור. לשטוף את המיכל מספר פעמים עם מים אלקטרופורזה כדי להסיר את כל המראה של כביסה. ממלאים את המיכל עם מים באולטרטהורים. Sonicate את המיכל עם זכוכית מיקרוסקופ עבור 30 דקות נוספות.
- חזור על השלב הקודם לפחות פעם נוספת. לבצע סיבובים נוספים של sonication במים עד שברור כי כל עקבות של חומרי הניקוי הוסרו.
- שופכים את התוכן של מכולה לניקוי. לשטוף את המיכל עם מים באולטרסאונד. למלא את המיכל עם אתנול. זכוכית מיקרוסקופ Sonicate עבור 30 דקות.
- שופכים את תכולת מיכל הניקוי למכל פסולת. מילוי עם אתנול. לכסות את המיכל כדי למנוע אובדן של אתנול באמצעות התאיידות. אחסן את זכוכית המיקרוסקופ במיכל זה עד לזמן הניסוי. השקופיות נשארות נקיות ושימושיות כל עוד הן נשארות מכוסות באתנול בתוך מיכל מכוסה.
-
הכנת התמיסה הננו-חלקיק
- באמצעות מיקרופיפטה, להסיר 100 μl סדרת מחלקים של 0.05 mg/mL זהב פתרון ננו-חלקיק מתוך מיכל האחסון המקורי שלה להוציא את הפתרון לתוך שפופרת צנטריפוגה ל 1.5 mL.
- צנטריפוגה את המדגם עבור 10 דקות ב 6,000 x g.
- הסר את הסופרנטנט עם מיקרופיפטה, כדי להסיר את החומרים העודפים.
- באמצעות מיקרופיפטה, המקום 100 μL של מים אולטרה טהורים לתוך צינור הצנטריפוגה.
הערה: אם לא כל הסופרנטאנט ניתן להסיר בניסיון הראשון, חזור על הצעדים הצנטריפוגה וההשעיה. - בקצרה מערבולת הדגימה כדי להשעות מחדש את הגלולה. Sonicate מיד לאחר מכן עבור 20 דקות כדי להשהות במלואה ולשבור את ננו-חלקיק אגרגטים.
הערה: אם המדגם אינו משמש באופן מיידי, זה צריך להיות sonicated שוב 20 דקות לפני הפקדת הפתרון על זכוכית מיקרוסקופ.
-
עדות לדוגמא
- הסר תעודות מכסות מנוקות ושקופיות מיקרוסקופ ממיכלי האחסון שלהם. תנשוף את הזכוכית. עם חנקן או ארגון
- באמצעות מיקרופיפטה, drop-יצוקה 6 μL של פתרון ננו-חלקיק משלב 1.2.5 על שובר הכיסוי. כדי לפזר את ה-droplet באופן שווה, המקום בזהירות, פיסת מיקרוסקופ גדולה יותר על גבי שובר הכיסוי, כגון תעודת כיסוי שנייה או שקופית מיקרוסקופ. להימנע מקבלת בועות אוויר לכודים בין שתי חתיכות של זכוכית.
- הפוך את מצע המדגם מעל, ואטום את הקצוות של שובר הכיסוי עם קו צר של לק על מנת למנוע אידוי של הפתרון הבינוני.
- לחילופין, כדי לדמות את המדגם "יבש", לאפשר לפתרון לעמוד 5 – 15 דקות על שובר הכיסוי, לפני הסרת פיסת זכוכית לא רצויה. לפוצץ בעדינות את שובר הכיסוי. עם חנקן מווסת או ארגון
- אם אפשר, דגימות תמונה מיד לאחר ההכנה. אם אין זה אפשרי, יש לאחסן דגימות במיכל מכוסה, כגון צלחת פטרי עד להדמיה.
2. הדמיה DIC
- ליישר את המטרה ואת הקבל.
- לאחר הצבת המדגם על המיקרוסקופ, למצוא את המטוס מוקד עם המדגם על זה. תחילה אתר והתמקד בסימן הטיוטה שנוצר קודם לכן. אז בסדר לכוונן את הפוקוס עד חלקיקים לבוא לראות.
- כדי לקבוע את המיקום המדויק של הקבל, לנצל את השיטה תאורה קוסלר. 5 התאורה קולר בהגדלה גבוהה (80x, 100x) מושגת בקלות רבה יותר על ידי הגדרה ראשונה של התאורה הקוסלר בהגדלה נמוכה יותר, כגון 20x.
הערה: בדרך כלל אין צורך להתאים מחדש את התאורה במהלך הדמיה של מדגם אחד. עם זאת, מומלץ לוודא שהתאורה של קוסלר מוגדרת כראוי בעת מעבר לשקופית מיקרוסקופ חדשה.
- מטב את הגדרות הניגודיות.
- בחר אזור מעניין בדוגמה לדימות. מרכז את האזור בשדה התצוגה של המצלמה והתאם את המיקוד לפי הצורך.
- אם המיקרוסקופ יש את העיצוב דה Senarmont, להתחיל עם הקיטוב להגדיר ליד להכחדה ברקע המרבי ובהדרגה לסובב את הקיטוב לקראת ירידה ברקע הכחדה. עוצמת הרקע תעלה בהדרגה.
- אם המיקרוסקופ אין עיצוב דה Senarmont, להתחיל עם הרכבת האופטית להגדיר ברקע המרבי הכחדה. במקרה זה, להתאים בהדרגה את העמדה מנסרה המטרה להפחתת הכחדה ברקע.
הערה: ההגדרה האידיאלית מושגת כאשר חלקיקים מגיעים ההבדל האינטנסיביות הגדול ביותר שלהם (כלומר, ניגודיות) מערך הרקע המקומי הממוצע. עבור חלקיקים פלמונית, ניגודיות אופטימלית מושגת בדרך כלל עם רקע כהה יחסית, ולכן על הגדרות ליד הכחדה מקסימלית הרקע.
- בחר אזור מעניין בדוגמה לדימות. מרכז את האזור בשדה התצוגה של המצלמה והתאם את המיקוד לפי הצורך.
- . צלם את הדגימה
- כבה את תאורת החדר כדי למנוע הפעלה של תאורה תועה עם התהליך.
- בזמן הצגת חלקיקים עם מצלמת דימות מדעית, לקבוע את רמת הרקע האופטימלי. באמצעות 10 ננומטר רוחב מלא בחצי מקסימום (FWHM) מסנן bandpass עם הגל המרכזי שלו ממוקם יחד עם ה-LSPR הראשי אורך הגל, להציג את האזור של הריבית. כוונן את עוצמת המנורה או את זמן החשיפה עד שרמת הרקע תהיה בטווח של 15%-40% מרמת הקיבולת המרבית של המצלמה וללא אובייקטים באזור של עוצמות האות של התערוכה שיחרגו מ-90% מרמת העוצמה המירבית של המצלמה.
הערה: המטרה של step 2.3.2 היא למנוע שיקוף החיישן בעת מעבר בין מסננים. רמת הרקע האידיאלית תשתנה בין דגימות ומצלמות. לאחר שלב זה הושלמה, זמן חשיפה ניתן לכוונן אך לא את עוצמת המנורה. - תמונה את המדגם עם סדרה של מסנני bandpass כי לכל אחד יש FWHM של 10 ננומטר וכי כולה לאפשר הדמיה לאורך אורך הגל כולו של הריבית. ודא שעוצמת הרקע נשארת עקבית מהתמונה לתמונה (בתוך ~ 5% אחד מהשני) על-ידי התאמת זמן החשיפה. לאחר החלפת מסננים, התמקד מחדש בדגימה לפני לכידת התמונה.
- שמור את התמונות כקובצי TIFF לא דחוסים ו/או בתבנית הקובץ המקורית של התוכנה, כדי לשמר את כל המידע.
- סובב את המדגם.
- לאחר איסוף תמונות של המדגם במיקומה המקורי, המדגם יכול עכשיו להיות מסובב והתמונה בכיוונים נוספים בנתיב האור. בצע סיבוב במרווחי זמן קבועים (לדוגמה, 10 ° או 15 °) על-פני טווח של 180 ° או 360 °.
הערה: סיבוב דורש שלב לדוגמה rotatable. - כמו בסעיפים 2.1-2.3, התאימו את הגדרות המצלמה כדי לספק רמת רקע עקבית מהתמונה לתמונה.
הערה: אין לעשות התאמה לתאורה של קוסלר.
- לאחר איסוף תמונות של המדגם במיקומה המקורי, המדגם יכול עכשיו להיות מסובב והתמונה בכיוונים נוספים בנתיב האור. בצע סיבוב במרווחי זמן קבועים (לדוגמה, 10 ° או 15 °) על-פני טווח של 180 ° או 360 °.
3. ניתוח נתונים באמצעות ImageJ
הערה: ניתן לבצע את החישובים הבאים במגוון חבילות תוכנה, ולעיתים בתוכנית המקורית המשמשת לאיסוף התמונות. ImageJ היא תוכנה זמינה באופן חופשי מן המכונים הלאומיים לבריאות (NIH).
- חישוב ניגודיות או אינטנסיביות של חלקיקים.
- פתחו את התמונה באמצעות ImageJ.
- בחרו בכלי מלבן וציירו מלבן מסביב לאזור העניינים העיקרי.
- בסרגל הכלים, בחרו תמונהולאחר מכן הרחק מתצוגה, ולאחר מכן לבחירה. חלון ההדמיה יופיע בתצוגה מקדימה של האזור שנבחר.
- בסרגל הכלים, בחר תמונהולאחר מכן התאם, לאחר מכן בהירות /ניגודיות. מופיע חלון חדש. כדי לאפשר תצוגה טובה יותר של אזור הדגימה, התאם את ארבע ההגדרות: מינימום, מקסימום, בהירות וניגודיות. התאמות אלה אינן משנות את הנתונים המדעיים, הן רק מאפשרות ניראות טובה יותר של אזור המדגם.
הערה: שלבים 3.1.3 ו-3.1.4 עשויים להתבצע מספר פעמים ובסדר הפוך. - באמצעות הכלי מלבן שוב, צייר תיבה מסביב לננו-חלקיק הראשונה שיש למדוד. התיבה צריכה להיות גדולה במקצת מהדיסק האוורירי של הננו-חלקיק.
- בסרגל הכלים, בחר באפשרות ניתוחולאחר מכן מדידה. מופיע חלון חדש המדווח על מינימום, מקסימום וממוצע עוצמות עבור הפיקסלים הממוקמים בתוך התיבה שנבחרה.
- גרור את התיבה המשמשת למדידת הננו-חלקיק לאזור הסמוך לחלקיק, כאשר הניגודיות ברקע היא יחסית אפילו ולא קיימים חלקיקים או מזהמים. שמור על הגודל המקורי של התיבה.
- השתמשו בכלי מדידה כדי לקבוע את עוצמת הממוצע של אזור הרקע.
- מדדו את החלקיקים הנותרים ואת אזור הרקע הסמוך לכל.
- חזור על התהליך עבור כל חלקיק בכל התמונות בסדרה.
- יצא את הנתונים לגיליון אלקטרוני כדי לחשב את הניגודיות או האינטנסיביות של כל חלקיק, בכל אורכי הגל והזוויות.
- חשב את הניגודיות של כל חלקיק, תוך שימוש במשוואה הבאה13,14,15:

הערה: שימוש במשוואה זו, על ניגודיות החלקיקים להיות תמיד > 0. - לחשב את הערך המרבי של החלקיקים המותאם לרקע על-ידי חלוקת עוצמת החלקיקים המרבית שנמדדו באמצעות ממוצע הרקע:
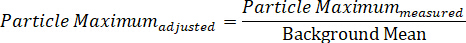
- באופן דומה, חשב את הערך המינימלי שהותאם לרקע על-ידי חלוקת עוצמת החלקיקים המינימלית הנמדדת על-ידי ממוצע הרקע:
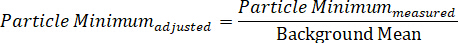
הערה: כמחושב, המקסימום צריך להיות בעל ערך גדול מאחד, בעוד שהמינימום יהיה פחות מאחד. מקובל להחסיר כל ערך ב-"1", כך שהרקע הממוצע הוא אפס, המקסימום מיוצג כערך חיובי והערך המינימלי מוקצה ערך שלילי16. גישה זו מאפשרת לאנליסט לשקול בנפרד את מה שמתרחש לאורך כל אחד מהשדות הפולריזציה, שהוא שימושי בעת לימוד חלקיקים אניסוטרופיים. - לגרף את הפרופיל הספקטרלי במיקום ננו-חלקיק נתון, מתווה נתונים עם אורך הגל לאורך ציר ה-x והניגודיות או האינטנסיביות לאורך ציר ה-y.
- כדי ליצור גרף של פרופיל הסיבוב באורך גל נתון, התווה את זווית הסיבוב לאורך ציר ה-x והניגודיות או העוצמה לאורך ציר ה-y.
Access restricted. Please log in or start a trial to view this content.
תוצאות
כאשר עובדים עם דגימות גדולות מספיק כדי להיראות עם עין בלתי, הצבת ציוני דרך על מצע זכוכית לא נדרש בדרך כלל. עם זאת, כאשר עובדים עם ננו או כאשר הסיבוב של המדגם נדרש, ציוני דרך יכולים לספק שיטה קלה לאיתור, הבחנה, ומעקב אחר כיוון המדגם. למרות טכניקות מתוחכמות יותר יכול להיות מנו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
בעת הדמיה עם מיקרוסקופ DIC, חיוני למטב את הרכיבים האופטיים לפני איסוף הנתונים. אפילו התאמות מינורי מקטצר באמצע הניסוי יכול לגרום להשפעות משמעותיות על הנתונים הסופיים6. יתר על כן, חומרים שונים דורשים הגדרות מקטייזר שונים. למרות שגודלי השלבים הגדולים היו מנוצלים כאן כדי להדגים א?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
. לסופר אין מה לגלות
Acknowledgements
ד ר אנתוני ס. סטנדר מבקש להכיר בתמיכה הטכנית באמצעות המכון לתופעות ננו והקוונטים (NQPI) באוניברסיטת אוהיו. מאמר זה התאפשר באמצעות סטארט-up מימון סיפק ד ר סטנדר על ידי אוניברסיטת אוהיו.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Contrad 70 | Decon Labs, Inc. | 1002 | For cleaning microscope glass, Available through many chemical suppliers |
| Ethanol | Fisher Scientific | A962-4 | For cleaning and storing microscope glass |
| Glass microscope cover slips | Ted Pella | 260148 | |
| Glass microscope slides | Ted Pella | 26007 | |
| Gold nanorods | Nanopartz | DIAM-SPR-25-650 | |
| Gold nanospheres (80 nm) | Sigma Aldrich | 742023-25ML | |
| ImageJ | NIH | N/A | Free Software availabe for data analysis from NIJ |
| Nail polish | Electron Microscopy Sciences | 72180 | |
| Nikon Ti-E microscope | Nikon | N/A | |
| Nitrogen gas | Airgas | N/A | |
| ORCA Flash 4.0 V2+ digital sCMOS camera | Hamamatsu | 77054098 | |
| Scribing pen | Amazon | N/A | Many options available online for under $10. Not necessary to buy an expensive version. |
| Ultrapure water | 18 megaohm |
References
- Pluta, M. Ch 7: Differential Interference Contrast in. Advanced Light Microscopy. 2, Elsevier. 146-197 (1989).
- Stender, A. S., Wang, G., Sun, W., Fang, N. Influence of Gold Nanorod Geometry on Optical Response. ACS Nano. 4 (12), 7667-7675 (2010).
- Stender, A. S., et al. Single Cell Optical Imaging and Spectroscopy. Chemical Reviews. 113 (4), 2469-2527 (2013).
- Mehta, S. B., Sheppard, C. J. R. Partially coherent image formation in differential interference contrast (DIC) microscope. Optics Express. 16 (24), 19462-19479 (2008).
- Murphy, D. B., Davidson, M. W. Ch 1: Fundamentals of Light Microscopy. Fundamentals of Light Microscopy and Electronic Imaging, Second edition. , Wiley. 1-20 (2012).
- Stender, A. S., Augspurger, A. E., Wang, G., Fang, N. Influence of Polarization Setting on Gold Nanorod Signal at Nonplasmonic Wavelengths Under Differential Interference Contrast Microscopy. Analytical Chemistry. 84 (12), 5210-5215 (2012).
- Wang, G., Sun, W., Luo, Y., Fang, N. Resolving Rotational Motions of Nano-objects in Engineered Environments and Live Cells with Gold Nanorods and Differential Interference Contrast Microscopy. Journal of the American Chemical Society. 132 (46), 16417-16422 (2010).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Mulvaney, P. Not All That's Gold Does Glitter. MRS Bulletin. 26 (12), 1009-1014 (2012).
- Maier, S. A. Plasmonics: Fundamentals and Applications. , Springer US. (2007).
- Sun, W., Wang, G., Fang, N., Yeung, E. S. Wavelength-Dependent Differential Interference Contrast Microscopy: Selectively Imaging Nanoparticle Probes in Live Cells. Analytical Chemistry. 81 (22), 9203-9208 (2009).
- Cras, J. J., Rowe-Taitt, C. A., Nivens, D. A., Ligler, F. S. Comparison of chemical cleaning methods of glass in preparation for silanization. Biosensors and Bioelectronics. 14 (8), 683-688 (1999).
- Augspurger, A. E., Sun, X., Trewyn, B. G., Fang, N., Stender, A. S. Monitoring the Stimulated Uncapping Process of Gold-Capped Mesoporous Silica Nanoparticles. Analytical Chemistry. 90 (5), 3183-3188 (2018).
- Murphy, D. B., Davidson, M. W. Ch 2: Light and Color. Fundamentals of Light Microscopy and Electronic Imaging, Second Edition. , Wiley. 21-33 (2012).
- Wayne, R. Ch 3: The Dependence of Image Formation on the Nature of Light. Light and Video Microscopy (Second Edition). , Academic Press. 43-78 (2014).
- Stender, A. S., Wei, X., Augspurger, A. E., Fang, N. Plasmonic Behavior of Single Gold Dumbbells and Simple Dumbbell Geometries. The Journal of Physical Chemistry C. 117 (31), 16195-16202 (2013).
- Hu, M., et al. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance. Journal of Materials Chemistry. 18 (17), 1949-1960 (2008).
- Choo, P., et al. Wavelength-Dependent Differential Interference Contrast Inversion of Anisotropic Gold Nanoparticles. The Journal of Physical Chemistry C. 122 (47), 27024-27031 (2018).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon Coupling of Gold Nanorods at Short Distances and in Different Geometries. Nano Letters. 9 (4), 1651-1658 (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved