Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выполнение спектроскопии на плазмонных наночастиц с передачей на основе Номарски-тип дифференциальной микроскопии интерференции
В этой статье
Резюме
Целью данного протокола является детальный проверенный подход к подготовке плазмонных образцов наночастиц и для выполнения спектроскопии отдельных частиц на них с дифференцаальной интерференцией (DIC) микроскопии.
Аннотация
Дифференциальная интерференционная контрастность (DIC) микроскопия является мощным инструментом визуализации, который чаще всего используется для визуализации микромасштабных объектов с использованием видимого диапазона света. Целью данного протокола является детальный метод подготовки образцов плазмонных наночастиц и выполнения одной спектроскопии частиц на них с помощью микроскопии DIC. Для проведения повторяемых экспериментов с спектроскопией необходимо тщательно выполнить несколько важных шагов. Во-первых, ориентиры могут быть выгравированы в образцовом субстрате, который помогает в обнаружении поверхности образца и в отслеживании области интереса во время экспериментов. Далее субстрат должен быть надлежащим образом очищен от мусора и загрязняющих веществ, которые в противном случае могут препятствовать или скрыть изучение образца. После того, как образец правильно подготовлен, оптический путь микроскопа должен быть выровнен, используя Kohler Illumination. Со стандартным микроскопом DIC в стиле Номарски может потребоваться вращение образца, особенно когда плазмонные наночастицы обладают зависящими от ориентации оптическими свойствами. Поскольку микроскопия DIC имеет два присущих ортогонализованных полях поляризации, контрастный узор, зависящий от длины волны DIC, показывает ориентацию плазмонных наночастиц в форме стержня. Наконец, необходимо тщательно проводить процесс сбора данных и анализа данных. Обычно данные спектроскопии на основе DIC представляются как контрастное значение, но их можно также представить в качестве данных интенсивности. В этой демонстрации DIC для спектроскопии отдельных частиц, основное внимание уделяется сферических и стержневидных золотых наночастиц.
Введение
С 1980-х годов микроскопическая микроскопия дифференциальной интерференции (DIC) в значительной степени рассматривается в качестве важного метода визуализации, предназначенного для микромасштабных объектов в биологических науках. Тем не менее, во время его развития в 1950-х и 1960-х годов, он был задуман как метод для материаловедения1. С недавними достижениями в материаловедениях, связанных с плазмонными наночастицами, возрос интерес к характеристике материалов с оптической микроскопией.
Многие оптические методы, безусловно, доступны для характеристик наноматериалов (например, темное поле, яркое поле, поляризованный свет, флуоресценция и т.д.). Темное поле широко популярно в исследованиях наночастиц, но оно опирается исключительно на сбор рассеяния и предоставляет ограниченную информацию о сложных образцах2. Флуоресценция может быть полезна, но только с образцами, которые люминесцентные или которые могут быть правильно окрашены. Микроскопия DIC имеет несколько признаков, которые делают его ценным инструментом для анализа наночастиц. Наиболее часто заявленные преимущества DIC по сравнению с другими методами и в отношении плазмонных наночастиц являются таковыеокрашивания образцов, нет эффектов гало, неглубокая глубина поля и высокое боковое разрешение 3. DIC имеет дополнительные сильные стороны, которые являются ценными для плазмонных исследований наночастиц. Во-первых, присутствуют два присущих и ортогоналкополя поля поля, и они могут быть измерены одновременно для целей спектроскопии2. Во-вторых, деполяризованный сигнал наночастиц незапечатлен на конечном изображении 2, что может стать причиной серьезной обеспокоенности при измерениях спектроскопии темного поля.
Целью данной статьи является предоставление четкой методологии использования передового света номарской МИКРОСКОПии DIC для выполнения спектроскопии плазмонных наночастиц. Хотя DIC является мощным методом, который может быть применен к весьма разнообразным материалам, это также метод, который требует большого мастерства и понимания, чтобы работать над ним должным образом при визуализации наночастиц. Трансмиссия на основе Номарски DIC микроскопии имеет сложный световой путь1, который будет только кратко рассмотрены здесь. Оптический поезд DIC отображается на рисунке 1. Свет передается через микроскоп, сначала проходя через поляризатор и луч-расщепление призмы Номарски, прежде чем быть сосредоточены конденсатора на образец плоскости. Пройдя через цель, свет сталкивается с луч-комбинируя призму Номарски и анализатор перед выходом на детектор. Два поляризатора и призмы Номарски имеют решающее значение для формирования изображения DIC и отвечают запроизводство двух ортогональных полей поляризации DIC 1. Для читателя заинтересованы в получении дополнительной информации о принципах работы и оптический путь Номарски DIC микроскопов, или различия между Nomarski DIC и других стилей DIC, пожалуйста, обратитесь к другим хорошо написанные счета по этим темам1, 4 , 5 , 6 , 7.
Не менее важно понимать основную природу плазмонных наночастиц перед попыткой выполнения спектроскопии на них, будь то с Nomarski DIC, темным полем или любой другой техникой микроскопии. В области плазмоники наночастицы определяются как частицы с размерами в масштабе 10-100 нм8,9. Наночастицы могут принимать различные формы (например, сферы, стержни, звезды, гантели и т.д.), и большинство их важных свойств возникают из взаимодействия со светом в ультрафиолетов-видимом-ближнем инфракрасном диапазоне электромагнитного спектра. Термин "плазмон" не ограничивается наночастицами10; однако при обсуждении наночастиц он используется в связи с локализованным поверхностным плазмонным резонансом (LSPR). LSPR является явлением, при котором электроны проводимости в наночастице колеблются из-за взаимодействия Куломбида сэлектромагнитным излучением высокоспецифической и относительно узкой частотной полосы 8. На этих же частотах плазмонные наночастицы обладают повышенной абсорбцией и рассеянием света, что делает их наблюдаемыми с помощью оптической микроскопии. Во многих случаях, предпочтительно наблюдать наночастицы при размещении фильтров bandpass перед конденсатором2, чтобы улучшить контраст изображения и устранить свет, который не может вызвать эффект LSPR. Использование фильтров также позволяет проводить эксперименты с спектроскопией отдельных частиц.
Оптическое поведение, связанное с LSPR, сильно зависит от размера и формы наночастиц, и его можно исследовать с помощью многих методов оптической микроскопии. Однако для расшифровки информации о ориентации плазмонных наночастиц с анизотропной (т.е. несферической) формой необходимо использовать поляризацию светового поля. Тщательно вращая поле поля поляризации или образцовый субстрат с небольшими приращениями, можно контролировать зависящие от ориентации спектроскопические свойства отдельных наночастиц. Вращение и поляризация могут также помочь в определении того, является ли спектральная особенность обусловлена диполярным или более высоким уровнем колебаний поверхностных электронов наночастиц. Однако в случае изотропных (т.е. сферических) наночастиц спектральный профиль остается практически неизменным при вращении образца под поляризованным светом.
При просмотре через микроскоп DIC(Рисунок2), наночастицы имеют воздушный диск с теневым бело-черным видом на сером фоне. Сферические наночастицы сохранят этот внешний вид при вращении и при смене фильтров bandpass; однако, частицы будут постепенно исчезать из поля зрения, как центральная длина волны фильтра становится еще более отделены от только диполярной длины волны LSPR сферы11. Появление нанородов может измениться довольно резко, как они вращаются2. Нанороды имеют две полосы LSPR с диполярным поведением, расположение которых основано на физических размерах нанородов. Когда продольная ось нанорода ориентирована параллельно одному из полей поляризации DIC, воздушный диск будет отображаться все белые или все черные, если рассматривать с bandpass фильтр, связанный с этой длиной волны LSPR. После вращения образца 90 ", он будет принимать на противоположный цвет. Кроме того, поскольку поперечная ось нанорода перпендикулярно продольной оси, стержень будет принимать противоположный цвет при переключении между фильтрами, которые соответствуют длинам волны LSPR для двух осей. В других ориентациях и настройках фильтра нанороды будут больше похожи на сферы, представляющие различные модели воздушного диска, отлитые тенью. Для нанородов с поперечной оси Злт; 25 нм, это может быть трудно обнаружить сигнал на том, что длина волны LSPR с помощью микроскопии DIC.
Для выполнения спектроскопии отдельных частиц важно использовать правильные оптические компоненты и правильно их выравнивать. Необходимо использовать цель, способную микроскопии DIC. Для экспериментов с отдельными частицами, 80x или 100x масляных целей являются идеальными. Номарские призмы DIC обычно бывают трех разновидностей. Идеальный тип сильно зависит от цели эксперимента и размера наночастиц. Стандартные призмы прекрасны для многих экспериментов; но при работе с меньшими наночастицами (злот; 50 нм), высокая контрастность призмы может быть полезным, так как контраст частиц уменьшается, как частицы уменьшаются в размере11. Корректировка контраста DIC достигается либо путем вращения поляризатора, либо путем перевода одной из призмDIC, в зависимости от бренда микроскопа или модели 6.
После установки освещения Kohler и настроек поляризатора, очень важно не сравнять эти параметры при сборе данных спектроскопии. Кроме того, при постоянном переключении между фильтрами и настройками угла необходимо постоянно поддерживать средний фоновый сигнал. Фактическое идеальное фоновое значение зависит от динамического диапазона научной камеры, но в целом фон должен находиться в диапазоне 15-40% от максимального уровня обнаружения камеры. Это снижает вероятность насыщения датчика камеры, обеспечивая при этом оптимальный контраст частиц. Для сбора данных спектроскопии необходимо работать с научной камерой, которая фиксирует изображения в черно-белом цвете, в отличие от цветной камеры.
Подготовка образцов является еще одним важным аспектом визуализации плазмонных наночастиц. Крайне важно, чтобы операторы микроскопии DIC имели представление о оптических свойствах образца и субстрате образца. "Предварительно очищенное" стекло микроскопа недостаточно подготовлено для визуализации наночастиц, и оно должно быть надлежащим образом очищено перед осаждением образца, чтобы обеспечить беспрепятственное наблюдение образца. Многие протоколы очистки для слайдов микроскопа были ранее задокументированы12, но это не шаг, который обычно сообщается в экспериментальных исследованиях.
Наконец, методы анализа данных являются конечным компонентом спектроскопии отдельных частиц. Максимальная и минимальная интенсивность каждой наночастицы должна быть измерена, а также среднее значение локального фона. Частицы, представляющие интерес, должны располагаться в районах, где нет фонового мусора, дефектов субстрата или неравномерного освещения. Одним из методов определения спектрального профиля наночастиц является вычисление контраста частиц на каждой длине волны, используя уравнение ниже11,13,14,15

Кроме того, спектр одной частицы может быть разделен на ее индивидуальные максимальные и минимальные компоненты сигнала, которые представляют два поля поляризации DIC, тем самым отображая два одновременно собранных направленно зависимых спектра, через два уравнения,
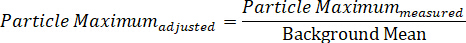
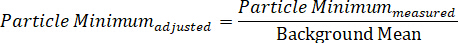
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовка образца со стандартными слайдами стеклянной микроскопии
- Подготовьте слайды стеклянного микроскопа для осаждения образцов.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, В некоторых случаях, это может быть более целесообразным для хранения стекла в ультрачистой воде вместо этанола. Тем не менее, хранение в воде или воздухе делает стекло гидрофобных с течением времени.- Для достижения наилучших результатов купите стеклянные или кварцевые слайды и накройте стекло.
- Используя scribing ручку, поместите неглубокий и короткий знак царапины на центр каждого стеклянного покрытия скольжения.
- Очистите все микроскопы стекла, даже если он приобрел "предварительно очищены", чтобы удалить осколки стекла, пыль, порошок, органические остатки, и любые другие загрязняющие вещества, которые влияют на качество изображения или осаждения образца.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ примечание множеств ниже хорошо работает для типов образцов, описанных здесь, и позволяет избежать использования суровых химических веществ. Харшер химических веществ может etch стекла и требуют больше йога в обработке и утилизации.- Поместите микроскоп стекла на стеллажи для хранения, а затем в стакан, или в окрашивание банку. Не размещайте микроскоповое стекло на дне стаканов и другой лабораторной стеклянной посуды без стеллажей, потому что каждый кусок и поверхность микроскопа стекла должны быть полностью подвержены моющим средствам.
- Налейте 1 мл жидкого моющего средства(Таблицаматериалов) в контейнер и сверху с контейнера с водой. Соникат в течение 30 мин.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ я вступления в силу, только обрабатывать стекла во время ношения перчаток, чтобы избежать оставить остатки отпечатков пальцев на стекле. - Вылейте жидкое содержимое чистящего контейнера в раковину. Промыть контейнер несколько раз с ультрачистой водой, чтобы удалить все появление моющего средства. Пополнить контейнер ультрачистой водой. Снофите контейнер с микроскопом стекла еще 30 минут.
- Повторите предыдущий шаг по крайней мере еще раз. Выполните дополнительные раунды звукоизоляции в воде, пока не будет очевидно, что все следы моющего средства были удалены.
- Вылейте содержимое чистящего контейнера. Промыть контейнер ультрачистой водой. Пополнить контейнер этанолом. Сноникат микроскоп стекла в течение 30 мин.
- Вылейте содержимое контейнера для очистки в мусорный контейнер. Пополнить этанолом. Обложка контейнера для предотвращения потери этанола через испарение. Храните стекло микроскопа в этом контейнере до времени эксперимента. Слайды остаются чистыми и пригодными для использования до тех пор, пока они остаются погруженными в этанол внутри крытого контейнера.
-
Подготовка раствора наночастиц
- Используя микропипетт, удалите 100-мл аликот 0,05 мг/мл раствора наночастиц золота из исходного контейнера для хранения и вывешните раствор в центрифужную трубку объемом 1,5 мл.
- Центрифуги образца в течение 10 мин на 6000 х г.
- Удалите супернатант с помощью микропипетта, чтобы удалить избыток сурфактанта.
- Используя микропипетт, поместите 100 л ультрачистой воды в центрифужную трубку.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Если не все супернатанты могут быть удалены с первой попытки, повторите центрифугацию и повторное действие. - Кратко вихрь образца, чтобы приостановить гранулы. Сножате сразу после этого в течение 20 минут, чтобы полностью приостановить и разбить наночастицы агрегатов.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Если образец не используется немедленно, он должен быть sonicated снова в течение 20 минут, прежде чем откладывать раствор на микроскоп стекла.
-
Осаждение образцов
- Удалите очищенные крышки и слайды микроскопа из контейнеров для хранения. Удар сухой стакан с под давлением азота или аргона.
- Используя микропипетт, падение-литые 6 л наночастиц решение от шага 1.2.5 на крышку скольжения. Чтобы равномерно распределить каплю, аккуратно поместите второй, более крупный кусок микроскопа стекла поверх крышки скольжения, такие как второй крышкой скольжения или микроскоп слайд. Избегайте попадания пузырьков воздуха в ловушке между двумя кусками стекла.
- Переверните образец субстрата и уплотнизвите края крышки скольжения узкой линией лака для ногтей, чтобы предотвратить испарение среднего раствора.
- Кроме того, для изображения образца "сухой", позволяют растворстоять 5-15 мин на крышке скольжения, прежде чем удалить нежелательные кусок стекла. Аккуратно удар крышки скольжения сухой с под давлением азота или аргона.
- Если возможно, образцы изображений сразу после подготовки. Если это невозможно, храните образцы в закрытом контейнере, например, блюдо Петри до визуализации.
2. DIC изображений
- Выровнять объективную и конденсаторную.
- После размещения образца на микроскоп, найти фокусной плоскости с образцом на нем. Сначала найдите и сосредоточьтесь на царапинной отметке, созданной ранее. Затем тонкой настройки фокуса до наночастицы приходят в поле зрения.
- Для определения точного размещения конденсатора используйте метод kohler Illumination. 5 Kohler Освещение при высоком увеличении (80x, 100x) легче достичь путем первого установки Kohler освещение на более низкое увеличение, такие как 20x.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Как правило, Kohler Освещение не нужно повторно корректировать во время изображения одного образца. Тем не менее, это хорошая практика, чтобы убедиться, что Kohler Освещение правильно установлен при переключении на новый слайд микроскопа.
- Оптимизация контрастных настроек.
- Выберите область интереса в выборке для визуализации. Центр области в поле зрения камеры и настроить фокус по мере необходимости.
- Если микроскоп имеет дизайн de Senarmont, начните с поляризатора, установленного вблизи максимального фонового вымирания, и постепенно поверните поляризатор в сторону уменьшения вымирания фона. Интенсивность фона будет постепенно увеличиваться.
- Если микроскоп не имеет дизайна де Сенармонт, начните с оптического поезда, установленного на максимальном фоне исчезновения. В этом случае постепенно корректируют объективную призму в сторону уменьшения фонового вымирания.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ место достижения идеальной настройки достигается, когда наночастицы достигают наибольшей разницы интенсивности (т.е. контраста) от усредненном локального фонового значения. Для плазмонных наночастиц оптимальный контраст обычно достигается при относительно темном фоне, таким образом, в условиях, близких к максимальному вымиранию фона.
- Выберите область интереса в выборке для визуализации. Центр области в поле зрения камеры и настроить фокус по мере необходимости.
- Изображение образца.
- Выключите освещение комнаты, чтобы предотвратить нерабляльное освещение от взаимодействия с процессом.
- При просмотре наночастиц с помощью научной камеры визуализации, определить оптимальный уровень фона. Используя 10 нм полной ширины на половину максимум (FWHM) bandpass фильтр с его центральной длины волны совместно расположен с основной длиной волны LSPR, просматривать область интереса. Отрегулируйте интенсивность лампы или время экспозиции до тех пор, пока фоновый уровень не будет в диапазоне 15%-40% от максимального уровня емкости камеры и никаких объектов в регионе, представляющих интерес, не проявляют интенсивность сигнала, превышающей 90% от максимального уровня интенсивности камеры.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, цель шага 2.3.2 состоит в том, чтобы предотвратить насыщение датчика при переключении между фильтрами. Идеальный фоновый уровень будет варьироваться между образцами и камерами. Как только этот шаг завершен, время экспозиции может быть скорректировано, но не интенсивность лампы. - Изображение образца с серией фильтров bandpass, каждый из которых имеет FWHM 10 нм и что в целом позволяют изображения по всему диапазону длинволн интереса. Убедитесь, что интенсивность фона остается последовательной от изображения к изображению (в пределах 5% друг от друга) путем корректировки времени экспозиции. После переключения фильтров переориентируйте образец перед захватом изображения.
- Сохранить изображения как несжатые файлы TIFF и/или в родном формате файла программного обеспечения, чтобы сохранить всю информацию.
- Поверните образец.
- После сбора изображений образца в исходном положении образец теперь может быть повернут и изображен на дополнительных ориентациях в светлом пути. Выполняйте вращение через регулярные промежутки времени (например, 10 или 15 градусов) в диапазоне 180 или 360 градусов.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Вращение требует вращающейся стадии образца. - Как и в разделах 2.1-2.3, отрегулируйте настройки камеры, чтобы обеспечить согласованный уровень фона от изображения к изображению.
ПРИМЕЧАНИЕ ПРИМЕЧАние, никакой корректировки на Kohler Освещение должно быть сделано.
- После сбора изображений образца в исходном положении образец теперь может быть повернут и изображен на дополнительных ориентациях в светлом пути. Выполняйте вращение через регулярные промежутки времени (например, 10 или 15 градусов) в диапазоне 180 или 360 градусов.
3. Анализ данных с использованием ImageJ
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Следующие вычисления могут быть выполнены в различных пакетах программного обеспечения, а иногда и в родной программе, используемой для сбора изображений. ImageJ является свободно доступным программным обеспечением от Национальных институтов здравоохранения (NIH).
- Рассчитайте контраст или интенсивность частиц.
- Откройте изображение с помощью ImageJ.
- Выберите инструмент Rectangle и нарисуйте прямоугольник вокруг основного интересуемого региона.
- На панели инструментов, выберите изображение, затем увеличить, то для выбора. Окно изображения увеличит выбранную область.
- На панели инструментов, выберите изображение, затем отрегулируйте,затем яркость /Контраст. Появляется новое окно. Для лучшего просмотра области выборки отрегулируйте четыре настройки. Эти корректировки не меняют научные данные, они лишь обеспечивают лучшую видимость области выборки.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Шаги 3.1.3 и 3.1.4 могут быть выполнены несколько раз и в обратном порядке. - Используя инструмент прямоугольника снова, нарисуйте коробку вокруг первой наночастицы, которая будет измерена. Коробка должна быть лишь немного больше, чем воздушный диск наночастиц.
- На панели инструментов, выберите Анализ,затем мера. Появляется новое окно, которое сообщает о минимальном, максимальном и среднем интенсивности для пикселей, расположенных внутри выбранного окна.
- Перетащите коробку, используемую для измерения наночастиц, в область, непосредственно прилегающую к частице, где контраст фона относительно ровный и никаких частиц или загрязняющих веществ нет. Сохранить исходный размер коробки.
- Используйте инструмент Измерения для определения средней интенсивности фоновой области.
- Измерьте оставшиеся частицы и прилегающую фоновую область для каждого из них.
- Повторите процесс для каждой частицы во всех изображениях в серии.
- Экспорт данных в электронную таблицу для расчета контрастности или интенсивности каждой частицы на всех длинах волн и углах.
- Рассчитайте контраст каждой частицы, используя следующее уравнение13,14,15-

ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, Используя это уравнение, контраст частиц всегда должен быть - Рассчитайте максимальное значение частицы, скорректированное на фоне фона, разделив измеренную максимальную интенсивность частиц ы на фоновое значение.
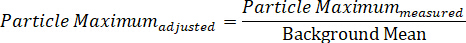
- Аналогичным образом, вычислить фон-скорректированное минимальное значение путем деления измеренной минимальной интенсивности частиц на фоновое среднее значение.
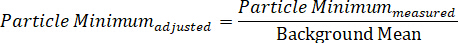
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, как подсчитано, максимум должен иметь значение больше одного, в то время как минимум будет меньше одного. Допустимо вычесть каждое значение по "1", так что средний фон по существу равен нулю, максимум представлен как положительное значение, а минимальное значение присваивается отрицательное значение16. Такой последний подход позволяет аналитику отдельно учитывать то, что происходит вдоль каждого из полей поляризации, что полезно при изучении анизотропных частиц. - Для графика спектрального профиля в данном положении наночастиц, участок данных с длиной волны вдоль оси x и контраста или интенсивности вдоль y-оси.
- Для графика вращательного профиля на заданной длине волны, начастоте угол вращения вдоль оси х и контраста или интенсивности вдоль оси y.
Access restricted. Please log in or start a trial to view this content.
Результаты
При работе с образцами, которые являются достаточно большими, чтобы увидеть невооруженным глазом, размещение ориентиров на стеклянном субстрате обычно не требуется. Однако при работе с наноматериалами или при вращении образца ориентиры могут обеспечить простой мето...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
При визуализации с помощью микроскопии DIC крайне важно оптимизировать оптические компоненты перед сбором данных. Даже незначительные корректировки поляризатора в середине эксперимента могут привести к значительному воздействию на окончательные данные6. Кроме того, разл...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Автору нечего раскрывать.
Благодарности
Д-р Энтони С. Стендер хотел бы отметить техническую поддержку через Nanoscale и квантовых явлений института (НЗПИ) в Университете Огайо. Эта статья стала возможной благодаря стартовому финансированию, предоставленному доктору Стендеру Университетом Огайо.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Contrad 70 | Decon Labs, Inc. | 1002 | For cleaning microscope glass, Available through many chemical suppliers |
| Ethanol | Fisher Scientific | A962-4 | For cleaning and storing microscope glass |
| Glass microscope cover slips | Ted Pella | 260148 | |
| Glass microscope slides | Ted Pella | 26007 | |
| Gold nanorods | Nanopartz | DIAM-SPR-25-650 | |
| Gold nanospheres (80 nm) | Sigma Aldrich | 742023-25ML | |
| ImageJ | NIH | N/A | Free Software availabe for data analysis from NIJ |
| Nail polish | Electron Microscopy Sciences | 72180 | |
| Nikon Ti-E microscope | Nikon | N/A | |
| Nitrogen gas | Airgas | N/A | |
| ORCA Flash 4.0 V2+ digital sCMOS camera | Hamamatsu | 77054098 | |
| Scribing pen | Amazon | N/A | Many options available online for under $10. Not necessary to buy an expensive version. |
| Ultrapure water | 18 megaohm |
Ссылки
- Pluta, M. Ch 7: Differential Interference Contrast in. Advanced Light Microscopy. 2, Elsevier. 146-197 (1989).
- Stender, A. S., Wang, G., Sun, W., Fang, N. Influence of Gold Nanorod Geometry on Optical Response. ACS Nano. 4 (12), 7667-7675 (2010).
- Stender, A. S., et al. Single Cell Optical Imaging and Spectroscopy. Chemical Reviews. 113 (4), 2469-2527 (2013).
- Mehta, S. B., Sheppard, C. J. R. Partially coherent image formation in differential interference contrast (DIC) microscope. Optics Express. 16 (24), 19462-19479 (2008).
- Murphy, D. B., Davidson, M. W. Ch 1: Fundamentals of Light Microscopy. Fundamentals of Light Microscopy and Electronic Imaging, Second edition. , Wiley. 1-20 (2012).
- Stender, A. S., Augspurger, A. E., Wang, G., Fang, N. Influence of Polarization Setting on Gold Nanorod Signal at Nonplasmonic Wavelengths Under Differential Interference Contrast Microscopy. Analytical Chemistry. 84 (12), 5210-5215 (2012).
- Wang, G., Sun, W., Luo, Y., Fang, N. Resolving Rotational Motions of Nano-objects in Engineered Environments and Live Cells with Gold Nanorods and Differential Interference Contrast Microscopy. Journal of the American Chemical Society. 132 (46), 16417-16422 (2010).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Mulvaney, P. Not All That's Gold Does Glitter. MRS Bulletin. 26 (12), 1009-1014 (2012).
- Maier, S. A. Plasmonics: Fundamentals and Applications. , Springer US. (2007).
- Sun, W., Wang, G., Fang, N., Yeung, E. S. Wavelength-Dependent Differential Interference Contrast Microscopy: Selectively Imaging Nanoparticle Probes in Live Cells. Analytical Chemistry. 81 (22), 9203-9208 (2009).
- Cras, J. J., Rowe-Taitt, C. A., Nivens, D. A., Ligler, F. S. Comparison of chemical cleaning methods of glass in preparation for silanization. Biosensors and Bioelectronics. 14 (8), 683-688 (1999).
- Augspurger, A. E., Sun, X., Trewyn, B. G., Fang, N., Stender, A. S. Monitoring the Stimulated Uncapping Process of Gold-Capped Mesoporous Silica Nanoparticles. Analytical Chemistry. 90 (5), 3183-3188 (2018).
- Murphy, D. B., Davidson, M. W. Ch 2: Light and Color. Fundamentals of Light Microscopy and Electronic Imaging, Second Edition. , Wiley. 21-33 (2012).
- Wayne, R. Ch 3: The Dependence of Image Formation on the Nature of Light. Light and Video Microscopy (Second Edition). , Academic Press. 43-78 (2014).
- Stender, A. S., Wei, X., Augspurger, A. E., Fang, N. Plasmonic Behavior of Single Gold Dumbbells and Simple Dumbbell Geometries. The Journal of Physical Chemistry C. 117 (31), 16195-16202 (2013).
- Hu, M., et al. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance. Journal of Materials Chemistry. 18 (17), 1949-1960 (2008).
- Choo, P., et al. Wavelength-Dependent Differential Interference Contrast Inversion of Anisotropic Gold Nanoparticles. The Journal of Physical Chemistry C. 122 (47), 27024-27031 (2018).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon Coupling of Gold Nanorods at Short Distances and in Different Geometries. Nano Letters. 9 (4), 1651-1658 (2009).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены