Method Article
השתלת כימוגנטית מהונדס בקליפת המוח ושלתי לתוך המוחות המוקדמים של העכבר לנטאל
In This Article
Summary
כאן אנו מציגים פרוטוקול, שנועד להשתמש כלים גנטיים כדי לתמרן את הפעילות של הושלתי בקליפת המוח הפנימי מושתלים לתוך הקליפה של עכברים לידתיים מוקדם.
Abstract
פיתוח עצבי מוסדר על ידי שילוב מורכב של גורמים סביבתיים וגנטיים. הערכת התרומה היחסית של כל אחד מהרכיבים היא משימה מסובכת, שקשה במיוחד לגבי התפתחות החומצה הγ-בוטירית הקורטיבית (חבר העמים). CIs הם הנוירונים המעמילים העיקריים בקליפת המוח, והם משחקים תפקידי מפתח ברשתות נוירואליות, על ידי ויסות הן הפעילות של נוירונים בודדים בעלי מידות, כמו גם התנהגות מנדנוד של הרכבים עצביים. הם מופקים במבנים עובריים ארעי (המדיטציה וקאדלי-MGE ו-CGE) כי הם קשים מאוד ליעד ביעילות באמצעות הרחם בגישות. הושלתי להעביר מרחקים ארוכים במהלך התפתחות מעובריים נורמלית, לפני שהם משתלבים במעגל הקורטיקלית. היכולת המדהימה הזאת להתפזר ולהשתלב ברשת המתפתחת יכולה להיות נחטפה על-ידי שתילת מקדם-נוירונים עובריים מתחת לפני לידה מוקדם לאחר הלידה. כאן, אנו מציגים פרוטוקול המאפשר שינוי גנטי של ושלתי הבינניותא עובריים באמצעות מוקד לשעבר vivo electroporation. מקדם הנדסה אלה מראש מהונדסים לאחר מכן מושתלים לאחר לידה מחשב מארח לאחר לידה, שם הם בוגרים לזיהוי CIs בקלות. פרוטוקול זה מאפשר את השימוש של מספר כלים מקודדים גנטית, או את היכולת לווסת את הביטוי של גנים ספציפיים בושלתי הבינתא, כדי לחקור את ההשפעה של משתנים גנטיים או סביבתיים על ההבשלה ו אינטגרציה של CIs.
Introduction
הפונקציה של הרשתות העצבי מסתמך על קיומה של השלמה מאוזנת של נוירונים הקרנה מרגש ומעכבות אינטרנוירונים. למרות האינטרנוירונים הקורטיקליים (CIs) רק מייצגים 20% של כל הנוירונים במרכיבי היונקים, החסרונות במספר או בפונקציה שלהם נחשבים לנגן חלק מפתח בפתוגנזה של הפרעות נוירולוגיה1,2. המחקר של התפתחות CI הוא מאתגר כי חבר העמים מופקים מבנים עובריים ארעי כי הם קשים גישה, והם עוקבים אחר הגירה ממושכת לפני שהם מגיעים לפליום ולפתח אנטומית ופיסיולוגיים בוגרים שלהם נכסים3. שני מנגנונים גנטיים וסביבתיים ידועים כי להסדיר את הפיתוח של CI4, אבל זה הוכיח קשה ללמוד את התרומה היחסית של גורמים מרובים.
תובנות רבות בפיתוח CI הושגו באמצעות מערכות תרבות מבחנה לאחר בידוד של ושלתי מ-ganglionic מוקדי5,6. אחד היתרונות הגדולים של שיטות אלה הוא הפוטנציאל תווית ולשנות גנטית ושלתי מבודדים ולעקוב אחר הבידול שלהם בפירוט, כדי לזהות שינויים האוטונומית התא. עם זאת, שיטות אלה אינן מאפשרות להציע מידע בנוגע לאינטראקציות בין פיתוח אינטרנוירונים ורשת פעילה. התאמתי את הפרוטוקולים האלה, על ידי השתלת הסמנים האחרונים שהשתנו לתוך קליפת לאחר לידה מוקדמת. בושלתי הבינתא מבודדים מהפרואודים עובריים מסוגלים לשרוד, להתפזר ולהשתלב ברשת המארחת עם השתלת לתוך קליפת המוח7,8. שיטה זו שימש כדי להפחית את חומרת התקפים אפילפטי במודלים של העכבר הגנטי, והוצע כטיפול חדש אפשרי עבור הפרעות נוירותפתחותיות שונות9,10. פרוטוקול קודם מתאר הליך המתאר את הסמנים הבאים עם וקטורים ויראליים לפני הזריעה11. הפרוטוקול שאנו מתארים כאן מאפשר גם את השינוי הגנטי של האינטרנוירונים, אך אינו דורש יצירת וקטור ויראלי, המחייב רק DNA פלמיד, אשר מגביר מאוד את הגמישות שלה. מחקרים מסוימים דיווחו על הצלחה בשימוש באלקטרופורציה הרחם כדי לשנות גנטית ושלתי הבין בתוך גנגלייוני ganglionic (CGE)12, אבל שיטה זו הוכיחה קשה מאוד להתרבות.
בסעיף תוצאות נציג, אנו ממחישים את השימוש בשיטה זו כדי לבטא קולטני מעצבים המופעל באופן בלעדי על ידי תרופות מעצבים (הראסטות13) ב-CIs המושתלים, שיטה בה השתמשנו בפרסום האחרון14. אנו הביע hM3D (הקיו), קולטן מהונדסים המבוססת על CHRM3 cholinergic האדם הקולטן, אשר אינו משפיע על הפונקציה העצבית אלא אם כן הוא מאגד ליגנד clozapine-N-תחמוצת המסוים שלו (cno). ניהול CNO באופן סלקטיבי מפעיל הפעלה של hM3D (קיו) המבטא תאים. השתמשנו בשיטה זו כדי להראות כי התא האוטונומי ואת depolarization ארעית מספיק כדי למנוע אפופטוזיס של CIs במהלך פיתוח14. בשילוב עם כלים שונים מקודד גנטית, פרוטוקול זה יש פוטנציאל למעלה או למטה-להסדיר את הביטוי הגנטי, ולהמחיש או לתמרן פעילות התא בשלבים שונים של הבחנה בין תאי העצב.
Protocol
בעלי חיים נולדו ושוכנו בהתאם לחוק בעלי חיים בבריטניה (הליכים מדעיים) (1986).
הערה: עבור הדור של pCAGGs-hM3D (ג ' י)-IRES-RFP לבנות, קטע של סאלי-StuI, המכיל את hM3D (הג) רצף, כבר מבודד פלממיד 50463 (Addgene), והוכנס לתוך הביטוי וקטור pCAGGs-RFP (מתנה של F. Guillemot) מתעכל עם קסהוי-אכרוב
1. הכנת העובר העכבר פרוסות קורטיקלית
- לחטא ציוד מעבדה (למשל, מיקרוסקופים סטריאו) ומשטחים (למשל, ספסלים) עם הממס ניקוי המתאים ו 70% אתנול (אטוח) פתרון במים (H2O).
- השתמש בכלי הניתוח שהיו באוטוקלשים ולשמור אותם כל הזמן ב 100% אטוה.
- הכינו 3 20 mL של 4% הטמפ ' הנמוכה ביותר בטמפרטורת מאגר של 1 x פוספט (PBS), בצינורות של 50 mL, ושמרו אותם ב-55 ° c.
- להקריב עכברים בהריון על ידי נקע בצוואר הרחם ב 13.5 או 14.5 ימים של ההיריון (יום מעובי 13.5-E 23.4).
- עם זוג של מספריים לחיתוך, לפתוח את הבטן של עכברים בהריון, להסיר את קרני הרחם (עם העוברים) ולמקם אותם בתמיסת קרבס קר (שולחן 1), בצלחת פטרי 90 מ"מ.
- עם זוג של מלקחיים בסדר התלמיד ישר, לפתוח את שקי השפיר, להסיר את העוברים ולהעביר אותם בתמיסת קרבס טרי קר, בצלחת פטרי חדשה 90 מ"מ. לנתח את המוח העובר העכבר (המוח הקדמי, אמצע המוח, החוצה המוח) משאר הגוף העובר.
- החזקת המוח גזור מן המוח הפגר, להעביר אותם בתמיסת קרבס קר ב-90 מילימטר חדש צלחת פטרי, ולשמור אותם על קרח.
- עם עט עמיד למים, צייר קו ישר במשטח החיצוני, באמצע החלק התחתון של 6 35 מנות פטרי מילימטר.
- מקום אחד 4% נמוך-gelling עשר העשרה בשעה 37 ° c עבור 5 דקות. מיד לאחר מכן המסכן 10 mL ב 2 35 מ"מ מנות פטרי ולהטביע את המוח גזור.
הערה: את הריח צריך לעמוד כלפי מטה (בתחתית צלחת פטרי). להטביע 3-4 מוחות לכל צלחת פטרי, ליישר אותם בקו ישר שצויר בעבר. השאר מרווח של 3 מילימטר. בין שני מוחות - חזור על שלבים 1.8 ו-1.9 עד שכל המוחות המוגזור הוטבעו.
- מניחים את המוח המוטבע ב -4 ° c, כדי לחזק את הצמח, ולאחר מכן לגלף את שלושת המוחות לבלוק אחד של גודל ואוריינטציה מתאימים.
הערה: השאירו כ 3 מ"מ מסביב לקצות דגימות המוח. שינוי הכיוון של המוח, עם הנורות ריח על גבי. - הדבק את הבלוק על פני השטח של בסיס מיקרוטום ובאמצעות להב כירורגי לחתוך כל הדרך בתחתית הבלוק, בין שני המוחות, על מנת ליצור 3 בלוקים עצמאיים (כל מיני בלוק המכיל מוח אחד).
- מקטע את הבלוקים, בתמיסת קרבס קר כקרח, לתוך 250 יקרומטר פרוסות עבות, באמצעות להב רוטט מיקרוטומה.
- עם מיקרו-מרית שטוח בסופו של דבר לאסוף רק את הפרוסות המכילות את המדיליאלים או caulionic מקואל (MGE או CGE; איור 1) ובנפרד להעביר אותם על ממברנות מסנן (13 יקרומטר קוטר, 8.0 יקרומטר גודל הנקבוביות), צף על מדיום חיוני מינימלי (זיכרון, שולחן 1) ב פוליסטירן מרכז-מנות תרבות עוגב (60 מ"מ x 15 מ"מ).
- מניחים את הכלים בחממה לתרבות הרקמה של CO2 , ב-37 ° c, במשך 1, והיכונו לאלקטרופורציה המרכזית.
2. אלקטרופורציה חדה במוח
- לפני תחילת ההליך אלקטרופורציה, להכין 50 mL של 1% העלה ג'ל בצלחת פטרי 100 מ"מ. השאירו את הג ג'ל כדי לגבש בטמפרטורת החדר (RT) במשך כ 30 דקות.
- הכנת עמודות agarose זעיר (קוטר 1 מ"מ ו 10 מ"מ אורך), מנוקב עם פיפטה זכוכית (225 מ"מ אורך; 2 mL קיבולת) ולהעביר אותם פתרונות קרבס קר הקרח.
הערה: הנורה טפטפת גומי מתאים 2 להפיפטות mL מחוברת לפיפטה, ועל ידי לחיצה עליו את העמודה ניתן לשחרר מן הצנרת זכוכית לפתרון Krebs. - עם להב כירורגי, גזור גושי agarose קטנים של שני גדלים: אחד קטן שיתאים על פני השטח של האלקטרודה (ראה להלן) ואחד גדול, אשר ישמש כבסיס לביצוע זריקות ה-DNA המוקד לתוך פרוסות המוח. להעביר את אבני agarose בפתרון קרבס קר גם.
- הכן את הגדרת הזריקות המרכזית ואת האלקטרופורציה החריפה (איור 2).
הערה: עבור הזריקות, הציוד הבא נדרש: 1) שדה בהיר לנתיחה סטריאו מיקרוסקופ, 2) מזרק פניאומטי משאבת, 3) מיקרומניפולציה, 4) עמדה מגנטית, ו 5) צלחת פלדה בסיס. עבור electroporation הפרוסה החדה, הציוד הבא נדרש: 1) אחד מרובע פלטינה 10 מ"מ צלחת פטרי אלקטרודה, 2) ריבוע אחד פלטינה 10 מ"מ לכסות אלקטרודה, 3) מיקרומניפולציה, ו 4) אלקטרופורטור. -
הזרקת דנ א מוקד
- להכין תערובת DNA של ביטוי וקטורים: pCAGGs-IRES-GFP (שליטה וקטור) + pCAGGs-hM3D (ג ' קיו)-IRES-RFP, בריכוז של 1 μg/μL עבור כל וקטור ולהוסיף פתרון ירוק מהיר (מניות 25 מ"ג/mL) ב 1/10 דילול.
- למלא מיקרופיפטה זכוכית משכה (0.5 מ"מ קוטר פנימי 1 מ"מ קוטר חיצוני) עם 10 μL של תערובת ה-DNA ולהזריק כמויות קטנות (על הטווח 25-50 nL) לתוך האזור שנבחר (MGE/CGE) של הפרוסה (איור 1 ואיור 2).
-
אלקטרופורציה חריפה
הערה: האלקטרופורציה צריכה להתבצע מיד. לאחר הזרקת הדי. אנ. איי המרכזית- מניחים את הבלוק agarose קטן על האלקטרודה צלחת פטרי ולצרף את העמודה agarose לתוך האלקטרודה לכסות ניידים בעזרת מיקרו-מרית הסתיימה שטוח.
- העבר את הפרוסה עם הממברנה התומכת שלו אל הבלוק של agarose והקצה את האלקטרודה העליונה עם העמודה agarose על גבי האזור שנבחר (MGE/CGE) של הפרוסה.
הערה: טעינת המתח של 125 V (שני פולסים של 5 ms כל, מרווח 500 ms) תניב אלקטרופורציה מוצלחת (איור 3).
- לאחר האלקטרופורציה, מניחים את הפרוסה עם הקרום התומך שלה בתוך המנה ומעבירים את המנה בחממה לתרבות הרקמה של CO2 , ב-37 ° c.
- לאחר השעה 1, החלף את המדיום הראשי עבור מדיום בסיסי המתאים לתרבויות הנוירואליות הראשיות (תא עצב בינוני בסיסי; שולחן 1) ומודיית את הפרוסות לילה, תמורת כ 18-24 h.
3. הכנת תא-שתלי
- בדוק את יעילות האלקטרופורציה בכל הפרוסות. בחר רק את הפרוסות שבהן מספר מקובל של תאי פלורסנט נצפה (איור 3).
הערה: אלקטרופורה כ-30 פרוסות/לכל ניסוי כדי להשיג את מספר התאים המתאים להשתלת (ראה להלן). - לנתח את האזור שנבחר (MGE/CGE) מכל פרוסה וחותכים את הרקמה לתוך חתיכות קטנות בתמיסת קרבס קר בקרח, תחת ניתוח פלורסנט מיקרוסקופ-סטריאו.
- בינתיים, המקום שפופרת 1.5 mL עם 900 μL תא עצב בסיסי בינוני באמבט מים ב 37 ° c.
- העבר את חתיכות הרקמה עם P1000 מיקרופיפיאור לצינור 1.5 mL המכיל 500 μL של L15/DNase בינוני מוכן על ידי הוספת 100 μL של 1 מ"ג/mL DNase מלאי ב-d/F12 בינונית לתוך 900 μL של L15 medium. לשטוף את חתיכות הרקמה על ידי הקשה.
- הוסף 100 μL של DNase (מניות 1 מ"ג/mL ב dמדיום/F12 בינונית) לתוך מדיום בסיסית 900 μL.
- להיפטר L15/DNase בינונית ולהשעות מחדש את חתיכות הרקמה 200 μL תא עצב בסיסי/DNase בינוני מוכן בשלב 3.5.
- הגדרת P200 מיקרופיפיפיאור כדי 180 μL ומכנית הנתק את חתיכות הרקמה על ידי ליטוף למעלה ולמטה בעדינות, 20-30 פעמים, עד חלקה ו "קרם" השעיה מתקבל.
- הוסף 200 μL של תא עצב בסיסי/DNase בינונית (הנפח הכולל הסופי 400 μL) והשעיה מחדש.
- לקחת 4 μL ליטר של תאים, לדלל כראוי והר על המוגלובין.
- תחת מיקרוסקופ שדה בהיר, בדוק את יעילות הדיסוציאציה וספור את מספר התאים.
הערה: אם הדיסוציאציה היא מוצלחת, בהיר (בחיים) תאים בודדים ולא אגרגטים תאים יהיה נצפתה. - תא צנטריפוגה השעיה משלב 3.8, ב 1,000 rpm, ב RT, עבור 5 דקות, ולאחר מכן, להסיר את supernatant מן הצינור ולהוסיף את המדיום L15/DNase המתאים (בדרך כלל 5-7 μL) כך הריכוז הסופי של תאים יהיה 8 x 105-1.2 x 106 תאים/μL.
הערה: במהלך ההשעיה, חשוב מאוד להימנע בועות אוויר. - מניחים את התא סדרת מחלקים על הקרח ויש להם עוד L15/dnase בינונית עבור זריקות.
4. זריקות תוך-גולגולתי
הערה: ההליכים הבאים מתקיימים בחדר הליכים בתוך מתקן בית החיות. מאז התאים ייזריקו ישירות למוח של גורים היילוד מבלי לחשוף את המוח, מצבים אספטי נשמרים על ידי חיטוי מרחב העבודה עם 70% הפתרון אטוח ושימוש במחטים זכוכית אוטוקלבה. הציוד הבא נדרש עבור זריקות תוך גולגולתי: 1) שדה בהיר לנתיחה סטריאו מיקרוסקופ, 2) מיקרו מזרק, ו 3) משטח חימום להתאוששות העכבר.
- הכינו מחט זכוכית על ידי משיכת מחטים בהתאם להמלצות של היצרן. מחטי זכוכית עם קוטר החיצוני 80 יקרומטר, 40 יקרומטר קוטר פנימי, ו-30 ° משופע משמשות בפרוטוקול זה.
הערה: כפי שהוזכר לעיל, יש להשתמש במחטים לפני השימוש. - Backfill באופן ידני את המחט עם שמן אדיש ביולוגית באמצעות 30 G, 2 המחט אינטש מזרק.
- להרכיב ולהכניס את המחט ליחידת מזרק על פי הוראות היצרן.
- קבע את הגדרות ההזרקה באמצעי האחסון המרבי (69 nL) וקצב איטי יחסי (23 nL/s).
- רוקן את המחט עד שהבוכנה מורחבת לגמרי.
-
. תמלא את המחט
- חותכים חתיכה קטנה מקלטת השתלה ומניחים אותו תחת לחיתוך שדה בהיר-מיקרוסקופ סטריאו. עם P10 מיקרופיפטה, להעביר 5 μL מן המדגם (תא aliquot) אל הקלטת, כך ירידה כדורית נוצרת.
- מניחים את קצה המחט לתוך המדגם וממלאים את המחט (הבוכנה מופרע הזה בו ומציירת את המדגם עם זה).
הערה: מאז המדגם צריך להיות צמיגי למדי, למלא את המחט בשלבים קטנים כך את המדגם יהיה שיווי משקל, ובקצב איטי המונע בועות מיצירת. המדגם צריך להיות חלק והומוגנית בתוך המחט. אם המדגם הוא צמיגי מדי ולא ניתן למלא את המחט, להוסיף L15/DNase בינונית כפי שהוא נדרש כדי לקבל את צמיגות הנכון. אף על פי כן, זה ישנה את ריכוז המדגם, ובאופן אידיאלי יש להימנע.
- הרדים גורים חדשים שנולדו (יום לפני הלידה 0-2 [P0-P2]) על קרח עבור 2-5 דקות.
הערה: . תוודא שכלבלב לא זז - מניחים את הגור רדימים תחת השדה בהיר לנתיחה סטריאו מיקרוסקופ.
- לבצע 3-4 זריקות של 69 nL כל אחד בחצי הכדור.
הערה: אתרי ההזרקה ממוקמים כ 1 מ"מ לרוחב לקו האמצע, ו בין 1 מ"מ caudal לברגמה ו 1 מ"מ rostral לקו הפנימי. קצה המחט צריך להיות ממוקם בערך 1 מ"מ עמוק משטח pial. לאחר כל הזרקה, המחט נשאר במקום בערך 30 s ונסוג בתקופות. - מיד לאחר הזריקות, מניחים את הגור על משטח חימום עם חימום בסביבה הנמוכה ביותר (37 ° c). כאשר הגור מתאושש להעביר אותו לכלוב עם אמו.
הערה: לעולם אל תעזוב את האמא. בלי כלבלבים בכלוב ההליך כולו (מהסרת הגור מן החברים האחרים שלו, עד שהוא מוחזר) צריך להימשך פחות מ 10 דקות.
5. clozapine-N-תחמוצת הזריקות
- הכן את ליגד ligand, CNO פתרון מניות על ידי דילול 1 מ"ג של CNO ב 50 μL של diמתיל סולפוקסיד (DMSO) עד הפתרון הוא שקוף. Top-עד 10 mL עם מלוחים כך הריכוז הסופי של CNO הוא 0.1 mg/mL.
הערה: . DMSO רעיל הימנע משימוש בו לריכוז גבוה יותר מ 0.1%. השתמש כפקד פתרון מלוחים המכיל את אותו ריכוז DMSO כמו הפתרון המכיל CNO. - מיום הלידה 14 ו 3 ימים באופן מחודש (P14-P16), בכל עכבר לבצע שני הפנימי (כגון) זריקות של CNO (ריכוז CNO: 1 מ"ג/ק"ג) או 0.05% DMSO ב תמיסת מלח, ליום, 12 h בנפרד.
- ביום האחרון (P17), לבצע הזרקה בודדת ולהקריב עכברים על ידי פריקה צוואר הרחם בתוך חלון זמן של 30 דקות-1 h.
תוצאות
באמצעות ההליך המוצג כאן, בדקנו אם ההישרדות של האינטרנוירונים בקליפת הסביבה במהלך השלבים המוקדמים לאחר הלידה מוסדר על ידי פעילות באופן אוטונומי התא. בוצעו 3 המוח הניסוי אלקטרופורציה ניסויים (12-16 עוברים [e 14.5 עוברים] לניסוי) עם pcaggs-ires-gfp (בקרה) ו pcaggs-hM3D (ג'י אי)-ires-rfp ביטוי וקטורים, בריכוז של 1 μg/μl עבור כל מבנה. בניסויי האלקטרופורציה שלנו, רק חלקיק (כ-50%; איור 3) של GFP+ נוירונים שיתוף מבוטא hM3D (הקיו) (rfp+) ולכן gfp+rfp- האוכלוסייה שימש שליטה פנימית להשפעה של הדרד ליגנדס. האינטרנוירונים מתחלקים בקליפת המוח היו הושעה מכנית וכתוצאה מכך השעיה התא (8 x 105 תאים/μl) הושתל בקליפת P0-P1 פראי עכברים סוג. . ביצעו 6 זריקות לכל מוח בכל ניסוי, הזריקו לפחות 6 גורים. חדשים שנולדו המינהל של CNO סלקטיבי הגביר את הפעילות של RFP מזוהמים+ תאים, כפי שמתואר על ידי ביטוי של חלבון תלוי הפעילות cno (איור 4). טיפול CNO בהתאם לפרוטוקול המתואר (ניהול פעמיים ביום P14-P17) הביא עלייה בפרופורציה של GFP+rfp+ ביחס gfp+rfp- תאים, בהשוואה לרכב (0.5% dmso ב מלוחים) (איור 5).
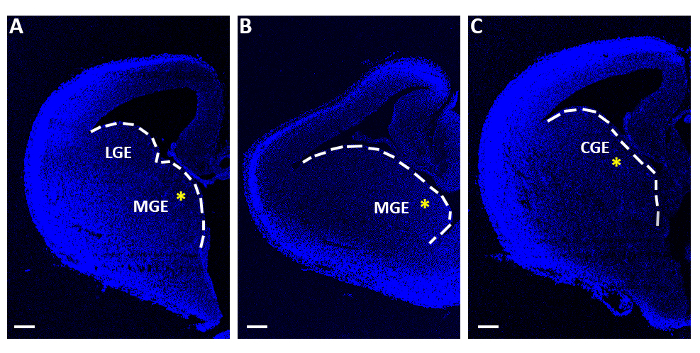
איור 1: telencephalic הנציגים המשמשים לניסויים באלקטרופורציה חריפה. (א-ג) Telencephalic פרוסות שהתקבלו בשלוש רמות רציפות סדרתית של הרוסטרו-caudal, ויטראז ' 4 ′, 6-diamidino-2-פניינילידול (DAPI). LGE: כבודך הגנגליתית לרוחב; מ. ג. כהוד מעלתך; . כבוד האלים קנה מידה של סרגלים = 200 μm. הכוכביות הצהובות מציינות את אתר האלקטרופורציה בכל פרוסה. הקו הלבן מסמן את הקצה. של כבודך הגנגלייוני אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
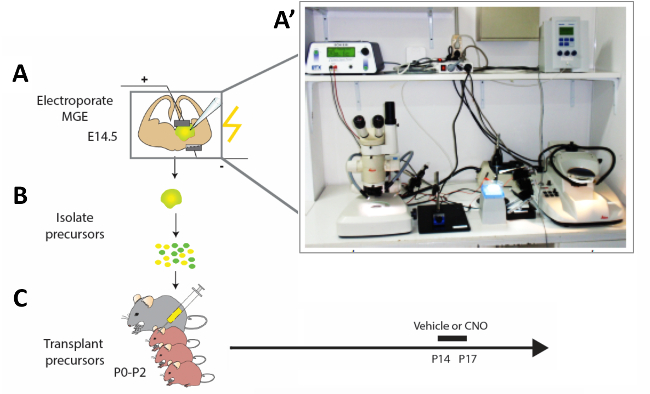
איור 2: ייצוג סכמטי של זרימת העבודה הניסיונית. (א) פרוסות מוח של העכבר הן electroporated עם המבנים המתאימים, ו (ב) לאחר 12 h שונה האינטרקותא (CI) מבודדים ו (ג) המושתלים ב הפליום של גורי העכבר היילוד (P0-P2). על מנת לשנות את הפעילות של CIs בלתי-מפותחים, כלבלבים P14 שקיבלו שתילת תאים הזריקו להם CNO או רכב במשך ארבעה ימים בהתאם לפרוטוקול המוצג. (א) תצלום של המוח האקוטי של מערכת החשמל הגדר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
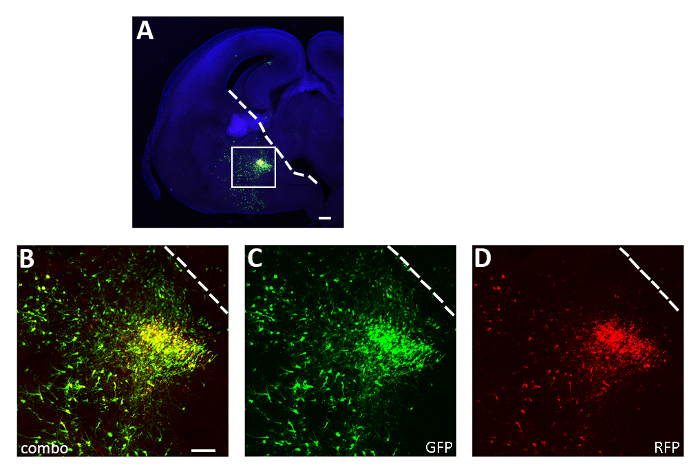
איור 3: נציג ניסוי אלקטרופורציה חדה מוצלחת של פרוסה. (A) הנציג בחלק השני של המוח העובר של י. י. ו. ב. מעורב ב-cge עם שניהם pCAGGs-IRES-GFP (gfp) ו Pcaggs-HM3D (מג)-IRES-RFP (rfp) פלמידים ומתורבתים עבור 12 h. הסעיף כבר מוכתם ב-GFP (A, B, C) ו-RFP (A, B, D). האזור הארוז בלוח A מוגדל כדי להציג את הביטוי של שני כתבים פלורסנט (ב), gfp (C) ו rfp בלבד (D). הקו הלבן מסמן את הקצה. של כבודך הגנגלייוני B-D: תמונה זהה, ערוצים שונים או שילוב של שני ערוצים שונים. סרגל ברים = 200 יקרומטר (A), 100 יקרומטר (B-D). דמות זו שונתה מ-Denaxa ואח '14. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
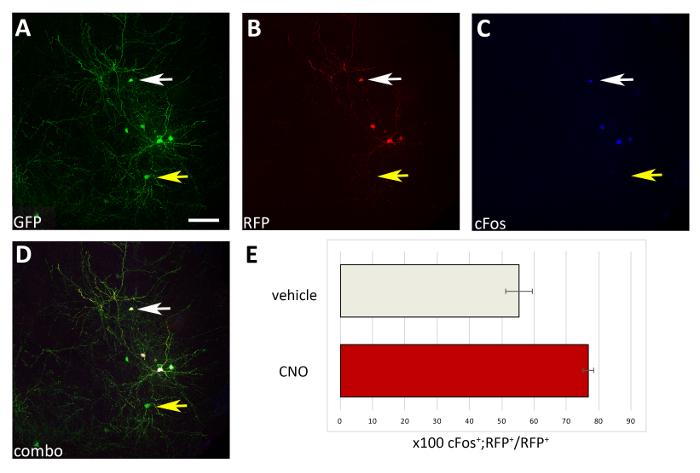
איור 4: הגידול האוטונומי של התא בפעילות של M3D (ג'י קיו)-הבעת הושתלים CIs על הממשל CNO. (A-D) הנציג מיקוד תמונות של קטע ילתית של עכבר P17 המושתלים ב P1 עם העברה מראש של CI עם שניהם pcaggs-ires-gfp (gfp) ו pcaggs-hM3D (ג ' קיו)-ires-rfp (rfp) פלמידים ו מטופלים עם cno. המקטע מוכתם בחיסוני של GFP (A), Rfp (B) ו-cfos (C). (ד) התמונה המשולבת של A, B ו-C האימונולואוורנציה (משולבת). שים לב כי רק CIs שיתוף ביטוי הן פלסטלינה (החצים לבנים ב-A-D) הם גם cFos+ לעומת חבר העמים ביטוי רק בקרת-gfp פלמיד (חיצים צהובים ב-A-D). (ה) קוונפיקציה של cfos+rfp+ תאים שנמצאו ב-P17 של עכברים המושתלים ב P1 (מנורמל ל-rfp בסך הכל האוכלוסייה) ומטופלים עם רכב או cfos (N = 2). A-D: תמונה זהה, ערוצים שונים, או שילוב של שלושה ערוצים שונים. קנה מידה ברים = 50 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
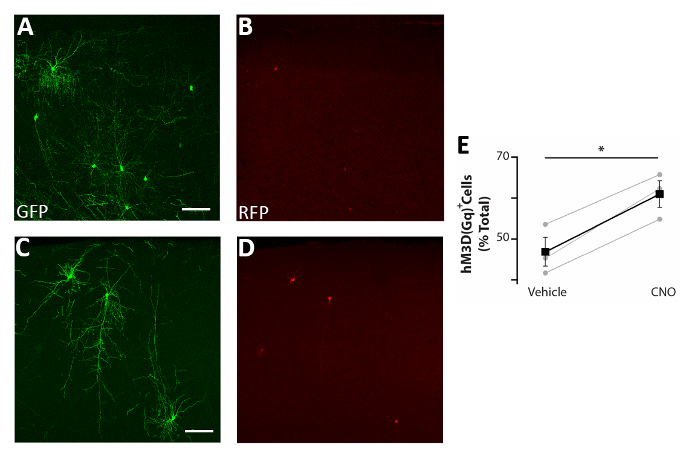
איור 5: הגידול האוטונומי של התא בפעילות של CIs מגביר את ההישרדות . (A-D) הנציגה המייצגת את התמונות של קליפת המוח הסוP17 פרוסות של עכברים המושתלים ב-P0-P2 עם מכוניות מקדימות בשני pCAGGs-IRES-GFP (GFP) ו pCAGGs-hM3D (ג'י אי)-IRES-RFP (RFP) ומטופלים עם רכב (א-ב) או cno (C-D). (ה) קוונפיקציה של rfp+ תאים שנמצאו במוח הקדמי של P17 עכברים המושתלים ב P0-P2 (מנורמל כל האוכלוסייה gfp+ ). RFP+(רכב) = 47% ± 3%, cno = 61% ± 3%, p = 0.01, בדיקת מדגם t של הסטודנט, n = 3 רכב ו-3 cno, מינימום של 150 תאים שנספרו לכל מוח. A ו-B: תמונה זהה, ערוצים שונים. C ו-D: תמונה זהה, ערוצים שונים. קנה מידה של סרגלים = 50 μm. דמות זו שונתה מ-Denaxa ואח '14. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
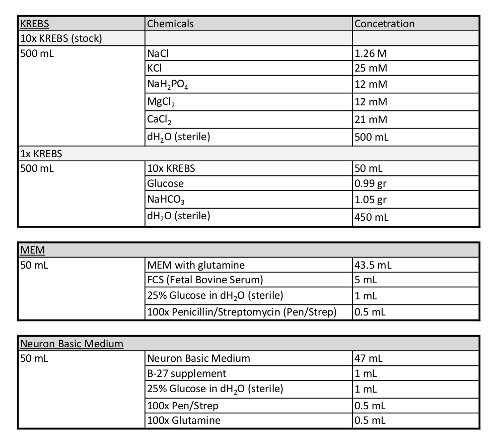
טבלה 1: מידע נוסף הנוגע למדיה המשמשת בפרוטוקול זה.
Discussion
כאן אנו מתארים מתודולוגיה נגישה נרחב כדי לשנות גנטית את הפעילות של הקדם-סמנים CI ללמוד את ההשפעה של פעילות פנימית על התבגרות CI, ו/או את ההשפעה של הפעילות מודנן על ההרכבה/פונקציה של קליפת הבית המשולבת עגלים.
בעבר, מספר מעבדות, כולל שלנו, ביצעו ניסויים אלקטרופורציה ברחם כדי לשנות גנטית הקרנה נוירונים6. עם זאת, בתוך הרחם באמצעות אלקטרולייוני הושלתי הכוללים CI מאוד קשה, בשל בעיות ההולכה החשמלית הנתיב. כדי לפתור בעיה זו, מספר קטן של מעבדות מבצעים הזרקת אולטרסאונד זריקות מונחה ואחריו אלקטרופורציה, שהיא טכניקה תובענית הדורשת ציוד יקר. פרוטוקול זה מספק חלופה למתודולוגיות אלה, הנגישה לרוב הקהילה המדעית.
אחד ההיבט המאתגר ביותר של פרוטוקול זה הוא למקסם את מספר התאים השורדים בקליפת המארח לשלבים בוגרים, כאשר ניתוח פנוטימית מבוצע בדרך כלל (תלוי מאוד בעיצוב הניסוי, אך בדרך כלל מבוגר מ P17). ישנם שלושה צעדי מפתח שהחוקר צריך לשים לב אליהם: (1) יעילות האלקטרופורציה. זה יכול להיות מוגדל על ידי הבטחת טוהר של הפלמידים DNA. יש להשתמש רק באיכות גבוהה של ה-DNA (A A260/a280 יחס של 1.9-2.0) עבור הליך זה. אנו משיגים כזה באיכות גבוהה DNA ההכנות על ידי שימוש בטיהור ה-DNA צסיום כלוריד. גורם מכריע נוסף הוא היזם המניע את הביטוי של גן העניין. מצאנו כי וקטור pcaggs, אשר מורכב מיזם העוף b-actin, הוא חזק מאוד יכול להגדיל באופן דרמטי את יעילות אלקטרופורציה. (2) מספר עוברי התורם המתחילים. חשוב לוודא כי מספר גדול (12-16) של עוברים באותו שלב הם אלקטרופורמות. מספר זה יכול להיות מוגבר, אם ניסויים נוספים מבצעים ניתוח העובר והעברתם יחד, כמו שחשוב כי הפרוסות הקורטיקלית העובריים מתקבלים, אלקטרופורמות והועברו לחממה בהקדם האפשרי. (3) חשוב לוודא כי מספר גדול של תאים מוזרק כל גור כדי להבטיח סיכוי גבוה של הישרדות התא המושתלים עד שלבים בוגרים. בנוסף, זה יהיה באופן דרמטי לשפר את הסבירות של השתלות מוצלח מאז צפיפות נמוכה ההכנות התאים תגרום ערבוב אחיד של התאים עם המדיום, אשר יפיק שינויים משמעותיים במוח מושתלים15 .
הפרוטוקול המתואר כאן הותאם לחקירת תפקידה של הפעילות בוויסות הישרדות CI באופן אוטונומי התא. חלון הזמן P14-P17 לביצוע זריקות CNO נבחר במיוחד על פי נתונים שפורסמו, אשר מראים כי השיא של מוות מושתל ושלתי ' התאים מתרחש בתקופה זו16. לכן, מסגרת הזמן או התדירות של זריקות CNO עשויה שלא להיות נכונה עבור סוגי תאים אחרים או אזורי מוח אחרים, והחוקר צריך להתאים את הפרמטרים הללו לפי המטרות הנסיוניות הספציפיות. בסופו של דבר, המתודולוגיה המתוארת כאן עבור זריקות בתוך הגולגולתית של CIs הוא אפשרי רק עבור P0-P5 גורים (תלוי גם על הרקע קו העכבר). בעיקרון, כל הזריקות מעל P5 ידרוש דילול או הסרת הגולגולת15.
אחד היתרונות המרכזיים של פרוטוקול זה הוא היכולת להשתמש בכלים חדשים מקודדים גנטית כדי להמחיש או לטפל בפעילות של חבר העמים במהלך שלבים שונים של בידול כפי שהם להשתלב ברשת מתפתחת. עם קצב של גילוי של מתח חדש מקודד גנטית וחיישנים סידן, כמו גם כימוכלים חדשים ואלקטרואופטיקה, פרוטוקול זה מאפשר לחוקרים להשתמש בהם בתוך שבועות של שחרור לתוך מאגרים פלביניים, כגון Addgene.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי מענק המתחיל ERC (282047), פרס חוקר ברוך הבא (095589/Z/11/Z), מענק תשוקה FP7 EC, ו פרס ליסטר מכון ל JB. העבודה במעבדה של סגן הנשיא נתמכת על-ידי BBSRC (BB/L022974/1), מועצת המחקר הרפואי של בריטניה (MRC), ומכון פרנסיס קריק (אשר מקבל מימון מ-MRC, מחקר הסרטן בבריטניה, והאמון הברוכים). המחקר במעבדת ה-md התאפשר באמצעות המענק מקרן סטבarchos לB.S.R.C. "אלכסנדר פלמינג", כחלק מיוזמת הקרן לתמוך במחקר היווני.
Materials
| Name | Company | Catalog Number | Comments |
| Medium/Supplements | |||
| B-27 | GIBCO (ThermoFisher Scientific) | 175040-044 | |
| DMEM/F12 | GIBCO (ThermoFisher Scientific) | 21331-020 | |
| DNAse | SIGMA | DN15-100MG | |
| FBS | GIBCO (ThermoFisher Scientific) | 10270-098 | |
| 100x Glutamine | GIBCO (ThermoFisher Scientific) | 35050-061 | |
| L15 | GIBCO (ThermoFisher Scientific) | 11415-049 | |
| MEM alpha, GlutaMAX | GIBCO (ThermoFisher Scientific) | 32561-029 | |
| Neurobasal medium | GIBCO (ThermoFisher Scientific) | 21103-049 | Neuron basic medium |
| 100x P/S | GIBCO (ThermoFisher Scientific) | 15140-122 | |
| Equipment | |||
| Electroporator | BTX | ECM 830 generator | |
| Injector for acute slice electroporation | Eppendorf | FemtoJet Microinjector | |
| Injector for cell transplantation (I) | Visual Sonics | Vevo Injector System | |
| Injector for cell transplantation (II) | WPI | NANOLITER2010 | |
| Magnetic Stand | WPI | M10L Magnetic Stand | |
| Kite Manual Micromanipulator | WPI | KITE-M3-R | |
| Platinum Elecrode (I) | Protech International Inc. | CUY-700-1 | |
| Platinum Elecrode (II) | Protech International Inc. | CUY-700-2 | |
| Steel Base Plate | WPI | 5479 | |
| Vibratome | Leica | VT1200S | |
| Other Material | |||
| Glass capillaries for electroporation | VWR | 1B100-4 | |
| Glass capillaries for cell transplantation | Visual Sonics | provided by Visual Sonics | |
| Nuclepore 8 µm whatman membrane | SLS | 110414 | |
| Organ tissue culture dishes | BD Biosciences (Falcon) | 353037 |
References
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Review Neuroscience. 13 (2), 107-120 (2012).
- Glausier, J. R., Lewis, D. A. GABA and schizophrenia: Where we stand and where we need to go. Schizophrenia Research. 181, 2-3 (2017).
- Fishell, G., Rudy, B. Mechanisms of inhibition within the telencephalon: "where the wild things are". Annual Review Neuroscience. 34, 535-567 (2011).
- Wamsley, B., Fishell, G. Genetic and activity-dependent mechanisms underlying interneuron diversity. Nature Review Neuroscience. 18 (5), 299-309 (2017).
- Xu, Q., Cobos, I., De La Cruz, E., Rubenstein, J. L., Anderson, S. A. Origins of cortical interneuron subtypes. Journal of Neuroscience. 24 (11), 2612-2622 (2004).
- Denaxa, M., et al. Maturation-promoting activity of SATB1 in MGE-derived cortical interneurons. Cell Reports. 2 (5), 1351-1362 (2012).
- Wichterle, H., Garcia-Verdugo, J. M., Herrera, D. G., Alvarez-Buylla, A. Young neurons from medial ganglionic eminence disperse in adult and embryonic brain. Nature Neuroscience. 2 (5), 461-466 (1999).
- Alvarez-Dolado, M., et al. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. Journal of Neuroscience. 26 (28), 7380-7389 (2006).
- Baraban, S. C., et al. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proccedings of the National Academy of Sciences of the United States of America. 106 (36), 15472-15477 (2009).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Vogt, D., et al. Viral-mediated Labeling and Transplantation of Medial Ganglionic Eminence (MGE) Cells for In Vivo Studies. Journal of Visualized Experiments. (98), e52740 (2015).
- De Marco Garcia, N. V., Karayannis, T., Fishell, G. Neuronal activity is required for the development of specific cortical interneuron subtypes. Nature. 472 (7343), 351-355 (2011).
- Urban, D. J., Roth, B. L. DREADDs (designer receptors exclusively activated by designer drugs): chemogenetic tools with therapeutic utility. Annual Review of Pharmacology and Toxicology. 55, 399-417 (2015).
- Denaxa, M., et al. Modulation of Apoptosis Controls Inhibitory Interneuron Number in the Cortex. Cell Reports. 22 (7), 1710-1721 (2018).
- Quatrocolo, G., et al. Homochronic Transplatation of Interneuron Precursors into Early Postnatal Mouse Brains. Journal of Visualized Experiments. (136), e57723 (2018).
- Southwell, D. G., et al. Intrinsically determined cell death of developning cortical interneurons. Nature. 491 (7422), 103-113 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved