Method Article
Erken Doğum Sonrası Fare Beyinlerine Kemogenetik Mühendislik Kortikal İnkornöron Progenitorlarının Nakli
Bu Makalede
Özet
Burada, erken doğum sonrası farelerin korteksine nakledilen kortikal internöron atalarının aktivitesini manipüle etmek için kemogenetik araçları kullanmak üzere tasarlanmış bir protokol sıyoruz.
Özet
Nöronal gelişim çevresel ve genetik faktörlerin karmaşık bir kombinasyonu ile düzenlenir. Her bileşenin göreceli katkısını değerlendirmek, γ-aminobütirik asit (GABA)ergic kortikal internöronların (BDB) gelişimi açısından özellikle zor olan karmaşık bir görevdir. CIs serebral kortekste ana inhibitör nöronlar, ve nöronal ağlarda önemli roller oynamak, bireysel piramidal nöronların aktivitesini düzenleyerek, hem de nöronal toplulukların salınım davranışı. Rahim elektroporasyon yaklaşımlarında etkili bir şekilde hedeflenmeleri çok zor olan geçici embriyonik yapılarda (medial ve kaudal ganglionik yapılar - MGE ve CGE) üretilirler. İnternöron ataları kortikal devreentegre önce, normal embriyonik gelişim sırasında uzun mesafeler göç. Gelişmekte olan bir ağa dağılma ve entegre olma gibi olağanüstü bir yetenek, embriyonik internöron öncüllerinin erken doğum sonrası konak kortekslerine nakledilmesiyle ele geçirilebilir. Burada, fokal ex vivo elektroporasyon kullanarak embriyonik internöron progenitors genetik modifikasyon sağlayan bir protokol salıyoruz. Bu mühendislik internöron öncüleri daha sonra erken doğum sonrası konak kortekslere nakledilir, kolayca tanımlanabilir CIs içine olgun olacak. Bu protokol, genetik olarak kodlanmış birden fazla aletin kullanılmasına veya genetik veya çevresel değişkenlerin olgunlaşma üzerindeki etkisini araştırmak amacıyla, internöron progenitatörlerinde belirli genlerin ekspresyonunu düzenleme olanağının CIs entegrasyonu.
Giriş
Nöronal ağların işlevi uyarıcı projeksiyon nöronlar ve inhibitör internöronlar dengeli bir kompleman varlığında dayanır. Kortikal internöronlar (CIs) sadece memeli kortekslerde tüm nöronların% 20 temsil rağmen, onların sayısı veya fonksiyonu açıkları nörogelişimsel bozuklukların patogenezinde önemli bir rol oynadığı düşünülmektedir1,2. CI gelişimi, CIs'lere ulaşılması zor geçici embriyonik yapılarda üretildiği ve pallium'a ulaşmadan önce uzun bir teğet göçü takip ettikleri ve olgun anatomik ve fizyolojik gelişimlerini geliştirdikleri için zorlu bir çalışmadır. özellikleri3. Hem genetik hem de çevresel mekanizmalar CI gelişimini düzenleyen bilinmektedir4, ama birden fazla faktörün göreceli katkısını incelemek zor kanıtlanmıştır.
CI gelişiminde birçok anlayışlar ganglionic eminences5,6atalarının izolasyon sonra in vitro kültür sistemleri kullanılarak elde edildi. Bu yöntemlerin en büyük avantajlarından biri, izole edilmiş ataları etiketleme ve genetik olarak değiştirme ve hücre özerk değişikliklerini tespit etmek için farklılaşmalarını ayrıntılı olarak takip etme potansiyelidir. Ancak, bu yöntemler internöronlar ve aktif bir ağ gelişmekte olan arasındaki etkileşimleri ile ilgili bilgi sunmak mümkün değildir. Modifiye öncüllerin erken doğum sonrası korteksine nakli ile bu protokolleri uyarladık. Embriyonik ganglionik itibarlardan izole internöron ataları korteks7,8içine nakli üzerine hayatta kalmak, dağıtmak ve konak ağına entegre edebiliyoruz. Bu yöntem genetik fare modellerinde epileptik nöbetlerin şiddetini azaltmak için kullanılmıştır ve farklı nörogelişimsel bozukluklar için olası bir yeni tedavi olarak önerilmiştir9,10. Önceki bir protokol, transplantasyonlar 11'den önce viral vektörlerle buöncülleri iletme prosedürünü açıklar. Burada tanımladığımız protokol aynı zamanda internöronların genetik modifikasyonuna da izin verir, ancak sadece plazmid DNA'sı gerektiren ve esnekliğini büyük ölçüde artıran viral bir vektörün yaratılmasını gerektirmez. Bazı çalışmalar genetik kaudal ganglionic eminences internöron progenitors değiştirmek için rahim elektroporasyon kullanarak başarı bildirdi (CGE)12, ama bu yöntem çoğaltmak için çok zor kanıtlamıştır.
Temsili sonuçlar bölümünde, biz sadece tasarımcı ilaçlar tarafından aktive tasarımcı reseptörleri ifade etmek için bu yöntemin kullanımını göstermek (DREADDs13) nakledilen CIs, biz son yayın kullanılan bir yöntem14. Biz hM3D (Gq), insan kolinerjik reseptör CHRM3 dayalı bir mühendislik reseptörü ifade, hangi spesifik ligand klozapin-N-oksit bağlar sürece nöronal fonksiyonu etkilemez (CNO). CNO uygulaması seçici hM3D (Gq) ifade hücrelerinin aktivasyonunu tetikler. Bu yöntemi, hücre otonom ve geçici depolarizasyon geliştirme sırasında CIs apoptosis önlemek için yeterli olduğunu göstermek için kullanılır14. Genetik olarak kodlanmış farklı araçlarla birleşen bu protokol, gen ekspresyonunu yukarı veya aşağı düzenleme ve internöron farklılaşmasının farklı aşamalarında hücre aktivitesini görselleştirme veya manipüle etme potansiyeline sahiptir.
Protokol
Hayvanlar, Birleşik Krallık Hayvanlar (Bilimsel Prosedürler) Yasası (1986) uyarınca yetiştirildi ve barındırıldı.
NOT: pCAGGs-hM3D(Gq)-IRES-RFP yapısının üretimi için, hM3D(Gq) dizisini içeren bir SalI-StuI parçası plazmid 50463 'den izole edilmiş ve ifade vektörpCAGGs-RFP (F. Guille'den hediye) ile sindirilmiş olarak eklenmiştir. XhoI-EcoRV.
1. Fare Embriyosu Kortikal Dilimlerinin Hazırlanması
- Laboratuvar ekipmanlarını (örn. stereo mikroskoplar) ve yüzeyleri (örn. banklar) uygun bir deterjan çözücü ve suda %70 etanol (EtOH) çözeltisi (H2O) ile sterilize edin.
- Otoklavlanmış diseksiyon araçlarını kullanın ve bunları her zaman %100 EtOH'ta saklayın.
- 50 mL tüplerde 1x fosfat tampon çözeltisinde (PBS) %4 düşük jellemalı agarose üç adet 20 mL aliquot hazırlayın ve 55 °C'de tutun.
- Gebe fareleri 13.5 veya 14.5 günlük gebelikte servikal çıkığı ile kurban edin (embriyonik gün E13.5-E14.5).
- Bir çift diseksiyon makası ile, hamile farelerin karnını açın, rahim boynuzlarını (embriyolarla birlikte) çıkarın ve 90 mm'lik Petri kabına buz gibi krebs çözeltisi (Tablo1)yerleştirin.
- Düz öğrenci ince forseps bir çift ile, amniyotik keseleri açın, embriyoları kaldırmak ve taze buz gibi Krebs çözeltisi onları transfer, yeni bir 90 mm Petri çanak. Fare embriyo beyin (ön beyin, orta beyin, arka beyin) embriyo vücudunun geri kalanından diseksiyon.
- Kesilen beyinleri arka beyinden tutarak, buz gibi Krebs çözeltisi içinde yeni bir 90 mm Petri kabına aktarın ve onları buzda tutun.
- Su geçirmez bir kalemle, altı adet 35 mm Petri kabının alt kısmının ortasına dış yüzeye düz bir çizgi çizin.
- 37 °C'de %4 düşük jelleştirici agarose/PBS 20 mL aliquot 5 dk. Hemen ardından iki 35 mm Petri kabına 10 mL'lik zayıflık yerleştirin ve parçalanmış beyinleri gömün.
NOT: Koku ampulleri aşağı ya da petri kabının alt yüz gerekir. Petri kabına 3-4 beyin yerleştirin, daha önce çizilmiş düz çizgide hizalayın. Her iki beyin arasında 3−5 mm boşluk bırakın. - Tüm parçalara ayrılan beyinler yerleştirilene kadar 1.8 ve 1.9 adımlarını tekrarlayın.
- Gömülü beyinleri 4 °C'ye yerleştirin, agarose'un katılaşması için, ve daha sonra üç beyni uygun boyut ve oryantasyonda tek bir blok halinde oyun.
NOT: Beyin örneklerinin kenarlarında yaklaşık 3 mm bırakın. Üst kısmında koku ampulleri ile, beyin yönünü değiştirin. - Bir mikrotom tabanının yüzeyinde tutkal blok ve bir cerrahi bıçak kullanarak bloğun alt boyunca tüm yol kesilmiş, her iki beyin arasında, amacıyla 3 bağımsız blok (her mini blok bir beyin içeren) oluşturmak için.
- Blokları buz gibi Krebs çözeltisinde, titreşen bir bıçak mikrotom'u kullanarak 250 μm kalınlığında dilimlere ayırın.
- Bükülmüş düz uçlu mikro-spatula ile sadece medial veya kaudal ganglionik itibarlar (MGE veya CGE içeren dilimleri toplamak; Şekil 1) ve polistiren merkezi-iyi organ kültür yemeklerinde (60 mm x 15 mm) minimum esansiyel ortamda (MEM, Tablo1) yüzen filtre membranlarına (13 m çapında, 8,0 m gözenek boyutu) ayrı ayrı aktarın.
- Bulaşıkları 37 °C'de bir CO2 doku kültürü kuluçka makinesine yerleştirin ve fokal elektroporasyona hazırlanın.
2. Akut Beyin Dilimi Elektroporasyon
- Elektroporasyon işlemine başlamadan önce, 100 mm Petri kabına %1 agarose jelin 50 mL'sini hazırlayın. Yaklaşık 30 dakika oda sıcaklığında (RT) katılaşmak için agarose jel bırakın.
- Küçük agarose kolonları (1 mm çap ve 10 mm uzunluk), cam pipet (225 mm uzunluk; 2 mL kapasiteli) ile delinmiş ve buz gibi Krebs çözeltilerinde aktarın.
NOT: Pipete 2 mL pipete uygun bir kauçuk damlalık ampulü bağlanır ve kolonu basılarak cam pipetten Krebs çözeltisine kadar serbest bırakılabilir. - Bir cerrahi bıçak ile, iki boyutta küçük agarose blokları kesti: elektrot yüzeyine uyacak küçük bir (aşağıya bakın) ve daha büyük bir, beyin dilimleri içine odak DNA enjeksiyonları gerçekleştirmek için bir üs olarak kullanılacak. Buz gibi Krebs çözeltisi içinde agarose blokları da aktarın.
- Odak enjeksiyonları ve akut elektroporasyon için kurulum hazırlayın (Şekil2).
NOT: Enjeksiyonlar için aşağıdaki ekipmangereklidir: 1) parlak alan diseksiyonu stereo-mikroskop, 2) pnömatik piko-pompa enjektörü, 3) bir mikromanipülatör, 4) manyetik stand ve 5) çelik taban plakası. Akut dilim elektroporasyonu için aşağıdaki ekipmana ihtiyaç vardır: 1) bir kare platin 10 mm Petri kabı elektrodu, 2) bir kare platin 10 mm kapak elektrodu, 3) bir mikromanipülatör ve 4) bir elektroporatör. -
Odak DNA enjeksiyonları
- İfade vektörlerinin DNA karışımını hazırlayın: pCAGGs-IRES-GFP (kontrol vektörü) + pCAGGs-hM3D(Gq)-IRES-RFP, her vektör için 1 μg/μL konsantrasyonda ve 1/10 seyreltme de hızlı yeşil çözelti (stok 25 mg/mL) ekleyin.
- Çekilen cam mikropipetini (0,5 mm iç çapı ve 1 mm dış çapı) 10 μL DNA karışımıyla doldurun ve dilimin seçili bölgesine (MGE/CGE) küçük miktarlarda (25-50 nL aralığında) enjekte edin (Şekil1 ve Şekil2).
-
Akut elektroporasyon
NOT: Elektroporasyon fokal DNA enjeksiyonundan hemen sonra yapılmalıdır.- Petri çanak elektrot üzerinde küçük agarose blok yerleştirin ve düz uçlu mikro-spatula yardımı ile mobil kapak elektrot agarose sütun takın.
- Destek membranı ile dilimi agarose bloğuna aktarın ve seçili bölgenin (MGE/CGE) üzerine agarose sütunlu üst elektrodu yerleştirin.
NOT: 125 V'lik şarj gerilimleri (her biri 5 ms, aralık 500 ms) başarılı bir elektroporasyon sağlayacaktır (Şekil 3).
- Elektroporasyondan sonra, destek membranı ile dilimi tabağa yerleştirin ve 37 °C'de bir CO2 doku kültürü kuluçka makinesine aktarın.
- 1 saat sonra, birincil nöronal kültürler (nöron temel orta) için uygun temel bir orta MEM orta değişimi; Tablo 1) ve yaklaşık 18-24 saat boyunca, bir gecede dilimleri kuluçkaya yatırın.
3. Hücre greftlerinin hazırlanması
- Tüm dilimlerde elektroporasyon verimliliğini kontrol edin. Yalnızca kabul edilebilir sayıda floresan hücrenin gözlendiği dilimleriseçin (Şekil 3).
NOT: Aşılama için uygun sayıda hücre elde etmek için deney başına yaklaşık 30 dilim/deney başına elektroporate (aşağıya bakın). - Seçilen bölgeyi (MGE/CGE) her dilimden ayırın ve bir floresan diseksiyon stereo-mikroskop altında, buz gibi Krebs çözeltisi içinde küçük parçalar halinde doku kesti.
- Bu arada, 37 °C'deki bir su banyosuna 900 μL nöron temel orta ile 1,5 mL'lik bir tüp yerleştirin.
- P1000 mikropipetli doku parçalarını, DMEM/F12 ortam100 μL'lik 1 mg/mL DNase stoku eklenerek hazırlanan 500 μL L 15/DNase orta sını içeren 1,5 mL'lik bir tüpe aktarın. Dokunarak doku parçalarını yıkayın.
- 900 μL nöron temel ortamına 100 μL DNase (DMEM/F12 ortamda stok 1 mg/mL) ekleyin.
- L15/DNase ortamını atın ve adım 3.5'te hazırlanan 200 μL nöron temel/DNase ortasında doku parçalarını yeniden askıya alın.
- P200 mikropipettor'u 180 μL'ye ayarlayın ve pürüzsüz ve "kremsi" süspansiyon elde edilene kadar doku parçalarını hafifçe 20-30 kez yukarı ve aşağı borular atarak mekanik olarak ayrıştırın.
- 200 μL nöron temel/DNase orta (nihai toplam hacim 400 μL) ekleyin ve yeniden askıya alın.
- Hücrelerin 4 μL aliquot alın, uygun seyreltmek ve bir hemositometre üzerine monte.
- Parlak bir alan mikroskobu altında, dissosyasyon verimliliğini kontrol edin ve hücre sayısını saymak.
NOT: Dissociation başarılı olursa, parlak (canlı) tek hücre ve hücre agregaları gözlenecektir. - Merkezsel süspansiyon adım 3.8, at 1.000 rpm, RT, 5 dakika için, ve daha sonra, tüpten supernatant kaldırmak ve uygun L15/DNase orta ekleyin (genellikle 5-7 μL) böylece hücrelerin son konsantrasyonu 8 x 105-1.2 x 10 6 olacak hücreleri/μL'leri.
NOT: Resuspension sırasında, hava kabarcıkları önlemek için son derece önemlidir. - Hücre aliquot buz üzerine yerleştirin ve enjeksiyonlar için ek L15/DNase orta var.
4. İntrakraniyal Enjeksiyonlar
NOT: Aşağıdaki işlemler Hayvan Evi Tesisi içinde bir prosedür odasında gerçekleşir. Hücreler doğrudan yenidoğan yavruların beyne beyin maruz kalmadan enjekte edilecek olduğundan, aseptik koşullar% 70 EtOH çözeltisi ile çalışma alanı sterilize ve otoklavcam iğneler kullanılarak tutulur. Aşağıdaki ekipman intrakranial enjeksiyonlar için gereklidir: 1) parlak bir alan diseksiyonu stereo-mikroskop, 2) bir mikro-enjektör, ve 3) fare kurtarma için bir ısıtma yastığı.
- Üreticinin tavsiyelerine göre iğne çekerek cam bir iğne hazırlayın. Bu protokolde 80 μm dış çapı, 40 μm iç çapı ve 30° yata sahip cam iğneler kullanılmaktadır.
NOT: Yukarıda belirtildiği gibi, iğneler kullanmadan önce otoklavolmalıdır. - 30 G, 2 inç iğne ve şırınga kullanarak iğneyi biyolojik olarak inert yağla manuel olarak doldurun.
- İğneyi üreticinin talimatlarına göre enjektör ünitesine monte edin ve takın.
- Enjeksiyon ayarlarını maksimum hacim (69 nL) ve göreceli yavaş hızı (23 nL/s) olarak belirleyin.
- Piston tamamen uzatılıncaya kadar iğneyi boşaltın.
-
İğneyi doldur.
- Bir aşılama bandından küçük bir parça kesin ve parlak bir alan diseksiyon stereo-mikroskop altına yerleştirin. P10 mikropipeti ile, örnekten (hücre aliquot) 5 μL'yi banta aktarın, böylece küresel bir damla oluşur.
- İğneucunu numunenin içine yerleştirin ve iğneyi doldurun (piston geri çeker ve numuneyi onunla birlikte çeker).
NOT: Örnek oldukça viskoz olması gerektiğinden, iğneyi küçük adımlarla doldurun, böylece örnek dengelenecek ve kabarcıkların oluşmasını engelleyen yavaş bir hızda. Örnek iğne içinde pürüzsüz ve homojen olmalıdır. Örnek çok viskoz ise ve iğneyi doldurmak mümkün değilse, doğru viskoziteyi elde etmek için gerekli olduğu kadar L15/DNase ortamı ekleyin. Yine de, bu örnek konsantrasyonu değişecektir, ve ideal kaçınılmalıdır.
- 2-5 dakika buz üzerinde yeni doğan yavrular (doğum sonrası gün 0-2 [P0-P2]) anestezi.
NOT: Yavrunun hareket etmediä inden emin olun. - Anestezili yavruyu parlak alan diseksiyonu stereo-mikroskobun altına yerleştirin.
- Her yarımkürede 69 nL'lik 3-4 enjeksiyon yapın.
NOT: Enjeksiyon bölgeleri orta hatta yaklaşık 1 mm lateral, bregma için 1 mm kaudal ve interaural çizgiye 1 mm rostral arasında yer alır. İğneucu pial yüzeye yaklaşık 1 mm derinliğinde yerleştirilmelidir. Her enjeksiyondan sonra iğne yaklaşık 30 s'lik bir yerde bırakılır ve periyotlar halinde geri çekilir. - Enjeksiyonlardan hemen sonra, yavruyu en düşük ayarında (37 °C) ısıtma yastığına yerleştirin. Yavru iyileştiğinde annesiyle birlikte kafese nakleder.
NOT: Kafeste yavru olmadan anneyi asla bırakma. Tüm prosedür (yavrunun çöp arkadaşlarından çıkarılmasından, döndürülene kadar) 10 dakikadan az sürmelidir.
5. Klozapin-N-oksit Enjeksiyonları
- Çözelti yarı saydam olana kadar 50 μL dimetil sülfoksitte (DMSO) 1 mg CNO seyrelterek DREADD ligand, CNO stok çözeltisini hazırlayın. CNO'nun son konsantrasyonunun 0.1 mg/mL olması için tuzlu su ile 10 mL'ye kadar kontör.
NOT: DMSO zehirlidir. %0,1'den daha yüksek bir konsantrasyonda kullanmaktan kaçının. CNO içeren çözelti ile aynı DMSO konsantrasyonuna neden olan tuzlu bir çözeltiyi kontrol etmek için kullanın. - Doğum sonrası gün 14 ve 3 kontertikülel gün (P14-P16), her fare iki intraperitoneal (I.P.) CNO enjeksiyonları gerçekleştirmek (CNO konsantrasyonu: 1 mg / kg) veya 0.05% DMSO tuzlu, günde, 12 saat arayla.
- Son gün (P17), 30 dakika-1 saat bir zaman dilimi içinde servikal çıkış ile tek bir enjeksiyon ve kurban fareler gerçekleştirin.
Sonuçlar
Burada sunulan prosedürü kullanarak, erken doğum sonrası evrelerde kortikal internöronların sağkalımlarının hücre otonom bir şekilde aktivite ile düzenlenip düzenlenmediğini test ettik. Her yapı için 1 μg/μL konsantrasyonda pCAGS-IRES-GFP (kontrol) ve pCAGGs-hM3D(Gq)-IRES-RFP ekspresyon vektörleri ile 3 beyin dilimi elektroporasyon deneyi (deney başına 12-16 embriyo [E14.5 embriyo] gerçekleştirdik. Elektroporasyon deneylerimizde, sadece bir kısmı (yaklaşık %50; Şekil 3) GFP+ nöronlar co-hM3D (Gq) (RFP+) ve bu nedenle GFP+RFP ifade- nüfus DREADD ligands etkisi için bir iç kontrol olarak görev yaptı. Transfected kortikal embriyonik internöronlar mekanik olarak ayrıştırıldı ve p0-P1 yabani tip farelerin korteksinde ortaya çıkan hücre süspansiyonu (8 x 105 hücre/l) aşılandı. Beyin başına 6 enjeksiyon yapmıştık. Her deneyde en az 6 yeni doğmuş yavru enjekte edildi. CNO'nun uygulanması, aktiviteye bağlı protein cFos'unun ekspresyonunda gösterildiği gibi transfected RFP+ hücrelerinin aktivitesini seçici olarak artırmıştır (Şekil 4). Açıklanan protokole göre CNO tedavisi (günde iki kez P14-P17 uygulayın) Araç (%0.5 DMSO tuzlu) ile karşılaştırıldığında GFP+RFP+ GFP+RFP+ hücreleri ile orantılı bir artış ile sonuçlandı (Şekil 5)uygulanmış çöpler .
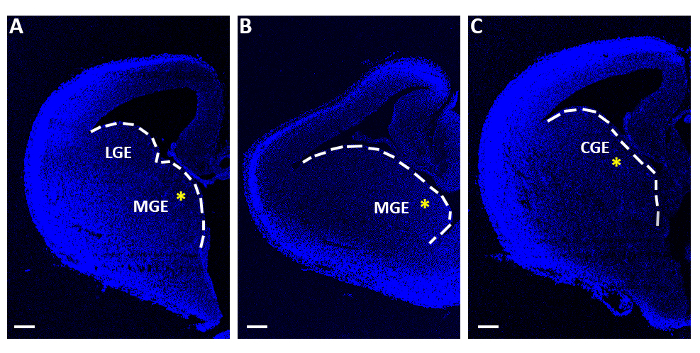
Şekil 1: Akut elektroporasyon deneyleri için kullanılan temsili telensefalik dilimler. (A-C) Telensefalik dilimleri üç farklı sıralı rostro-kaudal düzeyde elde edilen, 4 ile boyanmış,6-diamidino-2-fenilindole (DAPI). LGE: lateral ganglionik saygınlık; MGE: medial ganglionik saygınlık; CGE: kaudal ganglionik saygınlık. Ölçek çubukları = 200 μm. Sarı yıldız lar her dilimdeki elektroporasyon alanını gösterir. Beyaz çizgi ganglionik saygınlık kenarına işarettir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
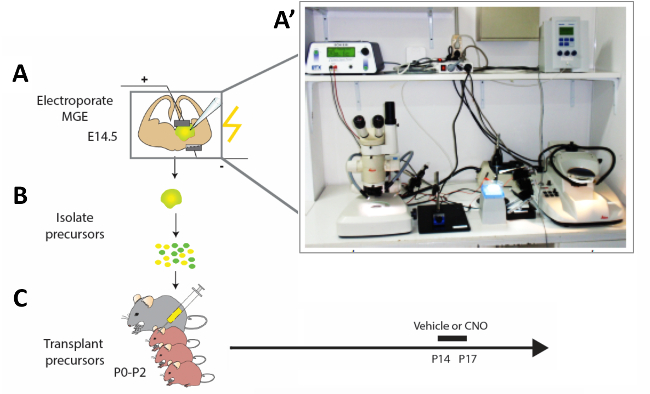
Şekil 2: Deneysel iş akışının şematik gösterimi. (A) Fare beyin dilimleri uygun yapılarla elektroporated ve (B) sonra 12 h modifiye kortikal interneuron (CI) öncülleri izole edilir ve (C) yenidoğan fare yavrularının pallium nakledilir (P0−P2). Olgunlaşmamış CIs'lerin aktivitesini değiştirmek amacıyla, hücre nakli yapılan P14 yavrularına sunulan protokole göre dört gün süreyle CNO veya araç enjekte edildi. (A') Akut fare beyin dilimi elektroporasyon kurulumu fotoğrafı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
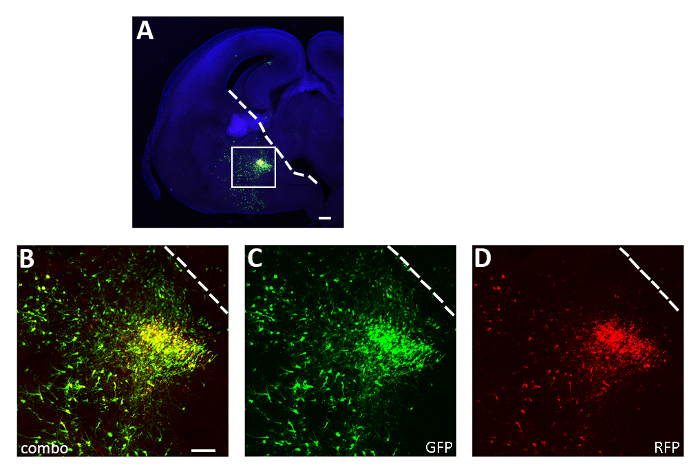
Şekil 3: Temsilci başarılı akut dilim elektroporasyon deneyi. (A) Hem pCAGGs-IRES-GFP (GFP) hem de pCAGGs-hM3D(Gq)-IRES-RFP (RFP) plazmidleri ve 12 saat için kültürlü cge transfected bir E14.5 embriyo beyin temsilcisi koronal bölüm. Bölüm GFP (A, B, C) ve RFP (A, B, D) için immünosüle edilmiştir. A panelindeki kutulu alan, yalnızca floresan muhabirlerin (B),GFP (C) ve RFP (D) ifadesini göstermek için büyütülür. Beyaz çizgi ganglionik saygınlık kenarına işarettir. B-D: aynı fotoğraf, farklı kanallar veya iki farklı kanal kombinasyonu. Ölçek çubukları = 200 μm (A), 100 μm (B-D). Bu rakam Denaxa ve ark.14'ten değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
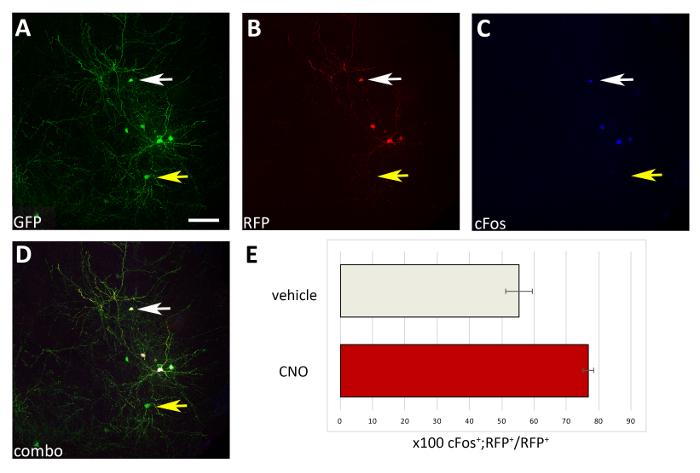
Şekil 4: CNO uygulaması üzerine M3D(Gq)-ekspres nakledilen CIs aktivitesinde hücre otonom artışı. (A-D) P1'de ci öncülleri ile nakledilen pCAGs-IRES-GFP (GFP) ve pCAGS-hM3D(Gq)-IRES-RFP (RFP) plazmidleri ile nakledilen p17 faresinin koronal bölümünün temsili konfokal görüntüleri ve CNO ile tedavi edilir. Bölüm GFP (A), RFP (B) ve cFos (C) için immünostained olmuştur. (D) A, B ve C immünofülans (açılan) kombine görüntüsü. Sadece cIs co-ifade her iki plazmids (A-D beyaz oklar) da cFos+ cIs sadece kontrol-GFP plazmid (A-D sarı oklar) ifade ile karşılaştırıldığında olduğunu unutmayın. (E) P1'de nakledilen P17 farelerinin pallium'unda bulunan cFos+RFP+ hücrelerinin sayısallaştırılması (toplam RFP+ popülasyona normalleştirilmiş) ve araç veya CNO ile tedavi edilmiştir (N = 2). A-D: aynı fotoğraf, farklı kanallar veya üç farklı kanalın kombinasyonu. Ölçek çubukları = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
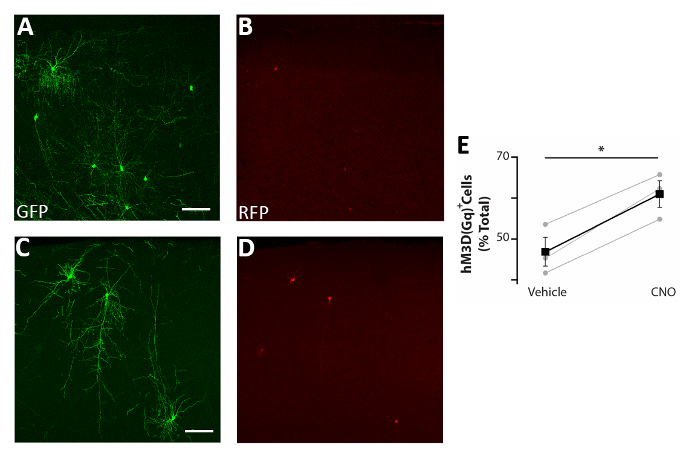
Şekil 5: CIs aktivitesinde hücre otonom artış sağkalımı artırır . (A-D) P0-P2'de ci öncülleri ile nakledilen P17 farelerinin somatosensoriyel korteks koronal dilimlerinin temsili konfokal görüntüleri hem pCAGGs-IRES-GFP (GFP) hem de pCAGGs-IRES-GFP (GFP) ve pCAGGs-hM3D(Gq)-IRES-RFP (RFP) plasmids ve araçla tedavi edilir (A-B) veya CNO (C-D). (E) P0-P2'de nakledilen P17 farelerinin ön beyninde bulunan RFP+ hücrelerinin sayısallaştırılması (toplam GFP+ popülasyona normalleştirilmiş). RFP+(araç) = %47 ± %3, CNO = %61 ± %3, p = 0.01, Öğrencinin eşleştirilmiş örnek t testi, n = 3 araç ve 3 CNO, beyin başına en az 150 hücre sayılır. A ve B: aynı fotoğraf, farklı kanallar. C ve D: aynı fotoğraf, farklı kanallar. Ölçek çubukları = 50 μm. Bu rakam Denaxa ve ark.14'ten değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
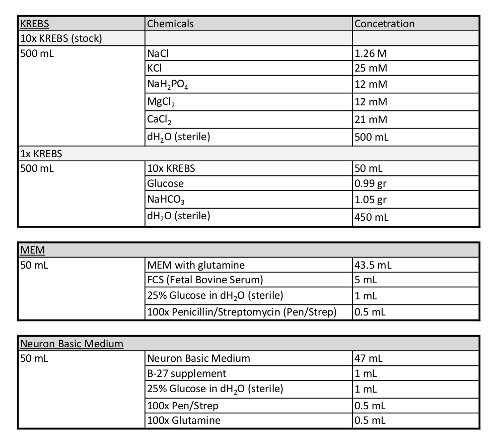
Tablo 1: Bu protokolde kullanılan ortamla ilgili ek bilgiler.
Tartışmalar
Burada, ci özyinelemeli faktörlerin etkinliğini genetik olarak değiştirmek için yaygın olarak erişilebilir bir metodolojiyi tanımlıyoruz, içsel aktivitenin CI olgunlaşması üzerindeki etkisini incelemek ve/veya aktivite modüle edilmiş CIs'lerin entegre kortikal kortikal ın montajı/işlevi üzerindeki etkisini incelemek için Devre.
Geçmişte, bizimki de dahil olmak üzere birçok laboratuvar, genetik olarak projeksiyon nöronlar 6değiştirmek için rahim elektroporasyon deneyleri yapmıştı. Ancak, CI atalarını içeren ganglionik saygınlıklar içine rahim elektroporasyon çok zordur, elektrikiletim yolu sorunları nedeniyle. Bu sorunu çözmek için, laboratuvarların az sayıda pahalı ekipman gerektiren zorlu bir tekniktir elektroporasyon, ardından ultrason güdümlü enjeksiyonlar gerçekleştirilmektedir. Bu protokol, bilim camiasının çoğunluğu tarafından erişilebilen bu metodolojilere bir alternatif sunmaktadır.
Bu protokolün en zorlu yanlarından biri, branotik analiz genellikle yapıldığında (deney tasarımına çok bağlı, ancak genellikle P17'den daha eski) ev sahibi kortekste hayatta bulunan hücrelerin sayısını olgun aşamalara kadar en üst düzeye çıkarmaktır. Araştırmacının dikkat etmesi gereken üç önemli adım vardır: (1) Elektroporasyonun verimliliği. Bu DNA plazmidlerinin saflığı sağlanarak maksimize edilebilir. Bu işlem için sadece yüksek kaliteli DNA plazmidleri (A260/A280 oranı 1.9-2.0) kullanılmalıdır. Biz sezyum klorür DNA arıtma istihdam ederek böyle yüksek kaliteli DNA preparatları elde. Bir diğer önemli faktör de ilgi geninin ekspresyonunu yönlendiren organizatördür. Biz pCAGGs vektör, hangi tavuk b-actin organizatörü oluşur, son derece güçlü ve önemli ölçüde elektroporasyon verimliliğini artırabilir bulundu. (2) Başlangıç donör embriyosayısı. Aynı evredeki embriyoların çok sayıda (12-16) elektroporated olduğundan emin olmak önemlidir. Embriyonik kortikal dilimlerin elde edilmesi, elektroporated ve en kısa sürede kuvöze aktarılması önemli olduğu gibi, daha fazla deneyci birlikte embriyo diseksiyonu ve kesit yapıyorsa, bu sayı artabilir. (3) Olgun evrelere kadar nakledilen hücre hayatta kalma şansının yüksek olmasını sağlamak için her yavruya çok sayıda hücre enjekte edilmesini sağlamak önemlidir. Buna ek olarak, düşük yoğunluklu hücre preparatları, nakledilen beyinlerde önemli değişkenlik yaratacak olan hücrelerin ortamla eşit olmayan bir şekilde karışmasıyla sonuçlanacaktır, bu da başarılı nakil olasılığını önemli ölçüde artıracaktır15 .
Burada açıklanan protokol, CI'nin hücre özerk bir şekilde hayatta kalmasını niçin düzenlemedeki etkinliğin rolünü araştırmak için tasarlanmıştır. CNO enjeksiyonları gerçekleştirmek için P14-P17 zaman penceresi özellikle nakledilen CI atalarının hücre ölümü zirve bu dönemde meydana geldiğini gösteren yayınlanan verilere göre seçilmiştir16. Bu nedenle, bu zaman dilimi veya CNO enjeksiyonları sıklığı diğer hücre tipleri veya beyin bölgeleri için geçerli olmayabilir, ve araştırmacı belirli deneysel amaçlara göre bu parametreleri ayarlamak gerekir. Son olarak, CIs intrakraniyal enjeksiyonlar için burada açıklanan metodoloji sadece P0-P5 yavrular için uygulanabilir (fare hattı arka plan da bağlı olarak). Prensip olarak, P5 üzerinde herhangi bir enjeksiyon inceltme veya kafatası15çıkarma gerektirir.
Bu protokolün en önemli avantajlarından biri, gelişmekte olan bir ağa entegre olarak farklılaşmanın farklı aşamalarında CIs'lerin etkinliğini görselleştirmek veya işlemek için yeni genetik olarak kodlanmış araçlar kullanabilmektir. Yeni genetik olarak kodlanmış voltaj ve kalsiyum sensörlerinin yanı sıra yeni kemogenetik ve optogenetik araçların keşfedilmesi hızıyla, bu protokol araştırmacıların bunları addgene gibi plazmid depolarına salınmasından birkaç hafta sonra kullanmalarına olanak tanır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma BIR ERC Starter Grant (282047), Wellcome Trust Araştırmacı Ödülü (095589/Z/11/Z), fp7 EC DESIRE hibeve JB bir Lister Enstitüsü Ödülü tarafından desteklenmiştir. V.P.'nin laboratuvarındaki çalışmalar BBSRC (BB/L022974/1), İngiltere Tıbbi Araştırma Konseyi (MRC) ve Francis Crick Enstitüsü (MRC, Cancer Research UK ve Wellcome Trust'tan fon alan) tarafından desteklenir. M.D. laboratuvarındaki araştırma, Stavros Niarchos Vakfı'nın Yunan araştırmasını destekleme girişimi nin bir parçası olarak B.S.R.C. "Alexander Fleming"e verdiği hibe ile mümkün oldu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Medium/Supplements | |||
| B-27 | GIBCO (ThermoFisher Scientific) | 175040-044 | |
| DMEM/F12 | GIBCO (ThermoFisher Scientific) | 21331-020 | |
| DNAse | SIGMA | DN15-100MG | |
| FBS | GIBCO (ThermoFisher Scientific) | 10270-098 | |
| 100x Glutamine | GIBCO (ThermoFisher Scientific) | 35050-061 | |
| L15 | GIBCO (ThermoFisher Scientific) | 11415-049 | |
| MEM alpha, GlutaMAX | GIBCO (ThermoFisher Scientific) | 32561-029 | |
| Neurobasal medium | GIBCO (ThermoFisher Scientific) | 21103-049 | Neuron basic medium |
| 100x P/S | GIBCO (ThermoFisher Scientific) | 15140-122 | |
| Equipment | |||
| Electroporator | BTX | ECM 830 generator | |
| Injector for acute slice electroporation | Eppendorf | FemtoJet Microinjector | |
| Injector for cell transplantation (I) | Visual Sonics | Vevo Injector System | |
| Injector for cell transplantation (II) | WPI | NANOLITER2010 | |
| Magnetic Stand | WPI | M10L Magnetic Stand | |
| Kite Manual Micromanipulator | WPI | KITE-M3-R | |
| Platinum Elecrode (I) | Protech International Inc. | CUY-700-1 | |
| Platinum Elecrode (II) | Protech International Inc. | CUY-700-2 | |
| Steel Base Plate | WPI | 5479 | |
| Vibratome | Leica | VT1200S | |
| Other Material | |||
| Glass capillaries for electroporation | VWR | 1B100-4 | |
| Glass capillaries for cell transplantation | Visual Sonics | provided by Visual Sonics | |
| Nuclepore 8 µm whatman membrane | SLS | 110414 | |
| Organ tissue culture dishes | BD Biosciences (Falcon) | 353037 |
Referanslar
- Marin, O. Interneuron dysfunction in psychiatric disorders. Nature Review Neuroscience. 13 (2), 107-120 (2012).
- Glausier, J. R., Lewis, D. A. GABA and schizophrenia: Where we stand and where we need to go. Schizophrenia Research. 181, 2-3 (2017).
- Fishell, G., Rudy, B. Mechanisms of inhibition within the telencephalon: "where the wild things are". Annual Review Neuroscience. 34, 535-567 (2011).
- Wamsley, B., Fishell, G. Genetic and activity-dependent mechanisms underlying interneuron diversity. Nature Review Neuroscience. 18 (5), 299-309 (2017).
- Xu, Q., Cobos, I., De La Cruz, E., Rubenstein, J. L., Anderson, S. A. Origins of cortical interneuron subtypes. Journal of Neuroscience. 24 (11), 2612-2622 (2004).
- Denaxa, M., et al. Maturation-promoting activity of SATB1 in MGE-derived cortical interneurons. Cell Reports. 2 (5), 1351-1362 (2012).
- Wichterle, H., Garcia-Verdugo, J. M., Herrera, D. G., Alvarez-Buylla, A. Young neurons from medial ganglionic eminence disperse in adult and embryonic brain. Nature Neuroscience. 2 (5), 461-466 (1999).
- Alvarez-Dolado, M., et al. Cortical inhibition modified by embryonic neural precursors grafted into the postnatal brain. Journal of Neuroscience. 26 (28), 7380-7389 (2006).
- Baraban, S. C., et al. Reduction of seizures by transplantation of cortical GABAergic interneuron precursors into Kv1.1 mutant mice. Proccedings of the National Academy of Sciences of the United States of America. 106 (36), 15472-15477 (2009).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Vogt, D., et al. Viral-mediated Labeling and Transplantation of Medial Ganglionic Eminence (MGE) Cells for In Vivo Studies. Journal of Visualized Experiments. (98), e52740 (2015).
- De Marco Garcia, N. V., Karayannis, T., Fishell, G. Neuronal activity is required for the development of specific cortical interneuron subtypes. Nature. 472 (7343), 351-355 (2011).
- Urban, D. J., Roth, B. L. DREADDs (designer receptors exclusively activated by designer drugs): chemogenetic tools with therapeutic utility. Annual Review of Pharmacology and Toxicology. 55, 399-417 (2015).
- Denaxa, M., et al. Modulation of Apoptosis Controls Inhibitory Interneuron Number in the Cortex. Cell Reports. 22 (7), 1710-1721 (2018).
- Quatrocolo, G., et al. Homochronic Transplatation of Interneuron Precursors into Early Postnatal Mouse Brains. Journal of Visualized Experiments. (136), e57723 (2018).
- Southwell, D. G., et al. Intrinsically determined cell death of developning cortical interneurons. Nature. 491 (7422), 103-113 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır