Method Article
הדמיה של אינטרפרון באתרו הפקת גמא בטחול העכבר בעקבות זיהום יסטריה חיידקי
In This Article
Summary
כאן, אנו מתארים מיקוד פשוט שיטה הדמיה כדי להמחיש את הלוקליזציה באתרו של תאים הפרשה את ציטוקינים אינטרפרון גמא באיברי הלימפה משני מוראין. פרוטוקול זה ניתן להארכה עבור ויזואליזציה של ציטוקינים אחרים ברקמות שונות.
Abstract
ציטוקינים הם חלבונים קטנים המופרשים על-ידי תאים, תקשורת תא תא מדיה חיוניים עבור תגובות החיסונית יעיל. מאפיין אחד של ציטוקינים הוא pleiotropism שלהם, כפי שהם מיוצרים על ידי והוא יכול להשפיע על המון סוגי תאים. ככזה, חשוב להבין לא רק אילו תאים מייצרים ציטוקינים, אלא גם באיזו סביבה הם עושים זאת, כדי להגדיר therapeutics ספציפי יותר. כאן, אנו מתארים שיטה להמחיש את הייצור cy, באתרו לאחר זיהום חיידקי. טכניקה זו מסתמכת על cytokine הדמיה-הפקת תאים בסביבה הטבעית שלהם על ידי מיקרוסקופ קונפוקלית וקד. לשם כך, מקטעי רקמות מוכתם סמנים של סוגי תאים מרובים יחד עם כתם ציטוקין. מפתח לשיטה זו, הפרשת ציטוקין חסומה ישירות בvivo לפני קצירת רקמת העניין, ומאפשר זיהוי של cy, שהצטברו בתוך התאים המייצרים. היתרונות של שיטה זו הם מרובים. ראשית, מיקרוסביבה שבה ציטוקינים מיוצרים נשמר, אשר יכול בסופו של דבר להודיע על האותות הדרושים לייצור cy, ואת התאים המושפעים על ידי ציטוקינים אלה. בנוסף, שיטה זו מציינת את המיקום של הפקת הציטוקין ב vivo, משום שהיא אינה נשענת על מלאכותית בגירוי מחדש של התאים המייצרים. עם זאת, לא ניתן לנתח בו cy, במורד הזרם איתות בתאים המקבלים את ציטוקינים. בדומה לכך, אותות הציטוקין שנצפו מתאימים רק לחלון הזמן שבמהלכו נחסם הפרשת ציטוקין. בעוד אנו מתארים את ההדמיה של ציטוקינים אינטרפרון (ifn) גמא בטחול לאחר זיהום העכבר על ידי חיידקים תאיים יסטריה monocytogenes, שיטה זו עשויה להיות מותאמת הדמיה של כל ציטוקין ב רוב האיברים.
Introduction
מארגן תגובה חיסונית יעילה נגד הפתוגן דורש אינטגרציה מורכבת של אותות המוצגים על ידי מגוון של תאים חיסוניים, כי הם התפזרו לעתים קרובות בין האורגניזם. על מנת לתקשר, תאים אלה לייצר חלבונים מסיסים קטנים עם פונקציות ביולוגיות מרובות הפועלות כמו אימונומודולטורים בשם ציטוקינים. בקרת ציטוקינים לגיוס תאים, הפעלה והפצה ולכן ידועים כנגני מפתח בקידום תגובות החיסון1. תגובות החיסון יעיל דורשים ציטוקינים להשתחרר בתבנית זמן מאורגנת מאוד חיבור תאים ספציפיים כדי לגרום לאותות ספציפיים. לכן, זה חיוני כדי ללמוד את הייצור cy, ואת האיתות שלה באתרו, לוקח בחשבון את מיקרוסביבה שבה ציטוקינים מיוצרים.
יסטריה מונוציטוטוגנס (L. חיידקי) הוא חיידק התאיים גרם-חיוביים המשמש כמודל הממשלה לחקור את התגובות החיסונית פתוגנים תאיים בעכברים. ציטוקין אחד, ifn גמא (IFNγ) מופק במהירות, בתוך 24 h לאחר זיהום L. חיידקי . יש צורך בסיווג הפתוגן, כמו עכברים שיצאו עבור IFNγ הם רגישים מאוד ל -L. מונציטוטוגנים זיהום2. IFNγ הוא pleiotropic והופק על ידי תאים מרובים בעקבות זיהום3. בעוד IFNγ המיוצר על ידי הרוצח הטבעי (NK) תאים נדרש עבור פעילות אנטי בקטריאלי ישירה4, IFNγ ממקורות אחרים הוכחו יש פונקציות אחרות. אכן, אנו ואחרים מצאו לאחרונה כי IFNγ המיוצר על ידי CD8 + T תאים יש פונקציה מסוימת באופן ישיר ויסות תא T בידול5,6,7. ככזה, הבנת אילו תאים מייצרים IFNγ (ובאיזו מיקרואקולוגיה) יש הכרחי לנתח את תפקודו.
הטכניקה הנפוצה ביותר כדי ללמוד הייצור cy, מסתמך על הצביעת ציטוקינים תאיים שנותחו על ידי הזרמת cy, לנסות. שיטה זו מאפשרת זיהוי סימולטני של ציטוקינים מרובים בשילוב עם סמנים פני השטח בתוך מדגם אחד, מתן כלי שימושי ביותר כדי ללמוד את הייצור ציטוקינים. עם זאת, שימוש בטכניקה הנ ל מרמז על אובדן כל מידע מרחבי. בנוסף, זיהוי cy, מסתמך בדרך כלל על גירוי מחדש של מבחנה כדי לאפשר זיהוי ציטוקין. ככזה, היכולת של תא מסוים לייצר ציטוקין מנותח, והיא אינה בהכרח מתאם עם הפרשת ציטוקין בפועל באתרו. שיטות אחרות משתמשות בעכברי כתבת שבהם ביטוי חלבון פלורסנט תואם לתמלול ומאפשר הדמיה ברמה של תא בודד8. למרות שיטה זו יכולה לעקוב אחר שעתוק ציטוקין באתרו, יש מספר מצומצם של עכברים כתבת הציטוקין זמין. בנוסף, שעתוק, תרגום הפרשה יכול לפעמים להיות מקושרים, וחלבונים פלורסנט יש מחצית חיים שונה מאשר cy, הם דיווחו, ביצוע שיטה זו לפעמים לא מספיק עבור הדמיית באתרו.
כאן, אנו מתארים שיטה להמחיש הפקה של ציטוקין באתרו על ידי מיקרוסקופ קונפוקלית וקד ברזולוציה תא יחיד. טכניקה זו מאפשרת הדמיה של המקור הסלולרי והנישה הסובבת בתוך הרקמה. פרוטוקול זה מתאר במפורש את ההדמיה של ייצור IFNγ בטחול של L. חיידקי נגועים, התמקדות כאן על הפקה IFNγ על ידי תאים NK ו אנטיגן מסוימים CD8+ T תאים. עם זאת, זה יכול להיות מורחב ומותאם לאפיון של כל ייצור cy, בהקשר של מצבים אחרים שבהם ציטוקינים מיוצרים כגון זיהום, דלקת או מחלות אוטואימוניות, כל עוד cy, ממוקד יכול להישמר בתאים על ידי מעכב הובלה בחלבון תאיים.
Protocol
כל הניסויים מעורבים עכברים היו בהסכמה עם הליכים מדעיים בבריטניה חוק של 1986.
1. העברה המאמצת של הCD8 בתאי T ספציפיים בעכברים
- בידוד אובלבומין (ב)-ספציפי CD8+ T תאים (oti) המבטא חלבון פלורסנט ירוק (oti-gfp) או חלבון פלורסנט אדום (oti-rfp) מתוך צומת לימפה הבולם של עכברי T-cell קולטן טרנסגניים9,10 באמצעות עכבר CD8+ T ערכת בידוד תא לפי הוראות ייצור. להכין את ההשעיה התא ידי ניפוץ בלוטות הלימפה באמצעות מזרק הבוכנה, כפי שתוארה בעבר11.
- העברת OTI-GFP או OTI-RFP תאים (3 x 106 תאים) לתוך C57BL/6 עכברים סוג פראי נמענים על ידי הזרקה ורידי כפי שמתואר על ידי Cahalan, ואח '12. השתמש בעכברים שבדרך כלל 6 – 12 שבועות של גיל.
הערה: שלב זה הוא אופציונלי ונדרש למעקב אחר תאי CD8+ T ספציפיים לאנטיגן.
2. זיהום יסטריה מונציטוטוגנים
- הרחיבו את L. חיידקי ששונו גנטית כדי לבטא את ה-ova (LM-OVA)13 לשלב מעריכי של צמיחה בעירוי לב של ציר ב-37 ° c בעצבנות עדינה עד ל-OD600 מגיע 0.08 – 0.1, כפי שמתואר בעבר . ארבע עשרה
- הכנס 100 μL (מקסימום נפח = 200 μL) של 0.1 – 0.5 LD50 LM-OVA מדולל במלח פוספט באגירה (PBS) על ידי הזרקה ורידית באמצעות מזרק 29 גרם אינסולין, לתוך C57BL/6 עכברים סוג פראי מקבלי הנושאת OTI-gfp או OTI-rfp תאים כמצוין.
הערה: בידינו, 0.1 x LD50 LM-OVA תואם 2 x 104 המושבה היוצרים יחידות (cfu). L. חיידקי שונה גנטית כדי לבטא את OVA משמש כדי להפעיל את oti CD8 בעבר הועברו בתאי T, אבל זנים אחרים של L. חיידקי ניתן להשתמש.
3. טיפול בברפלדין א (BFA) לחסימת הפרשת ציטוקין
- הכנס 250 μg של BFA ב 200 μL של PBS intraperitoneally 6 h לפני הקרבת העכבר באמצעות מזרק 29 גרם אינסולין.
הערה: BFA ליאופניקס מושעה תחילה ב diמתיל סולפוקסיד (DMSO) כדי להכין מלאי של 25 מ"ג/mL ריכוז. BFA מדולל אז ב PBS בטמפרטורת החדר (RT) כדי למנוע התגבשות לפני ההזרקה. עיכוב הפרשת ציטוקין גורם להצטברות של IFNγ בתאים. זה חיוני לגילוי ציטוקין.
4. קציר הטחול
- המתת חסד העכברים באמצעות עלייה ריכוז של CO2 ואחריו פריקה צוואר הרחם.
הערה: בצע את הנחיות המוסד המקומי לקבלת המתת חסד של עכברים. - לטהר את הבטן עם 70% אתנול, לבצע חתך עם מספריים כדי לעשות 1 – 2 ס מ לחתוך דרך העור על האגף השמאלי של העכבר, איפה הטחול ממוקם. בזהירות לעשות חתך בצפק לחשוף את הטחול ולהוציא אותו עם מספריים. לקצור את הטחול, להיות זהירים לא לסחוט אותו עם מלקחיים או לחתוך אותו כדי למנוע שיבוש הארכיטקטורה הטחול.
5. קיבוע של הטחול עם פאראפורמלדהיד (בתחתית)
- הכינו את הפתרון הקבע על ידי ערבוב 3.75 ml של PBS ו 3.75 mL של 0.2 M L-ליזין. הוסף 21 מ ג של נתרן m-הפרישדייט ומערבבים היטב. לאחר מכן להוסיף 2.5 mL של 4% בתחתית ו 20 μL של 12 N NaOH.
הערה: השתמש בפתרון הקבע באותו היום והשמט את העודפים. אל תאחסן אותו. זה צעד הקיבעון חשוב אם המדגם מכיל חלבונים פלורסנט כגון GFP. אין להשתמש במתנול, כאשר היא מכילה חלבונים פלורסצנט.
זהירות: היחידה הזאת רעילה. ויש לטפל בה בזהירות - לטבול את הטחול בתיקונים ולתקן למינימום של 4 h, בדרך כלל 16 – 20 h ב 4 ° c תחת עצבנות עדינה.
- השמט את התמיסה הקבע והוסף 5 מ ל של PBS במשך 5 דקות ב-RT תחת עצבנות עדינה.
- החליפו את ערוץ ה-PBS עם 5 מ ל של מודטה חדשה של PBS במשך 1 h ב -4 ° c תחת עצבנות עדינה.
- החלף את ה-PBS עם 5 מ ל של 30% סוכרוז, מודרת עבור 12 – 24 שעות.
הערה: שיטה זו מסייעת לשמור על מורפולוגיה של הרקמה. לאחר הדגירה עם פתרון סוכרוז, העוגב צריך לשקוע בתחתית הבאר.
6. הקפאה ושאיפה
- הניחו את הקרח היבש בכלי קיבול גדול והניחו כלי קיבול קטן יותר בתוך המכיל סביב 50 מ ל של מתנול טהורים וכמה פיסות של קרח יבש.
- יבש בעדינות את הטחול. על מגבון נטול מוך
- מניחים את הטחול בתוך עובש בסיס המכיל טיפה של טמפרטורת חיתוך מיטבית (OCT) מתחם בתחתית. להיזהר לא לייצר בועות כלשהן. . הוסף את הטה על הטחול
- עם מלקחיים, להפקיד את תבנית הבסיס על פני השטח של מתנול, וודא כי הוא לא לגעת OCT. הקפאת הרקמה מהר ככל האפשר כדי למזער את חפצי האמנות.
- , כשהיא קפואה. המשיכי עם הזמן
הערה: טחול קפוא ניתן לשמור ב-80 ° c במשך כמה חודשים. -
מדור את הרקמה באמצעות cryomicrotome.
- הגדר את טמפרטורת החדר בקריוסטט עד 21 ° c. גזור קטעים של עובי הרצוי (בדרך כלל סביב 10 μm). פרוטוקול זה פועל עם עוביים של עד 30 μm.
- לאסוף מקטעים על שקופיות מיקרוסקופ זכוכית (לראות את הטבלה של חומרים) ולבדוק חזותית.
הערה: מקטעים ניתן לשמור ב-80 ° c במשך מספר חודשים.
7. מכתים כתמים
- אפשר למקטע לבוא אל RT.
- צייר עיגול עם חוסם נוזלים (למשל, עט פאפ) סביב מקטע הרקמה. לצייר מחוץ ל-OCT או שהוא לא נדבק.
- ברגע שהוא יבש, מימה מחדש את המדגם על ידי הצבת PBS על מקטע הרקמה עבור 5 דקות.
הערה: עוצמת הקול הנמצאת במקטע תלויה בגודל המקטע. אנו משתמשים בדרך כלל 100-300 μL. אל תתנו את הסעיפים יבשים ברגע שהם מייבשים. - שטפו עם PBS לפחות פעמיים כדי לוודא שהמקטע מדבק היטב בשקופית.
-
הוסף פתרון חסימה למקטע כדי להקטין איגוד לא ספציפי של נוגדנים.
- הכנת פתרון חסימת כלפי: PBS עם 0.1% טריטון X100, 2% סרום עגל עוברי (FCS), 2.5 μg/mL חוסם קולטן (אנטי עכבר CD16/32). ואז להוסיף 2 – 5% סרום רגיל של המינים של כל נוגדן משני של הפאנל הכתמים.
הערה: אם הנוגדנים מצובטים ישירות/biotinylated, להוסיף 5% סרום רגיל של מינים של כל נוגדן ראשי. אם הנוגדן העיקרי ואחד הנוגדנים המשניים הם מאותו מינים (למשל, הנוגדן העיקרי הרים ארנב משני הארנב נגד עכברוש), לא להשתמש במיני סרום נורמלי כפי שהוא יגדיל את אות הרקע. - הסר בעדינות את ה-PBS מהמקטע על-ידי השאיפה והוסף 100 μL של פתרון החסימה לכל מקטע לדוגמה. מודטה בחדר רטוב מקורה למינימום של 1 h בשעה RT.
- הכנת פתרון חסימת כלפי: PBS עם 0.1% טריטון X100, 2% סרום עגל עוברי (FCS), 2.5 μg/mL חוסם קולטן (אנטי עכבר CD16/32). ואז להוסיף 2 – 5% סרום רגיל של המינים של כל נוגדן משני של הפאנל הכתמים.
-
. כתם עם נוגדנים ראשוניים
- דלל את הנוגדנים העיקריים בריכוז האופטימלי בפתרון החסימה. ריכוז נוגדן נקודת ההתחלה הכללית הוא 5 μg/mL, אבל זה צריך להיות אופטימיזציה עבור כל נוגדן ורקמות.
הערה: אם הנוגדנים הם בעלי מעלה ישירות, צנטריפוגה את תערובת הנוגדן ב 17.135 x g (13.500 rpm) עבור 15 דקות ב 4 ° צ' לפני השימוש בו. . Fluorophores יכול לזרז שלב זה יחלק את הזרז ובכך ימנע את הפקדת הנוגדנים הבלתי ספציפית בשקופית. - החלף את פתרון החסימה בתמהיל הנוגדן העיקרי לכל דוגמה.
- המלון משלב 4 שעות ב-RT או בלילה (OVN) ב -4 ° c בחדר רטוב מקורה.
- דלל את הנוגדנים העיקריים בריכוז האופטימלי בפתרון החסימה. ריכוז נוגדן נקודת ההתחלה הכללית הוא 5 μg/mL, אבל זה צריך להיות אופטימיזציה עבור כל נוגדן ורקמות.
-
. בצעו כביסה
- הכן מאגר כביסה על-ידי הוספת 2% FCS ל-PBS.
- לשטוף 4 פעמים עם מאגר לשטוף: אחד מהיר (ללא דגירה), אחד עבור 10 דקות ושתיים עבור 5 דקות. לאחר מכן בצע שטיפה אחרונה עם PBS עבור 5 דקות.
-
. מכתים עם נוגדנים משניים
- דלל את הנוגדנים המשניים המעניינים בריכוז האופטימלי בפתרון החסימה. לצנטריפוגה את התערובת, כפי שתוארה על הנוגדנים העיקריים.
- הסר את פתרון השטיפה הסופי. הוסף את שילוב הנוגדן המשני על גבי המקטע ואת הדגירה עבור 1 – 4 h ב RT בחדר רטוב מקורה.
- לשטוף 4 פעמים עם מאגר לשטוף: אחד מהיר (ללא דגירה), אחד עבור 10 דקות ושתיים עבור 5 דקות. לאחר מכן בצע שטיפה אחרונה עם PBS עבור 5 דקות.
- הסר את פתרון השטיפה הסופי. הניחו ל-PBS להתאדות אך לא לייבש את האזור. מניחים טיפה של המדיום הגובר על גבי המדגם ומניחים בזהירות את הזכוכית המכסה על גבי זה. המדיום הגובר חייב לשחזר את כל המקטע. . שיהיה מוגן מפני אור
הערה: צייר עיגול מסביב למקטע בצד ההפוך של השקופית לפני החלת המדיום הגובר. לאחר החלת המדיום הגובר, הרקמה עלולה להיות קשה לראות. - אחסן את השקופיות בחשכה ב-4 ° צ' עד שהיא מוכנה לתמונה.
8. הדמיה וניתוח
- לבצע הדמיה של ההכתמים עם מיקרוסקופ קונפוקלית וקד.
הערה: בפרוטוקול זה, לייזר ספקטרלי הפוכה סריקה מיקרוסקופ שימש (לראות את הטבלה של חומרים), יחד עם מטרות 10x/NA 0.40 או 60x/NA 1.4 (לניתוח של התאמה לוקליזציה של cy, משנה סלולרית). אורכי גל של עירור ופליטה מוצגים עבור כל fluorophore ו חלבון פלורסנט בטבלה של חומרים. - בצע ניתוח וכימות כנדרש באמצעות תוכנת עיבוד תמונה (למשל, מאריס או פיג'י).
תוצאות
IFNγ המיוצר בתוך 24 h הראשון לאחר זיהום יסטריה חיידקי הוא קריטי כדי לשלוט על התפשטות של פתוגן זה. באמצעות פרוטוקול זה, אנחנו יכולים לדמיין לא רק אילו תאים מייצרים IFNγ אלא גם אם הם ממוקמים מיקרוסביבה מסוימת. כדי לעזור לנו להתוות את הארכיטקטורה של הטחול, אנו תוויות תאים ידוע יש מיקום מסוים בתוך הטחול. סמן F4/80 תוויות כל מקרופאגים ומדגיש את הציפה האדומה. הסמן B220 מתייג תאים B ומדגיש את זקיקי התא B המקיפים את אזור התא T. הסמן CD169 מתייג מקרופאגים באזור השולי, סביב עיסת הלבן (איור 1). רוב התאים OTI, בין אם הם מבטאים IFNγ או לא, נמצאים הזולה הלבנה וככזה, כל התמונות הם אלה של עיסת לבן, אלא אם צוין.
צעד קריטי אחד בפרוטוקול זה הוא השימוש ב-BFA כדי לעכב הפרשת ציטוקין. אכן, זיהוי של IFNγ על ידי התאים NK היה לקוי מאוד כאשר העכברים לא טופלו BFA (איור 2). באמצעות הפרוטוקול שלנו, יכולנו לגלות כי לפחות שני סוגי תאים לייצר IFNγ 24 h לאחר ההדבקה-תאים NK ו-אנטיגן ספציפי CD8+ T תאים (איור 3) — בדומה למה שנמצא בעבר על ידי הזרימה cy, try3.
באתרו הדמיה של IFNγ לייצר תאים חשף כי הייצור IFNγ אינו מתפשט ברחבי הטחול, אבל מרוכז לאזורים דיסקרטי (איור 4). אכן, מצאנו כי תאי T הופעלו בכל הטחול (מודגש על ידי באשכולות תא T), וזה לא בהכרח לתאם עם ייצור IFNγ. הסבר אחד סביר הוא כי ייצור IFNγ מוגבל למיקום של תאים נגועים15,16, ו-T הפעלת תא-מיוצגת על-ידי קיבוץ באשכולות — ניתן לתמוך על-ידי שניהם נגועים (IFNγ חיובי) ולא נגוע (IFNγ שלילי) אנטיגן המציג תאים. כתמים אחרים יידרש לאתר את המיקום המדויק ולקבל אינדיקציה למנגנון הגבלת ייצור IFNγ לאזור זה ואת הקשר שלה להעברת אנטיגן. מעניין, מצאנו כי מופעל, באשכולות, אנטיגן ספציפיים תאי T ממוקמים לאורך העיסה הלבנה של הטחול אבל הם מייצרים IFNγ רק באזורים שבהם תאי NK הם מקוקיים עם אותם (איור 5). ככזה, הנוכחות של תאים NK מתארת מיקרוסביבה ספציפית בעיסת הלבן, שבו באשכולות תאי T לייצר IFNγ לעומת תאים T באשכולות בחלק השני של העיסה הלבנה. זה מרמז כי T הפעלה תא אינו מספיק כדי להכתיב ייצור IFNγ בשלב זה זמן.
תכונה מעניינת נוספת מודגשת על ידי הפרוטוקול שלנו היא לוקליזציה sub-סלולריים שונים של IFNγ ב NK לעומת CD8+ T תאים5. כפי שמוצג באיור 6, בעוד IFNγ לוקליזציה בתאי NK הוא פיזור ב ציטוסול, CD8+ T תאים לעתים קרובות לגייס IFNγ לעבר תא T אחר.

איור 1: סמנים המדגיש את ארכיטקטורת הטחול. עכברים נדבקו 2 x 104 CFU LM-OVA ו מורדמים 24 h לאחר זיהום. הטחול היה הסבר ועיבד כפי שמתואר בפרוטוקול. (א) מקטעים היו מוכתמים תאים NK (ANTI-NCR1 ואחריו האנטי עז IGG-fitc; ירוק), OTI-rfp תאים (אדום) ו מקרופאגים (Anti-F4/80-APC; מגנטה). RP = עיסת אדום; WP = לבן עיסת. סרגל בקנה מידה = 200 μm. (ב) סעיפים היו מוכתמים עבור תאי B (Anti-B220-פסיפיק כחול; כחול), OTI-GFP תאים (האות GFP המוצג אדום) ו מקרופאגים אזור שוליים (anti-CD169-Alexa647; מגנטה). RP = עיסת אדום; BF = B תא זקיק; TZ = T אזור התא. סרגל קנה מידה = 50 μm. זוהי תמונה ייצוגית של 3 ניסויים עצמאיים (N = 4). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
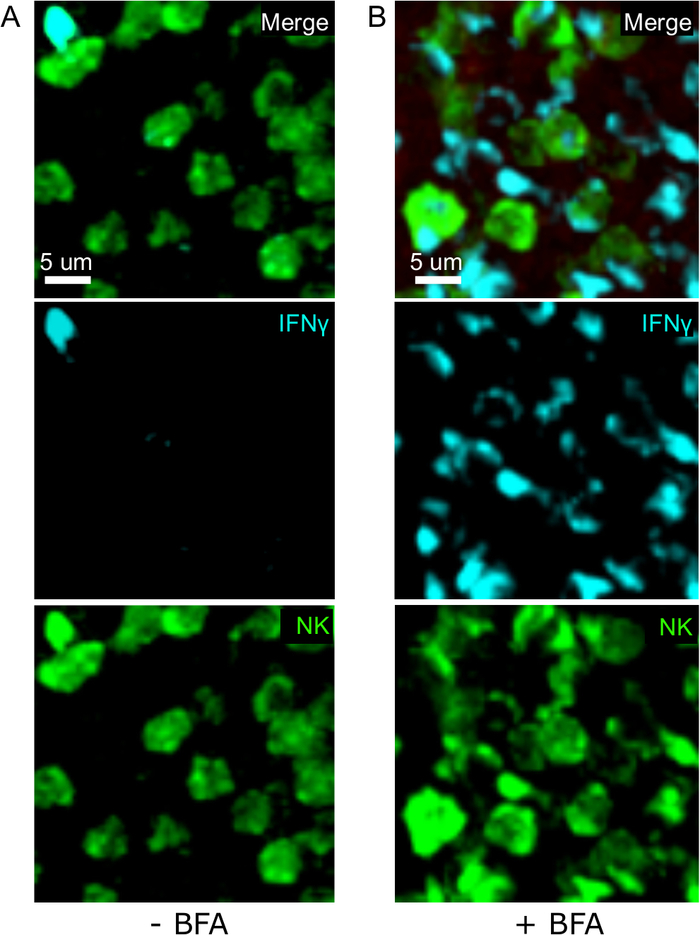
איור 2: הטיפול BFA מאפשר זיהוי של IFNγ תאיים באתרו. הייצור Nγ מוגבל לאזורים ספציפיים בעכברים sple נדבקו 2 x 104 CFU LM-OVA וטיפל ב-Bfa (א) או שמאל מטופל (ב) לאחר 18 h. עכברים הורדמים 24 לכתוב זיהום. הטחול היה הסבר ועיבד כפי שמתואר בפרוטוקול. מקטעים היו מוכתמים בתאי NK (anti-NCR1 ואחריו האנטי-עז IgG-FITC; ירוק), התאים OTI-RFP (אדום) ו-IFNγ (anti-IFNγ-BV421; ציאן). סרגל קנה מידה = 5 μm. זוהי תמונה ייצוגית של האזורים העשירים בתאי NK מ -3 ניסויים עצמאיים (N = 3). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
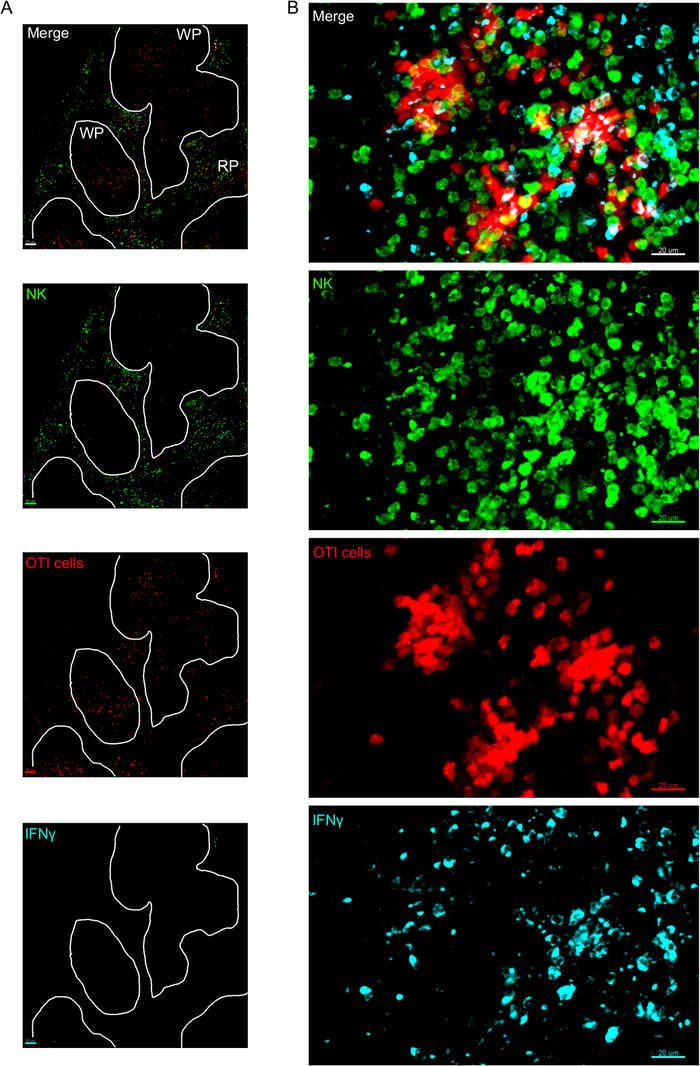
איור 3: IFNγ לייצר תאים בטחול. עכברים נדבקו 2 x 104 CFU LM-OVA כאשר המצוין וטיפל ב-bfa לאחר 18 h. עכברים מורדמים 24 הודעה לאחר הידבקות. הטחול היה הסבר ועיבד כפי שמתואר בפרוטוקול. מקטעים היו מוכתמים בתאי NK (anti-NCR1 ואחריו האנטי-עז IgG-FITC; ירוק), התאים OTI-RFP (אדום) ו-IFNγ (anti-IFNγ-BV421; ציאן). (א) דמות מייצגת של טחול מעכבר נאיבי בלתי נגוע כדי להדגים היעדרות של IFNγ לא ספציפי כתמים. הקווים הלבנים מתידקים. את העיסה הלבנה WP = לבן עיסת; RP = ציפה אדומה. (ב) הדמות הנציגה של עיסת לבן מן הטחול של העכבר נגוע על ידי LM-OVA, מראה פלישה של תאים nk כדי עיסת והפקה לבנה של IFNγ ידי תאים nk, תאי oti ותאים שאינם מתויג. תמונות מייצגות 4 ניסויים עצמאיים (N = 4). קנה מידה של סרגלים = 70 יקרומטר (A); ו -20 יקרומטר (ב). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
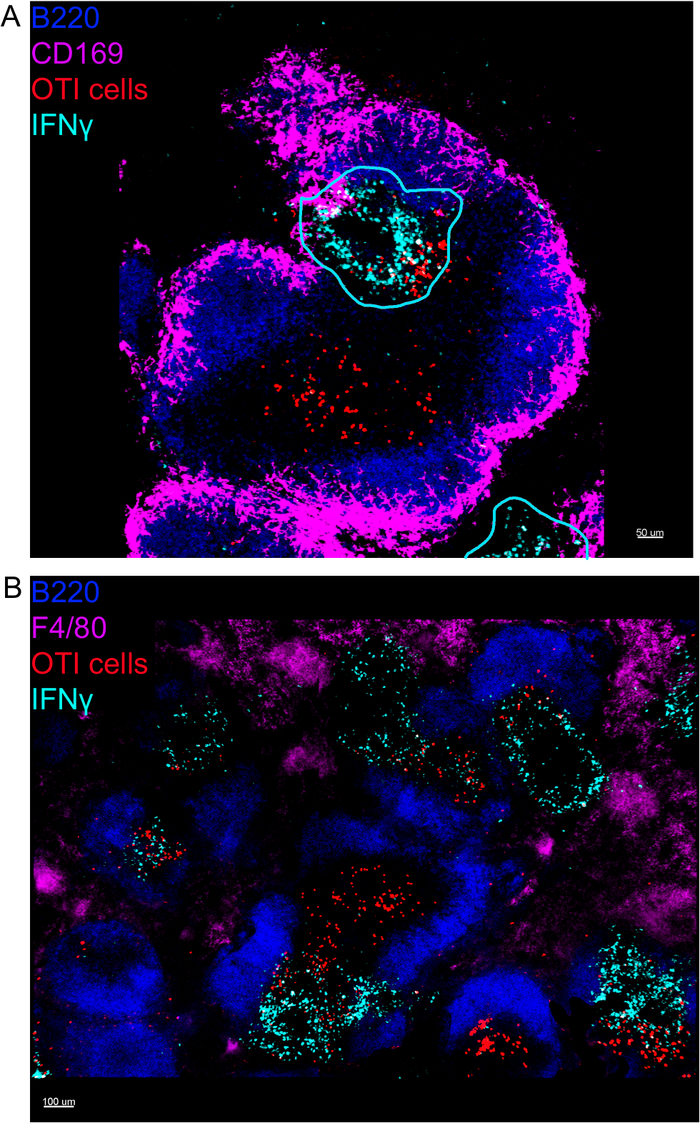
איור 4: IFNγ הייצור מוגבל לאזורים ספציפיים בטחול לאחר הידבקות LM-OVA. עכברים נדבקו 2 x 104 CFU LM-OVA וטופלו bfa לאחר 18 h. עכברים מורדמים 24 לאחר ההדבקה. הטחול היה הסבר ועיבד כפי שמתואר בפרוטוקול. כל המקטעים היו מוכתמים עבור תאים B (B220-פסיפיק כחול Ab, כחול) ו IFNγ (אנטי IFNγ-biotin ואחריו streptavidin-PE; ציאן). תאי OTI-GFP (אות GFP המוצג באדום). קווים ציאן מתאימים לאזורים של ייצור IFNγ גבוה. אלה תמונות מייצגות של 4 ניסויים עצמאיים (N = 4). (א) מקטעים היו מוכתמות עבור מקרופאגים באזור השולי (ANTI-CD169-אלקסה 647, מגנטה). סרגל בקנה מידה = 50 μm. (ב) מקטעים היו מוכתמים עבור כל מקרופאגים (F4/80). סרגל קנה מידה = 100 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
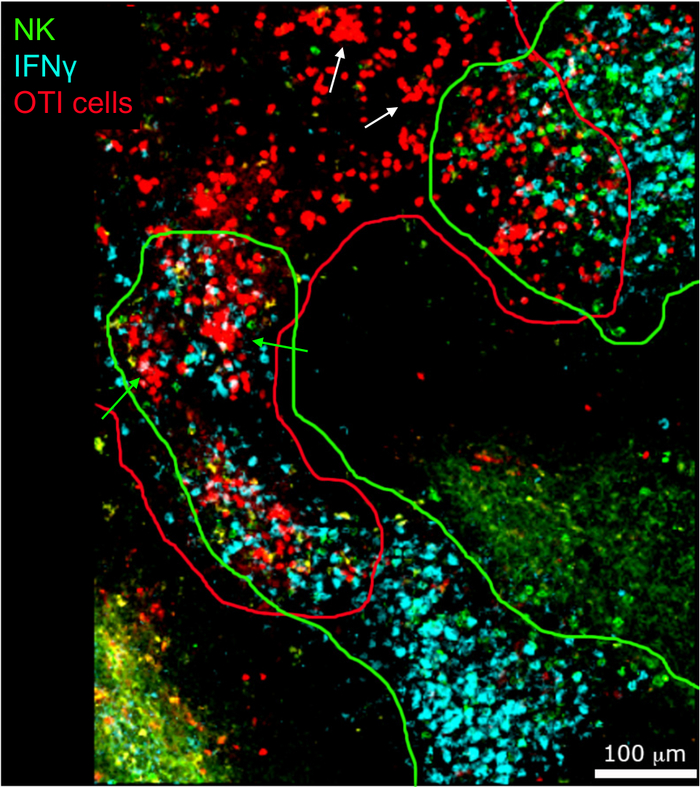
איור 5: IFNγ הייצור על ידי תאי OTI מופעל מתרחשת מיקרוסביבה מסוימת. עכברים נדבקו 2 x 104 CFU LM-OVA וטופלו bfa לאחר 18 h. עכברים מורדמים 24 לאחר ההדבקה. Spleens היו הסבר ועיבד כפי שמתואר בפרוטוקול. מקטעים היו מוכתמים בתאי NK (anti-NCR1 ואחריו האנטי-עז IgG-FITC; ירוק), התאים OTI-RFP (אדום) ו-IFNγ (anti-IFNγ-BV421; ציאן). קווים ירוקים ואדומים מדגישים את האזורים של תא NK ו-OTI, בהתאמה. חץ לבן מציין דוגמאות של אשכולות תא T שאינם מייצרים IFNγ. חיצים ירוקים דוגמאות של אשכולות תא T להפקת IFNγ. סרגל קנה מידה = 100 μm. זוהי תמונה ייצוגית של ארבעה ניסויים עצמאיים (N = 4). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
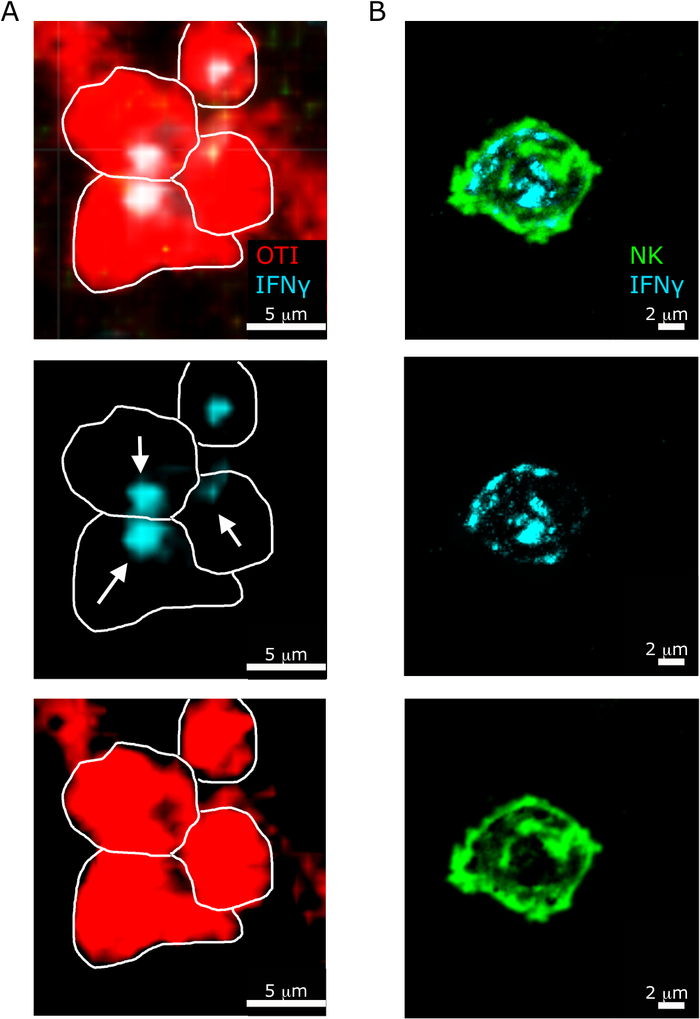
איור 6: לוקליזציה תת-תאית של IFNγ בתאי NK ובתאי T. עכברים נדבקו 2 x 104 CFU LM-OVA וטופלו bfa לאחר 18 h. עכברים מורדמים 24 לאחר ההדבקה. הטחול היה הסבר ועיבד כפי שמתואר בפרוטוקול. כל המקטעים היו מוכתמים עבור IFNγ (anti-IFNγ-BV421; ציאן). קווים לבנים להתוות קצוות תאים וחצים לבנים מראה כיוון הפרשה. זוהי תמונה ייצוגית של שני ניסויים עצמאיים (N = 5). (א)-OTI-rfp תאים מוצגים באדום. סרגל בקנה מידה = 5 μm. (ב) סעיפים היו מוכתמים בתאי NK (ANTI-NCR1 ואחריו igg-האנטי עז-fitc; ירוק. סרגל קנה מידה = 2 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
בכתב יד זה, אנו מציגים שיטה להמחיש IFNγ ייצור בטחול בעקבות זיהום L. חיידקי בעכברים. פרוטוקול זה הוא פשוט יכול להיות מותאם לרקמות אחרות מפעילים cy, אבל ההיבטים הבאים צריכים להיחשב. תאים לעתים קרובות מפרישות במהירות את ציטוקינים שהם מייצרים, ו ציטוקינים הם הרים במהירות על ידי תאים שכנים. זה כל כך קשה לזהות ציטוקינים באתרו. שיטה נפוצה ליזום מחדש במהירות הייצור cy, היא לגרות מחדש את התאים לשעבר vivo ואחריו הזיהוי ציטוקינים במדיה על ידי האנזים מקושר אנזימים המוכפופות. בהקשר זה, כל מידע על הלוקליזציה המרחבית של התאים המייצרים cytokine הוא איבד. בנוסף, ייצור cy, בעקבות גירוי מחדש לא בהכרח משקף אם ציטוקינים מיוצרים למעשה מופרש ב vivo, אלא מציין את הקיבולת של אוכלוסיית התאים נתון לייצר ציטוקינים. לכן, שתי השיטות יספקו מידע שונה והאדם צריך לשקול איזה מידע הוא בעל ערך רב לניסוי שלהם.
על מנת לזהות ציטוקינים תאיים, השיטה שלנו משתמשת הובלה חלבון תאיים מעכב למלכודות ציטוקינים בתוך התאים ולהגדיל את זיהוי האותות. עם זאת, חשוב לציין כי מעכבי אלה משפיעים על התעבורה הרגילה של חלבונים מרשת האנדותל (RE) למנגנון Golgi ולתוך שלפוחית הסוד הפוגעת בשחרורם, דבר שעלול לגרום לרעילות. כתוצאה מכך, BFA, או מעכב אחר, יש להשתמש לפרק זמן קצר, בדרך כלל לא יותר מכמה שעות. מכאן, חשוב למצוא את האיזון הנכון בין המינון המדכא ואת זמן הטיפול כדי לייעל את רמת ציטוקינים לכודים בתוך התא מבלי לגרום להשפעות חמורות ציטוטוקסינים. משתנים אלה יכולים להיות שונים בין ציטוקינים לבין תוואי המינהל של BFA. במודל הזיהום שלנו, BFA היה בניהול intraperitoneally על מנת לספק פיזור מערכתי מהיר, אבל זה יכול להיות גם מועברת באופן פנימי.
מעכבי התחבורה הנפוצים ביותר בשימוש בחלבון תאיים הם BFA, המשמשים כאן, ו-monensin (MN). מעכבי אלה משמשים לעתים קרובות לצבור וללמוד הייצור cy, אבל יש להם הבדלים קלים במנגנון הפעולה שלהם. MN מעכב הובלה של חלבונים בתוך מנגנון Golgi ולכן צבירת חלבונים ב-Golgi17 בעוד bfa מונע מורכבות חלבון coatomer-I גיוס, מעכב את התנועה נסיגה של חלבונים כדי הרשתית העין (ER) ובכך לקדם הצטברות של ציטוקינים במיון18. ככזה, בחירת מעכב התחבורה הטובה ביותר של חלבון תאיים יהיה תלוי בגורמים שונים, כגון cy, כדי להתגלות. למשל, זה הוצג ליפופוליסכד המושרה מכתים תאיים של מונוציטים כי BFA יעיל יותר למדוד את ציטוקינים IL-1β, IL-6 ו-TNF מאשר MN19.
פרוטוקול זה כרוך ויזואליזציה של cy, באתרו על ידי מיקרוסקופ קונפוקלית וקד, ולכן יש רק מספר מוגבל של סמנים מאשר ניתן להשתמש כדי ללמוד את cy, הפקת תאים ומיקרו הסביבה שלהם. יש צורך גם לשקול כי מעכבי הובלה חלבונים כגון BFA או MN להפריע הביטוי הרגיל של חלבונים מספר ומכאן השימוש שלהם כאשר לימוד ביטוי סימולטני של סמנים מסוימים משטח ההפעלה תא יש להתקרב בזהירות. לדוגמה, BFA אך לא MN חוסם את הביטוי של CD69 בלימפוציטים מורטין20. למרות מגבלה זו, הדמיה מוקד מאפשר לוקליזציה תת-תאית של ציטוקינים, כמו גם את הכיוון של הפרשת ציטוקין בתוך התא. הנתונים שנוצרו באמצעות פרוטוקול זה מראים כי תאי NK נוטים להפריש IFN-y בתבנית מפוזר בעוד CD8+ t תאים נראה להפנות את הפרשת IFNγ לעבר CD8 ותאי t אחרים הנמצאים באינטראקציה ישירה עם אותם5.
כדי להסיק, פרוטוקול זה מתאים להמחיש מגוון של ציטוקינים באתרו ולזהות הפקת תאים שלהם מיקרוסביבה בעקבות גורמים רבים כגון זיהום או חסינות עצמית. המידע המתקבל הוא אינסטרומנטלי כדי להבין את החשיבות של vivo מרחבית תזמור של סוגי תאים שונים הציטוקין שהם מייצרים, הכרחי לתגובה חיסונית יעילה.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מודים לאנשי המרכז לדימות ממכון קנדי לקבלת סיוע טכני בהדמיה. עבודה זו תמכה במענקים מקרן קנדי (לתובע הכללי), ובמועצה למחקר ביוטכנולוגיה ומדעי הביולוגיה (BB/R015651/1 לתובע הכללי).
Materials
| Name | Company | Catalog Number | Comments |
| Brefeldin A | Cambridge bioscience | CAY11861 | |
| Paraformaldehyde | Agar scientific | R1018 | |
| L-Lysin dihydrochloride | Sigma lifescience | L5751 | |
| Sodium meta-periodate | Thermo Scientific | 20504 | |
| D(+)-saccharose | VWR Chemicals | 27480.294 | |
| Precision wipes paper Kimtech science | Kimberly-Clark Professional | 75512 | |
| O.C.T. compound, mounting medium for cryotomy | VWR Chemicals | 361603E | |
| Fc block, purified anti-mouse CD16/32, clone 93 | Biolegend | 101302 | Antibody clone and Concentration used: 2.5 mg/ml |
| Microscope slides - Superfrost Plus | VWR Chemicals | 631-0108 | |
| anti-CD169 - AF647 | Biolegend | 142407 | Antibody clone and Concentration used: clone 3D6.112 1.6 mg/ml Excitation wavelength: 650 Emission wavelength: 65 |
| anti-F4/80 - APC | Biolegend | 123115 | Antibody clone and Concentration used: clone BM8 2.5 mg/ml Excitation wavelength: 650 Emission wavelength: 660 |
| anti-B220 - PB | Biolegend | 103230 | Antibody clone and Concentration used: clone RA3-6B2 1.6 mg/mL Excitation wavelength: 410 Emission wavelength: 455 |
| anti-IFNg - biotin | Biolegend | 505804 | Antibody clone and Concentration used: clone XMG1.2 5 mg/mL |
| anti-IFNg - BV421 | Biolegend | 505829 | Antibody clone and Concentration used: clone XMG1.2 5 mg/mL Excitation wavelength: 405 Emission wavelength: 436 |
| anti-Nkp46/NCRI | R&D Systems | AF2225 | Antibody clone and Concentration used: goat 2.5 mg/mL |
| anti-goat IgG-FITC | Novusbio | NPp 1-74814 | Antibody clone and Concentration used: 1 mg/mL Excitation wavelength: 490 Emission wavelength: 525 |
| Streptavidin - PE | Biolegend | 405203 | Antibody clone and Concentration used: 2.5 mg/mL Excitation wavelength: 565 Emission wavelength: 578 |
| Streptavidin - FITC | Biolegend | 405201 | Antibody clone and Concentration used: 2.5 mg/mlL Excitation wavelength: 490 Emission wavelength: 525 |
| Fluoromount G | SouthernBiotech | 0100-01 | |
| Cover glasses 22 mm x 40 mm | Menzel-Glazer | 12352128 | |
| Liquid blocker super PAP PEN mini | Axxora | CAC-DAI-PAP-S-M | |
| Imaris - Microscopy Image Analysis Software | Bitplane | ||
| Confocal microscope - Olympus FV1200 Laser scanning microscope | Olympus | ||
| Cryostat - CM 1900 UV | Leica | ||
| Base mould disposable | Fisher Scientific UK Ltd | 11670990 | |
| PBS 1x | Life Technologies Ltd | 20012068 | |
| BHI Broth | VWR Brand | 303415ZA | |
| GFP | Excitation wavelength: 484 Emission wavelength: 507 | ||
| RFP | Excitation wavelength: 558 Emission wavelength: 583 | ||
| Insulin syringe, with needle, 29 G | VWR International | BDAM324824 | |
| C57BL/6 wild type mice | Charles River |
References
- Iwasaki, A., Medzhitov, R. Control of adaptive immunity by the innate immune system. Nature Immunology. 16 (4), 343-353 (2015).
- Harty, J. T., Bevan, M. J. Specific immunity to Listeria monocytogenes in the absence of IFN gamma. Immunity. 3 (1), 109-117 (1995).
- Kubota, K., Kadoya, Y. Innate IFN-gamma-producing cells in the spleen of mice early after Listeria monocytogenes infection: importance of microenvironment of the cells involved in the production of innate IFN-gamma. Frontiers in Immunology. 2 (26), (2011).
- Dunn, P. L., North, R. J. Early gamma interferon production by natural killer cells is important in defense against murine listeriosis. Infection and Immunity. 59 (9), 2892-2900 (1991).
- Krummel, M. F., et al. Paracrine costimulation of IFN-gamma signaling by integrins modulates CD8+ T cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 115 (45), 11585-11590 (2018).
- Curtsinger, J. M., Agarwal, P., Lins, D. C., Mescher, M. F. Autocrine IFN-gamma promotes naive CD8+ T cell differentiation and synergizes with IFN-alpha to stimulate strong function. Journal of Immunology. 189 (2), 659-668 (2012).
- Hosking, M. P., Flynn, C. T., Whitton, J. L. Antigen-specific naive CD8++ T cells produce a single pulse of IFN-gamma in vivo within hours of infection, but without antiviral effect. Journal of Immunology. 193 (4), 1873-1885 (2014).
- Croxford, A. L., Buch, T. Cytokine reporter mice in immunological research: perspectives and lessons learned. Immunology. 132 (1), 1-8 (2011).
- Gerard, A., et al. Secondary T cell-T cell synaptic interactions drive the differentiation of protective CD8++ T cells. Nature Immunology. 14 (4), 356-363 (2013).
- Engelhardt, J. J., et al. Marginating dendritic cells of the tumor microenvironment cross-present tumor antigens and stably engage tumor-specific T cells. Cancer Cell. 21 (3), 402-417 (2012).
- Matheu, M. P., Cahalan, M. D. Isolation of CD4+ T cells from mouse lymph nodes using Miltenyi MACS purification. Journal of Visualized Experiments. (9), 409 (2007).
- Matheu, M. P., Parker, I., Cahalan, M. D. Dissection and 2-photon imaging of peripheral lymph nodes in mice. Journal of Visualized Experiments. (7), 265 (2007).
- Pope, C., et al. Organ-specific regulation of the CD8+ T cell response to Listeria monocytogenes infection. Journal of Immunology. 166 (5), 3402-3409 (2001).
- Jones, G. S., D'Orazio, S. E. Listeria monocytogenes: cultivation and laboratory maintenance. Current Protocols in Microbiology. 31, 1-7 (2013).
- Kang, S. J., Liang, H. E., Reizis, B., Locksley, R. M. Regulation of hierarchical clustering and activation of innate immune cells by dendritic cells. Immunity. 29 (5), 819-833 (2008).
- Chang, S. R., et al. Characterization of early gamma interferon (IFN-gamma) expression during murine listeriosis: identification of NK1.1+ CD11c+ cells as the primary IFN-gamma-expressing cells. Infection and Immunity. 75 (3), 1167-1176 (2007).
- Mollenhauer, H. H., Morre, D. J., Rowe, L. D. Alteration of intracellular traffic by monensin; mechanism, specificity and relationship to toxicity. Biochimica et Biophysica Acta. 1031 (2), 225-246 (1990).
- Helms, J. B., Rothman, J. E. Inhibition by brefeldin A of a Golgi membrane enzyme that catalyses exchange of guanine nucleotide bound to ARF. Nature. 360 (6402), 352-354 (1992).
- Schuerwegh, A. J., Stevens, W. J., Bridts, C. H., De Clerck, L. S. Evaluation of monensin and brefeldin A for flow cytometric determination of interleukin-1 beta, interleukin-6, and tumor necrosis factor-alpha in monocytes. Cytometry. 46 (3), 172-176 (2001).
- Nylander, S., Kalies, I. Brefeldin A, but not monensin, completely blocks CD69 expression on mouse lymphocytes: efficacy of inhibitors of protein secretion in protocols for intracellular cytokine staining by flow cytometry. Journal of Immunology Methods. 224 (1-2), 69-76 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved