A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הזרקת דנ א לתוך eyebuds ב xenopus זריזה העוברים והדמיה של gfp המבטא האופטי axonal הביע בשלמותו, חי xenopus tadpoles
In This Article
Summary
פרוטוקול זה נועד להדגים כיצד להחדיר מיקרוקל DNA/dotap תערובת לתוך eyebuds של יום אחד xenopus זריזה העוברים, וכיצד התמונה ולשחזר חלבון פלורסנט בודדים ירוק (gfp) המבטא האופטית סיבי סוכת ב tectal מידות של . שלמים וחיים של קסנופוס
Abstract
ההקרנה החזותית העיקרית של טתרנים של הצפרדע הימית xenopus זריזה משמש מערכת מודל מעולה למחקר מנגנונים המסדירים את ההתפתחות של קישוריות עצבית. במהלך הקמתה של ההקרנה retino-tectal, מרחיבים אופטיים להאריך מן העין ולנווט באזורים שונים של המוח כדי להגיע רקמת היעד שלהם, tectal אופטי. לאחר אקסונים אופטיים להיכנס tectum, הם מורכבים סוכת הטרמינל כי הפונקציה להגדיל את מספר הקשרים סינפטית הם יכולים לעשות עם היעד interneurons ב tectum. כאן, אנו מתארים שיטה לבטא קידוד ה-DNA חלבון פלורסנט ירוק (GFP), ו-להשיג ואובדן של פונקציה מבנים גנים, ב נוירונים אופטיים (בתאי גנגליון הרשתית) ב העוברים Xenopus . אנו מסבירים כיצד להחדיר מיקרו DNA/ליפופיהזיהום מגיב לתוך eyebuds של עוברים הישן יום אחד כגון גנים אקסוגני מבוטא במספר יחיד או קטן של נוירונים אופטיים. על-ידי תיוג גנים עם gfp או שיתוף הזרקת עם gfp פלאבאמצע, הטרמינל סיבי סוכת של נוירונים בודדים אופטיים עם איתות מולקולרי שונה ניתן לדימות ישירות במוח של שלמים, חי xenopus ראשנים מספר ימים לאחר מכן, ואת מורפולוגיה שלהם ניתן לכמת. פרוטוקול זה מאפשר לקבוע את המנגנון המולקולרי האוטונומי התאי הנמצא בתוך הvivo.
Introduction
במהלך הפיתוח של מערכת העצבים, אקסונים של נוירונים טרום סינפטיות לנווט באזורים שונים של המוח כדי להגיע לאזורי היעד שלהם. כאשר אקסונים לפלוש רקמות היעד שלהם, הם לבסס קשרים סינפטית עם היעד הפוסט נוירונים. בסוגים רבים של נוירונים, אקסונים להגדיל את המספר ואת ההיקף המרחבי של חיבורי סינפטית הם יכולים לעשות על ידי הגברת רשתות של סניפי מסופים או סוכת1. ההקרנה retino-tectal של טתרנים של הצפרדע הימית xenopus זריזה הוא מודל בעלי חוליות רב עוצמה עבור בדיקת מנגנונים בבסיס מסוף אקסון arborization קישוריות סינפטית2,3,4 . בודדים gfp ביטוי סוכת אופטיים עם איתות מולקולרי נורמלי ושונה ניתן לצפות ישירות בתוך שלמים, חי xenopus ראשנים5,6,7,8. כדי לבטא GFP בלבד או ביחד עם גירסאות באורך מלא או מקוצר של גנים במספר קטן של נוירונים אופטיים, אנו משתמשים בטכניקה הכוללת מיקרוהזרקה/ליפופישל דנ א לתוך eyebuds של עוברי יום אחד עוברים9, 10. טכניקה זו פותחה במקור כדי לחקור מנגנונים של אקסון האופטי מציאת הצעיר xenopus tadpoles, והוא כבר הוחל על ידינו ואחרים כדי לקבוע מנגנונים מולקולריים סלולריים בבסיס האקסון האופטי , הארבוריזציה בקספוס העמודים5,6,7,8,9,10
טכניקות חלופיות כדי לבטא גנים אקסוגני במספר קטן של נוירונים אופטיים פותחו במינים מודל אחרים, כמו גם ב -X זריזה. עם זאת, כל אחת מגישות אלה מציגה אתגרים ומגבלות בהשוואה למיקרו הזרקת דנ א/ליפופישל מגיב בeyebuds של עוברי קסנפוס . בעכברים, הטרנסגנזה יכולה לשמש כדי לבטא גנים במספר קטן של נוירונים אופטיים, אבל הדור של עכברים טרנסגניים הוא יקר, עכברים הזמן לארוך ולעתים קרובות להציג עם תופעות לוואי לא רצויות11. בנוסף ניתן ליצור על ידי הזרקת פלסטלינה לתוך השלב המוקדםשל עוברימחשוף בעלי הצבע האופטי בנוירונים. עם זאת, תהליך זה דורש שיבוט של מיזם מסוים כדי לבטא גנים בתבנית פסיפס בנוירונים אופטיים בזחלים של דג הרימות12. תדירות הביטוי של דנ א אקסוגני בנוירונים אופטיים ב-דג זברה הוא גם נמוך במקצת (< 30%) שהיו מוזרקים באמצעות מגיב DNA/ליפוזומלי (30-60%) בשנת אלקטרופורציה שימש גם לבטא גנים במספר קטן של נוירונים אופטיים באפרוחים13. עם זאת, הליך זה נכשל באפיון מלא של מנגנונים הקובעים הקרנות אופטיות, מכיוון שאין אפשרות ליצור תמונה של מנגנוני הראייה האופטיים ללא שינוי, עוברים בחורות חיות. בסופו של דבר, מספר מעבדות השתמשו באלקטרופורציה לגנים שונים למספר קטן של נוירונים אופטיים בקספוס טתרנים14,15. עם זאת, האלקטרופורציה דורשת אופטימיזציה של ציוד ופרוטוקולים (מלקחיים, אלקטרודות, דפוסים מרחביים ומרחבי של פולסים בגלי גל) מעבר לכך ששימשו להזרקות של דנ א/ליפופיציה מגיב לעיניים של עוברי קספוס .
אנחנו ואחרים בעבר השתמשנו בטכניקה של מיקרוהזרקה/ליפושל ה-DNA לתוך eyebuds של עוברי xenopus כדי לקבוע מנגנוני איתות אוטונומי האוטונומית הקמת אקסון אופטי5,6, מיכל סבן , 8. בתחילה השתמשנו בגישה זו כדי לנתח את הפונקציות של מתאם הקדהרין ו-wnt חלבון β-catenin בארבוריזציה אופטיתב- xenopus ראשנים עמודים 5,6. במחקר אחד, הראנו כי β-catenin קשירה ל α-catenin ו pdz נדרש, בהתאמה, עבור ייזום ועיצוב סוכת אופטיים בvivo5. בדו ח השני, הדגמנו כי התחומים β-catenin קשירה עבור α-catenin ו GSK-3β הקרנה לווסת את דפוסי ההקרנה של הפלבטים אופטיים הגחותיים6. לאחרונה, זיהינו תפקידים לגורם wnt, מאפייני פוליפוזיס coli (APC), בוויסות תכונות מורפולוגיות של סוכת אופטיים בתוך xenopus ראשנים7. על ידי שיתוף הביטוי את N-terminal ואת התחומים המרכזיים של APC לווסת יציבות β-catenin וארגון מיקרוכדורית יחד עם GFP בנוירונים בודדים אופטיים, החלטנו תפקידים משותפים וייחודיים עבור אלה תחומים האינטראקציה APC על מספר הסניף, אורך, וזווית בתוך סוכת אופטיים ב vivo7. מעבדה נוספת השתמשה בטכניקת המיקרוהזרקה/ליפוחות כדי לקבוע את תפקידי האוטונומית של התא עבור איתות על-ידי קולטן bdnf, trkb, ב-סיבי אופטיים ב- xenopus ראשנים8. קבוצה זו הראתה כי הביטוי של הסתעפות מודאג שלילי-TrkB המוני והתבגרות סינפטית בתוך האקסון האופטי הבודד ב vivo8. באופן כללי, טכניקת הליפיפוס ב- Xenopus כבר הרחיבה את התפקידים הספציפיים של גנים שונים בעלת הסתעפות אופטית בסביבה הטבעית.
Protocol
כל השיטות המתוארות כאן אושרו על ידי הוועדה לטיפול בבעלי חיים מוסדיים (IACUC) של אוניברסיטת טורו קליפורניה (פרוטוקול TUCA003TE01X).
1. השגת X. זריזה עוברים
- השג X. זריזה העוברים על ידי ההזדווגות הטבעית של זוגות של זכר ונקבה צפרדעים מבוגרים מוכן גונדוטרופין כוריוני אנושי (HCG), על ידי הפריה חוץ גופית של ביצים לשפוך מצפרדעים למבוגרים נקבה מוכן hcg, או על ידיהזמנת ישירות (השולחן של חומרים).
-
העוברים dejelly השיגו עם פתרון ציסטאין 2% בטמפרטורת החדר (לוח חומרים)16.
- איסוף 50-100 עוברים בצלחת פטרי גדולה. להסיר את הפתרון העוברים הם על ידי היין או שימוש בצנרת העברה פלסטיק. הוסף 25 מ ל של 2% ציסטאין פתרון (0.5 g ציסטאין ב 25 ml ddh2O, pH כדי 8.0) את המנה המכילה את העוברים.
- מערבולת עדינה את צלחת פטרי המכילה את העוברים בתמיסה הציסטאני עד שהמעילים של העוברים נופלים והעוברים אוספים בתוך גוש במרכז המנה (5-10 דקות). בשלב זה, לאט ובעדינות לשפוך את הפתרון ציסטאין לתוך גביע פסולת. לדאוג לא לשפוך רבים מדי העוברים בגביע הפסולת יחד עם פתרון ציסטאין.
- שטפו את העוברים בצלחת פטרי 6x עם 10% הפתרון הצלצול של מארק (MMR) או פתרון מתאים אחרים (למשל, שונה של Barth פתרון, MBS), מתערבל את הצלחת בכל פעם הפתרון מוחלף.
- תרבות העוברים ב -10% MMR עד שהם מגיעים לשלבים התפתחותיים 22 עד 2417. עוברים מודפוס בטמפרטורה בין 15 ל -25 ° c. שיעור ההתפתחות של העוברים תלוי בטמפרטורה שהם מודבטים ב-17.
הערה: העוברים מקטלוג בדרך כלל מגיעים למעבדה בשלבים התפתחותיים 20-24, כך שהם יכולים להיות מדוכא ומוזריקו מייד.
2. הכנת ה-DNA פלמידים ועשיית DNA/DOTAP תערובת
- ביטוי ה-DNA של שיבוט משנה מבנה לתוך xenopus ביטוי וקטורים pCS2 + או pCS2 + MT או נגזרים מהם (במקור נבנה על ידי ד. טרנר ו ר. ראפ)5,6,7. pCS2 + וקטורים מכילים cytomegalovirus שונה (CMV) יזם המסייע הביטוי גנים צפרדעים.
- להגביר את הpCS2 פלמידים המכילים GFP ו/או גנים של עניין עם ערכות miniprep (טבלת חומרים) בעקבות ההליך הסטנדרטי. בשלב הסופי של הפרוטוקול miniprep, לבצע הימנעות רציפים של ה-DNA אל ddH2O כדי להניב ריכוז סופי של > 1 μg/μl.
- אחסן את כל pCS2 פלמידים ב-80 ° צ' עד מוכן לבצע ניסוי מיקרוהזרקה/ליפופה, כלומר, כאשר עוברים בשלבים התפתחותיים 22-24.
- להפשיר את הפלפידים של דנ א. בטמפרטורת החדר , מייד לפני הזיהום. הצנטריפוגה בקצרה דנ א זה ימנע את היווצרות בתערובת DNA/DOTAP שיכול לסתום את הקצה של הצינורות מיקרונימי.
- מערבבים דנ א עם ליפופיזומיום מגיב (לוח חומרים) ב 1:3 (w/v) יחס9,10. לדוגמה, להעביר 2 μg של ה-DNA לצינור מיקרוצנטריפוגה 1.5 mL ולהוסיף 6 μL של DOTAP, או להעביר 3 μg של DNA בשפופרת מיקרוצנטריפוגה ולהוסיף 9 μL של DOTAP.
- לאחר DNA ו-DOTAP משולבים, בעדינות קפיצי שפופרת מיקרוצנטריפוגה לערבב את הפתרון. ה-DNA/הפתרון DOTAP צריך להיות אטום מעט לאחר ערבוב.
- אם שני פלסטלינה הם ליפומי ביחד (למשל, pCS2-GFP עם השני pCS2 פלמיד המכיל גרסה מעוגלים או באורך מלא של גן) בנוירונים אופטיים, תחילה לשלב את שני הפלמידים (אחרי בקצרה תפרידו שניהם) ביחס 1:1, ולאחר מכן להוסיף DOTAP ב 1:3 (w/v) יחס. לדוגמה, לשלב 1 μg של pCS2-GFP עם 1 μg של השני pCS2 פלאמיד ולאחר מכן להוסיף 6 μL של DOTAP.
הערה: מחקרים הראו כי ליפופה של שני פלמידים לתוך העיניים של עוברי xenopus בשלבים ההתפתחותיים אלה תגרום לביטוי המשותף שלהם בנוירונים בודדים אופטיים9,10.
3. טעינת מחט מיקרוהזרקה עם דנ א/דוברז
- בעדינות לחתוך את הקצה של הצנרת מיקרוקפילר זכוכית משכה עם מלקחיים עדינים (שולחן חומרים).
- ממלאים את הצינורות המיקרוקפיליות בשמן מינרלי בעזרת מיקרופיל, כך שטיפה זעירה של שמן מינרלי מופיעה בקצה החתוך של המיקרופיפטה. מלאו את הפיפטה המיקרוקפילי בחצי הדרך עם שמן מינרלי.
- לטעון את הצנרת מיקרוקפילר זכוכית שנמשך כעת מלא שמן מינרלי לתוך מחזיק הזרקה מתאים מחובר מזרק. אם משתמשים במזרק (שולחן חומרים), הוצא את הבוכנה בחצי הדרך לפני טעינת הפיפטה המיקרונימים. לאחר שהפיפטה המיקרונימי מחובר היטב למזרק, הארך את הבוכנה במידה מלאה כדי לוודא שהפיפטה המיקרוקפילר מחובר בחוזקה למזרק ואינו זז עם התוספת של הבוכנה.
- העברת 3 μL שחרור של ה-DNA/DOTAP תערובת על ריבוע לחתוך (1 אינץ ' ריבוע) גיליון של נייר פרפין.
- מתחת למיקרוסקופ מנתח סטריאו, הזז את קצה הצנרת המיקרוקפילר בזכוכית לתוך ה-DNA/DOTAP.
- לאט למצוץ את ה-DNA/DOTAP ירידה לתוך הצינורות מיקרונימי זכוכית באמצעות אפשרות המילוי על מנגנון ההזרקה. כאשר הנוזל נטען לתוך הצנרת המיקרוקפילר, הירידה תהיה קטנה יותר. בשל אטימות קלה של ה-DNA/הפתרון DOTAP, את הגבול בין השמן המינרלים ואת ה-DNA/DOTAP הפתרון צריך להיות גלוי בתוך הצנרת מיקרוקפילר זכוכית (איור 1). במקרה הצורך, הפסיקו למלא את הפיפטה מדי פעם כדי לאפשר את הלחץ בצינורות המיקרוקפילר כדי לכייל מייל.
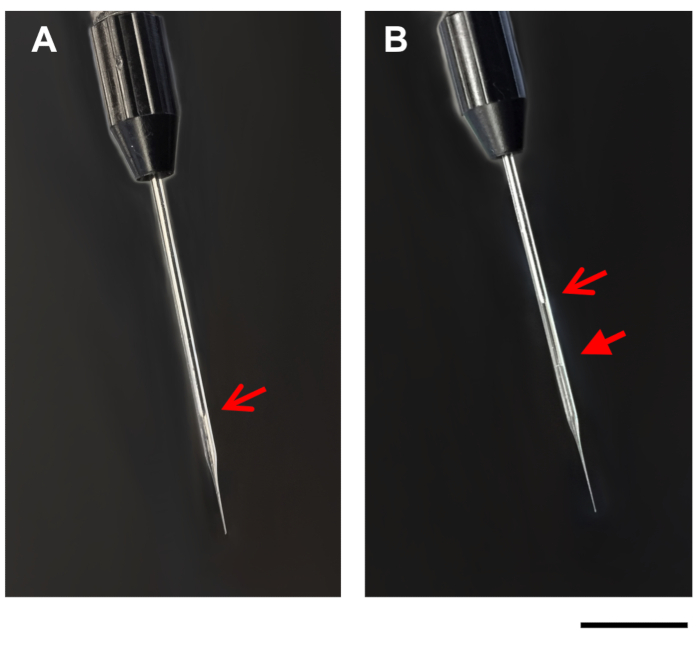
איור 1: תמונות של פיפטה מיקרונימי. התמונות מציגות פיפטה מיקרוקפילר על מנגנון ההזרקה, לפני (א), ואחרי (ב) מילוי עם דנ א/דוברז. חצים פתוחים, קצה הבוכנה בפיפטה המיקרונימי (A, B). חץ סגור, קו בין שמן מינרלי DNA/DOTAP בצינורות מיקרונימי ממולא (ב). סרגל בקנה מידה = 1 מ"מ. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. מיקרוזרקת DNA/DOTAP לתוך Eyebuds של יום 1 קסנפוס הישן
- הפעלה ידנית של 10 שלב 20 לאורך 24 העוברים עם מלקחיים עדינים בצלחת פטרי בגודל 10 מ"מ מלאה 0.1 x mmr. לתפוס את מעטפת vitelline על המותניים כדי למנוע פציעה העוברים. עם מלקחיים הן בידיים שמאל וימין של הנסניסה, פופ את הבועה של המעטפה vitelline ולשחרר את העובר מן המעטפה vitelline. לדאוג לא לפגוע העוברים בעת הסרת המעטפה vitelline.
הערה: החל משלב 20, העוברים מפתחים כניסה או ' מותניים ' בין החצאים הקדמי והאחורי של העובר. המותניים הללו מאפשרות לפער להיווצר בין מעטפת הווילין לבין העובר בתנוחה זו. - השתמש בפיפטה להעברת פלסטיק עם קצה לחתוך כדי להעביר 5-10 שלבים בשלב 22-24 העוברים לצלחת פטרי של 10 מ"מ מלאה ב-1x MMR.
הערה: פתרון מלח גבוה יותר ב-1x MMR מסייע לריפוי פצעי ניקוב שיגרמו להזרקות. - תחת הstereomicroscope, אחוז באחד מעוברי הדאיטאלליזציה בצלחת הפטרי עם מלקחיים בכל יד, וסדר את העובר כך שהעמוד הקדמי שלו מכוון בשדה הראייה. מכוון את העובר כך שהוא מונח באופן שמאלי ואחד העיניים שלו (ימין או שמאל) פונה כלפי מעלה.
- מתחת לstereomicroscope, החזיקו את העובר בעזרת הלקחיים בידו הלא-דומיננטית של הנסניסה, וכאשר ידו הדומיננטית של הנסנסיית מציגה את קצה מיקרוסקופ הזכוכית אל תוך העיניים (מהצד הגחוני או הצדדי, תלוי בחצי העובר כרגע מוזרק), ממש מתחת לאפידרמיס (איור 2). הכנס בין 70 עד 210 nL של פתרון ה-DNA/DOTAP. זה יכול להיעשות בפולסים מספר, תלוי בגודל של הדופק מזרק מוגדר (בדרך כלל 70 nL).
הערה: עומק ההזרקה חשוב מאוד לליפסתה לנוירונים אופטיים. אם המיקום של קצה המיקרונימי מוכנס היטב בצורה מאוד שטחית לתוך eyebud, ואז אחרי המיקרו הזרקה, את האפידרמיס האפור על גבי eyebud יהיה להתנפח. אם התנוחה עמוקה מדי, העיניים האפורות לא יראו שום שינויים, ותדירות הביטוי של הדנ א בנוירונים אופטיים תהיה נמוכה יותר. - הפוך את העובר סביב ולבצע את אותה מיקרוזריקה לתוך eyebud בצד המקביל של העובר.
- הכנס את שתי העיניים של 6-10 (או יותר) עוברים בכל ניסוי.
- לאחר המיקרו הזרקה, לאחסן עוברים בצלחת פטרי עם 1x MMR עבור כ 30 דקות כדי להקל על ריפוי הפצע.
- לאחר 30 דקות, העברת עוברים מוזרק לתוך פתרון 0.1 x MMR עם 0.001% הלבנת הסוכן (פנילתאיובםבמאמיד) כדי להפחית פיגמנטציה. תרבות העוברים המכוסים במשך כחמישה ימים, עד שהעוברים התפתחו לעמודים בשלבים 46-4716.
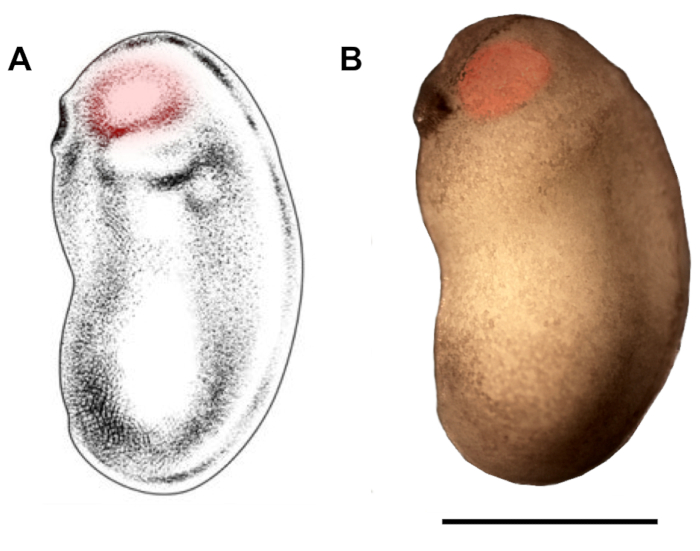
איור 2: תיחום אזור העיניים עבור מיקרוהזרקה. סכימטי (א) וphotomicrograph (ב) של X. זריזה העובר בשלבים התפתחותיים 22/23 להראות האזור eyebud כי צריך להיות מכוון מיקרו הזרקה (אדום מדגיש). סרגל קנה מידה = 1 מ"מ. פאנל A שונה מ-בר ואח '18. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
5. הדמיה של GFP ביטוי אופטי המבטא האופטיים ללא שינוי, חיים Tadpoles
הערה: כאשר העמודים שהיו מזוהמים בדגימת דנ א מגיעים לשלבים התפתחותיים 46-47, הם מוכנים להדמיה.
- , לפני ההדמיה. מוטות הראש חייבים להיות מורדם כדי להדלף את העמודים האלה, העבירו את המוטות ליפופיטרים בתמיסה של 0.02% tricaine ב-ddH2O בצלחת פטרי בגובה 10 מ"מ. המתן 5 עד 10 דקות עד שהעמודים יהיו משותק. לוודא כי המוטות הם עדיין בחיים על ידי התבוננות לבבות המכות שלהם תחת מיקרוסקופ מבתר סטריאו.
- לתוך תא סיליקון מותאם אישית. על מגלשת זכוכית וחותם עם שמיכות הראשן צריך להטות מעט את הראש כך שבצד אחד (ימין או שמאל) של ראשו בזווית כלפי מעלה ובקושי נוגע בשובר הכיסוי.
- הטקו את חצי המוח הטשני של הראשן המוטה כלפי מעלה בהגדלה נמוכה עבור המבטא האופטי של GFP.
הערה: שטח מיקרוסקופ זקוף מצויד בתאורה אפיפומית ועדשת אובייקטיבי האפורומטית (טבלת חומרים) ניתן להשתמש כדי לעבור על המסך עבור arbors פלורסנט. - אם חצי הכדור tectal מכיל בין אחד עד שלושה gfp המבטא האופטית סוכת, ללכוד z סדרה של תמונות של סוכת אלה באמצעות ניגודיות גבוהה 40 x אוויר מטרה העבודה במרחק זמן רב (טבלת חומרים). עבור כל אחד מהארבור, לכידת 10-20-עשרים פרוסות z-series במרווחי זמן של 1.5 יקרומטר.
- כדי לראות אקסון סוכת בצד השני של המוח tectal, טען מחדש את הראשן בתא הסיליקון, כך שהוא נוטה לצד השני וחותם עם שובר כיסוי. לאחר מכן חזור על שלבים 5.3 ו-5.4.
6. שחזור וקוונפיקציה של מורפולוגיה האופטית של ארבור
- בחר מחסנית תמונה המכילה בין אחד לשלושה מבני מוצרים בעלי מבטא GFP המבטא אופטי.
- השתמש בכלי ציור ביד חופשית בתוכנה לעריכת גרפיקה (טבלה של חומרים) כדי לעקוב אחר החלק של כל ארבור האקונאליות אופטית לעין בכל z-פרוסה. מעקב דרך פיסות של כל מובן ארבור בכל z-פרוסה תיצור הקרנה דו-ממדית מדויקת של הארבור. בצבעים שונים ניתן להשתמש כדי לעקוב אחר GFP מובחנת המבטא האופטית arbors.
- הפוך את כל המידות המורמטריות על שחזורים דו-ממדיים של ה-סיבי arbors, עם התייחסות לסדרת z המקורית של תמונות בעת הצורך7. באמצעות תוכנת Image J (טבלה של חומרים), למדוד פרמטרים מורפולוגיים כגון מספר סניפים (כלומר, מספר עצות הסניף או נקודות הסניף), סה כ הענף ארבור אורך, אורך לכל ענף, אורך ורוחב של ארבור, הצורה הכוללת של ארבור (L/W יחס, מעגליות) וזווית ענפים7.
תוצאות
הפרוטוקול המתואר במאמר זה מניב שיעור הצלחה של 30 ל-60% של מוזרקים העוברים ביטוי gfp (לבד או ביחד עם מבנים DNA נוספים) באחד עד עשר arbors אופטיים. באיור 3, אנו מציגים הנציג מיקוד תמונות של בקרת הביטוי gfp ו-מוטציה אופטיים מוטנטים בתוך שלמים של xenopus ראשנים מן המחקר שפורסם לאחרונ?...
Discussion
במאמר זה, אנו מדגימים כיצד לבטא במבנים DNA אקסוגני במספר יחיד או קטן של נוירונים אופטיים וכיצד התמונה בודדים gfp המבטא האופטית סוכת עם איתות רגיל ומשתנה מולקולרית בשלמותו, החיים ראשנים של הצפרדע X . . אני מבין. אנו גם מסבירים כיצד לשחזר ולכמת את המבנה של gfp המבטא האופטית סוכת מתמונות שנתפסו...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מודים Touro אוניברסיטת קליפורניה המכללה לרפואה אוסטאופתי על תמיכה במחקר שלנו. אנו מכירים את התלמידים הקודמים במעבדה (אסתר וו, גרגורי פנג, Taegun Jin, ג'ון סלים) שסייעו ליישם את טכניקת המיקרוהזרקה הזאת במעבדה שלנו. אנו אסירי תודה לד ר כריסטין הולט, שבמעבדאת הטכניקה הזאת, מיקרופיפוס ה-DNA וטכניקת הליפסד בעוברים התפתחו לראשונה.
Materials
| Name | Company | Catalog Number | Comments |
| 3.5" Micropipettes | Drummond Scientific | 3-000-203 - G/X | |
| μ-manager software (Version ) | www.micro-manager.org | ||
| CCD camera | Scion Corporation | CFW-1312 M | |
| Chorulon (Human Chorionic Gonadotropin) | AtoZ Vet Supply | N/A | |
| Cysteine | Sigma-Aldrich | 168149-100G | |
| DOTAP | Sigma-Aldrich | 11202375001 | |
| Dumont Forceps #5 | Fine Science Tools | 11250-10 | |
| Eclipse E800 epifluoresence microscope | Nikon | Objectives: Nikon Plan Apo 20X/0.75, Nikon Plan Fluor 40/0.75 | |
| GNU Image Manipulation Program (Version 2.10.10) | GIMP | ||
| Illustrator (2017 Creative Cloud) | Adobe | ||
| Image J (Version 1.46r) | NIH | ||
| Microfil | World Precision Instruments | MF 34G-5 | |
| Micromanipulator with universal adaptor and support base | Drummond Scientific | 3-000-024-R | |
| 3-000-025-SB | |||
| 3-000-024-A | |||
| Micropipette Puller | Sutter Instrument | P-30 | |
| Miniprep Kit | Qiagen | 27104 | |
| Motorized z-stage | Applied Scientific Instrumentation | MFC-2000 | |
| Nanoject II injector | Drummond Scientific | 3-000-204 | |
| Powerpoint (Version 15.31) | Microsoft | ||
| Xenopus laevis embryos | Nasco | LM00490 |
References
- Gibson, D. A., Ma, L. Developmental regulation of axon branching in the vertebrate nervous system. Development. 138 (2), 183-195 (2011).
- Alsina, B., Vu, T., Cohen-Cory, S. Visualizing synapse formation in arborizing optic axons in vivo: dynamics and modulation by BDNF. Nature Neuroscience. 4 (11), 1093-1101 (2001).
- Harris, W. A., Holt, C. E., Bonhoeffer, F. Retinal axons with and without their somata, growing to and arborizing in the tectum of Xenopus embryos: a time-lapse video study of single fibres in vivo. Development. 101 (1), 123-133 (1987).
- Sakaguchi, D. S., Murphey, R. K. Map formation in the developing Xenopus retinotectal system: an examination of ganglion cell terminal arborizations. Journal of Neuroscience. 5 (12), 3228-3245 (1985).
- Elul, T. M., Kimes, N. E., Kohwi, M., Reichardt, L. F. N-and C-terminal domains of β-catenin, respectively, are required to initiate and shape axon arbors of retinal ganglion cells in vivo. Journal of Neuroscience. 23 (16), 6567-6575 (2003).
- Wiley, A., et al. GSK-3β and α-catenin binding regions of β-catenin exert opposing effects on the terminal ventral optic axonal projection. Developmental Dynamics. 237 (5), 1434-1441 (2008).
- Jin, T., Peng, G., Wu, E., Mendiratta, S., Elul, T. N-terminal and central domains of APC function to regulate branch number, length and angle in developing optic axonal arbors in vivo. Brain research. 1697, 34-44 (2018).
- Marshak, S., Nikolakopoulou, A. M., Dirks, R., Martens, G. J., Cohen-Cory, S. Cell-autonomous TrkB signaling in presynaptic retinal ganglion cells mediates axon arbor growth and synapse maturation during the establishment of retinotectal synaptic connectivity. Journal of Neuroscience. 27 (10), 2444-2456 (2007).
- Holt, C. E., Garlick, N., Cornel, E. Lipofection of cDNAs in the Embryonic Vertebrate Central Nervous System. Neuron. 4 (2), 203-214 (1990).
- Ohnuma, S. I., Mann, F., Boy, S., Perron, M., Harris, W. A. Lipofection strategy for the study of Xenopus retinal development. Methods. 28 (4), 411-419 (2002).
- Joesch, M., Meister, M. A neuronal circuit for colour vision based on rod-cone opponency. Nature. 532 (7598), 236-239 (2016).
- Meyer, M. P., Smith, S. J. Evidence from in vivo imaging that synaptogenesis guides the growth and branching of axonal arbors by two distinct mechanisms. Journal of Neuroscience. 26 (13), 3604-3614 (2006).
- Li, X., Monckton, E. A., Godbout, R. Ectopic expression of transcription factor AP-2δ in developing retina: effect on PSA-NCAM and axon routing. Journal of Neurochemistry. 129 (1), 72-84 (2014).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo-from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Developmental Biology. 7, 107 (2007).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early Development of Xenopus laevis: A Laboratory Manual. , (2000).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin). , (1956).
- Zahn, N., Levin, M., Adams, D. S. The Zahn drawings: new illustrations of Xenopus embryo and tadpole stages for studies of craniofacial development. Development. 144 (15), 2708-2713 (2017).
- Piper, M., Dwivedy, A., Leung, L., Bradley, R. S., Holt, C. E. NF-protocadherin and TAF1 regulate retinal axon initiation and elongation in vivo. Journal of Neuroscience. 28 (1), 100-105 (2008).
- Dwivedy, A., Gertler, F. B., Miller, J., Holt, C. E., Lebrand, C. Ena/VASP function in retinal axons is required for terminal arborization but not pathway navigation. Development. 134 (11), 2137-2146 (2007).
- Leung, L. C., Harris, W. A., Holt, C. E., Piper, M. NF-Protocadherin Regulates Retinal Ganglion Cell Axon Behaviour in the Developing Visual System. PLOS One. 10 (10), e0141290 (2015).
- Lee, P. C., He, H. Y., Lin, C. Y., Ching, Y. T., Cline, H. T. Computer aided alignment and quantitative 4D structural plasticity analysis of neurons. Neuroinformatics. 11 (2), 249-257 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved