Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Xenopus laevis Embriyolarında Göz tomurcuklarına DNA'nın mikroenjeksiyonu ve GFP'nin Sağlam Optik Aksonal Arbors'u İfade Etme Görüntülemesi, Yaşayan Xenopus Kurbağaları
Bu Makalede
Özet
Bu protokol, bir günlük Xenopus laevis embriyolarının göz tomurcuklarına bir DNA/DOTAP karışımının nasıl mikroenjekte edilebildiğini ve tek tek yeşil floresan proteinin (GFP) tek tek görüntülenme ve yeniden nasıl yeniden yapılandırılabildiğini göstermeyi amaçlamaktadır. bozulmamış, yaşayan Xenopus kurbağa yavruları.
Özet
Su kurbağası Xenopus laevis iribaşlarının birincil görsel projeksiyonnöronal bağlanabilirlik gelişimini düzenleyen mekanizmaları incelemek için mükemmel bir model sistemi olarak hizmet vermektedir. Retino-tectal projeksiyonun kurulması sırasında optik aksonların gözden uzaması ve beynin farklı bölgelerinde niçin hedef dokuya, optik tektuma ulaşmasına yol açar. Optik aksonlar tektuma girdikten sonra, tektumdaki hedef internöronlarla yapabilecekleri sinaptik bağlantı sayısını artırmak için işlev gören terminal çardaklarını ayrıntıya sokarlar. Burada, Xenopus embriyolarında optik nöronlarda (retinal ganglion hücreleri) yeşil floresan protein (GFP) kodlayan DNA'yı ve fonksiyon kaybı ve kazanç ve fonksiyon kaybı gen yapılarını ifade etmek için bir yöntem tanımlıyoruz. Bir günlük embriyoların göz tomurcuklarına birleştirilmiş dna/lipofection reaktifinin nasıl mikro enjekte edileceğini açıklarız, bu şekilde eksojen genler tek veya az sayıda optik nöronla ifade edilir. GFP ile genleri etiketleme veya gfp plazmid ile birlikte enjekte ederek, değiştirilmiş moleküler sinyalile bireysel optik nöronların terminal aksonal arbors bozulmamış beyinlerde doğrudan görüntülenebilir, birkaç gün sonra yaşayan Xenopus iribaşlar, ve morfolojisi ölçülebilir. Bu protokol, in vivo optik akson arborization gelişiminin altında yatan hücre otonom moleküler mekanizmaların belirlenmesiiçin izin verir.
Giriş
Sinir sisteminin gelişimi sırasında, presinaptik nöronların aksonları hedef bölgelerine ulaşmak için beynin çeşitli bölgelerinde gezinmek. Aksonlar hedef dokularını istila ettiklerinde, postsinaptik hedef nöronlarla sinaptik bağlantılar kurarlar. Birçok nöron türünde aksonlar terminal dallarının veya çardakların ağlarını ayrıntılı bir şekilde detaylandırmak için yapabilecekleri sinaptik bağlantıların sayısını ve mekansal kapsamını arttırırlar1. Su kurbağası Xenopus laevis iribaşlarının retino-tectal projeksiyon terminal akson arborization ve sinaptik bağlantı2,3,4 altında yatan mekanizmaları incelemek için güçlü bir omurgalı modelidir . Normal ve değiştirilmiş moleküler sinyalile optik aksonal arbors ifade bireysel GFP bozulmamış doğrudan görülebilir, yaşayan Xenopus kurbağa yavruları5,6,7,8. GFP'yi tek başına veya az sayıda optik nöronda genlerin tam uzunlukta veya kesilmiş versiyonlarıyla ifade etmek için, bir günlük Xenopus embriyolarının göz tomurcuklarına DNA'nın mikroenjeksiyon/lipofeksiyonunu içeren bir teknik kullanıyoruz9, 10- Bu teknik ilk olarak genç Xenopus kurbağalarında optik akson yol bulma mekanizmalarını incelemek için geliştirilmiştir ve o zamandan beri optik akson altında yatan hücre özerk moleküler mekanizmaları belirlemek için bize ve diğerleri tarafından uygulanmıştır Xenopus kurbağa yavruları nda ağaçlandırma5,6,7,8,9,10.
Optik nöronların az sayıda eksojen genleri ifade etmek için alternatif teknikler diğer model türler de geliştirilmiştir, yanı sıra X. laevis . Ancak, bu yaklaşımların her biri, Xenopus embriyolarının göz tomurcuklarında DNA/lipofection reaktifinin mikroenjeksiyonu ile karşılaştırıldığında zorluklar ve sınırlamalar sunmaktadır. Farelerde, transgenez optik nöronların az sayıda genleri ifade etmek için kullanılabilir, ancak transgenik farelerin üretimi pahalı ve zaman alıcı ve transgenik fareler genellikle istenmeyen yan etkileri ile mevcut11. Optik nöronlarda eksojen genleri ifade eden transgenik zebra balıkları da erken bölünme evre embriyolarına plazmid enjekte edilerek oluşturulabilir12. Ancak, bu süreç zebrabalığı larvaları optik nöronlarda bir mozaik desen genleri ifade etmek için belirli bir organizatörün klonlama gerektirir12. Transgenik zebra balıklarında optik nöronlarda ekzojen DNA ekspresyonu sıklığı da biraz daha düşüktür (<%30). DNA/lipozomal reaktif (%30−60) ile mikroenjekte edilen Xenopus kurbağa yavruları ile karşılaştırıldığında12. Ovo elektroporasyon da civciv optik nöronların az sayıda genleri ifade etmek için kullanılmıştır13. Ancak, optik akson arborization bozulmamış görüntülenemez, yaşayan civciv embriyolar çünkü bu prosedür optik projeksiyonlar kurmak mekanizmaları tam olarak karakterize etmek için başarısız oldu. Son olarak, birkaç laboratuvarxenopus kurbağa yavruları optik nöronlar az sayıda içine transfect genler için elektroporasyon kullandık14,15. Ancak, elektroporasyon ekipman ve protokollerin optimizasyonu gerektirir (uyarıcı, elektrotlar, dalga darbeleri mekansal ve zamansal desenler) ötesinde dna / lipofection reagent mikroenjeksiyon için kullanılan Xenopus embriyoların eyebuds içine.
Biz ve diğerleri daha önce optik aksonarborization5 kurmak hücre otonom sinyal mekanizmaları belirlemek için Xenopus embriyolarının eyebuds içine DNA mikroenjeksiyon / lipofection tekniği nikullandı5 ,6, 7.000 , 8- Biz başlangıçta Xenopus iribaşları optik aksonal arborization Cadherin ve Wnt adaptör protein β-catenin fonksiyonlarını incelemek için bu yaklaşımıkullandı5,6. Bir çalışmada, β-kateninα-catenin ve PDZ'ye bağlanmasının sırasıyla, in vivo5'teoptik aksonal arborların başlatılması ve şekillendirilmesi için gerekli olduğunu gösterdik. İkinci bir raporda, α-catenin ve GSK-3β için β-catenin bağlayıcı etki alanlarının ventral optik aksonal çarkların projeksiyon desenlerini zıt olarak modüle ettiğini gösterdik6. Daha yakın zamanda, Biz Wnt faktörü için roller tespit, adenomatöz polipozis coli (APC), Xenopus iribaşları optik aksonal arbors morfolojik özellikleri düzenleyen7. Β-catenin stabilitesini ve mikrotübül organizasyonunu bireysel optik nöronlarda GFP ile birlikte modüle eden APC'nin N-terminal ve merkezi etki alanlarını birlikte ifade ederek, şube numarası ndaki bu APC etkileşim etki alanları için ortak ve farklı roller belirledik, uzunluk ve in vivo7optik aksonal arbors açı . Başka bir laboratuvar, Xenopus iribaşları optik aksonal arbors bdnf reseptörü, TrkB, tarafından sinyal için hücre otonom rolleri belirlemek için mikroenjeksiyon / lipofection tekniği kullanılır8. Bu grup, vivo8yılında bireysel optik akson arbors bir baskın-negatif TrkB tedirgin dallanma ve sinaptik olgunlaşma ifade gösterdi. Genel olarak, Xenopus lipofection tekniği zaten yerli ortamda optik akson dallanma farklı genlerin belirli rolleri aydınlatılmış vardır.
Protokol
Burada açıklanan tüm yöntemler Touro University California Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) (Protokol # TUCA003TE01X) tarafından onaylanmıştır.
1. X. laevis Embriyolarının Elde Edilmesi
- İnsan koryonik gonadotropin (HCG) ile astarlanmış erkek ve dişi yetişkin kurbağa çiftlerinin doğal çiftleşme ile X. laevis embriyoları elde, hcg ile astarlanmış dişi yetişkin kurbağalardan dökülen yumurtaların in vitro döllenmesi veya doğrudan sipariş edilerek (Tablo Malzemeler).
-
Oda sıcaklığında %2 sistein çözeltisi ile elde edilen dejelly embriyolar (Malzeme Tablosu)16.
- Büyük bir Petri kabında 50−100 embriyo toplayın. Embriyoların içinde bulunan çözeltiyi plastik transfer pipetini dekantting veya kullanarak çıkarın. Embriyoları içeren tabağa %2 sistein çözeltisi (25 mL ddH2O'da 0,5 g sistein, pH ila 8,0) ekleyin.
- Embriyoların jöle katları düşene ve embriyolar kabın ortasında (5−10 dk) bir küme halinde toplanana kadar sistein çözeltisindeki embriyoları içeren Petri kabını yavaşça döndürün. Bu noktada, yavaş yavaş ve yavaşça bir atık kabı içine sistein çözeltisi dökün. Sistein çözeltisi ile birlikte atık kabında embriyoların çok fazla dökmek için dikkat edin.
- Petri kabındaki embriyoları %10 modifiye edilmiş Mark'ın Ringer çözeltisi (MMR) veya diğer uygun çözelti (örneğin, değiştirilmiş Barth's Solution, MBS) ile durulayın ve çözelti her değiştirildiğinde kabı döndürün.
- Kültür embriyolar gelişim aşamalarına ulaşına kadar% 10 MMR 22−2417. Ksenopus embriyoları 15−25 °C arasındaki sıcaklıklarda kuluçkaya yayılabilir. Embriyoların gelişim hızı17'dekuluçkaya yatırılabildikleri sıcaklığa bağlıdır.
NOT: Bir katalogdan sipariş edilen Xenopus embriyoları genellikle laboratuvara gelişim aşamalarında 20−24 olarak gelirler, böylece hemen dejellied ve mikroenjekte edilebilirler.
2. DNA Plazmidlerinin Hazırlanması ve DNA/DOTAP Karışımının Yapılması
- Subclone DNA ekspresyonu Xenopus ekspresyonu vektörleri pCS2 + veya pCS2 + MT veya bunların türevleri içine inşa (başlangıçta D. Turner ve R. Rupp tarafından inşa)5,6,7. pCS2+ vektörleri kurbağalarda gen ekspresyonunu kolaylaştıran değiştirilmiş bir sitomegalovirüs (CMV) promotörü içerir.
- Standart prosedürü izleyerek GFP ve/veya ilgi genleri içeren pCS2 plazmidlerini miniprep kitleri(Malzeme Tablosu)ile yükseltin. Miniprep protokolünün son elution adımında, DNA'nın ddH2O'ya ardışık bir elüsünü gerçekleştirerek son konsantrasyon >1 μg/μL'yi elde edin.
- Tüm pCS2 plazmidlerini mikroenjeksiyon/lipofection deneyi yapmaya hazır olana kadar -80 °C'de saklayın, yani embriyolar gelişim evrelerinde yken 22−24.
- Oda sıcaklığında dudak uçuklatıcı dna plazmidleri çözülür. Lipofection hemen önce, kısaca santrifüj DNA plazmidleri. Bu, mikrokapiller pipetin ucunu tıkayabilecek DNA/DOTAP karışımında çökelti oluşmasını önler.
- DNA plazmidlerini DOTAP lipozomal transfeksiyon reaktifi(Tablo)ile 1:3 (w/v) oranında birleştirin9,10. Örneğin, 2 μg DNA'yı 1,5 mL'lik mikromerkezrifuge tüpüne aktarın ve 6 μL DOTAP ekleyin veya mikrosentrifuge tüpüne 3 μg DNA aktarın ve 9 μL DOTAP ekleyin.
- DNA ve DOTAP birleştirildiğinde, çözeltiyi karıştırmak için mikrosantrifüj tüpünü hafifçe hafifçe hareket ettirin. DNA/DOTAP çözeltisi karıştırıldıktan sonra biraz opak hale gelmelidir.
- Optik nöronlarda iki plazmid birlikte lipofektomi yapılacaksa (örneğin, bir genin kesilmiş veya tam uzunlukta versiyonunu içeren ikinci bir pCS2 plazmidi ile pCS2-GFP) ilk olarak iki plazmidi (her ikisini de kısaca santrifüj ettikten sonra) 1:1 oranında birleştirin ve DOTAP 1:3 (w/v) oranında. Örneğin, 1 μg pCS2-GFP'yi ikinci bir pCS2 plazmidin 1 μg'si ile birleştirin ve 6 μL DOTAP ekleyin.
NOT: Çalışmalar bu gelişim aşamalarında Xenopus embriyolarının eyebuds içine iki plazmidlerin lipofeksiyon bireysel optik nöronlar kendi co-ekspresyon neden olacağını göstermiştir9,10.
3. Mikroenjeksiyon İğnesi'nin DNA/DOTAP ile Yüklenmesi
- Hafifçe ince forceps(Malzeme Tablosu)ile çekilen cam mikrocapiller pipet ucu nu klip.
- Cam mikrokapiller pipeti mineral yağ ile doldurun, mikropipetin kırpılmış ucunda küçük bir damla mineral yağ belirir. Mikrokapiller pipeti mineral yağile yarıya kadar doldurun.
- Madeni yağ ile doldurulmuş çekilmiş cam mikrokapiller pipeti, enjektöre bağlı uygun bir enjeksiyon tutucuya yükleyin. Bir enjektör kullanıyorsanız(Malzeme Tablosu),üzerine mikrokapiller pipet yüklemeden önce yarı yolda piston çıkarmak. Mikrokapiller pipet enjektöre güvenli bir şekilde bağlandıktan sonra, mikrokapiller pipetin enjektöre güçlü bir şekilde bağlı olduğunu ve pistonun uzantısı ile hareket etmediğini doğrulamak için pistonu tam ölçüde genişletin.
- DNA/DOTAP karışımının 3 μL'lik bir damlasını kesilmiş bir kare (1 inç kare) parafin kağıdına aktarın.
- Stereo diseksiyon mikroskobu altında, cam mikrokapiller pipetin ucunu DNA/DOTAP damlasına taşıyın.
- Enjeksiyon aparatı üzerindeki dolgu seçeneğini kullanarak DNA/DOTAP damlasını cam mikrokapiller pipete yavaşça em. Sıvı mikrokapiller pipete yüklendikçe, damla daha küçük olacaktır. DNA/DOTAP çözeltisinin hafif opaklığı nedeniyle, mineral yağ ile DNA/DOTAP çözeltisi arasındaki sınır cam mikrokapiller pipette görülmelidir (Şekil 1). Gerekirse, cam mikrokapiller pipetteki basıncın yeniden ayarlanabilmesi için mikrokapiller pipetin düzenli olarak doldurulmasını bekleyin.
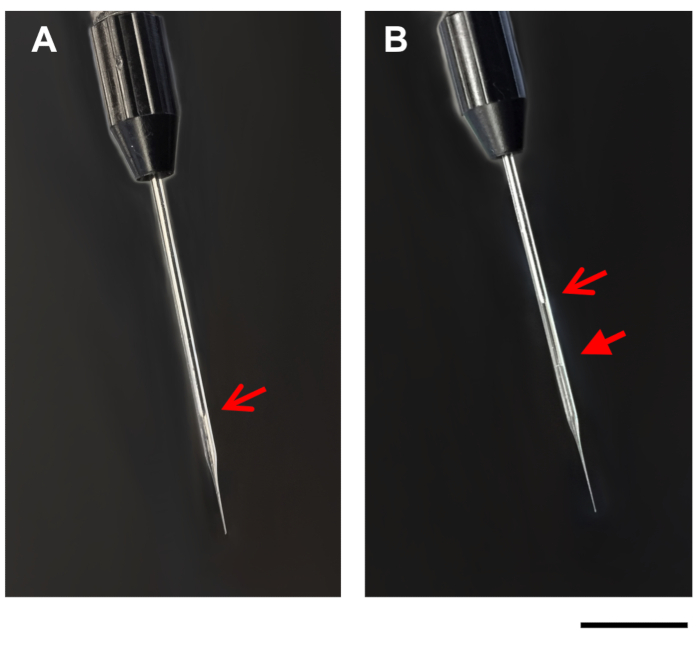
Şekil 1: Mikrokapiller pipet görüntüleri. Görüntüler enjeksiyon aparatı üzerinde mikrocapiller pipet göstermektedir, önce (A), ve sonra (B) DNA / DOTAP ile dolum. Açık oklar, mikrokapiller pipet(A,B)piston ucu. Kapalı ok, dolgulu mikrokapiller pipet(B)mineral yağ ve DNA / DOTAP arasındaki çizgi. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. 1 Günlük Kenopus Embriyolarının Göz Tomurcuklarına Mikroenjeksiyon DNA/DOTAP
- Elle 0.1x MMR ile dolu 10 mm Petri kabında ince büşralar ile on aşama 20−24 Xenopus embriyoları devitellinize. Embriyoların yaralanmasını önlemek için beldeki vitellinzarfı kavrayın. Deneycinin hem sol hem de sağ ellerindeki forsepslerle vitellin zarfının balonunu patlatın ve embriyoyu vitellin zarfından serbest bırakın. Vitellin zarfını çıkarırken embriyoları yaralamamaya dikkat edin.
NOT: Evre 20 başlayarak, Xenopus embriyoları embriyonun ön ve arka yarısı arasında bir girinti veya 'bel' geliştirmek. Bu bel vitellin zarf ve bu pozisyonda embriyo arasında bir boşluk oluşmasını sağlar. - 5−10 devitellinized stage 22−24 embriyoları 1x MMR ile dolu 10 mm Petri kabına aktarmak için kesik uçlu plastik bir transfer pipetkullanın.
NOT: 1x MMR'deki yüksek tuz çözeltisi, mikroenjeksiyondan kaynaklanan delinme yaralarının iyileşmesini kolaylaştırır. - Stereomikroskop altında, Petri kabındaki devitellinized embriyolardan birini her elde forsepsle tutarak ve embriyoyu ön kutbunun görüş alanına doğru işaret edilebilmesi için düzenleyin. Embriyoyu yanal bir şekilde yatsın ve göz tomurcuklarından biri (sol veya sağ) yukarı bakacak şekilde yönlendirin.
- Stereomikroskop altında, deneycinin baskın olmayan elinde forseps ile embriyo tutun ve deneycinin baskın el ile göz budiçine cam mikropipet ucu tanıtmak (ventral veya sırt tarafında, yarısına bağlı olarak şu anda enjekte edilmekte olan embriyo), epidermisin hemen altında(Şekil 2). DNA/DOTAP çözeltisinin 70−210 nL'sini enjekte edin. Bu, enjektörün ayarlı olduğu darbenin büyüklüğüne bağlı olarak (genellikle 70 nL) çeşitli darbelerde yapılabilir.
NOT: Enjeksiyon derinliği optik nöronlar içine lipofection için çok önemlidir. Mikrokapillerin ucunun pozisyonu doğru bir şekilde göz odasına yüzeysel olarak yerleştirilirse, mikroenjeksiyondan sonra, göz budağının üzerini örten gri epidermis kabarır. Pozisyon çok derin ise, gri göz bud herhangi bir değişiklik göstermez, ve optik nöronlarda DNA ifade sıklığı daha düşük olacaktır. - Embriyoyu döndürün ve aynı mikroenjeksiyonu embriyonun kontralateral tarafındaki göz dürbününe yapın.
- Her deneyde 6−10 (veya daha fazla) embriyonun her iki göz tomurcuklarını enjekte edin.
- Mikroenjeksiyondan sonra, yara iyileşmesini kolaylaştırmak için embriyoları 1x MMR ile yaklaşık 30 dakika saklayın.
- 30 dakika sonra, pigmentasyonu azaltmak için enjekte edilen embriyoları %0,001 beyazlatma maddesi (feniltiokarbamide) ile 0,1x MMR çözeltisine aktarın. Kültür embriyolar yaklaşık beş gün boyunca kapalı, embriyolar aşamalarında iribaş haline gelene kadar 46−4716.
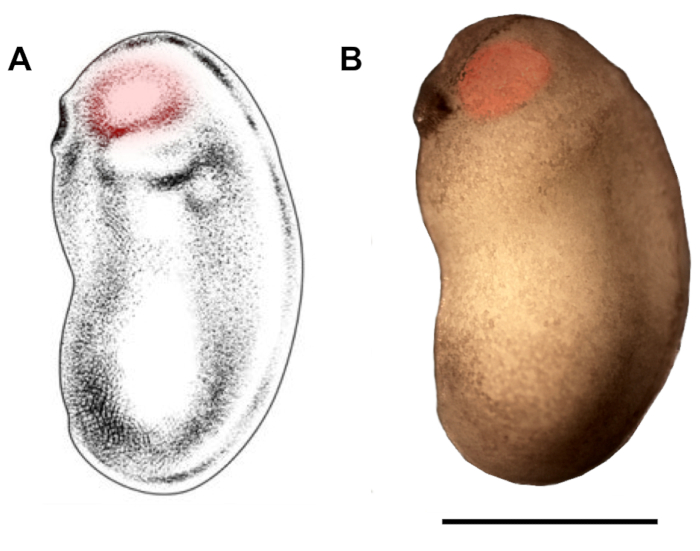
Şekil 2: Mikroenjeksiyon için göz budak bölgesinin çizilmesi. X. laevis embriyonun gelişim evrelerinde 22/23'te mikroenjeksiyon (kırmızı vurgular) için hedef alınması gereken göz tomurcuk bölgesini gösteren şematik (A) ve fotomikrograf (B). Ölçek çubuğu = 1 mm. Panel A, Zahn ve ark.18'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. GFP'nin Sağlam, Canlı Kurbağalarda Optik Aksonal Arbors İfade Sinin Görüntülenmesi
NOT: DNA ile lipofektomi yapılan kurbağa yavruları gelişim evrelerine 46−47'ye ulaştıklarında görüntülemeye hazır olurlar.
- Görüntülemeden önce kurbağa yavruları anestezi lidir. Kurbağa yavruları anestezik için, 10 mm Petri kabında ddH2O'da dudak uçukdaki iribaşları %0,02'lik bir trikotin çözeltisine aktarın. Kurbağa yavruları hareketsiz hale kadar 5−10 dk bekleyin. Kurbağa yavrularının stereo bir kesişme mikroskobu altında atan kalplerini gözlemleyerek hala hayatta olduklarını doğrulayın.
- Bir cam slayt üzerinde özel yapım silikon odasına bir anestezi kurbağa yavrusu yerleştirin ve bir coverslip ile mühür. Kurbağa yavrusu, başının bir tarafının (sol veya sağ) yukarı doğru açılı olması ve kapak kapağına zar zor dokunur şekilde hafifçe eğilmelidir.
- Optik aksonal çardakları ifade eden GFP için düşük büyütmede yukarı doğru eğilen iribaşın dorsal tectal orta beyninin yarısını ekran.
NOT: Bir epilfuorescence aydınlatma ve apochromatic objektif lens(Tablo Malzemeler)floresan arbors için tarama için kullanılabilir ile donatılmış geniş bir dik mikroskop kullanılabilir. - Tectal yarımkürede optik aksonal çardakları ifade eden bir ila üç GFP arasında yer alıyorsa, yüksek kontrastlı 40x hava uzun çalışma mesafesi hedefi(Tablo Malzemeler)kullanarak bu çardakların bir z serisi görüntü yakalayın. Her aksonal arbor için 10−20 z-serisi dilimleri 1,5 μm aralıklarla yakalayın.
- Tectal orta beynin diğer tarafındaki akson arbors görüntülemek için, diğer tarafa eğilir ve bir kapak kayma ile mühür böylece silikon odasında kurbağa yavrusu yeniden yükleyin. Ardından 5.3 ve 5.4 adımlarını tekrarlayın.
6. Optik Aksonal Arbor Morfolojisinin Yeniden İnşası ve Niceliği
- Optik aksonal çardakları ifade eden bir ila üç GFP arasında içeren bir görüntü yığını seçin.
- Her z diliminde görünen her optik aksonal arbor bölümünü izlemek için grafik düzenleme yazılımı(Tablo Malzemeler)freehand çizim aracını kullanın. Her z-dilim belirgin her çardak parçaları ile izleme çardak doğru bir 2D projeksiyon yaratacaktır. Farklı renkler optik aksonal arbors ifade farklı GFP izlemek için kullanılabilir.
- Aksonal çardakların 2B rekonstrüksiyonlarında, gerektiğinde orijinal z serisi görüntülere atıfta bulunarak tüm morfometrik ölçümleryapın7. Image J yazılımını(Malzeme Tablosu)kullanarak, dal sayısı (yani, dal uçları veya dal noktalarının sayısı), toplam arbor dalı uzunluğu, dal başına uzunluk, ağaç landırma uzunluğu ve genişliği, çardak toplam şekli (L/W) gibi morfolojik parametreleri ölçün oranı, dairesellik) ve dalların açısı7.
Sonuçlar
Bu makalede açıklanan protokol, enjekte edilen Xenopus embriyolarının %30−60'ının gfp'yi (tek başına veya ek bir DNA yapısıyla birlikte) bir ila on optik aksonal arbor'da ifade eden bir başarı oranı sağlar. Şekil3'te, gfp'nin temsili konfokal görüntülerini gösteriyoruz ve yakın zamanda yayınlanançalışmamızdansağlam Xenopus kurbağalarında kontrol ve mutant optik aksonal çardakları ifade ediyoruz 7 . Bu çalışma için,...
Tartışmalar
Bu makalede, tek veya az sayıda optik nöronda eksojen DNA yapılarının nasıl ifade edilebildiğini ve X kurbağasının yaşayan kurbağa yavrularında normal ve değiştirilmiş moleküler sinyallerle optik aksonal çardakları ifade eden gfp'nin nasıl görüntülenebileceğimizi gösteriyoruz. . laevis. Ayrıca, in vivo'da çekilen görüntülerden optik aksonal çardakları ifade eden GFP'nin morfolojisinin nasıl yeniden yapılandırılabildiğini ve ölçültebileceğimizi de açıklıyoruz. Az sayı...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Biz araştırma desteklemek için Touro Üniversitesi California Osteopatik Tıp Koleji teşekkür ederiz. Bu mikroenjeksiyon tekniğinin laboratuarımızda uygulanmasına yardımcı olan laboratuvardaki (Esther Wu, Gregory Peng, Taegun Jin, John Lim) önceki öğrencileri kabul ediyoruz. Dr. Christine Holt'a minnettarız, bu DNA mikroenjeksiyon/lipofection tekniği ilk olarak Xenopus embriyolarında geliştirildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3.5" Micropipettes | Drummond Scientific | 3-000-203 - G/X | |
| μ-manager software (Version ) | www.micro-manager.org | ||
| CCD camera | Scion Corporation | CFW-1312 M | |
| Chorulon (Human Chorionic Gonadotropin) | AtoZ Vet Supply | N/A | |
| Cysteine | Sigma-Aldrich | 168149-100G | |
| DOTAP | Sigma-Aldrich | 11202375001 | |
| Dumont Forceps #5 | Fine Science Tools | 11250-10 | |
| Eclipse E800 epifluoresence microscope | Nikon | Objectives: Nikon Plan Apo 20X/0.75, Nikon Plan Fluor 40/0.75 | |
| GNU Image Manipulation Program (Version 2.10.10) | GIMP | ||
| Illustrator (2017 Creative Cloud) | Adobe | ||
| Image J (Version 1.46r) | NIH | ||
| Microfil | World Precision Instruments | MF 34G-5 | |
| Micromanipulator with universal adaptor and support base | Drummond Scientific | 3-000-024-R | |
| 3-000-025-SB | |||
| 3-000-024-A | |||
| Micropipette Puller | Sutter Instrument | P-30 | |
| Miniprep Kit | Qiagen | 27104 | |
| Motorized z-stage | Applied Scientific Instrumentation | MFC-2000 | |
| Nanoject II injector | Drummond Scientific | 3-000-204 | |
| Powerpoint (Version 15.31) | Microsoft | ||
| Xenopus laevis embryos | Nasco | LM00490 |
Referanslar
- Gibson, D. A., Ma, L. Developmental regulation of axon branching in the vertebrate nervous system. Development. 138 (2), 183-195 (2011).
- Alsina, B., Vu, T., Cohen-Cory, S. Visualizing synapse formation in arborizing optic axons in vivo: dynamics and modulation by BDNF. Nature Neuroscience. 4 (11), 1093-1101 (2001).
- Harris, W. A., Holt, C. E., Bonhoeffer, F. Retinal axons with and without their somata, growing to and arborizing in the tectum of Xenopus embryos: a time-lapse video study of single fibres in vivo. Development. 101 (1), 123-133 (1987).
- Sakaguchi, D. S., Murphey, R. K. Map formation in the developing Xenopus retinotectal system: an examination of ganglion cell terminal arborizations. Journal of Neuroscience. 5 (12), 3228-3245 (1985).
- Elul, T. M., Kimes, N. E., Kohwi, M., Reichardt, L. F. N-and C-terminal domains of β-catenin, respectively, are required to initiate and shape axon arbors of retinal ganglion cells in vivo. Journal of Neuroscience. 23 (16), 6567-6575 (2003).
- Wiley, A., et al. GSK-3β and α-catenin binding regions of β-catenin exert opposing effects on the terminal ventral optic axonal projection. Developmental Dynamics. 237 (5), 1434-1441 (2008).
- Jin, T., Peng, G., Wu, E., Mendiratta, S., Elul, T. N-terminal and central domains of APC function to regulate branch number, length and angle in developing optic axonal arbors in vivo. Brain research. 1697, 34-44 (2018).
- Marshak, S., Nikolakopoulou, A. M., Dirks, R., Martens, G. J., Cohen-Cory, S. Cell-autonomous TrkB signaling in presynaptic retinal ganglion cells mediates axon arbor growth and synapse maturation during the establishment of retinotectal synaptic connectivity. Journal of Neuroscience. 27 (10), 2444-2456 (2007).
- Holt, C. E., Garlick, N., Cornel, E. Lipofection of cDNAs in the Embryonic Vertebrate Central Nervous System. Neuron. 4 (2), 203-214 (1990).
- Ohnuma, S. I., Mann, F., Boy, S., Perron, M., Harris, W. A. Lipofection strategy for the study of Xenopus retinal development. Methods. 28 (4), 411-419 (2002).
- Joesch, M., Meister, M. A neuronal circuit for colour vision based on rod-cone opponency. Nature. 532 (7598), 236-239 (2016).
- Meyer, M. P., Smith, S. J. Evidence from in vivo imaging that synaptogenesis guides the growth and branching of axonal arbors by two distinct mechanisms. Journal of Neuroscience. 26 (13), 3604-3614 (2006).
- Li, X., Monckton, E. A., Godbout, R. Ectopic expression of transcription factor AP-2δ in developing retina: effect on PSA-NCAM and axon routing. Journal of Neurochemistry. 129 (1), 72-84 (2014).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo-from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Developmental Biology. 7, 107 (2007).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early Development of Xenopus laevis: A Laboratory Manual. , (2000).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin). , (1956).
- Zahn, N., Levin, M., Adams, D. S. The Zahn drawings: new illustrations of Xenopus embryo and tadpole stages for studies of craniofacial development. Development. 144 (15), 2708-2713 (2017).
- Piper, M., Dwivedy, A., Leung, L., Bradley, R. S., Holt, C. E. NF-protocadherin and TAF1 regulate retinal axon initiation and elongation in vivo. Journal of Neuroscience. 28 (1), 100-105 (2008).
- Dwivedy, A., Gertler, F. B., Miller, J., Holt, C. E., Lebrand, C. Ena/VASP function in retinal axons is required for terminal arborization but not pathway navigation. Development. 134 (11), 2137-2146 (2007).
- Leung, L. C., Harris, W. A., Holt, C. E., Piper, M. NF-Protocadherin Regulates Retinal Ganglion Cell Axon Behaviour in the Developing Visual System. PLOS One. 10 (10), e0141290 (2015).
- Lee, P. C., He, H. Y., Lin, C. Y., Ching, Y. T., Cline, H. T. Computer aided alignment and quantitative 4D structural plasticity analysis of neurons. Neuroinformatics. 11 (2), 249-257 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır