A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת בצקת מוחית לאחר שבץ מוחי, אזור אוטם ופירוק מחסום דם- מוח בערכה אחת של דגימות מוח מכרסמים
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר טכניקה חדשנית של מדידת שלושת הפרמטרים החשובים ביותר של פגיעה מוחית איסכמית על אותה קבוצה של דגימות מוח מכרסמים. שימוש במדגם מוח אחד בלבד הוא יתרון גדול במונחים של עלויות אתיות וכלכליות.
Abstract
אחד הגורמים השכיחים ביותר לתחלואה ותמותה ברחבי העולם הוא שבץ איסכמי. מבחינה היסטורית, מודל של בעלי חיים המשמש להמרצת שבץ איסכמי כרוך בחסימת עורק המוח האמצעי (MCAO). אזור אוטם, בצקת במוח והתמוטטות מחסום הדם - מוח (BBB) נמדדים כפרמטרים המשקפים את היקף הפגיעה המוחית לאחר MCAO. מגבלה משמעותית לשיטה זו היא כי מדידות אלה מתקבלות בדרך כלל בדגימות שונות של מוח החולדות, מה שמוביל לעומסים אתיים ופיננסיים בשל המספר הגדול של חולדות שיש להרדים עבור גודל מדגם מתאים. כאן אנו מציגים שיטה להעריך במדויק פגיעה מוחית בעקבות MCAO על ידי מדידת אזור אוטם, בצקת במוח וחדירות BBB באותה קבוצה של מוחות חולדה. טכניקה חדשנית זו מספקת דרך יעילה יותר להעריך את הפתופיזיולוגיה של שבץ.
Introduction
אחד הגורמים השכיחים ביותר לתחלואה ותמותה ברחבי העולם הוא שבץ מוחי. באופן גלובלי, שבץ איסכמי מייצג 68% מכלל מקרי השבץ, ואילו בארצות הברית שבץ איסכמי מהווה 87% ממקריהשבץ 1,2. ההערכה היא כי הנטל הכלכלי של שבץ מגיע $34 מיליארד בארצות הברית2 ו 45 מיליארד אירו באיחוד האירופי3. מודלים בעלי חיים של שבץ נחוצים כדי ללמוד את הפתופיזיולוגיה שלה, לפתח שיטות חדשות להערכה, ולהציע אפשרויות טיפוליות חדשות4.
שבץ איסכמי מתרחש עם חסימה של עורק מוחי גדול, בדרך כלל עורק המוח האמצעי או אחד מענפיו5. לכן, מודלים של שבץ איסכמי מעורבים היסטורית חסימת עורק המוח התיכון (MCAO)6,7,8,9,10,11,12. בעקבות מקאו, פגיעה נוירולוגית מוערכת בדרך כלל על ידי מדידת אזור אוטם (IZ) באמצעות 2,3,5-טריפינילטטרזוליום כלוריד (TTC) שיטת הכתמת13, בצקת במוח (BE) באמצעות יבש חישוב או חישוב כרכים hemispheric14,15,16, ומחסום הדם מוח (BBB) חדירות על ידי טכניקה ספקטרומטריה באמצעות אוונס כחול מכתים17,18,19.
שיטת MCAO המסורתית משתמשת בקבוצות נפרדות של מוחות עבור כל אחת משלוש מדידות המוח. עבור גודל מדגם גדול, התוצאה היא מספר משמעותי של בעלי חיים מורדמים, עם שיקולים אתיים ופיננסיים נוספים. שיטה חלופית להקלה על עלויות אלה תכלול מדידות של כל שלושת הפרמטרים בסט אחד של מוחות מכרסמים שלאחר MCAO.
נעשו ניסיונות קודמים למדוד שילובים של פרמטרים באותה דגימת מוח. שיטות צביעה חיסוניות בו זמנית20, כמו גם ניתוחים מולקולריים וביוכימיים אחרים21 תוארו לאחר כתמי TTC באותה דגימת מוח. חישבנו בעבר כרכים בחצי הכדור במוח כדי להעריך בצקת במוח וביצענו כתמי TTC כדי לחשב אזור אוטם באותו מוח להגדיר15.
בפרוטוקול הנוכחי, אנו מציגים טכניקת MCAO שונה המודדת פגיעה מוחית איסכמית באמצעות קביעת חדירות IZ, BE ו- BBB באותה קבוצה של מוחות מכרסמים. IZ נמדד על ידי כתמי TTC, BE נקבע על ידי חישוב נפח hemispheric, וחדירות BBB מתקבלת על ידי שיטות ספקטרומטריה19. בפרוטוקול זה, השתמשנו במודל MCAO שונה, המבוסס על החדרה ישירה וקיבעון של קטטר המונופילמנט לתוך עורק העורק הראשי הפנימי (ICA) וחסימת זרימת דם נוספת לעורק המוחי האמצעי (MCA)22. שיטה זו שונה מראה שיעור ירידה של תמותה ותחלואה לעומת שיטת MCAO המסורתית16,22.
גישה חדשה זו מספקת מודל כלכלי ואתי למדידת פגיעה נוירולוגית לאחר MCAO. הערכה זו של הפרמטרים העיקריים של פגיעה מוחית איסכמית תסייע לחקור באופן מקיף את הפתופיזיולוגיה שלה.
Protocol
ההליכים הבאים נערכו בהתאם להמלצות הצהרת הלסינקי וטוקיו וההנחיות לשימוש בבעלי חיים ניסיוניים של הקהילה האירופית. הניסויים אושרו גם על ידי הוועדה לטיפול בבעלי חיים באוניברסיטת בן-גוריון בנגב.
1. הכנת חולדות להליך הניסויי
- בחר חולדות Sprague-Dawley זכר בוגר ללא פתולוגיה גלויה, כל אחד במשקל בין 300 ל 350 גרם.
- יש לשמור על כל החולדות בטמפרטורת החדר בטמפרטורה של 22 מעלות צלזיוס, עם 12 שעות של מחזורים בהירים וחשוכים לפני הניסוי.
- ודא כי מזון ומים זמינים libitum המודעה.
- בצע את כל ההליכים בין השעות 06:00 .m עד 14:00.m.
2. הכנת חולדות לניתוח
- יש להרדים את החולדות במשך 30 דקות עם isoflurane (4% לאינסדוקציה ו-2% לתחזוקה) ו-24% חמצן (1.5 ל' לדקה).
- בדוק את רמת ההרדמה בחולדות על ידי הבטחת אין להם רפלקס נסיגה דוושה.
- הכנס את הקטטר 24-מד לתוך וריד הזנב.
הערה: התחממות הזנב עבור vasodilation אינו מבוצע.- מניחים את החולדות על השולחן בתנוחה על-חושית. השתמש בקלטת רפואית כדי להדביק את כל ארבעת הגפיים של החולדות.
- מניחים את הגשוש למדידת טמפרטורה בפי הטבעת של החולדה לפני הניתוח.
- במהלך ההליך, לשמור על צלחת חימום כדי לתמוך 37 °C (70 °F) טמפרטורת הגוף הליבה.
- הוסף משחה בשתי עיניו של החולדה להגנה.
- לגלח את האזור הכירורגי ולחטא עם שלושה יישומים של 10% povidone-יוד ואחריו 70% אלכוהול איזופרופיל.
3. חסימת עורק המוח האמצעי בצד ימין
הערה: מקאו מבוצע על ידי טכניקה שונה, כפי שתואר קודם לכן16,22,23, עם שימוש בכלים המתוארים על ידי McGarry ואח'24 ו Uluç ואח'25.
- לנתח את העור ואת fascia שטחית בקו האמצע הגחוני של הצוואר עם פינצטה כירורגית ומספריים עם להבים מעוגלים.
- זהה את משולש השרירים, המורכב מה- ICA, עורק הראשי החיצוני (ECA) ועורק הראשי המשותף (CCA).
- בזהירות להפריד את CCA הנכון ICA מן העצב vagus עם microforceps לניתוח כלי דם.
- חשוף את CCA הנכון ואת ICA. חסום את זרימת הדם המגיעה מ- CCA ל- ICA באמצעות מיקרו-קליפים או חוסמי עורקים מיוחדים לניתוח כלי דם. בצע חתך (כ 1 מ"מ) על ICA באמצעות microscissors לניתוח כלי דם.
- הכנס קטטר monofilament (4-0 ניילון) ישירות דרך ICA, על 18.5-19 מ"מ מנקודת bifurcation של CCA הימני לתוך המעגל של ויליס עד להגיע התנגדות קלה, כדי לחסום את MCA26.
- ליגייט סביב ICA מעל bifurcation של CCA.
- עבור קבוצת הביקורת המופעלת באמצעות sham, בצע הוספה של חוט ניילון במקום שלבים 3.5 ו- 3.616,22.
- לנהל 5 מ"ל של 0.9% נתרן כלורי על ידי הזרקה תוך-פריטונית.
- סגור את הפצע על ידי תפר ולקחת את החולדה לאזור התאוששות.
הערה: כמה דקות לאחר תום ההרדמה, החולדה תתעורר ותנוע באופן עצמאי סביב הכלוב. - ב 23 שעות לאחר MCAO, להזריק 2% אוונס כחול מלוחים (4 מ"ל / קילוגרם)23,26 לתוך וריד הזנב עבור שתי הקבוצות המופעלות באמצעות קנולה27.
הערה: זה משמש כמעקב חדירות דם - מוח. אפשר להסתובב במשך 60 דקות.
4. קביעת אזור אוטם
- מידה IZ ב 24 שעות לאחר MCAO כמתואר קודם לכן9,15,18,19,26.
הערה: חולדות שאיבדו יותר מ -20% ממשקל משקלן או פיתחו התקפים או hemiplegia אינן נכללות בניסוי. - המתת לחות החולדה על ידי החלפת תערובת הגז בהשראת 20% חמצן ו 80% פחמן דו חמצני עד החולדה מפסיק לנשום באופן ספונטני.
- פתח את החזה עם חתך רוחבי 5-6 ס"מ דרך דופן הבטן מתחת לכלוב הצלעות באמצעות מספריים ומלקחיים כירורגיים.
- בצע חתך סרעפתי לאורך כל כל כלוב הצלעות עם מספריים ומלקחיים כירורגיים.
- בזהירות עקירת הריאות, לחתוך דרך כלוב הצלעות עד עצם הבריח בצד ימין ושמאל28.
- לחלחל עם 200 מ"ל של מלוחים נורמלי דרך החדר השמאלי של הלב.
- לנקב או להסית את האטריום הנכון של הלב עם מספריים.
- בצע עריפת ראש באמצעות גיליוטינה ולאסוף רקמת מוח.
- באמצעות מספריים איריס, לחתוך מן מגנום foramen לקצה דיסטלי של משטח הגולגולת האחורי משני הצדדים.
- להפריד את נורות הריח, חיבורים עצביים לאורך פני השטח הגחוניים ואת פני השטח הגביים של הגולגולת מהמוח.
- הסר את המוח מהראש.
- הפק 6 פרוסות מוח על-ידי יצירת מקטעים אופקיים בעובי 2 מ"מ עם פלדת אל-חלד "0.009, לא צ'יצוק, סכין גילוח בעל קצה יחיד.
- דגירה במשך 30 דקות ב 37 °C (69 °F) ב 0.05% TTC.
- הנח את רקמת המוח על שקופיות המיקרוסקופ ובצע סריקה אופטית של 6 פרוסות מוח אלה ברזולוציה של 1600x1600 dpi (ראה תוספת 1 למשל).
- הוסיפו מסנן כחול עם עורך תמונות (למשל, Adobe Photoshop CS2) באמצעות הפונקציה Channel Mixer (Image > Adjustments > Channel Mixer)ושמרו את התמונה כתבנית קובץ JPEG.
הערה: לאחר החלת המסנן הכחול, התמונה תופיע בגווני אפור. - פתח את התמונה השמורה ב- ImageJ 1.37v29,30.
הערה: תוכנית מחשב זו משתמשת בפונקציית סף כדי לבודד ולחשב את הפיקסלים בשחור-לבן (ראו איור 1). - עבור כל אחת מ-6 פרוסות המוח של התמונה, בחרו ושמרו כל חצי כדור (ימין פצוע ipsilateral ושמאלה ללא פגע) כקובץ תמונה נפרד באמצעות הכלי "בחירת מצולע" מהתפריט הראשי.
- קבעו את הניתוק לקביעת IZ באמצעות פונקציית סף אוטומטית מהתפריט הראשי של תוכנת ImageJ באמצעות בחירה באפשרות 'תמונה' > 'התאם' > 'סף'ומדידת מספר הפיקסלים בכל חצי כדור של ערכת מוח אחת.
הערה: ניתן להשתמש בפקודות מאקרו עבור שלב זה בתוכנת ImageJ (ראה תוספת 2 עבור הקוד). החיתוך הוא פרמטר קריטי לקביעת הפיקסלים שיש להמיר ללבן ואיזה להמיר לשחור בהתאם לגוון האפור (ראה תוספת 3 ו-תוסף 4 כדוגמאות). לאחר מכן ImageJ משווה פיקסלים לבנים ושחורים כדי לקבוע IZ. בהתבסס על פרוטוקול הכתמים והגדרות הסורק, השתמשנו בערך מנותק קבוע של 0.220. - בצע מדידה של תיקון IZ לנפיחות ברקמות באמצעות היחסים של חצי הכדור המוחי Ipsilateral ו Contralateral (RICH) שיטה13,23 (ראה דוגמה תוספת 5).
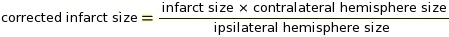
הערה: גודל האוטם מוערך כאחוז מחצי הכדור הנגדי.
5. קביעת בצקת במוח31
הערה: השתמש ImageJ 1.37v למדידה של BE32,33.
- מידה BE 24 שעות אחרי מקאו. לחישוב BE, השתמש בנתונים מאמצעי אחסון בחצי הכדור השמאלי והימני (ביחידות).
- בצע סריקה אופטית ברזולוציה של 1600x1600 dpi (ראה תוספת 1 למשל).
- בחר את ההמיספרות במוח והגדר את הניתוק לקביעת BE עם ImageJ 1.37v, כמתואר לעיל בסעיפים 4.17-4.19.
- בטא את אזור BE כאחוז מהאזורים הסטנדרטיים בחצי הכדור הנגדי שלא הושפע, המחושב על-ידי שיטת RICH באמצעות המשוואה הבאה (ראה דוגמה בתוספת 5)23,34.

הערה: היקף BE מוערך כאחוז מחצי הכדור הנגדי.
6. קביעת שיבוש BBB
- למדוד שיבוש BBB 24 שעות אחרי MCAO.
- מחלקים את ההמיספרות הימנית והשמאלית לשש פרוסות ומכניסים כל אחת מהן לצינור מיקרוצנטריפוגה.
- הומוגניזציה כל פרוסה של רקמת המוח בחומצה טריכלורואצטית, בהתבסס על חישוב של 1 גרם של רקמת המוח ב 4 מ"ל של 50% חומצה טריכלורואצטית.
- צנטריפוגה ב 10,000 x g במשך 20 דקות.
- לדלל נוזל על טבעי 1:3 עם 96% אתנול.
- בצע ספקטרופוטומיות זוהרת על ידי שימוש בתוכנת ספקטרופוטומטריה, התקנת הצלחת וביצוע קריאה לדוגמה באמצעות הפרמטרים הבאים: אורך גל עירור עוצמת פלואורסצנטי של 620 ננומטר (רוחב פס 10 ננומטר) ואורך גל פליטה של 680 ננומטר (רוחב פס 10 ננומטר)23,35 ; Mod העליון; מספר בשר 25; מדריך 100; רועד 1 שניות, 1 מ"מ.
הערה: השתמש באורך גל עירור של 620 ננומטר (רוחב פס 10 ננומטר) ואורך גל פליטה של 680 ננומטר (רוחב פס 10 ננומטר). 23,35
תוצאות
מדידת אזור אוטם
בדיקת T מדגם עצמאי הצביעה על כך ש-19 חולדות שעברו MCAO קבוע הראו עלייה משמעותית בנפח אוטם המוח בהשוואה ל-16 החולדות המופעלות על ידי זיוף (MCAO=7.49% ± 3.57 לעומת 3.57 לעומת. שאם = 0.31% ± 1.9, t(28.49) = 7.56, p < 0.01 (ראה איור 2A)). הנתונים באים לידי ביטוי כ...
Discussion
המטרה העיקרית של הפרוטוקול הנוכחי הייתה להפגין מדידות עקביות של שלושה פרמטרים עיקריים של פגיעה איסכמית: חדירות IZ, BE ו- BBB. מחקרים קודמים בתחום זה הראו את האפשרות לבצע אחד או שניים של פרמטרים אלה יחד באותו מדגם. מלבד הפחתת העלויות שמציעה שיטה בת שלושה חלקים זו, היא גם מספקת מודל ביו-אתי רצוי י?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים למריאנה קושריבה, מקסים קריבונוסוב, דרינה יאקומנקו ויבגניה גנצ'ריק מהמחלקה לפיזיולוגיה, הפקולטה לביולוגיה, אקולוגיה ורפואה, אולס הונצ'ר, אוניברסיטת דניפרו, דניפרו, אוקראינה על תמיכתם ותרומתם המועילה לדיונים שלנו. הנתונים המתקבלים הם חלק מתזה לדוקטורט של רוסלן קוטס.
Materials
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
References
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved