このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
げっ歯類の脳サンプルの単一のセットで脳卒中後脳浮腫、梗塞ゾーンおよび血液脳関門破壊を測定する
* これらの著者は同等に貢献しました
要約
このプロトコルは、げっ歯類の脳サンプルの同じセット上の虚血性脳損傷の3つの最も重要なパラメータを測定する新しい技術を記述する。1つの脳サンプルのみを使用することは、倫理的および経済的コストの面で非常に有利である。
要約
世界的に罹患率と死亡率の最も一般的な原因の1つは虚血性脳卒中である。歴史的に、虚血性脳卒中を刺激するために使用される動物モデルは、中大脳動脈閉塞(MCAO)を含む。梗塞領域、脳浮腫および血液脳関門(BBB)の内訳は、MCAO後の脳損傷の程度を反映するパラメータとして測定される。この方法の重要な制限は、これらの測定は通常、異なるラットの脳サンプルで得られ、適切なサンプルサイズのために安楽死させられる必要がある多数のラットのために倫理的および財政的負担を引き起こします。ここでは、同じラット脳の中で梗塞領域、脳浮腫およびBBB透過性を測定することによってMCAOに続く脳損傷を正確に評価する方法を提示する。この新しい技術は、脳卒中の病態生理を評価するより効率的な方法を提供する。
概要
世界的に罹患率と死亡率の最も一般的な原因の1つは脳卒中です。世界的に、虚血性脳卒中は全脳卒中症例の68%を占め、米国では虚血性脳卒中が脳卒中症例1,2の87%を占める。脳卒中の経済的負担は、米国では240億ドル、欧州連合(EU)では450億ユーロに達すると推定されています。脳卒中の動物モデルは、その病態生理学を研究し、評価のための新しい方法を開発し、新しい治療オプションを提案するために必要です4.
虚血性脳卒中は、大脳動脈の閉塞で起こり、通常は中大脳動脈またはその枝の1つである5。したがって、虚血性脳卒中のモデルは、歴史的に中大脳動脈閉塞(MCAO)6、7、8、9、10、11、12を含む。MCAOに続いて、 神経損傷は、2,3,5トリフェニルテトラゾリウムクロリド(TTC)染色法13、脳浮腫(BE)を乾燥または半球量14、15、16、および血液脳関門(BBB)透過性を、エバンスブルー17を用いた透過性を測定することによって最も一般的に評価される。
従来のMCAO法は、3つの脳の測定のそれぞれのために別々の脳のセットを使用しています。サンプルサイズが大きい場合、これは、倫理的および財政的な考慮事項を追加して、安楽死させた動物のかなりの数になります。これらのコストを軽減する別の方法は、MCAO後げっ歯類の脳の単一のセットで3つのパラメータすべての測定を含むであろう。
以前の試みは、同じ脳サンプル内のパラメータの組み合わせを測定するために行われています.同時免疫蛍光染色法20 は、他の分子及び生化学的分析21 と同様に、同じ脳試料中でTTC染色後に記載されている。我々は以前に脳浮腫を評価するために脳半球の体積を計算し、同じ脳セット15で梗塞領域を計算するためにTTC染色を行った。
本プロトコルでは、同じ齧歯類脳の中でIZ、BE、BBB透過性を判定することで虚血性脳損傷を測定する改変MCAO技術を提示する。IZはTTC染色法により測定され、BEは半球体積を算出して求められ、BBB透過性は分光法19により得られる。このプロトコルでは、内部頸動脈(ICA)へのモノフィラメントカテーテルの直接挿入および固定に基づく改変MCAOモデルを用いた、および中大脳動脈(MCA)22への血流のさらなる遮断を用いた。この修飾方法は、従来のMCAO法16,22と比較して死亡率および罹患率の低下率を示す。
この新しいアプローチは、MCAO後の神経損傷を測定するための財政的に健全で倫理的なモデルを提供します。虚血性脳損傷の主なパラメータのこの評価は、その病態生理学を包括的に調査するのに役立ちます。
プロトコル
以下の手順は、ヘルシンキ宣言及び東京宣言及び欧州共同体の実験動物使用に関するガイドラインに従って行われた。実験はまた、ネゲブのベングリオン大学で動物ケア委員会によって承認されました.
実験手順のための1.ラットの準備
- 成人オスのスプレイグ・ドーリーラットを、あから過ぎの病理を伴わず、それぞれ300〜350gの重さを選択する。
- 実験前に12時間の明暗サイクルで、室温で全てのラットを22°Cで維持します。
- 食べ物と水がアドリビタムで利用できることを確認してください。
- 6:00 a. .m~ 2:00 p.m の間ですべての手順を実行します。
2. 手術用のラットの準備
- イオブルラン(誘導で4%、維持のために2%)と24%の酸素(1.5 L /分)でラットを30分間麻酔します。
- 彼らはペダル離脱反射を持っていないことを確認することにより、ラットの麻酔のレベルをテストします。
- 24ゲージのカテーテルを尾静脈に挿入します。
注意:血管拡張のための尾の温暖化は行われません。- テーブルの上にネズミを置いて、上の位置に置きます。医療テープを使用して、ラットの四肢4本すべてを貼り付けます。
- 温度測定のためのプローブを手術前にラット直腸に入れる。
- 手順の間、37°Cのコア体温を支える加熱プレートを維持する。
- 保護のためにラットの目の両方に軟膏を追加します。
- 手術領域を剃り、10%ポビドネヨウ素の3つのアプリケーションで消毒し、続いて70%イソプロピルアルコールを行います。
3. 右側中大脳動脈閉塞
注:MCAOは、以前に説明した16、22、23のように、マクガリーら24およびUluçら.25によって記述された楽器を使用して、修正された技術によって行われる。
- 外科的ピンセットと湾曲した刃のはさみで首の腹側の正中線で皮膚および表面性筋膜を解剖する。
- 筋肉三角形を識別します, ICAからなります, 外耳頸動脈 (ECA) と一般的な頸動脈 (CCA).
- 血管手術用のマイクロ鉗子で、右のCCAとICAを迷走神経から慎重に分離します。
- 正しい CCA と ICA を公開します。血管手術用のマイクロクリップまたは特別な止血帯を使用して、CCAからICAへの血流を遮断します。血管手術用マイクロシザーを使用してICAを切開(約1mm)します。
- モノフィラメントカテーテル(4-0ナイロン)をICAを介して直接挿入し、右CCAの分岐点から約18.5〜19mmをウィリスの円に入れ、軽度の抵抗に達するまで、MCA26を閉塞させる。
- CCAの分岐の上のICAの周りにリゲート。
- シャム操作制御グループの場合、手順 3.5 および 3.616、22の代わりにナイロンスレッドの挿入を実行します。
- 腹腔内注射により0.9%塩化ナトリウムの5mLを投与する。
- 縫合によって創傷を閉じ、ラットを回復領域に連れて行く。
注:麻酔が終わる数分後、ラットは目を覚まし、ケージの周りを独立して移動します。 - MCAOの後23時間で、2%のエバンスブルーを生理食アルカリ(4mL/kg)23、26をカニューレ27を介して両方の操作されたグループの尾静脈に注入する。
注:これは、血液脳透過性トレーサーとして使用されます。60分間循環させます。
4. 梗塞領域の決定
- 前述の9、15、18、19、26のように MCAO の後の24時間で IZを測定します。
注:体重の20%以上を失った、または発作や片麻痺を発症したラットは、実験から除外されます。 - ラットが自然呼吸を停止するまで、インスピレーションを受けたガス混合物を20%の酸素と80%の二酸化炭素に置き換えることによってラットを安楽死させる。
- はさみと外科用鉗子を使用して、肋骨ケージの下の腹壁を通して5〜6センチメートルの横切開で胸を開きます。
- はさみと外科用鉗子で肋骨のケージの全長に沿って横隔膜切開を行う。
- 慎重に肺を置き換え、リブケージを左右28の鎖骨まで切り取る。
- 心臓の左心室を通って正常な生理液の200 mLとパーフューズ。
- 穿刺またははさみで心臓の右心房を切開します。
- ギロチンを使用して切断を行い、脳組織を収集します。
- 虹彩はさみを使用して、両側の後頭蓋表面の遠位縁に前部マグナムからカットします。
- 嗅球、腹側表面に沿った神経質なつながり、頭蓋骨の側側表面を脳から分離する。
- 頭から脳を取り除きます。
- .009"ステンレススチール、コーティングされていない、単一エッジカミソリブレードを備えた2mm厚い水平セクションを作成することで、6つの脳スライスを作成します。
- 37°Cで30分間インキュベートして0.05%TTCで行います。
- 顕微鏡スライド上に脳組織を配置し、1600x1600 dpiの解像度でこれらの6脳スライスの光学スキャンを実行します(例えば 、補足1 を参照してください)。
- チャンネルミキサー機能(画像/調整/チャンネルミキサー)を使用して、フォトエディタ(例えばアドビフォトショップCS2)で青いフィルタを追加し、画像をJPEGファイル形式で保存します。
注: 青いフィルターを適用すると、イメージはグレースケールで表示されます。 - 保存したイメージを ImageJ 1.37v29,30で開きます。
注 : このコンピュータ プログラムでは、しきい値機能を使用して、黒または白のピクセルを分離して計算します ( 図 1を参照)。 - 画像の6つの脳のスライスのそれぞれについて、メインメニューから「ポリゴン選択」ツールを使用して、各半球(右の負傷したイプシララルと左の傷のない矛盾)を別々の画像ファイルとして選択して保存します。
- ImageJ ソフトウェアのメイン メニューから自動しきい値関数を使用して、 イメージ/調整/しきい値を選択して IZ を決定するためのカットオフを設定し、1 つの脳セットの各半球のピクセル数を測定します。
メモ:マクロは、ImageJソフトウェアのこの手順で使用することができます(コードについては 補足2 を参照してください)。カットオフは、白に変換するピクセルと、グレーの陰影に応じて黒に変換するピクセルを決定するための重要なパラメータです(例として 、補足 3 と 補足 4 を 参照)。次に、ImageJ は白と黒のピクセルを比較して IZ を決定します。染色プロトコルとスキャナの設定に基づいて、一定のカットオフ値0.220を使用しました。 - イプシ側および逆側大脳半球(RICH)法13,23を用いて組織膨潤のIZ補正の測定を行う(補足5の例を参照)。
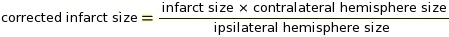
注: 梗塞のサイズは、対側半球の割合として評価されます。
5. 脳浮腫の測定31
注意:BE32、33の測定にはImageJ1.37vを使用してください。
- MCAOの後に24時間を測定してください。BE の計算には、左と右半球の体積のデータを使用します (単位)。
- 1600x1600 dpi の解像度で光学スキャンを実行します( 例えば、補足 1 を 参照)。
- 脳半球を選択し、上記のセクション 4.17-4.19 で説明したように、ImageJ 1.37v で BE を決定するためのカットオフを設定します。
- 次の式を使用してRICH法によって計算される、影響を受けない対側半球の標準面積の割合としてBE領域を表現する(補足5の例を参照して、23,34。

注: BE の範囲は、対側半球の割合として評価されます。
6. BBBの中断の決定
- MCAO の後で BBB の中断を測定します。
- 左右半球を6つのスライスに分け、それぞれをマイクロ遠心分離チューブに入れます。
- 50%トリクロロ酢酸の4 mLにおける脳組織の1gの計算に基づいて、トリクロロ酢酸で脳組織の各スライスを均質化する。
- 20分間10,000 x g で遠心分離機。
- 上清液を1:3に96%エタノールで希釈する。
- 分光光度測定ソフトウェアを利用して発光分光度測定を行い、プレートを設置し、次のパラメータを用いてサンプル読み取りを行います:蛍光強度励起波長620nm(帯域幅10nm)および発光波長680nm(帯域幅10nm)23,35;モッドトップ;数肉25;マニュアル100;1秒、1mm振る。
注: 励起波長は 620 nm (帯域幅 10 nm) で、発光波長は 680 nm (帯域幅 10 nm) を使用してください。23,35
結果
梗塞ゾーン測定
独立サンプルt-テストでは、永久的MCAOを受けた19匹のラットが、3.57ラット対シャム=0.31%± ±1.9、t(28.49)=7.56、p<0.01(図2)と比較して脳梗塞容積が有意に増加したことを示した(図2A)。データは、SDの反側半球±平均パーセントとして表されます。
脳浮腫測定
?...
ディスカッション
本プロトコルの主な目標は、虚血性損傷の3つの主要なパラメータの一貫した測定を実証することであった:IZ、BEおよびBBB透過性。この分野の以前の研究は、同じサンプルでこれらのパラメータの1つまたは2つを一緒に実行する可能性を実証しました。この3部構成の方法が提供するコスト削減に加えて、手術とその後の安楽死化しなければならない動物の数を制限するより望ましい生物倫理モ?...
開示事項
著者らは開示するものは何もない。
謝辞
マリナ・クシェリアヴァ、マクシム・クリヴォノソフ、ダリーナ・ヤクメンコ、エフゲニア・ゴンチャリク生物学・生態学・医学部、オレス・ホンチャリク、ドニプロ大学、ドニプロ、ウクライナの皆様のご支援、そして私たちの議論への貢献に感謝します。得られたデータは、ルスラン・クッツ博士課程の一部です。
資料
| Name | Company | Catalog Number | Comments |
| 2 mL Syringe | Braun | 4606027V | |
| 2% chlorhexidine in 70% alcohol solution | Sigma-Aldrich | 500 cc | Provides general antisepsis of the skin in the operatory field |
| 27 G Needle with Syringe | Braun | 305620 | |
| 3-0 Silk sutures | Henry Schein | 1007842 | |
| 4-0 Nylon suture | 4-00 | ||
| Brain & Tissue Matrices | Sigma-Aldrich | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 183603985447 | |
| Centrifuge Sigma 2-16P | Sigma-Aldrich | Sigma 2-16P | |
| Compact Analytical Balances | Sigma-Aldrich | HR-AZ/HR-A | |
| Digital weighing scale | Sigma-Aldrich | Rs 4,000 | |
| Dissecting scissors | Sigma-Aldrich | Z265969 | |
| Eppendorf pipette | Sigma-Aldrich | Z683884 | |
| Eppendorf tube | Sigma-Aldrich | EP0030119460 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | Model: Infinite 200 PRO multimode reader | Optional. |
| Fluorescence detector | Molecular Devices LLC | VWR cat. # 10822 512 SpectraMax Paradigm Multi Mode Microplate Reader Base Instrument | Optional. |
| Gauze sponges | Fisher | 22-362-178 | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Hemostatic microclips | Sigma-Aldrich | ||
| Horizon-XL | Mennen Medical Ltd | ||
| Infusion cuff | ABN | IC-500 | |
| Micro forceps | Sigma-Aldrich | ||
| Micro scissors | Sigma-Aldrich | ||
| Multiset | Teva Medical | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Operating forceps | Sigma-Aldrich | ||
| Operating scissors | Sigma-Aldrich | ||
| Optical scanner | Canon | Cano Scan 4200F | Resolution 3200 x 6400 dpi |
| Petri dishes | Sigma-Aldrich | P5606 | |
| Purina Chow | Purina | 5001 | Rodent laboratory chow given to rats, mice and hamster is a life-cycle nutrition that has been used in biomedical research for over 5 decades. Provided to rats ad libitum in this experiment. |
| Rat cages | Techniplast | 2000P | Conventional housing for rodents. Cages were used for housing rats throughout the experiment |
| Scalpel blades #11 | Sigma-Aldrich | S2771 | |
| Software | |||
| Adobe Photoshop CS2 for Windows | Adobe | ||
| ImageJ 1.37v | NIH | The source code is freely available. The author, Wayne Rasband (wayne@codon.nih.gov), is at the Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | |
| SPSS Statistics 22 | IBM | ||
| Office 365 ProPlus | Microsoft | - | Microsoft Office Excel |
| Windows 10 | Microsoft | ||
| Reagents | |||
| 2,3,5-Triphenyltetrazolium chloride | Sigma-Aldrich | 298-96-4 | |
| 50% trichloroacetic acid | Sigma-Aldrich | 76-03-9 | |
| Ethanol 96 % | Romical | Flammable liquid | |
| Evans blue 2% | Sigma-Aldrich | 314-13-6 | |
| Isoflurane, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 |
参考文献
- Krishnamurthi, R. V., et al. Global and regional burden of first-ever ischaemic and haemorrhagic stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet Global Health. 1, 259-281 (2013).
- Benjamin, E. J., et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 135, 146 (2017).
- Wilkins, E., et al. . European cardiovascular disease statistics 2017. , (2017).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Lloyd-Jones, D., et al. Heart disease and stroke statistics--2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation. 119, 480-486 (2009).
- Shigeno, T., McCulloch, J., Graham, D. I., Mendelow, A. D., Teasdale, G. M. Pure cortical ischemia versus striatal ischemia. Circulatory, metabolic, and neuropathologic consequences. Surgical Neurology. 24, 47-51 (1985).
- Albanese, V., Tommasino, C., Spadaro, A., Tomasello, F. A transbasisphenoidal approach for selective occlusion of the middle cerebral artery in rats. Experientia. 36, 1302-1304 (1980).
- Hudgins, W. R., Garcia, J. H. Transorbital approach to the middle cerebral artery of the squirrel monkey: a technique for experimental cerebral infarction applicable to ultrastructural studies. Stroke. 1, 107-111 (1970).
- Waltz, A. G., Sundt, T. M., Owen, C. A. Effect of middle cerebral artery occlusion on cortical blood flow in animals. Neurology. 16, 1185-1190 (1966).
- Tamura, A., Graham, D. I., McCulloch, J., Teasdale, G. M. Focal cerebral ischaemia in the rat: 1. Description of technique and early neuropathological consequences following middle cerebral artery occlusion. Journal of Cerebral Blood Flow & Metabolism. 1, 53-60 (1981).
- Aspey, B. S., Cohen, S., Patel, Y., Terruli, M., Harrison, M. J. Middle cerebral artery occlusion in the rat: consistent protocol for a model of stroke. Neuropathology and Applied Neurobiology. 24, 487-497 (1998).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20, 84-91 (1989).
- O'Brien, M. D., Jordan, M. M., Waltz, A. G. Ischemic cerebral edema and the blood-brain barrier. Distributions of pertechnetate, albumin, sodium, and antipyrine in brains of cats after occlusion of the middle cerebral artery. Archives of Neurology. 30, 461-465 (1974).
- Chen, C. H., Toung, T. J., Sapirstein, A., Bhardwaj, A. Effect of duration of osmotherapy on blood-brain barrier disruption and regional cerebral edema after experimental stroke. Journal of Cerebral Blood Flow & Metabolism. 26, 951-958 (2006).
- Boyko, M., et al. Establishment of Novel Technical Methods for Evaluating Brain Edema and Lesion Volume in Stroked Rats: a Standardization of Measurement Procedures. Brain Research. , (2019).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Sifat, A. E., Vaidya, B., Abbruscato, T. J. Blood-Brain Barrier Protection as a Therapeutic Strategy for Acute Ischemic Stroke. AAPS Journal. 19, 957-972 (2017).
- Jiang, X., et al. Blood-brain barrier dysfunction and recovery after ischemic stroke. Progress in Neurobiology. 163-164, 144-171 (2018).
- Belayev, L., Busto, R., Zhao, W., Ginsberg, M. D. Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats. Brain Research. 739, 88-96 (1996).
- Li, L., Yu, Q., Liang, W. Use of 2,3,5-triphenyltetrazolium chloride-stained brain tissues for immunofluorescence analyses after focal cerebral ischemia in rats. Pathology - Research and Practice. 214, 174-179 (2018).
- Kramer, M., et al. TTC staining of damaged brain areas after MCA occlusion in the rat does not constrict quantitative gene and protein analyses. Journal of Neuroscience Methods. 187, 84-89 (2010).
- Kuts, R., et al. A middle cerebral artery occlusion technique for inducing post-stroke depression in rats. Journal of Visualized Experiments. , e58875 (2019).
- Kuts, R., et al. A Novel Method for Assessing Cerebral Edema, Infarcted Zone and Blood-Brain Barrier Breakdown in a Single Post-stroke Rodent Brain. Frontiers in Neuroscience. 13, 1105 (2019).
- McGarry, B. L., Jokivarsi, K. T., Knight, M. J., Grohn, O. H. J., Kauppinen, R. A. A Magnetic Resonance Imaging Protocol for Stroke Onset Time Estimation in Permanent Cerebral Ischemia. Journal of Visualized Experiments. , e55277 (2017).
- Uluc, K., Miranpuri, A., Kujoth, G. C., Akture, E., Baskaya, M. K. Focal cerebral ischemia model by endovascular suture occlusion of the middle cerebral artery in the rat. Journal of Visualized Experiments. , e1978 (2011).
- Boyko, M., et al. The effect of blood glutamate scavengers oxaloacetate and pyruvate on neurological outcome in a rat model of subarachnoid hemorrhage. Neurotherapeutics. 9, 649-657 (2012).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. , e58875 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. , e3564 (2012).
- Poinsatte, K., et al. Quantification of neurovascular protection following repetitive hypoxic preconditioning and transient middle cerebral artery occlusion in mice. Journal of Visualized Experiments. , e52675 (2015).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (2018)
- Boyko, M., et al. Pyruvate's blood glutamate scavenging activity contributes to the spectrum of its neuroprotective mechanisms in a rat model of stroke. European Journal of Neuroscience. 34, 1432-1441 (2011).
- Collins, T. J. ImageJ for microscopy. Biotechniques. 43, 25-30 (2007).
- . ImageJ, U. S. National Institutes of Health Available from: https://imagej.nih.gov/ij (1997)
- Kaplan, B., et al. Temporal thresholds for neocortical infarction in rats subjected to reversible focal cerebral ischemia. Stroke. 22, 1032-1039 (1991).
- Kumai, Y., et al. Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability. Journal of Cerebral Blood Flow & Metabolism. 27, 1152-1160 (2007).
- Schuleri, K. H., et al. Characterization of peri-infarct zone heterogeneity by contrast-enhanced multidetector computed tomography: a comparison with magnetic resonance imaging. Journal of the American College of Cardiology. 53, 1699-1707 (2009).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules. 24, (2019).
- Di Napoli, M. Caplan's Stroke: A Clinical Approach. Journal of the American Medical Association. 302, 2600-2601 (2009).
- Deb, P., Sharma, S., Hassan, K. M. Pathophysiologic mechanisms of acute ischemic stroke: An overview with emphasis on therapeutic significance beyond thrombolysis. Pathophysiology. 17, 197-218 (2010).
- Simard, J. M., Kent, T. A., Chen, M., Tarasov, K. V., Gerzanich, V. Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications. Lancet Neurology. 6, 258-268 (2007).
- Klatzo, I. Pathophysiological aspects of brain edema. Acta Neuropathology. 72, 236-239 (1987).
- Yang, Y., Rosenberg, G. A. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease. Stroke. 42, 3323-3328 (2011).
- Lin, T. N., He, Y. Y., Wu, G., Khan, M., Hsu, C. Y. Effect of brain edema on infarct volume in a focal cerebral ischemia model in rats. Stroke. 24, 117-121 (1993).
- Liu, C., et al. Increased blood-brain barrier permeability in contralateral hemisphere predicts worse outcome in acute ischemic stroke after reperfusion therapy. Journal of NeuroInterventional Surgery. 10, 937-941 (2018).
- Boyko, M., et al. Establishment of novel technical methods for evaluating brain edema and lesion volume in stroked rats: A standardization of measurement procedures. Brain Research. 1718, 12-21 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved