A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מוצלח בהדמיית סידן Vivo עם מיקרוסקופ מיניאטורי ראש הר באמיגדלה של עכבר מתנהג בחופשיות
In This Article
Summary
דימות סידן מיקרונדוסקופי In vivo הוא כלי רב ערך המאפשר ניטור בזמן אמת של פעילויות עצביות בבעלי חיים מתנהגים בחופשיות. עם זאת, יישום טכניקה זו על האמיגדלה היה קשה. פרוטוקול זה נועד לספק קו מנחה שימושי עבור מיקוד מוצלח תאי אמיגדלה עם מיקרוסקופ מיניאטורי בעכברים.
Abstract
ניטור בזמן אמת של פעילויות עצביות בבעלי חיים הנעים בחופשיות היא אחת הגישות המרכזיות לקשר פעילות עצבית להתנהגות. לשם כך, טכניקת דימות in vivo המזהה סידן חולף בנוירונים באמצעות מחווני סידן מקודדים גנטית (GECIs), מיקרוסקופ פלואורסצנטי מיניאטורי, ועדשת שבירה הדרגתית (GRIN) פותחה ויושמה בהצלחה על מבני מוח רבים1,2,3,4,5,6. טכניקת הדמיה זו חזקה במיוחד משום שהיא מאפשרת הדמיה סימולטנית כרונית של אוכלוסיות תאים מוגדרות גנטית לתקופה ארוכת טווח של עד מספר שבועות. למרות השימושיות, טכניקת הדמיה זו לא יושמה בקלות על מבני מוח המאתרים עמוק בתוך המוח כגון אמיגדלה, מבנה מוח חיוני לעיבוד רגשי וזיכרון פחד אסוציאטיבי7. ישנם מספר גורמים המקשה ליישם את טכניקת ההדמיה על האמיגדלה. לדוגמה, ממצאי תנועה מתרחשים בדרך כלל בתדירות גבוהה יותר במהלך ההדמיה שנערכה באזורי המוח העמוקים יותר מכיוון שמיקרוסקופ להרכבה על הראש המושתל עמוק במוח הוא יחסית לא יציב. בעיה נוספת היא כי החדר לרוחב ממוקם קרוב לעדשת GRIN המושתלת ותנועתו במהלך הנשימה עלולה לגרום לחפצי תנועה לא סדירים מאוד שלא ניתן לתקן בקלות, מה שמקשה על יצירת תצוגת הדמיה יציבה. יתר על כן, מכיוון שתאים באמיגדלה שקטים בדרך כלל במצב מנוחה או הרדמה, קשה למצוא ולמקד את תאי היעד המבטאים GECI באמיגדלה במהלך הליך baseplating להדמיה מאוחרת יותר. פרוטוקול זה מספק קו מנחה מועיל כיצד למקד ביעילות תאים המבטאים GECI באמיגדלה עם מיקרוסקופ מיניאטורי להרכבה על הראש להדמיה מוצלחת של סידן ויוו באזור מוח כה עמוק. יצוין כי פרוטוקול זה מבוסס על מערכת מסוימת (למשל, אינסקופיקס) אך אינו מוגבל אליה.
Introduction
סידן הוא שליח שני בכל מקום, ממלא תפקיד מכריע כמעט בכל פונקציות הסלולר8. בנוירונים, ירי פוטנציאלי פעולה וקלט סינפטי לגרום לשינוי מהיר של חינם תאיים [Ca2+]9,10. לכן, מעקב אחר סידן חולף מספק הזדמנות לפקח על פעילות עצבית. GECIs הם כלים רבי עוצמה המאפשרים ניטור [Ca2+] באוכלוסיות תאים מוגדרות ותאים פנים-תאיים11,12. בין סוגים רבים ושונים של מחוון סידן מבוסס חלבון, GCaMP, בדיקה Ca2 + המבוססת על מולקולת GFP אחת13, הוא GECI אופטימיזציה ביותר ולכן בשימוש נרחב. באמצעות סבבים מרובים של הנדסה, מספר גרסאות של GCaMP פותחה12,14,15,16. אנו משתמשים באחד GCaMP שפותחו לאחרונה, GCaMP7b, בפרוטוקול זה16. חיישני GCaMP תרמו רבות לחקר תפקודי מעגלים עצביים במספר אורגניזמים לדוגמה כגון הדמיה של Ca2 + חולפים במהלך הפיתוח17, בהדמיית vivo בשכבה קליפתית ספציפית18, מדידת דינמיקת מעגלים בלמידה מוטורית19 והדמיה של פעילות הרכב התא הקשורה לזיכרון הפחד האסוציאטיבי בהיפוקמפוס ובאמיגדלה20,21.
הדמיה אופטית של GECIs יש מספר יתרונות22. קידוד גנטי מאפשר ל-GECIs לבוא לידי ביטוי ביציבות לתקופה ארוכת טווח בקבוצת משנה ספציפית של תאים המוגדרים על ידי פרופיל גנטי או דפוסים ספציפיים של קישוריות אנטומית. הדמיה אופטית מאפשרת ניטור בו זמנית של מאות עד אלפי נוירונים בבעלי חיים. כמה מערכות הדמיה אופטית פותחו עבור הדמיה ואנליזה של GECIs בתוך המוח של עכברים מתנהגים בחופשיות עם מיקרוסקופים פלואורסצנטיים מיניאטוריים הר הראש21,23,24,25. למרות טכניקת ההדמיה האופטית in vivo המבוססת על GECIs, עדשת GRIN, ומיקרוסקופ מיניאטורי להרכבת ראש להיות כלי רב עוצמה ללמוד את הקשר בין פעילות מעגל עצבי והתנהגות, החלת טכנולוגיה זו על האמיגדלה כבר קשה בשל מספר בעיות טכניות הקשורות מיקוד עדשת GRIN לתאים המבטאים GECIs באמיגדלה מבלי לגרום חפצי תנועה להפחית באופן חמור את איכות רכישת התמונה ומציאת תאים המבטאים GECIs. פרוטוקול זה נועד לספק קו מנחה מועיל עבור הליכים כירורגיים של התקשרות baseplate והשתלת עדשת GRIN כי הם צעדים קריטיים להדמיית סידן אופטי vivo מוצלח באמיגדלה. למרות פרוטוקול זה מטרות האמיגדלה, רוב ההליכים המתוארים כאן הם בדרך כלל ישימים לאזורים אחרים במוח עמוק יותר. למרות שפרוטוקול זה מבוסס על מערכת מסוימת (למשל, Inscopix), ניתן להשיג בקלות את אותה מטרה עם מערכות חלופיות אחרות.
Protocol
כל ההליכים אושרו על ידי ועדת האתיקה של בעלי החיים במכון המדע והטכנולוגיה המתקדם של קוריאה. כל הניסויים בוצעו בהתאם להנחיית הוועדה המוסדית לטיפול בבעלי חיים ולשימוש בבעלי חיים.
הערה: פרוטוקול זה מורכב משישה שלבים עיקריים: ניתוח הזרקת וירוסים, ניתוח השתלת עדשת GRIN, אימות השתלת עדשת GRIN, חיבור Baseplate, הקלטה אופטית של אות GCaMP במהלך בדיקת התנהגות ועיבוד נתונים (איור 1A). למעט ניתוח, נעשה שימוש בחבילת התוכנה המסחרית (Inscopix).
1. ניתוח סטראוטקסי – הזרקת וירוס AAV
הערה: זן העכבר המשמש בהליך כירורגי זה הוא C57BL6/J. גופו של בעל החיים מכוסה וילון סטרילי במהלך הניתוח וכל השלבים בפרוטוקול מבוצעים עם לבישת כפפות סטריליות. ניתוחים מרובים בדרך כלל אינם מבוצעים באותו יום. עם זאת, אם עכברים מרובים צריכים לעבור את אותו ניתוח באותו יום, להשתמש במערכת נפרדת של כלים כירורגיים autoclaved עבור כל עכבר ו 70% אתנול כדי לחטא את המכשירים הכירורגיים בין עכברים. כדי לשמור על העכבר חם במהלך ההליך הכירורגי, העכבר מכוסה בשמיכה כירורגית בהתאמה אישית לאחר קבוע למסגרת סטראוטקסית.
- לחטא את כל הכלים הכירורגיים הנדרשים עם 70% אתנול, ולהכין מזרק המילטון פיפטה זכוכית. מלאו את פיפט הזכוכית במים מזוקקים.
הערה: כל הכלים הכירורגיים המשמשים בפרוטוקול הם autoclaved. מכיוון שלא ניתן להשתמש בברגים של עדשת GRIN וגולגולת לחיטוי אוטומטי, 70% אתנול משמש כחומר חיטוי למניעת דלקת. למרות שלא נוסה, צורות אחרות של עיקור ניתן להשתמש למשל גז או עיקור כימי. - הרדמה את העכבר עם pentobarbital (83 מ"ג∙ק"ג-1 של משקל הגוף) על ידי הזרקה תוך-אישית. לאחר שהעכבר הופך מחוסר הכרה, לגלח את הפרווה על הגולגולת.
- לנקות את העור מעל הגולגולת עם 70% אתנול ולתקן את העכבר למסגרת סטראוטקסית. הסר בזהירות את העור ולנגב את משטח הגולגולת עם תמיסת מי חמצן 35% באמצעות אפליקטור קצה כותנה. יש למרוח משחת עיניים סיכה כדי למנוע ייבוש קרנית במהלך הניתוח.
הערה: אמנם בדרך כלל אין בעיה עם שימוש 70% אתנול רק להכנת עור אספטי, מומלץ להשתמש 3 סיבובים לסירוגין של חיטוי למשל יוד או פתרון כלורהקסידין, ו 70% אתנול. ריכוז גבוה יותר של מי חמצן משמש בפרוטוקול זה כדי לוודא כי רקמת חיבור על גולגולת העכבר מוסר לחלוטין ככל האפשר, וזה קריטי להפחתת חפץ תנועה במהלך הדמיה מאוחר יותר כי רקמת החיבור על הגולגולת מפריעה התקשרות מוצקה של baseplate לגולגולת. יש לציין כי 35% מי חמצן הוא הרבה יותר גבוה ממה שנעשה בו שימוש בדרך כלל (3 %). - תקן את הסיכה באמצעות מחזיק בדיקה סטראוטקסי. ליישר את הגובה של bregma ו lambda עם הסיכה.
- מצא את המיקום הספציפי על גולגולת העכבר לגולגולת.
הערה: קואורדינטות של האמיגדלה לרוחב (LA) להזרקת וירוסים הן (AP, ML, DV) = ( -1.6 מ"מ, -3.5 מ"מ, -4.3 מ"מ) מ bregma בפרוטוקול זה (AP; פנים-אחורי, ML; מדיאלי-לרוחב, DV; גב-גחוני, כל קיצור מציין מרחק צירי יחסי מן bregma)26. הקואורדינטות צריכות להיות ממוטבות לכל מצב ניסיוני. - לקדוח את משטח הגולגולת (איור 1B). לשטוף שברי גולגולת עם מלוחים אגירת פוספט (PBS). הסר את השכבה הנותרת באמצעות מלקחיים או מחט 27 G.
- בעת קידוח הגולגולת, נסה לא לגעת בשכבת הדורה האחרונה כדי למנוע נזק לפני השטח של רקמת המוח. משטח מוח פגום גורם לדלקת סביב העדשה, אשר גורם חפצי תנועה חמורים ושפעת אוטומטית גבוהה במהלך ההקלטה. גודל הגולגולת הוא 1.6 מ"מ. מהירות המקדחה היא 18,000 סל"ד, וגודל הסיביות הוא 0.6 מ"מ.
- להורדת עדשת GRIN מפני השטח של רקמת המוח של האתר שנקדח לאתר האמיגדלה היעד, לחשב את המרחק בשם "ערך A" על ידי חיסור ההבדל DV בין bregma ואת פני השטח המוח חשוף מתוך קואורדינטת DV של השתלת העדשה, אשר מוגדר על בסיס bregma (4.2 מ"מ במקרה זה, איור 1C).
- טען 3 μL של שמן מינרלי ו 0.7 μL של פתרון וירוס AAV בפיפט זכוכית.
הערה: שמן מינרלי מסייע להפריד פתרון וירוס ומים. 0.7 μL הוא נפח אופטימיזציה עבור הזרקת וירוס לוס אנג'לס שיכול לכסות באופן מלא את לוס אנג'לס. - הסר את הסיכה ממחזיק בדיקה סטראוטקסית ותקן את פיפטה הזכוכית אליו.
- אתר את פיפטה זכוכית באתר ההזרקה שהוזכרו בשלב 1.5. הכנס את פיפטה זכוכית לתוך רקמת המוח לאחר הדימום נעצר לחלוטין.
- להעביר את הווירוס דרך פיפטה זכוכית באמצעות משאבת הזרקה.
הערה: הטיטר של הנגיף צריך להיות גבוה מ 1 x 1013 vg/mL כדי להשיג מספר מספיק של GCaMP הבעת תאים. מהירות ההזרקה היא 0.1 μL / min ומפזרים במשך 10 דקות. אם יש דימום, לשטוף את פני השטח של המוח עם PBS. שמור על פני השטח של המוח רטובים בשלב זה. - לאחר סיום ההזרקה, להסיר את פיפטה זכוכית לאט.
2. ניתוח סטראוטקסי – השתלת עדשת GRIN
הערה: ניתוח השתלת עדשת GRIN הוא השלב הקריטי ביותר בפרוטוקול זה. מאז מהירות איטית עקבית של תנועת עדשת GRIN הוא קריטי עבור השתלת עדשת GRIN מוצלחת, זרוע ניתוח ממונע יכול להיות שימושי. זרוע הניתוח הממונע היא מניפולטור סטראוטקסי הנשלט על ידי תוכנת מחשב. למרות הזרוע הממונעת משמש בפרוטוקול זה, דרכים אחרות ניתן להשתמש גם כל עוד העדשה נעה באופן עקבי ולאט במהלך ההשתלה. מידע מפורט על המכשיר נמצא בטבלת החומרים.
- תקדח את הגולגולת כדי להשתיל שני ברגים בגולגולת. לשטוף את כל שברי הגולגולת עם PBS.
הערה: כדי להפחית את ממצאי התנועה בהדמיה אופטית מאוחרת יותר, נדרשים לפחות שני ברגים. שני ברגי הגולגולת ותנוחת השתל של עדשת GRIN יוצרים משולש שווהצלעות (איור 1B). גודל הגולגולת צריך להתאים היטב לקוטר הבורג. אם יש דימום, לשטוף את משטח הדימום עם PBS. מהירות המקדחה היא 18,000 סל"ד, וגודל הסיביות הוא 0.6 מ"מ. - לחטא את הברגים עם 70% אתנול כדי למנוע דלקת. שתל את הברגים עמוק ככל האפשר.
הערה: יש לתקן את הברגים בחוזקה ללא הידבקות נוספת כגון מלט. - התקן זרוע ניתוח ממונעת על המסגרת הסטראוטקסית. חבר את החומרה הדרושה למחשב הנישא שבו מותקנת תוכנת השליטה (טבלה של חומרים).
- לפני הורדת עדשת GRIN, להתכונן לעשות מסלול מחט עם מחט 26 G.
הערה: מסלול המחט הוא מעין מסלול מדריך המסייע להשתיל את עדשת GRIN העבה יחסית לאזורי מוח עמוקים כגון אמיגדלה מבלי לגרום לעיוות חמור של מבנה המוח לאורך נתיב ההזרקה. מסלול מדריך זה נקרא מסלול מחט כי זה נעשה על ידי הליך הנמכה והעלאת של מחט דקה יחסית 26 G. - חבר את מחזיק הצינורית כדי להחזיק את המחט על המסגרת הסטראוטקסית.
- אחוז במחט 26 G עם מחזיק הצינורית וחשב את הקואורדינטות של אתר החדרת המחט.
הערה: בפרוטוקול זה, הקואורדינטות של אתר החדרת המחט הן 50 מיקרומטר לרוחב מאתר הזרקת הנגיף (AP, ML, DV) = ( -1.6 מ"מ, -3.55 מ"מ, -3.7 מ"מ). - גישה לתוכנת השליטה והכנה מלאה למניפולציה מיקום מחט.
- הפעל את תוכנת השליטה ובחר בלחצן התחל פרוייקט חדש כדי להתחיל לשלוט בהפעלה.
הערה: בהפעלת השליטה, קיימות מספר תיבות ריקות ולחצני תפריט. התיבות הריקות הן שטח קלט עבור קואורדינטות. לאחר הזנת קואורדינטות בתיבות הריקות, הזרוע הסטראוטקסית הממונעת זזה על-ידי לחיצה על לחצן עבור אל. לחצן עבור אל משתנה ללחצן STOP כאשר הזרוע הסטראוטקסית זזה. בין מספר לחצני תפריט, רק לחצן כלי נדרש בפרוטוקול זה. - לחץ על לחצן כלי. כייל את תוכנת השליטה על-ידי לחיצה על לחצן כייל את תפריט המסגרת. כיול הוא התהליך שבאמצעותו המיקום בפועל של מניפולטור מוגדר כערכים בתוכנת Stereodrive.
- הפעל את תוכנת השליטה ובחר בלחצן התחל פרוייקט חדש כדי להתחיל לשלוט בהפעלה.
- אתר את קצה המחט על פני השטח של המוח החשוף על פני השטח של הגולגולת באמצעות מניפולטור סטראוטקסי.
הערה: מהירות המחט מוגדרת באמצעות תפריט המהירות Microdrive בתפריט כלי. מהירות ברירת המחדל היא 3.0 מ"מ/ים. עם זאת, בשלב זה מומלץ להאיץ 0.5 מ"מ/s. התנועה של המחט נשלטת על ידי מקשי החצים. - הוסף 2-3 טיפות של PBS כדי לשמור על פני השטח של המוח רטובים. מלא את התיבה הריקה על מסך המחשב עם קואורדינטות DV מתאימות של לוס אנג'לס. אם פני המוח יבשים, זה מעכב חדירה של המחט לתוך רקמת המוח.
- הנמך את המחט 26 G על ידי לחיצה על כפתור עבור אל. זה נעצר באופן אוטומטי כאשר המחט מגיעה לאתר היעד שנקבע על ידי קואורדינטות DV. המהירות של המחט היא 100 מיקרומטר / דקה. אם יש דימום, לעצור את המחט על ידי לחיצה על כפתור STOP ולשטוף את פני השטח של המוח עם PBS. שמור על פני השטח של המוח רטובים בשלב זה. לאחר הדימום נעצר, להתחיל להוריד שוב.
- לאחר שהמחט מפסיקה לזוז לחלוטין, הזן 45.00 מ"מ בתיבה הריקה על מסך המחשב.
הערה: 45.00 מ"מ הוא ערך של קואורדינטת DV שגורם למחט לחזור למצב ההתחלה. - העלה את המחט על-ידי לחיצה על לחצן עבור אל. המהירות של תנועת המחט היא 100-200 מיקרומטר / דקה.
- לאחר המחט מפסיק לזוז, להסיר את PBS על פני השטח של המוח. הסר את המחט ואת מחזיק הצינורית מהמסגרת הסטראוטקסית. הנסיין יכול לעצור את המחט באופן ידני על ידי לחיצה על כפתור STOP בעת הצורך.
- ציידו את המוט הסטראוטקסי במחזיק העדשה. התקן את עדשת GRIN למחזיק העדשה.
הערה: עדשת GRIN ממוטבת למיקוד לוס אנג'לס (קוטר 0.6 מ"מ, אורך 7.3 מ"מ) משמשת בפרוטוקול זה. אם מחזיק העדשה אינו מוכן, דרך חלופית היא להשתמש קליפ בולדוג כדי לאחוז בעדשת GRIN. - לחטא את העדשה עם 70% אתנול ולחבר את המוט סטראוטקסי למסגרות סטריאוטאקסיות.
- אתר את קצה עדשת GRIN באתר המיועד על משטח הגולגולת (אותה שיטה המתוארת בשלב 2.8).
הערה: הקואורדינטות של עדשת GRIN הן (AP, ML, DV) = ( -1.6 מ"מ, -3.55 מ"מ, -4.2 מ"מ) (איור 1C). העדשה לא צריכה לגעת בגולגולת כדי למנוע נזק בקצה שלה. - חשב את קואורדינטת ה- DV על-ידי חיסור הערך המוחלט של "ערך A" מקואורדינטת ה- DV של השתלת העדשה המתוארת בשלב 2.16.
- זרוק 2-3 טיפות של PBS על פני השטח של המוח. הזן 1000 מיקרומטר להורדה ו 300 מיקרומטר להעלאת העדשה בתיבה הריקה על מסך המחשב.
- חזור על הנמכה (1000 מיקרומטר כלפי מטה) והעלאה (300 מיקרומטר כלפי מעלה) של עדשת GRIN עד שהוא מגיע לאתר היעד. הליך זה למעלה ולמטה משמש כדי לעזור לשחרר את הלחץ שנוצר בתוך רקמת המוח עקב הליך הורדת העדשה כי אחרת יכול לגרום לעיוות של מבני המוח לאורך נתיב ההשתלה.
הערה: המהירות של תנועת עדשת GRIN היא 100 מיקרומטר / דקה. גם אם יש דימום, לא להפסיק להזיז את עדשת GRIN ולשטוף את פני השטח של המוח עם PBS. שמור על פני השטח של המוח רטובים בשלב זה. אם פני השטח של המוח יבשים, רקמת המוח נדבקת לפני השטח של עדשת GRIN וגורמת לעיוות מבנה המוח. - אם עדשת GRIN מגיעה לאתר היעד, הסירו את PBS והחילו בזהירות את מלט השיניים של שף סביב עדשת GRIN, הברגים והצד שלהם(איור 1D).
הערה: החלת מלט שף על כל הגולגולת עשוי להפחית חפצי תנועה. להיפך, אם מלט לשרף מכסה בטעות את השרירים המחוברים לגולגולת, זה מגביר חפצי תנועה. - לאחר השרף מלט שיניים מתקשה, לפרק את עדשת GRIN ממחזיק העדשה ולהחיל מלט אקרילי על כל הגולגולת (איור 1D).
- כדי לחבר את צלחת הראש, לפרק את מחזיק העדשה מהמוט הסטראוטקסי ולחבר את צלחת הראש על קצה המוט באמצעות קלטות. ודא אם לוחית הראש אופקית.
הערה: לוחית ראש מוטה גורמת לתצוגה מוטה. לוחית ראש נדרשת לתיקון ראש העכבר במערכת הכלוב הביתי הניידת (במקטע הקובץ המצורף baseplate). אם הנסיין אינו משתמש במערכת, דלג על שלב זה (שלב 2.22) ועל השלב הבא 2.23. - מנמיכים באיטיות את המוט עד שלוחית הראש מאתרת בחלק העליון של חפת העדשה. מנמיכים את צלחת הראש 1000 מיקרומטר יותר. הזז את לוחית הראש עבור עדשת GRIN המושתלת כדי לאתר בקצה הימני של הטבעת הפנימית של לוחית הראש.
הערה: לוחית הראש צריכה להיות ממוקמת נמוך יותר משטח עדשת GRIN המושתל; אחרת, המיקרונדוסקופ לא יכול להתקרב מספיק לעדשת GRIN המושתלת להתאמת מישור המוקד בשל מלט האקריל. - יש למרוח מלט אקרילי כדי לחבר את לוחית הראש לשכבות הבטון(איור 1D).
- צרף סרט פרפין על משטח עדשת GRIN המושתל כדי להגן על פני השטח של העדשה מפני אבק. לאחר מכן להחיל קשר אפוקסי נשלף על הסרט פרפין כדי לשמור על סרט פרפין להישאר על פני השטח של העדשה.
- הזרק Carprofen, משכך כאבים (0.5 מ"ג / מ"ל ב PBS), ו Dexamethasone, תרופה אנטי דלקתית (0.02 מ"ג / מ"ל ב PBS) פתרון, בחלל הצפק של העכבר.
הערה: המינון של התרופה תלוי במשקל הגוף: Carprofen (5 מ"ג∙ק"ג-1 של משקל גוף) ו Dexamethasone (0.2 מ"ג∙ק"ג-1 של משקל גוף). הן Carprofen והן Dexamethasone מנוהל לאחר הניתוח ופעם ביום במשך 7 ימים לאחר הניתוח. - יש לערבב 0.3 מ"ג/מ"ל אמוקסיצילין, אנטיביוטיקה, במי כלוב ביתיים כדי לתת את התרופה למשך שבוע.
- להחזיר את העכבר לכלוב הבית ולאפשר 5-8 שבועות להחלמה והעברת וירוסים.
הערה: העכבר נמצא בכלוב מחומם מראש על שמיכה חשמלית עד שהעכבר מתעורר מההרדמה.
3. אימות השתלת עדשת GRIN
הערה: אימות השתלת עדשת GRIN מספק מידע על השאלה אם עדשת GRIN המושתלת נמצאת ביעד לתאי ההבעה של GCaMP. בהתבסס על מידע זה, הנסיין חוסך את זמנם מתהליכים גוזלים זמן כגון בדיקת התנהגות ועיבוד נתונים על ידי אי הכללת בעלי חיים עם השתלת עדשת GRIN לא ממוקדת. במהלך שגרת האימות, תאים עם ביטוי GCaMP צריכים להיות ממוקדים בשדה ההקלטה של התצוגה. כלוב ביתי נייד משמש בשלב זה. כלוב ביתי נייד הוא מכשיר מיוחד בצורת עגול המאפשר לעכברים עם ראש קבוע להזיז את רגליהם בחופשיות במהלך אימות השתלת עדשת GRIN והחזקת לוחית בסיס. שולחן הרמה אווירית במנגנון זה שעליו מונחות הרגליים של עכברים קבועים בראש מאפשר תנועה חופשית כזו של הרגליים למרות שהראש קבוע. התאים בגרעין לרוחב של האמיגדלה הוא בדרך כלל שקט במצב מנוחה או הרדמה כך אותות פלואורסצנטיות GCaMP מזוהים לעתים רחוקות בתנאים אלה, מה שהופך אותו קשה מאוד, לפעמים בלתי אפשרי, למצוא תאים המבטאים GCaMP במהלך אימות של השתלת עדשת GRIN והחזקת baseplate. עם זאת, תנועת הרגליים מייצרת לעתים קרובות אותות פלואורסצנטיים GCaMP בתאים של גרעין לרוחב של אמיגדלה ובכך יכול לעזור לאתר את המיקרוסקופ. לכן, כלוב הבית הנייד משמש בפרוטוקול זה.
- להרכיב את המניפולטור סטראוטקסי למערכת כלוב הבית הנייד.
- המשך את העכבר עם 1.5% גז isoflurane. לאחר שהעכבר מחוסר הכרה לחלוטין, הנח את העכבר על מוט הראש של מערכת הכלוב הביתי הניידת.
- אתר את כלוב הפחמן מתחת לעכבר. סגור את כלוב הפחמן והפעל את זרימת האוויר כדי לגרום לכלוב לנוע בחופשיות ללא חיכוך. המתן מספר דקות עד שהעכבר יהפוך לפעיל.
הערה: יש למטב את מהירות זרימת האוויר עבור כל מצב ניסיוני (כאן, 100 ליטר לדקה). - הסר סרט פרפין וקשר אפוקסי על פני השטח של עדשת GRIN המושתלת ולנגב את משטח העדשה עם 70% אתנול באמצעות נייר עדשה.
- הכן את תוכנת רכישת הנתונים (DAQ) (למשל, אינסקופיקס). הגדר את תנאי הדימות.
הערה: תוכנת DAQ משמשת לשליטה במיקרוסקופ (כוח LED, מיקוד עדשהוכו') ואחסון נתונים.- הפעל את תיבת DAQ וחבר אליה מיקרוסקופ. לאחר מכן, חבר אותו למחשב נישא ישירות באמצעות כבל או באמצעות אינטרנט אלחוטי.
הערה: תוכנת DAQ מותקנת בחומרה הנוספת הנקראת DAQ box (למשל, Inscopix). על-ידי חיבור תיבת DAQ למחשב הנישא, תוכנת DAQ הופכת לנגישה במחשב נישא. - גישה לתוכנת DAQ באמצעות דפדפן אינטרנט (מומלץ ל- Firefox).
- הגדר את כל הפרטים הדרושים (תאריך, מזהה עכברוכו') בהפעלה המוגדרת. לאחר מכן לחץ על שמור והמשך. לאחר השמירה, גש להפעלת ההפעלה.
- בהפעלה ,הגדר את תנאי ההדמיה כגון זמן חשיפה, רווח, מיקוד אלקטרוני וכוח נורית חשיפה.
הערה: הספק ועוצמת נורית חשיפה ניתנים לשינוי בהתאם לתנאי המעבדה. הערך המומלץ למיקוד חשמלי הוא 500 וזמן החשיפה הוא 50 אלפיות השנייה. אין הגבלה לשינוי עוצמת LED ורווח. עם זאת, אינטנסיביות גבוהה יותר של אור יכול לגרום הלבנה יותר. זמן החשיפה של ההקלטה קובע קצב מסגרות של הקלטת וידאו. קצבי פריימים גבוהים יותר יפחיתו את עוצמת האות. יש למטב את קצבי המסגרות עבור ה- GECIs המשמשים להדמיה.
- הפעל את תיבת DAQ וחבר אליה מיקרוסקופ. לאחר מכן, חבר אותו למחשב נישא ישירות באמצעות כבל או באמצעות אינטרנט אלחוטי.
- כדי להחזיק את המיקרוסקופ על מניפולטור סטראוטקסי, חבר את המוט הסטראוטקסי עם אחיזת מיקרוסקופ למניפולטור סטראוטקסי.
הערה: האחיזה היא אביזר קטן שניתן לחבר למנגנון הסטריאוטאקסי כדי להחזיק גוף מיקרוסקופ להצבתו במיקום המוח היעד. - תפוס את המיקרוסקופ עם אחיזת המיקרוסקופ. הדליקו את נורית ה-LED המחוברת למיקרוסקופ ויישרו את המיקרוסקופ אנכית. מנמיכים את המיקרוסקופ תוך התבוננות בתמונה עד שפני השטח של עדשת GRIN המושתלת מופיעים.
- יישר את מרכז עדשת GRIN המושתלת עם מרכז הנוף.
הערה: בשלב זה ניתן לבצע אימות של השתלת עדשת GRIN (מוזכר בסעיף התוצאות, איור 2B, איור 2D, איור 2F). - תמונת לכידה של משטח עדשת GRIN המושתל (לחץ על לחצן Prt Sc במקלדת). התמונה של משטח עדשת GRIN המושתל נדרשת לביטול הבחירה ברכיבים שאינם עצביים במהלך עיבוד נתונים מאוחר יותר (שלב 6.8).
- מצא את המיקום המתאים של המיקרוסקופ. העלה באיטיות את העדשה האובייקטיבית של מיקרוסקופ תוך התבוננות בתמונה כדי לחפש תאים עם ביטוי GCaMP7b.
הערה: ייתכן שיהיה צורך להתאים את הרווח של רכישת התמונה או את עוצמת נורית החשיפה. בשלב זה ניתן לבצע אימות של השתלת עדשת GRIN (המוזכר בסעיף התוצאות, איור 2A, איור 2C, איור 2E).
4. קובץ מצורף Baseplate
הערה: שלב ההצמדה baseplate עוקב אחר האימות של השתלת עדשת GRIN. לוח הבסיס הוא פלטפורמה להרכבת המיקרוסקופ לראשם של עכברים. כפי שצוין בסעיף הקודם, כלוב ביתי נייד משמש בפרוטוקול זה.
- לאחר אימות השתלת עדשת GRIN, יש לפרק מיקרוסקופ זעיר מאחיזת המיקרוסקופ.
- חבר לוח בסיס למיקרוסקופ. הדק את הבורג באמצעות מפתח הקסוס לחיבור יציב של baseplate למיקרוסקופ.
- תפוס את המיקרוסקופ עם אחיזת המיקרוסקופ. הדליקו את נורית ה-LED המחוברת למיקרוסקופ ויישרו את המיקרוסקופ אנכית. מנמיכים את המיקרוסקופ עד שנצפה פני השטח של עדשת GRIN המושתלת. יישר את מרכז עדשת GRIN המושתלת עם מרכז הנוף.
- מצא את המיקום המתאים של המיקרוסקופ. הגבה באיטיות את העדשה האובייקטיבית של המיקרוסקופ עד למציאת מישור מוקד המעניק את התמונות הטובות ביותר של תאים עם ביטוי GCaMP7b (איור 2A).
הערה: ייתכן שיהיה צורך להתאים את הרווח של רכישת תמונה או כוח LED חשיפה במהלך שלב זה. - יש למרוח מלט אקרילי כדי לחבר את לוחית הבסיס ללוחית הראש (איור 2G). לבנות את sidewalls עם מלט אקרילי בין הלוחית ואת צלחת הראש.
הערה: מלט אקרילי מתכווץ כאשר הוא מתקשה. מסיבה זו, לא להסיר את המיקרוסקופ עד המלט מתקשה לחלוטין (שלב זה לוקח לפחות 30 דקות). מלט צריך להיעשות בזהירות רבה כדי למנוע מלט לא רצוי של המיקרוסקופ ואת העדשה האובייקטיבית שלה עם מלט אקרילי. - לאחר מלט אקרילי מתקשה לחלוטין, לשחרר את הבורג ולרומם את הגוף מיקרוסקופ לאט.
- אם יש פער בצד, בצע שוב חיזוק נוסף כדי להגן על עדשת GRIN המושתלת מפני אבק.
- מכסים את לוח הבסיס כדי להגן על עדשת GRIN המושתלת מפני אבק ולהדק את הבורג של לוח הבסיס.
- שחרר את לוחית הראש מהבר הראשי. החזר את העכבר לכלוב הביתי עד להדמיה אופטית עתידית.
5. הקלטה אופטית של אות GCaMP במהלך בדיקת התנהגות
הערה: ההליך של הקלטת אותות GCaMP במהלך ההתנהגות יכול להיות שונה מאוד בהתאם למערכות המשמשות להדמיה אופטית, תכנון ניסיוני וסביבת מעבדה. לכן, הוא מתואר בצורה פשוטה בסעיף זה.
- בצע מספר ימי טיפול לפני בדיקת ההתנהגות.
- הכן את מנגנון ההתנהגות (למשל, תא מיזוג פחד, תוכנת התנהגות ומכשיר קולבורן) ומחשב נייד.
- חבר את המיקרוסקופ לתיבת DAQ והפעל את התיבה DAQ.
- חבר את התיבה DAQ למחשב נייד באמצעות חיבור לאינטרנט אלחוטי.
- הפעל את תוכנת DAQ (מומלץ להשתמש בדפדפן Firefox) במחשב הנישא. לחץ על לחצן מנהל הקבצים ובדוק את קיבולת האחסון הנותרת של תיבת DAQ לשמירת נתונים מוקלטים.
הערה: גודל הנתונים הוא כ 80 GB עבור הקלטה של 30 דקות. - הזן את המידע הדרוש (תאריך, מזהה עכברוכו') בהפעלה המוגדרת והזן את הפעלת ההפעלה.
- תפוס בעדינות את העכבר והסר כיסוי baseplate על ראשו. מניחים את המיקרוסקופ על פלטפורמת הלוח.
- הדקו את בורג הלוחית והניחו את החיה עם מיקרונדוסקופ להרכבה על הראש לתוך תא ההתנהגות.
הערה: העכבר מנסה לברוח בשלב זה אם הטיפול אינו מספיק. - חבר את לוח ה- NI ליציאת TRIG של התיבה DAQ באמצעות כבל BNC. לוח NI מקבל אותות TTL מתוכנות התנהגות (למשל, FreezeFrame) ומתאם הליך הקלטה בו-זמני של אות GCaMP והתנהגות בעלי חיים.
- כוונן את מישור המוקד.
הערה: מישור המוקד נקבע על ידי המרחק בין העדשה האובייקטיבית של המיקרוסקופ לבין עדשת GRIN המושתלת במוח. כדי להתאים את מישור המוקד, מיקום העדשה האובייקטיבית מניפולציה תוך התבוננות בתמונות. המרחק בין שתי העדשות האלה שמראה מורפולוגיה ברורה של תאים וכלי דם מוגדר כמישור המוקד להדמיה. בפרוטוקול זה, תוכנת DAQ משמשת לשליטה בתנועת העדשה האובייקטיבית במהלך ההתאמה. - הגדר את זמן החשיפה הממוטב, רווח, עוצמת LED בהפעלת הפעלה.
הערה: בדרך כלל, 50 אלפיות השנייה משמשות לזמן חשיפה. הגברה ועוצמת LED מוגדרים על סמך היסטוגרמות תמונה. היסטוגרמות מציינות את התפלגות עוצמת הפלואורסצנטיות של הפיקסלים. בהתבסס על בדיקה חזותית, הקצה הימני של היסטוגרמה צריך להיות ערך בין 40% ל 60% במקרה של GCaMP7b. הוא משתנה בהתאם ל- GECIs המשמשים להדמיה. - שנה את אפשרות ההקלטה להקלטה מופעלת. לחץ על הקלט והתחל את אופן הפעולה.
הערה: אפשרות ההקלטה המופעלת מספקת ציר זמן תואם של הפעלת ההקלטה והפעלת אופן הפעולה. אם מתקבל אות TTL, נורה אדומה מעל יציאת TRIG נדלקת. - לאחר סיום בדיקת ההתנהגות, נתק את המיקרוסקופ וחבר את כיסוי לוח הבסיס.
- תחזיר את העכבר לכלוב הביתי. לאחר מכן, בחר מנהל קבצים וייצא נתונים מהתיבה DAQ.
- לאחר בדיקת ההתנהגות, להקריב את העכבר לאימות היסטולוגי נתיחה שלאחר המוות.
6. עיבוד נתונים
הערה: הליך עיבוד הנתונים שונה מאוד בהתאם לתוכנת עיבוד הנתונים ול- GECIs המשמשים לניסוי ההדמיה. לכן, הוא מתואר בצורה פשוטה בסעיף זה. פרוטוקול זה משתמש בתוכנה מסחרית לעיבוד נתונים (ראה טבלת חומרים). לחלופין, ניתן להשתמש גם בתוכנות קוד פתוח אחרות המוזכרות בסעיף הדיון ללא בעיה. המשתנים המשמשים בפרוטוקול זה מפורטים בטבלה 1.
- יבא את קובץ נתוני הווידאו המתעד (1280 פיקסלים x 800 פיקסלים) מהתיבה DAQ למחשב שולחני לעיבוד נתונים. הפעל את תוכנת עיבוד הנתונים.
הערה: תוכנת עיבוד נתונים שונה מתוכנת DAQ בשלבים קודמים. בתוכנה לעיבוד נתונים, ישנם 6 שלבים: דגימה למטה, חיתוך, מסנן מרחבי, תיקון תנועה, חישוב ΔF /F, זיהוי אירועים הנחוצים לחילוץ נתונים ארעיים של סידן תא יחיד מסרטון מוקלט. - צמצם וחתוך את הוידאו.
הערה: דגימת הפחתה וחיתוך נחוצים כדי להגביר את מהירות עיבוד הנתונים. חתוך את האזור למעט אזור מעניין שבו אות GCaMP נצפה. - החל מסנן מרחבי. לאחר החלת מסנן מרחבי, צרו תמונת הקרנת עוצמת ממוצעת.
הערה: המסנן המרחבי מבדיל כל פיקסל בתמונת וידאו מוקלטת ומספק תמונת חדות גבוהה. קיימים שני סוגים של מסנן מנותק, מסנן ניתוק נמוך וגבוה. הערך הגבוה יותר של מסנני ניתוק נמוכים מגביר את הניגודיות של התמונה, אך באותו רעש אפור כולל גם גדל. הערך הנמוך יותר של מסנן חיתוך גבוה הופך את התמונה לטשטוש. - החל תיקון תנועה. השתמש בתמונת הקרנת עוצמת הממוצע כתמונת ייחוס לתיקון תנועה.
- החל שוב תיקון תנועה באמצעות התמונה של המסגרת הראשונה כתמונת ייחוס.
הערה: שני שלבים של תיקון תנועה מפחיתים באופן משמעותי את חפץ התנועה. - החל חישוב ΔF/F כדי להציג באופן חזותי פיקסלים המציגים שינוי בבהירות.
הערה: שינוי הבהירות של פיקסלים נגרם על ידי שינוי עוצמת הפלואורסצנטיות של GCaMP, והוא מציין מעברי סידן. - החל את האלגוריתם PCA / ICA כדי לדמיין עקומת סידן חולפת של כל תא.
הערה: PCA/ICA הוא אלגוריתם למיון קבוצת נתונים לתוך קבוצה של נתוני רכיב יחיד. יש למטב את המשתנים עבור כל תנאי מעבדה. בפרוטוקול זה, כל המשתנים הם ברירת מחדל למעט משקל זמן ICA (0.4 משמש בפרוטוקול זה)27. - בטלו את הבחירה ברכיבים שאינם עצביים ידנית בין רכיבים שזוהו בהתבסס על הקריטריונים המתוארים בהערה הבאה.
הערה: שני קריטריונים עיקריים משמשים למטרה זו. ראשית, אות GCaMP שמקורו בנוירון נראה כמו צורה כדורית ברורה. לכן, רק האות עם צורה כדורית ברורה נבחר כנוירון. שנית, בהתחשב בקוטר של גוף התא של תא פירמידלי אמיגדלה ידוע להיות כ 20 מיקרומטר28,29,30, רק האות תואם בערך עם גודל זה נבחר כנוירון. כדי לקבוע את גודל אות ה- GCaMP, הגודל הממשי של פיקסל בודד מחושב בהתבסס על התמונה שנלכדה של משטח העדשה (שלב 3.9) והרוחב המרבי של צורה כדורית בודדת מחושב. לדוגמה, בפרוטוקול זה, הקוטר של עדשת GRIN המושתלת הוא 600 מיקרומטר. לכן, אם קוטר העדשה הוא 800 פיקסלים, הגודל בפועל של פיקסל יחיד הוא 1.5 מיקרומטר (20 מיקרומטר הוא כ 7 פיקסלים). - החל את פונקציית זיהוי האירוע כדי לזהות עלייה משמעותית של סידן חולף (אירוע סידן).
הערה: בשלב זה, המשתנה הנקרא זמן הריקבון הקטן ביותר באירוע (τ) נדרש. בפרוטוקול זה, 1.18s משמש כמשתנה ממוטב עבור GCaMP7b. זמן הריקבון הממוצע (t1/2=0.82s) מחושב בהתבסס על עקומת ΔF/F במהלך פעילות ספונטנית של תאים. מאז GCaMP בעקבות ריקבון אקספוננציאלי, τ =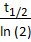 .
.
תוצאות
אימות השתלת עדשת GRIN
לפני הצמדה כרונית של לוח הבסיס למוח על ידי מלט, השתלת עדשת GRIN צריכה להיות מאומתת. בבעלי חיים עם השתלת עדשה מוצלחת, הן תאי GCaMP מבטאים והן כלי דם נצפו בבירור בטווח מישור מוקדי שנקבע על ידי המרחק בין העדשה האובייקטיבית של מיקרוסקופ לבין עדשת GRIN מושתלת (
Discussion
טכניקות ניתוח מיומנת חיוניות להשגת מוצלח בהדמיית סידן אופטי vivo עם מיקרוסקופיה מיניאטורית ראש הר באזורים עמוקים יותר במוח כגון האמיגדלה כפי שתיארנו כאן. לכן, למרות שפרוטוקול זה מספק קו מנחה לתהליכים כירורגיים ממוטבים של חיבור baseplate והשתלת עדשות GRIN, ייתכן שיהיה צורך בתהליכי אופטימיזציה נו?...
Disclosures
למחבר אין מה לחשוף
Acknowledgements
עבודה זו נתמכה על ידי מענקים של קרן המדע והטכנולוגיה של סמסונג (פרויקט מספר SSTF-BA1801-10).
Materials
| Name | Company | Catalog Number | Comments |
| 26G needle | BD | 302002 | Surgery |
| AAV1-Syn-GCaMP7b-WPRE | Addgene | 104493-AAV1 | Surgery |
| AAV2/1-CaMKiiα-GFP | custom made | Surgery | |
| Acrylic-Dental cement (Ortho-jet Acrylic Pink) | Lang | 1334-pink | Surgery & Baseplate Attachment |
| Air flow manipulator | Neurotar | NTR000253-04 | Baseplate Attachment |
| Amoxicillin | SIGMA | A8523-5G | Surgery |
| Baseplate | INSCOPIX | 1050-002192 | Baseplate Attachment |
| Baseplate cover | INSCOPIX | 1050-002193 | Baseplate Attachment |
| Behavioral apparatus (chamber) | Coulbourn Instrument | Testcage | Behavior test |
| Behavioral apparatus (software) | Coulbourn Instrument | Freeze Frame | Behavior test |
| Carbon cage | Neurotar | 180mm x 70mm | Baseplate Attachment |
| Carprofen | SIGMA | PHR1452-1G | Surgery |
| Data processing software | INSCOPIX | INSCOPIX Data Processing Software | Baseplate Attachment & Behavior test |
| Dexamethasone | SIGMA | D1756-500MG | Surgery |
| Drill | Seyang | marathon-4 | Surgery |
| Drill bur | ELA | US1/2, Shank104 | Surgery |
| Glass needle | WPI | PG10165-4 | Surgery |
| GRIN lens (INSCOPIX Proview Lens Probe) | INSCOPIX | 1050-002208 | Surgery |
| Hamilton Syringe | Hamilton | 84875 | Surgery |
| Head plate | Neurotar | Model 5 | Surgery |
| Hex-key | INSCOPIX | 1050-004195 | Baseplate Attachment |
| Laptop computer | Samsung | NT950XBV | Surgery & Baseplate Attachment |
| Lens holder, Stereotaxic rod (INSCOPIX proview implant kit) | INSCOPIX | 1050-004223 | Surgery |
| Microscope gripper | INSCOPIX | 1050-002199 | Baseplate Attachment |
| Microscope, DAQ software, hardware | INSCOPIX | nVista 3.0 | Baseplate Attachment & Behavior test |
| Mobile homecage | Neurotar | MHC V5 | Baseplate Attachment |
| Moterized arm | Neurostar | Customized | Surgery |
| Moterized arm software | Neurostar | Customized | Surgery |
| NI board | National instrument | Behavior test | |
| Removable epoxy bond | WPI | Kwik-Cast | Surgery |
| Resin cement (Super-bond) | Sun medical | Super bond C&B | Surgery |
| Skull screw | Stoelting | 51457 | Surgery |
| Stereotaxic electrode holder | ASI | EH-600 | Surgery |
| Stereotaxic frame | Stoelting | 51600 | Surgery |
| Stereotaxic manipulator | Stoelting | 51600 | Baseplate Attachment |
References
- Gonzalez, W. G., Zhang, H., Harutyunyan, A., Lois, C. Persistence of neuronal representations through time and damage in the hippocampus. Science. 365 (6455), 821-825 (2019).
- Ghandour, K., et al. Orchestrated ensemble activities constitute a hippocampal memory engram. Nature Communications. 10 (1), 2637 (2019).
- Grundemann, J., et al. Amygdala ensembles encode behavioral states. Science. 364 (6437), (2019).
- Krabbe, S., et al. Adaptive disinhibitory gating by VIP interneurons permits associative learning. Nature Neuroscience. 22 (11), 1834-1843 (2019).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- LeDoux, J. E. Emotion circuits in the brain. Annual Review of Neuroscience. 23, 155-184 (2000).
- Burgoyne, R. D. Neuronal calcium sensor proteins: generating diversity in neuronal Ca2+ signalling. Nature Reviews Neuroscience. 8 (3), 182-193 (2007).
- Miyakawa, H., et al. Synaptically activated increases in Ca2+ concentration in hippocampal CA1 pyramidal cells are primarily due to voltage-gated Ca2+ channels. Neuron. 9 (6), 1163-1173 (1992).
- Denk, W., Yuste, R., Svoboda, K., Tank, D. W. Imaging calcium dynamics in dendritic spines. Current Opinion in Neurobiology. 6 (3), 372-378 (1996).
- Mank, M., et al. A genetically encoded calcium indicator for chronic in vivo two-photon imaging. Nature Methods. 5 (9), 805-811 (2008).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Huber, D., et al. Multiple dynamic representations in the motor cortex during sensorimotor learning. Nature. 484 (7395), 473-478 (2012).
- Grewe, B. F., et al. Neural ensemble dynamics underlying a long-term associative memory. Nature. 543 (7647), 670-675 (2017).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56 (2019).
- Jacob, A. D., et al. A Compact Head-Mounted Endoscope for In vivo Calcium Imaging in Freely Behaving Mice. Current Protocols in Neuroscience. 84 (1), 51 (2018).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Xiong, B., et al. Precise Cerebral Vascular Atlas in Stereotaxic Coordinates of Whole Mouse Brain. Frontiers in Neuroanatomy. 11, 128 (2017).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Millhouse, O. E., DeOlmos, J. Neuronal configurations in lateral and basolateral amygdala. Neuroscience. 10 (4), 1269-1300 (1983).
- McDonald, A. J. Neuronal organization of the lateral and basolateral amygdaloid nuclei in the rat. Journal of Comparative Neurology. 222 (4), 589-606 (1984).
- McDonald, A. J. Neurons of the lateral and basolateral amygdaloid nuclei: a Golgi study in the rat. Journal of Comparative Neurology. 212 (3), 293-312 (1982).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved