É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem de cálcio in vivo bem sucedida com um microscópio miniaturizado de head-mount na Amígdala do Rato Livremente Comportado
Neste Artigo
Resumo
A imagem microendoscópica de cálcio in vivo é uma ferramenta inestimável que permite o monitoramento em tempo real das atividades neuronais em animais de comportamento livre. No entanto, aplicar essa técnica à amígdala tem sido difícil. Este protocolo visa fornecer uma diretriz útil para atingir com sucesso células de amígdala com um microscópio miniaturizado em camundongos.
Resumo
O monitoramento in vivo em tempo real das atividades neuronais em animais em movimento livre é uma das principais abordagens para ligar a atividade neuronal ao comportamento. Para isso, uma técnica de imagem in vivo que detecta transitórios de cálcio em neurônios usando indicadores de cálcio geneticamente codificados (GECIs), um microscópio de fluorescência miniaturizada e uma lente de índice de refração gradiente (GRIN) foi desenvolvida e aplicada com sucesso em muitas estruturas cerebrais1,2,3,4,5,6. Esta técnica de imagem é particularmente poderosa porque permite imagens simultâneas crônicas de populações celulares geneticamente definidas por um período de longo prazo até várias semanas. Embora útil, essa técnica de imagem não tem sido facilmente aplicada às estruturas cerebrais que se localizam profundamente dentro do cérebro, como a amígdala, uma estrutura cerebral essencial para o processamento emocional e a memória do medo associativo7. Existem vários fatores que dificultam a aplicação da técnica de imagem na amígdala. Por exemplo, artefatos de movimento geralmente ocorrem com mais frequência durante a imagem realizada nas regiões cerebrais mais profundas porque um microscópio de montagem de cabeça implantado nas profundezas do cérebro é relativamente instável. Outro problema é que o ventrículo lateral está posicionado perto da lente GRIN implantada e seu movimento durante a respiração pode causar artefatos de movimento altamente irregulares que não podem ser facilmente corrigidos, o que dificulta a formação de uma visão de imagem estável. Além disso, como as células da amígdala são geralmente silenciosas em um estado de repouso ou anestesiado, é difícil encontrar e concentrar as células-alvo expressando GECI na amígdala durante o procedimento de base para imagens posteriores. Este protocolo fornece uma diretriz útil para como direcionar eficientemente as células expressando GECI na amígdala com microscópio miniaturizado de montagem de cabeça para imagens de cálcio in vivo bem sucedidas em uma região cerebral tão profunda. Nota-se que este protocolo é baseado em um sistema específico (por exemplo, Inscopix), mas não restrito a ele.
Introdução
O cálcio é um segundo mensageiro onipresente, desempenhando um papel crucial em quase todas as funções celulares8. Nos neurônios, o potencial de ação de disparo e a entrada sináptica causam rápida mudança de livre intracelular [Ca2+]9,10. Portanto, o rastreamento de transintes de cálcio oferece uma oportunidade de monitorar a atividade neuronal. GeCIs são ferramentas poderosas que permitem o monitoramento [Ca2+] em populações celulares definidas e compartimentos intracelulares11,12. Entre muitos tipos diferentes de indicador de cálcio à base de proteína, o GCaMP, uma sonda Ca2+baseada em uma única molécula de GFP13,é a GECI mais otimizada e, portanto, amplamente utilizada. Através de várias rodadas de engenharia, uma série de variantes de GCaMP foi desenvolvida12,14,15,16. Utilizamos um dos GCaMPs recentemente desenvolvidos, GCaMP7b, neste protocolo16. Os sensores GCaMP contribuíram muito para o estudo das funções do circuito neural em uma série de organismos modelo, como imagens de transientes Ca2+ durante o desenvolvimento17, imagem in vivo em uma camada cortical específica18,medição da dinâmica do circuito no aprendizado de tarefas motoras19 e imagem da atividade do conjunto celular relacionada com memória de medo associativo no hipocampo e amígdala20,21.
A imagem óptica de GECIs tem várias vantagens22. A codificação genética permite que os GECIs sejam expressos por um longo período de tempo em um subconjunto específico de células definidas por perfil genético ou padrões específicos de conectividade anatômica. A imagem óptica permite o monitoramento simultâneo in vivo de centenas a milhares de neurônios em animais vivos. Alguns sistemas ópticos de imagem foram desenvolvidos para imagens in vivo e análise de GECIs dentro do cérebro de camundongos que se comportam livremente com microscópios de fluorescência miniaturizada de montagem da cabeça21,23,24,25. Apesar da técnica de imagem óptica in vivo baseada em GECIs, lente GRIN e um microscópio em miniatura de montagem de cabeça ser uma ferramenta poderosa para estudar a ligação entre a atividade do circuito neural e o comportamento, aplicar essa tecnologia à amígdala tem sido difícil devido a vários problemas técnicos relacionados com o direcionamento da lente GRIN para células expressando GECIs na amígdala sem causar artefatos de movimento que reduzem severamente a qualidade da aquisição de imagens e encontrar células expressas gecIs. Este protocolo visa fornecer uma diretriz útil para procedimentos cirúrgicos de fixação de placa base e implantação de lentes GRIN que são etapas críticas para o sucesso da imagem óptica de cálcio in vivo na amígdala. Embora este protocolo tenha como alvo a amígdala, a maioria dos procedimentos descritos aqui são comumente aplicáveis a outras regiões cerebrais mais profundas. Embora este protocolo seja baseado em um sistema específico (por exemplo, Inscopix), o mesmo propósito pode ser facilmente alcançado com outros sistemas alternativos.
Protocolo
Todos os procedimentos foram aprovados pelo Comitê de Ética Animal do Instituto Avançado de Ciência e Tecnologia da Coreia. Todos os experimentos foram realizados de acordo com a diretriz do Comitê Institucional de Cuidado e Uso de Animais.
NOTA: Este protocolo consiste em seis etapas principais: cirurgia de injeção de vírus, cirurgia de implante de lente GRIN, validação da implantação da lente GRIN, fixação da placa base, gravação óptica do sinal GCaMP durante um teste de comportamento e processamento de dados(Figura 1A). Com exceção da cirurgia, o pacote de software comercial (Inscopix) é usado.
1. Cirurgia estereotaxica – Injeção do Vírus AAV
NOTA: A cepa do camundongo utilizada neste procedimento cirúrgico é C57BL6/J. O corpo do animal é coberto com uma cortina estéril durante a cirurgia e todas as etapas do protocolo são realizadas com o uso de luvas estéreis. Várias cirurgias geralmente não são realizadas no mesmo dia. No entanto, se vários camundongos tiverem que fazer a mesma cirurgia no mesmo dia, use um conjunto separado de ferramentas cirúrgicas autoclavadas para cada rato e 70% de etanol para desinfetar os instrumentos cirúrgicos entre camundongos. Para manter o rato aquecido durante o procedimento cirúrgico, o mouse é coberto com um cobertor cirúrgico feito sob medida após fixado no quadro estereotaxic.
- Desinfetar todas as ferramentas cirúrgicas necessárias com 70% de etanol, e preparar uma seringa Hamilton e uma pipeta de vidro. Encha a pipeta de vidro com água destilada.
NOTA: Todas as ferramentas cirúrgicas utilizadas no protocolo são autoclavadas. Como a lente GRIN e os parafusos do crânio não podem ser autoclavados para esterilização, 70 % de etanol é usado como desinfetante para evitar inflamação. Embora não tenha sido experimentou, outras formas de esterilização podem ser utilizadas, por exemplo, gás ou esterilização química. - Anestesiar o camundongo com pentobarbital (83 mg∙kg-1 de peso corporal) por injeção intraperitoneal. Depois que o rato ficar inconsciente, raspe a pele no crânio.
- Limpe a pele acima do crânio com 70% de etanol e fixe o mouse no quadro estereotaxico. Remova cuidadosamente a pele e limpe a superfície do crânio com uma solução de peróxido de hidrogênio de 35% usando um aplicador de ponta de algodão. Aplique pomada lubrificante para evitar a secagem da córnea durante a cirurgia.
NOTA: Embora geralmente não haja problema em usar 70% de etanol apenas para preparação da pele asséptica, recomenda-se o uso de 3 rodadas alternadas de desinfetantes, por exemplo, solução de iodoforos ou clorexidina, e 70% de etanol. Maior concentração de peróxido de hidrogênio é usado neste protocolo para garantir que o tecido conjuntivo no crânio do rato seja removido o mais completamente possível, o que é fundamental para reduzir o artefato de movimento durante a imagem posterior porque o tecido conjuntivo no crânio interfere com um firme acessório da placa base ao crânio. Deve-se notar que 35% de peróxido de hidrogênio é muito maior do que o normalmente utilizado (3%). - Fixar o pino com um suporte de sonda estereotaxic. Alinhe a altura da bregma e lambda com o pino.
- Encontre a localização específica no crânio do rato para craniotomia.
NOTA: As coordenadas da amígdala lateral (LA) para injeção de vírus são (AP, ML, DV) = (-1,6 mm, -3,5 mm, -4,3 mm) de bregma neste protocolo (AP; Anterior-Posterior, ML; Medial-Lateral, DV; Dorsal-Ventral, cada abreviação indica distância axial relativa do bregma)26. As coordenadas devem ser otimizadas para cada condição experimental. - Perfurar a superfície do crânio(Figura 1B). Lave frações de crânio com soro fisiológico tamponado de fosfato (PBS). Remova a camada restante usando fórceps ou uma agulha de 27 G.
- Ao perfurar o crânio, tente não tocar na última camada dura para evitar danos à superfície do tecido cerebral. Uma superfície cerebral danificada causa inflamação ao redor da lente, que induz artefatos de movimento severos e alta autofluorescência durante a gravação. O tamanho da craniotomia é de 1,6 mm. A velocidade da broca é de 18.000 rpm, e o tamanho do bit é de 0,6 mm.
- Para baixar a lente GRIN da superfície do tecido cerebral do local perfurado até o local da amígdala alvo, calcule a distância nomeada como "Valor A" subtraindo a diferença de DV entre o bregma e a superfície cerebral exposta da coordenada DV da implantação da lente, que é definida com base no bregma (4,2 mm neste caso, Figura 1C).
- Carregar 3 μL de óleo mineral e 0,7 μL da solução do vírus AAV na pipeta de vidro.
NOTA: O óleo mineral ajuda a separar a solução do vírus e a água. 0,7 μL é um volume otimizado para a injeção do vírus la que pode cobrir totalmente a LA. - Remova o pino do suporte da sonda estereotaxic e fixe a pipeta de vidro nele.
- Localize a pipeta de vidro no local da injeção mencionado na etapa 1.5. Insira a pipeta de vidro no tecido cerebral depois que o sangramento estiver completamente parado.
- Entregue o vírus através de uma pipeta de vidro usando uma bomba de injeção.
NOTA: O título do vírus deve ser superior a 1 x 1013 vg/mL para obter um número suficiente de células expressas GCaMP. A velocidade de injeção é de 0,1 μL/min e difusa por 10 min. Se houver sangramento, lave a superfície cerebral com PBS. Mantenha a superfície cerebral molhada nesta etapa. - Após a injeção de acabamento, remova a pipeta de vidro lentamente.
2. Cirurgia estereotaxica – implantação de lentes GRIN
NOTA: A cirurgia de implante de lente GRIN é o passo mais crítico neste protocolo. Uma vez que uma velocidade lenta consistente do movimento da lente GRIN é fundamental para a implantação bem sucedida da lente GRIN, um braço de cirurgia motorizada pode ser útil. O braço de cirurgia motorizado é um manipulador estereotipado que é controlado por software de computador. Embora o braço motorizado seja usado neste protocolo, outras formas também podem ser usadas desde que a lente se mova de forma consistente e lenta durante a implantação. Informações detalhadas sobre o dispositivo estão na Tabela de Materiais.
- Perfurar o crânio para implantar dois parafusos do crânio. Lave todas as frações do crânio com PBS.
NOTA: Para reduzir os artefatos de movimento em imagens ópticas posteriores, são necessários pelo menos dois parafusos. Os dois parafusos do crânio e a posição do implante da lente GRIN formam um triângulo equilátero(Figura 1B). O tamanho da craniotomia deve se encaixar firmemente com o diâmetro do parafuso. Se houver sangramento, lave a superfície de sangramento com PBS. A velocidade da broca é de 18.000 rpm, e o tamanho do bit é de 0,6 mm. - Desinfete os parafusos com 70% de etanol para evitar inflamação. Implante os parafusos o mais fundo possível.
NOTA: Os parafusos devem ser bem fixados sem aderência adicional, como cimento. - Instale um braço de cirurgia motorizado na estrutura estereotaxic. Conecte o hardware necessário ao computador portátil no qual o software de controle é instalado(Tabela de Materiais).
- Antes de baixar a lente GRIN, prepare-se para fazer uma trilha de agulha com uma agulha de 26 G.
NOTA: A trilha da agulha é uma espécie de guia que ajuda a implantar a lente GRIN relativamente espessa em regiões cerebrais profundas, como a amígdala sem causar uma grave distorção da estrutura cerebral ao longo do caminho da injeção. Esta trilha guia é chamada de pista de agulha porque é feita por um procedimento de redução e elevação de agulha relativamente fina de 26 G. - Fixar o suporte da cânula para segurar a agulha no quadro estereotaxista.
- Segure a agulha de 26 G com o suporte da cânula e calcule as coordenadas do local de inserção da agulha.
NOTA: Neste protocolo, as coordenadas do local de inserção da agulha são 50 μm laterais do local de injeção do vírus (AP, ML, DV) = (-1,6 mm, -3,55 mm, -3,7 mm). - Acesse o software de controle e preparação completa para manipulação da posição da agulha.
- Execute o software de controle e selecione o novo botão de projeto Iniciar para iniciar a sessão de controle.
NOTA: Na sessão de controle, há várias caixas em branco e botões de menu. As caixas em branco são espaço de entrada para coordenadas. Depois de inserir coordenadas nas caixas em branco, o braço estereotaxizado motorizado se move clicando no botão Ir para. O botão Go To muda para um botão STOP quando o braço estereotaxic está se movendo. Entre vários botões de menu, apenas o botão Ferramenta é necessário neste protocolo. - Clique no botão Ferramenta. Calibrar o software de controle clicando no botão Calibrar o menu do quadro. Calibração é o processo pelo qual a posição real do manipulador é definida como valores no software Stereodrive.
- Execute o software de controle e selecione o novo botão de projeto Iniciar para iniciar a sessão de controle.
- Localize a ponta da agulha na superfície do cérebro exposta na superfície do crânio usando manipulador estereotaxico.
NOTA: A velocidade da agulha é definida usando o menu de velocidade Microdrive no menu Ferramenta. A velocidade padrão é de 3,0 mm/s. No entanto, recomenda-se uma velocidade de 0,5 mm/s nesta etapa. O movimento da agulha é controlado pelas teclas de seta. - Adicione 2-3 gotas de PBS para manter a superfície cerebral molhada. Preencha a caixa em branco na tela do computador com coordenadas DV apropriadas da LA. Se a superfície cerebral estiver seca, dificulta a penetração da agulha no tecido cerebral.
- Abaixe a agulha de 26 G clicando no botão Ir para. Ele pára automaticamente quando a agulha atinge o local alvo definido pelas coordenadas DV. A velocidade da agulha é de 100 μm/min. Se houver sangramento, pare a agulha clicando no botão STOP e lave a superfície cerebral com PBS. Mantenha a superfície cerebral molhada nesta etapa. Depois que o sangramento é interrompido, comece a baixar novamente.
- Depois que a agulha parar completamente de se mover, digite 45,00 mm na caixa em branco na tela do computador.
NOTA: 45,00 mm é um valor da coordenada DV que faz a agulha retornar à posição inicial. - Eleve a agulha clicando no botão Ir para. A velocidade do movimento da agulha é de 100-200 μm/min.
- Depois que a agulha parar de se mover, remova o PBS na superfície cerebral. Desinstale a agulha e o suporte de cânula do quadro estereotaxista. O experimentador pode parar manualmente a agulha clicando no botão STOP quando necessário.
- Equipar a haste estereottaxic com o suporte da lente. Instale a lente GRIN no suporte da lente.
NOTA: A lente GRIN otimizada para mirar o LA (0,6 mm de diâmetro, 7,3 mm de comprimento) é usada neste protocolo. Se o suporte da lente não estiver preparado, uma maneira alternativa é usar um clipe bulldog para segurar a lente GRIN. - Desinfete a lente com 70% de etanol e conecte a haste estereotaxic aos quadros estereotaxicos.
- Localize a ponta da lente GRIN no local designado na superfície do crânio (mesmo método descrito na etapa 2.8).
NOTA: A coordenada da lente GRIN é (AP, ML, DV) = (-1,6 mm, -3,55 mm, -4,2 mm)(Figura 1C). A lente não deve tocar no crânio para evitar danos na ponta. - Calcule a coordenada DV subtraindo o valor absoluto de "Valor A" da coordenada DV da implantação da lente descrita na etapa 2.16.
- Queda de 2-3 gotas de PBS na superfície cerebral. Digite 1000 μm para abaixar e 300 μm para levantar a lente na caixa em branco na tela do computador.
- Repita a redução (1000 μm para baixo) e a elevação (300 μm para cima) da lente GRIN até chegar ao local alvo. Este procedimento para cima e para baixo é usado para ajudar a liberar a pressão gerada dentro do tecido cerebral devido ao procedimento de redução da lente que de outra forma pode causar distorção das estruturas cerebrais ao longo do caminho de implantação.
NOTA: A velocidade do movimento da lente GRIN é de 100 μm/min. Mesmo que haja sangramento, não pare de mover a lente GRIN e lave a superfície cerebral com PBS. Mantenha a superfície cerebral molhada nesta etapa. Se a superfície cerebral estiver seca, o tecido cerebral gruda na superfície da lente GRIN e causa distorção da estrutura cerebral. - Se a lente GRIN chegar ao local alvo, remova o PBS e aplique cuidadosamente o cimento dentário de resina ao redor da lente GRIN, os parafusos e sua parede lateral(Figura 1D).
NOTA: A aplicação do cimento de resina por todo o crânio pode reduzir os artefatos de movimento. Pelo contrário, se o cimento de resina acidentalmente cobre os músculos ligados ao crânio, aumenta os artefatos de movimento. - Após o freio de cimento dentário de resina endurecer, desmonte a lente GRIN do suporte da lente e aplique cimento acrílico por todo o crânio(Figura 1D).
- Para fixar a placa da cabeça, desmonte o suporte da lente da haste estereotaxic e coloque a placa da cabeça na ponta da haste usando fitas. Confirme se a placa da cabeça é horizontal.
NOTA: Uma placa inclinada da cabeça causa uma visão inclinada. Uma placa de cabeça é necessária para fixar a cabeça do mouse no sistema de gaiola doméstica móvel (na seção de fixação da placa base). Se o experimentador não usar o sistema, pule esta etapa (etapa 2.22) e a etapa seguinte 2.23. - Abaixe lentamente a haste até que a placa da cabeça se localize na parte superior da braçadeira da lente. Abaixe a placa da cabeça 1000 μm a mais. Mova a placa da cabeça para a lente GRIN implantada para localizar na borda direita do anel interno da placa.
NOTA: A placa da cabeça deve ser posicionada mais baixa do que a superfície da lente GRIN implantada; caso contrário, o microscópio não pode se aproximar o suficiente da lente GRIN implantada para ajustar o plano focal devido ao cimento acrílico. - Aplique cimento acrílico para fixar a placa da cabeça às camadas de cimento(Figura 1D).
- Conecte o filme de parafina na superfície da lente GRIN implantada para proteger a superfície da lente contra o pó. Em seguida, aplique uma ligação epóxi removível no filme de parafina para manter o filme de parafina permanecendo na superfície da lente.
- Injete Carprofen, uma solução analgésico (0,5 mg/mL em PBS), e Dexamethasona, uma solução anti-inflamatória (0,02 mg/mL em PBS), na cavidade peritoneal do camundongo.
NOTA: A dose da droga depende do peso corporal: Carprofen (5 mg∙kg-1 de peso corporal) e Dexametasona (0,2 mg∙kg-1 de peso corporal). Tanto Carprofen quanto Dexametasona são administrados após cirurgia e uma vez por dia durante 7 dias após a cirurgia. - Misture 0,3 mg/mL amoxicilina, um antibiótico, na água da gaiola doméstica para administrar a droga por 1 semana.
- Devolva o rato para a gaiola doméstica e permita 5-8 semanas para recuperação e transdução do vírus.
NOTA: O rato é recuperado em uma gaiola pré-aquecida em um cobertor elétrico até que o rato acorde do anestésico.
3. Validação da implantação da lente GRIN
NOTA: A validação da implantação da lente GRIN fornece informações sobre se a lente GRIN implantada está no alvo para células expressas GCaMP. Com base nessas informações, o experimentador economiza seu tempo de processos demorados, como o teste de comportamento e o processamento de dados, excluindo animais com implantação de lentes GRIN fora do alvo. Durante o procedimento de validação, as células com expressão GCaMP devem ser focadas no campo de visão de gravação. Uma gaiola doméstica móvel é usada nesta etapa. Uma gaiola doméstica móvel é um aparelho especializado em forma redonda que permite que ratos com fixação na cabeça movam livremente suas pernas durante a validação da implantação da lente GRIN e do acessório de placa base. Uma mesa de transporte aéreo neste aparelho no qual as pernas dos ratos fixos da cabeça são colocadas permite tal livre circulação de pernas, embora a cabeça esteja fixa. As células do núcleo lateral da amígdala são geralmente silenciosas em um estado de repouso ou anestesiado, de modo que os sinais de fluorescência GCaMP raramente são detectados nessas condições, o que torna muito difícil, às vezes impossível, encontrar células expressando GCaMP durante a validação da implantação da lente GRIN e do acessório de placa base. No entanto, o movimento das pernas muitas vezes produz sinais de fluorescência GCaMP nas células do núcleo lateral da amígdala e, assim, pode ajudar a localizar o microscópio. Assim, a gaiola doméstica móvel é usada neste protocolo.
- Monte o manipulador estereotílico para o sistema de gaiola doméstica móvel.
- Anestesiar o rato com 1,5% de gás isoflurane. Depois que o mouse estiver completamente inconsciente, coloque o mouse na barra principal do sistema de gaiola doméstica móvel.
- Localize a jaula de carbono sob o rato. Feche a gaiola de carbono e ligue o fluxo de ar para fazer a gaiola se mover livremente sem atrito. Espere alguns minutos até que o mouse fique ativo.
NOTA: A velocidade do fluxo de ar deve ser otimizada para cada condição experimental (aqui, 100 L/min). - Remova o filme de parafina e a ligação epóxi na superfície da lente GRIN implantada e limpe a superfície da lente com 70% de etanol usando papel de lente.
- Prepare o software de aquisição de dados (DAQ) (por exemplo, Inscopix). Defina as condições de imagem.
NOTA: O software DAQ é usado para controlar o microscópio (energia LED, foco de lente, etc.) e armazenamento de dados.- Ligue a caixa DAQ e conecte um microscópio a ele. Em seguida, conecte-o a um computador portátil usando diretamente um cabo ou via internet sem fio.
NOTA: O software DAQ está instalado no hardware extra chamado caixa DAQ (por exemplo, Inscopix). Ao conectar a caixa DAQ ao computador portátil, o software DAQ torna-se acessível em um computador portátil. - Acesse o software DAQ através de um navegador de internet (o Firefox é recomendado).
- Defina todos os detalhes necessários (Data, ID do mouse,etc.) na Sessão Definida. Em seguida, clique em Salvar e Continuar. Depois de economizar, acesse a sessão Executar.
- Na Sessão de Execução,defina as condições de imagem, como tempo de exposição, ganho, foco eletrônico e energia LED de exposição.
NOTA: A energia led de ganho e exposição é mutável dependendo das condições laboratoriais. O valor recomendado para foco elétrico é de 500 e o tempo de exposição é de 50 ms. Não há restrição para alterar a potência e o ganho de LED. No entanto, uma maior intensidade de luz pode causar mais branqueamento. O tempo de exposição da gravação determina uma taxa de quadros de gravação de vídeo. Taxas de quadros mais altas reduzirão a intensidade do sinal. As taxas de quadros devem ser otimizadas para os GECIs utilizados para a imagem.
- Ligue a caixa DAQ e conecte um microscópio a ele. Em seguida, conecte-o a um computador portátil usando diretamente um cabo ou via internet sem fio.
- Para segurar o microscópio em um manipulador estereotaxico, conecte a haste estereotaxic com pinça de microscópio ao manipulador estereotílico.
NOTA: O gripper é um pequeno acessório que pode ser anexado ao aparelho estereotaxico para segurar um corpo de microscópio para colocá-lo na localização cerebral alvo. - Segure o microscópio com o gripper do microscópio. Acenda a luz LED conectada ao microscópio e alinhe o microscópio verticalmente. Abaixe o microscópio enquanto observa a imagem até que a superfície da lente GRIN implantada apareça.
- Alinhe o centro da lente GRIN implantada com o centro da vista.
NOTA: A validação da implantação da lente GRIN pode ser realizada nesta etapa (mencionada na seção de resultado, Figura 2B, Figura 2D, Figura 2F). - Capture a imagem da superfície da lente GRIN implantada (clique no botão Prt Sc no teclado). A imagem da superfície da lente GRIN implantada é necessária para desmarcar componentes não neuronais durante o processamento posterior de dados (etapa 6.8).
- Encontre a posição apropriada do microscópio. Eleve lentamente a lente objetiva do microscópio enquanto observa a imagem para procurar células com expressão GCaMP7b.
NOTA: Pode ser necessário ajustar o ganho da aquisição da imagem ou a potência LED de exposição. A validação da implantação da lente GRIN pode ser realizada nesta etapa (mencionada na seção de resultados, Figura 2A, Figura 2C, Figura 2E).
4. Fixação em placa base
NOTA: A etapa de fixação da placa base segue a validação da implantação da lente GRIN. A placa base é uma plataforma para montar o microscópio na cabeça de ratos. Como mencionado na seção anterior, uma gaiola doméstica móvel é usada neste protocolo.
- Após validar a implantação da lente GRIN, desmonte um microscópio em miniatura do gripper do microscópio.
- Conecte a placa base ao microscópio. Aperte o parafuso usando chave hexa-chave para fixação estável da placa base ao microscópio.
- Segure o microscópio com o gripper do microscópio. Acenda a luz LED conectada ao microscópio e alinhe o microscópio verticalmente. Abaixe o microscópio até que a superfície da lente GRIN implantada seja observada. Alinhe o centro da lente GRIN implantada com o centro da vista.
- Encontre a posição apropriada do microscópio. Eleve lentamente a lente objetiva do microscópio até encontrar um plano focal que dê melhores imagens de células com expressão GCaMP7b(Figura 2A).
NOTA: Pode ser necessário ajustar o ganho de aquisição de imagem ou exposição de energia LED durante esta etapa. - Aplique cimento acrílico para fixar a placa base à placa da cabeça(Figura 2G). Construa as paredes laterais com cimento acrílico entre a placa base e a placa da cabeça.
NOTA: O cimento acrílico encolhe quando endurece. Por essa razão, não remova o microscópio até que o cimento endureça completamente (este passo leva pelo menos 30 minutos). O cimento deve ser feito com muito cuidado para evitar o cimentação indesejado do microscópio e sua lente objetiva com cimento acrílico. - Depois que o cimento acrílico endurecer completamente, solte o parafuso e eleve o corpo do microscópio lentamente.
- Se houver uma lacuna na parede lateral, refaça a cimentação adicional para proteger a lente GRIN implantada da poeira.
- Cubra a placa base para proteger a lente GRIN implantada do pó e aperte o parafuso da placa base.
- Solte a placa da cabeça da barra da cabeça. Volte mouse para gaiola doméstica até futuras imagens ópticas.
5. Gravação óptica do sinal GCaMP durante um teste de comportamento
NOTA: O procedimento de gravação de sinal GCaMP durante o comportamento pode ser muito diferente dependendo dos sistemas utilizados para imagem óptica, design experimental e ambiente laboratorial. Portanto, é descrito de forma simples nesta seção.
- Realize vários dias de manuseio antes do teste de comportamento.
- Prepare o aparelho de comportamento (por exemplo, câmara de condicionamento do medo, software de comportamento e o Instrumento Coulbourn) e computador portátil.
- Conecte o microscópio na caixa DAQ e ligue a caixa DAQ.
- Conecte a caixa DAQ ao computador portátil via conexão de internet sem fio.
- Inicie o software DAQ (o navegador Firefox é recomendado) no computador portátil. Clique no botão Gerenciador de arquivos e verifique a capacidade de armazenamento restante da caixa DAQ para salvar dados gravados.
NOTA: O tamanho dos dados é de aproximadamente 80 GB para gravação de 30 minutos. - Digite as informações necessárias (Data, ID do mouse,etc.) na sessão Definida e entre na sessão Executar.
- Pegue suavemente o mouse e remova a tampa da placa base na cabeça. Colocando o microscópio na plataforma base.
- Aperte o parafuso da placa base e coloque o animal com um microscópio de montagem da cabeça na câmara de comportamento.
NOTA: O mouse tenta escapar nesta etapa se o manuseio não for suficiente. - Conecte a placa NI à porta TRIG da caixa DAQ usando um cabo BNC. A placa NI recebe sinais TTL do software de comportamento (por exemplo, FreezeFrame) e coordena o procedimento de gravação simultânea do sinal GCaMP e do comportamento do animal.
- Ajuste o plano focal.
NOTA: O plano focal é determinado pela distância entre a lente objetiva do microscópio e a lente GRIN implantada no cérebro. Para ajustar o plano focal, a posição objetiva da lente é manipulada ao observar imagens. A distância entre essas duas lentes que mostra morfologia clara das células e vasos sanguíneos é definida como o plano focal para a imagem. Neste protocolo, o software DAQ é usado para controlar o movimento da lente objetiva durante o ajuste. - Defina o tempo de exposição otimizado, o ganho, a potência led na sessão Executar.
NOTA: Geralmente, 50 ms são usados para o tempo de exposição. O ganho e a potência led são definidos com base em histogramas de imagem. Histogramas indicam a distribuição da intensidade da fluorescência dos pixels. Com base na inspeção visual, a borda direita do histograma deve ter um valor entre 40% e 60% no caso do GCaMP7b. Ele muda dependendo dos GECIs usados para imagem. - Alterar a opção de gravação para gravação ativada. Clique em Gravar e inicie o comportamento.
NOTA: A opção de gravação acionada fornece uma linha do tempo combinada da sessão de gravação e da sessão de comportamento. Se o sinal TTL for recebido, uma luz vermelha acima da porta TRIG se acenderá. - Após terminar o teste de comportamento, desprender o microscópio e anexar a tampa da placa base.
- Devolva o rato para a jaula. Em seguida, selecione O gerenciador de arquivos e os dados de exportação da caixa DAQ.
- Após o teste de comportamento, sacrifique o rato para verificação histológica pós-morte.
6. Processamento de dados
NOTA: O procedimento de processamento de dados é muito diferente dependendo do software de processamento de dados e dos GECIs utilizados para o experimento de imagem. Portanto, é descrito de forma simples nesta seção. Este protocolo utiliza software de processamento de dados comerciais (ver Tabela de Materiais). Alternativamente, outros softwares de código aberto mencionados na seção de discussão também podem ser usados sem problemas. As variáveis utilizadas neste protocolo estão listadas na Tabela 1.
- Importe o arquivo de dados de vídeo de gravação (1280 pixels x 800 pixels) da caixa DAQ para o computador desktop para processamento de dados. Inicie o software de processamento de dados.
NOTA: O software de processamento de dados é diferente do software DAQ em etapas anteriores. No software de processamento de dados, há 6 passos: amostragem, corte, filtro espacial, correção de movimento, cálculo ΔF/F, detecção de eventos necessários para extrair dados transitórios de cálcio de célula única do vídeo gravado. - Downsample e crop o vídeo.
NOTA: A baixa amostragem e o corte são necessários para aumentar a velocidade de processamento de dados. Lavo a área, exceto região de interesse onde o sinal GCaMP é observado. - Aplique filtro espacial. Depois de aplicar filtro espacial, crie uma imagem de projeção de intensidade média.
NOTA: O filtro espacial distingue cada pixel na imagem de vídeo gravada e fornece uma imagem de alto contraste. Existem dois tipos de filtro de corte, filtro de corte baixo e alto. O maior valor dos filtros de corte baixo aumenta o contraste da imagem, mas no mesmo ruído cinza geral também aumenta. O menor valor do filtro de corte alto faz com que a imagem fique embaçada. - Aplique correção de movimento. Use a imagem de projeção de intensidade média como uma imagem de referência para correção de movimento.
- Aplique novamente a correção de movimento usando a imagem do primeiro quadro como uma imagem de referência.
NOTA: Dois passos de correção de movimento diminuem significativamente o artefato de movimento. - Aplique o cálculo ΔF/F para visualizar pixels que mostram uma mudança no brilho.
NOTA: A mudança de brilho dos pixels é causada pela mudança de intensidade de fluorescência do GCaMP, e indica transitórios de cálcio. - Aplique o algoritmo PCA/ICA para visualizar a curva transitória de cálcio de cada célula.
NOTA: PCA/ICA é um algoritmo para classificar um grupo de dados em um conjunto de dados de componentes únicos. As variáveis devem ser otimizadas para cada condição laboratorial. Neste protocolo, todas as variáveis são padrão, exceto o peso temporal do ICA (0,4 é usado neste protocolo)27. - Desmarque manualmente componentes não neuronais entre componentes identificados com base nos critérios descritos na nota a seguir.
NOTA: Dois critérios principais são utilizados para este fim. Primeiro, o sinal GCaMP originado de um neurônio parece uma forma esférica clara. Assim, apenas o sinal com uma forma esférica clara é selecionado como um neurônio. Em segundo lugar, dado o diâmetro do corpo celular da célula piramidala pirâmide é conhecido por ser aproximadamente 20 μm28,29,30, apenas o sinal aproximadamente corresponde a este tamanho é selecionado como um neurônio. Para determinar o tamanho do sinal GCaMP, o tamanho real de um único pixel é calculado com base na imagem capturada da superfície da lente (passo 3.9) e a largura máxima de forma esférica única é calculada. Por exemplo, neste protocolo, o diâmetro da lente GRIN implantada é de 600 μm. Portanto, se o diâmetro da lente é de 800 pixels, o tamanho real do pixel único é de 1,5 μm (20 μm é de cerca de 7 pixels). - Aplique a função de detecção de eventos para detectar um aumento significativo de cálcio transitório (evento de cálcio).
NOTA: Nesta etapa, é necessária a variável chamada evento menor tempo de decomposição (τ). Neste protocolo, o 1.18s é usado como uma variável otimizada para GCaMP7b. O tempo médio de meio decaimento (t1/2=0,82s) é calculado com base na curva ΔF/F durante a atividade espontânea das células. Uma vez que o GCaMP segue a decadência exponencial, τ =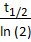 .
.
Resultados
Validação da implantação das lentes GRIN
Antes de anexar cronicamente a placa base ao cérebro por cimentação, a implantação da lente GRIN precisa ser validada. Em animais com implantação bem sucedida de lentes, tanto células expressas GCaMP quanto vasos sanguíneos foram claramente observados dentro de uma faixa de plano focal determinada pela distância entre lente objetiva de microscópio e lente GRIN implantada(Figura 2A e B
Discussão
Técnicas de cirurgia habilidosas são essenciais para alcançar imagens de cálcio óptica in vivo bem sucedidas com microscopia em miniatura de montagem de cabeça em regiões cerebrais mais profundas, como a amígdala como descrevemos aqui. Portanto, embora este protocolo forneça uma diretriz para processos cirúrgicos otimizados de fixação de placas base e implantação de lentes GRIN, processos adicionais de otimização podem ser necessários para etapas críticas. Como mencionado na seção de protocolo, amígd...
Divulgações
O autor não tem nada a revelar
Agradecimentos
Este trabalho foi apoiado por subsídios da Samsung Science and Technology Foundation (Project Number SSTF-BA1801-10).
Materiais
| Name | Company | Catalog Number | Comments |
| 26G needle | BD | 302002 | Surgery |
| AAV1-Syn-GCaMP7b-WPRE | Addgene | 104493-AAV1 | Surgery |
| AAV2/1-CaMKiiα-GFP | custom made | Surgery | |
| Acrylic-Dental cement (Ortho-jet Acrylic Pink) | Lang | 1334-pink | Surgery & Baseplate Attachment |
| Air flow manipulator | Neurotar | NTR000253-04 | Baseplate Attachment |
| Amoxicillin | SIGMA | A8523-5G | Surgery |
| Baseplate | INSCOPIX | 1050-002192 | Baseplate Attachment |
| Baseplate cover | INSCOPIX | 1050-002193 | Baseplate Attachment |
| Behavioral apparatus (chamber) | Coulbourn Instrument | Testcage | Behavior test |
| Behavioral apparatus (software) | Coulbourn Instrument | Freeze Frame | Behavior test |
| Carbon cage | Neurotar | 180mm x 70mm | Baseplate Attachment |
| Carprofen | SIGMA | PHR1452-1G | Surgery |
| Data processing software | INSCOPIX | INSCOPIX Data Processing Software | Baseplate Attachment & Behavior test |
| Dexamethasone | SIGMA | D1756-500MG | Surgery |
| Drill | Seyang | marathon-4 | Surgery |
| Drill bur | ELA | US1/2, Shank104 | Surgery |
| Glass needle | WPI | PG10165-4 | Surgery |
| GRIN lens (INSCOPIX Proview Lens Probe) | INSCOPIX | 1050-002208 | Surgery |
| Hamilton Syringe | Hamilton | 84875 | Surgery |
| Head plate | Neurotar | Model 5 | Surgery |
| Hex-key | INSCOPIX | 1050-004195 | Baseplate Attachment |
| Laptop computer | Samsung | NT950XBV | Surgery & Baseplate Attachment |
| Lens holder, Stereotaxic rod (INSCOPIX proview implant kit) | INSCOPIX | 1050-004223 | Surgery |
| Microscope gripper | INSCOPIX | 1050-002199 | Baseplate Attachment |
| Microscope, DAQ software, hardware | INSCOPIX | nVista 3.0 | Baseplate Attachment & Behavior test |
| Mobile homecage | Neurotar | MHC V5 | Baseplate Attachment |
| Moterized arm | Neurostar | Customized | Surgery |
| Moterized arm software | Neurostar | Customized | Surgery |
| NI board | National instrument | Behavior test | |
| Removable epoxy bond | WPI | Kwik-Cast | Surgery |
| Resin cement (Super-bond) | Sun medical | Super bond C&B | Surgery |
| Skull screw | Stoelting | 51457 | Surgery |
| Stereotaxic electrode holder | ASI | EH-600 | Surgery |
| Stereotaxic frame | Stoelting | 51600 | Surgery |
| Stereotaxic manipulator | Stoelting | 51600 | Baseplate Attachment |
Referências
- Gonzalez, W. G., Zhang, H., Harutyunyan, A., Lois, C. Persistence of neuronal representations through time and damage in the hippocampus. Science. 365 (6455), 821-825 (2019).
- Ghandour, K., et al. Orchestrated ensemble activities constitute a hippocampal memory engram. Nature Communications. 10 (1), 2637 (2019).
- Grundemann, J., et al. Amygdala ensembles encode behavioral states. Science. 364 (6437), (2019).
- Krabbe, S., et al. Adaptive disinhibitory gating by VIP interneurons permits associative learning. Nature Neuroscience. 22 (11), 1834-1843 (2019).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- LeDoux, J. E. Emotion circuits in the brain. Annual Review of Neuroscience. 23, 155-184 (2000).
- Burgoyne, R. D. Neuronal calcium sensor proteins: generating diversity in neuronal Ca2+ signalling. Nature Reviews Neuroscience. 8 (3), 182-193 (2007).
- Miyakawa, H., et al. Synaptically activated increases in Ca2+ concentration in hippocampal CA1 pyramidal cells are primarily due to voltage-gated Ca2+ channels. Neuron. 9 (6), 1163-1173 (1992).
- Denk, W., Yuste, R., Svoboda, K., Tank, D. W. Imaging calcium dynamics in dendritic spines. Current Opinion in Neurobiology. 6 (3), 372-378 (1996).
- Mank, M., et al. A genetically encoded calcium indicator for chronic in vivo two-photon imaging. Nature Methods. 5 (9), 805-811 (2008).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Huber, D., et al. Multiple dynamic representations in the motor cortex during sensorimotor learning. Nature. 484 (7395), 473-478 (2012).
- Grewe, B. F., et al. Neural ensemble dynamics underlying a long-term associative memory. Nature. 543 (7647), 670-675 (2017).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56 (2019).
- Jacob, A. D., et al. A Compact Head-Mounted Endoscope for In vivo Calcium Imaging in Freely Behaving Mice. Current Protocols in Neuroscience. 84 (1), 51 (2018).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Xiong, B., et al. Precise Cerebral Vascular Atlas in Stereotaxic Coordinates of Whole Mouse Brain. Frontiers in Neuroanatomy. 11, 128 (2017).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Millhouse, O. E., DeOlmos, J. Neuronal configurations in lateral and basolateral amygdala. Neuroscience. 10 (4), 1269-1300 (1983).
- McDonald, A. J. Neuronal organization of the lateral and basolateral amygdaloid nuclei in the rat. Journal of Comparative Neurology. 222 (4), 589-606 (1984).
- McDonald, A. J. Neurons of the lateral and basolateral amygdaloid nuclei: a Golgi study in the rat. Journal of Comparative Neurology. 212 (3), 293-312 (1982).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados