Method Article
רישום זרמים חשמליים על פני קרום הפלזמה של תאי זרע של יונקים
In This Article
Summary
פרוטוקול זה מתאר כיצד לבצע הקלטות חשמליות מתאי זרע של יונקים בתצורת תא שלם, במטרה להקליט ישירות את פעילות תעלות היונים. השיטה הייתה חיונית בתיאור הפרופילים האלקטרופיזיולוגיים של מספר תעלות יוני זרע וסייעה לחשוף את זהותם המולקולרית והוויסות שלהם.
Abstract
רישום הפעילות החשמלית מאחד התאים הקטנים ביותר של אורגניזם יונק - תא זרע - היה משימה מאתגרת עבור אלקטרופיזיולוגים במשך עשורים רבים. השיטה המכונה "מהדק תיקון זרע" הוצגה בשנת 2006. הוא איפשר רישום ישיר של פעילות תעלות יונים בתצורות של תאים שלמים ומחוברים לתאים והיה חיוני בתיאור הפיזיולוגיה של תאי הזרע והזהות המולקולרית של תעלות יונים שונות של סידן, אשלגן, נתרן, כלוריד ופרוטונים. עם זאת, רישום מזרעונים בודדים דורש מיומנויות מתקדמות והכשרה באלקטרופיזיולוגיה. פרוטוקול מפורט זה מסכם את ההליך שלב אחר שלב ומדגיש מספר 'טריקים של המקצוע' על מנת להפוך אותו לזמין לכל מי שרוצה לחקור את הפיזיולוגיה המרתקת של תא הזרע. באופן ספציפי, הפרוטוקול מתאר רישום מתאי זרע אנושיים ועכברים, אך ניתן להתאים אותו למעשה לכל תא זרע של יונקים מכל מין. הפרוטוקול מכסה פרטים חשובים של יישום טכניקה זו, כגון בידוד תאי זרע, בחירת ריאגנטים וציוד, קיבוע של התאים בעלי התנועה הגבוהה, היווצרות האיטום ההדוק (Gigaohm) בין אלקטרודת הקלטה לקרום הפלזמה של תאי הזרע, מעבר למצב זרע שלם (המכונה גם פריצה), והקלטות מופת של תעלת יוני הסידן של תא הזרע, CatSper, משישה מיני יונקים. נדונים היתרונות והמגבלות של שיטת מהדק תיקון הזרע, כמו גם השלבים הקריטיים ביותר.
Introduction
בדומה למהדק המדבקה המסורתי שהומצא על ידי ארווין נהר וברט סקמן1, מהדק טלאי תאי זרע מאפשר חקירה של פעילות תעלת יונים בודדת, כמו גם רישום מהפעילות של כל אוכלוסיית תעלות היונים בתוך התא הבודד 2,3. השיטה מאפשרת זיהוי של סוג תעלת יונים ספציפי בדרגות של ניתוק מתהליכים תוך-תאיים אנזימטיים. שיטה זו חיונית לקביעת פעילות תעלת יונים על סמך טביעות האצבע האלקטרופיזיולוגיות והפרמקולוגיות שלה, ולכן מספקת אסטרטגיית זיהוי אמינה. החיסרון של השיטה הוא חוסר היכולת שלה לזהות טרנספורטרים לא אלקטרוגניים. בנוסף, אימון אלקטרופיזיולוגי בסיסי עוזר להבין את הניואנסים של הפרוטוקול. כדי לשלוט בטכניקת מהדק התיקון וליישם אותה על זרעונים של יונקים, אנו ממליצים ללמוד ספרות בסיסית של מהדק טלאי 4,5. במאמר זה אנו מספקים הליך מפורט שלב אחר שלב ומדגישים שיטות ייחודיות שהופכות טכניקה זו לקלה להבנה וזמינה לכל מי שרוצה לתרגל אלקטרופיזיולוגיה של תאי זרע.
הומאוסטזיס יונים הוא פונקציה פיזיולוגית חיונית של תאי זרע המסתמכת במידה רבה על תעלות יונים ומובילי יונים כדי לשמור על שיפועי יונים חשובים מבחינה פיזיולוגית, לשנות סידן תוך תאי ולשנות את המתח הטרנסממברני. תעלות יונים ומובילי יונים מווסתים פונקציות חיוניות של תאי זרע כגון תנועתיות, ניווט במערכת הרבייה הנשית, הבשלת הזרע, ובאורגניזמים ימיים, כימוטקסיס לכיוון הביצית 6,7,8,9,10,11,12 . תנועתיות הזרע היא תהליך נרכש בהדרגה. תאי הזרע שקטים בעיקר במהלך התבגרותם באשך ובמהלך מעברם באפידידימיס. התנועתיות שלהם מרוסנת על ידי סביבה אפידידימלית חומצית המובילה להחמצה פנימית של תא הזרע. זה פוגע בתפקוד האקסונם מכיוון שהוא אינו מסוגל לתפקד מתחת ל-pH 6.0 13,14. עם זאת, עם חשיפה לנוזלי הזרע או לסביבה בסיסית יותר, ריכוזי היונים התוך-תאיים של הזרע וה-pH הציטופלזמי עוברים שינויים גדולים והזרע הופך לתנועתי 15,16,17. התנועה של דגל הזרע מופעלת על ידי הידרוליזה של ATP התומכת בהחלקה של מיקרו-צינורות אקסונמליים18 ותהליך זה תלוי מאוד ב-pH14. בנוסף, תנועת הדגל נשלטת גם על ידי עלייה של סידן תוך-דגלי ו-cAMP 13,19,20,21,22,23,24. גורמים אלה, כלומר ריכוז הסידן התוך תאי בזרע [Ca2+]i, pH, ATP ו-cAMP הם מנגנוני הוויסות העיקריים המאפשרים שינויים בתנועתיות וריכוזם מוסדר היטב על ידי תעלות יוני הזרע והמובילים.
תאי הזרע ייחודיים בכך שהם מבטאים מספר חלבונים שלא ניתן למצוא בשום מקום אחר בגוף. דוגמאות בולטות הן תעלות יוני זרע, כגון תעלת האשלגן, Slo3 25,26,27,28,29 והתעלה היונית החתוליתשל Sperm, CatSper 2,30,31,32. האחרון הוא ערוץ הסידן העיקרי של זרעונים של יונקים31, ומווסת על ידי אלקליזציה תוך-תאית 2,30,31,32,33,34. CatSper מווסת גם על ידי רמזים ספציפיים למין 7,35 ומאורגן בננו-דומיינים אורכיים מרובעים לאורך דגל הזרע 36,37,38. בפרימטים, CatSper מופעל על ידי שילוב של בסיסיות דגל, דה-פולריזציה של הממברנה ופרוגסטרון 3,39,40,41, בעוד שעבור עכברים אין צורך בפרוגסטרון 2,39. מאפיין ספציפי נוסף של ערוץ זה הוא הארגון הרב-יחידתי שלו: CatSper הוא קומפלקס של לפחות 10 יחידות משנה שונות 31,32,34,37,38,42,43,44,45,46,47. מבנה מתוחכם כזה ופרטי הוויסות שלו עיכבו את הביטוי הרקומביננטי של CatSper בכל מערכת ביטוי הטרולוגית ידועה, ולכן האפיון הפיזיולוגי של CatSper הוגבל למערכת הביטוי המקורית שלו - תא הזרע. בעוד שאפיון מולקולרי של חלבון CatSper הושג במאמר מכונן בשנת 2000 על ידי D. Ren et. al.31, ההוכחה האולטימטיבית לכך ש-CatSper היא תעלת יונים בתום לב התאפשרה רק לאחר הצגת שיטת מהדק טלאי הזרע בשנת 20062. מאז טכניקה זו אפשרה אפיון מדויק של מסלולים מוליכים יונים רבים בתאי זרע 9,28,37,39,40,44,46,48-54.
השיטה הקלאסית והפשוטה ביותר לחקר מאפייני תעלות יונים - טכניקת מהדק התיקון - האמינה כלא ישימה לתאי זרע בשל התנועתיות והמורפולוגיה הספציפית שלהם (איור 1A). באופן ספציפי, הנפח הזעיר של ציטופלזמת הזרע והחיבור ההדוק של קרום פלזמת הזרע למבנים התוך-תאיים הנוקשים כגון המעטפת הסיבית והגרעין של הזרע היו האתגרים העיקריים55. שני המאפיינים המבניים הללו מביאים לתא דק בצורת חץ שנועד לחדור דרך סביבות צמיגות מאוד כגון בגדי מגן של ביצים, ללא עיוות משמעותי או נזק לקרום הפלזמה.
השלב הראשון בשיטת מהדק התיקון הוא הקמת האיטום ההדוק בין פיפטת הקלטה (מיקרופיפטה מזכוכית) לקרום הפלזמה של התא. על מנת להשיג זאת, יש למשוך מספיק קרום פלזמה בתוך פיפטת ההקלטה כדי שייווצר ג'יגה-סיל יציב מכנית בין קרום הפלזמה לזכוכית. ממברנת הפלזמה חייבת להיות גמישה ולא נוקשה (איור 1B). כפי שהוזכר לעיל, כל פני השטח של קרום פלזמת הזרע דבוקים למדי, למעט האזור המכונה טיפה ציטופלזמית (איור 1A ואיור 2). לפיכך, האופי הנוקשה של קרום הפלזמה של הזרע נחשב למכשול עיקרי בהשגת האיטום ההדוק או 'ג'יגה-סיל', שנקרא כך מכיוון שנדרשים >109 אוהם להקלטות טובות. עם זאת, הכנסת טכניקת מהדק תיקון הזרע בשנת 20062 הסירה את המחסום הזה וניתן ליישם שיטה זו בהצלחה על תאי זרע של מספר מיני יונקים 2,41,51,56. פריצת הדרך הזו הושגה על ידי התמקדות בטיפה הציטופלזמית (CD)2,8, מבנה זעיר שנמצא לאורך החלק האמצעי של הזרע (איור 1A ואיור 2), והוא פשוט שריד של הזרע המוארך – קודמן של תאי זרע שממנו מתפתחים הראש והזנב. מבחינה תפקודית, הוא עשוי לעזור לתאים להסתגל לשינויים באוסמולריות החוץ-תאית במהלך השפיכה. המאפיין החשוב הוא שממברנת הפלזמה בתוך התקליטור גמישה מספיק כדי להימשך לתוך הפיפטה ליצירת אטם ג'יגה-אום. לפיכך, תקליטור הזרע הוא החלק הטוב ביותר על פני הזרע שדרכו ניתן להשיג היווצרות מוצלחת של ג'יגה-סיל ולעבור למצב של תא שלם שבסופו של דבר מצמיד חשמלית את תא הזרע למגבר מהדק טלאי 2,8. ראוי לציין, כי פרסומים קודמים דיווחו על היווצרות מוצלחת של ג'יגה-סיל בראש הזרע, המאפשרת רישום בתצורה המחוברת לתא 54,57,58,59. עם זאת, ההקלטות בתצורת תא שלם דווחו עד כה רק על ידי ביצוע היווצרות ג'יגה-סיל באזור התקליטורים. מצב תא שלם זה מאפשר גישה חשמלית לכל נפח תאי הזרע, ולכן מאפשר זיהוי של פעילויות תעלות יונים הממוקמות על דגל הזרע, כמו גם על ראש הזרע. במשך שנים ספורות בלבד מאז פיתוחה, טכניקת מהדק תיקון הזרע הביאה להתקדמות אדירה בהבנתנו את תעלות יוני הזרע ועד כה היא אחת הטכניקות החזקות ביותר לחקירה ישירה של הפונקציונליות של תעלות יוני הזרע 9,28,37,39,40,44,46,48,49, 50,51,52,53 (איור 1).
מהדק תיקון זרע משתנה בפרטים מסוימים מטכניקת מהדק התיקון הקלאסית כמתואר להלן. ראשית, רוב קרום פלזמת הזרע מחובר היטב למבנה התוך תאי הנוקשה ומכאן, לזרעונים אין כמעט קרום פלזמה "רזרבי" שניתן למשוך לתוך הפיפטה. האזור היחיד שהוא גמיש הוא קרום התקליטור הדומה לקרום פלזמה של תאים סומטיים רבים, ולכן ניתן למשוך אותו בקלות לתוך הפיפטה. כדי ליצור אטם ג'יגה-אוהם עם התקליטור, נוצר לחץ שלילי על ידי יניקה קלה בחלק העליון של הפיפטה במטרה למשוך חלק קטן מממברנת פלזמת הזרע לתוך קצה המיקרופיפטה (איור 1B). חלק זה של הממברנה יוצר פלישה בצורת Ω לקצה הפיפטה ויוצר אטימה הדוקה עם קירותיו הפנימיים.
שנית, הטיפה הציטופלזמית בזרעונים של בני אדם ועכברים היא בין 1 ל-2 מיקרומטר (איור 1 ואיור 2). לפיכך, היישום של טכניקת מהדק תיקון על אובייקט כה קטן דורש אופטיקה ברזולוציה גבוהה. רוב אסדות מהדק הזרע מצוידות במיקרוסקופ הפוך עם ניגודיות הפרעות דיפרנציאלית (DIC) או רכיבים אופטיים של נומרסקי (איור 2 ואיור 3). מומלץ מאוד להשתמש במיקרוסקופ המצויד באופטיקה של DIC עבור מהדק תיקון זרע על פני אופטיקה קונבנציונלית יותר של ניגודיות פאזה, מכיוון שהמידע המרחבי הנראה ב-DIC מסייע להשיג דיוק מעולה במיקום פיפטת תיקון על התקליטור הזעיר. אנו ממליצים גם להשתמש באובייקט טבילה במים פי 60 או עדשה דומה, עם צמצם מספרי של 1.2. למטרה זו יש מרחק עבודה ארוך (0.28 מ"מ), המאפשר תצפית על תאי זרע שוחים חופשיים בתמיסה (איור 2). למטרה יש גם צווארון כוונון להתאמה לעובי החלקת הכיסוי (משתנה בין 0.13 ל -0.21 מ"מ). שילוב זה של מרחק עבודה ארוך וצווארון כוונון מאפשר תצפית דרך שתי החלקות כיסוי של 0.13 מ"מ; פתק כיסוי אחד משמש כתחתית הזכוכית של תא ההקלטה, וכיסוי 5 מ"מ עם תאי זרע מופקדים מונח מעל. כפי שנדון להלן, הפקדת תאי זרע על כיסויים עגולים של 5 מ"מ הניתנים להחלפה בקלות, במקום בתחתית תא ההקלטה ישירות, היא דרך נוחה להעמיס תאי זרע טריים לתוך תא ההקלטה.
שלישית, אסדת מהדק תיקון הזרע חייבת להיות מצוידת במגבר מהדק תיקון עם רעש נמוך ובדיגיטייזר כדי להקליט זרמים חשמליים זעירים (טווח פיקו-אמפר) ושינויים זעירים בפוטנציאל הממברנה. ציוד זה חייב להבטיח את הנמוך ביותר ampרעש חיים יותר. היעדר רטט הוא חלק חיוני בהקלטה מוצלחת של מהדק תיקון. הידוק טלאי זרע דורש מיקרומניפולטור מדויק נטול סחיפה שניתן לחבר למיקרוסקופ ההפוך עם פלטפורמת מיקרומניפולטור כדי להבטיח יציבות טובה יותר מאשר מעמד מיקרומניפולטור עצמאי (איור 3A). כדי לבדוק את ההגדרה, אין לראות שום תנועה של קצה הפיפטה (מתחת להגדלה של פי 60) גם כאשר אדם קופץ למעלה ולמטה על הרצפה ליד שולחן בידוד הרעידות.
Protocol
כל הניסויים בוצעו בהתאם להנחיות ה-NIH למחקר בבעלי חיים ואושרו על ידי הוועדה לטיפול ושימוש בבעלי חיים של אוניברסיטת ברקלי (AUP 2015-07-7742), תוך כל מאמץ למזער את סבלם של בעלי החיים. כל השיטות המתוארות עולות בקנה אחד עם המלצות הפאנל להמתת חסד של האגודה האמריקאית לרפואה וטרינרית וועדת IACUC. כל הליכי הניסוי המשתמשים בדגימות שמקורן בבני אדם אושרו על ידי הוועדה למחקר בבני אדם באוניברסיטת קליפורניה, ברקלי, פרוטוקול IRB מספר 2013-06-5395.
1. הכנת מיקרופיפטות זכוכית להקלטת מהדק תיקון זרע של תאים שלמים.
הערה: הגודל הקטן של הטיפה הציטופלזמית דורש מיקרופיפטות זכוכית עם קצות עדינים.
- לייצור מיקרופיפטה, התחל עם נימי זכוכית בורוסיליקט בקוטר חיצוני 1.5 מ"מ, קוטר פנימי 0.86 מ"מ ונימה פנימית. משוך את הקצה על חולץ מיקרופיפטה (איור 3B).
- לעיצוב וליטוש של קצה הפיפטה, מקם חוט חם בסמיכות לקצה לרגע. בצע תהליך זה של ליטוש אש בהגדלה של פי 100 באמצעות מלטש פיפטה (איור 3C,D).
- ודא שהקוטר הפנימי של קצה הפיפטה הוא ~2 מיקרומטר לפני ליטוש אש ומצטמצם ל-~0.5 מיקרומטר לאחר ליטוש מתאים.
הערה: רק פיפטות טריות שנשלפו ביום ההקלטה מומלצות לשימוש. זה מונע הצטברות של חלקיקי אבק על קצה הפיפטה.
2. הקמת האסדה
- הרכבת תא ההקלטה
- השתמש בתא זלוף בצורת יהלום בנפח נמוך עם זרימה למינרית ושערי חליפין מהירים יחסית של תמיסה (איור 4). חבר את התא באמצעות סעפת למערכת זלוף מוזנת בכוח הכבידה (איור 5).
- כדי להחדיר תמיסה דרך תא ההקלטה, הרכיבו מערכת זלוף פשוטה מתוצרת עצמית המוזנת בכוח הכבידה עם סעפת פוליטטרפלואורואתילן המחברת את תא הזלוף לשמונה קווי זלוף נפרדים.
הערה: הצינורות לא צריכים לדלוף חומרי גלם לתמיסות, מכיוון שכימיקלים כאלה יכולים להשפיע באופן משמעותי על התפקוד התקין של תאי הזרע60 ולשנות את פעילות תעלת היונים61,62. צינור פוליטטרפלואורואתילן בקוטר קטן מומלץ מאוד כצינור הזלוף העיקרי. - מכיוון שצינורות פוליטטרפלואורואתילן נוקשים למדי, צור חיבורים גמישים עם צינורות סיליקון בטוהר גבוה המתאימים מעל צינורות הפוליטטרפלואורואתילן. בנוסף, השתמשו במזרקים (למשל, מזרק Luer Lock) חסרי חומר סיכה, מכיוון ששמן מינרלי או תוספי סיכה אחרים יכולים להפריע לרישום תעלות יונים (איור 5).
- הרכבת גשר אגר
- כדי למנוע שינויים בפוטנציאל צומת הנוזל במהלך ההקלטות, שמרו על יציבות הסביבה סביב אלקטרודת הייחוס באמצעות גשר אגר (איור 4).
- כדי ליצור גשר אגר, הכינו נימי זכוכית בצורת L על ידי כיפופו מתחת לאש מבער בונסן קטן ותנו לו להתקרר.
- הכינו תמיסה של 1% אגרוז ב-1 M KCl וחממו אותה במיקרוגל עד שהאגרוז נמס והתמיסה הופכת לשקופה. מלאו בזהירות את נימי הזכוכית בצורת L בתמיסה הנ"ל כדי למנוע בועות אוויר ולתת לו להתקרר לטמפרטורת החדר. ניתן לאחסן את גשרי האגר ב-1 M KCl למשך ~2 חודשים בטמפרטורה של +4 מעלות צלזיוס.
- כדי להשתמש בגשר אגר, מלא אלקטרודת ייחוס גלולה Ag/AgCl ב-1 M KCl והכנס את גשר האגר בזהירות כדי למנוע אגרוז מוצק שיצא מנימי הזכוכית.
- לאחר מכן, הכנס את סיכת הזהב (2 מ"מ) של המגבר חוט ראש הבמה לחריץ אלקטרודת הייחוס 2 מ"מ (זהב) והכנס את קצה גשר האגר בצורת L לתא הזלוף כפי שמוצג באיור 4.
- פתרונות ומתכונים
הערה: כל הריאגנטים והכימיקלים חייבים להיות בטוהר הגבוה ביותר. כל התמיסות המוכנות מסוננות דרך מסנן PES סטרילי של 0.22 מיקרומטר ומאוחסנות בטמפרטורה של 4 מעלות צלזיוס עד חודש. יש לציין כי ההתאמה המדויקת של האוסמולריות היא תנאי מוקדם להידוק תיקון מוצלח.- הכן תמיסת נוזל צינורי אנושי (HTF) כמתואר בטבלה 1. התאם את ה-pH ל-7.4 עם NaOH. האוסמולריות צריכה להיות 280 ± 5 mOsm, הנמדדת באמצעות אוסמומטר לחץ אדים.
- הכן תמיסת מלח גבוהה (HS) "אמבטיה" או "חוץ-תאית" כמפורט בטבלה 2. התאם את ה-pH ל-7.4 עם NaOH. האוסמולריות צריכה להיות 320 ± 5 mOsm.
- הכן את תמיסת הצזיום מתאן מתאן "אמבטיה" או "חוץ-תאית" כמתואר בטבלה 3. התאם את ה-pH ל-7.4 עם CsOH ואת האוסמולריות ל-320 ±-5 mOsm.
- כדי להכין את תמיסת ה"פיפטה" התוך-תאית של צזיום מתאן-סולפונאט (CsMeSO3), עקוב אחר טבלה 4 והתאם את ה-pH ל-7.4 עם CsOH. האוסמולריות צריכה להיות גבוהה עד 10 mOsm מתמיסת HS.
3. בידוד וטיהור זרעונים של יונקים
הערה: המתת חסד של עכברים זכרים C57BL/6 בגילאי 3-6 חודשים על ידי שאיפת CO2 ואחריה פריקת צוואר הרחם. לאחר פריקת צוואר הרחם, בצע מיד איסוף רקמות (זנב או קורפוס אפידידימיס) מעכברים.
- בידוד של זרע עכבר אפידידימלי
הערה: המתת חסד של עכברים זכרים C57BL/6 בגילאי 3-6 חודשים על ידי שאיפת CO2 ואחריה פריקת צוואר הרחם. לאחר פריקת צוואר הרחם, בצע מיד איסוף רקמות (זנב או קורפוס אפידידימיס) מעכברים.- פתח את אזור הבטן התחתונה של העכבר בעזרת מספריים וחלץ את שני האפידידימידים.
- מניחים אותם בתבנית תרבית תאים בגודל 35 מ"מ מלאה בתמיסת HS (תמיסת מלח גבוהה, ראה טבלה 2). ודא כי מנה של תמיסת HS מחוממת מראש לטמפרטורת החדר לפני מגע עם תאי הזרע.
- העבירו את האפידידימידים לתבנית תרבית תאים חדשה המכילה תמיסת HS והסירו היטב את כל שאריות השומן.
- הפרד את האפידידימידים לקפוט, קורפוס וקאודה באמצעות להב אזמל #15 (איור 6).
- העבירו את הקורפוס (או הזנב במידת הצורך) של כל אפידידימיס לתוך צלחת תרבית תאים חדשה המכילה תמיסת HS. בצע חתכים מרובים בחלק המבודד של האפידידימיס באמצעות להב אזמל מחודד #11.
- העבירו את חלקי האפידידימידים עם חתכים מרובים לצינור מיקרו-צנטריפוגה של 1.5 מ"ל המכיל תמיסת HS של 1.5 מ"ל.
- לנער לזמן קצר תאי זרע מהאפידידימיס לתוך התמיסה באמצעות מלקחיים עדינים במיוחד מסוג Dumont מסוג 5a. השליכו אפידידימידים והשאירו את הצינור בטמפרטורת החדר למשך 10 דקות.
- המתן עד שהחומר המוצק (תאים שאינם זרע) ישקע לתחתית הצינור, ואז העבר את הסופרנטנט לצינור מיקרו-צנטריפוגה נוסף של 1.5 מ"ל.
- אחסן את תערובת הזרע בטמפרטורת החדר עם גישה לאוויר עד שעתיים, במהלכן ניתן לבצע את הניסויים. זרע מבודד מאבד את ביצועיו 3 שעות לאחר הבידוד.
- קיבול של זרע עכבר
הערה: כל הזרעונים האפידידימליים מתאימים למהדק טלאי, אך רק זרעונים מהזנב אפידידימיס בוגרים מספיק כדי להיות כשירים להפריה. מכיוון שזרע זנב יכול לעבור קיבולת, בצע ניסויים, במיוחד קיבולת זרע, באמצעות תאי זרע זנביים.- בצע איסוף זרע על זרעונים זנביים או שפיכה (ראה שלבים 3.1.1-4).
- קח קאודה מבודדת כמתואר בשלב 3.1.4. ולהחיל חתכים מרובים כמתואר בשלב 3.1.5. העבירו את הקאודה לתבנית תרבית תאים בגודל 10 מ"מ עם 2 מ"ל תמיסת קיבולת.
- דגרו את הרקמה הזנבית בתמיסת קיבולת זו בתחילה למשך 10 דקות ב-37 מעלות צלזיוס ו-5% CO2, ולאחר מכן השליכו את הרקמה ודגרו על תאי הזרע המשוחררים למשך 50-80 דקות נוספות.
הערה: קיבולת חוץ גופית של זרע זנב עכבר מושגת על ידי דגירה של 60-90 דקות. תאי זרע בעלי קיבולת מזוהים ויזואלית על סמך כיפוף אסימטרי מוגזם של הדגלים שלהם המכונה היפר-אקטיביציה. סוג זה של תנועתיות מאפשר לזרעונים לשחות בצורה לא ליניארית.
- איסוף וטיהור זרע אנושי
הערה: במקרה זה, דגימות זרע טריות התקבלו מ-21 מתנדבים בריאים בגילאי 21-38 וזרעונים מטוהרים בטכניקת שחייה בטמפרטורת החדר כמתואר בפירוטב-48,63. בקצרה, הנוהל הוא כדלקמן:- השאירו את דגימות השפיכה האנושיות בטמפרטורת החדר למשך 60 דקות כדי לאפשר הנזלה לפני הטיהור (משכי זמן ארוכים יותר עלולים להשפיע לרעה על איכות הזרע).
- מחממים מראש כ-7 מ"ל של תמיסת HTF ל-37 מעלות צלזיוס בצינור צנטריפוגה של 50 מ"ל. העריכו חזותית את נפח השפיכה - אם הנפח גדול מ -1 מ"ל, הכינו מספר צינורות של תמיסת HTF.
- הניחו בזהירות 1 מ"ל של שפיכה נוזלית לתחתית כל צינור מבלי להרים קווצות זרע אל פני המאגר. ממשק הזרע ל-HTF צריך להיות ברור ככל האפשר. הימנע מבועות אוויר.
- הנח את הצינורות באינקובטור של 37 מעלות צלזיוס למשך שעה במעמד המחזיק אותם בזווית של 45 מעלות לשטח פנים מקסימלי. אם החממה היא חממת CO2 , סגור את המכסה בחוזקה כדי למנוע החמצה של המאגר (CO2 אינו נדרש להליך זה). במהלך הדגירה, זרע נע ישחה בהדרגה לעבר פני השטח של מאגר ה-HTF.
- לאחר שעה אספו את החלק העליון של 1 מ"ל מכל הדגימות בצינור צנטריפוגה של 15 מ"ל, ובכך שלבו את הזרע האיכותי ביותר והנייד ביותר להידוק טלאי. אל תנסה להסיר את כל ה-supernatant שנותר כמה מ"ל של HTF שנותרו מעל פלזמת הזרע כדי למנוע זיהום. ניתן לאחסן את תרחיף התאים המטוהר בטמפרטורת החדר למשך מספר שעות.
הערה: שפיכה רגילה צריכה להכיל לפחות 15 x 106 תאי זרע לכל מ"ל64, אך ספירת הזרע משתנה מאוד בין הדגימות. ניתן להתגבר על המכשול של ספירת תאים נמוכה על ידי מתן תרחיף הזרע המטוהר לשבת במשך 30-60 דקות בטמפרטורת החדר לפני הידוק המדבקה. במצב זה, התאים יצטברו בהדרגה בתחתית צינור הצנטריפוגה ויצרו ענן תאים גלוי שממנו ניתן להזרים תאים לתוך תא ההקלטה (ראה להלן).
- קיבולת של זרע אנושי
הערה: קיבולת חוץ גופית של זרע אנושי יכולה להתבצע על ידי דגירה של 4 שעות בתמיסת קיבולת: 20% סרום בקר עוברי, 25 מ"מ NaHCO3 במאגרי HTF או HS48,51. ניתן לזהות תאי זרע קיבוליים על סמך התנועתיות הנמרצת שלהם וכיפוף אסימטרי מוגזם של הפלאגלה המאפשר לזרעונים לשחות בצורה לא ליניארית.- הכן תמיסת קיבולת פי 2 וערבב 1:1 עם תרחיף הזרע.
- בצע דגירה ב-37 מעלות צלזיוס ו-5% CO2 למשך 4 שעות לפחות. כדי להבטיח אחוז גבוה של תאים קיבוליים, זמן הדגירה צריך להיות לא פחות מ-4 שעות.
4. הכנת תמיסת ציפוי (נחוץ רק לתיקון זרע אנושי)
הערה: שלב חיוני הוא להרים את הזרע המחובר מהכיסוי לפני הפריצה. שלב זה הכרחי רק לתאי זרע אנושיים ודורש ציפוי של כיסוי הזכוכית כדי ליצור משטח זכוכית פחות דביק. ציפוי Coverslip מפחית את ההסתברות של תאי הזרע להיצמד לכיסוי ומאפשר להרים את הזרעונים האנושיים מכיסוי הזכוכית לאחר היווצרות מוצלחת של gigaseal.
- לדלל 200 מיקרוליטר מהשפיכה ב-5 מ"ל של תמיסת HS בצינור צנטריפוגה של 15 מ"ל.
- יש לסובב בטמפרטורה של 300 x גרם למשך 5 דקות ולהסיר את הסופרנטנט.
- השעו מחדש את הגלולה ב-1 מ"ל של תמיסת HS והעבירו לצינור מיקרו-צנטריפוגה.
- סוניקציה למשך 10 דקות בטמפרטורה של 25 מעלות צלזיוס באמצעות אמבט סוניקציה מלא במים.
- סובב מטה ב-10,000 x גרם למשך 5 דקות.
- העבירו את הסופרנטנט לצינור מיקרו-צנטריפוגה טרי והשתמשו בו לציפוי (הוראות למטה).
5. הקלטת מוליכות יונים מקרום פלזמת הזרע השלם.
- הצמדת זרע לכיסוי.
הערה: לפני התיקון-clamp הקלטה, הזרעונים מצופים על גבי החלקות כיסוי עגולות של 5 מ"מ.- אם עובדים עם תאים אנושיים, טבלו בקצרה את הכיסויים בתמיסת הציפוי המוכנה בעזרת מלקחיים חדים.
- מניחים ארבעה פתקי כיסוי לבאר אחת של צלחת 4 בארות ומכסים ב-300 מיקרוליטר של תמיסת HS. מנע מהחלקות הכיסוי לצוף על ידי הדבקתם לתחתית צלחת 4 הבארות, דחיפתם עם קצה הפלסטיק של פיפטטור.
- השהה בעדינות את התרחיפים המרוכזים של זרע אנושי (שלב 3.3.5) או עכבר (שלב 3.1.9) מצינור האחסון (20-50 מיקרוליטר זרע מרוכז) ב-300 מיקרוליטר של תמיסת HS מעל הכיסוי.
- ודא שזרעונים מצטברים בתחתית הבאר היכן שראשיהם יתחברו לכיסוי והדגלים שלהם יכו במרץ בתמיסה ממש מעל החלקת הכיסוי. חשוב לאפשר לזרעונים לשקוע על הכיסוי למשך כ-10 דקות בטמפרטורת החדר לפני ההקלטה.
הערה: אם זרעונים אנושיים נצמדים בצורה גרועה, חזור לשלב 5.1.1 ודלל את תמיסת הציפוי המוכנה בתמיסת HS (1:20 עד 1:2). יש להתאים שלב זה לדגימות זרע מתורמים אנושיים שונים בהתבסס על תנועתיות הזרע המשתנה הנפוצה בתכשירי זרע אנושיים.
- הנחת תלוש הכיסוי
- קח כיסוי אחד עם תאים דבוקים מעט מהבאר והנח לבאר בצורת יהלום של תא ההקלטה המכיל תמיסת HS (איור 4).
- הפעל את מערכת הזלוף (איור 5) המלאה בתמיסת HS כדי לשטוף את החדר ולהסיר פסולת ועודפי זרעונים מנותקים מהתא. זה יגדיל את ההסתברות שפיפטה ההקלטה תישאר נקייה כשהיא תגיע לתאים. שלב זה מועיל בעבודה עם תאים לא קיבוליים הנוטים להיצמד לכיסוי חזק יותר.
הערה: אם מקליטים מזרע מקובל, יש להימנע מהפעלת הזלוף מיד לאחר הנחת החלקת כיסוי טרייה לתוך החדר. לזרעונים קיבוליים יש תנועתיות נמרצת והם מתחברים רק באופן רופף לכיסוי. לכן, כדי להבטיח שהמספר הגדול ביותר של זרע קיבולי זמין, חשוב להמתין ~ 10 דקות ולתת לזרעונים קיבוליים להיצמד לכיסוי לפני הפעלת הזלוף. לאחר בחירת התא הקיבולי המתאים ויצירת ג'יגה-סיל, ניתן להפעיל מחדש את הזלוף.
- בחירת תא זרע לרישום מהדק טלאי.
- מצא תא זרע מתאים עם טיפה ציטופלזמית באמצעות הגדלה של פי 600 (ראה להלן). זה נעשה באמצעות לן טבילה במים פי 60 כמתואר בשיטות עם עינית הגדלה פי 10. בתאי זרע המבודדים מהקורפוס אפידידימיס, התקליטור ממוקם בדרך כלל קרוב למרכז האמצע. בתאים זנביים, ה-CD בדרך כלל יכול להימצא קרוב לטבעת (איור 2C). עבור זרע אנושי, התקליטור ממוקם באזור הצוואר (איור 2A,B).
הערה: בנוסף, ניתן להשתמש באפשרות ההגדלה הנשלפת פי 1.6 של המיקרוסקופ כדי לבחון מקרוב את מורפולוגיה הזרע (הגדלה פי 960). - ודאו שהטיפה הציטופלזמית היא אליפסה ובעלת צורה מעט מוארכת (איור 2G), דמוית ציר. תקליטורים שנראים עגולים ומוגדלים מאוד הם לעתים קרובות שבירים ולא מתאימים לתיקון (איור 2D,F).
- בחר זרע תנועתי עם הראש מחובר לכיסוי, כך שתא הזרע מקובע חלקית, אך התקליטור ושאר הפלאגלום ממשיכים לנוע עם מכות דגל. ודא שראש הזרע מחובר באופן רופף לכיסוי כך שהוא מסתובב מעט כשהדגל נע מצד לצד.
הערה: חיבור רופף חשוב מכיוון שלאחר היווצרות חותם הג'יגאוהם ולפני המעבר למצב תא שלם, יש להרים את הזרע מהכיסוי לתמיסה.
- מצא תא זרע מתאים עם טיפה ציטופלזמית באמצעות הגדלה של פי 600 (ראה להלן). זה נעשה באמצעות לן טבילה במים פי 60 כמתואר בשיטות עם עינית הגדלה פי 10. בתאי זרע המבודדים מהקורפוס אפידידימיס, התקליטור ממוקם בדרך כלל קרוב למרכז האמצע. בתאים זנביים, ה-CD בדרך כלל יכול להימצא קרוב לטבעת (איור 2C). עבור זרע אנושי, התקליטור ממוקם באזור הצוואר (איור 2A,B).
- יצירת ג'יגה-סיל
הערה: כדי להקליט זרמי CatSper חד-ערכיים במצב תא שלם, פיפטות ממולאות בתמיסת Cs-methanesulfonate (המכונה גם פיפטה או תוך-תאית) (טבלה 4) - זה מניב התנגדות פיפטה של 11-17 MΩ (איור 7A), כפי שמחושב אוטומטית על ידי המגבר בעת הפעלת צעד מתח מ-0 mV ל-10 mV. ניתן למלא פיפטות גם בפתרונות אחרים בהתאם ליישום. מומלץ לייצר פתרונות עם אניונים ניידים כגון מתאן סולפונט, Cl- , אספרטט או יונים דומים כדי להפחית את עמידות הפיפטה. האוסמולריות של תמיסת הפיפטה צריכה להיות גבוהה עד 10 mOsm מתמיסת האמבטיה. טונוס מעט גבוה יותר של תמיסת הפיפטה עוזר לשמור על התנגדות הגישה לתאי הזרע נמוכה ככל האפשר במהלך הקלטת מהדק טלאי.- לאחר בחירה חזותית של תא זרע עם מורפולוגיה מתאימה (איור 2G), מלאו את המיקרופיפטה בתמיסת פיפטה (טבלה 4) והדקו אותה לתוך מחזיק הפיפטה.
- על מנת לשמור על קצה הפיפטה נקי מפסולת, הפעל לחץ חיובי על הפיפטה באמצעות המכלול בצורת צינור U כדי להבטיח שתמיסת הפיפטה תזרום החוצה מהקצה לאחר שהיא טובלת בתמיסה החוץ-תאית, המכונה גם להלן תמיסת "אמבטיה" (ראה טבלה 2).
הערה: אם התנאים מאפשרים זאת, מומלץ מאוד להיווצר החותם תחת זלוף מתמיד, מכיוון שתנאי זה מבטיח את קצה הפיפטה הנקי ביותר. - הורד את הפיפטה כלפי מטה וטבל את קצהו בתמיסת האמבטיה (טבלה 2). בשלב זה, ניתן למדוד את התנגדות הפיפטות (איור 7A).
- על מנת לדמיין בבירור את התא, מקם את קצה הפיפטה מעל התקליטור כשפתח הקצה מיושר באלכסון (כ-45°) לכיוון התקליטור.
- הורד במהירות את קצה הפיפטה לכיוון התקליטור כך שיהיה באותו מישור מוקד, בטווח של כמה מיקרומטר מהתקליטור.
- ברגע שקצה הפיפטה נוגע בתקליטור, הפעל לחץ שלילי על הפיפטה באמצעות "הפיה" כדי להעביר חלק מהטיפה לקצה וליצור אטימה של ג'יגהום - המכונה גם באלקטרופיזיולוגיה "אירוע יניקה". בדרך כלל, לאחר מגע ראשוני עם קצה הפיפטה, ניתן לשמור על הלחץ השלילי בפיפטה עד דקה כדי להשיג בהדרגה איטום ג'יגה-אום.
- לאחר היווצרות מוצלחת של אטם הג'יגאוהם (> 4-20 GΩ), הרם את הזרע מכיסוי הכיסוי (איור 7B).
הערה: שלב זה אינו נדרש לתאי זרע של מכרסמים בשל אורכם; עם זאת, ניתוק חלקי של דגל הזרע מועיל להקלה על סחף פיפטה פוטנציאלי. ניתוק זרע אנושי הוא צעד חיוני, מכיוון שה-CD קטן (1~3 מיקרומטר); אם התא נשאר מחובר לכיסוי, אפילו סחיפה קלה של הפיפטה במהלך הניסוי עלולה לשבש את התקליטור. לאחר הרמת הזרע, הדגל שלו בדרך כלל ממשיך לפעום, בעוד התא מחובר רק למיקרופיפטה.
- פריצה ומעבר למצב תא שלם.
- פיצוי טרנזיינטים של קיבוליות תועה באמצעות אופן הפיצוי של המגבר לפני המעבר לאופן התא השלם (איור 7B). כדי לצפות בתחילה במעברי קיבול, החזק את פוטנציאל הממברנה ב- mV 0 והחל פולסים של mV 10 באמצעות הכלי "בדיקת ממברנה" (איור 7B).
- בצע פריצה ומעבר לאופן תא שלם על ידי הפעלת פולסי מתח קצרים (1 ms) הגדלים בהדרגה (430-650 mV, מרווח של ~50 mV) בשילוב עם יניקה קלה ביותר (איור 7C).
הערה: כדי להחיל פעימות פריצה , השתמש בפרוטוקול הפריצה שתוכנת קודם לכן בתוך התיקון clamp התוכנה. פולסי מתח הפריצה מופעלים על הזרע באמצעות כניסת פקודת המתח הגבוה (מתג אחורי) בגב המגבר. - לאחר יישום כל דופק מתח פריצה, הפעל את כלי בדיקת הממברנה כדי לבדוק אם מופיעים מעברי קיבול גדולים יותר.
הערה: נוכחותם של ארעי קיבול גדולים (איור 7C) מצביעה על כך שהפריצה התרחשה, וכל הקיבול של התא נמדד (~1 pF עבור זרע אנושי ו~2.5 pF או יותר עבור זרע עכברי). - התאם את מעברי הקיבול הגדולים באמצעות כלי בדיקת הממברנה כדי לקבוע את הקיבול של התא כולו כמו גם את התנגדות הגישה שלו.
הערה: התנגדות הגישה צריכה להיות נמוכה ככל האפשר לזלוף יעיל של פנים תא הזרע עם תמיסת המיקרופיפטה, כמו גם לכרך אמיןtage clamp של קרום פלזמת הזרע. התנגדות הגישה היא בדרך כלל 25-30 MΩ ו-50-70 MΩ עבור פתרונות תוך-תאיים מבוססי Cs+ /K+ ו-NMDG, בהתאמה. - לאחר פריצה מוצלחת, המשיכו בניסויים המתוכננים של מהדק-תיקון תא שלם, כגון יישום תמיסות אמבט שונות (איור 8) המכילות תרכובות שונות או מדידת פעילויות תעלות באמצעות צעד-מתח (איור 8, איור 9) או פרוטוקולי רמפת מתח. אם הפריצה לא הצליחה, חזור לשלב 6.4.1. על ידי בחירת מיקרופיפטה טרייה ובחירת תא זרע מתאים אחר.
תוצאות
שיטת מהדק תיקון הזרע מאפשרת הקלטה ישירה של ערוץ CatSper.
כפי שהוזכר לעיל, הקלטות CatSper בוצעו על ידי יצירת חותם עמידות גבוהה (gigaohm) בין פיפטת המדבקה לזרע היונקים בטיפה הציטופלזמית שלו. עם הפריצה והמעבר למצב תא שלם, מתקבלת גישה חשמלית מלאה לכל גוף תא הזרע ולפנים שלו, כולל ראש הזרע והדגל 2,8,39,51. מצב זה מאפשר בסופו של דבר הקלטה מכל תעלת יונים פעילה הממוקמת על קרום פלזמת הזרע. תמיסה נטולת דו-ערכית (DVF) המכילה צזיום או נתרן כיון הקבוע העיקרי עדיפה לרישום זרמי CatSper חד-ערכיים 2,8,39,51. בעוד שערוץ CatSper מוליך יונים דו-ערכיים כגון Ca2+ ו-Ba2+, הם נעים דרך נקבובית CatSper בקצב איטי בהרבה, וכתוצאה מכך מוליכות בקושי ניתנת לזיהוי של כמה פיקואמפרים (~10-20 pA)2,8,39,51. לפיכך, מדידת זרמים חד-ערכיים, ולכן גדולים יותר, דרך ערוץ CatSper היא דרך נוחה יותר להעריך את הזרם (איור 8). חשוב לציין כי CatSper חדיר גם לאשלגן; לכן, יש לחסום את ערוץ CatSper, או להשתמש בתאי זרע חסרי CatSper במצבים בהם רוצים לחקור רק תעלות אשלגן של תאי זרע 2,3,8,28,65. על ידי שינוי הרכב היונים של הפיפטה ותמיסת האמבטיה, ניתן להוציא באופן סלקטיבי תעלות יונים מסוימות, תוך יצירת תנאים להקלטה סלקטיבית מסוגי תעלות יונים ספציפיים בלבד. לדוגמה, תוספת של Cs+ לתמיסת הפיפטה מביאה לחסימת חדירות יונים דרך תעלות אשלגן זרע.
ערוץ CatSper מווסת באופן שונה בין מיני יונקים.
תאי זרע ממינים שונים מגוונים במורפולוגיה ובמסלולי הוויסות הפנימיים שלהם66. אין זה מפתיע שתעלות היונים שלהם מווסתות באופן ייחודי בדרכים המשקפות את המיקרו-סביבות המיוחדות של דרכי הרבייה הזכריות והנקביות. שיטת תיקון-מהדק הזרע יושמה בהצלחה על שישה מיני יונקים: עכברים2, חולדה56, אדם39,51, בקר, חזיר ומקוק41 כפי שמוצג באיור 9. לצורך ניסויים אלה התקבלו תאי זרע מקופי מקוק רזוס זכרים בוגרים [Macaca mulatta] מהמרכז הלאומי לחקר פרימטים בקליפורניה בהתאם לסטנדרטים של האגודה להערכה והסמכה של טיפול בחיות מעבדה בינלאומיות (AAALAC) תחת פרוטוקולים מאושרים לבעלי חיים על ידי אוניברסיטת קליפורניה, דייוויס כמתוארב-41; וכל המחקרים נערכו בהתאם למדריך המכונים הלאומיים לבריאות בארה"ב לטיפול ושימוש בחיות מעבדה. זרע של שור וחזיר הושג כתוצרי לוואי הפטורים מאישור ספציפי של IACUC ממתקני המחלקה למדעי בעלי החיים של UCD וכל בעלי החיים הוחזקו במתקנים שאושרו על ידי AAALAC. ניתן להשיג זרע של שור וחזיר בר גם ממקורות מסחריים.
פרימט (מקוק רזוס) וזרעונים אנושיים הראו תכונות וויסות דומות של ערוץ CatSper. מעניין שהפעלת פרוגסטרון של CatSper נראית ייחודית לפרימטים (איור 9 ו-41), מכיוון שזרע חזיר, שור ומכרסם לא הראה שום שינוי מעורר פרוגסטרון בזרמי ה-CatSper שלהם. בזרעוני שור וחזיר בר, אפילו פעילות ערוץ CatSper הבסיסית הייתה מתחת לגבולות הניתנים לזיהוי (איור 9), מה שמרמז על כך שבמינים אלה, זרם הסידן וכתוצאה מכך היפראקטיביות מונעים על ידי ערוצים/טרנספורטרים אחרים, או שיש צורך בגירוי טבעי אחר להפעלת ערוצי ה-CatSper שלהם. בכל מיני הזרע שהוזכרו כאן, כולל תאי זרע של שור וחזיר, הושגה גישה חשמלית מלאה לחלק הפנימי של תאי הזרע ותאים נרשמו במצב תא שלם, כפי שניתן לראות בהופעת חפצי הקיבול הגדולים בעת הפריצה (איור 7). מצב זה מאפשר רישום קל של ערוץ CatSper הפונקציונלי, והיעדרו מזרעוני חזיר ובקר מצביע על כך שתעלה זו חסומה על ידי מעכב אנדוגני שעדיין לא ידוע הקיים בתאי הזרע של מינים אלה או דורש הפעלת מודולטור ספציפי. עם זאת, מדובר בניסויים ראשוניים ויידרשו ניסויים נוספים עבור תאי זרע של חזיר ושור כדי להבטיח את החשיבות התפקודית של ערוץ CatSper במינים אלה. ספקטרום רחב זה של מגוון תעלות יוני זרע בין מינים יכול להיות קשור ליחס גודל הזרע לביצית, הקשר בין גודל הזרע לבגדי המגן על הביצית, או לשמש מחסום להפריה על ידי מינים אחרים66.
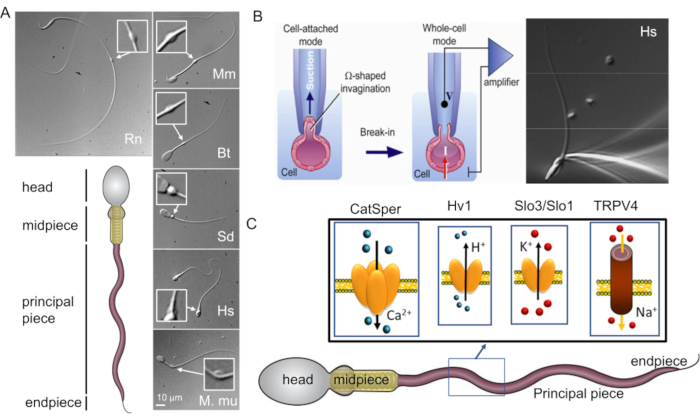
איור 1: מגוון מורפולוגי של זרע של יונקים. (A) פאנל תחתון: ייצוג סכמטי של זרע; תאים סלולריים מסומנים. פנלים עליונים: תמונות DIC של זרעונים ממינים שונים בכיוון השעון: חולדה (Rn; Rattus norvegicus); עכבר (מ"מ; Mus musculus); שור (Bt; בוס שור); חזיר (Sd; sus scrofa domesticus); אנושי (Hs; הומו ספיינס), ומקוק רזוס (Mmu; Macaca mulatta). סרגל קנה המידה חל על כל תמונות ה-DIC. תוספות מצביעות על טיפות ציטופלזמיות. (B) תיקון של תאי הזרע של היונקים. כדי להשיג היווצרות איטום מוצלחת בין קצה הפיפטה לקרום הפלזמה, חלק מקרום הפלזמה נשאב בעדינות לתוך קצה הפיפטה. ההעברה למצב תא שלם מתבצעת על ידי קריעת קרום הפלזמה בין הקצה לתא (נתון זה שוחזרמ-8). פאנל ימני: תאי זרע אנושיים המחוברים למיקרופיפטה מקליטה. (C) ייצוג סכמטי של תאי זרע אנושיים וחלק מתעלות היונים שנחקרו בתאי זרע אנושיים בשיטת Patch Clamp, כמו גם היונים שהם מוליכים. CatSper- תעלת יוני סידן 39,51; Hv1- ערוץ פרוטון 51,56,67; Slo3/Slo1- תעלות אשלגן 50,53,65,68; TRPV4- קולטן חולף פוטנציאל קטיונים ערוץ ונילואיד סוג 448. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
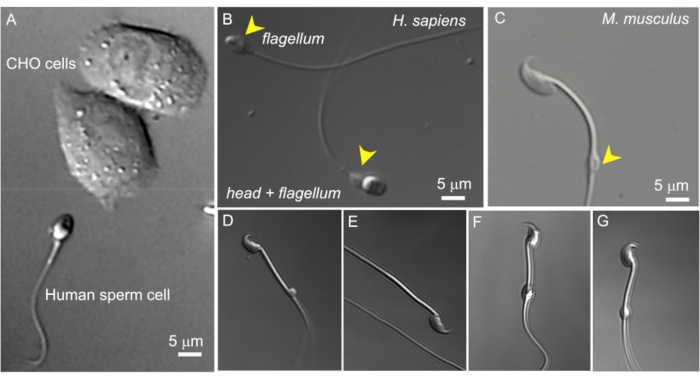
איור 2: גודל זרע ומורפולוגיה משתנה של טיפות ציטופלזמיות. תמונות ה-DIC של תאי זרע חיים שלמים. (A) השוואה בין גודל תא זרע אנושי (למטה) ושני תאי CHO (עליון). (B) זרע אנושי שלם (הומו ספיינס) (למטה) ותא זרע חסר ראש (דגל, עליון). טיפות ציטופלזמיות מסומנות על ידי ראשי חץ צהובים; נתון זה שוחזרמ-8. (C) זרע עכברי שלם (Mus musculus) עם טיפות ציטופלזמיות בצורת תקין (CD) המסומנות על ידי ראש החץ הצהוב. (ד-ג') לתאי זרע של עכברים אפידידימליים יש טיפות ציטופלזמיות בגדלים וצורות שונות; רק (C) ו-(G) מתאימים לתיקון-clamp. (D) CD הוא מיקרוסקופי וחד-צדדי; (ה) התקליטור חסר; (F) בתקליטור יש חלקיקים שעלולים לסתום את פיפטת ההקלטה; (G) CD חלק, אחיד ולא נפוח. יצירת ג'יגה-סיל עם תקליטור מסוג זה תביא ככל הנראה להקלטה מוצלחת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: רכיבי אסדת מהדק תיקון זרע. (A) מתקן אלקטרופיזיולוגיה טיפוסי של זרע עם רכיבים חיוניים: (1) מיקרוסקופ הפוך; (2) דיגיטייזר רעש נמוך; (3) מגבר; (4) מיקרומניפולטור סחיפה נמוכה המחובר למיקרוסקופ ההפוך עם פלטפורמת מיקרומניפולטור; (5) מחשב PC; (6) שולחן אוויר לשיכוך רעידות; (7) כלוב פאראדיי כדי להגן על ההתקנה מפני הפרעות חשמליות סביבתיות. חיוני שכל הרכיבים החשמליים של האסדה, כולל מקלדת ועכבר מחשב, יפיקו רעש חשמלי נמוך או ללא רעש חשמלי (50 הרץ או 60 הרץ) ושכל רכיבי האסדה יהיו מוארקים כהלכה. (B) חולץ מיקרופיפטות המשמש לרישום ייצור פיפטות. (ג) (1) microForge המשמש לליטוש אש של פיפטות; (2) נימי זכוכית בורוסיליקט בקוטר חיצוני 1.5 מ"מ, קוטר פנימי 0.86 מ"מ וחוט פנימי; (3) קופסת איסוף פיפטות. (ד) שלבים של ליטוש אש מוצלח של פיפטה: (א) פיפטה לא מלוטשת בקוטר פנימי של 2 מ"מ; (ב) פיפטה מלוטשת אש בקוטר פנימי של 0.5 מ"מ; (ג) פיפטה אטומה מלוטשת יתר על המידה שאינה מתאימה להקלטה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: רכיבי מערכת תא ההקלטה והרכבתה. (A) רכיבים חיוניים של מערכת תא ההקלטה: (1) מתאם שלב מיקרוסקופ עבור פלטפורמות סדרה 20 עם (2) מהדקי אחיזה דו-שלביים; (3-4) פלטפורמה מחוממת מגנטית מסדרת PM עם (3) מהדקים מגנטיים להחזקת תא הזילוף; (5) תא זלוף; (6) גשר אגר; (7) מהדק מגנטי, אלקטרודת ייחוס עם שקע 2 מ"מ לגלולת Ag/AgCl; (8) מחזיק מגנטי (MAG-1) לקו היניקה; (9) צינור יניקה; (10) מחזיק O של צינור יניקה. (ב) מערכת תא הקלטה מורכבת עם רכיבים מצוינים מ-(A). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
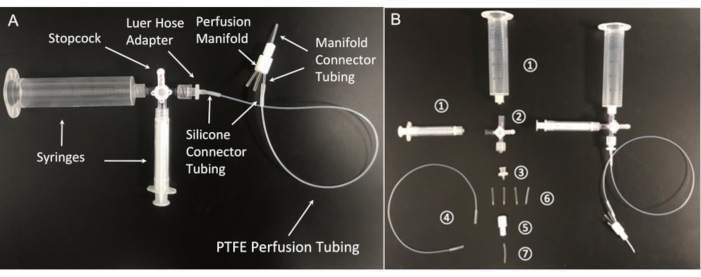
איור 5: רכיבי מערכת הזילוף. (א) קו זלוף מורכב ו-(ב) מרכיביו החיוניים: (1) מזרקים של 20 מ"ל ו-3 מ"ל; (2) תא עצירה עם חיבורי לואר; 4 כיוונים; מנעול זכר; (3) מתאם דוקרני צינור לואר נקבה, 1/16 אינץ'; (4) צינורות זלוף פוליטטרפלואורואתילן (PTFE) (צינורות PTFE Microbore, מזהה 0.022 אינץ' × 0.042 אינץ' OD); (5) סעפת זלוף פוליטטרפלואורואתילן 8 מצבים; (6) צינורות מחבר סיליקון (צינורות סיליקון מרפאים פלטינה, מזהה 1/32 אינץ' × 3/32 אינץ' OD); (7) צינורות מחבר סעפת (צינורות PTFE, מזהה 1/32 אינץ' × 1/16 אינץ' OD). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
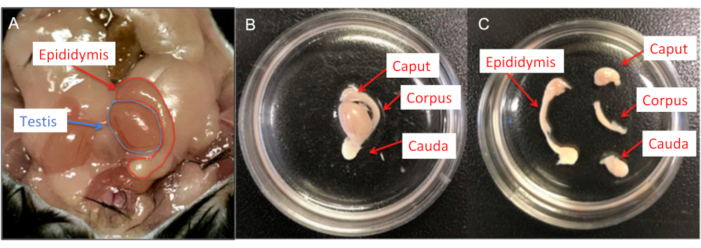
איור 6: דיסקציה של עכבר זכר. (A) איברי רבייה זכריים של עכברים; גם האשכים וגם האפידידימיס מוצגים. (B) האפידידימידים מועברים לתוך צלחת תרבית תאים בקוטר 35 מ"מ שמכילה תמיסת HS, ושאריות השומן וכלי הדם מוסרים. (C) לאחר מכן כל אפידידימיס מחולק לקפוט, קורפוס וקאודה באמצעות להב אזמל #15. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
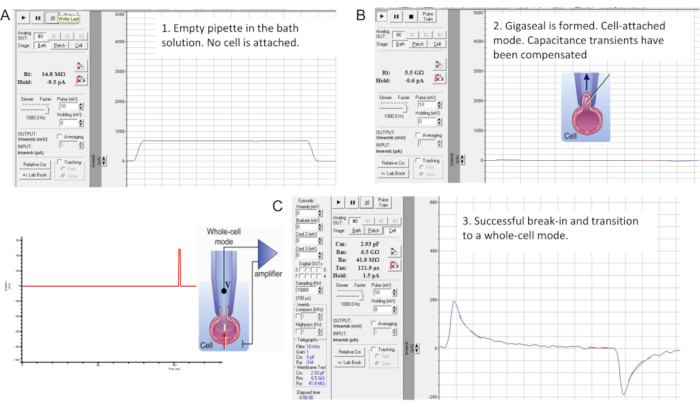
איור 7: היווצרות Gigaseal ופריצה עם תא הזרע של העכבר. הממשק של הכלי "בדיקת ממברנה" של תוכנת מהדק התיקון המסחרית. שלושה שלבים של הידוק תיקון זרע: (A) פיפטה מוקלטת טובלת בתמיסת HS אמבטיה ומייצרת התנגדות לפיפטה של 14.8 MΩ; (B) נוצר ג'יגה-סיל (ההתנגדות היא 4.7 GΩ), מעברי קיבול מפוצה, והזרע מורם מהכיסוי; (C) מעבר למצב תא שלם. פריצה ומעבר למצב תא שלם מתבצעת על ידי הפעלת פולסי מתח קצרים (1 אלפיות השנייה) הגדלים בהדרגה (430-650 mV, ~ 50 mV) בשילוב עם יניקה קלה, כפי שמוצג משמאל. פריצה התרחשה כפי שניכר מהופעת ארעי הקיבול הגדולים המשקפים את כל הקיבול של התא (~2.93 pF עבור תא זרע זה). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
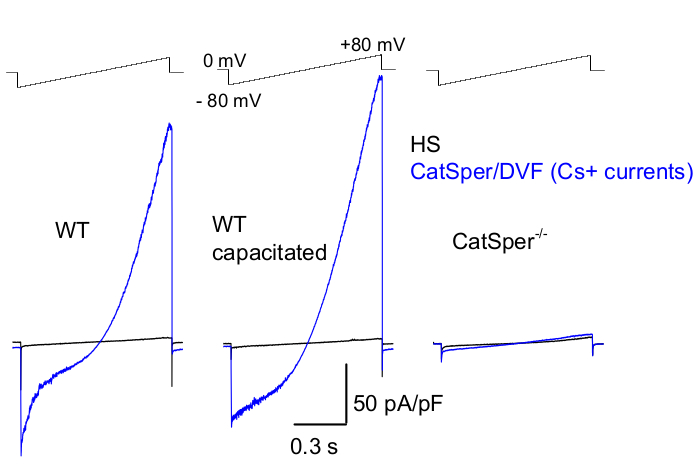
איור 8: הקלטת CatSper של עכברים מזרעוני זנב אפידידימלי, קיבולי ונוקאאוט של CatSper. כדי לתעד פעילות CatSper חד-ערכית, פרוטוקול רמפה מוחל כל 5 שניות וזרמי CatSper הנוצרים על ידי רמפות מתח מפוטנציאל החזקה של 0 mV39,51. רמפות מתח (-80 mV עד 80 mV; 850 ms) מיושמות ב-HS ובתמיסה נטולת-דו-ערכית (DVF) נומינלית. הנתונים נדגמו ב-2-5 קילו-הרץ וסוננו ב-1 קילו-הרץ. זרמי הבסיס נרשמים בתמיסת HS, שאינה מייצרת זרם CatSper עקב עיכוב על ידי מגנזיום חוץ-תאי גבוה39,51. זרמי בסיס שימושיים להערכת מוליכות הדליפה (מסלולי תעלות ללא יונים). מייצג, צפיפות זרם CatSper של תאים שלמים Cs+ (pA/pF; כחול) שתועדה מתאי זרע של עכברי WT זנביים (לא קיבוליים; שמאליים וקיבוליים; באמצע) ותאי זרע זנביים של עכברים חסרי CatSper (מימין). זרמים נוצרו על ידי רמפות מתח מפוטנציאל החזקה של 0 mV ורמפות הוחלו מ-80 mV עד 80 mV ב-HS ופתרון נטול דו-ערכיות נומינלית. זרמי בסיס (שחור) נרשמו בתמיסת HS. כדי להשיג צפיפות זרם, משרעות הזרם של CatSper נורמלו לקיבול התא (pA/pF). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
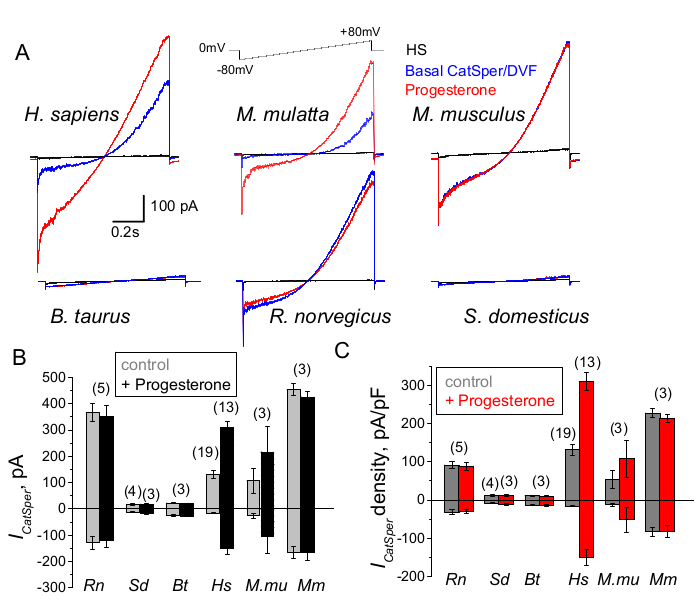
איור 9: ויסות פרוגסטרון של CatSper במינים שונים של יונקים. (A) זרם CatSper מייצג המופק מתאי זרע ממינים שונים על ידי פרוטוקול רמפת מתח כפי שצוין. מינים: אדם (Hs; הומו ספיינס); מקוק רזוס (Mmu; M. mulatta), עכבר (מ"מ; M. musculus), שור (Bt; ב. שור); חולדה (Rn; R. norvegicus); חזיר (Sd; S. scrofa domesticus). תועדו זרמי CatSper בהיעדר (כחול) ונוכחות (אדום) של פרוגסטרון של 1 מילימטר, כמו גם זרמי הבסיס בתמיסת HS (שחור). (B) אמפליטודות זרם CatSper (ICatSper, pA) ו-(C) רישומי צפיפות זרם ממוצעת (pA/pF) מתאי זרע ממינים שונים כפי שצוין; n מציין את מספר תאי הזרע הבודדים בשימוש. הנתונים הם ממוצע +/- S.E.M . אנא לחץ כאן לצפייה בגרסה גדולה יותר של נתון זה.
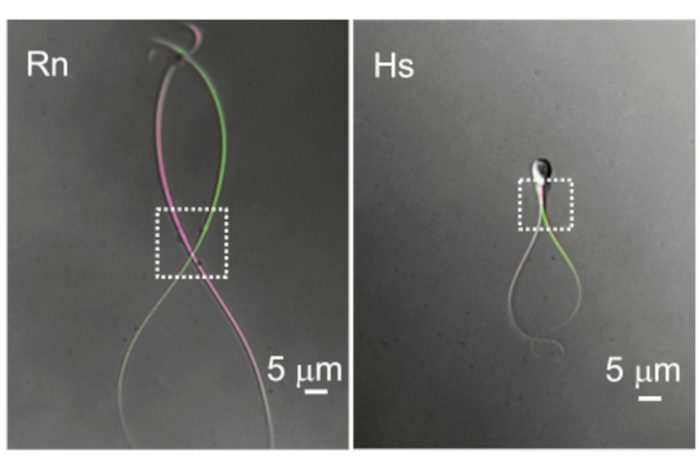
איור 10: ההבדל בתנועתיות הדגל. שתי דוגמאות מייצגות של טיפות ציטופלזמיות ותנועתיות דגל. התמונות העליונות של אותם תאי זרע של חולדה (Rn) ואדם (Hs) צולמו בשתי נקודות זמן שונות כאשר הן מראות את הסטייה הדיסטלית ביותר. מלבנים מנוקדים מציינים את האזור עם טיפות ציטופלזמיות ואת הניידות המרחבית המתאימה להן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
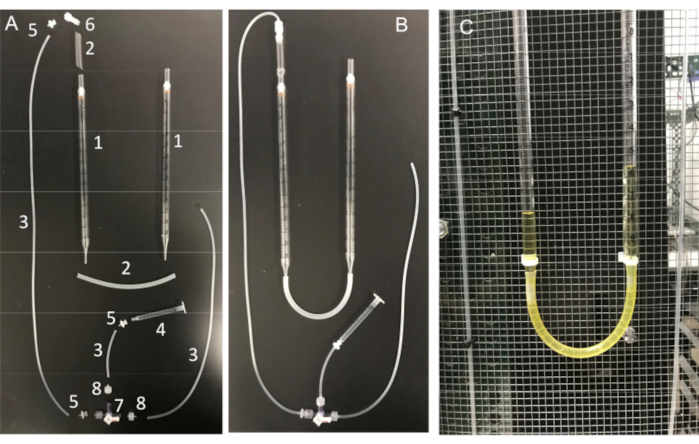
איור 11: מכלול צינור U ומרכיביו החיוניים. (A) מרכיבי צינור ה-U: (1) פיפטה סרולוגית של 10 מ"ל; (2) צינורות סיליקון; (3) צינורות מחבר סיליקון; (4) מזרק 1 מ"ל; (5) מתאם דוקרני לואר נקבה; (6) מתאם מנעול אינטגרלי Luer זכר 1/8 אינץ'; (7) תא עצירה עם חיבורי לואר; 4 כיוונים; מנעול זכר; (8) מתאם דוקרני מסדרת Luer זכר, 1/16 אינץ'. (B) צינור U מורכב במלואו ו-(C) צינור U המחובר לכלוב פאראדיי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
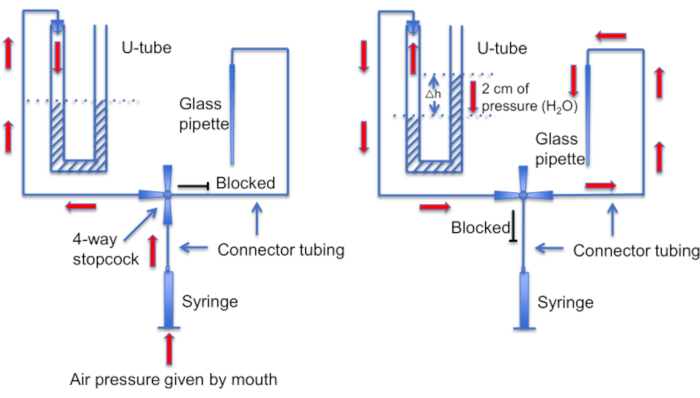
איור 12: ייצוג סכמטי של מכלול שפופרת ה-U. פאנל שמאלי: לחץ אוויר חיובי מסופק דרך הפה כדי ליצור הבדל ברמות הנוזל בצינור ה-U. מפלס הנוזל בקרן הימנית עולה ב -2 ס"מ. לאחר שנוצר הפרש מפלס זה, מסובבים את תא העצירה כדי לחבר את צינור ה-U לקו המוביל לפיפטה הקלטה. פאנל ימני: מפלס הנוזל הגבוה יותר בקרן הימנית יוצר לחץ חיובי שדוחף כל הזמן את תמיסת הפיפטה החוצה מקצה הפיפטה ושומר על הקצה נקי מפסולת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| כימיקלים | משקל טוחנת (גרם/מול) | מ"מ | גרם ל-1 ליטר |
| NaCl | 58.44 | 97.8 | 5.72 גרם |
| KCl | 74.55 | 5 | 0.373 גרם |
| ק"ח2פ"ד4 | 136.09 | 0.37 | 50.4 מ"ג |
| MgSO4 x 7.ח2א | 246.48 | 0.2 | 49.3 מ"ג |
| CaCl2 x 2.ח2א | 147.02 | 2 | 0.294 גרם |
| הפס | 238.3 | 20 | 4.766 גרם |
| גלוקוז | 180.2 | 3 | 0.540 גרם |
| נתרן לקטט (60% w/w) | 112.06 | 20 | 3 מ"ל |
| נתרן פירובט | 110 | 0.4 | 44 מ"ג |
טבלה 1: תמיסת נוזל צינורי אנושי (HTF)
| כימיקלים | משקל טוחנת (גרם/מול) | מ"מ | גרם ל-1 ליטר |
| NaCl | 58.44 | 135 | 7.889 גרם |
| KCl | 74.55 | 5 | 0.373 גרם |
| CaCl2 x 2. ח2א | 147.02 | 2 | 0.294 גרם |
| MgSO4 x 7. ח2א | 246.48 | 1 | 0.247 גרם |
| הפס | 238.3 | 20 | 4.766 גרם |
| גלוקוז | 180.2 | 5 | 0.901 גרם |
| נתרן לקטט (60% w/w) | 112.06 | 10 | 1.5 מ"ל |
| נתרן פירובט | 110 | 1 | 0.110 גרם |
טבלה 2: תמיסת מלח גבוהה (HS)
| כימיקלים | משקל טוחנת (גרם/מול) | מ"מ | גרם (עבור 500 מ"ל) |
| CsMeSO3 | 228.0 | 140 | 15.960 גרם |
| הפס | 238.3 | 40 | 4.766 גרם |
| EDTA | 292.24 | 1 | 0.146 גרם |
טבלה 3: פתרון אמבטיה CsMeSO3 (פתרון אמבטיה ללא ערך: DVF)
| כימיקלים | משקל טוחנת (גרם/מול) | מ"מ | מ"ג (עבור 25 מ"ל) |
| CsMeSO3 | 228.0 | 130 | 741 מ"ג |
| הפס | 238.3 | 70 | 417 מ"ג |
| EDTA | 292.24 | 2 | 14.6 מ"ג |
| א.ג.ט.א. | 380.35 | 3 | 28.5 מ"ג |
| CsCl | פתרון של 1 מיליון | 1 | 25 מיקרוליטר |
טבלה 4: תמיסת פיפטה CsMeSO3
Discussion
אנו מתארים פרוטוקול מפורט לביצוע רישומים אלקטרופיזיולוגיים מתאי זרע ממינים שונים. בהתחשב במשמעות הפיזיולוגית של תעלות יונים ומובילים אלקטרוגניים לזרעונים, טכניקה זו היא כלי רב עוצמה לחקר הפיזיולוגיה של תאי הזרע כמו גם פגמים המובילים לאי פוריות הגבר. הנסיין עשוי למצוא את ביצוע הטכניקה הזו מאתגר בהתחלה, אבל עם התמדה וסיבולת, ההצלחה מגיעה.
זרעונים של יונקים הם ארוכים (בדרך כלל >50 מיקרומטר), צרים ותנועתיים מאוד. תדירות פעימות הבסיס (BF) של זרעונים של יונקים משתנה מאוד עם ערכים בממוצע בין 4 הרץ (עכבר 69), 7-15 הרץ (חזיר 70,71), 11 הרץ (חולדה 72), 11-20 הרץ (שור 18), 24 הרץ (מקוק רזוס 23) ועד 25 הרץ (אדם 3). הטיפה הציטופלזמית (CD) היא הכניסה לרישום מתאי זרע. בזרעונים של מכרסמים התקליטור הוא לעתים קרובות דיסטלי אך נע לצד הדגל (איור 10), מה שיוצר מכשול נוסף להקלטה. עם זאת, בתאי זרע אנושיים התקליטור ממוקם בדרך כלל ליד הראש. מרכיבי המפתח של מהדק טלאי זרע מוצלח הם אפוא אופטיקה מצוינת המאפשרת תצוגה ברורה וחדה של התקליטור ומערכת מיקרומניפולטור מדויקת ביותר ללא סחיפה או רעידות. צפוי שיעור ראשוני גבוה של כישלון והוא נורמלי בימים הראשונים של מהדק תיקון הזרע. אנו ממליצים על תרגול שגרתי הכולל ניסיונות רבים בשבוע. השגת מספר הקלטות ביום בשבוע תבסס שגרה ותשפר את המיומנויות המוטוריות.
עד לאחרונה, הזיהוי והאפיון התרופתי של תעלות יוני זרע נפגעו בשל חוסר יכולת לחקור אותן ישירות. התחום הסתמך במידה רבה על מחקרי אימונוציטוכימיה, שלעתים קרובות סובלים מחוסר ספציפיות של נוגדנים ו/או היעדר מודלים גנטיים מתאימים. כדי לחקור תעלות סידן, נעשה שימוש נרחב בשיטת הדמיית הסידן הקלאסית, שיש לה יתרונות ומגבלות משלה 73,74,75,76,77. בעוד שהדמיית סידן היא שיטה קלה יחסית הניתנת ליישום למחקרי תפוקה בינונית עד גבוהה 78,79,80,81 והיא פחות פולשנית, היא דורשת תאים שלמים יחסית, ולכן מהווה מכשול לנתח את תפקודם של תעלות יונים המנותקות ממפלי איתות תוך-תאיים או להבדיל אותם ממחליפי יוני סידן. בנוסף, קשה לשלוט בפוטנציאל הממברנה ולכן קשה יותר לשלול את התרומה של תעלות הסידן מגודרות המתח. בין מספר יתרונות של סידן פלואורומטריה הוא השימוש בצבעים מטריים של יחס סידן המאפשרים מדידה מדויקת של השינויים בריכוז יוני הסידן. יחד עם זאת, יש להיות מודעים לכך שהרגישות של צבעים אלה יכולה להשתנות בהתאם לשינויים ב-pH התוך תאי.
להלן נתאר את השלבים הקריטיים בפרוטוקול, כולל שלבי פתרון בעיות של השיטה. חיוני להשתמש רק בריאגנטים טהורים להכנת תמיסות הניסוי, מכיוון שאפילו זיהום קטן ביונים לא רצויים (כגון מגנזיום או מתכות כבדות) עלול לפגוע בזיהוי זרמים חד ערכיים. בהתחשב בגודלם הקטן של תאי הזרע, ניתן לצפות למספר נמוך יחסית של תעלות יונים לתא. לפיכך, הזרם הנקי נע בין כמה pA לכמה מאות pA. לכן, הרעש החשמלי הפנימי של האסדה חייב להיות מינימלי כדי להבטיח זיהוי זרמים קטנים, ומומלץ מאוד להשתמש בציוד נטול סחיפה. על מנת להבחין בין מוליכות ספציפית לבין רעש חשמלי ודליפת רקע, יש למקסם את מנגנון ההקלטה ומערכת ההארקה. זה מושג על ידי הארקה נכונה של האסדה כדי למנוע הפרעות חשמליות82. מומלץ מאוד להשתמש בכלוב פאראדיי כדי להגן מפני הפרעות חשמליות המיוצרות על ידי מגוון מכשירים חשמליים, כגון אורות בניין וחיווט חשמלי בתוך הקיר. חיוני שכל הרכיבים החשמליים של האסדה, כולל המקלדת והעכבר של המחשב, יקרינו רעש חשמלי מועט או ללא רעש חשמלי (50 הרץ או 60 הרץ) ושכל רכיבי המתקן יהיו מקורקעים כהלכה. הרעש החשמלי בתצורת התא כולו כאשר כל תעלות היונים סגורות צריך להיות < 0.5-1 pA.
נקודה חשובה נוספת היא לפקח על אוסמולריות נכונות של פתרונות העבודה. יש לקבוע במדויק את הרכב התמיסות התוך-תאיות והחוץ-תאיות ולמדוד נכון את האוסמולריות שלהן. התמיסה החוץ-תאית חייבת להיות מעט היפוטונית, בהשוואה לתמיסת הפיפטה, מכיוון שהיא מובילה לנפיחות תאים זעירה ומונעת את סתימת הפיפטה על ידי קרום הזרע. הערה: אם תמיסת הפיפטה היפרטונית מדי ושונה מתמיסת האמבטיה יותר מ-10 mOsm, נוצרת נפיחות מוגזמת בתאים וקרע באיטום. כתוצאה מכך, התא יהיה שביר והג'יגה-סיל יאבד תוך שניות לאחר הפריצה. מניסיוננו, הכנת תמיסה לא מדויקת היא אחת הטעויות הנפוצות ביותר המונעות הידוק מוצלח של טלאי.
מכשול פוטנציאלי נוסף שיש להימנע ממנו הוא פלסטיק פלסטי המכיל פתלטים, כמו גם מזרקים משומנים בשמן מינרלי. הצינורות, המזרקים וכל ציוד הפלסטיק שנתקל בתמיסות, ומכאן תאי הזרע, לא צריכים לדלוף חומרים פלסטיים או רעלים או שמנים סביבתיים אחרים, מכיוון שכימיקלים כאלה יכולים לשנות באופן משמעותי את פעילות תעלת היונים. אנו משתמשים בצינורות טפלון בקוטר קטן כקו הזלוף העיקרי. לטפלון (PTFE) יש מעט תרכובות הניתנות לשטיפה, אך הוא נוקשה למדי. חיבורים גמישים עשויים מצינורות סיליקון בטוהר גבוה המתאימים מעל צינורות הטפלון. כל המזרקים המשמשים למערכת הזלוף חסרים כל חומר סיכה, מכיוון שהשמן המינרלי או תוספי סיכה אחרים עלולים להפריע להקלטת תעלות יונים.
איננו יכולים להפריז בחשיבות השימוש בזכוכית הנכונה ומשיכת צורת המיקרופיפטה הנכונה. לפיכך, הייצור האופטימלי של מיקרופיפטות זכוכית הוא תנאי מוקדם לתיקון מוצלח. אנו משתמשים במיקרופיפטות זכוכית העשויות רק מזכוכית בורוסיליקט המכילה נימה למילוי תמיסה טוב יותר. קצה הפיפטות חייב להיות מלוטש באש כדי לספק את האיטום ההדוק האידיאלי. קצות פיפטות בקוטר העולה על 2 מיקרומטר (ולכן יש להם התנגדות של 10 MΩ ומטה) בדרך כלל אינם מתאימים לתיקון תאי זרע.
צעד חשוב נוסף הוא לוודא שקצה המיקרופיפטה יישמר נקי מכל פסולת או בועות אוויר לפני היווצרות האיטום. זו משימה קשה בהתחשב בכך שהמיקרופיפטה נטענת בתמיסה מלאה בתאים נעים. גורם אחד שעוזר למנוע "התנגשות" מקרית של הפיפטה בתאי זרע שוחים חופשיים, הוא שימוש בזלוף קבוע כדי לשטוף את כל התאים שאינם נצמדים. כלי נוסף הוא "שפופרת U" תוצרת בית המאפשרת לעבור בין אופני לחץ חיובי ושלילי כדי לשמור על הקצה נקי (איור 11 ואיור 12).
מכיוון שתאי הזרע שונים מאוד בצורתם וגודלם של הטיפות הציטופלזמיות שלהם (CD), חשוב לבחור טיפה עם מורפולוגיה מתאימה. כפי שמוצג באיור 2, רק תקליטורים קטנים (1-3 מיקרומטר), חלקים, אחידים ולא נפוחים מדי מתאימים לתיקון-מהדק. זעיר, חד צדדי; תקליטורים "מנופחים" ושקופים לחלוטין מייצרים חותמות חלשות או ללא חותמות. תקליטורים שיש בהם חלקיקים מסיסים גדולים עלולים לסתום את פיפטת ההקלטה. כאשר זרעונים של עכברי אשכים נכנסים לאפידידימיס, התקליטורים שלהם ממוקמים באזור הצוואר, קרוב לראש. כשהם עוברים דרך האפידידימיס, התקליטורים שלהם נעים לאורך החלק האמצעי ובסופו של דבר מגיעים לחיבור בין החלק האמצעי לחלק הראשי (הטבעת) כאשר הזרעונים מגיעים לאפידידימיס הזנב. לכן, כפי שהוזכר לעיל בתאי זרע המבודדים מהקורפוס אפידידימיס, התקליטור ממוקם בדרך כלל קרוב למרכז האמצע. בתאים זנביים, ה-CD בדרך כלל יכול להימצא קרוב לטבעת (איור 2C). עבור זרע אנושי, התקליטור ממוקם באזור הצוואר (איור 2A,B).
אמנם זו לא בעיה עבור זרעונים שבודדו מחיות מעבדה, אך קיימת שונות משמעותית בין תורמים אנושיים. שונות באיכות הזרע בתוך אותו תורם משפיעה בעיקר על איכות קרום פלזמת הזרע ולעיתים מקשה יחסית על היווצרות חותם. יש פחות שונות בהתנהגות תעלות יונים ובפרמקולוגיה, גורמים שככל הנראה קשורים לגנטיקה או לפיזיולוגיה של הפרט. יש להתמיד ולהעריך דגימות מתרומות שונות במשך מספר ימים, כמו גם להסתמך על מספר משתתפים תורמים אנושיים. עבודה עם חומר אנושי דורשת סבלנות יתרה, שכן הזרע התורם משתנה מאוד באיכות הזרע אצל אותו תורם, בהתאם לגורמים סביבתיים שונים. אנו ממליצים להעריך דגימות מימי תרומה שונים כדי לקבל החלטה סופית על סטטוס התורם. בעוד שזרעונים מטוהרים שנפלטו מתאימים בדרך כלל לאלקטרופיזיולוגיה תוך שעות (עד 12 שעות לאחר בידוד לזרע אנושי), תאי זרע של עכברים אפידידימליים מתאימים לתיקון רק בחלון של שעתיים לאחר הבידוד.
ואחרון חביב, היווצרות ג'יגה-סיל שונה בין תאי זרע. עבור תאי זרע מורין/מכרסמים, היווצרות ג'יגה-סיל מתרחשת כמעט באופן מיידי, בעוד שנדרשות מספר שניות (ולפעמים עד דקה) כדי ליצור ג'יגה-סיל עם זרע אנושי. לעתים קרובות היניקה הראשונית מביאה להתנגדות כניסה הנעה בין 200 MΩ ל-800 MΩ. החלפת פוטנציאל ההחזקה ל-60 mV ומתן פולסים קצרים של "מבחן ממברנה" עד 10mV מסייעים לרוב בהצלת היווצרות ג'יגה-סיל (באמצעות תנועה המושרה על ידי שדה מתח של הממברנה בפיפטה).
טכניקת מהדק תיקון תאי הזרע מאפשרת מחקר מפורט של תעלות יונים ספציפיות במערכת הביטוי הטבעית שלהן. הצלחת הטכניקה תלויה בציוד מתאים, תאי זרע ברי קיימא באיכות גבוהה, ריאגנטים טהורים, מיומנויות אלקטרופיזיולוגיה בסיסיות, סבלנות והתמדה. השיטה פותחת גבולות חדשים בפיזיולוגיה של הזרע על ידי חקר המגוון האבולוציוני של תעלות יונים, מנגנוני ויסות שלהן ושינויים בתפקודן כאשר הן עוברות ממערכת הרבייה הזכרית לנקבית ומשתנות על ידי תנאים אקסוגניים, כגון pH וליגנדים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק NIH R01GM111802, פרס Pew Biomedical Scholars 00028642, פרס אלפרד פ. סלואן FR-2015-65398 וצוואה של פקר וונץ (ל-P.V.L). עבודה זו נתמכה גם על ידי Deutsche Forschungsgemeinschaft (קרן המחקר הגרמנית) 368482240/GRK2416 (ל-N.M.) ועל ידי מלגת מועצת המלגות של סין ל-B.L. אנו מודים לד"ר דן פלדמן על שיתוף רקמת חולדה, לקייטי קלוסטר וסטיוארט מאיירס מאוניברסיטת קליפורניה בדייוויס על העזרה ברכישת תאי זרע של פרימטים, ולסטיבן מנסל על העזרה בניתוח רכישת נתונים מתאי זרע של חזיר ושור.
Materials
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
References
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. . Ion Channels of Excitable Membranes 3rd Edition. , (2001).
- Molleman, A. . An Introductory Guide to Patch Clamp Electrophysiology. , (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082 (2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130 (2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153 (2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53 (2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853 (2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438 (2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426 (2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5 (2019).
- World Health Organization. . World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009 (2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212 (2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved