Method Article
哺乳類精子細胞の原形質膜を横切る電流の記録
要約
このプロトコルは、イオンチャネル活性を直接記録することを目的として、全細胞構成の哺乳類精子細胞からの電気記録を行う方法を説明しています。この方法は、いくつかの精子イオンチャネルの電気生理学的プロファイルを記述するのに役立ち、それらの分子同一性と調節を明らかにするのに役立ちました。
要約
哺乳類の生物の最も小さい細胞の1つである精子細胞からの電気的活動の記録は、何十年にもわたって電気生理学者にとって困難な課題でした。「精子パッチクランプ」として知られる方法は、2006年に導入されました。これは、全細胞および細胞付着構成におけるイオンチャネル活性の直接記録を可能にし、精子細胞の生理学およびさまざまなカルシウム、カリウム、ナトリウム、塩化物、およびプロトンイオンチャネルの分子同一性を説明するのに役立ちました。しかし、単一の精子からの記録には、高度な技術と電気生理学の訓練が必要です。この詳細なプロトコルは、ステップバイステップの手順を要約し、精子細胞の魅力的な生理学を探求したい人が利用できるようにするために、いくつかの「取引のトリック」を強調しています。具体的には、プロトコルは、ヒトおよびマウスの精子細胞からの記録を説明していますが、本質的に任意の種の任意の哺乳動物の精子細胞に適応させることができます。プロトコルは、精子細胞の単離、試薬および機器の選択、高運動性細胞の固定化、記録電極と精子細胞の原形質膜との間のタイト(ギガオーム)シールの形成、全精子モードへの移行(ブレークインとしても知られている)、および精子細胞カルシウムイオンチャネルの例示的な記録など、この技術の適用の重要な詳細をカバーしています。 CatSper、6つの哺乳類種から。精子パッチクランプ法の利点と制限、および最も重要な手順について説明します。
概要
Erwin NeherとBert Sakmann1によって発明された従来のパッチクランプと同様に、精子細胞パッチクランプは、個々のイオンチャネル活性の調査を可能にするだけでなく、単一細胞2,3内のイオンチャネル集団全体の活性から記録することができます。この方法により、酵素細胞内プロセスからのデカップリングの程度下で特定のイオンチャネルタイプを同定できます。この方法は、電気生理学的および薬理学的フィンガープリントに基づくイオンチャネル活性の測定に不可欠であり、したがって、信頼性の高い同定戦略を提供します。この方法の欠点は、非電気発生性トランスポーターを検出できないことです。さらに、基本的な電気生理学的トレーニングは、プロトコルのニュアンスを理解するのに役立ちます。パッチクランプ技術を習得し、それを哺乳類の精子に適用するには、基本的なパッチクランプの文献4,5を研究することをお勧めします。この論文では、詳細なステップバイステップの手順を提供し、この手法を理解しやすく、精子細胞の電気生理学を実践したい人なら誰でも利用できるようにする独自の実践に焦点を当てています。
イオン恒常性は、精子細胞の重要な生理学的機能であり、生理学的に重要なイオン勾配を維持し、細胞内カルシウムを変化させ、膜貫通電圧を変化させるために、イオンチャネルとイオントランスポーターに大きく依存しています。イオンチャネルとイオントランスポーターは、運動性、雌の生殖管でのナビゲーション、精子の成熟、海洋生物では卵子への走化性などの精子細胞の必須機能を調節しています6,7,8,9,10,11,12 .精子の運動性は徐々に獲得されるプロセスです。精子細胞は、精巣内での成熟期と、その結果として精巣上体を通過する間、主に静止状態になります。それらの運動性は、精子細胞の内部酸性化につながる酸性の精巣上体環境によって抑制されます。これは、pH 6.013,14未満で機能できないため、軸索の機能を損なう。しかし、精液やよりアルカリ性の環境にさらされると、精子の細胞内イオン濃度と細胞質のpHは大きく変化し、精子は運動性になります15,16,17。精子の鞭毛の動きは、軸索微小管18の滑りを支えるATP加水分解によって駆動され、このプロセスはpHに大きく依存する14。さらに、べん毛の動きは、べん毛内カルシウムとcAMPの上昇によっても制御されます13,19,20,21,22,23,24。これらの因子、すなわち精子の細胞内カルシウム濃度[Ca2+]i、pH、ATP、およびcAMPは、運動性の変化を可能にする主要な調節メカニズムであり、それらの濃度は精子イオンチャネルとトランスポーターによって厳密に制御されています。
精子細胞は、体内の他のどこにも見られない多くのタンパク質を発現するという点で独特です。注目すべき例は、カリウムチャネル、Slo3 25,26,27,28,29、およびSpermのCatイオンチャネル、CatSper 2,30,31,32などの精子イオンチャネルです。後者は、哺乳類の精子31の主要なカルシウムチャネルであり、細胞内アルカリ化2,30,31,32,33,34によって調節されている。CatSperは、種特異的な手がかり7,35によっても調節され、精子の鞭毛36,37,38に沿って四辺形の縦方向のナノドメインに組織化されている。霊長類では、CatSperはべん毛アルカリ度、膜脱分極、プロゲステロンの組み合わせによって活性化されます3,39,40,41、マウスの場合、CatSper活性化プロゲステロンは必要ありません2,39。このチャネルのもう一つの特徴は、そのマルチサブユニット編成です:CatSperは、少なくとも10の異なるサブユニット31,32,34,37,38,42,43,44,45,46,47の複合体です.このような洗練された構造とその調節特異性は、既知の異種発現系におけるCatSperの組換え発現を妨げ、したがって、CatSperの生理学的特性評価は、その天然の発現系である精子細胞に限定されてきました。CatSperタンパク質の分子特性評価は、2000年にD. Renらによって独創的な論文で達成されました。al.31、CatSperが真正なイオンチャネルであるという究極の証明は、2006年に精子パッチクランプ法が導入された後にのみ可能になりました2.それ以来、この技術により、精子細胞9,28,37,39,40,44,46,48-54の多くのイオン伝導経路の正確な特性評価が可能になりました。
イオンチャネルの特性を研究するための古典的で最も簡単な方法であるパッチクランプ法は、その運動性と特定の形態のために精子細胞には適用できないと考えられていました(図1A)。具体的には、精子の細胞質の微小な体積と、精子の線維性鞘や核などの硬い細胞内構造への精子原形質膜の緊密な付着が主な課題であった55。これらの2つの構造的特徴により、卵の保護服などの高粘度環境を貫通するように設計されたスリムな矢印型の細胞ができあがり、原形質膜に大きな変形や損傷を与えることなく形成されます。
パッチクランプ法の最初のステップは、記録ピペット(ガラスマイクロピペット)と細胞原形質膜との間のタイトシールの確立です。これを達成するためには、記録ピペットの内側に十分な量の原形質膜を引っ張り込み、原形質膜とガラスとの間に機械的に安定したギガシールを形成する必要があります。原形質膜は柔軟性があり、硬くないものでなければなりません(図1B)。上述したように、精子原形質膜の表面全体は、細胞質液滴として知られる領域を除いて、かなり密着しています(図1Aおよび図2)。したがって、精子の原形質膜の硬直性は、良好な記録には>109オームが必要であることから、そのように名付けられたタイトシールまたは「ギガシール」を得る際の主な障害であると考えられていました。しかし、2006年に精子パッチクランプ技術2が導入されたことで、この障壁が取り除かれ、この方法はいくつかの哺乳類の精子細胞にうまく適用することができた2,41,51,56。このブレークスルーは、精子の中央部に沿って見られる小さな構造である細胞質液滴(CD)2,8に焦点を当てることによって達成され(図1Aおよび図2)、頭と尾が発達する精子細胞の前駆体である細長い精子細胞の残骸にすぎません。機能的には、射精中の細胞外浸透圧の変化に細胞が適応するのを助ける可能性があります。重要な特徴は、CD内の原形質膜がピペットに引き込まれてギガオームシールを形成するのに十分な柔軟性があることです。したがって、精子CDは、精子表面の最良の部分であり、それを通じてギガシール形成に成功し、最終的に精子細胞をパッチクランプ増幅器2,8に電気的に結合する全細胞モードに移行することができる。注目に値するのは、以前の論文では、精子頭部でのギガシール形成の成功が報告されており、これにより細胞付着型54,57,58,59での記録が可能になったことです。しかし、全細胞構成での記録は、これまでCD領域でギガシール形成を行うことによってのみ報告されています。この全細胞モードは、精子細胞の全体積への電気的アクセスを可能にし、したがって、精子の鞭毛および精子頭部に位置するイオンチャネル活性の検出を可能にする。その開発からわずか数年で、精子パッチクランプ技術は、精子イオンチャネルの理解において大きな進歩をもたらし、これまでのところ、精子イオンチャネルの機能を直接調査するための最も堅牢な技術の1つです9、28、37、39、40、44、46、48、49、 50,51,52,53(図1)。
精子パッチクランプは、以下に概説するように、古典的なパッチクランプ技術とはいくつかの詳細が異なります。まず、精子の原形質膜の大部分は硬直した細胞内構造にしっかりと付着しているため、精子にはピペットに引き込まれる「予備の」原形質膜がほとんどありません。柔軟性がある唯一の領域は、多くの体細胞の原形質膜に似たCDの膜であるため、ピペットに簡単に引き込むことができます。CDとギガオームシールを形成するには、ピペットの上部で軽い吸引によって負圧を発生させ、精子原形質膜のごく一部をマイクロピペットの先端に引き込みます(図1B)。メンブレンのこの部分は、ピペットの先端にΩ字型の陥入を形成し、その内部壁と密封を確立します。
次に、ヒトおよびマウスの精子の細胞質液滴は1〜2μmです(図1 および 図2)。したがって、このような小さな物体にパッチクランプ技術を適用するには、高解像度の光学系が必要です。ほとんどの精子パッチクランプリグには、微分干渉コントラスト(DIC)またはノマルスキー光学部品を備えた倒立顕微鏡が装備されています(図2 および 図3)。DICの空間情報により、小さなCD上にパッチピペットを位置決めする精度が向上するため、従来の位相差光学系よりも、精子パッチクランプにDIC光学系を搭載した顕微鏡を使用することを強く推奨します。また、60倍水浸対物レンズまたは同様のレンズを使用し、開口数が1.2のものもお勧めします。この対物レンズは作動距離が0.28mmと長いため、溶液中で自由に泳ぐ精子細胞を観察できます(図2)。対物レンズには、カバースリップの厚さ(0.13〜0.21mm)に合わせて調整するための調整カラーもあります。この長い作動距離と調整カラーの組み合わせにより、2つの0.13mmカバースリップによる観察が可能になります。1枚のカバースリップが記録室のガラス底部として機能し、その上に精子細胞が沈着した5mmのカバースリップが置かれています。以下で論じるように、記録チャンバの底部に直接ではなく、容易に交換可能な丸い5mmカバースリップ上に精子細胞を沈着させることは、新鮮な精子細胞を記録チャンバにロードする便利な方法である。
第三に、精子パッチクランプリグには、微小な(ピコアンペア範囲の)電流と膜電位の微小な変化を記録するために、低ノイズのパッチクランプアンプとデジタイザを装備する必要があります。この機器は、最小のアンプノイズを確保する必要があります。振動がないことは、パッチクランプ録音を成功させるために不可欠な要素です。精子パッチクランプには、独立したマイクロマニピュレータースタンドよりも優れた安定性を確保するために、マイクロマニピュレータープラットフォームを備えた倒立顕微鏡に取り付けることができるドリフトフリーの精密マイクロマニピュレーターが必要です(図3A)。セットアップをテストするには、人が防振テーブルの近くの床で飛び跳ねても、ピペットチップの動き(60倍倍以下)が見られないようにする必要があります。
プロトコル
すべての実験は、動物研究に関するNIHのガイドラインに従って行われ、カリフォルニア大学バークレー校の動物管理および使用委員会(AUP 2015-07-7742)によって承認され、動物の苦痛を最小限に抑えるためにあらゆる努力が払われました。記載されているすべての方法は、米国獣医師会およびIACUC委員会の安楽死に関するパネルの推奨事項と一致しています。ヒト由来のサンプルを使用するすべての実験手順は、カリフォルニア大学バークレー校のヒト研究委員会(IRBプロトコル番号2013-06-5395)によって承認されました。
1. 全細胞精子パッチクランプ記録用のガラスマイクロピペットの製作
注:細胞質液滴のサイズが小さいため、先端が細いガラス製マイクロピペットが必要です。
- マイクロピペットの製造には、外径1.5 mm、内径0.86 mm、内部フィラメントを備えたホウケイ酸ガラスキャピラリーから始めます。マイクロピペットプーラーの先端を引っ張ります(図3B)。
- ピペットチップの成形と研磨のために、ホットワイヤーをチップのすぐ近くにしばらく配置します。ピペットポリッシャーを使用して、100倍の倍率でこのファイヤーポリッシュのプロセスを実行します(図3C、D)。
- ピペットチップの内径が火研磨前に~2μmであり、適切な研磨後に~0.5μmに減少していることを確認してください。
注意: 録音日に作られた引きたてのピペットのみを使用することをお勧めします。これにより、ピペットの先端にほこりの粒子が蓄積するのを防ぎます。
2. リグのセットアップ
- 記録室の組み立て
- 層流と比較的速い溶液交換速度を備えた少量のダイヤモンド型灌流チャンバーを使用します(図4)。チャンバーをマニホールドを介して重力供給灌流システムに接続します(図5)。
- 記録チャンバーを介して溶液を灌流するには、灌流チャンバーを8つの別々の灌流ラインに接続するポリテトラフルオロエチレンマニホールドを備えた簡単な自作の重力供給灌流システムを組み立てます。
注:チューブは、可塑剤を溶液に浸出させてはならない、なぜなら、そのような化学物質は精子細胞60の正常な機能に重大な影響を与え、イオンチャネル活性61,62を変化させる可能性があるからである。小径のポリテトラフルオロエチレンチューブをメインの灌流チューブとして強くお勧めします。 - ポリテトラフルオロエチレンチューブはかなり硬いため、ポリテトラフルオロエチレンチューブに高純度シリコンチューブをフィットさせてフレキシブルに接続します。また、鉱物油やその他の潤滑油添加剤がイオンチャネルの記録を妨げる可能性があるため、潤滑剤が不足しているシリンジ(ルアーロックシリンジタイプなど)を使用してください(図5)。
- 寒天ブリッジの組み立て
- 記録中の液路電位の変化を避けるために、寒天ブリッジを使用して参照電極周辺の環境を安定させます(図4)。
- 寒天ブリッジを作るには、小さなブンゼンバーナーの火の下でL字型のガラスキャピラリーを曲げて作り、冷まします。
- 1%アガロースを1M KClに溶かし、アガロースが溶けて溶液が透明になるまで電子レンジで加熱します。L字型のガラスキャピラリーに上記の溶液を慎重に充填して、気泡を防ぎ、室温まで冷まします。寒天ブリッジは、+4°Cで1 M KClに~2か月間保存できます。
- 寒天ブリッジを使用するには、Ag/AgClペレット参照電極に1 M KClを充填し、固化したアガロースがガラスキャピラリーから飛び出さないように寒天ブリッジを慎重に挿入します。
- 次に、 図4に示すように、アンプヘッドステージワイヤーの金ピン(2mm)を参照電極2mm(金)スロットに挿入し、L字型寒天ブリッジの端を灌流チャンバーに挿入します。
- ソリューションとレシピ
注:すべての試薬と化学薬品は最高純度でなければなりません。調製したすべての溶液は、滅菌済みの0.22μmPESフィルターでろ過され、4°Cで最大1か月間保存されます。浸透圧の正確な調整は、パッチクランプを成功させるための前提条件であることに注意する必要があります。- 表1に記載されているように、ヒト尿管液(HTF)溶液を調製します。NaOHでpHを7.4に調整します。浸透圧は280±5 mOsmで、蒸気圧浸透計を使用して測定します。
- 表2に示すように、高生理食塩水(HS)の「浴」または「細胞外」溶液を調製します。NaOHでpHを7.4に調整します。浸透圧は320±5mOsmである必要があります。
- 表3に記載されているように、メタンスルホン酸セシウムの「浴」または「細胞外」溶液を調製します。CsOHでpHを7.4に調整し、浸透圧を320±5 mOsmに調整します。
- メタンスルホン酸セシウム(CsMeSO3)細胞内「ピペット」溶液を調製するには、 表4 に従い、CsOHでpHを7.4に調整します。浸透圧はHSソリューションよりも最大10 mOsm高くする必要があります。
3. 哺乳類精子の単離と精製
注:生後3〜6か月のC57BL / 6雄マウスをCO2の吸入とそれに続く子宮頸部脱臼により安楽死させます。子宮頸部脱臼後、直ちにマウスから組織採取(尾状または精巣上体)を行います。
- マウス精巣上体精子の単離
注:生後3〜6か月のC57BL / 6雄マウスをCO2の吸入とそれに続く子宮頸部脱臼により安楽死させます。子宮頸部脱臼後、直ちにマウスから組織採取(尾状または精巣上体)を行います。- マウスの下腹部をハサミで開き、両方の精巣上体を抽出します。
- HS溶液(高生理食塩水、 表2参照)で満たされた35 mm細胞培養皿に入れます。HS溶液のアリコートが精子細胞と接触する前に室温に予熱されていることを確認してください。
- エピジメディーをHS溶液を含む新しい細胞培養皿に移し、残留脂肪をすべて完全に除去します。
- #15メスの刃を使用して、精巣上体をcaput、corpus、およびcaudaに分離します(図6)。
- 各精巣上体のコーパス(または必要に応じて尾)をHS溶液を含む新しい細胞培養皿に移します。尖った#11メスの刃を使用して、精巣上体の孤立した部分に複数の切開を行います。
- 複数の切開部がある精巣上体の一部を、1.5 mL HS溶液を含む1.5 mLマイクロ遠心チューブに移します。
- 精巣上体からの精子細胞を、超微細なデュモン型5a鉗子を用いて溶液に短時間振とうします。精巣上体を廃棄し、チューブを室温で10分間放置します。
- 固形物(非精子細胞)がチューブの底に沈殿するまで待ち、上清を別の1.5mL微量遠心チューブに移します。
- 精子混合物を室温で保存し、空気に最大2時間アクセスし、その間に実験を行うことができます。分離された精子は、分離後3時間でパフォーマンスを失います。
- マウス精子の能力
注:すべての精巣上体の精子はパッチクランプに適していますが、精巣上体尾の精子のみが受精能力を持つのに十分成熟しています。尾側の精子は受理能力を得ることができるので、尾側の精子細胞を用いて実験、特に精子の受精能受理を行います。- 尾側または射精した精子で精子収集を行います(手順3.1.1-4を参照)。
- 手順 3.1.4 で説明したように、caudae を分離します。ステップ3.1.5で説明されているように、複数の切開を適用します。カウダエを2 mLの容量化溶液を入れた10 mm細胞培養皿に移します。
- この容量増強溶液で尾側組織を最初に37°Cおよび5%CO2で10分間インキュベートし、次に組織を廃棄し、放出された精子細胞をさらに50〜80分間インキュベートします。
注:マウス尾側精子のin vitro容量化は、60〜90分のインキュベーションによって達成されます。容量のある精子細胞は、過活性化として知られるべん毛の過度の非対称な屈曲に基づいて視覚的に識別されます。このタイプの運動性により、精子は非線形に泳ぐことができます。
- ヒト精子の収集と精製
注:この場合、新鮮な精液サンプルは、21〜38歳の合計21人の健康なボランティアから得られ、精子は48,63で詳細に記載されているように室温のスイムアップ技術によって精製されました。簡単に言うと、手順は次のとおりです。- ヒト射精サンプルを室温で60分間放置して、精製する前に液化させます(長時間は精子の品質に悪影響を与える可能性があります)。
- 50 mLの遠心チューブで約7 mLのHTF溶液を37°Cに予熱します。射精液の量を視覚的に評価します-容量が1mLを超える場合は、HTF溶液の複数のチューブを準備します。
- 1 mLの液化射精液を各チューブの底に注意深く下敷きし、精液のストランドを緩衝液の表面に持ち上げないようにします。.精液とHTFのインターフェースは、できるだけ明確であるべきです。気泡を避けてください。
- チューブを37°Cのインキュベーターに1時間入れ、表面積を最大にするために45°の角度で保持するスタンドに入れます。インキュベーターがCO2 インキュベーターの場合は、バッファーの酸性化を防ぐためにキャップをしっかりと閉めます(この手順にはCO2 は必要ありません)。インキュベーション中、運動性精子はHTFバッファーの表面に向かって徐々に泳ぎます。
- 1時間後、15 mLの遠心分離チューブ内のすべてのサンプルから最上部の1 mL画分を採取し、最高品質の高運動性精子をパッチクランプに組み合わせます。汚染を避けるために、精漿の上に残っている数mLのHTFをすべて除去しようとしないでください。.精製した細胞懸濁液は、室温で数時間保存できます。
注:正常な射精液には、mL64あたり少なくとも15 x 106個の精子細胞が含まれている必要がありますが、精子数はサンプル間で大きく異なります。細胞数が少ないという障害は、精製された精子懸濁液を室温で30〜60分間放置してからパッチクランプを行うことで克服できます。この条件下では、細胞は遠心分離管の底部に徐々に蓄積し、目に見える細胞雲を形成し、そこから細胞を記録チャンバーにピペットで移すことができます(下記参照)。
- ヒト精子の能力
注:ヒト精子のインビトロ容量化は、容量化溶液中で4時間インキュベーションすることによって達成できます:20%ウシ胎児血清、HTFまたはHSバッファー48,51中の25mM NaHCO3。容量のある精子細胞は、精子が非線形に泳ぐことを可能にするべん毛の活発な運動性と過度の非対称の屈曲に基づいて視覚的に識別できます。- 2倍の容量化溶液を調製し、精子懸濁液と1:1で混合します。
- 37°Cおよび5%CO2で最低4時間インキュベートします。容量のある細胞の割合を高くするためには、インキュベーション時間を4時間以上にする必要があります。
4. コーティング液の準備(ヒト精子パッチクランプのみ必要)
注:重要な手順は、侵入する前に、取り付けられた精子をカバーガラスから持ち上げることです。このステップは、ヒトの精子細胞にのみ必要であり、ガラスカバースリップをコーティングして、接着性の少ないガラス表面を作成する必要があります。カバースリップコーティングは、精子細胞がカバースリップに付着する確率を減らし、ギガシール形成が成功した後にヒトの精子をガラスカバースリップから持ち上げることができます。
- 射精液200μLを15 mL遠心チューブ内の5 mLのHS溶液で希釈します。
- 300 x g で5分間スピンダウンし、上清を取り除きます。
- ペレットを1mLのHS溶液に再懸濁し、微量遠心チューブに移します。
- 水で満たされた超音波処理浴を使用して、25°Cで10分間超音波処理します。
- 10,000 x g で5分間スピンダウンします。
- 上清を新しい微量遠心チューブに移し、コーティングに使用します(以下の手順)。
5. 精子原形質膜全体からのイオンコンダクタンスの記録
- カバースリップに精子を付着させます。
注:パッチクランプ記録の前に、精子は5mmの丸いカバースリップにメッキされます。- ヒト細胞を扱う場合は、鋭利な鉗子を使用して、調製したコーティング溶液にカバーガラスを短時間浸します。
- 4ウェルプレートの1つのウェルに4つのカバースリップを入れ、300μLのHS溶液で覆います。カバースリップが浮かぶのを防ぐには、カバーを4ウェルプレートの底にテープで固定し、ピペッターのプラスチック製の先端で押します。
- ヒト(ステップ3.3.5)またはマウス精子(ステップ3.1.9)の濃縮懸 ?? 液を保存チューブ(20〜50 μLの濃縮精子)からカバーガラスの上の300 μLのHS溶液に穏やかに再懸 ?? します。.
- 精子がウェルの底に蓄積し、頭がカバースリップに付着し、べん毛がカバースリップのすぐ上の溶液で激しく叩くことを確認します。記録する前に、精子が室温で約10分間カバーガラスに沈殿するのを待つことが重要です。
注:ヒト精子の付着が不十分な場合は、手順5.1.1に戻り、調製したコーティング溶液をHS溶液で希釈します(1:20から最大1:2)。このステップは、ヒトの精子調製物に共通する可変の精子運動性に基づいて、異なるヒトドナーからの精子サンプルに合わせて調整する必要があります。
- カバースリップの置き方
- ウェルから細胞がわずかに付着したカバースリップを1枚取り出し、HS溶液を含む記録チャンバーのひし形ウェルに入れます(図4)。
- HS溶液で満たされた灌流システム(図5)をオンにしてチャンバーをすすぎ、チャンバーから破片や余分な剥離した精子を取り除きます。これにより、記録ピペットが細胞に到達したときに清潔なままである可能性が高くなります。このステップは、カバーガラスに強くくっつく傾向がある非容量性細胞を扱う場合に役立ちます。
注:容量のある精子から記録する場合は、新しいカバースリップがチャンバーに配置された直後に灌流をオンにすることは避ける必要があります。容量のある精子は活発な運動性を持ち、カバーガラスにゆるく付着するだけです。したがって、最大数の能力付き精子が利用可能になるようにするには、~10分待って、容量のある精子をカバースリップに付着させてから灌流をオンにすることが重要です。適切な容量セルが選択され、ギガシールが形成されたら、灌流を再びオンにすることができます。
- パッチクランプ記録のための精子細胞の選択。
- 600倍の倍率を使用して、細胞質の液滴を持つ適切な精子細胞を見つけます(下記参照)。これは、10倍倍アイピースを使用した方法で説明されているように、60倍の水浸レンズを使用して行われます。精巣上体から単離された精子細胞では、CDは通常、中盤の中心近くに位置しています。尾側細胞では、CDは通常、輪の近くに見つけることができます(図2C)。ヒトの精子の場合、CDは首の領域にあります(図2A、B)。
注:さらに、顕微鏡の引き出し式1.6倍オプションを使用して、精子の形態を綿密に調べることができます(倍率960倍)。 - 細胞質液滴が楕円形で、わずかに細長い(図2G)紡錘形の形状をしていることを確認します。非常に丸く拡大して見える CD は、壊れやすく、パッチ適用に適していないことがよくあります (図 2D、F)。
- 頭がカバーガラスに付着した状態で運動性があり、精子細胞は部分的に固定されているが、CDと残りの鞭毛は鞭毛の鼓動で動き続ける精子を選択します。精子の頭がカバースリップにゆるく取り付けられていることを確認し、鞭毛が左右に移動するときに少し回転します。
注:ギガオームシールの形成後、全細胞モードに移行する前に、精子をカバーガラスから溶液に持ち上げる必要があるため、緩い付着は重要です。
- 600倍の倍率を使用して、細胞質の液滴を持つ適切な精子細胞を見つけます(下記参照)。これは、10倍倍アイピースを使用した方法で説明されているように、60倍の水浸レンズを使用して行われます。精巣上体から単離された精子細胞では、CDは通常、中盤の中心近くに位置しています。尾側細胞では、CDは通常、輪の近くに見つけることができます(図2C)。ヒトの精子の場合、CDは首の領域にあります(図2A、B)。
- ギガシールの形成
注:全細胞モードで一価のCatSper電流を記録するために、ピペットはCs-メタンスルホン酸(ピペットまたは細胞内とも呼ばれる)溶液(表4とも呼ばれます)で満たされます-これにより、0 mVから10 mVの電圧ステップを印加するとアンプによって自動的に計算される11〜17 MΩのピペット抵抗が得られます(図7A)。ピペットは、用途に応じて他の溶液を充填することもできます。ピペットの抵抗を減らすために、メタンスルホン酸、Cl- 、アスパラギン酸、または同様のイオンなどの可動性陰イオンを使用して溶液を調製することをお勧めします。ピペット溶液の浸透圧は、浴液よりも最大10 mOsm高くする必要があります。ピペット溶液の張度がわずかに高いため、パッチクランプ記録中に精子細胞へのアクセス抵抗を可能な限り低く抑えることができます。- 適切な形態の精子細胞を視覚的に選択した後(図2G)、マイクロピペットにピペット溶液(表4)を入れ、ピペットホルダーに固定します。
- ピペットチップを破片から清潔に保つために、U字管形状のアセンブリを使用してピペットに陽圧を加え、ピペット溶液が細胞外溶液(以下「浴」溶液とも呼ばれる)に浸された後にチップから流出するようにします( 表2を参照)。
注:条件が許せば、一定の灌流下でシールを形成することを強くお勧めします。この条件により、ピペットの先端が最もきれいになります。 - ピペットを下げ、その先端を浴液に浸します(表2)。このとき、ピペットの抵抗を測定できます(図7A)。
- 細胞をはっきりと視覚化するために、ピペットの先端をCDの上に置き、先端の開口部をCDに対して斜め(約45°)に合わせます。
- ピペットの先端をCDに向かってすばやく下げて、CDから数μm以内の同じ焦点面に近づけます。
- ピペットの先端がCDに触れたらすぐに、「マウスピース」を使用してピペットに負圧を加え、液滴の一部をチップに移動し、ギガオームシールを形成します(電気生理学では「吸引イベント」とも呼ばれます)。通常、ピペットチップと最初に接触した後、ピペット内の負圧を最大1分間維持して、徐々にギガオームシールを達成できます。
- ギガオームシール(>4〜20GΩ)の形成に成功したら、精子をカバーガラスから持ち上げます(図7B)。
注:この手順は、げっ歯類の精子細胞には長さがあるため、必要ありません。ただし、精子の鞭毛の部分的な剥離は、潜在的なピペットドリフトを軽減するのに役立ちます。ヒトの精子の分離は、CDが小さい(1~3μm)ため、重要なステップです。セルをカバーガラスに取り付けたままにしておくと、実験中にピペットがわずかにずれるだけでもCDが乱れる可能性があります。精子が持ち上げられた後、その鞭毛は通常鼓動し続けますが、細胞はマイクロピペットにのみ付着します。
- 慣らし運転を行い、全細胞モードに移行します。
- アンプの補償モードを使用して浮遊容量トランジェントを補償してから、全セルモードに移行します(図7B)。最初にキャパシタンス過渡現象を観察するには、膜電位を0mVに保持し、「Membrane Test」ツールを使用して10mVパルスを印加します(図7B)。
- ブレークインを実行し、非常に軽い吸引と組み合わせて、短い(1 ms)徐々に増加する(430-650 mV、~50 mV刻み)電圧パルスを印加することにより、全細胞モードに移行します(図7C)。
注意: ブレークイン パルスを適用するには、パッチクランプソフトウェア内で以前にプログラムされたブレークインプロトコルを使用します。慣らし運転電圧パルスは、アンプの背面にある高電圧コマンド入力(リアスイッチ)を使用して精子に印加されます。 - 各ブレークイン電圧パルスを印加した後、 メンブレンテスト ツールを起動して、より大きな静電容量過渡現象が現れるかどうかを確認します。
注:大きな静電容量過渡現象(図7C)の存在は、侵入が発生し、細胞の全静電容量が測定されていることを示しています(ヒト精子の場合は~1pF、マウス精子の場合は~2.5pF以上)。 - Membrane Test Toolを使用して大きな静電容量過渡現象を適合させ、セル全体の静電容量とそのアクセス抵抗を決定します。
注:マイクロピペット溶液による精子細胞の内部の効率的な灌流、および精子原形質膜の信頼性の高い電圧クランプのために、アクセス抵抗はできるだけ低くする必要があります。アクセス抵抗は通常、Cs+ /K+ およびNMDGベースの細胞内溶液でそれぞれ25〜30MΩおよび50〜70MΩです。 - 慣らし運転が成功したら、さまざまな化合物を含むさまざまな浴溶液(図8)を適用したり、電圧ステップ(図8、 図9)または電圧ランププロトコルを使用してチャネル活動を測定するなど、計画された全細胞パッチクランプ実験を進めます。侵入が成功しなかった場合は、手順 6.4.1 に戻ります。新鮮なマイクロピペットを選択し、別の適切な精子細胞を選択します。
結果
精子パッチクランプ法により、CatSperチャネルを直接記録することができます。
上述したように、CatSperの記録は、パッチピペットと哺乳類の精子との間に高抵抗(ギガオーム)シールをその細胞質液滴で確立することによって行われました。侵入して全細胞モードに移行すると、精子細胞の全身とその内部(精子頭部と鞭毛を含む)への完全な電気的アクセスが得られる2,8,39,51。この条件により、最終的には精子原形質膜にある任意の活性イオンチャネルからの記録が可能になります。セシウムまたはナトリウムを主な透過イオンとして含む浴名目上二価フリー(DVF)溶液は、一価CatSper電流2,8,39,51の記録に適しています。CatSperチャネルはCa2+やBa2+などの二価イオンを伝導しますが、それらははるかに遅い速度でCatSperの細孔を通過しているため、数ピコアンペア(~10-20 pA)のコンダクタンスはほとんど検出できません2,8,39,51。したがって、CatSperチャネルを介して一価電流、したがってより大きな電流を測定することは、電流を評価するためのより便利な方法です(図8)。CatSperはカリウムにも透過性があることに注意することが重要です。したがって、CatSperチャネルをブロックするか、CatSper欠損精子細胞を精子細胞カリウムチャネル2,3,8,28,65のみを研究したい状況で使用する必要があります。ピペットと浴溶液のイオン組成を変化させることにより、特定のイオンチャネルを選択的に除外し、特定のイオンチャネルタイプのみから選択的に記録するための条件を作り出すことができます。例えば、ピペット溶液にCs+を添加すると、精子カリウムチャネルを介したイオン透過性が遮断されます。
CatSperチャネルは、哺乳類の種によって異なる方法で制御されています。
異なる種の精子細胞は、その形態と内部調節経路において多様である66。それらのイオンチャネルが、男性と女性の生殖管の特殊な微小環境を反映する方法で独自に制御されていることは驚くことではありません。精子パッチクランプ法は、図9に示すように、マウス2、ラット56、ヒト39,51、ウシ、イノシシ、マカク41の6種の哺乳類にうまく適用されています。これらの実験のために、成体のオスのアカゲザル[Macaca mulatta]の精子細胞は、カリフォルニア大学デービス校が承認した動物プロトコルの下で、Association for Assessment and Accreditation of Laboratory Animal Care International(AAALAC)の基準に従って、カリフォルニア国立霊長類研究センターから入手した(41)。;また、すべての研究は、米国国立衛生研究所の実験動物のケアと使用に関するガイドに従って実施されました。雄牛とイノシシの精液は、UCD動物科学部の施設から特定のIACUC承認を免除された副産物として入手され、すべての動物はAAALAC承認の施設で飼育されました。雄牛とイノシシの精液は、商業的な供給源からも入手できます。
霊長類(アカゲザル)とヒトの精子は、同様のCatSperチャネルの特性と調節を示しました。興味深いことに、CatSperのプロゲステロン活性化は霊長類の精子に特有のようであり(図9 および 41)、イノシシ、雄牛、およびげっ歯類の精子は、プロゲステロン刺激によるCatSper電流の変化を示さなかった。雄牛とイノシシの精子では、基底のCatSperチャネル活性でさえ検出可能な限界を下回っていました(図9)ことから、これらの種では、カルシウムの流入とそれに伴う過剰活性化が他のチャネル/トランスポーターによって引き起こされているか、CatSperチャネルの活性化には異なる天然の刺激物質が必要であることが示唆されています。ここで言及したすべての精子種(雄牛とイノシシの精子細胞を含む)では、精子細胞の内部への完全な電気的アクセスが得られ、侵入時の大きな静電容量アーチファクトの出現によって明らかなように、細胞は全細胞モードで記録されました(図7)。この状態により、機能的なCatSperチャネルの容易な記録が可能になり、イノシシおよびウシの精子からの不在は、このチャネルがこれらの種の精子細胞に存在する未知の内因性阻害剤によってブロックされているか、または活性化するために特定のモジュレーターが必要であることを示しています。ただし、これらは予備的な実験であり、これらの種におけるCatSperチャネルの機能的重要性を確保するためには、イノシシと雄牛の精子細胞に対して追加の実験が必要になります。この種間の精子イオンチャネルの多様性の広範囲は、精子と卵子のサイズの比率、精子のサイズと卵子保護服との関係に関連しているか、または他の種による受精の障壁として機能する可能性がある66。
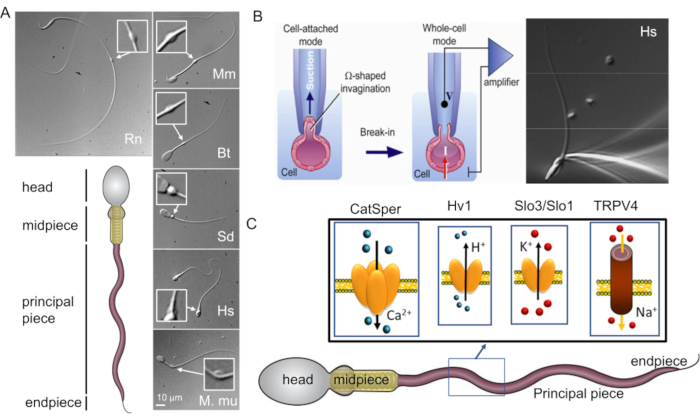
図1:哺乳類の精子の形態学的多様性 (A)下部パネル:精子の概略図。セルラーコンパートメントにはラベルが付けられています。トップパネル:時計回りに異なる種からの精子のDIC画像:ラット(Rn;Rattus norvegicus);マウス(Mm;Mus musculus);ブル(Bt;ボス・トーラス);イノシシ(Sd;sus scrofa domesticus);人間(Hs;ホモ・サピエンス)、アカゲザル(Mmu;マカカ・ムラッタ)。スケール バーは、すべての DIC イメージに適用されます。挿入物は細胞質の液滴を示します。(B)哺乳類の精子細胞のパッチング。ピペットチップと原形質膜との間のシール形成を成功させるために、原形質膜の一部をピペットチップに優しく吸い込みます。全細胞モードへの移行は、先端と細胞の間の原形質膜を破裂させることによって行われます(この図は8から再現されています)。右パネル:記録用マイクロピペットに取り付けたヒト精子細胞。(C)パッチクランプ法でヒト精子細胞で研究されたヒト精子およびべん毛イオンチャネルの一部、およびそれらが伝導するイオンの概略図。CatSper-カルシウムイオンチャネル39,51;Hv1-プロトンチャネル51,56,67;Slo3 / Slo1-カリウムチャネル50,53,65,68;TRPV4- 一過性受容体電位カチオンチャネルバニロイド4型48.この図の拡大版を表示するには、ここをクリックしてください。
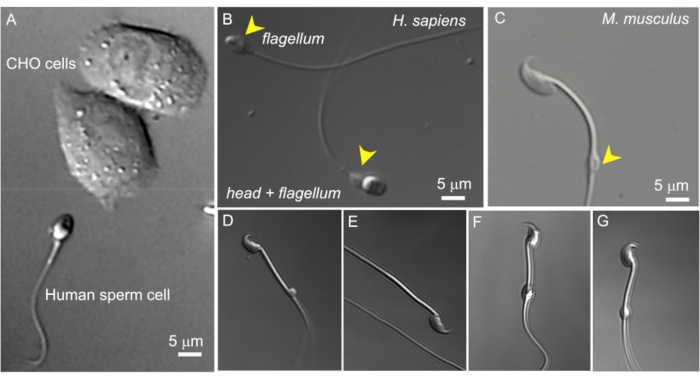
図2:精子のサイズと細胞質飛沫の形態の変化。 無傷の生きた精子細胞のDIC画像。(A)ヒト精子細胞(下)と2つのCHO細胞(上)のサイズの比較。(B)無傷のヒト(ホモ・サピエンス)の精子(下)と頭のない精子細胞(鞭毛、上)。細胞質の液滴は黄色の矢印で示されます。このフィギュアは8から再現しています。(C)黄色の矢印で示された正常な形状の細胞質液滴(CD)を持つ無傷のマウス(Mus musculus)精子。(D-G)精巣上体のマウス精子細胞は、さまざまなサイズと形状の細胞質液滴を持っています。(C)と(G)のみがパッチクランプに適しています。(D)CDは微視的で片面です。(E)CDがありません。(F)CDの内部には、録音ピペットを詰まらせる可能性のある粒子があります。(G)CDは滑らかで均一で、腫れていません。このタイプのCDでギガシールを形成すると、録音が成功する可能性があります。 この図の拡大版を表示するには、ここをクリックしてください。

図3:精子パッチクランプリグのコンポーネント (A)必須コンポーネントを備えた典型的な精子電気生理学リグ:(1)倒立顕微鏡;(2)低ノイズデジタイザー。(3)アンプ;(4)マイクロマニピュレータプラットフォームを備えた倒立顕微鏡に結合された低ドリフトマイクロマニピュレータ。(5)PCコンピュータ。(6)振動減衰エアテーブル。(7)周囲の電気的干渉からセットアップを保護するためのファラデーケージ。コンピュータのキーボードやマウスなど、リグのすべての電動コンポーネントが電気ノイズ(50Hzまたは60Hz)を低く、またはまったく発生せず、リグのすべてのコンポーネントが適切に接地されていることが不可欠です。(B)ピペット製作の記録に使用するマイクロピペットプーラー。(C) (1) ピペットの火磨きに使用されるmicroForge。(2)外径1.5mm、内径0.86mm、内部フィラメントを有するホウケイ酸ガラスキャピラリー。(3)ピペットコレクションボックス。(d)成功したピペットの火磨きの段階:(a)内径2mmの未研磨ピペット。(b)内径0.5mmのファイヤーポリッシュピペット。(c)過度に研磨された密封されたピペットは録音に適していません。 この図の拡大版を表示するには、ここをクリックしてください。

(A)記録室システムの必須部品:(1)シリーズ20プラットフォーム用の顕微鏡ステージアダプターと(2)2段保持クランプ。(3-4)PMシリーズ磁気加熱プラットフォーム、(3)灌流チャンバーを保持するための磁気クランプ付き。(5)灌流チャンバー;(6)寒天ブリッジ;(7)磁気クランプ、Ag/AgClペレットへの2mmジャッキ付き参照電極。(8)吸引ライン用の磁気ホルダー(MAG-1)。(9)吸引チューブ;(10)サクションチューブOホルダー。(B)(A)から示されたコンポーネントを備えた組み立てられた記録チャンバーシステム。この図の拡大版を表示するには、ここをクリックしてください。
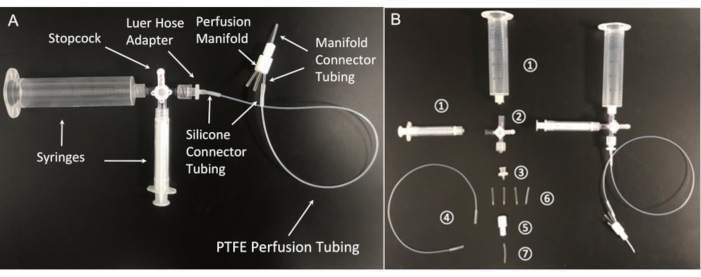
図5:灌流システムのコンポーネント。 (A)組み立てられた灌流ラインとその必須コンポーネント:(1)20mLおよび3mLシリンジ。(2)ルアー接続付きストップコック。4ウェイ;男性のロック;(3)メスルアーホースバーブアダプター、1/16インチ;(4)ポリテトラフルオロエチレン(PTFE)灌流チューブ(マイクロボアPTFEチューブ、内径0.022インチ×外径0.042インチ)。(5)ポリテトラフルオロエチレン8ポジション灌流マニホールド。(6)シリコンコネクタチューブ(プラチナ硬化シリコンチューブ、内径1/32インチ×外径3/32インチ)。(7)マニホールドコネクタチューブ(PTFEチューブ、1/32インチID×1/16インチOD)。この図の拡大版を表示するには、ここをクリックしてください。
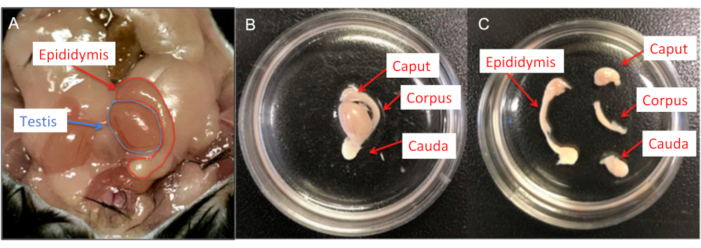
図6:雄性マウスの解剖(A)マウスの雄性生殖器官;精巣と精巣上体の両方が示されています。(B)精巣上体をHS溶液を含む35 mm細胞培養皿に移し、残留脂肪と輸精管を除去します。(C)次に、各精巣上体を#15メスの刃を使用して、頭蓋骨、体体、および尾骨に分けます。この図の拡大版を表示するには、ここをクリックしてください。
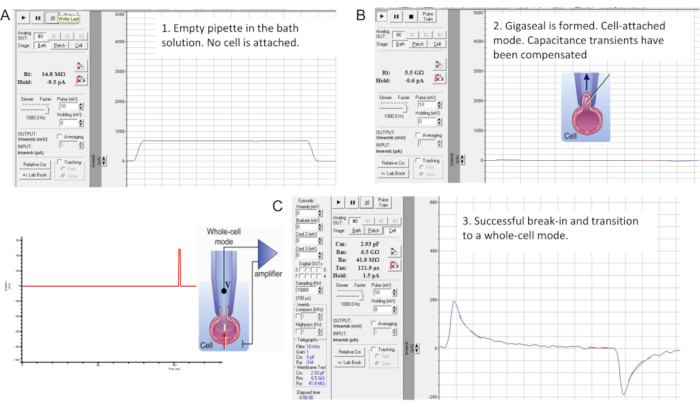
図7:ギガシールの形成とマウス精子細胞への侵入。 商用パッチクランプソフトウェアの「メンブレンテスト」ツールのインターフェース。精子パッチクランプの3つの段階:(A)記録されたピペットをバスHS溶液に浸し、14.8MΩのピペット抵抗を生成します。(B)ギガシールを形成し(抵抗は4.7GΩ)、静電容量過渡現象を補償し、精子をカバーガラスから持ち上げます。(C)全細胞モードに移行します。ブレークインと全細胞モードへの移行は、左図に示すように、短時間(1ms)の緩やかに増加する(430-650mV、~50mV刻み)電圧パルスを印加し、光吸引と組み合わせることで行われます。侵入は、細胞の全静電容量を反映する大きな静電容量過渡現象(この精子細胞では~2.93pF)の出現から明らかなように発生しています。 この図の拡大版を表示するには、ここをクリックしてください。
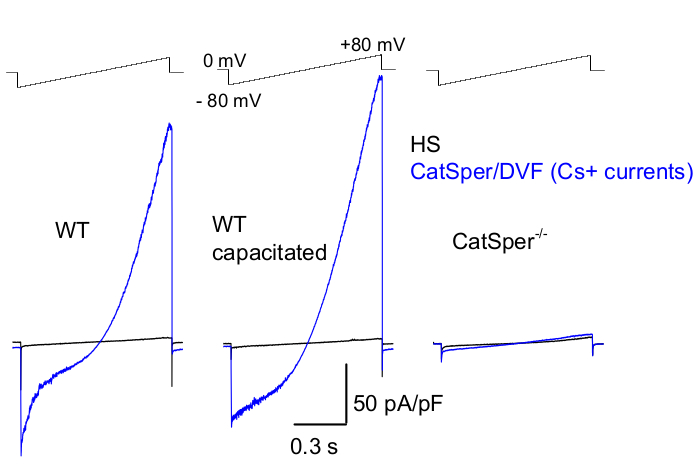
図8:野生型(WT)尾精巣上体、容量型、およびCatSperノックアウト精子からのマウスCatSperの記録。一価のCatSper活動を記録するために、ランププロトコルが5秒ごとに適用され、0 mV39,51の保持電位からの電圧ランプによってCatSper電流が引き出されます。電圧ランプ(-80mV〜80mV、850ms)は、HSおよび公称二価フリーソリューション(DVF)に適用されます。データは2〜5kHzでサンプリングされ、1kHzでフィルタリングされました。ベースライン電流はHS溶液に記録されますが、高細胞外マグネシウム39,51による阻害によりCatSper電流は発生しません。ベースライン電流は、リークコンダクタンス(非イオンチャネル経路)を推定するのに役立ちます。代表的なのは、尾側WTマウス精子細胞(非容量、左および容量、中央)およびCatSper欠損尾側マウス精子細胞(右)から記録されたCs+全細胞CatSper電流密度(pA/pF、青)。電流は、0mVの保持電位からの電圧ランプによって誘発され、HSおよび名目上は二価フリーのソリューションで-80mVから80mVのランプが印加されました。HS溶液に記録されたベースライン電流(黒色)。電流密度を得るために、CatSperの電流振幅をセル容量(pA / pF)に正規化しました。この図の拡大版を表示するには、ここをクリックしてください。
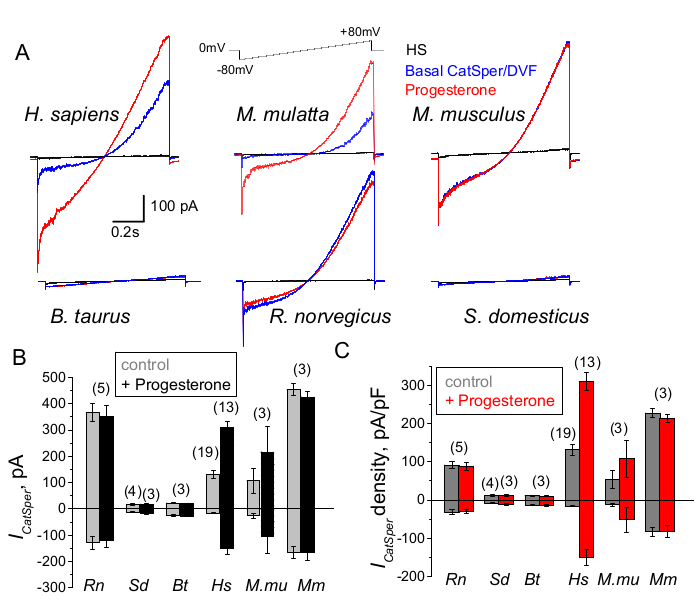
図9:異なる哺乳類種におけるCatSperのプロゲステロン調節 (A)示されているように、電圧ランププロトコルによって異なる種の精子細胞から引き出された代表的なCatSper電流。種:人間(Hs; H.サピエンス); アカゲザル(Mmu; M. mulatta)、マウス(Mm; M. musculus)、雄牛(Bt; B.おうし座);ラット(Rn; R. norvegicus);イノシシ(Sd; S. scrofa domesticus)。1 mMプロゲステロンの不在下(青)と存在下(赤)のCatSper電流、およびHS溶液中の基礎電流(黒)が記録されました。(B)CatSper電流振幅(ICatSper、pA)および(C)示されているように、異なる種の精子細胞からの平均電流密度(pA / pF)記録。nは、使用された個々の精子細胞の数を示します。データは平均+/- SEM ですこの図の拡大版を表示するには、ここをクリックしてください。
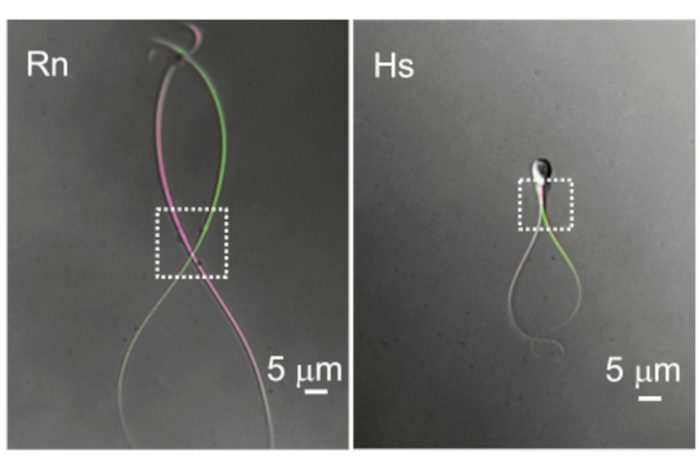
図10:べん毛の運動性の違い。 細胞質液滴とべん毛運動性の2つの代表的な例。同じラット(Rn)とヒト(Hs)の精子細胞の重ね合わせ画像は、最も遠位のべん毛のたわみを示す2つの異なる時点で撮影されました。点線の長方形は、細胞質の液滴がある領域とそれに対応する空間移動性を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
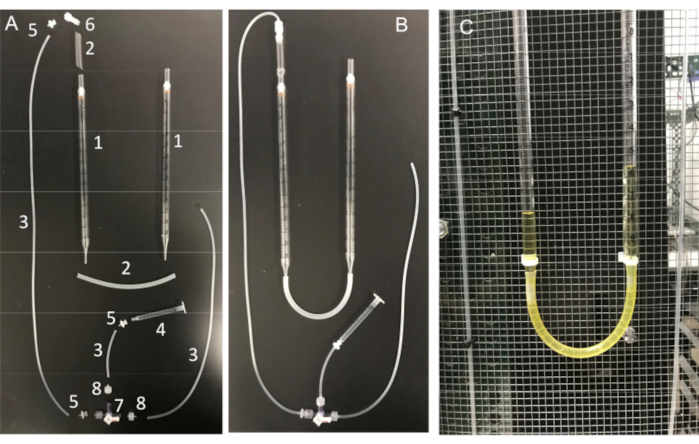
図11:U字管アセンブリーとその必須部品 (A)U字管の部品:(1)10mL血清ピペット;(2)シリコーンチューブ;(3)シリコンコネクタチューブ。(4)1mLシリンジ;(5)メスルアーバーブアダプター。(6)オスルアー一体型ロックアダプター1/8インチ;(7)ルアー接続の活栓。4ウェイ;男性のロック;(8)オスルアーシリーズバーブアダプター、1/16インチ。(B)ファラデーケージに取り付けられた完全に組み立てられたU字管と(C)U字管。 この図の拡大版を表示するには、ここをクリックしてください。
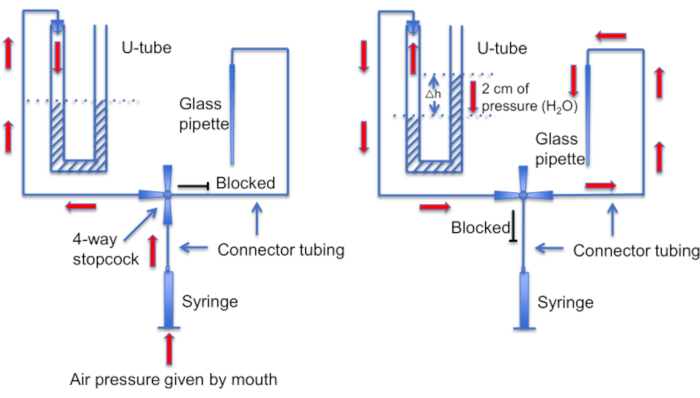
図12:U字管アセンブリの概略図。 左パネル:U字管内の液面に差を生じさせるために、口から正圧が供給されます。右ホーンの液体レベルは2cm上昇します。このレベル差が生じた後、ストップコックを回してU字管を録音ピペットにつながるラインに接続します。右パネル:右ホーンの液面が高いほど、正圧が発生し、ピペット溶液が常にピペットチップから押し出され、チップにゴミが付着しないようにします。 この図の拡大版を表示するには、ここをクリックしてください。
| 化学薬品 | モル重量(g / mol) | ミリメートル | 1Lのg |
| NaClの | 58.44 | 97.8 | 5.72 グラム |
| KClの | 74.55 | 5 | 0.373 グラム |
| KH2PO4 | 136.09 | 0.37 | 50.4ミリグラム |
| MgSO4 x 7です。H2O | 246.48 | 0.2 | 49.3ミリグラム |
| CaCl2 x 2。H2O | 147.02 | 2 | 0.294 グラム |
| ヘープス | 238.3 | 20 | 4.766 グラム |
| グルコース | 180.2 | 3 | 0.540グラム |
| 乳酸ナトリウム(60%w / w) | 112.06 | 20 | 3ミリリットル |
| ピルビン酸ナトリウム | 110 | 0.4 | 44ミリグラム |
表1: ヒト用尿管液(HTF)溶液
| 化学薬品 | モル重量(g / mol) | ミリメートル | 1Lのg |
| NaClの | 58.44 | 135 | 7.889 グラム |
| KClの | 74.55 | 5 | 0.373 グラム |
| CaCl2 x 2。 H2O | 147.02 | 2 | 0.294 グラム |
| MgSO4 x 7です。 H2O | 246.48 | 1 | 0.247グラム |
| ヘープス | 238.3 | 20 | 4.766 グラム |
| グルコース | 180.2 | 5 | 0.901グラム |
| 乳酸ナトリウム(60%w / w) | 112.06 | 10 | 1.5ミリリットル |
| ピルビン酸ナトリウム | 110 | 1 | 0.110グラム |
表2: 高生理食塩水(HS)溶液
| 化学薬品 | モル重量(g / mol) | ミリメートル | g(500ml用) |
| CsMeSO3 | 228.0 | 140 | 15.960 グラム |
| ヘープス | 238.3 | 40 | 4.766 グラム |
| EDTAの | 292.24 | 1 | 0.146グラム |
表3: CsMeSO3 浴液(Divalent Free bath solution:DVF)
| 化学薬品 | モル重量(g / mol) | ミリメートル | mg (25 ml用) |
| CsMeSO3 | 228.0 | 130 | 741ミリグラム |
| ヘープス | 238.3 | 70 | 417ミリグラム |
| EDTAの | 292.24 | 2 | 14.6ミリグラム |
| エグタ | 380.35 | 3 | 28.5ミリグラム |
| セシCl | 1 Mソリューション | 1 | 25 μl |
表4: CsMeSO3 ピペット溶液
ディスカッション
我々は、様々な種の精子細胞から電気生理学的記録を行うための詳細なプロトコルについて述べる。精子のイオンチャネルと電気起源トランスポーターの生理学的重要性を考えると、この技術は精子細胞の生理学だけでなく、男性の不妊につながる欠陥を研究するための強力なツールでもあります。実験者は、この手法の実行に最初は難しいと感じるかもしれませんが、忍耐力と忍耐力があれば、成功が続きます。
哺乳類の精子は長く(通常は>50μm)、狭く、運動性が高いです。哺乳類の精子の基礎拍動周波数(BF)は、4 Hz(マウス69)、7-15 Hz(イノシシ70,71)、11 Hz(ラット72)、11-20 Hz(雄18)、24 Hz(アカゲザル23)、および最大25 Hz(ヒト3)の平均値で大きく異なります。細胞質液滴(CD)は、精子細胞からの記録の入り口です。げっ歯類の精子では、CDはしばしば遠位にありますが、鞭毛に沿って移動するため(図10)、録音にさらなる障害が生じます。しかし、ヒトの精子細胞では、CDは頭部の近くに位置しているのが一般的です。したがって、精子パッチクランプを成功させるための主要なコンポーネントは、CDの鮮明でシャープなビューを可能にする優れた光学系と、ドリフトや振動のない高精度のマイクロマニピュレーターシステムです。最初は高い失敗率が予想され、精子パッチクランプの最初の数日以内に正常です。週に何度も試みる日常的な練習をお勧めします。週に1日数回の録音を達成することで、ルーチンが確立され、運動能力が向上します。
最近まで、精子イオンチャネルの同定と薬理学的特性評価は、精子イオンチャネルを直接研究できないことによって妨げられていました。この分野は主に免疫細胞化学研究に依存しており、抗体の非特異性や対応する遺伝子モデルの欠如に悩まされることがよくあります。カルシウムチャネルを研究するために、古典的なカルシウムイメージング法が広く使用されており、これには独自の利点と制限があります73,74,75,76,77。カルシウムイメージングは、中程度から高スループットの研究78、79、80、81に適用でき、侵襲性が低い比較的簡単な方法ですが、比較的無傷の細胞を必要とするため、細胞内シグナル伝達カスケードから分離されたイオンチャネルの機能を解剖したり、カルシウムイオン交換体と区別したりするのにハードルが高くなります。さらに、膜電位を制御することは困難であり、したがって、電位依存性カルシウムチャネルの寄与を排除することは困難です。カルシウム蛍光測定法のいくつかの利点の中には、カルシウムイオン濃度の変化を正確に測定できるカルシウムレシオメトリック色素の使用があります。同時に、これらの色素の感度は細胞内pHの変化に基づいて変化する可能性があることに注意する必要があります。
以下では、このメソッドのトラブルシューティング手順を含む、プロトコル内の重要な手順について説明します。望ましくないイオン(マグネシウムや重金属など)によるわずかな汚染でも一価電流の検出が損なわれる可能性があるため、実験溶液の調製には純粋な試薬のみを使用することが不可欠です。精子細胞のサイズが小さいため、細胞あたりのイオンチャネルの数は比較的少ないと予想できます。したがって、正味電流は数pAから数百pAの範囲です。したがって、小さな電流を確実に検出するために、リグの内部電気ノイズを最小限に抑える必要があり、ドリフトのない機器の使用を強くお勧めします。特定のコンダクタンスを電気ノイズやバックグラウンドリークと区別するためには、記録装置と接地システムを最大限に活用する必要があります。これは、電気的干渉82を避けるためにリグを適切に接地することによって達成されます。ファラデーケージの使用は、建物の照明や壁内電気配線など、さまざまな電気機器によって生じる電気的干渉から保護するために強く推奨されます。コンピュータのキーボードやマウスなど、リグのすべての電動コンポーネントが電気的ノイズ(50 Hzまたは60 Hz)をほとんどまたはまったく放射せず、リグのすべてのコンポーネントが適切に接地されていることが不可欠です。すべてのイオンチャネルが閉じているときの全細胞構成での電気ノイズは、0.5〜1 pA<である必要があります。
もう1つの重要な点は、作業溶液の正しい浸透圧を監視することです。細胞内および細胞外溶液の組成を正確に測定し、それらの浸透圧を正しく測定する必要があります。細胞外溶液は、細胞の微細な腫脹を引き起こし、ピペットが精子膜によって詰まるのを防ぐため、ピペット溶液と比較してわずかに低張性でなければなりません。注:ピペット溶液が高張で、入浴液と10mOsm以上異なる場合、細胞が過度に腫れ、シールが破裂します。その結果、セルは壊れやすくなり、侵入後数秒でギガシールが失われます。私たちの経験では、不正確な溶液調製は、パッチクランプの成功を妨げる最も一般的な間違いの1つです。
避けるべきもう一つの潜在的な障害は、可塑剤/フタル酸エステル含有プラスチック、および鉱物油潤滑シリンジです。溶液、したがって精子細胞に遭遇するチューブ、シリンジ、およびすべてのプラスチック機器は、可塑剤やその他の環境毒素や油を浸出させるべきではありません。小径のテフロンチューブを主な灌流ラインとして使用しています。テフロン(PTFE)は浸出性化合物が少ないですが、かなり硬いです。フレキシブル接続は、テフロンチューブにフィットする高純度シリコンチューブで作られています。灌流システムに使用されるすべてのシリンジは、鉱物油やその他の潤滑添加剤がイオンチャネルの記録を妨げる可能性があるため、潤滑剤が不足しています。
適切なガラスを使用し、正しい形状のマイクロピペットを引くことの重要性は、いくら強調してもし過ぎることはありません。したがって、ガラス製マイクロピペットの最適な製造は、パッチングを成功させるための前提条件です。ホウケイ酸ガラスのみで作られたガラス製マイクロピペットを使用しており、溶液の充填性を高めています。ピペットの先端は、理想的な密閉性を実現するためにファイヤーポリッシュする必要があります。直径が2μmを超える(したがって抵抗が10MΩ以下の)ピペットチップは、一般的に精子細胞のパッチクランプには適していません。
もう1つの重要なステップは、シールを形成する前に、マイクロピペットの先端に破片や気泡がないようにすることです。これは、マイクロピペットが運動性細胞で満たされた溶液にロードされることを考えると、難しい作業です。ピペットが自由遊泳の精子細胞に誤って「ぶつかる」のを防ぐのに役立つ1つの要因は、すべての非接着細胞を洗い流すために一定の灌流を使用することです。もう1つのツールは、正圧モードと負圧モードを切り替えて先端を清潔に保つことができる自家製の「Uチューブ」です(図11 および 図12)。
精子細胞は細胞質の液滴(CD)の形状や大きさが大きく異なるため、適切な形態の液滴を選ぶことが重要です。 図2に示すように、パッチクランプに適したのは、小さく(1〜3μm)、滑らかで均一で、過度に膨らんでいないCDのみです。小さく、一方的。「肥大化」した完全に透明なCDは、シールが弱いか、まったくシールされません。内部に大きな可溶性粒子が含まれているCDは、録音ピペットを詰まらせる可能性があります。精巣マウスの精子が精巣上体に入ると、それらのCDは頭の近くの首の領域にあります。精巣上体を通過すると、CDは中盤に沿って移動し、精子が尾状精巣上体に到達すると、最終的に中盤と主片(輪)の間の接続に到達します。したがって、上述したように、精巣上体から単離された精子細胞では、CDは通常、ミッドピースの中心近くに位置しています。尾側細胞では、CDは通常、輪の近くに見つけることができます(図2C)。ヒトの精子の場合、CDは首の領域にあります(図2A、B)。
これは実験動物から分離された精子では問題ではありませんが、ヒトのドナー間には大きなばらつきがあります。同じドナー内の精子の質の変動は、主に精子原形質膜の質に影響を与え、シール形成を比較的困難にすることもあります。イオンチャネルの挙動や薬理学にはばらつきが少なく、個々の遺伝学や生理学と相関する要因と考えられます。粘り強く、さまざまな寄付からのサンプルを数日間にわたって評価し、複数の人間のドナー参加者に頼る必要があります。提供された精子は、さまざまな環境要因に応じて、同じドナー内で精子の質が大きく異なるため、人間の材料を扱うには特別な忍耐が必要です。さまざまな寄付日のサンプルを評価して、寄付者のステータスについて最終決定を下すことをお勧めします。射精した精製精子は一般に数時間以内(ヒト精子の単離後最大12時間)の電気生理学に適していますが、精巣上体のマウス精子細胞は単離後2時間以内のパッチングにのみ適しています。
そして最後に、ギガシールの形成は精子細胞によって異なります。マウス/げっ歯類の精子細胞の場合、ギガシールの形成はほぼ瞬時に起こりますが、ヒトの精子とギガシールを形成するには数秒(場合によっては最大1分)かかります。多くの場合、最初の吸引では、200MΩから800MΩの範囲の入力抵抗が発生します。保持電位を-60mVに切り替え、最大10mVの「メンブレンテスト」短パルスを提供することは、多くの場合、ギガシールの形成を救うのに役立ちます(ピペット内のメンブレンの電圧フィールドによる動きを通じて)。
精子細胞パッチクランプ法は、精子細胞の自然発現系における特定のイオンチャネルの詳細な研究を可能にします。この技術の成功は、適切な機器、高品質の生存精子細胞、純粋な試薬、基本的な電気生理学のスキル、忍耐力、および粘り強さにかかっています。この方法は、イオンチャネルの進化的多様性、その調節のメカニズム、およびイオンチャネルが男性から女性の生殖管に移動し、pHやリガンドなどの外因性条件によって変化する際の機能の変化を研究することにより、精子生理学の新たなフロンティアを開きます。
開示事項
著者は何も開示していません。
謝辞
この研究は、NIH Grant R01GM111802、Pew Biomedical Scholars Award 00028642、Alfred P. Sloan Award FR-2015-65398、および Packer Wentz Endowment Will (P.V.L. に贈られる) の支援を受けました。この研究は、Deutsche Forschungsgemeinschaft(ドイツ研究財団)の368482240/GRK2416(ニューメキシコ州)および中国奨学金評議会フェローシップ(B.L.)の支援も受けました。ラット組織を共有してくださったDan Feldman博士、霊長類の精子細胞取得に協力してくださったUCデービス校のKatie Klooster氏とStuart Meyers氏、イノシシと雄牛の精子細胞からデータ取得解析に協力してくださったSteven Mansell氏に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| IX71 with DIC optics | Olympus Inc | IX71 | Nikon TiU microscope can be used as well |
| UplanSApo 60x | Olympus Inc | water immersion objective | |
| Vibration-damping air table | Newport Inc | TMC airtables or similar can be used | |
| Axopatch™ 200B amplifier | Axon™ /Molecular Devices | Sutter IPA®/Double IPA® Integrated patch clamp system is also an excellent amplifier | |
| Axon Digidata analog to digital converter | Axon™ /Molecular Devices | 1440 or 1550 | can be used as well |
| Vapor pressure osmometer | Wescor | model 5600 | |
| MPC 385 micromanipulator | Sutter Instruments, Novato CA | MPC 385 | The Eppendorf micromanipulator TransferMan series can be also used |
| Micropipette puller | Sutter Instruments, Novato CA | P1000 | P97 can be used |
| MicroForge | Narishige | MF-830 | Should be equiped with Nikon MPlan 100/0.80 ELWD 210/0 objective |
| Faraday cage | Homemade | to shield the setup from ambient electrical interference | |
| 5 mm glass Cover Slips | WPI | #502040 | |
| Perfusion chamber | Warner Instruments, Inc | RC-24E | |
| Borosilicate glass capilary | Sutter Instruments, Novato CA | BF 150-85-7.5 | outer diameter 1.5 mm, inner diameter 0.86 mm and an internal filament |
| Teflon manifold MP-8 | Warner Instruments, Inc | 64-0211 | Teflon 8-position perfusion manifold |
| Nunc 4-well plate | Nunc | #179820 | |
| 1 X HTF buffer | EmbryoMax | MR-070-D | capacitation solution |
| SA-Oly/2 stage adapter | Warner Instruments, Inc | for series 20 platforms | only for Olympus microscope |
| Magnetic heated platform | Warner Instruments, Inc | PM-1 or similar series | to hold RC-24E chamber |
| MAG-1 magnetic clamp | Warner Instruments, Inc | #64-0358 | |
| Microelectrode holder with 2mm Ag/AgCl pellet | WPI | MEH3F4515 | |
| Stopcock with Luer connections; 4-way; male lock | Cole-Parmer, Inc | EW-30600–09 | |
| female luer hose barb adapter, 1/16” | Cole-Parmer, Inc | EW-45508–00 | |
| Polytetrafluoroethylene (PTFE) perfusion tubing | Cole-Parmer, Inc | EW-06417–21 | (Microbore PTFE Tubing, 0.022” ID × 0.042” OD) |
| Silicone connector tubing (platinum-cured silicone tubing, 1/32” ID × 3/32” OD) | Cole-Parmer, Inc | EW-95802–01 | |
| Manifold connector tubing (PTFE Tubing, 1/32” ID × 1/16” OD) | Cole-Parmer, Inc | EW-06407–41 | |
| male Luer series barb adapter, 1/16” | Cole-Parmer, Inc | 45518–00 | |
| Male Luer integral lock adapter 1/8” | Cole-Parmer, Inc | 45-503-04 | |
| Silicone connector tubing | Dow Silicone Corporation; MI | #508-008 | |
| Syringes | Fisher Scientific or VWR | Air-Tite, Norm-Ject Luer | 1 mL, 3mL, and 20 mL |
| NaCl | Sigma-Aldrich | S7653 | |
| KH2PO4 | Sigma-Aldrich | 60216 | |
| MgSO4 x 7.H2O | Sigma-Aldrich | 63140 | |
| CaCl2 x 2.H2O | Sigma-Aldrich | 21097 | |
| HEPES | Sigma-Aldrich | H7523-250G | |
| Glucose | Sigma-Aldrich | G8270 | |
| Sodium lactate (60% w/w) | Sigma-Aldrich | L7900 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| EDTA | Sigma-Aldrich | BCBG2421V | |
| CsMeSO3 | Sigma-Aldrich | C1426 | Cesium methanesulfonate |
| KCl | Fisher Scientific | P217 | |
| EGTA | Sigma-Aldrich | BCBF5871V | |
| Tris-HCl | Quality Biological | 315-006-721 | 1 M solution of similar |
| NaOH | Sigma-Aldrich | 221465 | |
| CsOH | Sigma-Aldrich | 232041 | |
| Embryomax Human Tubal Fluid medium: | Millipore | MR-070-D | capacitation medium for murine sperm cells |
| (Embryomax-HTF) | |||
| Animals | |||
| Male Wistar rats | Wistar | Harlan Laboratories (Livermore, CA) | adult rats |
| Male C57BL/6 mice | C57BL/6 mice | Harlan Laboratories (Livermore, CA) | 3-6 month old |
参考文献
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual Review Physiology. 46, 455-472 (1984).
- Kirichok, Y., Navarro, B., Clapham, D. E. Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+ channel. Nature. 439, 737-740 (2006).
- Smith, J. F., et al. Disruption of the principal, progesterone-activated sperm Ca2+ channel in a CatSper2-deficient infertile patient. Proceedings of the National Academy of Science U. S. A. 110, 6823-6828 (2013).
- Hille, B. . Ion Channels of Excitable Membranes 3rd Edition. , (2001).
- Molleman, A. . An Introductory Guide to Patch Clamp Electrophysiology. , (2003).
- Darszon, A., et al. Measuring ion fluxes in sperm. Methods Cell Biology. 74, 545-576 (2004).
- Lishko, P. V., et al. The control of male fertility by spermatozoan ion channels. Annual Review Physiology. 74, 453-475 (2012).
- Lishko, P., Clapham, D. E., Navarro, B., Kirichok, Y. Sperm patch-clamp. Methods in Enzymology. 525, 59-83 (2013).
- Ren, D., Xia, J. Calcium signaling through CatSper channels in mammalian fertilization. Physiology (Bethesda). 25, 165-175 (2010).
- Darszon, A., Labarca, P., Nishigaki, T., Espinosa, F. Ion channels in sperm physiology. Physiological Reviews. 79, 481-510 (1999).
- Cook, S. P., Brokaw, C. J., Muller, C. H., Babcock, D. F. Sperm chemotaxis: egg peptides control cytosolic calcium to regulate flagellar responses. Developmental Biology. 165, 10-19 (1994).
- Miller, R. L. Chemotaxis of the spermatozoa of Ciona intestinalis. Nature. 254, 244-245 (1975).
- Goltz, J. S., Gardner, T. K., Kanous, K. S., Lindemann, C. B. The interaction of pH and cyclic adenosine 3',5'-monophosphate on activation of motility in Triton X-100 extracted bull sperm. Biology of Reproduction. 39, 1129-1136 (1988).
- Gibbons, B. H., Gibbons, I. R. Flagellar movement and adenosine triphosphatase activity in sea urchin sperm extracted with triton X-100. Journal of Cell Biology. 54, 75-97 (1972).
- Carr, D. W., Acott, T. S. Intracellular pH regulates bovine sperm motility and protein phosphorylation. Biology of Reproduction. 41, 907-920 (1989).
- Babcock, D. F., Rufo, G. A., Lardy, H. A. Potassium-dependent increases in cytosolic pH stimulate metabolism and motility of mammalian sperm. Proceedings of the National Academy of Science U. S. A. 80, 1327-1331 (1983).
- Zeng, Y., Oberdorf, J. A., Florman, H. M. pH regulation in mouse sperm: identification of Na(+)-, Cl(-)-, and HCO3(-)-dependent and arylaminobenzoate-dependent regulatory mechanisms and characterization of their roles in sperm capacitation. Developmental Biolgy. 173, 510-520 (1996).
- Lindemann, C. B., Gibbons, I. R. Adenosine triphosphate-induced motility and sliding of filaments in mammalian sperm extracted with Triton X-100. Journal of Cell Biology. 65, 147-162 (1975).
- Lindemann, C. B., Goltz, J. S., Kanous, K. S. Regulation of activation state and flagellar wave form in epididymal rat sperm: evidence for the involvement of both Ca2+ and cAMP. Cell Motility and Cytoskeleton. 8, 324-332 (1987).
- Brokaw, C. J. Calcium-induced asymmetrical beating of triton-demembranated sea urchin sperm flagella. Journal of Cell Biology. 82, 401-411 (1979).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14, 647-657 (2008).
- Suarez, S. S., Varosi, S. M., Dai, X. Intracellular calcium increases with hyperactivation in intact, moving hamster sperm and oscillates with the flagellar beat cycle. Proceedings of the National Academy of Science U. S. A. 90, 4660-4664 (1993).
- Ishijima, S., Mohri, H., Overstreet, J. W., Yudin, A. I. Hyperactivation of monkey spermatozoa is triggered by Ca2+ and completed by cAMP. Molecular Reproduction and Development. 73, 1129-1139 (2006).
- Ho, H. C., Granish, K. A., Suarez, S. S. Hyperactivated motility of bull sperm is triggered at the axoneme by Ca2+ and not cAMP. Developmental Biology. 250, 208-217 (2002).
- Schreiber, M., et al. Slo3, a novel pH-sensitive K+ channel from mammalian spermatocytes. Journal of Biological Chemisty. 273, 3509-3516 (1998).
- Santi, C. M., et al. The SLO3 sperm-specific potassium channel plays a vital role in male fertility. FEBS Letters. 584, 1041-1046 (2010).
- Zeng, X. H., Yang, C., Kim, S. T., Lingle, C. J., Xia, X. M. Deletion of the Slo3 gene abolishes alkalization-activated K+ current in mouse spermatozoa. Proceedings of the National Academy of Science U. S. A. 108, 5879-5884 (2011).
- Navarro, B., Kirichok, Y., Clapham, D. E. KSper, a pH-sensitive K+ current that controls sperm membrane potential. Proceedings of the National Academy of Science U. S. A. 104, 7688-7692 (2007).
- Navarro, B., Kirichok, Y., Chung, J. J., Clapham, D. E. Ion channels that control fertility in mammalian spermatozoa. International Journal of Developmental Biology. 52, 607-613 (2008).
- Quill, T. A., Ren, D., Clapham, D. E., Garbers, D. L. A voltage-gated ion channel expressed specifically in spermatozoa. Proceedings of the National Academy of Science U. S. A. 98, 12527-12531 (2001).
- Ren, D., et al. A sperm ion channel required for sperm motility and male fertility. Nature. 413, 603-609 (2001).
- Carlson, A. E., et al. Identical phenotypes of CatSper1 and CatSper2 null sperm. Journal of Biological Chemistry. 280, 32238-32244 (2005).
- Carlson, A. E., et al. CatSper1 required for evoked Ca2+ entry and control of flagellar function in sperm. Proceedings of the National Academy of Science U. S. A. 100, 14864-14868 (2003).
- Quill, T. A., et al. Hyperactivated sperm motility driven by CatSper2 is required for fertilization. Proceedings of the National Academy of Science U. S. A. 100, 14869-14874 (2003).
- Xia, J., Reigada, D., Mitchell, C. H., Ren, D. CATSPER channel-mediated Ca2+ entry into mouse sperm triggers a tail-to-head propagation. Biology of Reproduction. 77, 551-559 (2007).
- Chung, J. J., et al. Structurally distinct Ca(2+) signaling domains of sperm flagella orchestrate tyrosine phosphorylation and motility. Cell. 157, 808-822 (2014).
- Chung, J. J., et al. CatSperzeta regulates the structural continuity of sperm Ca2+ signaling domains and is required for normal fertility. eLife. 6, 23082 (2017).
- Hwang, J. Y., et al. Dual Sensing of Physiologic pH and Calcium by EFCAB9 Regulates Sperm Motility. Cell. 177, 1480-1494 (2019).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Strünker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Sumigama, S., et al. Progesterone accelerates the completion of sperm capacitation and activates CatSper channel in spermatozoa from the rhesus macaque. Biology of Reproduction. 93, 130 (2015).
- Chung, J. J., Navarro, B., Krapivinsky, G., Krapivinsky, L., Clapham, D. E. A novel gene required for male fertility and functional CATSPER channel formation in spermatozoa. Nature Communication. 2, 153 (2011).
- Wang, H., Liu, J., Cho, K. H., Ren, D. A novel, single, transmembrane protein CATSPERG is associated with CATSPER1 channel protein. Biology of Reproduction. 81, 539-544 (2009).
- Qi, H., et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility. Proceedings of the National Academy of Science U. S. A. 104, 1219-1223 (2007).
- Liu, J., Xia, J., Cho, K. H., Clapham, D. E., Ren, D. CatSperbeta, a novel transmembrane protein in the CatSper channel complex. Journal of Biological Chemistry. 282, 18945-18952 (2007).
- Jin, J., et al. Catsper3 and Catsper4 are essential for sperm hyperactivated motility and male fertility in the mouse. Biology of Reproduction. 77, 37-44 (2007).
- Lobley, A., Pierron, V., Reynolds, L., Allen, L., Michalovich, D. Identification of human and mouse CatSper3 and CatSper4 genes: characterisation of a common interaction domain and evidence for expression in testis. Reproductive Biology and Endocrinology. 1, 53 (2003).
- Mundt, N., Spehr, M., Lishko, P. V. TRPV4 is the temperature-sensitive ion channel of human sperm. eLife. 7, 35853 (2018).
- Zeng, X. H., Yang, C., Xia, X. M., Liu, M., Lingle, C. J. SLO3 auxiliary subunit LRRC52 controls gating of sperm KSPER currents and is critical for normal fertility. Proceedings of the National Academy Science U. S. A. 112, 2599-2604 (2015).
- Mansell, S. A., Publicover, S. J., Barratt, C. L., Wilson, S. M. Patch clamp studies of human sperm under physiological ionic conditions reveal three functionally and pharmacologically distinct cation channels. Molecular Human Reprodroduction. 20, 392-408 (2014).
- Lishko, P. V., Botchkina, I. L., Fedorenko, A., Kirichok, Y. Acid extrusion from human spermatozoa is mediated by flagellar voltage-gated proton channel. Cell. 140, 327-337 (2010).
- Miller, M. R., et al. Unconventional endocannabinoid signaling governs sperm activation via the sex hormone progesterone. Science. 352, 555-559 (2016).
- Brenker, C., et al. The Ca2+-activated K+ current of human sperm is mediated by Slo3. eLife. 3, 01438 (2014).
- Orta, G., et al. Human spermatozoa possess a calcium-dependent chloride channel that may participate in the acrosomal reaction. Journal of Physiology. 590, 2659-2675 (2012).
- Kirichok, Y., Lishko, P. V. Rediscovering sperm ion channels with the patch-clamp technique. Molecular Human Reproduction. 17, 478-499 (2011).
- Miller, M. R., et al. Asymmetrically positioned flagellar control units regulate human sperm rotation. Cell Reports. 24, 2606-2613 (2018).
- Espinosa, F., et al. Mouse sperm patch-clamp recordings reveal single Cl- channels sensitive to niflumic acid, a blocker of the sperm acrosome reaction. FEBS Letters. 426, 47-51 (1998).
- Gu, Y., Kirkman-Brown, J. C., Korchev, Y., Barratt, C. L., Publicover, S. J. Multi-state, 4-aminopyridine-sensitive ion channels in human spermatozoa. Developmental Biology. 274, 308-317 (2004).
- Jimenez-Gonzalez, M. C., Gu, Y., Kirkman-Brown, J., Barratt, C. L., Publicover, S. Patch-clamp 'mapping' of ion channel activity in human sperm reveals regionalisation and co-localisation into mixed clusters. Journal of Cell Physiology. 213, 801-808 (2007).
- Khasin, L. G., et al. The impact of di-2-ethylhexyl phthalate on sperm fertility. Frontiers in Cell and Developmental Biology. 8, 426 (2020).
- Tavares, R. S., et al. p,p'-DDE activates CatSper and compromises human sperm function at environmentally relevant concentrations. Human Reproduction. 28, 3167-3177 (2013).
- Schiffer, C., et al. Direct action of endocrine disrupting chemicals on human sperm. EMBO Reports. 15, 758-765 (2014).
- Skinner, W. M., Mannowetz, N., Lishko, P. V., Roan, N. R. Single-cell motility analysis of tethered human spermatozoa. Bio-Protocols. 9, 5 (2019).
- World Health Organization. . World Health Organization Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. , (2010).
- Mannowetz, N., Naidoo, N. M., Choo, S. A., Smith, J. F., Lishko, P. V. Slo1 is the principal potassium channel of human spermatozoa. eLife. 2, 01009 (2013).
- Miller, M. R., Mansell, S. A., Meyers, S. A., Lishko, P. V. Flagellar ion channels of sperm: similarities and differences between species. Cell Calcium. 58, 105-113 (2015).
- Berger, T. K., et al. Post-translational cleavage of Hv1 in human sperm tunes pH- and voltage-dependent gating. Journal Physiology. 595, 1533-1546 (2017).
- Chavez, J. C., et al. SLO3 K+ channels control calcium entry through CATSPER channels insperm. Journal Biological Chemistry. 289 (46), 32266-32275 (2014).
- Wennemuth, G., Babcock, D. F., Hille, B. Calcium clearance mechanisms of mouse sperm. The Journal of General Physiology. 122, 115-128 (2003).
- de Wagenaar, B., et al. Spermometer: electrical characterization of single boar sperm motility. Fertility and Sterility. , (2016).
- Satake, N., Elliott, R. M., Watson, P. F., Holt, W. V. Sperm selection and competition in pigs may be mediated by the differential motility activation and suppression of sperm subpopulations within the oviduct. The Journal of Experimental Biology. 209, 1560-1572 (2006).
- Dostal, L. A., Faber, C. K., Zandee, J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reproductive Toxicology. 10, 231-235 (1996).
- Umehara, T., et al. The acceleration of reproductive aging in Nrg1(flox/flox); Cyp19-Cre female mice. Aging Cell. 16, 1288-1299 (2017).
- Florman, H. M., Tombes, R. M., First, N. L., Babcock, D. F. An adhesion-associated agonist from the zona pellucida activates G protein-promoted elevations of internal Ca2+ and pH that mediate mammalian sperm acrosomal exocytosis. Developmental Biology. 135, 133-146 (1989).
- Carlson, A. E., Hille, B., Babcock, D. F. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility. Developmental Biology. 312, 183-192 (2007).
- Cook, S. P., Babcock, D. F. Activation of Ca2+ permeability by cAMP is coordinated through the pHi increase induced by speract. Journal of Biological Chemistry. 268, 22408-22413 (1993).
- Babcock, D. F., Pfeiffer, D. R. Independent elevation of cytosolic [Ca2+] and pH of mammalian sperm by voltage-dependent and pH-sensitive mechanisms. Journal of Biological Chemistry. 262, 15041-15047 (1987).
- Rehfeld, A., et al. Medium-throughput screening assays for assessment of effects on Ca2+-signaling and acrosome reaction in human sperm. Journal of Visualized Experiments. (145), e59212 (2019).
- Rehfeld, A., et al. Chemical UV filters can affect human sperm function in a progesterone-like manner. Endocrine Connections. 7 (1), 16-25 (2017).
- Martins da Silva, S. J., et al. Drug discovery for male subfertility using high-throughput screening: a new approach to an unsolved problem. Human Reproduction. 32, 974-984 (2017).
- Alasmari, W., et al. The clinical significance of calcium-signalling pathways mediating human sperm hyperactivation. Human Reproduction. 28, 866-876 (2013).
- Jim Rae, R. L. Optimizing your Axopatch 200B setup for low-noise recording. Axobits. 38, (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved