Method Article
הקמה ויישום של מערכי מיקרו-ectrode סיבי פחמן להקלטות כרוניות וחריפות ב-Vivo
In This Article
Summary
פרוטוקול זה מתאר הליך לבניית מערכי מיקרו-ectrode סיבי פחמן להקלטות אלקטרופיזיולוגיות כרוניות וחריפות ב- vivo בעכבר(שרירים)וחמוס(Mustela putorius furo) מאזורי מוח מרובים. כל שלב, לאחר רכישת סיבי פחמן גולמיים להשתלת מערך microelectrode, מתואר בפירוט, בדגש על בניית מערך microelectrode.
Abstract
מערכי אלקטרודה רב-ערוציים מציעים תובנה על המוח העובד ומשמשים להבהרת תהליכים עצביים ברמות התא והמעגל הבודד. פיתוח כלים אלה חיוני להבנת התנהגויות וקוגניציה מורכבות וקידום יישומים קליניים. עם זאת, זה עדיין אתגר לתעד בצפיפות מאוכלוסיות התאים ביציבות וברצף לאורך תקופות זמן ארוכות. אלקטרודות פופולריות רבות, כגון tetrodes ומערכי סיליקון, כוללות קטרים צולבים גדולים המייצרים נזק עם החדרה ומעוררים תגובות רקמות תגובתיות כרוניות הקשורות למוות עצבי, המעכבות את ההקלטה של פעילות עצבית יציבה ורציפה. בנוסף, רוב חבילות החוטים מציגות מרווח רחב בין הערוצים, המונע הקלטה סימולטני ממספר רב של תאים המקובצים באזור קטן. מערכי המיקרו-ectרודe של סיבי הפחמן המתוארים בפרוטוקול זה מציעים פתרון נגיש לחששות אלה. המחקר מספק שיטה מפורטת לייצור מערכי מיקרו-ectrode סיבי פחמן שניתן להשתמש בהם להקלטות חריפות וכרוניות ב- vivo. המאפיינים הפיזיים של אלקטרודות אלה הופכים אותם לאידיאליים להקלטות יציבות ומתמשכות לטווח ארוך בצפיפות תאים גבוהה, ומאפשרים לחוקר לבצע הקלטות חזקות וחד משמעיות מיחידות בודדות לאורך חודשים.
Introduction
אלקטרודות ומערכי אלקטרודה הם כלים בעלי ערך להבנת האופן שבו המוח מעבד מידע ברמה העצבית. בעוד הקלטות אלקטרופיזיולוגיות היו בר השגה במשך יותר ממאתיים שנה,עדיין לא ניתן למדוד בו זמנית את הפעילות של מעגלים עצביים שלמים ברזולוציה המרחבית והזמן הנדרשת כדי ללכוד את spiking של נוירונים בודדים. למרות שיטות לא פולשניות, כגון אלקטרואנצפלוגרפיה2, טופוגרפיה פליטת פוזיטרונים3, והדמיה תהודה מגנטית תפקודית4 מאפשרים מדידות מוח שלם, הם לא יכולים להשיג את הרזולוציה המרחבית והזמן הדרושה לפתרון הפעילות של מעגלים עצביים2,5. לעומת זאת, שיטות הדמיה כגון הדמיה אופטית באמצעות צבעים רגישים למתח או אינדיקטורים סידן מקודדים גנטית יכול להשיג רזולוציה מרחבית יחידה אחת, אבל הם מציבים בעיות כגון רזולוציה זמנית נמוכה סלקטיביות ירודה3,4,5,6. הקלטות חשמליות הן חלופה רבת עוצמה לשיטות אלה. הקלטה אלקטרודות לספק רזולוציה זמנית שאין דומה לה ולאפשר למשתמש לבצע מדידות עם דיוק ספייק-זמן בכל אזור של המוח7. בנוסף, מערכים רב-אלקטרוניים מושתלים כרונית (MEAs) מאפשרים בקנה מידה גדול(עשרותעד מאות תאים), הקלטות של תאים בודדים בבעלי חיים מתנהגים על פני תקופה של ימים עד חודשים 8,9. עם זאת, בדיקות סיליקון המתעדות בצפיפות גבוהה יותר יש טביעת רגל גדולה והם פולשניים מאוד, מערכים מושתלים כרונית לעתים קרובות ליצור תגובה דלקתית, אנקפסולציה רקמות, ומוות עצבי10,11,12,13.
המגבלות של אלקטרודות קיימות הביאו לחידושים אחרונים המאפשרים הקלטות יציבות, ברזולוציה גבוהה, לטווח ארוך. אלקטרודות טיפוסיות מורכבות ממוליך מתכתי, כגון טונגסטן או פלטינה-אירידיום, או מבוססות סיליקון או פולימר. בעוד מערכי מיקרו-חוט מבוססי מתכת יכולים לשמור על הקלטות ארוכות טווח ויציבות, יש להם טביעת רגל גדולה בהרבה, עם קוטר חוט יחיד הנע בין 10-200 מיקרומטר14. לעומת זאת, מערכי אלקטרודה מבוססי סיליקון מניבים הקלטות ברזולוציה מרחבית גבוהה, אך בשל העיצוב הנוקשה יחסית שלהם, הם בדרך כלל אינם מסוגלים לשמור על האות וההקלטה מאותם נוירונים במשך חודשים רבים15. ההתפתחויות האחרונות במערכים מבוססי סיליקון הביאו אלקטרודות שיכולות לבצע הקלטות כרוניות באופן אמין, אך לא ניתן להשתמש במערכים אלה כדי להקליט מאזורי מוח עמוקים בבעלי חיים גדולים יותר ומיועדים להקלטות ליניאריות9. ההתקדמות במערכי הפולימר הביאה לגמישות מוגברת וליציבות רישום של יחידות בודדות ומציעות פוטנציאל להקלטות בצפיפות גבוהה בעתיד הקרוב, אך עם זמינות מוגבלת כרגע8,16,17. סיבי פחמן מאפשרים הקלטות בצפיפות גבוהה עם חומרים מדף המתוארים כאן.
מיקרואלקטרודים להקלטת סיבי פחמן שימשו במשך עשרות שנים, כאשר האלקטרודות הראשונות של סיבי פחמן המורכבות מסיבי פחמן יחיד מוכנסים למיקרופיט זכוכית. מיקרו-קטרודות אלה שימשו להקלטות חוץ-תאיות ליחידה אחת, ולמרות שיחס האות לרעש היה דומה למיקרו-קטרודות הטונגסטן בזכוכית הטובות ביותר, הן היו מועילות בשל גמישותן, ערכי עבלות נמוכים יותר ופשטות לייצור18,19. המאמצים לפתח מערכי אלקטרודה סיבי פחמן הואצו לאחרונה בשל יכולות biosensing של סיבי פחמן. בנוסף ליכולת הביולוגית המוגברת שלהם ומוליכות חשמלית יוצאת דופן, הם כוללים קבוצה ייחודית של מאפיינים, כולל התנגדות בטמפרטורה גבוהה, צפיפות יחסית נמוכה, חוזק מתיחה גבוה, נוקשות כיפוף נמוכה, רגישות לזיהוי גבוהה, ואזור חתך קטן10,12. כל המאפיינים הללו הניבו את הפיתוח של מערכי מיקרו-ectrode סיבי פחמן (CFEAs) המאפשרים הקלטות כרוניות, יציבות, בעלות תפוקה גבוהה של נוירונים בודדים. כעת ניתן ליצור CFEAs כאלה ביד20,21 ( איור1), מערכי מיקרו-ectrode מניבים שיכולים להכיל נוירונים בודדים במשך חודשים. מתואר כאן תהליך בנייה נגיש עבור CFEAs שהותאם בשתי דרכים להקלטות חריפות וכרוניות של נוירונים בודדים בשני מינים.
Protocol
כל ההליכים הניסיוניים אושרו על ידי אוניברסיטת ברנדייס או אוניברסיטת וושינגטון טיפול בבעלי חיים והוועדה לשימוש. הנתונים המוצגים נאספו מחמוס אחד ונקבה אחת ועכבר זכר אחד.
1. הכנת סיבי פחמן וכלים
- הכנת סיבי פחמן מסחריים
- חותכים רצועות בגודל 8 ס"מ מחבילת הסיבים בגודל אפוקסי. מניחים את הרצועות במקביל כור היתוך ואופים בתנור ב 400 °C (6 שעות) כדי להסיר את האפוקסי מסיבים מסחריים. לאחר מכן, לאחסן את הסיבים האפויים בצלחת פטרי סטנדרטית או צינור חרוטי.
הערה: סיבים בקוטר של 7 מיקרומטר שימשו. קבוצות אחרות השתמשו 4 סיבי מיקרומטר20,21. - הכן קלטות להחזקת סיבים בודדים. השתמשו במדפסת תלת-ממד או בחותך לייזר ליצירת הקלטות ומחזיק הקלטת המשויך (ראו איור 2).
- תעמיסו את הסיבים על הקלטות. התחל על-ידי הנחת פיסת סרט דו-צדדית על שני הצדדים הארוכים של הקלטת, יישור קצה הקלטת עם הקצה הפנימי של הקלטת. מפרידים סיבים בודדים מהחבילה האפויה ומניחים אותם במקביל לצד הקצר של הקלטת, תוך שמירה על 2-3 מ"מ בין סיבים. יש להקפיד על להתאים 20-30 סיבים בכל קלטת. לאטום את הסיבים במקום על ידי הנחת סרט ברור מעל קלטת כפול מקל. הנח את הקלטות המלאות במחזיק הקלטות.
הערה: עבור בונה מנוסה, מילוי קלטת אחת של סיבים ייקח ~ 1 שעה. עבור בונה טירון, תהליך זה צפוי לקחת ~ 1.5-3 שעות. יש עשר קלטות לקופסה, ושני מחזיקי קלטות יכולים להיכנס לתא התצהיר של פארילן. - מצפים את הסיבים הבודדים עם פארילן C באמצעות תא תצהיר ואקום מסחרי. ריצה אחת נדרשת לציפוי. למדוד 2.3 גרם של פארילן עבור כל ריצה. שני מחזיקי קלטות מתאימים לתא בכל פעם. הליך הציפוי לוקח ~ 2 שעות לכל ריצה.
הערה: מדידה של 2.3 גרם של פארילן C מספקת כ 1 מיקרומטר של ציפוי. סיבים מצופים ניתן לאחסן ללא הגבלת זמן.
- חותכים רצועות בגודל 8 ס"מ מחבילת הסיבים בגודל אפוקסי. מניחים את הרצועות במקביל כור היתוך ואופים בתנור ב 400 °C (6 שעות) כדי להסיר את האפוקסי מסיבים מסחריים. לאחר מכן, לאחסן את הסיבים האפויים בצלחת פטרי סטנדרטית או צינור חרוטי.
- הכנת כלי מניפולציה סיבי פחמן
- עטפו חתיכה קטנה של סרט דבק גמיש סביב מחט 30 G, ויוצרים נקודה חדה אך גמישה עם סרט הדבקה.
הערה: עטיפת קצה מחט בפרפילם, ומתיחת parafilm בכך, יוצרת אפקט דבק קל המאפשר למשתמש להרים ולתמרן סיבים בודדים.
- עטפו חתיכה קטנה של סרט דבק גמיש סביב מחט 30 G, ויוצרים נקודה חדה אך גמישה עם סרט הדבקה.
2. עיצוב וימצאה
- בחר את עיצוב הג'יג המתאים הדרוש בהתבסס על המפרט של האלקטרודה שיש לבנות. זה יתבסס על מספר הערוצים הדרושים, יחד עם כל תוספות העיצוב.
הערה: Jig מתייחס לבלוק המודפס בתלת-ממד המספק עוגן לאלקטרודות ולחיבורים חשמליים. - צור או שנה את העיצוב הספציפי של הג'יג באמצעות תוכנת עיצוב (CAD) בעזרת מחשב.
- השתמש בחברת הדפסה תלת-ממדית או במעבדת היצרן המוסדי כדי להדפיס את הג'יגה באמצעות מדפסת תלת-ממד SLA ברזולוציה גבוהה.
3. הרכבת מערך המיקרו-ectרודe של סיבי הפחמן (CFEA)
הערה: שלב זה לוקח ~ 2 שעות עבור בונה מנוסה ~ 6 שעות עבור בונה טירון. בצע את כל שלבי ההרכבה של CFEA ושלבי קשיית הסיבים תחת מיקרוסקופ סטריאו 10x. השלם את הרכבת CFEA בסביבה עם תנועה אווירית מינימלית, שכן הדבר עלול להפריע לתהליך הבנייה.
- בחר את הג'יג המתאים הדרוש לבניית האלקטרודה הרצויה.
- באמצעות חותכי חוט מתכת, לחתוך שתי חתיכות של חוט טונגסטן של קוטר 0.003 ב (76.2 מיקרומטר), על 7 ס"מ אורך.
- הזן כל חוט דרך הערוץ המתאים בקצה המחבר של הג'יג (GND ו- REF). להאכיל מספיק דרך עד שני הקצוות שווים באורך, ולאחר מכן לסובב אותם יחד כדי לאבטח אותם על הג'יג.
הערה: עבור עיצוב אקוטי בן 16 ערוצים, ודא שחוט המתכת מתאים בתוך הרכס ב- jig.- יש למרוח מלט דנטלי שנרפא UV כדי לאבטח את החוט. הקפד לא לקבל שום מלט שיניים בתוך הערוץ הפתוח כי החוט מוזן דרך.
הערה: המשתמש צריך ללבוש הגנת עיניים סינון UV במהלך כל ההליכים הקשורים UV כדי למנוע נזק פוטנציאלי לעיניים. שרבים מטות ריפוי UV יש מסנני צפייה מובנים. - באמצעות שרביט ריפוי UV, לרפא את המלט הדנטלי עבור 20 s.
- אבטחו את הג'יג במקצף התכשיטים באחת מזרועות הג'יג. כוון את הג'יג כך שאחד הפרצופים הצדדיים יהיה מקביל לקרקע.
- כוון את הג'יג ואת האגרטל מתחת למיקרוסקופ כך שקצה המחבר, האגן וקצה המשפך יתגלו. כוון את הג'יג כך שהמשפך יצביע הרחק מהמשתמש וקצה המחבר פונה לכיוון המשתמש.
- אסוף את כלי סיבי הפחמן ומחט חדה של 25 ג'י.
- מניחים קלטת עם סיבים מצופים פרילן-C על גיליון נייר לבן, צד סרט למעלה, כך הסיבים אינם ישירות על הנייר.
- השתמש במחט 25 G כדי לחתוך סיבי פחמן יחיד מתוך הקלטת. לעשות זאת על ידי הזזת קצה המחט נגד הקלטת שבה הסיבים שיש להסיר מגיח.
- אם בונים באמצעות חצי סיבים, לחתוך קצה אחד של הסיב כמתואר לעיל. לכוון את הסיבים כך שהוא ישר, באמצעות המחט, לחתוך את הסיבים לשניים על ידי חיתוך הסיבים נגד הנייר. על מנת לחתוך את החצי השני, אשר עדיין מחובר לקלטת, להחזיק את הקצה החופשי של הסיבים עם כלי סיבי פחמן שנעשה בעבר, ולאחר מכן להשתמש במחט כדי לחתוך את הסיבים עדיין מחוברים לקלטת כמתואר לעיל.
- אם בונים באמצעות סיבים מלאים, לחתוך קצה אחד של הסיב כמתואר לעיל. השתמש בכלי סיבי הפחמן שנעשה בעבר והחזק את הקצה החופשי של הסיבים שנחתכו זה עתה. באמצעות המחט, לחתוך את הקצה השני של הסיבים מן הקלטת.
- הרם את סיבי הפחמן באמצעות כלי סיבי הפחמן שנעשו בעבר. הרם את הסיבים כך קצה אחד יש כ 1 ס"מ של אורך מהכלי.
- השתמש בכלי סיבי הפחמן עם הסיבים המחוברים והזן את הקצה הקצר יותר של הסיבים דרך חתיכת המשפך מהאגן האמצעי של הג'יג. השתמש במיקרוסקופ כדי לדמיין.
- המשיכו להאכיל את הסיבים דרך משפך הג'יג עד שרוב אורך הסיבים יעבור (ראו איור 3A).
- להאכיל את החלק האחורי של הסיב דרך ערוץ זמין באמצעות כלי סיבי פחמן שנעשו בעבר. להאכיל את הסיבים דרך הגב עד כ 5 מ"מ של סיבים בולטים מאחור. גזור לגודל במידת הצורך (ראו איור 3B).
הערה: אין להאכיל סיבים לערוצים המכילים את חוטי המתכת.
- מלא את שאר הערוצים בסיבים בצד אחד של הג'יג, בהתאם להוראות שניתנו לעיל.
הערה: בעת הזנת סיבים לתוך המשפך, להאכיל מחצית הסיבים לתוך כל חלוקה של משפך, עם החצי הימני של הערוצים בחטיבה הימנית ואת החצי השמאלי של הערוצים בחטיבה השמאלית. כאשר הסיבים נמצאים במגע קרוב בתוך המשפך, יש חיכוך שלילי בין סיבים שמוביל סיבים קיימים או משך רופף או שבור תוך הזנת סיבים חדשים לתוך הג'יג. חלוקה זו לארבעה חלקים מספקת הקלה מסוימת, שכן הסיבים נשמרים בחבילות קטנות יותר עד לשלב מאוחר יותר. - השתמש במצית גלגל ניצוץ סטנדרטי והעבר במהירות את הלהבה מעל הסיבים החשופים בקצה המחבר. ודאו שהבידוד של כל הסיבים יוסר בקצוות (ראו איור 3C).
הערה: החלק של הסיבים שנחשפו ללהבה צריך להיראות מעט דק יותר משאר הסיבים. - להאכיל את הסיבים הלהבה דרך הג'יג, כך החלק של הסיבים החשופים ללהבה הוא עכשיו בתוך הערוץ. ודאו שאין סיבים שבולטים בחלק האחורי של הג'יג (ראו איור 3D).
הערה: השתמש בכלי סיבי הפחמן כדי לתפוס את הסיבים מתוך האגן ולהאכיל את הסיבים הלהבים דרך הג'יג. אין לגעת בחלק הסיבים החשופים ללהבה, שכן חלק זה שברירי יותר. - החל מלט דנטלי UV נרפא על הסיבים באגן של ג'יג. מלאו את כל האגן כדי לכסות את פתחי הערוצים ואת פתיחת המשפך (ראו איור 3E).
- השתמש באור UV ולרפא את המלט הדנטלי במשך 20s. תרופה עבור 20 s נוספים אם מלט שיניים לא נרפא לחלוטין.
הערה: ודא כי מלט השיניים לא לנסוע בתוך הערוצים.
- השתמש באור UV ולרפא את המלט הדנטלי במשך 20s. תרופה עבור 20 s נוספים אם מלט שיניים לא נרפא לחלוטין.
- הסר את הג'יג מהמגפיים, הפוך אותו, ואבטח את הג'יג במתגפיים כפי שהובטח בעבר. ודא כי הצד המכיל את הסיבים הוא עכשיו עם הפנים כלפי מטה.
- מלאו את הצד הריק של הג'יג בסיבי פחמן בדיוק כמתואר לעיל.
- ברגע שלכל הערוצים יש סיבים, והסיבים מאובטחים עם מלט דנטלי, להסיר את הג'יג מן המצחס ולכוון את הג'יג, כך המשפך מצביע למטה. אבטח את הג'יג במקצה, כך שקצה המחבר יצביע למעלה.
- אסוף מחט חדת קצה של 25 G, מזרק 1 מ"ל, צבע מוליך כסוף, אפליקטורים עם קצה כותנה, מדלל צבע, מגבוני רקמות ומחבר הבמה המתאים.
הערה: ודאו שהצבע המוליך הכסוף מעורבב היטב ומהווה פתרון הומוגני. אל תתנו לצבע להתייבש. - ציירו 0.3 מ"ל של צבע כסף למזרק 1 מ"ל, ולאחר מכן חברו את מחט 25 G בעלת קצה חד.
- בזהירות להכניס את המחט לתוך ערוץ אחד עד נעצר על ידי מלט השיניים. דיכאו לאט את המזרק תוך כדי הסרת המחט מהערוץ כדי למלא את הערוץ בצבע (ראו איור 3E).
- נגב כל צבע מהמחט, ולאחר מכן להמשיך לערוץ הבא.
- מלא את כל הערוצים בצבע.
הערה: ייתכן שיהיה צורך במעברים נוספים לערוצים מכיוון שהצבע קובע בערוצים במשך הדקות הראשונות.
- מלא את כל הערוצים בצבע.
- טובלים אפליקטור עם קצה כותנה בדלל הצבע, ואז מנקים את בסיס הג'יג של כל צבע על פני השטח. כמה אפליקטורים עם קצה כותנה עשויים להיות נחוצים לכך.
הערה: אפליקטורים עם קצה כותנה שאינם טבולים בדלל צבע עשויים להיות שימושיים גם לניקוי הג'יג. - הכנס את מחברstage הראש בכיוון הנכון על-ידי יישור הפינים לערוצים. ודאו שמחבר הבמה יושב זקוף ושויק לתג ככל האפשר (ראו איור 3F).
- אפשר לג'יג לרפא 24 שעות.
- אבטחו את מחבר הבמה לג'יג באמצעות מלט דנטלי שנרפא UV על ידי החלת מלט דנטלי לאורך הקצה שבו מחבר headstage פוגש את הג'יג. תרופת UV באמצעות אור UV עבור 20 s.
- יש למרוח מלט דנטלי שנרפא UV כדי לאבטח את החוט. הקפד לא לקבל שום מלט שיניים בתוך הערוץ הפתוח כי החוט מוזן דרך.
4. אריזת חבילת סיבים
הערה: זה לוקח בערך 30 דקות כדי לבצע שלב זה. השלם שלב זה עבור האלקטרודות המשמשות בדגמים של בעלי חיים עם שכבה עבה של פיא מאטר. לחזק את חבילת הסיבים כדי למזער כיפוף. בהליכי עכבר, ייתכן שצעד זה לא יהיה נחוץ.
- להביא את החבילה של סיבים יחד בפיר אחד באמצעות מתח מים. השתמש pipette העברה כדי להפעיל טיפת מים מקצה המשפך לקצה החבילה בעוד האלקטרודה מאובטחת זקופה במזרווה.
- התחל עם החלת שכבה של מלט שיניים על 1.5 מ"מ עובי סביב החבילה בקצה משפך. לרפא את המלט הדנטלי עם 20 s של אור UV.
הערה: להקלטות קליפת המוח, אין צורך באריזה נוספת. עבור אזורי מוח עמוקים יותר, אבטחו צינור מדריך סביב החבילה. - בניית צינור מדריך והכנסת החבילה לתוך צינור המדריך
- למדוד ולחתוך את האורך הרצוי של צינורות פולימיד. ודא כי אורך צינורות פולימיד משאיר 2 מ"מ של סיבי פחמן טיפים חינם. למדוד ולחתוך חתיכה של צינורות מתכת 30 G 2 מ"מ קצר יותר צינורות פולימיד. השתמש בכלי סיבובי כדי להסיר קצוות חדים על צינורות המתכת. הכנס את צינורות פולימיד בתוך צינורות המתכת.
- מקם את האלקטרודה במאזף עם חבילת סיבי הפחמן מצביעה למעלה. אבטחו את הצינורות המורכבים למיקרו-מניפולטור, ובאמצעות מיקרוסקופ, הורידו אותו בזהירות מעל חבילת הסיבים. אבטחו את הצינורות לבסיס המלט הדנטלי הקיים באמצעות שכבה נוספת של מלט דנטלי. לרפא את המלט הדנטלי עם 20 s של אור UV.
הערה: ניתן להשהות את תהליך הבנייה כאן.
5. הכנת קצה אלקטרודה
הערה: זה לוקח בערך 30 דקות לכל מערך כדי לבצע שלב זה.
- חותכים אלקטרודות לאורך הרצוי.
- כהכנה לחיתוך קצה האלקטרודה, מחסנית תווים דביקים לבניית פלטפורמה בגובה של כ-1.5 מ"מ. למדוד, מקצה הפלטפורמה, את אורך האלקטרודה הרצוי ולסמן מרחק זה. הפלטפורמה תפעל כמדריך לחיתוך.
- מנמיכים את האלקטרודה לתוך של מים מתוכלים או מזוקקים עד שקצה המשפך שקוע לחלוטין, טיפ ראשון, ומחזיק נורמלי על פני השטח. להביא את סיבי הפחמן בודדים יחד על ידי הסרת האלקטרודה מהמים. מתח פני השטח יאחד את החבילה. אפשר לאלקטרודה להתייבש באוויר במשך 30 דקות.
- חבר את להב האזמל מספר 10 לידית. להקפיא את האזמל ואת האלקטרודה על ידי הצבתם במקפיא -18 °C לפחות 5 דקות.
- הנח את האלקטרודה כך שהסיבים ישכבו על פני המדריך (מוכן בשלב 5.1.1). חותכים את הסיבים לאורך הרצוי עם האזמל, באמצעות תנועה מתגלגלת. השלם שלב זה במהירות כדי להבטיח שהאלקטרודה והאזמל עדיין קפואים (ראו איור 3G).
- הזרק זרם חיובי כדי להפחית את העכבה של טיפים אלקטרודה.
- חבר את האלקטרודה לבוחן עכום multielectrode באמצעות המתאם המתאים (ראה טבלת חומרים). קצה אלקטרודה נמוך ~ 2 מ"מ לתוך צינור microcentrifuge של 0.1 M תמיסת מלח חוצצת פוספט (PBS). הכנס חוט הארקת לתוך צינור microcentrifuge.
- הזרק זרם עם המשרעת ומשך הנבחרים.
הערה: שלב זה נועד להפחית את ערכי העכבה בקצה CFEA. במחקר זה, הפרמטרים הבאים הוזנו לתוך ממשק המשתמש הגרפי של תוכנת electroplating: זרם: 0.100 μA; משך: 10 שניות; הפסקה: 1 s. ניתן לחזור על תהליך זה לפי הצורך, לפי ערוץ, עד שעישולים אלקטרודה יעמדו בערכים הרצויים (ראו איור 4C). - לאחר ערכי העכבה הם לפי הרצון, לשטוף את הסיבים במים deionized או מזוקק לנקות.
- אלקטרופלסטיקט בתמיסת ציפוי הזהב.
הערה: שלב זה צריך להיעשות זמן קצר לפני ההשתלה (באותו יום).
זהירות: חלק מהכימיקלים המשמשים להכנת טיפים CFEA הם מאכלים, כולל פתרון ציפוי זהב. יש להיוועץ ב-SDS לפני השימוש ולקבוע את אמצעי הזהירות המתאימים שיש לנקוט על מנת לטפל בפתרון בבטחה.
הערה: כדי לספק נוקשות לחבילת הסיבים, המשתמש עשוי ליצור פתרון ציפוי זהב על ידי תחילה solubilizing PEG8000 במים deionized או מזוקק ב 1 מ"ג / מ"ל. לאחר מכן, לשלב 625 μL solubilized PEG8000 ו 375 μL פתרון ציפוי זהב ופתרון מערבולת עבור 10 s לערבב. PEG8000 יתמוסס לאחר החדרת סיבים במוח.- מנמיכים את קצה צרור האלקטרודה ~ 2 מ"מ לתוך צינור microcentrifuge של תערובת ה ציפוי. הכנס את חוט ההארקה לתוך צינור microcentrifuge.
- הגדר פרמטרים מתאימים עבור electroplating. במחקר זה, הפרמטרים הבאים הוזנו לתוך ממשק המשתמש הגרפי של תוכנת electroplating: זרם: -0.05 μA; משך: 30 שניות; הפסקה: 5 שניות.
- יש לשטוף את הסיבים ביסודיות במים מסולסלים או מזוקקים. בשלב זה, למדוד את ערכי העכבה שוב אם תרצה.
6. החדרה למוח: ניתוח הישרדות, עכבר (שרירים)וניתוחים שאינם הישרדות, חמוס(מוסטילה פוטוריוס furo)
הערה: הליכים כירורגיים צריכים לפעול לפי הפרוטוקול הסטנדרטי בהתאם ל- IACUC. למידע מפורט ראו Ma et al.22 לפרוטוקול ניתוח הישרדות ופופוביץ' ואח'23 לפרוטוקול ניתוח שאינו הישרדות. בצע את ההליכים הכירורגיים aseptic לפי הנחיות ASC לניתוח הישרדות במינים מכרסמים. אלה כוללים autoclaving כל הכלים והחומרים כירורגיים ב 135 °C (5 °F) במשך 15 דקות וטיפול במנגנון סטריאוטקסי ואזור כירורגי עם 70% אתנול. יש להשתמש בכפפות כירורגיות סטריליות, שמלה חד פעמית ומסכת פנים במהלך ההליך.
- ניתוח הישרדות, עכבר (שרירים).
- מרדים את העכברים עם 2.5% איזופלוראן בתיבת אינדוקציה במשך ~ 1 דקות, עד קצב הנשימה מגיע 55-65 נשימות / דקה. לאחר מכן, לנהל 2.0% איזופלורן דרך חרוט האף כדי לשמור על הרדמה. יש למרוח משחת וטרינר על שתי העיניים כדי למנוע נזק לקרנית. בצע צביטת בוהן כדי לאמת את מידת ההרדמה הנכונה.
- לאחר האימות, בצע את ניתוח ההישרדות המפורטים מא ואח'22. לעקוב אחר קצב הנשימה ולשמור אותו ב 60 נשימות / דקה. שמור על טמפרטורת הגוף ב 37 °C (50 °F) באמצעות כרית חימום מבוקר תרמוסטטית. ראה שלבים 6.3-6.5 (מפורט להלן) לקבלת הוראות להכנת הגולגולת עבור גולגולת, durotomy, השתלת אלקטרודה.
- לאחר הניתוח, להחזיר את העכברים לכלוב התאוששות, מצויד כרית חימום 37 °C,000,000 מבודד מבעלי חיים אחרים.
- לכסות את הפצעים הכירורגיים במשחה האנטיביוטית. לעקוב אחר בעלי החיים עד שהם חוזרים להכרה מספקת כדי לשמור על recumbency החזה ולאפשר להם להתאושש לתקופה של 2-5 ימים. לשכן אותם בנפרד ולנטר ברציפות סימנים של זיהום או אי נוחות. תן לבעלי החיים מנה אחת של buprenorphine 72 h שחרור מתמשך (0.5-1.0 מ"ג/ק"ג) ביום הניתוח כמשעך כפיים.
- ניתוח ללא הישרדות, חמוס(מסטלה פוטוריוס furo)
- למרדים את החמוס בתחילה עם קטמין (20 מ"ג/ק"ג, i.m.), ולאחר מכן לאוורר עם 1.0%-2.0% איזופלוראן בתערובת 2:1 של תחמוצת חנקן וחמצן באמצעות מסכה. בצע צביטת בוהן כדי לאמת את מידת ההרדמה הנכונה.
- לאחר האימות, בצע הליכי ניתוח שאינם הישרדות המפורטים בפופוביץ 'ואח'23. בצע קנה נשימה ולאוורר את בעלי החיים עם 1.0%-2.0% של איזופלוראן בתערובת 2:1 של תחמוצת חנקן וחמצן. יש למרוח משחה וטרינרית על שתי העיניים כדי למנוע נזק לקרנית.
- שמור על טמפרטורת הגוף ב 37 °C (50 °F) באמצעות כרית חימום מבוקר תרמוסטטית. ניטור קצב הלב, רמות CO2 של גאות ושפל וקצב נשימה. שמור על שיעור הנשימה בטווח הפיזיולוגי המתאים (3.5%-4.0%). ראה שלבים 6.3-6.5 (מפורט להלן) לקבלת הוראות להכנת הגולגולת עבור גולגולת, durotomy, השתלת אלקטרודה.
- לעקוב באופן רציף אחר האק"ג של החיה כדי להבטיח הרדמה נאותה ולהגדיל את אחוז האיזופלוראן אם האק"ג מצביע על מצוקה כלשהי.
- בסיום הניסוי, לנהל 1 מ"ל של פתרון נתרן פנטוברביטל ו פניטואין נתרן חמוס ולפקח עד קצב הלב וסוף הגאות והשפל CO2 מודד 0.
- הכנת הגולגולת
- באמצעות מקדחה בקוחן 0.8 מ"מ, יש לקדוח גולגולת אחת של 4 מ"מ x 4 מ"מ במיקום הרצוי להשתלה. לעכבר, לקדוח חור בר נוסף באתר contralateral עבור החדרת בורג הקרקע נירוסטה.
הערה: אין לבצע durotomy עד האלקטרודה מוכנה להשתלות. - להקים קרקע / התייחסות. בניסויים חריפים בחמוס, השתמש במחט 18 גרם כדי לחדור דרך העור ואת שכבת השריר המקיף את הגולגולת בצד הראש של החיה מול הגולגולת. הכנס את קצה החוט של אלקטרודה ייחוס Ag / Cl לתוך קצה המחט, ולאחר מכן לסגת את המחט מן השריר / העור, כך הכדור יושב כעת בבטחה בין השריר לגולגולת. בעכבר, לעטוף את חוט הקרקע הכסף סביב בורג הארקת נירוסטה. מאובטח עם מלט שיניים נרפא UV.
- חבר את האלקטרודה למחזיק האלקטרודה באמצעות רצועה דקה של סרט תיוג ואבטח את מחזיק האלקטרודה לתוך המיקרו-מניפולטור. חבר את חוט הקרקע למקור הארקת באמצעות קליפ תנין. חבר את חוט הייחוס לאלקטרודה הייחוס המוטמעת בשריר החיה.
- באמצעות מקדחה בקוחן 0.8 מ"מ, יש לקדוח גולגולת אחת של 4 מ"מ x 4 מ"מ במיקום הרצוי להשתלה. לעכבר, לקדוח חור בר נוסף באתר contralateral עבור החדרת בורג הקרקע נירוסטה.
- חדירת דורוטומיה ופיא
- הסר את הדורה מן הגולגולת באמצעות דורה לבחור.
- צור חור קטן בפיא. כדי לעשות זאת, להכניס ולמשוך microelectrode מתכת (מומלץ בחמוס). לחלופין, להוריד את האורתוגונל CFEA אל פני השטח של המוח כדי למנוע כל כלי כלי. ברגע שמיקום זה נקבע, הרימו את האלקטרודה וחתכו בעדינות את פני השטח של המוח במיקום זה עם איסוף דורה, מושכים כלפי מעלה עם הבחירה (מומלץ בעכבר).
- השתלת אלקטרודה
- הורידו את קצה האלקטרודה לאותו מיקום, ובמצב עדין, מתחילים להניע את האלקטרודה למוח בקצב של ~ 2 מיקרומטר / s. השתמש במיקרוסקופ כדי להבטיח שהאלקטרודה נכנסת בצורה חלקה ולא מתכופפת.
הערה: אם האלקטרודה אינה נכנסת בצורה חלקה, הרימו אותה מהמוח והתיישרו מחדש את הזווית. אם הוא ממשיך להתכופף מבלי להיכנס בצורה חלקה, התאם את המיקום וחזר על תהליך חתך פני השטח של המוח למיקום הכניסה החדש. - בצע את ההשתלה הכרונית והחריפה באמצעות השלבים הבאים.
- להשתלות כרונית: מלט את האלקטרודה במקום באמצעות מלט דנטלי נרפא UV.
- סגור את החתך באמצעות תפרים כירורגיים 5-0 ולבנות את כיסוי הראש.
- כדי לבנות כיסוי ראש להוסיף מלט דנטלי נוסף סביב אתר השתל. ודא לכסות את האף של הג'יג.
- משוך את העור למעלה וסביב כיסוי הראש. תפרו את החתך מאחורי כיסוי הראש עם תפרים כירורגיים 5-0.
- יש למרוח קרם לידוקאין ומשחה אנטיביוטית.
- להפסיק את ההרדמה ופעל לפי הליכי התאוששות סטנדרטיים.
- להשתלת חריפה: לאחר הורדת האלקטרודה והגעה לעומק הרצוי, המתינו לפחות 30 דקות לפני תחילת ההקלטה האלקטרופיזיולוגית כדי לאפשר לאלקטרודה להתיישב במקום.
- להשתלות כרונית: מלט את האלקטרודה במקום באמצעות מלט דנטלי נרפא UV.
- הורידו את קצה האלקטרודה לאותו מיקום, ובמצב עדין, מתחילים להניע את האלקטרודה למוח בקצב של ~ 2 מיקרומטר / s. השתמש במיקרוסקופ כדי להבטיח שהאלקטרודה נכנסת בצורה חלקה ולא מתכופפת.
תוצאות
עם השלמת פרוטוקול זה, הקלטות יציבות של פעילות ספייק יחידה אחת יהיו אפשריות. מערכי מיקרו-ectrode אלה ניתנים להתאמה אישית בחומרים, בספירת ערוצים ובמתאם הבמה על בסיס צרכי החוקר. אלקטרו-תזרים סיבים בזהב גורם לירידה בעקיפה המתאימה להקלטה (איור 4 ואיור 5). אם המשתמש מתכוון להקליט באופן כרוני, מדידות ניתן לבצע לאחר החיה התאוששה מההליך הכירורגי. הליכים כרוניים הביאו להקלטות יציבות של יחידה אחת במשך 120 יום לפחות. הקלטה מייצגת מוצגת באיור 6, הממחישה פעילות אלקטרופיזיולוגית יציבה בת 64 ערוצים בקליפת המוח הרטרספלנית של עכבר גברי בוגר שמתנהג בחופשיות. אם נדרשת הכנה חריפה, ההקלטות יכולות להתחיל זמן קצר לאחר ההשתלה (כ-30 דקות). זה יאפשר זמן לאלקטרודה להתיישב במוח. איור 7 מספק דוגמה מייצגת להקלטת CFEA חריפה בת 16 ערוצים שנרכשה מקליפת המוח החזותית העיקרית של חמוס נקבה בוגרת. מיון ספייק בעכבר וחמוס בוצע עם תוכנת מיון ספייק (ראה טבלת חומרים).
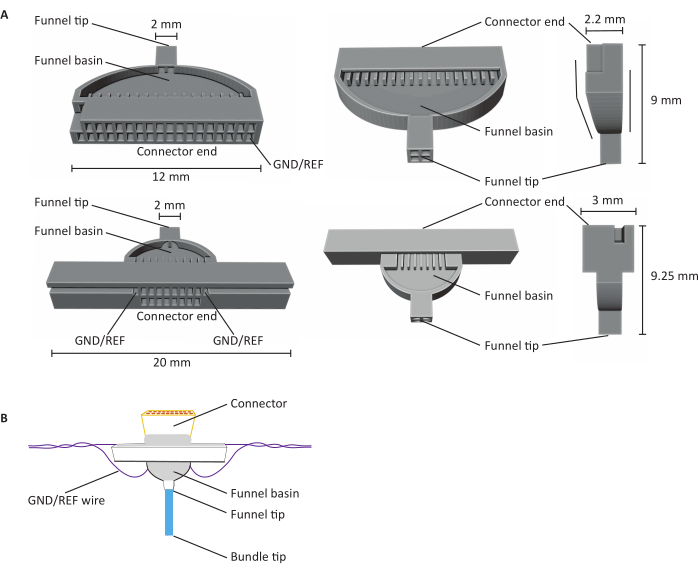
איור 1: אנטומיה של מערכי מיקרו-פחמן (CFEAs) בעלי 16 ו-32 ערוצים. (A) שרטוטים של CFEA בעלי 32 ערוצים (למעלה) ו-16 ערוצים (למטה) משלוש תצוגות שונות. CFEA בן 16 הערוצים כולל עיצוב מורחב למטרות טיפול. העיצוב בן 32 הערוצים כולל פנים שטוחות המאפשרות שילוב של שני פאזלים עבור CFEA בן 64 ערוצים. לשתי הדיאגרמות יש מבנים מזהים המסומנים בממדים. קצה המחבר מציין את המיקום של הוספת המחבר, וערוצי GND/REF מציינים היכן נוסף חוט האריקה. אגן המשפך מתייחס למיקום שבו הסיבים עוברים כדי להיות overlaid עם מלט שיניים UV נרפא אור, ואת קצה משפך מסמל את האתר שממנו הסיבים לצאת את הג'יג. קצה המשפך מחולק לרבעים כדי למזער סיבים הנצמדים זה לזה ויוצרים נזק. הסיבים נמשכים מאוחר יותר לתוך חבילה אחת עם השימוש במלט השיניים. Jigs מודפסים בתלת-ממד באמצעות מדפסות שרף SLA. דיאגרמות מוגדלות כדי להציג פרטים. (B)CFEA בנוי. לדיאגרמה יש מבנים מזהים המסומנים בתווית. קצה החבילה הכחולה מייצג את פלח סיבי הפחמן הנוכשים מדידות הקלטה. האפור בתוך אגן המשפך וסביב המחבר מעיד על מלט דנטלי שנרפא באור UV המחזיק סיבי פחמן במקומו באגן המשפך ומאבטח את המחבר לג'יג. החוט הסגול מייצג את חוט ההארקה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
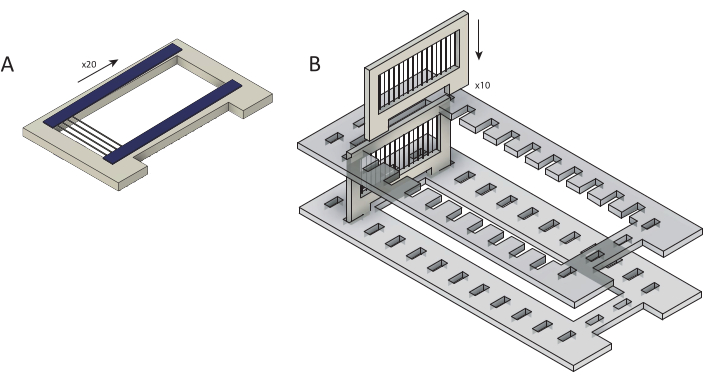
איור 2: העמסת סיבי פחמן גולמיים לקלטות לציפוי פארילן C. (A)סיבי פחמן נטענים על מחסניות עם שתי רצועות של סרט דו-צדדי (כחול). כל קלטת עמוסה בסיבים ~ 25. (B)קלטות נטענות למחזיק חיתוך בלייזר (אפור) כהכנה לציפוי פארילן C. כל אחת מהן מכילה עשר קלטות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
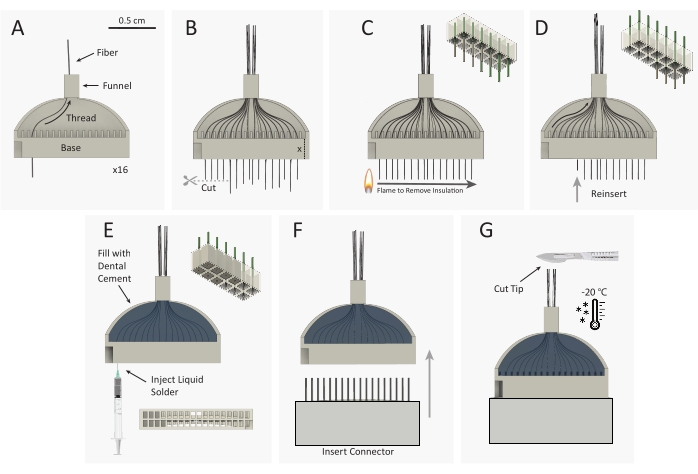
איור 3: מערך מיקרו-פחמן מיקרו-קטרודות (CFEA) סכמטי בניית חבילות. (A)16 סיבי פחמן מצופים בודדים (שחור) משורשרים דרך הג'יג המודפס בתלת-ממד (אפור) בן 32 ערוצים. (B)קצות סיבי פחמן נחתכים עם מיקרו מספריים, משאיר סיבים עודפים שווים לגובה של בסיס ג'יג, המשתרעים מתוך בסיס הג'יג. (C)מצית גלגל ניצוץ פלסטיק סטנדרטי מועבר במהירות מעל הסיבים העודפים כדי להסיר בידוד פארילן C. השרטוט הימני העליון מראה את הסרת פארילן מ 9 מתוך 12 סיבים. סיבים (D)הם reinserted לתוך הג'יג עד סוף הסיבים הוא לשטוף עם הבסיס. השרטוט הימני העליון מציג את ההקדמה של 9 סיבים עם טיפים סיבים לא מבודדים (אפורים) השוכנים בתוך בסיס הג'יג. לאחר מכן, הג'יג מתהפך ושלבי A-D חוזרים על עצמם כדי להשחיל את 16 הערוצים ההפוכים. (ה)הג'יג מלא במלט דנטלי כדי לאבטח את הסיבים. הדפס כסף מוזרק לכל באר של בסיס הג'יג. (F)המחבר הגברי מוכנס לבסיס הג'יג. (G)CFEA ואזמל קפואים במקפיא -20 מעלות צלזיוס. קצה המערך נחתך לאורך הרצוי, ומשאיר 32 סיבים זוגיים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
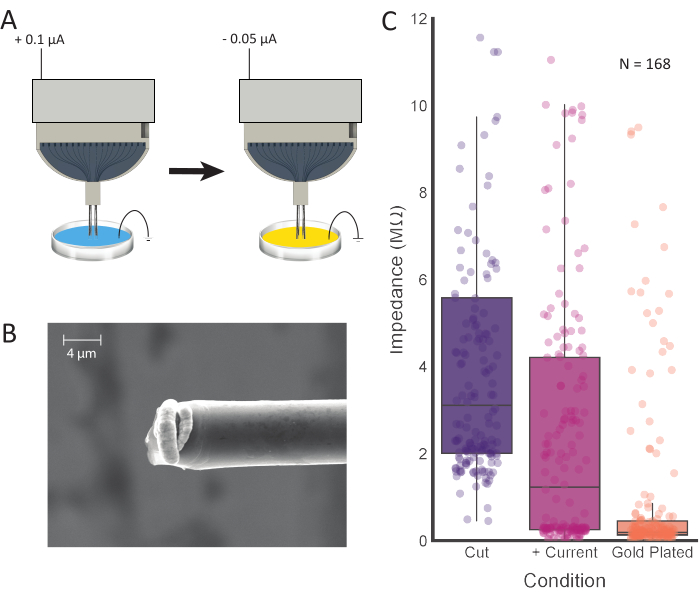
איור 4: טיפול טיפים ואלקטרו-צילומי. (A)טיפים אלקטרודה ממוקמים לראשונה ב- 0.1 M PBS, שם הזרם מועבר דרך כל אלקטרודה. הטיפים נשטפים ומועברים לתמיסת ציפוי זהב, שם הם אלקטרופלסטיים עם הזרם. (B)תמונות SEM של סיבי פחמן מוכנים מראות תמיסה ציפוי זהב מרוכז בקצה. סרגל קנה המידה מייצג 4 מיקרומטר. (C) ערכי עקיפה מ- 168 ערוצים לאחר חיתוך ראשוני (סגול; 3.11 MΩ ± 0.42 MΩ, חציון ± SE, n = 168 סיבים), הזרקה נוכחית חיובית (ורוד; 1.23 MΩ ± 0.36 MΩ, חציון ± SE, n = 168 סיבים) ואלקטרו-פלסטיק (כתום; 0.19 MΩ ± 0.15 MΩ, חציון ± SE, n = 168 סיבים) מראים ערכי עפגמה מופחתים לאחר כל שלב עיבוד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: משכי זמן מתונים של אלקטרופלינט זהב מייצרים מרבצים קטנים ומעוגלים על טיפים לחבילת סיבי פחמן. טיפים סיבי פחמן בתמונה הם כולם מערכי microelectrode שונים, המשקף משכי זמן שונים של זרם מוזרק להפחתת עכום או ציפוי זהב. תמונות מתארות בנוסף את ציפוי פארילן C, המבודד את סיבי הפחמן ומונע כל רכישה של אות ממיקום שאינו קצות הסיבים. (A)סריקת תמונת מיקרוסקופיה אלקטרונית של קצות סיבי פחמן לאחר הקפאה וחיתוך יחיד עם סכין גילוח. מוטות קנה מידה מייצגים 10 מיקרומטר. (B)זהה ל- A אך לאחר מכן עם הזרקת זרם חיובי עבור10 s. (C) זהה ל- B, אך לאחר מכן אלקטרופל עם זהב עבור 120 s. (E) זהה ל- B, אך לאחר מכן התחשמל בזהב למשך 30 s. (F) זהה ל- B אך לאחר מכן אלקטרופל עם זהב במשך 120 s. מצאנו כי electroplating עבור 30 s בזרם של -0.05 μA היה אופטימלי עבור הקלטות אלקטרופיזיולוגיות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
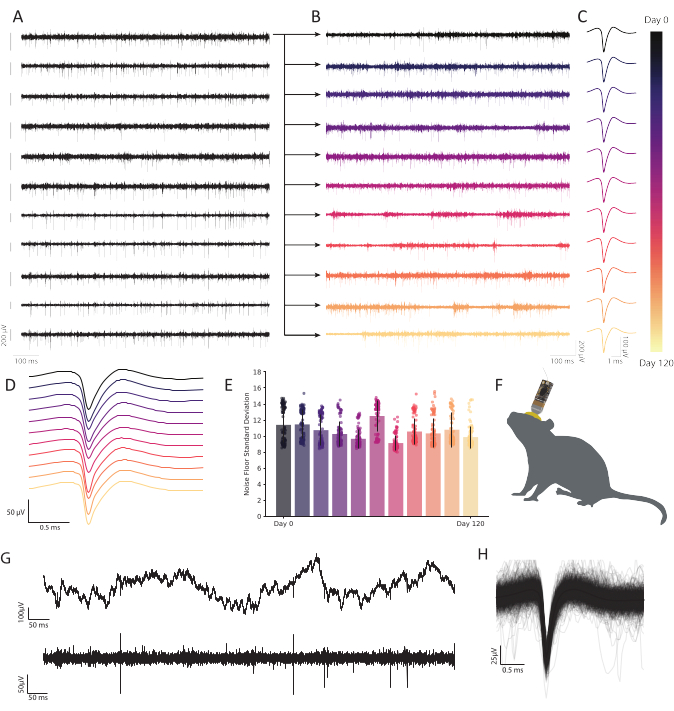
איור 6: הקלטות חוץ־תאיות כרוניות בקליפת המוח הרטרספלנית של העכבר המתנהגת בחופשיות עם מערכי מיקרו-נקטרודה מסיבי פחמן מראות פעילות עצבית מתמשכת ויציבה. (A)11 עקבות מתח שעברו רצועת הלהקה נרשמו בו זמנית. מעקבים הבאים שנרשמו מהעוץ הראשון (השורה העליונה) משורטטים ב- B כדי להציג עמידות לאורך זמן. עשר השורות הנותרות ממחישות את העקביות של איכות ההקלטה ומציגות פעילות חזקה במערך. סרגל קנה מידה משמאל לכל מעקב מייצג פוטנציאל של 200 μV. (B)Bandpassed נתונים מאותם סיבים כמו במעקב העליון ב- A, התרחב כדי להציג פעילות חזקה על פני הקלטה רציפה של 120 יום. (C)קיבוץ באשכולות חושף זיהוי חזק של יחידה אחת במשך חודשים. עקבות מייצגות את צורת הגל הממוצעת של יחידה יחידה ייצוגית הנצפית ברציפות לאורך 120 יום, המופקת מהסיבים המתוכננים ב- B בכל נקודת זמן. (D)ממוצע, צורות גל ספייק לא מנורמלות מ- C נערמו כדי להפגין עקביות לאורך זמן. (ה)הקלטות סיבי פחמן מראות רצפת רעש יציבה במשך חודשים רבים. סטיית התקן של רצפת הרעש (מעקב פחות פעילות ספייק) ב- B אינה מראה שינוי הדרגתי ברעש. ברים מייצגים זיהום ממוצע. קווי שגיאה מייצגים סטיית תקן. (ו)ציור קנה מידה של עכבר עם CFEA מושתל כרונית והבמה. (G)מעקב מתח גולמי (למעלה) 11 חודשים לאחר ההשתלה מראה LFP חזק. מעקב מתח פסים (למטה) מראה פעילות עצבית יציבה. (H)צורת גל ספייק ממוצעת של הנוירון שנרשמה על הסיבים מ- C, underlaied על ידי 1,000 המקרים הראשונים של פעילות spiking. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 7: הקלטות מערך מיקרו-פחמן (CFEA) מקליטה ראשונית של קליפת המוח החזותית העיקרית של החמוס. (A)צורות גל של ספייק ממוינות יחידות בודדות שנרשמו מ- CFEA בן 16 ערוצים. פוטנציאל פעולה של נוירונים בודדים ניכרו לעתים קרובות בערוצים מרובים בשרעת מעט שונה. (B)עקומות כוונון כיוון מתאי עצב נבחרים. צבעים תואמים ליחידות מוקלטות ב- A. החצים מצביעים על כיוון תנועת הגירוי. סרגלי קנה מידה מציינים את קצב התגובה. קווי שגיאה מציינים את התגובה הממוצעת עם שגיאה סטנדרטית. הקו המקווקו האופקי מייצג את קצב הירי הספונטני של אותו תא במהלך חשיפה למסך ריק. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר כל שלב הדרוש לבניית CFEA פונקציונלי לשימוש חריף וכרוני כאחד. התהליך המתואר ניתן להתאמה אישית לצרכי החוקר, מה שהופך אותו לאפשרות נגישה וזולה לניטור נוירונים בודדים במשך חודשים. הפרוטוקול מדגים את ההיתכנות של הקלטת פעילות חזקה ביחידה אחת בתוך דקות של השתלה בחיה מרדים, ועל פני ארבעה חודשים בחיה ערה ומתנהגת, הממחישה את הפוטנציאל של CFEAs אלה לחקור שינויים קצרי טווח וארוכי טווח בתגובות עצביות.
שלבי הפרוטוקול המתואר נבדקו ביסודיות ושופרו לאורך זמן כדי להניב הליך יעיל שניתן להשלים במהירות, בעלות שולית נמוכה (< 100.00 דולר), עם יכולת הקלטה של יחידות בודדות חד משמעיות, בצפיפות וביציבות במשך חודשים. ניתן להשלים את שלבי הבנייה בתוך פחות מיום אחד ולייצר אותות אלקטרופיזיולוגיים הדומים לכל מערך מסחרי מוביל. ל- CFEAs יש גם טביעת רגל קטנה בהרבה (חבילת סיבים בת 16 ערוצים בקוטר של ~ 26 מיקרומטר) מאשר מערכים מסחריים דומים, והתאימות הביולוגית שלהם הופכת אותם למתאים לשימוש ארוך טווח13. חשוב לציין, ישנם מספר שלבים קריטיים והוראות שיש לבצע על מנת לייצר CFEA מתפקד עם ביצועים דומים.
בשל שבריריותם של סיבי הפחמן, יש לטפל בהם בזהירות מירבית. טיפול בהם עם מלקחיים חדים או כלים אחרים עלול לגרום לשבר של הסיבים. בנוסף, חשוב לבנות את ה- CFEAs בחלל עם תנועה אווירית מוגבלת, כך שהסיבים לא יתפוצצו. כאשר בוער החלק האחורי של הסיבים, המצית רק צריך להיות מועבר בתנועה הלוך ושוב בקצרה רבה, עבור כ 1 s. השלבים הבאים לאחר הסרה זו של בידוד הם קריטיים לבניית אלקטרודה עם ערוצי עבודה. יש להאכיל את הטיפים הלהבים לתוך הג'יג ללא כל מגע נוסף. לאחר מכן, בעת מילוי האגן במלט דנטלי, חשוב כי המלט מוחל בקפידה וממלא לחלוטין את הערוצים ואת אגן משפך, סגירת הפתחים מבלי למלא אותם. לאחר מכן יש לרפא לחלוטין את המלט הדנטלי עם אור UV לפני שתמשיך. ברגע שזה הושלם, צבע כסף צריך להיות מוזרק לתוך כל ערוץ עד מלא לחלוטין אבל לא נשפך החוצה. זהו השלב המשתנה ביותר בתהליך. כל מילוי יתר יכול לייצר שיחה צולבת בין הערוצים, ומילוי לא מספיק עלול לגרום לכשל בחיבור. אם לא ניתן להזריק צבע כסף באמצעות מחט 25 G, סביר להניח כי הפתרון הוא צמיג מדי, ובמקרה זה, כמות קטנה של מדלל צבע ניתן להוסיף כדי ליצור פתרון נוזלי יותר. לאחר כל הערוצים מלאים, ואת מחבר headstage מוכנס, חשוב לאפשר את המערך לרפא עבור 24 שעות לפני אבטחת המחבר עם מלט שיניים. גילינו שכישלון לעשות זאת הוריד את מספר הערוצים המחוברים. החלת כמות נדיבה של מלט דנטלי חשובה גם כך המחבר לא להתנתק בעת מתמשוק עם מערכת רכישת אותות. אם הם מתנתקים, ניתן לנסות להתחבר מחדש עם מילוי חוזר ונשנה של ערוצים עם צבע כסף, אבל המשתמש צריך לבדוק את ערכי העכבה של CFEA כדי להעריך את מספר הערוצים המחוברים. מתן אפשרות למלט הדנטלי לרפא בן לילה משמש גם למניעת ניתוק פוטנציאלי.
מדידת העכבה של האלקטרודה תספק הערכה מדויקת של ערוצים מחוברים. זה יכול להיעשות לאחר שקוע בחוטי הקרקע והייחוס ואת קצות סיבי הפחמן PBS. ראינו כי עקיפה גבוהה (>15 MΩ) מעידה על ערוץ פתוח, לא מחובר. לפני הזרקת זרם electroplating, ערוץ מחובר יכול להיות מגוון של ערכי עכום זה צריך להקטין באופן משמעותי עם תהליך זה. המספר הממוצע של ערוצים מחוברים (עריסה < 4 MΩ לאחר הזרקה נוכחית) לכל אלקטרודה 16 ערוצים היה 12.96 ± 2.74 (ממוצע ± SD; N = 48 אלקטרודות). מספר פעמים אלקטרו-תול בבדיקה, ו-30 s יצרו בידוד אותות מעולה בין אתרי ההקלטה(איור 5). אמנם נקבע היטב כי PEDOT-pTS12,24,25,26 ו PEDOT-TFB21 לספק אפשרויות אמינות להכנת אתרי הקלטה סיבי פחמן, מצאנו כי ציפוי עם זהב, שיטה מוכחת ומהימנה עבור electroplating אלקטרודות עבור השתלה כרונית27,28 הגדיל את קלות ההשתלה ומנע מהקצוות האלקטרודה להתעשת יחד., בהפקת ערכי עכבה סופיים של פחות מ- 0.2 MΩ בממוצע, שיטה זו מוכיחה השוואה לערכים שהושגו באמצעות PEDOT-TFB21 ו- PEDOT-pTS26.
בעת השתלת מערך microelectrode, חשוב לעקוב חזותית אחר החדרת קצות סיבי הפחמן מתחת למיקרוסקופ. החדרה מוצלחת צריכה להיות גלויה, ללא כיפוף של הסיבים. אם הסיבים נראים קורסים, לא סביר שהם ייכנסו בהצלחה למוח. במקרה זה, יש להתאים את זווית הגשוש לניסיון שני. תהליך זה יכול להימשך עד שהכנסת הבדיקה תצליח. ברגע שהאלקטרודה נמצאת בעומק הרצוי, גילינו שהמתנה של לפחות 30 דקות תאפשר לגשוש להסתפק ברכישת אותות אופטימלית (הקלטות חריפות).
ה- CFEAs המתוארים, בנוסף לטביעת הרגל הקטנה שלהם וההתאמה הביולוגית שלהם, מציעים חלופה חזקה הניתנת להתאמה אישית למערכים מסחריים בשל קלות הבנייה והעלות הנמוכה שלהם. המגבלה הגדולה ביותר ל- CFEAs המפורטת בפרוטוקול זה היא המדרגיות שלהם. בשל האופי הידני של בנייתם, קנה המידה עד עיצובים עם מאות אתרי הקלטה לא יכול להיות מעשי. בנוסף, התקדמות בייצור מערך מיקרו-ectrode באמצעות ננוטכנולוגיה תאפשר הקלטות אוכלוסין בקנה מידה גדול יותר מהשיטות המתוארות כאן. עם זאת, פרוטוקול זה מספק נגישות CFEA למעבדות המעוניינות בייצור benchtop של אלקטרודות סיבי פחמן. לא ראינו אובדן יציבות או ירידה בחוסן במשרעת ספייק לאורך 120 יום הניסויים הכרוניים, כפי שצוין על ידי ערוץ יחיד מייצג האופייני לתצפיות שלנו בסולם הזמן הזה (איור 6A-E). בנוסף, ה- CFEAs מציגים את היכולת לפעילות מתמדת של יחידה אחת, שכן ארבע יחידות בודדות נותרו מובחנות 11 חודשים לאחר ההשתלה בעכבר (איור 6G, H). ניתן גם להשיג הקלטות יציבות של יחידה אחת באופן חריף(איור 7),המציע יתרון על פני אלקטרודות מסחריות רבות אחרות לחקר נוירונים בודדים על פני פרקי זמן קצרים. בעתיד, פיתוח של בדיקות גמישות וגמישות כאלה עם קטרים מינימליים יאפשר חקר תהליכים מורכבים. כלים אלה יספקו תועלת משמעותית בקידום הטכנולוגיה העצבית, כולל יישומים בממשקי מוח-מכונה (BMIs), הדורשים יציבות רציפה וארוכת טווח29.
Disclosures
המחברים אינם מצהירים על ניגודי עניינים כספיים.
Acknowledgements
ברצוננו להודות לגרג גויטצ'ואנטס על הדרכה עם תכנון ובנייה אלקטרודה וטים גרדנר על פתיחת המעבדה והמתקנים שלו אלינו. ברצוננו להודות לכריסטוס מיצ'אס על עזרתו בשימוש ב-PDS במתקן הליבה של הביו-ממשק והטכנולוגיה ולניל ריטר, ג'ון ספירייס ודיוויד לנדסמן על עזרתם בעיצוב גרסאות מוקדמות של הג'יג בן 16 הערוצים. ברצוננו להודות לטים קאוואנו על עזרתו בהדמיית SEM במרכז למערכות ננומטריות של הרווארד בהרווארד.
Materials
| Name | Company | Catalog Number | Comments |
| #10 scalpel blade | Fisher Scientific | 14-840-15 | Building tool |
| 16-channel CFEA Jig | Realize Inc. | CFMA component | |
| 16-channel Omnetics connector | Omnetics | A79014-001 | CFMA component |
| 25 G needle | Fisher Scientific | 14-840-84 | Building tool - sharp-tipped |
| 30 G needle | Fisher Scientific | 14-841-03 | Building tool |
| 31 G stainless steel 304 hypodermic round tubing | Small Parts Inc | B000FMYN38 | For guide tube |
| 32-channel CFEA jig | Realize Inc. | CFMA component | |
| 32-channel Omnetics connector | Omnetics | A79022-001 | CFMA component |
| 6 in cotton tip applicators | Fisher Scientific | 22-363-156 | Building tool |
| Acetone | Fisher Scientific | A16P4 | Building tool |
| AutoCad 3D printing software | Autodesk | Computer-aided design tool/ 3D modeling software | |
| Autodesk Fusion 360 | Autodesk | Computer-aided design tool/ 3D modeling software | |
| BD disposable syringes | Fisher Scientific | 14-823-30 | 1 mL |
| Carbon fibers | Good Fellow USA | C 005725 | 7 μm epoxy sized |
| Cassettes and cassette holder | For coating fibers | ||
| Clear tape | Scotch | For coating raw fibers | |
| Deionized water | Electroplating component | ||
| Double-sided tape | Scotch | For coating raw fibers | |
| Flowable Dental Composite | Pentron | Flow-It ALC | CFMA component/ UV cured dental cement |
| Gold plating solution | Sifco ASC | 5355 | 10.0-20.0% glycerol, 1.0-5.0% ethylenediamine, 1.0-5.0% acetic acid (ethylenedinitrilo)tetra-, dipotassium salt, 5.0-10.0% butanoic acid, mercapto-monogold(1+) sodium salt, 1.0–5.0% potassium metabisulfite, 55.0-82.0% water |
| Jewelry clamp | Amazon | B00GRABH9K | Building tool |
| JRClust | Ferret spike sorting software | ||
| Lighter | BIC | LCP62DC | Building tool |
| Micromanipulator | Scientifica | PS-7000C | For guide tube |
| Microscissors | Fisher Scientific | 08-953-1B | Building tool |
| MountainSort | Mouse spike sorting software | ||
| NanoZ 16-channel adapter | Multi-channel systems | ADPT-nanoZ-NN-16 | Electroplating component |
| NanoZ 32-channel adapter | White Matter | NZA-OMN-32 rev A | Electroplating component |
| NanoZ multi-electrode impedance tester | White Matter | Electroplating component | |
| Parafilm | Fisher Stockroom | 13-374-10 | Semi-transparent, flexible film with adhesive properties |
| Parylene 'C' Dimer | Specialty Coating Systems | 980130-C-01LBE | For coating raw fibers |
| PEG 8000 | Fisher Scientific | 25322-68-3 | Electroplating component |
| Phosphate-buffered saline | Electroplating component | ||
| Polyimide tubing | MicroLumen | BRAUNI001 | For guide tube |
| Rotary tool | Dremel | 300124 | For guide tube |
| Scalpel handle | Fine Science Tools | 10003-12 | Building tool |
| Silver conductive coating | MG Chemicals | 842AR Super Shield | CFMA component |
| Stereo microscope with range 6.7:1 | Motic | SMZ-168 | Building tool |
| Sticky notes | Post-it | Building tool | |
| Tissue wipes | Kimtech Science | 34155 | Building tool |
| Tungsten wire | A-M Systems | 797550 | CFMA component |
| UV curing wand | Woodpecker | Building tool | |
| Vacuum deposition chamber | Specialty Coating Systems | Labcoter 2 (PDS 2010) |
References
- Galvani, L. . De viribus electricitatis in motu musculari commentarius. , (1791).
- Buzsaki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature reviews. Neuroscience. 13 (6), 407-420 (2012).
- Ledochowitsch, P., et al. On the correspondence of electrical and optical physiology in in vivo population-scale two-photon calcium imaging. bioRxiv. , 800102 (2019).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Seymour, J. P., Wu, F., Wise, K. D., Yoon, E. State-of-the-art MEMS and microsystem tools for brain research. Microsystems and Nanoengineering. 3 (1), 16066 (2017).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nature reviews. Neuroscience. 9 (3), 195-205 (2008).
- Hong, G., Lieber, C. M. Novel electrode technologies for neural recordings. Nature reviews. Neuroscience. 20 (6), 330-345 (2019).
- Chung, J. E., et al. High-density, long-lasting, and multi-region electrophysiological recordings using polymer electrode arrays. Neuron. 101 (1), 21-31 (2019).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Kozai, T. D., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chemical Neuroscience. 6 (1), 48-67 (2015).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Kozai, T. D., et al. Ultrasmall implantable composite microelectrodes with bioactive surfaces for chronic neural interfaces. Nature Materials. 11 (12), 1065-1073 (2012).
- Chen, R., Canales, A., Anikeeva, P. Neural recording and modulation technologies. Nature Reviews Materials. 2 (2), 16093 (2017).
- Szostak, K. M., Grand, L., Constandinou, T. G. Neural interfaces for intracortical recording: requirements, fabrication methods, and characteristics. Frontiers in Neuroscience. 11, 665 (2017).
- Subbaroyan, J., Martin, D. C., Kipke, D. R. A finite-element model of the mechanical effects of implantable microelectrodes in the cerebral cortex. Journal of Neural Engineering. 2 (4), 103-113 (2005).
- Park, S., et al. One-step optogenetics with multifunctional flexible polymer fibers. Nature Neuroscience. 20 (4), 612-619 (2017).
- Guo, Y., et al. Polymer composite with carbon nanofibers aligned during thermal drawing as a microelectrode for chronic neural interfaces. ACS Nano. 11 (7), 6574-6585 (2017).
- Armstrong-James, M., Millar, J. Carbon fibre microelectrodes. Journal of Neuroscience Methods. 1 (3), 279-287 (1979).
- Garris, P. A., Ciolkowski, E. L., Pastore, P., Wightman, R. M. Efflux of dopamine from the synaptic cleft in the nucleus accumbens of the rat brain. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 14 (10), 6084-6093 (1994).
- Guitchounts, G., Markowitz, J. E., Liberti, W. A., Gardner, T. J. A carbon-fiber electrode array for long-term neural recording. Journal of Neural Engineering. 10 (4), 046016 (2013).
- Guitchounts, G., Cox, D. 64-channel carbon fiber electrode arrays for chronic electrophysiology. Scientific Reports. 10 (1), 3830 (2020).
- Ma, Z., Turrigiano, G. G., Wessel, R., Hengen, K. B. Cortical circuit dynamics are homeostatically tuned to criticality in vivo. Neuron. 104 (4), 655-664 (2019).
- Popovic, M., et al. Development of cross-orientation suppression and size tuning and the role of experience. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 38 (11), 2656-2670 (2018).
- Patel, P. R., et al. Chronic in vivo stability assessment of carbon fiber microelectrode arrays. Journal of Neural Engineering. 13 (6), 066002 (2016).
- Welle, E. J., et al. Ultra-small carbon fiber electrode recording site optimization and improved in vivo chronic recording yield. Journal of Neural Engineering. 17 (2), 026037 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. Journal of Neural Engineering. 12 (4), 046009 (2015).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating low-impedance tetrodes by electroplating with additives. Sensors and Actuators. A, Physical. 156 (2), 388-393 (2009).
- Vafaiee, M., Vossoughi, M., Mohammadpour, R., Sasanpour, P. Gold-plated electrode with high scratch strength for electrophysiological recordings. Scientific Reports. 9 (1), 2985 (2019).
- Lebedev, M. A., Nicolelis, M. A. Brain-machine interfaces: From basic science to neuroprostheses and neurorehabilitation. Physiological Reviews. 97 (2), 767-837 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved