Method Article
Построение и внедрение микроэлектродных массивов из углеродного волокна для хронических и острых записей in vivo
В этой статье
Резюме
Этот протокол описывает процедуру построения микроэлектродных массивов из углеродного волокна для хронических и острых электрофизиологических записей in vivo у мышей(Mus musculus)и хорьков(Mustela putorius furo) из нескольких областей мозга. Каждый шаг, следующий за покупкой необработанных углеродных волокон для имплантации микроэлектродного массива, подробно описан с акцентом на конструкцию микроэлектродной решетки.
Аннотация
Многоканальные электродные массивы дают представление о рабочем мозге и служат для выяснения нейронных процессов на одноклеточном и цепном уровнях. Разработка этих инструментов имеет решающее значение для понимания сложного поведения и познания, а также для продвижения клинических применений. Тем не менее, остается проблемой плотная запись из клеточных популяций стабильно и непрерывно в течение длительных периодов времени. Многие популярные электроды, такие как тетроды и кремниевые массивы, имеют большие поперечные диаметры, которые вызывают повреждение при вставке и вызывают хронические реакции реактивной ткани, связанные с гибелью нейронов, препятствуя регистрации стабильной, непрерывной нейронной активности. Кроме того, большинство пучков проводов имеют широкий интервал между каналами, что исключает одновременную запись из большого количества ячеек, сгруппированных на небольшой площади. Микроэлектродные массивы из углеродного волокна, описанные в этом протоколе, предлагают доступное решение этих проблем. Исследование предоставляет подробный метод изготовления микроэлектродных массивов из углеродного волокна, которые могут быть использованы как для острых, так и для хронических записей in vivo. Физические свойства этих электродов делают их идеальными для стабильных и непрерывных долгосрочных записей при высокой плотности клеток, что позволяет исследователю делать надежные, однозначные записи из отдельных единиц в течение нескольких месяцев.
Введение
Электроды и электродные массивы являются ценными инструментами для понимания того, как мозг обрабатывает информацию на нейронном уровне. Хотя электрофизиологические записи были достижимы на протяжении более двух столетий1,до сих пор невозможно одновременно измерить активность целых нейронных цепей с пространственным и временным разрешением, необходимым для захвата всплесков отдельных нейронов. Хотя неинвазивные методы, такие как электроэнцефалография2,позитронно-эмиссионная топография3и функциональная магнитно-резонансная томография4, позволяют проводить измерения всего мозга, они не могут достичь пространственного и временного разрешения, необходимого для разрешения активности нейронныхцепей 2,5. Напротив, методы визуализации, такие как оптическая визуализация с использованием чувствительных к напряжению красителей или генетически закодированных показателей кальция, могут достигать одноблочного пространственного разрешения, но они создают такие проблемы, как низкое временное разрешение и плохая селективность3,4,5,6. Электрические записи являются мощной альтернативой этим методам. Регистрирующие электроды обеспечивают беспрецедентное временное разрешение и позволяют пользователю производить измерения с точностью до времени всплеска в любой области мозга7. Кроме того, хронически имплантированные многоэлектродные массивы (MEA) позволяют проводить крупномасштабные (от десятков до сотен клеток) одноклеточные записи у ведущих себя животных в течение периода от нескольких дней до месяцев8,9. Тем не менее, кремниевые зонды, которые регистрируют при более высоких плотностях, имеют большой след и являются высокоинвазивными, а хронически имплантированные массивы часто генерируют реакцию воспаления, инкапсуляцию тканей и гибель нейронов10,11,12,13.
Ограничения существующих электродов привели к недавним инновациям, которые позволяют проводить стабильные долгосрочные записи с высоким разрешением. Типичные электроды состоят из металлического проводника, такого как вольфрам или платина-иридий, или имеют кремниевую или полимерную основу. В то время как металлические микропроводные массивы могут поддерживать долгосрочную, стабильную запись, они имеют гораздо большую площадь, с диаметром одного провода в диапазоне от 10 до 200 мкм14. Напротив, электродные решетки на основе кремния дают записи с высоким пространственным разрешением, но из-за их относительно жесткой конструкции они, как правило, не могут поддерживать сигнал и запись от одних и тех же нейронов в течение многих месяцев15. Недавние разработки в массивах на основе кремния привели к появлению электродов, которые могут надежно выполнять хронические записи, но эти массивы не могут использоваться для записи из глубоких областей мозга у более крупных животных и предназначены для линейных записей9. Достижения в области полимерных массивов привели к повышению гибкости и стабильности регистрации отдельных единиц и предлагают потенциал для записей высокой плотности в ближайшем будущем, но с ограниченной доступностью в настоящее время8,16,17. Углеродные волокна позволяют проводить записи высокой плотности с готовыми материалами, которые описаны здесь.
Микроэлектроды, регистрирующие углеродное волокно, использовались в течение десятилетий, причем первые электроды из углеродного волокна состояли из одного углеродного волокна, вставленного в стеклянную микропипетку. Эти микроэлектроды использовались для одноблочных внеклеточных записей, и хотя отношение сигнал/шум было сопоставимо с лучшими микроэлектродами вольфрама в стекле, они были выгодны из-за их гибкости, более низких значений импеданса и простоты изготовления18,19. Усилия по разработке электродных массивов из углеродного волокна в последнее время ускорились из-за возможностей биозондирования углеродных волокон. В дополнение к их повышенной биосовместимости и исключительной электропроводности, они обладают уникальным набором свойств, включая устойчивость к высоким температурам, низкую относительную плотность, высокую прочность на растяжение, низкую жесткость при изгибе, высокую чувствительность обнаружения и небольшую площадь поперечного сечения10,12. Все эти свойства мотивировали разработку микроэлектродных массивов углеродного волокна (CFEA), которые облегчают хронические, стабильные, высокопроизводительные записи одиночных нейронов. Такие CFEA теперь могут быть созданы вручную20,21 (рисунок 1),давая микроэлектродные массивы, которые могут удерживать одиночные нейроны в течение нескольких месяцев. Здесь описан доступный процесс построения для CFEA, который был адаптирован двумя способами для острой и хронической регистрации отдельных нейронов у двух видов.
протокол
Все экспериментальные процедуры были одобрены Комитетом по уходу и использованию животных Университета Брандейса или Вашингтонского университета. Показанные данные были собраны у одной самки хорька и одного самца мыши.
1. Подготовка углеродных волокон и инструментов
- Подготовка товарных углеродных волокон
- Вырежьте полоски размером 8 см из пучка волокон эпоксидного размера. Выложить полоски параллельно в тигель и выпекать в печи при 400 °C в течение 6 ч, чтобы удалить эпоксидную смолу из коммерческих волокон. Затем храните запеченные волокна в стандартной чашке Петри или конической трубке.
ПРИМЕЧАНИЕ: Использовались волокна диаметром 7 мкм. Другие группы использовали 4 мкм волокон20,21. - Подготовьте кассеты для удержания отдельных волокон. Используйте 3D-принтер или лазерный резак для создания кассет и соответствующего держателя кассеты (см. рисунок 2).
- Загрузите волокна на кассеты. Начните с укладки куска двусторонней ленты на две длинные стороны кассеты, выровняв край ленты с внутренним краем кассеты. Отделите отдельные волокна от обожженного пучка и уложите их параллельно короткой стороне кассеты, удерживая между волокнами 2-3 мм. Убедитесь, что на каждой кассете помещается 20-30 волокон. Запечатайте волокна на месте, уложив прозрачную ленту поверх двойной ленты. Поместите заполненные кассеты в держатель кассеты.
ПРИМЕЧАНИЕ: Для опытного строителя заполнение одной кассеты волокон займет ~1 ч. Для начинающего строителя этот процесс, скорее всего, займет ~1,5-3 ч. В коробке десять кассет, и два держателя кассет могут поместиться в камере осаждения парилена. - Покройте отдельные волокна париленом С с помощью коммерческой вакуумной камеры осаждения. Для нанесения покрытия необходим один прогон. Отмерьте 2,3 г парилена на каждый прогон. Два кассетных держателя помещаются в камере одновременно. Процедура нанесения покрытия занимает ~2 ч за прогон.
ПРИМЕЧАНИЕ: Измерение 2,3 г парилена С обеспечивает приблизительно 1 мкм покрытия. Покрытые волокна могут храниться бесконечно.
- Вырежьте полоски размером 8 см из пучка волокон эпоксидного размера. Выложить полоски параллельно в тигель и выпекать в печи при 400 °C в течение 6 ч, чтобы удалить эпоксидную смолу из коммерческих волокон. Затем храните запеченные волокна в стандартной чашке Петри или конической трубке.
- Подготовка инструмента для манипуляций с углеродным волокном
- Оберните небольшой кусочек гибкой клейкой пленки вокруг иглы весом 30 г, образуя острую, но гибкую точку с клейкой пленкой.
ПРИМЕЧАНИЕ: Обертывание кончика иглы парапленкой и растягивание парапленки при этом создает мягкий адгезивный эффект, который позволяет пользователю подбирать и маневрировать отдельными волокнами.
- Оберните небольшой кусочек гибкой клейкой пленки вокруг иглы весом 30 г, образуя острую, но гибкую точку с клейкой пленкой.
2. Проектирование и изготовление
- Выберите подходящую конструкцию приспособления, необходимую на основе спецификаций электрода, который будет построен. Это будет зависеть от количества необходимых каналов, а также от любых конструктивных дополнений.
ПРИМЕЧАНИЕ: Джиг относится к 3D-печатному блоку, который обеспечивает якорь для электродов и электрических соединений. - Создайте или измените конкретную конструкцию джига с помощью программного обеспечения автоматизированного проектирования (CAD).
- Используйте компанию по 3D-печати или лабораторию институционального производителя для печати джигов с помощью 3D-принтера SLA с высоким разрешением.
3. Сборка микроэлектродной решетки из углеродного волокна (CFEA)
ПРИМЕЧАНИЕ: Этот шаг занимает ~ 2 часа для опытного строителя и ~ 6 часов для начинающего строителя. Выполните все этапы сборки CFEA и сборки волокон под 10-кратным стереомикроскопом. Полная сборка CFEA в среде с минимальным движением воздуха, так как это может нарушить процесс строительства.
- Выберите подходящий джиг, необходимый для сборки желаемого электрода.
- Используя металлические проволочные резаки, вырежьте два куска вольфрамовой проволоки диаметром 0,003 дюйма (76,2 мкм), длиной около 7 см.
- Подайте каждый провод через соответствующий канал на соединительном конце джига (GND и REF). Достаточно подайте до тех пор, пока два конца не станут равными по длине, а затем скрутите их вместе, чтобы закрепить их на джиге.
ПРИМЕЧАНИЕ: Для 16-канальной острой конструкции убедитесь, что металлическая проволока помещается в гребень в джиге.- Нанесите УФ-отвержденный зубной цемент для закрепления проволоки. Убедитесь, что зубной цемент не попадает в открытый канал, через который подается проволока.
ПРИМЕЧАНИЕ: Пользователь должен носить защиту глаз с УФ-фильтрацией во время всех процедур, связанных с УФ-излучением, чтобы предотвратить потенциальное повреждение глаз. Многие палочки УФ-отверждения имеют встроенные фильтры просмотра. - Используя палочку УФ-отверждения, вылечите зубной цемент в течение 20 с.
- Закрепите джиг в ювелирных тиски одним из рычагов джига. Ориентируйте джиг так, чтобы одна из боковых граней была параллельна земле.
- Ориентируйте джиг и тиски под микроскопом так, чтобы были видны конец разъема, таз и наконечник воронки. Направьте джиг так, чтобы воронка указывала в сторону от пользователя, а конец разъема был обращен к пользователю.
- Соберите инструменты из углеродного волокна и иглу с острым наконечником 25 г.
- Поместите кассету с волокнами, покрытыми париленовым С, на белый лист бумаги, лентой стороной вверх, чтобы волокна не были непосредственно на бумаге.
- Используйте иглу весом 25 г, чтобы вырезать из кассеты одно углеродное волокно. Сделайте это, скользя кончиком иглы о кассету, откуда появляется удаляемое волокно.
- При строительстве с использованием половинных волокон отрежьте один конец волокна, как описано выше. Сориентируйте волокно так, чтобы оно было прямым, и с помощью иглы разрежьте волокно пополам, разрезав волокно о бумагу. Чтобы разрезать другую половину, которая все еще подключена к кассете, удерживайте свободный наконечник волокна с помощью инструмента из углеродного волокна, который был сделан ранее, а затем используйте иглу, чтобы разрезать волокно, все еще подключенное к кассете, как описано выше.
- Если вы строите с использованием полных волокон, отрежьте один конец волокна, как описано выше. Используйте ранее изготовленный инструмент из углеродного волокна и удерживайте свободный конец волокна, которое было только что разрезано. Используя иглу, отрежьте другой конец волокна от кассеты.
- Подберите углеродное волокно с помощью ранее изготовленного инструмента из углеродного волокна. Подберите волокно так, чтобы один конец имел длину около 1 см от инструмента.
- Используйте инструмент из углеродного волокна с прикрепленным волокном и подайте более короткий конец волокна через кусок воронки из среднего бассейна джига. Используйте микроскоп для визуализации.
- Продолжайте подавать волокно через воронку джига до тех пор, пока большая часть длины волокна не пройдет (см. Рисунок 3А).
- Подайте заднюю часть волокна через доступный канал с помощью ранее изготовленного инструмента из углеродного волокна. Подавайте волокно через спину до тех пор, пока около 5 мм волокна не выльется из спины. При необходимости вырежьте по размеру (см. рисунок 3B).
ПРИМЕЧАНИЕ: Не подавайте волокна в каналы, содержащие металлические провода.
- Заполните остальные каналы волокнами на одной стороне джига, следуя указаниям, приведенным выше.
ПРИМЕЧАНИЕ: При подаче волокон в воронку подавайте половину волокон в каждое подразделение воронки, причем правая половина каналов находится в правом отделе, а левая половина каналов в левом делении. Когда волокна находятся в тесном контакте внутри воронки, между волокнами возникает неблагоприятное трение, которое приводит к тому, что существующие волокна либо вытягиваются, либо ломаются при подаче новых волокон в джиг. Это разделение на четыре секции обеспечивает некоторое облегчение, так как волокна хранятся в более мелких пучках до более поздней стадии. - Используйте стандартную зажигалку для искрового колеса и быстро пропускайте пламя по открытым волокнам на конце разъема. Убедитесь, что изоляция всех волокон удалена на концах (см. Рисунок 3C).
ПРИМЕЧАНИЕ: Часть волокон, подвергшихся воздействию пламени, должна казаться немного тоньше, чем остальная часть волокна. - Подайте воспаленное волокно через джиг так, чтобы часть волокна, подвергшаяся воздействию пламени, теперь находилась в канале. Убедитесь, что из задней части джига не торчат волокна (см. Рисунок 3D).
ПРИМЕЧАНИЕ: Используйте инструмент из углеродного волокна, чтобы захватить волокно изнутри бассейна и подать пламенное волокно через джиг. Не прикасайтесь к части волокон, подверженных воздействию пламени, так как эта часть более хрупкая. - Нанесите УФ-отвержденный зубной цемент на волокна в бассейне джига. Заполните весь бассейн, чтобы покрыть отверстия каналов и отверстие воронки (см. рисунок 3E).
- Используйте ультрафиолетовый свет и вылечите зубной цемент в течение 20 с. Излечивайтесь еще на 20 с, если зубной цемент не полностью отверждается.
ПРИМЕЧАНИЕ: Убедитесь, что зубной цемент не перемещается внутри каналов.
- Используйте ультрафиолетовый свет и вылечите зубной цемент в течение 20 с. Излечивайтесь еще на 20 с, если зубной цемент не полностью отверждается.
- Снимите джиг с тиски, переверните его и закрепите джиг в тиски, как это было предварительно закреплено. Убедитесь, что сторона, содержащая волокна, теперь находится лицевой стороной вниз.
- Заполните пустую сторону джига углеродными волокнами в точности так, как описано выше.
- После того, как все каналы имеют волокна, а волокна закреплены зубным цементом, снимите джиг с тиски и сориентируйте джиг так, чтобы воронка была направлена вниз. Закрепите джиг в тиски так, чтобы конец разъема был направлен вверх.
- Соберите иглу с острым наконечником 25 Г, шприц объемом 1 мл, серебряную проводящую краску, аппликаторы с хлопковым наконечником, разбавитель краски, салфетки для тканей и соответствующий разъем для головной сцены.
ПРИМЕЧАНИЕ: Убедитесь, что серебряная проводящая краска хорошо перемешана и представляет собой однородный раствор. Не дайте краске высохнуть. - Втяните 0,3 мл серебряной краски в шприц объемом 1 мл, а затем прикрепите иглу с острым наконечником 25 г.
- Осторожно вставьте иглу в один канал до тех пор, пока не остановите зубной цемент. Медленно нажмите на шприц, снимая иглу с канала, чтобы заполнить канал краской (см. Рисунок 3E).
- Протрите любую краску с иглы, а затем перейдите к следующему каналу.
- Заполните все каналы краской.
ПРИМЕЧАНИЕ: Дополнительные проходы в каналы могут быть необходимы, так как краска устанавливается в каналах в течение первых нескольких минут.
- Заполните все каналы краской.
- Окуните аппликатор с хлопковым наконечником в разбавитель краски, а затем очистите основание джига от любой краски на поверхности. Для этого может потребоваться несколько аппликаторов с хлопковыми наконечниками.
ПРИМЕЧАНИЕ: Аппликаторы с хлопковыми наконечниками, не погруженные в разбавитель краски, также могут быть полезны для очистки джига. - Вставьте разъем головной ступени в правильную ориентацию, выровняв контакты с каналами. Убедитесь, что разъем головной ступени находится прямо в вертикальном положении и находится как можно более заподлицо с джигом (см. рисунок 3F).
- Дайте джигу затвердеть в течение 24 ч.
- Закрепите разъем головной ступени на джиге с помощью зубного цемента, отверждаемого УФ-излучением, путем нанесения зубного цемента вдоль края, где разъем головной ступени встречается с джигом. УФ-лечение с использованием ультрафиолетового света в течение 20 с.
- Нанесите УФ-отвержденный зубной цемент для закрепления проволоки. Убедитесь, что зубной цемент не попадает в открытый канал, через который подается проволока.
4. Упаковка пучка волокон
ПРИМЕЧАНИЕ: Выполнение этого шага занимает около 30 минут. Завершите этот этап для электродов, используемых на животных моделях с толстым слоем pia mater. Укрепите пучок волокон, чтобы свести к минимуму изгиб. В процедурах с помощью мыши этот шаг может отсутствовать.
- Соберите пучок волокон вместе в один вал, используя натяжение воды. Используйте передаточную пипетку, чтобы пропустить каплю воды от кончика воронки к наконечнику пучка, в то время как электрод закреплен вертикально в тиски.
- Начните с нанесения слоя зубного цемента толщиной около 1,5 мм вокруг пучка на кончике воронки. Вылечите зубной цемент с помощью 20 с ультрафиолетового света.
ПРИМЕЧАНИЕ: Для корковых записей дополнительная упаковка не требуется. Для более глубоких областей мозга закрепите направляющую трубку вокруг пучка. - Конструкция направляющей трубки и вставка пучка в направляющую трубку
- Измерьте и отрежьте нужную длину полиимидных трубок. Убедитесь, что длина полиимидных трубок оставляет 2 мм наконечников из углеродного волокна свободными. Измерьте и вырежьте кусок металлической трубки весом 30 Г на 2 мм короче, чем полиимидная трубка. Используйте вращающийся инструмент, чтобы удалить любые острые края на металлической трубке. Вставьте полиимидную трубку внутрь металлической трубки.
- Поместите электрод в тиски со пучком углеродного волокна, направленным вверх. Закрепите собранную трубку на микроманипуляторе и с помощью микроскопа осторожно опустите ее над пучком волокон. Закрепите трубку на существующей зубной цементной основе с помощью дополнительного слоя зубного цемента. Вылечите зубной цемент с помощью 20 с ультрафиолетового света.
ПРИМЕЧАНИЕ: Здесь процесс строительства можно приостановить.
5. Подготовка наконечника электрода
ПРИМЕЧАНИЕ: Выполнение этого шага занимает приблизительно 30 минут на массив.
- Нарежьте электроды на нужную длину.
- При подготовке к резке наконечника электрода сложите липкие заметки, чтобы построить платформу высотой около 1,5 мм. Измерьте от края платформы нужную длину электрода и отметьте это расстояние. Платформа будет выступать в качестве направляющей для резки.
- Опустите электрод в стакан с деионизированной или дистиллированной водой до тех пор, пока кончик воронки не будет полностью погружен, сначала наконечник и удерживается нормально на поверхности. Соберите отдельные углеродные волокна вместе, извлекая электрод из воды. Поверхностное натяжение объединит пучок (пучки) вместе. Дайте электроду высохнуть на воздухе в течение 30 минут.
- Прикрепите лезвие скальпеля No10 к рукоятке. Заморозьте скальпель и электрод, поместив их в морозильную камеру при температуре -18 °C не менее чем на 5 мин.
- Уложите электрод так, чтобы волокна лежали заподлицо на поверхности направляющей (подготовленной на этапе 5.1.1). Отрежьте волокна до нужной длины скальпелем, используя качающееся движение. Выполните этот шаг быстро, чтобы убедиться, что электрод и скальпель все еще заморожены (см. Рисунок 3G).
- Впрыскивайте положительный ток для уменьшения импеданса наконечников электродов.
- Прикрепите электрод к многоэлектродному тестеру импеданса с помощью соответствующего адаптера (см. Таблицу материалов). Нижний наконечник электрода ~2 мм в микроцентрифужную трубку из 0,1 М фосфат-буферного физиологического раствора (PBS). Вставьте заземляющий провод в трубку микроцентрифуги.
- Впрыск тока с выбранной амплитудой и длительностью.
ПРИМЕЧАНИЕ: Этот шаг предназначен для уменьшения значений импеданса на кончике CFEA. В данном исследовании в графический интерфейс гальванического программного обеспечения были введены следующие параметры: Ток: 0,100 мкА; Длительность: 10 с; Пауза: 1 с. Этот процесс может быть повторен по мере необходимости для каждого канала до тех пор, пока импедансы электродов не достигнут желаемых значений (см. Рисунок 4C). - Как только значения импеданса будут желаемыми, промойте волокна в деионизированной или дистиллированной воде для очистки.
- Гальваническая пластина в растворе золотого покрытия.
ПРИМЕЧАНИЕ: Этот шаг должен быть сделан незадолго до имплантации (в тот же день).
ВНИМАНИЕ: Некоторые химические вещества, используемые при приготовлении наконечников CFEA, являются коррозионными, включая раствор для позолочения. Проконсультируйтесь с SDS перед использованием и определите соответствующие меры предосторожности, которые необходимо принять для безопасного обращения с раствором.
ПРИМЕЧАНИЕ: Для обеспечения жесткости пучка волокон пользователь может создать раствор для золотого покрытия путем первого солюбилизации PEG8000 в деионизированной или дистиллированной воде при 1 мг/мл. Затем смешайте 625 мкл солюбилизированного ПЭГ8000 и 375 мкл золотого раствора и вихревого раствора в течение 10 с для смешивания. PEG8000 растворяется после введения волокон в мозг.- Опустите наконечник пучка электрода ~2 мм в микроцентрифужную трубку гальванической смеси. Вставьте заземляющий провод в трубку микроцентрифуги.
- Задайте соответствующие параметры для гальванического покрытия. В данном исследовании в графический интерфейс гальванического программного обеспечения были введены следующие параметры: Ток: -0,05 мкА; Длительность: 30 с; Пауза: 5 с.
- Тщательно промойте волокна деионизированной или дистиллированной водой. В это время при желании снова измерьте значения импеданса.
6. Введение в мозг: хирургия выживания,мышиная (Mus musculus)и хирургия без выживания, хорек(Mustela putorius furo)
ПРИМЕЧАНИЕ: Хирургические процедуры должны следовать стандартному протоколу в соответствии с IACUC. Для получения подробной информации см. Ma et al.22 для протокола операции выживания и Popovic et al.23 для протокола хирургии без выживания. Следуйте асептическим хирургическим процедурам в соответствии с руководящими принципами ASC для хирургии выживания у видов грызунов. К ним относятся автоклавирование всех хирургических инструментов и материалов при 135 °C в течение 15 мин и обработка стереотаксического аппарата и хирургической области 70% этанолом. Используйте стерильные хирургические перчатки, одноразовый халат и маску для лица во время процедуры.
- Хирургия выживания, мышь (Mus musculus).
- Обезболивают мышей 2,5% изофлурана в индукционной коробке в течение ~1 мин, пока частота дыхания не достигнет 55-65 вдохов/мин. Затем вводят 2,0% изофлурана через носовой конус для поддержания анестезии. Нанесите ветеринарную мазь на оба глаза, чтобы предотвратить повреждение роговицы. Выполните защемление пальца ноги, чтобы убедиться в правильной степени анестезии.
- После проверки следуйте процедурам хирургии выживания, описанным в Ma et al.22. Контролируйте частоту дыхания и поддерживайте ее на уровне 60 вдохов/мин. Поддерживайте температуру тела на уровне 37 °C с помощью термостатически управляемой грелки. См. шаги 6.3-6.5 (подробно описано ниже) для получения инструкций по подготовке черепа к трепанации черепа, дуротомии и имплантации электродов.
- После операции верните мышей в восстановительную клетку, оснащенную грелкой 37 °C, изолированной от других животных.
- Закройте хирургические раны антибиотической мазью. Наблюдайте за животными до тех пор, пока они не придут в достаточное сознание, чтобы поддерживать стерну и позволить им восстановиться в течение 2-5-дневного периода. Размещайте их поодиночке и постоянно следите за признаками инфекции или дискомфорта. Давайте животным одну дозу бупренорфина 72 ч пролонгированного высвобождения (0,5-1,0 мг/кг) в день операции в качестве анальгетика.
- Хирургия, не выживающая, хорек (Mustela putorius furo)
- Обезболивают хорька сначала кетамином (20 мг/кг, т.m.), а затем проветривают 1,0%-2,0% изофлурана в смеси закиси азота и кислорода 2:1 через маску. Выполните защемление пальца ноги, чтобы убедиться в правильной степени анестезии.
- После проверки следуйте хирургическим процедурам, не связанным с выживанием, описанным в Popovic et al.23. Выполняют трахеостомию и проветривают животных 1,0%-2,0% изофлурана в смеси закиси азота и кислорода 2:1. Нанесите ветеринарную мазь на оба глаза, чтобы предотвратить повреждение роговицы.
- Поддерживайте температуру тела на уровне 37 °C с помощью термостатически управляемой грелки. Контролируйте частоту сердечных сокращений, конечные приливные уровни CO2 и частоту дыхания. Держите частоту дыхания в пределах соответствующего физиологического диапазона (3,5%-4,0%). См. шаги 6.3-6.5 (подробно описано ниже) для получения инструкций по подготовке черепа к трепанации черепа, дуротомии и имплантации электродов.
- Постоянно контролируйте ЭКГ животного, чтобы обеспечить адекватную анестезию и увеличить процент изофлурана, если ЭКГ указывает на какой-либо дистресс.
- По завершении эксперимента вводят хорьку 1 мл пентобарбитала натрия и фенитоина натрия и контролируют до тех пор, пока частота сердечных сокращений и конечный прилив CO2 не будут измерять 0.
- Подготовка черепа
- Используя сверло 0,8 мм, просверлите одну трепанацию черепа 4 мм х 4 мм в нужном месте для имплантации. Для мыши просверлите дополнительное отверстие для заусенцев в контралатеральном месте для вставки винта из нержавеющей стали.
ПРИМЕЧАНИЕ: Не выполняйте дуротомию до тех пор, пока электрод не будет готов к имплантации. - Установите основание/ссылку. В экспериментах с острыми хорьками используйте иглу 18 G, чтобы проткнуть кожу и слой мышц, окружающий череп на стороне головы животного, противоположной трепанации черепа. Вставьте проволочный конец опорного электрода Ag/Cl в кончик иглы, а затем втяните иглу из мышцы/кожи так, чтобы гранула теперь надежно сидела между мышцей и черепом. В мыши оберните серебристый заземляющий провод вокруг заземляющего винта из нержавеющей стали. Защита зубным цементом, отверждаемым УФ-излучением.
- Прикрепите электрод к держателю электрода с помощью тонкой полоски этикетировочной ленты и закрепите держатель электрода в микроманипуляторе. Прикрепите заземляющий провод к источнику заземления с помощью зажима аллигатора. Прикрепите опорный провод к опорному электроду, встроенному в мышцу животного.
- Используя сверло 0,8 мм, просверлите одну трепанацию черепа 4 мм х 4 мм в нужном месте для имплантации. Для мыши просверлите дополнительное отверстие для заусенцев в контралатеральном месте для вставки винта из нержавеющей стали.
- Дуротомия и проникновение пиа
- Удалите твердую мозговую оболочку из трепанации черепа с помощью твердой мозговой оболочки.
- Создайте небольшое отверстие в пиа. Для этого вставляют и вынимают металлический микроэлектрод (рекомендуется в хорьке). В качестве альтернативы, опустите CFEA ортогонально к поверхности мозга, чтобы избежать каких-либо сосудов. Как только это местоположение будет определено, поднимите электрод и осторожно проткните поверхность мозга в этом месте с помощью твердой мозговой оболочки, потянув вверх киркой (рекомендуется для мыши).
- Имплантация электродов
- Опустите наконечник электрода в то же место и в тонком режиме начните загонять электрод в мозг со скоростью ~ 2 мкм / с. Используйте микроскоп, чтобы убедиться, что электрод входит плавно и не сгибается.
ПРИМЕЧАНИЕ: Если электрод не входит плавно, поднимите его из мозга и отрегулируйте угол. Если он продолжает изгибаться, не входя плавно, скорректируйте местоположение и повторите процесс прокола поверхности мозга для нового места входа. - Выполните хроническую и острую имплантацию, используя следующие этапы.
- Для хронической имплантации: Цементируйте электрод на месте с помощью зубного цемента, отверждаемого УФ-излучением.
- Закройте разрез с помощью 5-0 хирургических швов и постройте головную чашечку.
- Чтобы создать головной колпачок, добавьте дополнительный зубной цемент вокруг места имплантации. Убедитесь, что нос джига закрыт.
- Потяните кожу вверх и вокруг головного убора. Зашить разрез за головным колпачком 5-0 хирургическими швами.
- Применяют лидокаиновый крем и антибиотическую мазь.
- Прекратите прием анестетика и следуйте стандартным восстановительным процедурам.
- Для острой имплантации: после опускания электрода и достижения желаемой глубины подождите не менее 30 минут, прежде чем начать электрофизиологическую запись, чтобы электрод освоился на месте.
- Для хронической имплантации: Цементируйте электрод на месте с помощью зубного цемента, отверждаемого УФ-излучением.
- Опустите наконечник электрода в то же место и в тонком режиме начните загонять электрод в мозг со скоростью ~ 2 мкм / с. Используйте микроскоп, чтобы убедиться, что электрод входит плавно и не сгибается.
Результаты
С завершением этого протокола будут возможны стабильные записи одноблочной пиковой активности. Эти микроэлектродные массивы настраиваются по материалу, количеству каналов и адаптеру headstage в зависимости от потребностей исследователя. Гальваническое покрытие волокон золотом приводит к снижению импедансов, пригодных для записи(рисунок 4 и рисунок 5). Если пользователь намерен записывать хронически, измерения могут быть сделаны после того, как животное оправилось от хирургической процедуры. Хронические процедуры привели к стабильным записям в течение не менее 120 дней. Репрезентативная запись показана на рисунке 6,иллюстрирующем стабильную 64-канальную электрофизиологическую активность в ретросплениальной коре свободно ведущего себя взрослого самца мыши. Если предполагается острая подготовка, запись может начаться вскоре после имплантации (~ 30 мин). Это даст время электроду осесть в мозге. На рисунке 7 приведен репрезентативный пример острой 16-канальной записи CFEA, полученной из первичной зрительной коры взрослой самки хорька. Сортировка шипов у мышей и хорьков выполнялась с помощью программного обеспечения для сортировки шипов (см. Таблицу материалов).
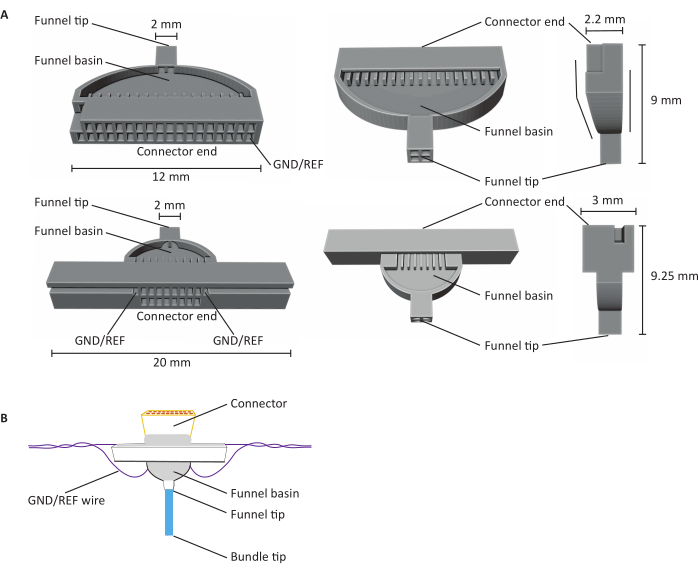
Рисунок 1:Анатомия 16- и 32-канальных микроэлектродных массивов углеродного волокна (CFEA). (A)Схемы 32-канальных (сверху) и 16-канальных (снизу) CFEA из трех различных видов. 16-канальный CFEA имеет расширенную конструкцию для целей обработки. 32-канальная конструкция имеет плоскую грань, которая позволяет комбинировать два джига для 64-канального CFEA. Обе диаграммы имеют идентифицирующие структуры, помеченные размерами. Конец разъема указывает местоположение вставки разъема, а каналы GND/REF указывают, где вставлен провод заземления. Воронкообразный бассейн относится к месту, через которое проходят волокна, чтобы быть наложенными УФ-светом отвержденным зубным цементом, а наконечник воронки означает место, откуда волокна выходят из джига. Наконечник воронки разделен на квадранты, чтобы свести к минимуму волокна, цепляющиеся вместе и создающие повреждение. Волокна позже втягиваются в один пучок с использованием зубного цемента. Джиги печатаются на 3D-принтерах с использованием смоляных принтеров SLA. Диаграммы увеличены, чтобы показать детали. (B) Построенный CFEA. Диаграмма имеет идентифицирующие структуры, помеченные метками. Синий наконечник пучка представляет собой сегмент углеродных волокон, которые получают регистрирующие измерения. Серый цвет в воронковом бассейне и вокруг соединителя указывает на зубной цемент, отвержденный ультрафиолетовым светом, который удерживает углеродные волокна на месте в воронковом бассейне и закрепляет соединитель с джигом. Фиолетовый провод представляет собой провод заземления. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
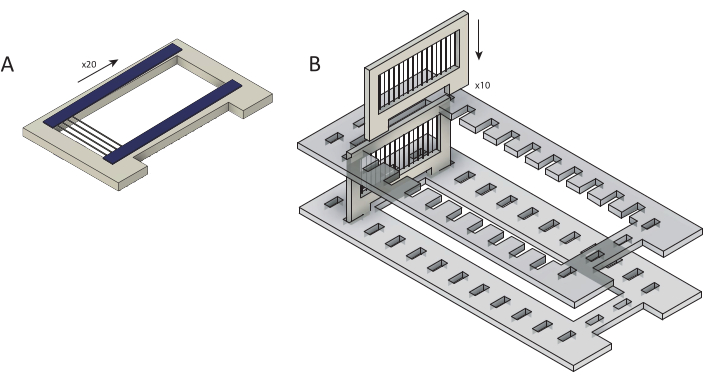
Рисунок 2:Загрузка необработанных углеродных волокон в кассеты для покрытия париленом С. (А)Углеродные волокна загружаются на картриджи, наложенные двумя полосками двусторонней ленты (синего цвета). Каждая кассета загружена ~25 волокнами. (B) Кассеты загружаются в держатель лазерной резки (серый) при подготовке к покрытию париленовым C. Каждый вмещает десять кассет. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
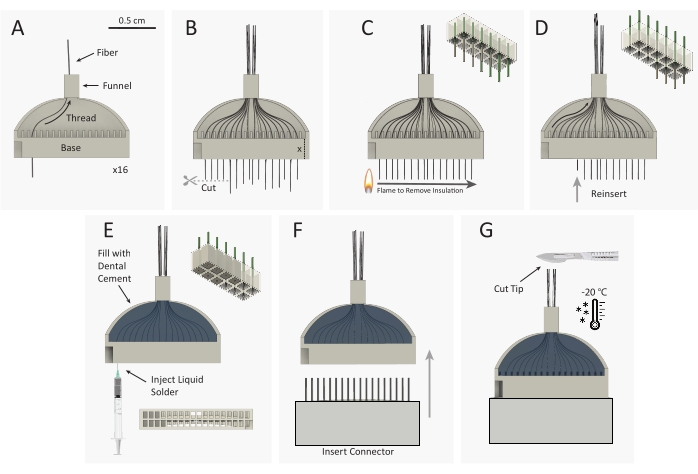
Рисунок 3:Схема построения пучка микроэлектродной решетки из углеродного волокна (CFEA). (A)16 отдельных углеродных волокон с покрытием (черный) продеты через 32-канальный 3D-печатный джиг (серый). (B)Наконечники из углеродного волокна разрезаются микроножными ножницами, оставляя избыток волокна, равный высоте основания джига, простираясь от основания джига. (C) Стандартная пластиковая зажигалка для искрового колеса быстро пропускается через избыточное волокно для удаления париленовой изоляции C. На схеме в правом верхнем углу показано удаление парилена из 9 из 12 волокон. (D) Волокна повторно вставляются в джиг до тех пор, пока конец волокна не будет заподлицо с основанием. На схеме в правом верхнем углу показана повторная вставка 9 волокон с неизолированными (серыми) наконечниками волокон, размещенными внутри основания джига. Затем джиг переворачивается, и шаги A-D повторяются, чтобы протянуть противоположные 16 каналов. (E) Джиг заполнен зубным цементом для закрепления волокон. Серебряный отпечаток впрыскивается в каждую лунку основания джига. (F) Штекерный разъем вставляется в основание джига. (G)CFEA и скальпель замораживают в морозильной камере при температуре -20 °C. Наконечник массива разрезается на нужную длину, оставляя 32 ровных волокна. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
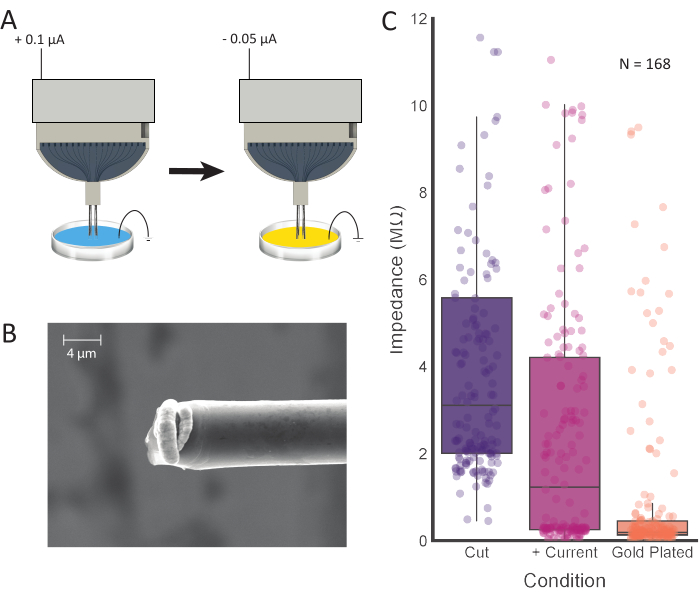
Рисунок 4:Обработка наконечника и гальваническое покрытие. (A)Наконечники электродов сначала помещаются в 0,1 М PBS, где ток пропускается через каждый электрод. Затем наконечники промывают и переносят в позолоченный раствор, где они гальванизируются током. (B) SEM изображения подготовленного углеродного волокна показывают раствор золотого покрытия, сконцентрированный на кончике. Шкала представляет собой значения импеданса 4 мкм.(C)из 168 каналов после первоначальной резки (фиолетовый; 3,11 МОм ± 0,42 МОм, медиана ± SE, n = 168 волокон), впрыска положительного тока (розовый; 1,23 МОм ± 0,36 МОм, медиана ± SE, n = 168 волокон) и гальваническое покрытие (оранжевый; 0,19 МОм ± 0,15 МОм, медиана ± SE, n = 168 волокон) показывают снижение значений импеданса после каждого этапа обработки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Средняя продолжительность гальванического покрытия золота производит небольшие, округлые отложения на кончиках пучков углеродного волокна. Все наконечники из углеродного волокна из разных микроэлектродных массивов, отражающих различную продолжительность впрыскиваемого тока для уменьшения импеданса или позолочения. Изображения дополнительно изображают покрытие parylene C, которое изолирует углеродные волокна и предотвращает любое получение сигнала из места, отличного от кончиков волокон. (A) Сканирующая электронная микроскопия изображения кончиков углеродного волокна после замораживания и выполнения одного разреза лезвием бритвы. Шкала слитков представляет собой 10 мкм. (B) То же, что и A, но затем с последующим впрыском положительного тока в течение 10 с. (C) То же самое, что B, но затем гальванизированное золотом в течение 5 с. (D) То же самое, что B, но затем гальванизированное золотом в течение 15 с. (E) То же самое, что B, но затем гальванизированное золотом в течение 30 с. (F) То же самое, что B, но затем гальванизированное золотом в течение 120 с. Мы обнаружили, что гальваническое покрытие в течение 30 с при токе -0,05 мкА было оптимальным для электрофизиологических записей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
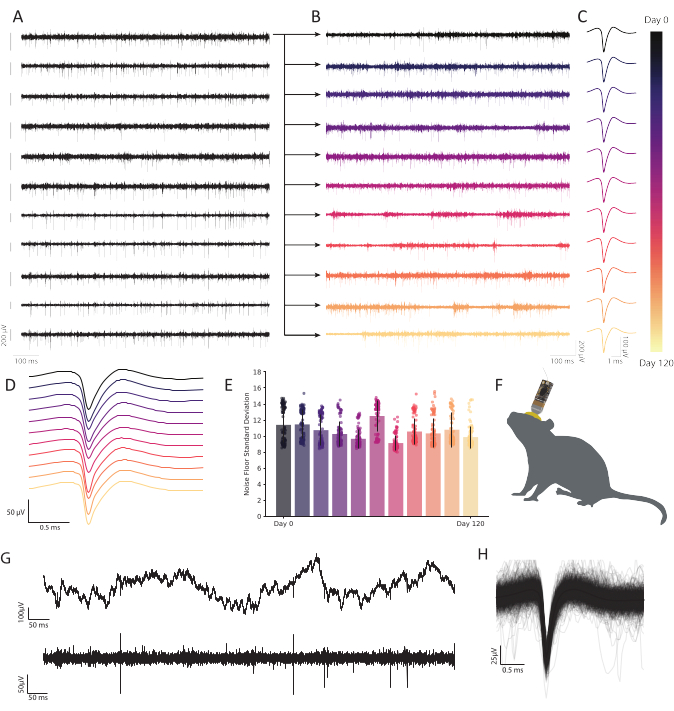
Рисунок 6:Хронические внеклеточные записи в свободно ведущей себя ретросплениальной коре мыши с микроэлектродными массивами углеродного волокна показывают стойкую, стабильную нейронную активность. (A)Одиннадцать следов полосатого напряжения были зарегистрированы одновременно. Последующие следы, записанные с первого канала (верхний ряд), отображаются в B, чтобы показать долговечность во времени. Остальные десять строк демонстрируют согласованность качества записи и показывают надежную активность по всему массиву. Шкала слева от каждого следа представляет потенциал 200 мкВ. (B)Полосовые данные из того же волокна, что и в верхней трассе в A, расширены, чтобы показать надежную активность в течение 120-дневной непрерывной записи. (C)Кластеризация показывает надежное обнаружение одного блока в течение нескольких месяцев. Следы представляют собой среднюю форму сигнала непрерывно наблюдаемой репрезентативной единицы в течение 120 дней, извлеченную из волокна, построенного в B в каждой точке времени. (D) Средние, ненормализованные формы сигналов шипов от C, сложенные для демонстрации согласованности с течением времени. (E)Записи из углеродного волокна демонстрируют стабильный уровень шума в течение многих месяцев. Стандартное отклонение уровня шума (след минус пиковая активность) в B не показывает прогрессивного изменения шума. Бары представляют собой среднее загрязнение. Полосы погрешностей представляют стандартное отклонение. (F)Масштабный рисунок мыши с хронически имплантированным CFEA и головной стадией. (G) След необработанного напряжения (сверху) через 11 месяцев после имплантации показывает надежный LFP. Ленточный след напряжения (внизу) показывает устойчивую нейронную активность. (H)Средняя форма спайкового волна нейрона, записанная на волокне от C, подкрепляемая первыми 1000 случаями всплесков активности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7:Записи микроэлектродной решетки углеродного волокна (CFEA) из первичной зрительной коры хорька. (A) Формы сигналов шипов, отсортированных одиночных единиц, записанных с 16-канального CFEA. Потенциалы действия отдельных нейронов часто были очевидны на нескольких каналах при слегка отличающихся амплитудах. (B) Кривые настройки направления от выбранных нейронов. Цвета соответствуют записанным единицам измерения в A. Стрелки указывают направление движения стимула. Шкалы шкалы указывают на частоту ответов. Полосы ошибок указывают на средний ответ со стандартной ошибкой. Горизонтальная пунктирная линия представляет спонтанную скорость срабатывания той же ячейки во время воздействия пустого экрана. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот протокол описывает каждый шаг, необходимый для построения функционального CFEA как для острого, так и для хронического использования. Описанный процесс настраивается в соответствии с потребностями исследователя, что делает его доступным и недорогим вариантом для мониторинга отдельных нейронов в течение нескольких месяцев. Протокол демонстрирует возможность регистрации как надежной одиночной активности в течение нескольких минут после имплантации у анестезированного животного, так и в течение четырех месяцев у бодрствующего, ведущего себя животного, иллюстрируя потенциал этих CFEA для изучения краткосрочных и долгосрочных изменений в нейронных реакциях.
Этапы описанного протокола были тщательно протестированы и улучшены с течением времени, чтобы получить эффективную процедуру, которая может быть завершена быстро, при низких предельных затратах (< 100,00 долларов США), с возможностью записи однозначных одиночных единиц, плотно и стабильно в течение нескольких месяцев. Этапы строительства могут быть завершены менее чем за один день и будут производить электрофизиологические сигналы, сопоставимые с любым ведущим коммерческим массивом. CFEA также имеют гораздо меньшую площадь (16-канальный пучок волокон имеет диаметр ~26 мкм), чем аналогичные коммерческие массивы, а их биосовместимость делает их пригодными для длительногоиспользования13. Важно отметить, что существует несколько критических шагов и инструкций, которым необходимо следовать, чтобы создать функционирующий CFEA с сопоставимой производительностью.
Из-за хрупкости углеродных волокон с ними необходимо обращаться с максимальной осторожностью. Обращение с ними острыми щипцами или другими инструментами может привести к поломке волокон. Кроме того, важно построить CFEA в пространстве с ограниченным движением воздуха, чтобы волокна не сдувались. При воспламенении задней части волокон зажигалку нужно только перемещать движением вперед-назад очень коротко, примерно на 1 с. Этапы, следующие за этим удалением изоляции, имеют решающее значение для строительства электрода с рабочими каналами. Горючие наконечники должны подаваться в джиг без какого-либо дополнительного контакта. Затем при заполнении тазика зубным цементом важно, чтобы цемент аккуратно нанес и полностью заполнил каналы и воронкообразный таз, закрыв отверстия без их заполнения. Затем зубной цемент должен быть полностью отвержден ультрафиолетовым светом, прежде чем продолжить. Как только это будет завершено, серебряная краска должна быть введена в каждый канал до полного заполнения, но не выплескивания. Это самый изменчивый шаг в процессе. Любое чрезмерное заполнение может привести к перекрестным помехам между каналами, а недостаточное заполнение может привести к сбою соединения. Если невозможно ввести серебряную краску с помощью иглы 25 Г, вполне вероятно, что раствор слишком вязкий и, в этом случае, небольшое количество разбавителя краски может быть добавлено для создания более жидкого раствора. После того, как все каналы заполнены, и разъем головной ступени вставлен, важно дать массиву отверждаться в течение 24 часов, прежде чем закрепить соединитель зубным цементом. Мы обнаружили, что неспособность сделать это снизила количество подключенных каналов. Применение большого количества зубного цемента также важно, чтобы разъем не отключался при сопряжении с системой сбора сигнала. Если они отсоединяются, можно попытаться повторно соединиться с повторным заполнением каналов серебряной краской, но пользователь должен проверить значения импеданса CFEA для оценки количества подключенных каналов. Позволяя зубному цементу отверждаться в течение ночи, также служит для предотвращения потенциального отслоения.
Измерение импеданса электрода обеспечит точную оценку подключенных каналов. Это можно сделать после погружения заземляющих и опорных проводов и наконечников из углеродного волокна в PBS. Мы заметили, что высокое сопротивление (>15 МОм) указывает на открытый, неподключенный канал. До впрыска тока и гальванического покрытия подключенный канал может иметь диапазон значений импеданса, которые должны значительно уменьшаться при этом процессе. Среднее количество подключенных каналов (импеданс < 4 МОм после впрыска тока) на 16-канальный электрод составило 12,96 ± 2,74 (среднее ± SD; N = 48 электродов). Было протестировано несколько раз гальванического покрытия, и 30 с произвели превосходную изоляцию сигнала между регистрирующими сайтами(рисунок 5). Хотя было хорошо установлено, что PEDOT-pTS12,24, 25,26 и PEDOT-TFB21 обеспечивают надежные варианты подготовки участков регистрации углеродного волокна, мы обнаружили, что покрытие золотом, проверенный и надежный метод гальванического покрытия электродов для хронической имплантации27,28 , увеличивал легкость имплантации и предотвращал слипание наконечников электродов. При получении конечных значений импеданса менее 0,2 МОм в среднем этот метод оказывается сопоставимым со значениями, достигнутыми с использованием PEDOT-TFB21 и PEDOT-pTS26.
При имплантации микроэлектродного массива важно визуально следить за введением наконечников из углеродного волокна под микроскопом. Успешное введение должно быть очевидным, без изгиба волокон. Если волокна кажутся изгибающимися, маловероятно, что они успешно попадут в мозг. В этом случае угол наклона зонда должен быть скорректирован для второй попытки. Этот процесс может продолжаться до тех пор, пока установка зонда не будет успешной. Как только электрод окажется на нужной глубине, мы обнаружили, что ожидание не менее 30 минут позволит зонду освоиться для оптимального получения сигнала (острые записи).
Описанные CFEA, в дополнение к их небольшой занимаемой площади и биосовместимости, предлагают надежную, настраиваемую альтернативу коммерческим массивам из-за их простоты конструкции и низкой стоимости. Самым большим ограничением для CFEA, подробно описанных в этом протоколе, является их масштабируемость. Из-за ручного характера их конструкции масштабирование до проектов с сотнями сайтов записи может быть непрактичным. Кроме того, достижения в изготовлении микроэлектродных массивов с использованием нанотехнологий позволят проводить более масштабные записи населения, чем методы, описанные здесь. Тем не менее, этот протокол обеспечивает доступность CFEA для лабораторий, заинтересованных в настольном изготовлении электродов из углеродного волокна. Мы не наблюдали потери стабильности или снижения надежности амплитуды шипов в течение 120-дневных хронических экспериментов, о чем свидетельствует репрезентативный единый канал, типичный для наших наблюдений на этой шкалевремени (рисунок 6A-E). Кроме того, CFEA показывают способность к постоянной одноблочной активности, поскольку четыре отдельных единицы оставались различимыми через 11 месяцев после имплантации в мышь(рисунок 6G,H). Также можно получить стабильные, одноблочные записи остро(рисунок 7),что дает преимущество перед многими другими коммерческими электродами для изучения одиночных нейронов в течение коротких периодов времени. В будущем разработка таких гибких, биосовместимых зондов с минимальными диаметрами позволит изучать сложные процессы. Эти инструменты обеспечат существенную полезность в развитии нейронных технологий, включая приложения в интерфейсах мозг-машина (ИМТ), которые требуют непрерывной, долгосрочной стабильности29.
Раскрытие информации
Авторы заявляют об отсутствии финансовых конфликтов интересов.
Благодарности
Мы хотели бы поблагодарить Грега Гитчунтса за руководство проектированием и строительством электродов и Тима Гарднера за открытие своей лаборатории и объектов для нас. Мы хотели бы поблагодарить Кристоса Михаса за его помощь в использовании PDS на базовом объекте Bio-Interface and Technology, а также Нила Риттера, Джона Спайреаса и Дэвида Ландесмана за их помощь в разработке ранних версий 16-канального джига. Мы хотели бы поблагодарить Тима Кавано за его помощь в визуализации SEM в Центре наноразмерных систем Гарварда в Гарварде.
Материалы
| Name | Company | Catalog Number | Comments |
| #10 scalpel blade | Fisher Scientific | 14-840-15 | Building tool |
| 16-channel CFEA Jig | Realize Inc. | CFMA component | |
| 16-channel Omnetics connector | Omnetics | A79014-001 | CFMA component |
| 25 G needle | Fisher Scientific | 14-840-84 | Building tool - sharp-tipped |
| 30 G needle | Fisher Scientific | 14-841-03 | Building tool |
| 31 G stainless steel 304 hypodermic round tubing | Small Parts Inc | B000FMYN38 | For guide tube |
| 32-channel CFEA jig | Realize Inc. | CFMA component | |
| 32-channel Omnetics connector | Omnetics | A79022-001 | CFMA component |
| 6 in cotton tip applicators | Fisher Scientific | 22-363-156 | Building tool |
| Acetone | Fisher Scientific | A16P4 | Building tool |
| AutoCad 3D printing software | Autodesk | Computer-aided design tool/ 3D modeling software | |
| Autodesk Fusion 360 | Autodesk | Computer-aided design tool/ 3D modeling software | |
| BD disposable syringes | Fisher Scientific | 14-823-30 | 1 mL |
| Carbon fibers | Good Fellow USA | C 005725 | 7 μm epoxy sized |
| Cassettes and cassette holder | For coating fibers | ||
| Clear tape | Scotch | For coating raw fibers | |
| Deionized water | Electroplating component | ||
| Double-sided tape | Scotch | For coating raw fibers | |
| Flowable Dental Composite | Pentron | Flow-It ALC | CFMA component/ UV cured dental cement |
| Gold plating solution | Sifco ASC | 5355 | 10.0-20.0% glycerol, 1.0-5.0% ethylenediamine, 1.0-5.0% acetic acid (ethylenedinitrilo)tetra-, dipotassium salt, 5.0-10.0% butanoic acid, mercapto-monogold(1+) sodium salt, 1.0–5.0% potassium metabisulfite, 55.0-82.0% water |
| Jewelry clamp | Amazon | B00GRABH9K | Building tool |
| JRClust | Ferret spike sorting software | ||
| Lighter | BIC | LCP62DC | Building tool |
| Micromanipulator | Scientifica | PS-7000C | For guide tube |
| Microscissors | Fisher Scientific | 08-953-1B | Building tool |
| MountainSort | Mouse spike sorting software | ||
| NanoZ 16-channel adapter | Multi-channel systems | ADPT-nanoZ-NN-16 | Electroplating component |
| NanoZ 32-channel adapter | White Matter | NZA-OMN-32 rev A | Electroplating component |
| NanoZ multi-electrode impedance tester | White Matter | Electroplating component | |
| Parafilm | Fisher Stockroom | 13-374-10 | Semi-transparent, flexible film with adhesive properties |
| Parylene 'C' Dimer | Specialty Coating Systems | 980130-C-01LBE | For coating raw fibers |
| PEG 8000 | Fisher Scientific | 25322-68-3 | Electroplating component |
| Phosphate-buffered saline | Electroplating component | ||
| Polyimide tubing | MicroLumen | BRAUNI001 | For guide tube |
| Rotary tool | Dremel | 300124 | For guide tube |
| Scalpel handle | Fine Science Tools | 10003-12 | Building tool |
| Silver conductive coating | MG Chemicals | 842AR Super Shield | CFMA component |
| Stereo microscope with range 6.7:1 | Motic | SMZ-168 | Building tool |
| Sticky notes | Post-it | Building tool | |
| Tissue wipes | Kimtech Science | 34155 | Building tool |
| Tungsten wire | A-M Systems | 797550 | CFMA component |
| UV curing wand | Woodpecker | Building tool | |
| Vacuum deposition chamber | Specialty Coating Systems | Labcoter 2 (PDS 2010) |
Ссылки
- Galvani, L. . De viribus electricitatis in motu musculari commentarius. , (1791).
- Buzsaki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature reviews. Neuroscience. 13 (6), 407-420 (2012).
- Ledochowitsch, P., et al. On the correspondence of electrical and optical physiology in in vivo population-scale two-photon calcium imaging. bioRxiv. , 800102 (2019).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Seymour, J. P., Wu, F., Wise, K. D., Yoon, E. State-of-the-art MEMS and microsystem tools for brain research. Microsystems and Nanoengineering. 3 (1), 16066 (2017).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nature reviews. Neuroscience. 9 (3), 195-205 (2008).
- Hong, G., Lieber, C. M. Novel electrode technologies for neural recordings. Nature reviews. Neuroscience. 20 (6), 330-345 (2019).
- Chung, J. E., et al. High-density, long-lasting, and multi-region electrophysiological recordings using polymer electrode arrays. Neuron. 101 (1), 21-31 (2019).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Kozai, T. D., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chemical Neuroscience. 6 (1), 48-67 (2015).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Kozai, T. D., et al. Ultrasmall implantable composite microelectrodes with bioactive surfaces for chronic neural interfaces. Nature Materials. 11 (12), 1065-1073 (2012).
- Chen, R., Canales, A., Anikeeva, P. Neural recording and modulation technologies. Nature Reviews Materials. 2 (2), 16093 (2017).
- Szostak, K. M., Grand, L., Constandinou, T. G. Neural interfaces for intracortical recording: requirements, fabrication methods, and characteristics. Frontiers in Neuroscience. 11, 665 (2017).
- Subbaroyan, J., Martin, D. C., Kipke, D. R. A finite-element model of the mechanical effects of implantable microelectrodes in the cerebral cortex. Journal of Neural Engineering. 2 (4), 103-113 (2005).
- Park, S., et al. One-step optogenetics with multifunctional flexible polymer fibers. Nature Neuroscience. 20 (4), 612-619 (2017).
- Guo, Y., et al. Polymer composite with carbon nanofibers aligned during thermal drawing as a microelectrode for chronic neural interfaces. ACS Nano. 11 (7), 6574-6585 (2017).
- Armstrong-James, M., Millar, J. Carbon fibre microelectrodes. Journal of Neuroscience Methods. 1 (3), 279-287 (1979).
- Garris, P. A., Ciolkowski, E. L., Pastore, P., Wightman, R. M. Efflux of dopamine from the synaptic cleft in the nucleus accumbens of the rat brain. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 14 (10), 6084-6093 (1994).
- Guitchounts, G., Markowitz, J. E., Liberti, W. A., Gardner, T. J. A carbon-fiber electrode array for long-term neural recording. Journal of Neural Engineering. 10 (4), 046016 (2013).
- Guitchounts, G., Cox, D. 64-channel carbon fiber electrode arrays for chronic electrophysiology. Scientific Reports. 10 (1), 3830 (2020).
- Ma, Z., Turrigiano, G. G., Wessel, R., Hengen, K. B. Cortical circuit dynamics are homeostatically tuned to criticality in vivo. Neuron. 104 (4), 655-664 (2019).
- Popovic, M., et al. Development of cross-orientation suppression and size tuning and the role of experience. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 38 (11), 2656-2670 (2018).
- Patel, P. R., et al. Chronic in vivo stability assessment of carbon fiber microelectrode arrays. Journal of Neural Engineering. 13 (6), 066002 (2016).
- Welle, E. J., et al. Ultra-small carbon fiber electrode recording site optimization and improved in vivo chronic recording yield. Journal of Neural Engineering. 17 (2), 026037 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. Journal of Neural Engineering. 12 (4), 046009 (2015).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating low-impedance tetrodes by electroplating with additives. Sensors and Actuators. A, Physical. 156 (2), 388-393 (2009).
- Vafaiee, M., Vossoughi, M., Mohammadpour, R., Sasanpour, P. Gold-plated electrode with high scratch strength for electrophysiological recordings. Scientific Reports. 9 (1), 2985 (2019).
- Lebedev, M. A., Nicolelis, M. A. Brain-machine interfaces: From basic science to neuroprostheses and neurorehabilitation. Physiological Reviews. 97 (2), 767-837 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены