Method Article
מאכיל מיקרו-תפוקה גבוהה לבדיקה לכימות הצריכה בדרוסופילה
In This Article
Summary
מאכיל המיקרו-לוח מציע שיטה חסכונית ובעלת תפוקה גבוהה לכימות צריכת מזון נוזלי בדרוזופילה. התקן מודפס בתלת-ממד מחבר מיקרו-לוחית בעלת 96 באר שבה זבובים שוכנים למיקרו-לוחית בעלת 1536 בארות שממנה זבובים צורכים תמיסת הזנה עם צבע מעקב. ירידת נפח הפתרון נמדדת באופן ספקטרופוטומטרי.
Abstract
כימות צריכת המזון בדרוסופילה משמש לחקר היסודות הגנטיים והפיזיולוגיים של תכונות הקשורות לצריכה, הגורמים הסביבתיים שלהם, ואת ההשפעות טוקסיקולוגיות ופרמקולוגיות של חומרים רבים. מעט שיטות המיושמות כיום מקובלות על מדידת תפוקה גבוהה. מאכיל המיקרופלסטים Assay (MFA) פותח לכימות צריכת מזון נוזלי לזבובים בודדים באמצעות ספיגה. ב-assay זה, זבובים צורכים מזון נוזלי בינוני מבארות נבחרות של מיקרו-לוח 1536-well. על ידי שילוב צבע מעקב מדלל לתוך מדיום המזון הנוזלי וטעינת נפח ידוע לתוך כל באר, מדידות ספיגה של הבאר שנרכשה לפני ואחרי הצריכה משקפות את השינוי הנובע בנפח (כלומר, נפח נצרך). כדי לאפשר ניתוח תפוקה גבוהה בשיטה זו, תוכנן מצמד מודפס בתלת-ממד המאפשר למיין זבובים בנפרד למיקרו-לוחות 96-well. מכשיר זה מכוון במדויק 96 ו 1536-היטב מיקרו-לוחות כדי לתת לכל זבוב גישה עד 4 בארות לצריכה, ובכך לאפשר כימות העדפת מזון בנוסף לצריכה רגילה. יתר על כן, המכשיר כולל רצועות מחסום המתעבורות בין עמדות פתוחות וסגורות כדי לאפשר בלימה מבוקרת ושחרור של עמוד דוגמאות בכל פעם. שיטה זו מאפשרת מדידות תפוקה גבוהה של צריכת פתרונות מימיים על ידי זבובים רבים בו זמנית. יש לו גם פוטנציאל להיות מותאם לחרקים אחרים ולמסנן את צריכת החומרים המזינים, הרעלים או התרופות.
Introduction
Drosophila melanogaster ראה שימוש נרחב כאורגניזם מודל גנטי כדי לחקור את היסודות הביולוגיים של צריכת מזון ותכונות הקשורות לצריכה1. ההערכה היא כי 65% מהגנים הגורמים למחלות אנושיות יש הומולוגים פונקציונליים בזבובים, כאשר חלק ניכר מאלה שבאים לידי ביטוי ברקמות שוות ערך מבחינה תפקודית בין זבובים לבני אדם2. יתר על כן, גודלו של D. melanogaster, זמן בין דורי קצר, תחזוקה פשוטה, ומתיחה גנטית לעשות את זה מודל אטרקטיבי עבור מחקרים על צריכת חומרים מזינים3,4 ואת ההשפעות טוקסיקולוגיות ופרמקולוגיות של מגוון רחב של חומרים, כולל קוטלי חרקים5, מזהמים6, תרופות7, ותרופות שלהתעללות 8,9,10.
במקרים רבים, לימוד תכונות כאלה דורש כימות מדויק של הצריכה. שיטות לכימות הצריכה הן מגוונות וכוללות את CApillary FEeder (CAFE)11,MAnual FEeding (MAFE)12, תגובתהרחבת Proboscis (PER)13, חילוץ צבע מעקב14,15, מיצוי מעקב אוליגונוקלאוטיד16,וחילוץ רדיו-איזוטופ5,17. המאמצים האחרונים התמקדו בשיפור התפוקה של התקפות אלה, כמו ב- Expresso assay18 או במערכת FLat האכלה מלאה מבוססת צלחת (WAFFL)19. למרות התועלת שלהם, בדיקות אלה יכולות להיות מסובכות, יקרות, או עבודה אינטנסיבית, לעכב את השימוש בהם במחקרים תפוקה גבוהה.
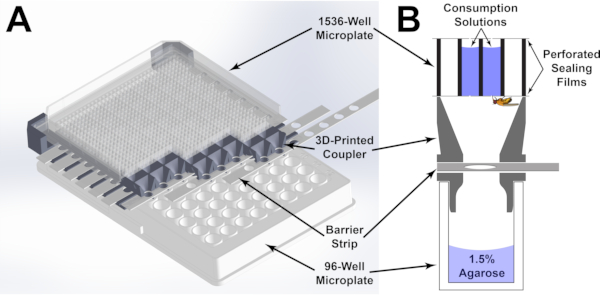
איור 1: רכיבים של מאכיל המיקרו-פלסטים . (A)עיבוד תלת-ממדי של מאכיל המיקרו-לוח המורכב. המיקרו-לוח בעל 1536 הבאר מכוון על ידי המצמד המודפס בתלת-ממד, כך שלכל באר של המיקרו-לוח התחתון בן 96 הבארות יש גישה לארבע בארות של המיקרו-לוח העליון בעל 1536 הבארות. ניתן לשלוט בגישה לבארות על ידי התאמת המיקום של רצועות המכשול המחורצות דרך המצמד. (B)ייצוג גרפי של כל באר של מאכיל המיקרו-לוח. פתרונות צריכה נשמרים בכל באר באמצעות סרט איטום שחורר כדי לאפשר גישה על ידי הזבוב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
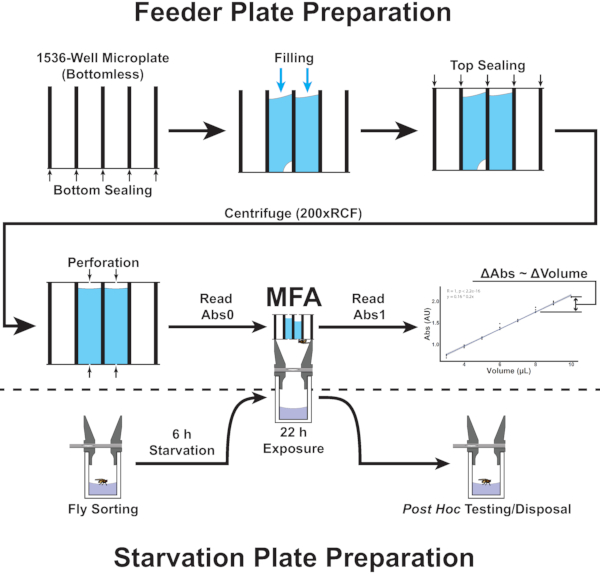
איור 2: סקירת הנהלים בבחאי מאכיל המיקרו-לוח. האיור מציג דיאגרמת זרימה התואמת לשלבים 4.1-5.8 של הפרוטוקול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כדי להתגבר על משוכות אלה, מאכיל מיקרו-פלסטיק אסאי (MFA; איור 1) פותח. במצב זה, זבובים שוכנים בנפרד במיקרו-לוחות 96-well. כל מיקרו-לוח מצמיד למיקרו-לוח 1536-well באמצעות התקן מותאם אישית בהדפסה תלת-ממדית. המכשיר מכוון במדויק את שתי הלוחות כך שלכל זבוב בבאר שלו של לוחית 96-well יש גישה ל -4 בארות של המיקרו-לוח 1536-well. באמצעות צלחת 1536-באר ללא תחתית וסרטי איטום, פתרונות מחולקים לבארות נבחרות ומחוררים עם מחטים מדויקות בקוטר 0.25 מ"מ כדי לספק גישה לזבובים. באופן קריטי, מתן אפשרות לצריכה ישירות ממיקרו-לוח מאפשר מדידות מבוססות ספיגה מיידיות באמצעות קורא מיקרו-לוח. צבע מעקב מדלל משולב במדיום הצריכה, והשינוי בספיגה לאחר החשיפה משמש לקביעת הנפח הנצרך (איור 2 ואיור 3). מכיוון שהנוזל בכל באר משווה עמודת נוזלים, הבדלים נפחיים יתבטאו כהבדלים בגובה העמודה. (איור 3A) על פי חוק באר-למברט20:
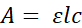
כאשר A הוא הספיגה, ε הוא מקדם ספיגת הטוחנת עבור ניתוח מוחלש, l הוא אורך הנתיב האופטי, ו- c הוא הריכוז של ניתוח מוחלש. לכן, עם מקדם ספיגת הטוחנת והריכוז הקבועים, השינויים בספיגה נובעים אך ורק משינויים בנתיב האור האופטי, כלומר, רמת הנוזל בתוך באר נתונה. על ידי מדידת ספיגה לפני ואחרי החשיפה, השינוי היחסי בספיגה משקף את השינוי היחסי בנפח (איור 3B).
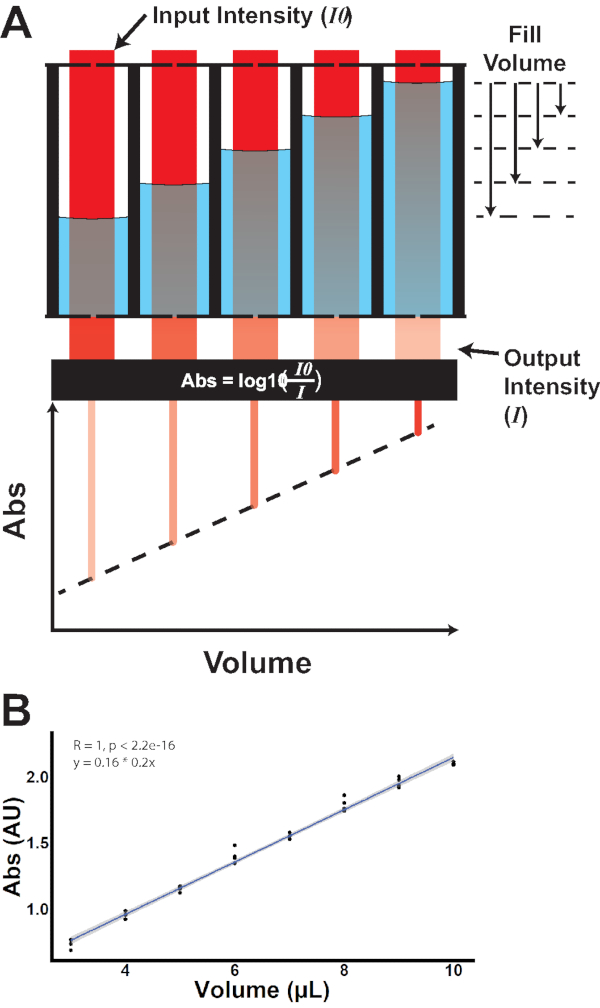
איור 3: כימות מבוסס ספיגה של נפח טוב. (A)אור תקרית של עוצמת קלט ידועה ( I 0 )חוצהכל באר. הנחת האור בנפחי מילוי שונים מניבה עוצמות פלט שונות (I), המציגות קשר ליניארי בין נפח לספיגה. (B)מדידה אמפירית של ספיגה לעומת נפח. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בהתבסס על השינוי בנפח, ניתן לחשב את כמות כל תרכובת שנבלעה מהריכוז הידוע שלה בתמיסת ההזנה. החלקים הדרושים לבדיקה הם בעלות נמוכה ויש להם רמה גבוהה של שימוש חוזר, מה שמפחית באופן משמעותי את העלות החוזרת של ההסתה. לכן, הליך זה מציע שיטת תפוקה גבוהה ובמחיר סביר לכימות מדויק של הצריכה.
Protocol
1. הכנת צלחת רעב
- שוקלים 1.5 גרם של אגרוז לכוס זכוכית 250 מ"ל.
- הוסף 100 מ"ל של H2O מזוקקים לכלוב.
- מיקרוגל לסירוגין עד שאגרוז מותך לחלוטין.
הערה: שימו לב לכלוב מכיוון שהאגורוז נוטה לרתוח. - יוצקים את האגורוז המותך לתוך שוקת ריאגנט ולחלק 80 μL של אגרוז מותך לתוך כל באר של 96 היטב microplate באמצעות pipette רב ערוצי. אפשר צלחות לרפא בזמן מכוסה בטמפרטורת החדר. מקררים את שאריות האגרוז עד שבוע בשקית אטומה וממיסים אותה מחדש להכנת צלחות נוספות.
2. מיון זבובים ורעב
- הכן מצמדים על ידי החדרת רצועות מחסום לתוך ערוצי רצועת המכשול. אם רצועות המחסום רופפות מדי, סליל אותם סביב האצבע כדי לתת להם עקמומיות להחזיק אותם בערוצים.
- הצמיד את המצמד לצלחת רעב. אין להשתמש במצמד כדי לתפעל את הצלחת מכיוון שהמצמד עלול לחמוק. ודא כי המצמדים מכוונים כראוי (כלומר, להבטיח את הפינה הזוויתית של המצמד תואם את הפינה הזוויתית של microplate).
- תחתהרדמה CO 2(שולחן החומרים),סוג זבובים בני 3-5 ימים. טען זבובים בודדים על ידי עמודה לתוך צלחת הרעב.
הערה: למרות שזבובים נטענים לפי עמודה, מומלץ לפזר קבוצות של דוגמאות לאורך שורות של הלוח ולא למטה בעמודות (ראה איור 4 לקבלת דוגמה לפריסת לוח). - סגור כל עמודה כשהיא מתמלאת על-ידי התאמת רצועת המחסום שלה למיקום הסגור.
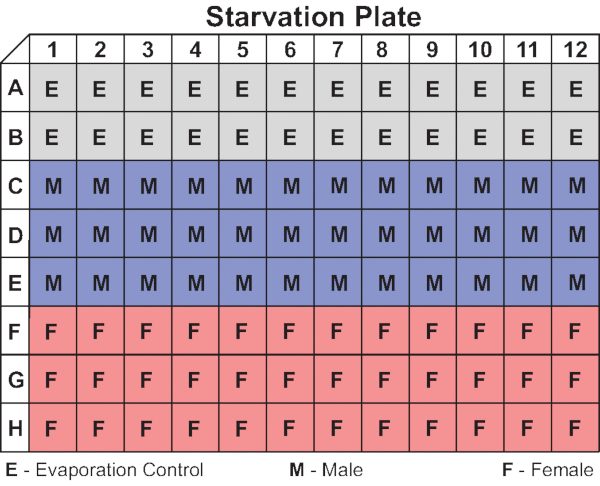
איור 4: פריסת לוחית רעב מייצגת. התרשים מראה את הארגון של פקדי אידוי וזבובים זכר ונקבה בצלחת 96 באר המשמשת במחקר זה. תצורות חלופיות, כולל שורות לסירוגין של זכרים ונקבות עם פקדי אידוי בשורות A ו- H, ניתן להשתמש גם. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הקלט בזהירות את פריסת הדגימה בתוך המיקרו-לוח. לאחר צלחת הרעב מתמלא, לאפשר לזבובים להתאושש באופן ספונטני לאחר הסרת CO2 ולהרעיב אותם במשך 6 שעות החל מזמן ההחלמה הראשוני שלהם.
3. הכנת מזון נוזלי
הערה: הפוך מזון נוזלי טרי כל יום.
- הכן 10 מ"ג / מ"ל של פתרון מלאי צבע של FD&C כחול #1 מזוקק H2O.
הערה: ניתן לאחסן זאת בטמפרטורת החדר עד 6 חודשים. - הכן 10 מ"ל של מזון נוזלי (4% סוכרוז, 1% תמצית שמרים, 40 מיקרוגרם / מ"ל של FD&C כחול #1) בצינור חרוט 15 מ"ל על ידי המסת 0.4 גרם של סוכרוז ו 0.1 גרם של תמצית שמרים ב 10 מ"ל של Hמזוקק H 2O. מערבולת הצינור עד מוצקים להתמוסס לחלוטין. הוסף 40 μL של פתרון מלאי צבע ולהפוך את הצינור שוב ושוב כדי homogenize הפתרון.
- מעבירים את המזון הנוזלי למזרק של 10 מ"ל עם מסנן של 0.45 מיקרומטר. מסנן ~ 1.5 מ"ל של הפתרון בכל פעם לתוך צינור microcentrifuge 1.7 מ"ל. מניחים בצד את המזרק המכיל את הפתרון ומסננים את הפתרון הנוסף לפי הצורך במהלך הכנת צלחת ההזנה.
4. הכנת צלחת מאכילה
הערה: לטפל בלוחות המאכיל בעדינות לאחר המילוי כדי למנוע היווצרות של בועות או טיפות בבאר שיכול להשפיע על קריאות הספיגה.
- הכן צלחת מאכילה על ידי איטום החלק התחתון של מיקרו-לוח 1536-well עם סרט איטום. השתמש במשוט איטום כדי לדבוק בסרט ביסודיות. גזור סרט עודף מהקצה השמאלי והיומי עם סכין גילוח.
- יש לחלק 10 μL של עמודת המזון הנוזלי המסוננת (ראה איור 5 להמחשה) לבארות המתאימות של המיקרו-לוח 1536-well. יש לחלק לבאר השמאלית העליונה כל אשכול של ארבע בארות (ראו איור 5 להמחשה).
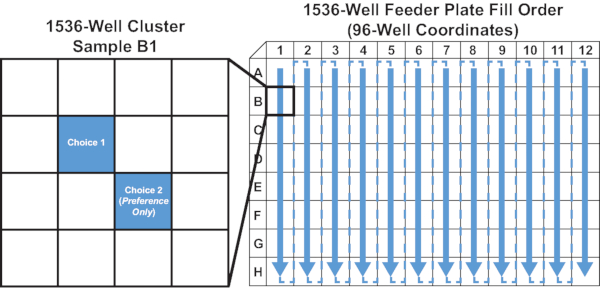
איור 5: מלאו סדר ומיקום טוב לצלחת ההזנה 1536-well. הדיאגרמה מדגימה את שלב 4.2 של הפרוטוקול. החצים מציגים את הסדר שבו מוצג פתרון ההזנה בלוח המאכיל עמודה אחת בכל פעם מעמודה 1 עד 12. מדגם B1 מוגדל כדי להציג דוגמה למיקום פתרונות הזנה לבדיקות של בחירה אחת ו-2 אפשרויות בחירה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- לאחר כל בארות הם מלאים, להחיל סרט איטום על החלק העליון של הצלחת. השתמש במשוט איטום כדי לדבוק בסרט ביסודיות. גזור סרט עודף מהקצה השמאלי והיומי עם סכין גילוח. חזור על הפעולה לקבלת מספר הצלחות הרצוי.
- צנטריפוגות את הצלחות ב 200 x g עבור 10 s כדי ליישב את הנוזל. אל תאפשר את הצלחת להיות צונן מאז זה יכול לגרום עיבוי להצטבר בבארות, טשטוש קריאות ספיגה.
5. חשיפה
- ברגע הזבובים מוכנים לבדיקת הצריכה, לנקב את בארות על פני השטח העליון של הצלחת עם כלי בדיקה מחט מצויד מחט בקוטר 0.25 מ"מ. השתמש באותו סדר כדי לנקב כפי שהיה בשימוש בעת חלוקת הפתרונות. הופכים את הצלחת ומנקבים את הבארות בתחתית. לנגב את המחט בין פתרונות כדי למנוע זיהום צולב. היזהר לא לגעת ניקובים כמו זה מנדף את הפתרון מן הבארות.
- קרא את ספיגת הצלחת ב 630 ננומטר ללא מכסה.
- מניחים מכסה פנימי על סרט האיטום העליון כדי להבטיח שטבעות ה עיבוי יכתרו את בארות המחוררות. מניחים את המכסה החיצוני על הצלחת.
- מניחים את צלחת המאכיל עם הפנים כלפי מעלה על המצמד כך שהמדריכים מיישרים את החורים המתאימים של צלחת ההזנה וצלחת הרעב. ודא כי המצמד והצלחות מכוונים כראוי (כלומר, להבטיח את הפינה הזוויתית של המצמד ואת הצלחות תואמות). עוטפים רצועות אלסטיות סביב הלוחות העליונים והתחתונים כדי להחזיק את המצמד יחד. בדוק אם יש יישור ורווחים בין לוחית המאכיל למצמד.
- לאחר שכל לוחות המאכילים נטענים על המצמדים, פתחו את בארות הלוחות על ידי התאמת רצועות המחסום במצמד. מניחים את מכלולי המצמד/הצלחת במיכל המשני. כל מיכל משני יכול להכיל עד שש מכלולים.
- מניחים את החצי התחתון של קופסת פיפטה המכילה מגבות נייר ספוגות בכל מיכל משני כדי לספק לחות. סגור את המכסה של המיכלים המשניים והעביר אותם לסביבה מבוקרת (25 °C (25 °C (25 °C), מבוקר לחות, 12 שעות אור:מחזורים כהים). אפשר לזבובים לצרוך במשך 22 שעות.
- לאחר החשיפה של 22 שעות, בדקו כל צלחת עבור זבובים מתים ועדכנו את פריסת הצלחת בהתאם. לאחר כל הצלחות נבדקים, למרדים את הזבובים בהמוניהם על ידי שאיבת CO2 בתוך המיכל המשני. לאחר ~ 60s, ודא כי כל הזבובים משותקים. יש לדחוס בעדינות את הזבובים לתוך צלחת הרעב ולהחליף את רצועות מחסום הפלסטיק. הסר את לוחות המאכיל לקריאה.
- קרא מחדש את ספיגת הצלחת ב-630 ננומטר. חזור על הפעולה עד שכל הצלחות נקראו.
6. ניתוח נתונים
הערה: ניתן לבצע ניתוח באמצעות חבילת התוכנה המועדפת על החוקר.
- השמט את כל הזבובים שמתו במהלך החשיפה של 22 שעות.
- עבור כל באר, חשב את אמצעי האחסון הנצרך כ:
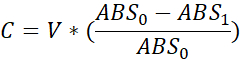
C - נצרך אמצעי אחסון (μL)
V - נפח באר ראשונית (כלומר, 10 μL)
ABS0 - ספיגה לפני חשיפה
ABS1 - ספיגה לאחר חשיפה
הערה: הצריכה מסומנת כאמצעי אחסון חיובי בחישוב. - כדי להסביר אידוי, הפחת את נפח האידוי הממוצע מערכי צריכת זבובים בתוך לוחות בהתאמה. לבדיקת 2 אפשרויות/העדפות, התאימו כל באר לפי הפתרון המתאים לה,למשל, התאימו את בארות "בחירה 1" לפי "בחירה 1" בפקדי האידוי.
- לאחר ההתאמה לאידוי, שחררו את כל הדגימות עם ערך צריכה קטן מאפס.
- לבדיקות של 2 אפשרויות, חשב את ההעדפה עבור כל אחד מהן וכן:
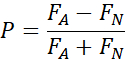
P - אינדקס העדפות (כיוון חיובי מציין העדפה)
FA - נפח של מזון נוזלי הנצרך המכיל תוסף (בחירה 2)
FN - נפח של מזון נוזלי רגיל נצרך (בחירה 1)
7. פרוטוקול שטיפת מיקרופלסטים ומצמדים.
הערה: יש להקפיד למנוע נזק לתחתית המיקרו-לוחות, שכן נזק עלול להשפיע על האיטום.
- הסר את הסרטים והתוויות מהמיקרו-לוחות של 1536 באר. הפרד את המצמדים ואת רצועות המחסום. מניחים את רצועות המכשול במיכל אטום, כגון בקבוק. לשטוף את רצועות המכשול על ידי רועד במרץ בסדרה של מי ברז חמים, פתרון דטרגנט קל, מי ברז חמים, ולאחר מכן מזוקק H2O.
- יש לשטוף 1536 מיקרו-לוחות ומצמדים במי ברז חמים. עבור מיקרו-לוחות, הפעל מי ברז דרך הבארות של כל מיקרו-לוח כדי לפנות כמה שיותר פתרונות ופסולת. במידת הצורך, השתמש בקצה פיפטה כדי להעביר פסולת; אין להשתמש בכלי מתכת או זכוכית על הצלחות.
- מכסים כל צלחת ומצמד עם פתרון דטרגנט קל (למשל, 1% v / v Aquet). עבור הצלחות, לשפשף את המשטחים עם יד בכפפה. למצמדים, יש להשתמש במברשת.
- לשטוף כל צלחת ביסודיות עם מי ברז, ולאחר מכן עם מזוקק H2O. להבטיח כי בארות נשטפות במיוחד מתחת לזרימת המים.
- אפשרו לצלחות ולזוגות להתייבש בטמפרטורת החדר. יש לאחסן בסל אחסון נקי עד לשימוש.
הערה: לעולם אל תטפל במיקרו-לוחות 1536-well ללא כפפות. שאריות שמנים מהעור עלולים לעכב איטום, מה שמוביל לדליפת בארות ואידוי.
תוצאות
כדי לקבוע אם קיימים קשרים בין בארות של לוחות בודדים, האידוי היה כימות עבור כל באר (n = 96 בארות / צלחת עבור שלוש צלחות). אידוי נמצאה -0.036 μL ± 0.003 μL (ממוצע ± SEM לאורך). (איור 6A) מתאמי פירסון חושבו כדי להעריך מגמות בין אידוי למיקומים טובים. מקדם המתאם (איור 6B, C) עבור אידוי לעומת שורות היה -0.04 (p = 0.4949) ולאידוי לעומת עמודות היה -0.23 (p = 0.0001). לאחר מכן חולקו קבוצות בין עמודות כדי למתן את המתאם המתון אך המשמעותי סטטיסטית בין עמודות.
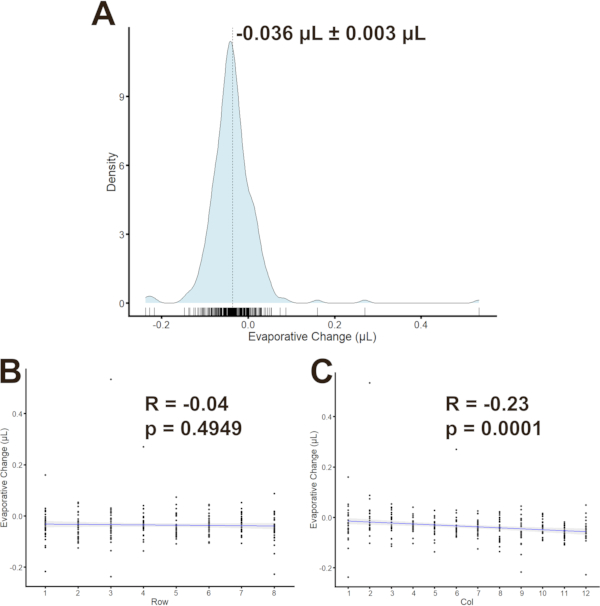
איור 6: אידוי בהתפלגות ה- MFA( A)התפלגות הצפיפות של שינויי אידוי עם ± SD ממוצע המצוין על-ידי הקו המקווקו. מתאמים בין אידוי לשורות (B) או עמודות (C) עם מקדם המתאם של פירסון וערך p כפי שצוין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כדי לקבוע את תוקפו של הפרוטוקול, הצריכה כותמה עבור זבובי קנטון-S B בני 3-5 ימים (n = 36/סקס/צלחת ו- n = 24 פקדי אידוי/צלחת לשלוש צלחות)(איור 7). אידוי בין בארות הבקרה היה שונה באופן משמעותי מאפס (-0.030 μL ± 0.006 μL, p = 4.81 x 10-6; מדגם אחד t-test לעומת אפס). שתי דגימות הושמטו (שתיהן זכריות) ממערך הנתונים, האחת עקב מוות במהלך החשיפה הלילית והשנייה בשל ערך צריכה שלילי לאחר התאמה לאידוי. זה הניב שיעור שימור מדגם > 99%.
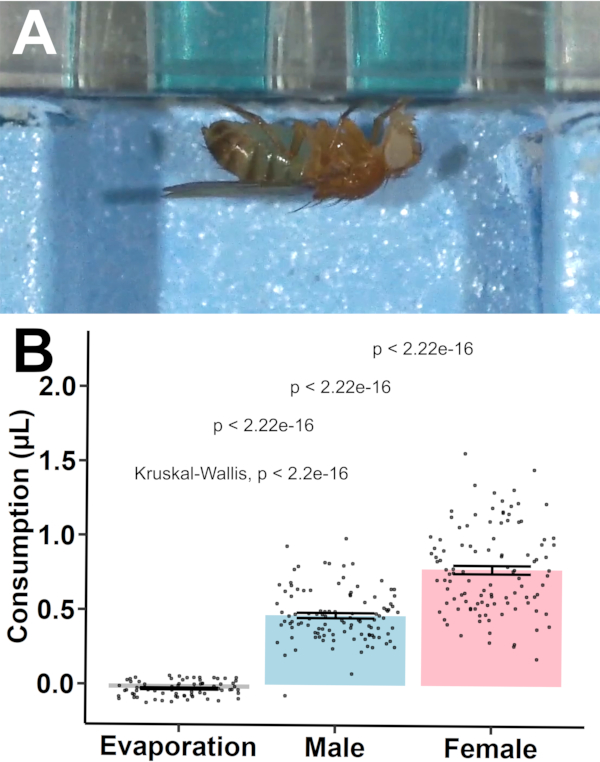
איור 7: כימות צריכה באמצעות MFA. (A)הצריכה הוצגה באמצעות תא זכוכית מפוברק מותאם אישית. זבובים נצפו שותים מבארות מחוררות והפגינו כתמי בטן כחולים בעקבות בליעה של הפתרון הנצבע. ראה גם וידאו משלים S.1. (B) ערכי צריכה (ממוצע ± SEM) בין פקדי אידוי, זבובים זכרים וזבובים נשיים. Pairwise post hoc t-test עם שונות לא שוויונית בוצעה עבור השוואות סטטיסטיות, עם משמעות המצוינת על-ידי עמודות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
לאחר מכן, מודל ניתוח של שונות (ANOVA) נבנה כמתואר על ידי Y = μ + S + P + SxP + e, עם Y כמו הקבוצה מתכוונת, μ כמו הממוצע הכולל, S כהשפעה קבועה של סקס, P כהשפעה קבועה של צלחת, SxP כמו האינטראקציה בין סקס וצלחת, ו- e כשונות שיורית. ANOVA לא הראתה שונות משמעותית בין צלחת לצלחת (p = 0.671) או אינטראקציות ספציפיות למין עם לוחות (p = 0.104) לצריכה, בעוד שהסקס לבדו תרם באופן משמעותי לשינוי הנצפה בצריכה (p = 4.17 x 10-18). פוסט הוק t-בדיקה הראתה כי זכרים נצרכו באופן משמעותי פחות מאשר נקבות (0.500 μL ± 0.017 μL לעומת 0.811 μL ± 0.028 μL, p = 1.13 x 10-17, שתי מדגם t-test עם שונות לא שוויונית).
כדי להדגים כי בדיקת ההעדפה יכולה לשמש לכימות העדפה של שתי אפשרויות, הזבובים קיבלו בחירה בין תמיסת סוכרוז 4% עם 1% תמצית שמרים ותמיסת סוכרוז 4% בתוספת 15% אתנול ותמצית שמרים 1%. גברים ונשים כאחד הראו העדפה גורפת לפתרון עם אתנול ותמצית שמרים עם מדדי העדפה של 0.974 ± 0.026 לגברים ו-0.876 ± 0.06 לנשים (ממוצע ± SEM)(איור 8).
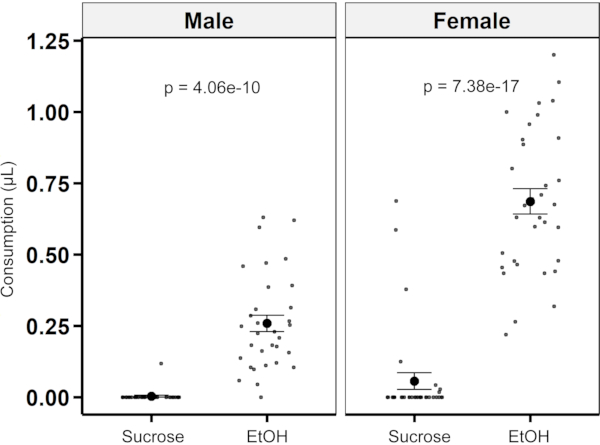
איור 8: כימות העדפה באמצעות MFA. צריכה של 4% סוכרוז לעומת 4% סוכרוז בתוספת 15% אתנול ותמצית שמרים לזבובים זכרים ונקביים (n = 33 לכל מין). זבובים זכרים צרכו יותר של פתרון אתנול מאשר פתרון סוכרוז בקרה (0.511 μL ± 0.029 μL לעומת 0.00 μL ± 0.017 μL; p = 4.06e-10; שתי דוגמאות t-test). זבובים נקבות גם צרכו יותר תמיסת אתנול מאשר פתרון סוכרוז בקרה (0.939 μL ± 0.044 μL לעומת 0.132 μL ± 0.044 μL; p = 7.38e-17; שתי דוגמאות t-test). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
וידאו משלים S.1: הסרטון מראה זבוב ניזון מהבאר המחוררת ומצטבר כתמי בטן כחולים תוך בליעת הפתרון הצבעוני. תמונת סטילס מוצגת באיור 7A. אנא לחץ כאן כדי להוריד את הסרטון הזה.
קובץ משלים S.2: מצמד מיזנה מיקרו-לוח . זהו מבנה להדפסה בתלת-ממד של המצמד המשמש ב- MFA. חומר הדפסה ניילון PA12 שימש עבור MFA. נא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים S.3: רצועת מחסום אסאי מאכיל מיקרופלסטית. זה מכיל את העיצוב של רצועות מחסום פלסטיק המשמשות כדי לעבור חשיפה של זבובים ללוח המאכיל. מצמד יחיד יכול להשתמש עד 12 רצועות מחסום. נא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים S.4: הוראות פירוק וימצאה עבור מאכיל מיקרופלסטיק Assay. הוראות כוללות לפרוק את המצמד ואת רצועות המכשול. הוראות ייצור כלולות עבור המכסה הפנימי, המכסה החיצוני והמכל המשני המשמש להגבלת אידוי במהלך החשיפה. נא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים S.5:השוואת עלויות של מאכיל מיקרופלסטיט אסאי (MFA) ו 1-אפשרות אחת זבוב יחיד FEeder (CAFE) אסייס. בדיקת 72 זבובים / סקס עבור קו אחד תדרוש שני סטים של ציוד MFA (מצמדים + צלחות + רצועות מחסום), בעוד CAFE יצטרך רק נימי אחד עבור כל מקטורן תרבות. למרות ההבדל הגדול בהשקעה הראשונית עבור ה- MFA, ההפרש הגדול בעלויות החוזרות ($14.80 לעומת $46.08, בהתאמה) יאפשר לשחזר את העלויות מראש לאחר בדיקת 4 קווים בלבד (נקודת שבירה זוגית). נא לחץ כאן כדי להוריד קובץ זה.
Discussion
המחקר מתאר פרוטוקול חדשני לכימות הצריכה בדרוסופיל: מאכיל המיקרו-לוח (MFA). ב-assay זה, זבובים צורכים מבארות אטומות של מיקרו-לוח 1536-well באמצעות ניקובים בגודל מבוקר (איור 1, איור 2; וידאו משלים S.1). מאחר שמזון נוזלי צבוע וניתן באמצעות מיקרו-לוח, ניתן להשיג מדידות של הספיגה האופטית של המזון באמצעות ספקטרופוטומטר מיקרו-לוח(איור 3). באופן זה, הצריכה נקבעת על ידי השוואת הספיגה לפני ואחרי הצריכה, ולאחר מכן החלת פרופורציה זו על הנפח הידוע שניתן לפני הצריכה. זה אומת אמפירית על ידי מדידת ספיגה של כרכים שונים של המדיום צבוע (איור 3B).
כדי לפתח את ההסמכה הזו, היה צורך במכשיר שיכול למנף את הכימות מבוסס הספיגה של הצריכה. בדיקת זבובים בתבנית מיקרו-פלט מושכת מכיוון שהיא משלימה את המיקרו-פלט המשמש לחלוקת מזון ומאפשרת גמישות בבחירה מתוך פורמטים מרובים של לוחות (לדוגמה, פורמטים של 6, 12, 48 או 96 באר) על-ידי התאמת הגיאומטריה של המצמד. תבנית של 96 באר של מיקרו-לוח נבחרה כדי לאפשר תרבות זבובים אישית.
המכשיר המודפס בתלת-ממד (איור 1) מכוון במדויק את צלחת ההזנה 1536-well עם צלחת התרבות 96-well, נותן לכל זבוב גישה עד 4 בארות של צלחת מאכיל לצריכה. יתר על כן, כדי לספק זמן מתאים לחלוקת זבובים לתוך צלחת הדיור ולשליטה בייזום בדיקה, המכשיר כולל פסי מחסום המכילים את הזבובים בבארות שלהם ומניעת פרצות. הקבצים הדרושים כדי להשיג או לשנות חלקים אלה מסופקים (קבצים משלימים S.2-S.3), כמו גם את הוראות הייצור הדרושות עבור החלקים הרלוונטיים (קובץ משלים S.4).
MFA מספק שיטת תפוקה גבוהה פשוטה המשלימה שיטות משוכללות יותר לניטור התנהגות האכלת Drosophila18,21,22. ה- MFA מציע יתרונות מרובים על פני שיטות אחרות המשמשות לכימות צריכת המזון. התפוקה גדלה על ידי כימות הצריכה באמצעות קורא לוחות. פעולה זו מבטלת מדידות ידניות ומסתירה הזנת נתונים ידנית. הנתונים מקובלים גם על חילוץ ועיבוד תכנותיים. בנוסף, התפוקה הגבוהה יותר מגדילה את המספר המשכפלות הביולוגיות, במיוחד בהשוואה לתכנוני מאכילים קהילתיים, מה שמגדיל באופן משמעותי את הכוח לזהות הבדלים קטנים בצריכה. באמצעות MFA, ניסוי יחיד יכול לכמת את הצריכה או ההעדפה של מעל 500 זבובים לכל ריצה לילית של ה- assay. על ידי חפיפה ריצות של בדיקה, מעל 2,000 זבובים ניתן לבדוק בתקופה של 5 ימים. לבסוף, ישנם חיסכון בעלויות לטווח ארוך בשל השימוש החוזר של מיקרו-לוחות ומצמדים(קובץ משלים S.5). באמצעות MFA, העלות המשוערת לבדיקה יכולה להיות נמוכה כמו $14.80, עם עלות מראש $127.60 עבור הציוד. באמצעות בדיקת FEeder (CAFE) הקלאסית CApillary, הדורשת מיקרו-קפילריה מדויקת יקרה, העלות המשוערת לבדיקה עבור מספר דומה של שכפולים היא $46.08. לכן, בעוד שיש השקעה מראש ברכישת הציוד הדרוש, הפחתה בעלויות החוזרות עלולה להוביל לחיסכון משמעותי, במיוחד במקרים שבהם מתבצעות בדיקות חוזרות ונשנות.
כמו בכל מקרים, ל- MFA יש מגבלות מסוימות. בעיקר, זה דורש גישה לספקטרופוטומטר מיקרו-לוח המסוגל לקרוא 1536 מיקרו-לוחות היטב. בנוסף, ההסתמכות על מדידות ספיגה לכימות הופכת את השיטה לרגיש להפרעה אופטית. זה בא לידי ביטוי כערכי צריכה שליליים עבור קבוצת משנה קטנה של דגימות שנבדקו. חומרים מזינים, תרופות, תרופות או רעלנים בעלי עניין חייבים להיות מסיסים במים כדי להתאים את ההסתייגות.
למרות מגבלותיה, שיטה זו מציעה שיטת תפוקה גבוהה של כימות התנהגויות הצריכה בדרוסופיל . יתר על כן, מכשיר צימוד יכול להיות שונה בקלות כדי לקבל פורמטים צלחת רבים, המאפשר לו להכיל מגוון של מיני חרקים.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק מהמכון הלאומי לשימוש בסמים (U01 DA041613) ל- TFCM ו- RRHA.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25 mm Diameter Needles | Rave Scientific | RS-MN-52-001012 | |
| 0.45 µm Syringe Filters | Olympus Plastics | 25-245 | |
| 10 mL Disposable Syringe | EXELINT | 26200 | |
| Agarose | Fisher Scientific | BP1600 | |
| Barrier Strips (Laser Cut) | Ponoko | - | Material: clear PETG, 0.5mm thickness; Supplementary File: |
| Centrifuge 5810 R | Eppendorf | 22625501 | |
| Centrifuge Rotor A-4-62 with micro-titer plate buckets | Eppendorf | 22638041 | |
| FD&C Blue #1 | Spectrum Chemical Mfg Corp | FD110 | |
| Film Sealing Paddle | Fisher Scientific | 50-563-280 | |
| Flystuff Flypad | Genesee Scientific | #59-114 and #59-119 | CO2 Anesthesia: The Flypads come in two sizes, either of which is appropriate |
| Microplate Coupler (3D Printed) | Shapeways | - | Material: Multi Jet Fusion nylon (MJF PA12); Supplementary File: |
| Microplate Lids | Greiner Bio-One | 656170 | |
| Molecular Devices SpectraMax iD5 | Molecular Devices | - | Any microplate reader with 1536-well resolution will do. |
| Needle Probe Holder | Rave Scientific | RS-MN-52-001000 | |
| Polyester Sealing Film | Excel Scientific, Inc. | 100-SEAL-PLT | |
| Polystyrene 96-well microplates | Greiner Bio-One | 655101 | |
| Polystyrene, Bottomless, 1536-well microplates | Greiner Bio-One | 783000 | Made to Order; allow for adequate lead time when purchasing. |
| Rubber Bands | |||
| Sucrose | Sigma | S7903 | |
| Weather Stripping | 1/2" x 1/8" High Density Self Adhesive Neoprene Rubber | ||
| Yeast Extract | Fisher Scientific | BP1422 |
References
- Wong, R., Piper, M. D. W., Wertheim, B., Partridge, L. Quantification of food intake in Drosophila. PLoS ONE. 4 (6), (2009).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Disease Models & Mechanisms. 9 (3), 235-244 (2016).
- Spitaler, U., et al. Yeast species affects feeding and fitness of Drosophila suzukii adults. Journal of Pest Science. 93 (4), 1295-1309 (2020).
- Wang, Q. P., et al. PGC1α controls sucrose taste sensitization in Drosophila. Cell Reports. 31 (1), 107480 (2020).
- Valtierra-de-Luis, D., et al. Quantification of dose-mortality responses in adult Diptera: Validation using Ceratitis capitata and Drosophila suzukii responses to spinosad. PLoS ONE. 14 (2), 1-11 (2019).
- Williams, M. J., et al. Exposure to bisphenol A affects lipid metabolism in Drosophila melanogaster. Basic & Clinical Pharmacology & Toxicology. 114 (5), 414-420 (2014).
- Jajoo, A., Donlon, C., Shnayder, S., Levin, M., McVey, M. Sertraline induces DNA damage and cellular toxicity in Drosophila that can be ameliorated by antioxidants. Scientific Reports. 10 (1), 1-12 (2020).
- Fochler, S., et al. Genetics of alcohol consumption in Drosophila melanogaster. Genes, Brain and Behavior. 16 (7), 675-685 (2017).
- Highfill, C. A., Baker, B. M., Stevens, S. D., Anholt, R. R. H., Mackay, T. F. C. Genetics of cocaine and methamphetamine consumption and preference in Drosophila melanogaster. PLOS Genetics. 15 (5), 1007834 (2019).
- Keebaugh, E. S., Park, J. H., Su, C., Yamada, R., Ja, W. W. Nutrition Influences caffeine-mediated sleep loss in Drosophila. Sleep. 40 (11), (2017).
- Ja, W. W., et al. Prandiology of Drosophila and the CAFE assay. Proceedings of the National Academy of Sciences. 104 (20), 8253-8256 (2007).
- Qi, W., et al. A quantitative feeding assay in adult Drosophila reveals rapid modulation of food ingestion by its nutritional value. Molecular Brain. 8 (1), 87 (2015).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (PER) assay in Drosophila. Journal of Visualized Experiments: JoVE. (3), e193 (2007).
- Shell, B. C., et al. Measurement of solid food intake in Drosophila via consumption-excretion of a dye tracer. Scientific Reports. 8 (1), 1-13 (2018).
- Wu, Q., et al. Excreta quantification (EX-Q) for longitudinal measurements of food intake in Drosophila. iScience. 23 (1), 100776 (2020).
- Park, A., Tran, T., Atkinson, N. S. Monitoring food preference in Drosophila by oligonucleotide tagging. Proceedings of the National Academy of Sciences of the United States of America. 115 (36), 9020-9025 (2018).
- Deshpande, S. A., et al. Quantifying Drosophila food intake: Comparative analysis of current methodology. Nature Methods. 11 (5), 535-540 (2014).
- Yapici, N., Cohn, R., Schusterreiter, C., Ruta, V., Vosshall, L. B. A Taste circuit that regulates ingestion by integrating food and hunger signals. Cell. 165 (3), 715-729 (2016).
- Jaime, M. D. L. A., et al. The high-throughput WAFFL system for treating and monitoring individual Drosophila melanogaster adults. bioRxiv. , (2018).
- IUPAC. . Compendium of Chemical Terminology (The "Gold Book"). , (1997).
- Itskov, P. M., et al. Automated monitoring and quantitative analysis of feeding behaviour in Drosophila. Nature Communications. 5, 4560 (2014).
- Ro, J., Harvanek, Z. M., Pletcher, S. D. FLIC: high-throughput, continuous analysis of feeding behaviors in Drosophila. PLoS One. 9 (6), 101107 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved