A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מניפולציה תת-תאית של מיקרוטובול ציטוספקלטון בעובר עכבר קדם-ההשתלה החי באמצעות פוטוסטטינים
In This Article
Summary
מעכבי microtubule טיפוסי, בשימוש נרחב במחקר בסיסי ויישום, יש השפעות מרחיקות לכת על תאים. לאחרונה, פוטוסטטינים הופיעו כסוג של מעכבי microtubule photowitchable, מסוגל מיידית, הפיך, מניפולציה מדויקת spatiotemporally של microtubules. פרוטוקול שלב אחר שלב זה מפרט את היישום של photostatins בעובר עכבר טרום השתלה חי 3D.
Abstract
המיקרוטובולה ציטוסקלטון יוצרת את המסגרת של תא והיא בסיסית לתחבורה תאית, חלוקת תאים והעברת אותות. הפרעה פרמקולוגית מסורתית של רשת microtubule בכל מקום באמצעות, למשל, nocodazole יכול להיות השלכות הרסניות עבור כל תא. מעכבי microtubule פוטו-חוטיים הפיכים יש פוטנציאל להתגבר על המגבלות על ידי מתן אפשרות השפעות סמים להיות מיושם באופן מבוקר spatiotemporally. משפחה אחת כזו של סמים היא פוטוסטטינים מבוססי אזובנזן (PSTs). תרכובות אלה אינן פעילות בתנאים כהים, ועם הארה עם אור UV, הם נקשרים לאתר מחייב קולכיצין של β-טובולין ולחסום פילמור microtubule ומחזור דינמי. כאן, היישום של PSTs בעובר עכבר קדם-השתלה חי תלת מימדי (3D) מוגדר לשבש את רשת microtubule ברמה תת-תאית. פרוטוקול זה מספק הוראות להתקנה הניסיונית, כמו גם פרמטרים של הפעלת אור ונטרול עבור PSTs באמצעות מיקרוסקופיה קונפוקלית של תאים חיים. זה מבטיח רבייה ומאפשר לאחרים ליישם הליך זה על שאלות המחקר שלהם. פוטו-טוויצ'ים חדשניים כמו PSTs עשויים להתפתח ככלים רבי עוצמה כדי לקדם את ההבנה של רשת המיקרוטובולה התאית הדינמית ולתפעל את הציטוסקלטון באופן לא פולשני בזמן אמת. יתר על כן, PSTs עשוי להוכיח שימושי במבנים תלת-ממדיים אחרים כגון organoids, blastoids, או עוברים של מינים אחרים.
Introduction
ארכיטקטורת המיקרוטובולה משתנה באופן נרחב בין סוגי תאים שונים כדי לתמוך בפונקציות מגוונות 1,2. האופי הדינמי של צמיחה והתכווצות מאפשר הסתגלות מהירה לרמזים חוץ-תאיים ותאיים ולהגיב לצרכים המשתנים ללא הרף של תא. לפיכך, זה יכול להיחשב "טביעת אצבע מורפולוגית" משחק תפקיד מפתח בזהות התאית.
מיקוד פרמקולוגי של ציטוספקלטון microtubule באמצעות מעכבי מולקולות קטנות הוביל שפע של תגליות בסיסיות בביולוגיה התפתחותית, ביולוגיה של תאי גזע, ביולוגיה של סרטן, נוירוביולוגיה 3,4,5,6,7. גישה זו, למרות שהיא הכרחית, מציגה מגבלות שונות כגון רעילות ואפקטים מחוץ למטרה. לדוגמה, אחד הסוכנים הנפוצים ביותר למיקוד מיקרוטובול, נוקודזול, הוא תרופה רבת עוצמה למיקרוטובולה-depolymerizing8. עם זאת, מעכבי מולקולות קטנות כגון nocodazole פעילים מרגע היישום, ובהתחשב באופי החיוני של ציטוסקלטון microtubule לפונקציות תאיות קריטיות רבות, depolymerization גלובלי של microtubules יכול לייצר השפעות מחוץ למטרה, אשר עשוי להיות לא מתאים עבור יישומים רבים. בנוסף, טיפול נוקודזול הוא בלתי הפיך אלא אם כן דגימות נשטפות ללא התרופה, מניעת הדמיה חיה מתמשכת, ובכך, מעקב מדויק של חוטי microtubule בודדים.
הפיתוח של תרכובות המופעלות באור החל עם יצירת מולקולות photouncaged ובישר עידן חדש מיקוד וניטור ההשפעות של עיכוב צמיחה microtubule באופן מדויק ו spatiotemporally נשלט. משפחה אחת של תרופות הניתנות לצילום הפיך, פוטוסטטינים (PSTs), פותחו על ידי החלפת רכיב הסטילבן של קומברטסטטין A-4 עם אזובנזן9. PSTs אינם פעילים עד הארה עם אור UV, לפיו טרנס-תצורה לא פעילה מומרת לתצורת cis פעילה על ידי איזומריזציה הפיכה. Cis-PSTs לעכב פילמור microtubule על ידי קשירה לאתר כריכת קולכיצין של β-tubulin, חסימת הממשק שלה עם β-טובולין ומניעת עמעום הנדרש לצמיחת microtubule10. בין קבוצה של PSTs, PST-1P הופיע כתרכובת עופרת כפי שיש לו את העוצמה הגבוהה ביותר, הוא מסיס במים לחלוטין, ומראה התחלה מהירה של ביואקטיביות לאחר תאורה.
הטרנס-לסיס-איזומריזציה היעילה ביותר של PSTs מתרחשת באורכי גל בין 360-420 ננומטר, המאפשרת אפשרויות כפולות להפעלת PST. קו לייזר 405 ננומטר על מיקרוסקופ קונפוקלי טיפוסי יכול להינתן עבור מיקוד מרחבי אופטימלי של עיכוב צמיחה microtubule. היכולת לאתר במדויק את המיקום והתזמון של הפעלת PST באמצעות תאורת לייזר 405 ננומטר מאפשרת שליטה זמנית ומרחבית מדויקת, ומאפשרת שיבוש של דינמיקת microtubule ברמה תת-תאית, בתוך תגובה תת-שנייה כפול9. לחלופין, אור UV LED במחיר סביר מאפשר תאורת אורגניזם שלם כדי לגרום להפרעה כלל אורגניזם של ארכיטקטורת microtubule. זו עשויה להיות חלופה חסכונית עבור חוקרים שעבורם תחילת העיכוב המתוזמנת במדויק, ולא פילוח מרחבי, היא המטרה. תכונה נוספת של PSTs היא ההשבתה לפי דרישה שלהם על ידי החלת אור ירוק של אורך גל בטווח 510-540 ננומטר9. זה מאפשר מעקב של חוטי microtubule לפני, במהלך, ואחרי עיכוב צמיחה בתיווך PST.
PSTs, בעוד עדיין עיצוב עדכני יחסית, שימשו ביישומי הפריה חוץ גופית רבים על פני תחומי מחקר מגוונים11, כולל חקירת מנגנונים חדשים של נדידת תאים באמביואידים12, בנוירונים מבודדים ממוחו של העכבר שזה עתה נולד13, ופיתוח אפיתל כנף ב Drosophila מלנוגאסטר14 . תרופות אחרות תגובת אור הוכיחו להיות כלים בעלי ערך בשיבוש ממוקד של תפקוד הסלולר. לדוגמה, אנלוגי של blebbistatin, אזידובלביסטין, שימש לעיכוב מיוזין משופר תחת תאורה15,16. זה מדגיש את הפוטנציאל לתגליות חדשות בשל היכולת לעיכוב מבוקר spatiotemporally של תפקוד הסלולר.
אורגניזמים תלת-ממדיים חיים מציגים מערכות מעולות אך עדינות יותר לתפעל דינמיקה של מיקרוטובול ברמה של חיה שלמה, חד-תאית או תת-תאית בתנאים פיזיולוגיים. בפרט, עובר העכבר טרום ההשתלה מציע תובנה יוצאת דופן על הפעולות הפנימיות של התא, כמו גם יחסים בין תאיים בתוך אורגניזם17. מחזורים רצופים ממוקדים זמנית ומרחבית של הפעלה ונטרול של PSTs תרמו לאפיון הגשר הבין-פאזי, מבנה פוסט-ציטוקינטי בין תאים, כמרכז לארגון מיקרוטובולה לא-קנטרוסומלית בעובר העכבר טרום ההשתלה16. התקנה ניסיונית דומה הדגימה את המעורבות של גידול מיקרוטובולות באיטום עובר העכבר כדי לאפשר היווצרות בלסטוציסט18. יתר על כן, PSTs שימשו גם בעוברים של דגי זברה שלמים כדי לחקור נדידת תאים עצביים על ידי עיכוב צמיחת microtubule בקבוצת משנה של תאים ב hindbrain19.
פרוטוקול זה מתאר את ההתקנה הניסיונית ואת השימוש של PST-1P בעובר עכבר טרום ההשתלה. ההוראות המוצגות כאן יכולות גם להנחות את היישום של PSTs למגוון רחב של מטרות כגון לימוד הפרדת כרומוזום וחלוקת תאים, סחר במטען תאי ומורפוגנזה של תאים והגירה. יתר על כן, מחקרים כאלה יסייעו ליישום של PSTs במערכות organoid, blastoids, ומודלים עוברים אחרים כגון Elegans Caenorhabditis ו Xenopus laevis, כמו גם פוטנציאל להרחיב את השימוש PSTs לטכנולוגיות הפריה חוץ גופית.
Protocol
הניסויים אושרו על ידי ועדת האתיקה לבעלי חיים מונאש תחת מספר אתיקה לבעלי חיים מספר 19143. בעלי חיים שוכנו בתנאי בית בעלי חיים ספציפיים ללא פתוגן במתקן לבעלי חיים (פלטפורמת המחקר לבעלי חיים מונאש) תוך הקפדה על הנחיות אתיות.
1. אוסף עוברי עכבר טרום ההשתלה
- עכברי סופרוולטה ובן זוג כפי שתואר קודם לכן16,18, בהתאם להנחיות האתיקה של בעלי החיים המוסדיים.
הערה: הזנים הנפוצים ביותר עבור אוסף עוברים חיים הם C57BL / 6 או עכברי FVB / N. כל הנתונים המוצגים כאן נוצרו באמצעות עכברי FVB/N. - בבוקר לאחר ההזדווגות, לשטוף זיגוט מן oviduct באמצעות מדיום M2 כמתואר20, או נוזל חצוצרות אנושי (HTF) מדיום. באמצעות מנגנון פיפטה בפה כמתואר21,22, להעביר זיגוטים טרי אשלגן סימפלקס ממוטב בינוני טיפות (KSOM), מראש מחומם ל 37 °C (37 °C) ושווה ל 5% CO2, בצלחת תרבות 35 מ"מ מכוסה עם נפח מספיק של שמן מינרלי כדי להבטיח כיסוי מדיה.
- זיגוטים מיקרו-מולקולריים כמתואר20 עם קידוד cRNA עבור מיקרוטובולה אדומה מתויגת בפלואורסצנטיות בתוספת סמן קצה. כאן, cRNA עבור חלבון מחייב קצה 3 (EB3)-dTomato שימש בריכוז 30 ng / μL לאחר הכנה וטיהור כמתואר16,18 ודילול במאגר microinjection.
הערה: מומלץ להכין cRNA מראש ולאחסן אותו ב -20 °C (60 °F) עד הצורך. - עוברים תרבות בחושך ב 37 °C (5° C) ו 5% CO2 עד העוברים הגיעו לשלב ההתפתחותי הרצוי לטיפול PST-1P.
הערה: עבור משאב מקיף של זמני התרבות הנדרשים לשלבים עובריים שונים ראה23. עבור עוברים בשלב 16 תאים המשמשים כאן, תרבות ליום עוברי 3 (E3) לאחר ההפריה.
2. הכנת מנות סמים והדמיה
הערה: עבור שלבים 2.1-2.10, עבוד אך ורק בתנאי אור כהה או אדום כדי למנוע הפעלה לא מכוונת של PST-1P. רדיד אלומיניום או כיסויים כהים יש להשתמש עבור כל הצינורות והכלים המכילים PSTs.
- הכן ריכוז מלאי של 50 mM PST-1P במים אולטרה-pure.
הערה: המשקל המולקולרי של PST-1P הוא 440 גרם / מול. פתרון המניה יציב ב -20 °C (65 °F) עד 1 שנה. PST-1P הוא מסיס במים או חוצץ מימית אבל לא מתמוסס בקלות ב- DMSO. - משלב 2.1, להכין ריכוז עבודה ביניים של 800 μM PST-1P במים אולטרה-פור.
- לדלל PST-1P לריכוז סופי של 40 מיקרומטר ב KSOM טרי. כמו ניסוי טיפוסי דורש כ 20 μL של PST-1P שטופלו KSOM, לדלל 1 μL של 800 μM PST-1P ב 19 μL של KSOM עבור נפח סופי של 20 μL כדי להבטיח מדיום מספיק מוכן מראש, באמצעות אור אדום בלבד עבור הנראות.
הערה: הן את הריכוז ואת מצב ההפעלה של דילול PST-1P ניתן לבדוק על ידי לקיחת ספקטרום ספיגת UV-Vis באמצעות spectrophotometer אשר צריך להיעשות במהלך הקמת הבדיקה. הספיגה ב 380 ננומטר (A380) של דילול מלא 40 מיקרומטר בקובט 1 ס"מ צריך להיות כ 0.8. הן cis- והן טרנס-צורות יש את אותה ספיגה ב 455 ננומטר (A455). כאשר היחס בין A380 ל- A455 הוא כ- 9:1, הדילול אינו פעיל ( טרנס מלא). כאשר היחס A380:A455 הוא 1:2, הדילול מופעל במלואו ( cis מלא). יחסי ביניים משקפים מצבי ביניים של הפעלה. - כדי להכין את שקופית התא להדמיה חיה, פיפטה 10 μL של KSOM שטופלו ב- PST-1P למרכז באר אחת כדי ליצור טיפה חצי כדורית (איור 1A).
- מוסיפים בעדינות מספיק שמן מינרלי כדי לכסות את הטיפה, ומבטיחים שהיא לא תפזר את המדיה. זה יבטיח כי טיפה לא להתאדות.
- טרום חם CO2-שיווי משקל את צלחת שקופית החדר בחממה ב 37 °C (5° פרנהייט) ו 5% CO2 עבור מינימום של 3 שעות או לכל היותר, לילה.
- בסוף תקופת שיווי המשקל בשלב 2.6, להכין צלחת תרבות 35 מ"מ עם טיפה 10 μL של PST-1P טופל, מראש, מראש, ו שיווי משקל KSOM כצעד לשטוף. אין לכסות בשמן.
- העבר עוברים על ידי צנרת הפה לתוך טיפת KSOM שטופלו PST-1P משלב 2.7.
הערה: שלבים 2.7 ו-2.8 מומלצים לצינורות בפה של עוברים, אך הם אופציונליים. - העבר מיד עוברים באמצעות צנרת פה למרכז טיפת KSOM שטופלה ב- PST-1P בשקופית תא ההדמיה שהוכנה בשלבים 2.4-2.6 (איור 1A).
- עוברים דגירה ב 37 °C ו 5% CO2 ב PST-1P שטופלו KSOM בשקופית תא ההדמיה לפחות 1 שעות לפני הדמיה. במידת האפשר, הר את שקופית התא על המיקרוסקופ בתוך תא סביבתי ב 37 °C (5° פרנהייט) ו 5% CO2, ובחשיכה מוחלטת כדי להבטיח את כל PST-1Ps נמצאים בתצורת טרנס לא פעיל וכי עוברים יכולים לשקוע לתחתית המנה.
3. הדמיה חיה וצילום PST-1P
הערה: שלבים 3.1-3.13 מבוצעים במיקרוסקופ קונפוקלי לסריקת לייזר המצויד בגלאי פוטודיודה של מפולת שלגים (APDs) ובתא סביבתי כהה. הוראות אלה מתייחסות במיוחד להגדרת ההדמיה באמצעות תוכנת הרכישה המתוארת בטבלת החומרים; עם זאת, ניתן להחיל אותם גם על מערכות מיקרוסקופיות קונפוקליות אחרות.
- הכן מטרה טבילה שמן מים 63x/1.2 NA עם מדיום הטבילה שנקבע.
- באמצעות לפיד אור אדום להנחיית מיקום, לקדם את המטרה כדי ליצור קשר עם מדיום הטבילה. בשלב זה, להימנע משימוש באור לבן או בהיר שדה כדי למצוא את העוברים כמו זה יכול להפעיל מראש PST-1P.
- באמצעות העפעף ותוך כדי תאורת אור אדום, אתר את קצה טיפת המדיום ומקם את המטרה ישירות מעל מיקום זה. זה יכול לסייע למשתמש ליצור אוריינטציה ולמצוא את מישור המוקד.
- לאחר מכן, דרך העין או בסריקה במצב חי התומכת בתוכנה, השתמש במסנן אורך גל אדום או בלייזר 561 ננומטר כדי לאתר את העוברים בתוך הטיפה.
- השתמש בבקרי במה ובמצב סריקה חיה כדי להגדיר את נקודות ההתחלה והסיום לרכישת מחסנית z של העובר כולו.
- התאם את הגדרות צריכת החשמל של הלייזר (בדרך כלל, עם גלאים רגישים מאוד כגון ה- APDs, מספיק כוח לייזר של 561 ננומטר של פחות מ- 5%), היסט דיגיטלי (בדרך כלל ב- -0.900) כדי למטב את המראה של כוכבי שביט EB3-dTomato ולמזער רעשי רקע, חור סיכה ב- 2 מיקרומטר, רזולוציית פיקסלים של 512 x 512 וזמן השתהות פיקסלים של 3.15 מיקרומטר.
- רכשו ערימת z של העובר כולו עם מרווחי מקטע של 1 מיקרומטר כדי להעריך אזורים של צמיחת מיקרוטובול באורגניזם כולו (איור 1B).
- השתמש בתמונת z-stack תלת-ממדית משלב 3.7 כדי לזהות אזורי עניין (ROIs) עבור ניסויי מעקב אחר EB3-dTomato. הגדל את הזום ל- 3x וצייר החזר השקעה מלבני סביב האזור התת-תאי הספציפי של עניין.
- לרכוש סרט לשגות זמן של מישור z יחיד באמצעות הערכים האופייניים של פרמטרי הדמיה: כוח לייזר 561 ננומטר ב 5%, היסט דיגיטלי של -0.900, רזולוציית פיקסלים של 512 x 512 x 512, חור סיכה ב 3 מיקרומטר, זמן השתהות פיקסלים של 3.15 מיקרוגרם, זום של 3x, מרווח זמן של 500 אלפיות השנייה.
הערה: 120 מסגרות זמן יספקו סרט מעקב של דקה אחת ואמורים להספיק לניתוח נתונים. הרכישה יכולה להימשך זמן רב יותר, בתנאי שהלבנת הפלואורופור היא מינימלית (איור 1C). - כדי להפעיל את PST-1P, עבור ללייזר 405 ננומטר ורכוש סרט אחר עם לייזר 405 ננומטר מוגדר ל-10% עוצמה, רזולוציית פיקסלים של 512 x 512, חור סיכה נפתח באופן מקסימלי, זמן השתהות פיקסלים של 3.15 מיקרוגרם, זום של 3x, מרווח זמן של 500 אלפיות השנייה, וסך הכל 20 פריימים (איור 1D).
- חזור ללייזר של 561 ננומטר ורכישה חוזרת כמו בשלב 3.9 כדי לאשר את אובדן כוכבי השביט EB3-dTomato לאחר הפעלת PST-1P (איור 1E). ודא שרכישה זו תתבצע בהקדם האפשרי לאחר ההפעלה.
הערה: שלב 3.10 יכול להתבצע שוב ושוב לעיכוב ארוך יותר של כוכבי שביט EB3-dTomato. עם זאת, עוברים חייבים להיות במעקב בזהירות כדי למנוע כל נזק שנגרם על ידי אור UV. - כדי להפוך PST-1P בחזרה למצב הטרנס לא פעיל שלה, לעסוק לייזר 514 ננומטר ב 10% כוח. רכשו סרט עם לייזר של 514 ננומטר המוגדר ל-10% עוצמה, רזולוציית פיקסלים של 512 x 512, חור סיכה נפתח באופן מקסימלי, זמן השתהות פיקסלים של 3.15 מיקרוגרם, זום של פי 3, מרווח זמן של 500 אלפיות השנייה ו-20 מסגרות זמן בסך הכל (איור 1F).
- חזור על שלב 3.11 כדי לדמיין שחזור של כוכבי שביט EB3-dTomato (איור 1G).
4. ניתוח נתוני תמונה
- לניתוח וכימות העיכוב של פילמור microtubule על ידי PSTs, להשתמש בתוכנות העומדות לרשות החוקרים כדי להתאים לצרכים הספציפיים שלהם. אלה המומלצים לשימוש יהיו בעלי כלי מעקב, שיכול לעקוב באופן ידני או אוטומטי אחר התנועה, הכיוון והמהירות של כוכבי שביט EB3-dTomato16,18.
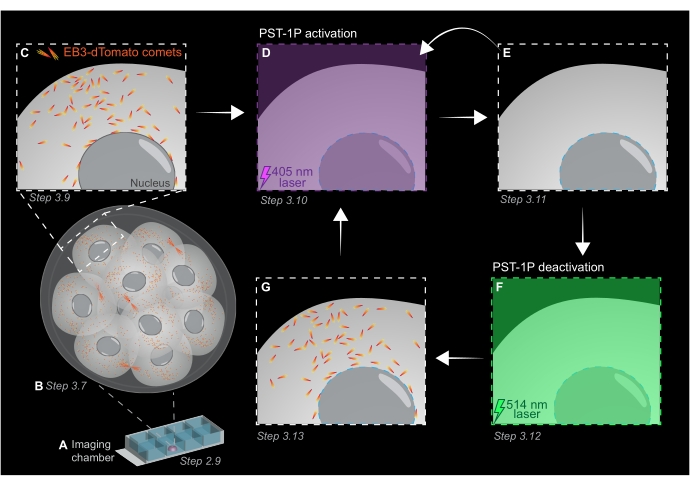
איור 1: ייצוג סכמטי של פוטואקטיבציה של PST-1P ונטרול בעובר עכבר קדם-ההשתלה התלת-ממדי החי. כל הניסויים מבוצעים בחושך מוחלט (רקע שחור) או רק על ידי תאורת אור אדום. (A) עוברי עכבר קדם-ההשתלה החיים המבטאים EB3-dTomato מתורבתים לשלב של 16 תאים ולאחר מכן מועברים לטיפת KSOM המכילה 40 מיקרומטר PST-1P בשקופית תא הדמיה. (B) תמונה תלת-ממדית של העובר כולו מאפשרת הערכה של צמיחת מיקרוטובולה על ידי הדמיית ההתפלגות של כוכבי שביט EB3-dTomato. (ג) כדי להתחיל את הניסוי, כוכבי שביט EB3-dTomato נמצאים במעקב באזור תת-תאי באמצעות הדמיה לשגות זמן. (D) pst-1P פוטואקטיבציה עוקבת באותו אזור תת-תאי באמצעות לייזר 405 ננומטר תוצאות באובדן של כוכבי שביט EB3-dTomato (E). הפעלת PST-1P מוגברת ניתן ליישם, במידת הצורך, על ידי תאורת אור רציף 405 ננומטר. (F-G) כדי להפוך PST-1P בחזרה למצבו הלא פעיל ולשחזר כוכבי שביט EB3-dTomato, לייזר 514 ננומטר מוחל על אותו אזור תת-תאי. במידת הצורך, ניתן לבצע סבבים מרובים של פוטואקטיבציה ונטרול. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
בהתאם לפרוטוקול, עוברי עכבר טרום ההשתלה היו microinjected עם cRNA עבור EB3, מתויג עם dTomato פלואורסצנטי אדום (EB3-dTomato). זה מאפשר הדמיה של microtubules גידול כמו EB3 נקשר microtubule פילמור פלוס מסתיים24.
הניסויים בוצעו 3 ימים לאחר ההפריה (E3) כאשר עובר העכבר מורכב מ -16 תאים. ניתן להשתמש בכל שלב ...
Discussion
רשת המיקרוטובולה היא חלק בלתי נפרד מהפעילות הפנימית הבסיסית של התא. כתוצאה מכך, זה מציב אתגרים במניפולציה דינמיקה microtubule באורגניזמים חיים, כמו כל הפרעה לרשת נוטה להיות השלכות נרחבות על כל ההיבטים של תפקוד הסלולר. הופעתה של תרכובות מיקוד microtubule photowitchable מציגה דרך לתפעל במדויק את cytoskeleton ברמה ...
Disclosures
המחברים מצהירים על שום אינטרס מתחרה או כספי.
Acknowledgements
המחברים רוצים להודות לד"ר אוליבר ת'ורן-ססהולד ולי גאו על שסיפקו לנו פוטוסטטינים ועצות על הכנת כתבי יד, מונאש הפקה לתמיכה בצילום, ומונש מיקרו הדמיה לתמיכה במיקרוסקופיה.
עבודה זו נתמכה על ידי המועצה הלאומית לבריאות ומחקר רפואי (NHMRC) מענק APP2002507 ל- J.Z. והמכון הקנדי למחקר מתקדם (CIFAR) מלגת עזריאלי ל- J.Z. המכון האוסטרלי לרפואה רגנרטיבית נתמך על ידי מענקים מממשלת מדינת ויקטוריה וממשלת אוסטרליה.
Materials
| Name | Company | Catalog Number | Comments |
| Aspirator tube | Sigma-Aldrich | A5177 | For mouth aspiration apparatus |
| Chamber slides - LabTek | Thermo Fisher Scientific | NUN155411 | |
| cRNA encoding for EB3-dTomato | N/A | N/A | Prepared according to manufacturers instructions using mMessage in vitro Transcription kit |
| Culture dishes - 35mm | Thermo Fisher Scientific | 150560 | |
| Human chorionic growth hormone | Sigma-Aldrich | C8554 | |
| Human Tubal Fluid (HTF) medium | Cosmo-Bio | CSR-R-B071 | |
| Imaris Image Analysis Software | Bitplane | ||
| Immersion Oil W 2010 | Carl Zeiss | 444969-0000-000 | For use with microscope immersion objective |
| LED torch - Red light | Celestron | 93588 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Mice - wild-type FVB/N, males and females | N/A | N/A | Females 8-9 weeks old. Males 2-6 months old. |
| Microcapillary Pipettes - Kimble | Sigma-Aldrich | Z543306 | For mouth aspiration apparatus |
| Microinjection buffer | N/A | N/A | 5 mM Tris, 5 mM NaCl, 0.1 mM EDTA, pH 7.4 |
| Mineral oil | Origio | ART-4008-5P | |
| mMessage In vitro Transcription kit | Thermo Fisher Scientific | AM1340 | |
| NanoDrop Spectrophotometer | Thermo Fisher Scientific | ||
| Potassium Simplex Optimised Medium (KSOM) medium | Cosmo-Bio | CSR-R-B074 | |
| Pregnant mare serum gonadotrophin | Prospec Bio | HOR-272 | |
| PST-1P | N/A | N/A | Borowiak, M. et al., Photoswitchable Inhibitors of Microtubule Dynamics Optically Control Mitosis and Cell Death. Cell. 162 (2), 403-411, doi:10.1016/j.cell.2015.06.049, (2015). |
| RNA purification kit | Sangon | B511361-0100 | |
| Ultrapure water | Sigma-Aldrich | W1503 | |
| ZEN Black Software | Carl Zeiss |
References
- Hawdon, A., Aberkane, A., Zenker, J. Microtubule-dependent subcellular organisation of pluripotent cells. Development. 148 (20), (2021).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Current Opinion in Cell Biology. 44, 93-101 (2017).
- Galli, M., Morgan, D. O. Cell size determines the strength of the spindle assembly checkpoint during embryonic development. Developmental Cell. 36 (3), 344-352 (2016).
- Vazquez-Diez, C., Paim, L. M. G., FitzHarris, G. Cell-size-independent spindle checkpoint failure underlies chromosome segregation error in mouse embryos. Current Biology. 29 (5), 865-873 (2019).
- Baudoin, J. P., Alvarez, C., Gaspar, P., Metin, C. Nocodazole-induced changes in microtubule dynamics impair the morphology and directionality of migrating medial ganglionic eminence cells. Developmental Neuroscience. 30 (1-3), 132-143 (2008).
- Munz, F., et al. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment. Scientific Reports. 8 (1), 312 (2018).
- Jordan, M. A., Wilson, L. Microtubules as a target for anticancer drugs. Nature Reviews Cancer. 4 (4), 253-265 (2004).
- Vasquez, R. J., Howell, B., Yvon, A. M., Wadsworth, P., Cassimeris, L. Nanomolar concentrations of nocodazole alter microtubule dynamic instability in vivo and in vitro. Molecular Biology of the Cell. 8 (6), 973-985 (1997).
- Borowiak, M., et al. Photoswitchable inhibitors of microtubule dynamics optically control mitosis and cell death. Cell. 162 (2), 403-411 (2015).
- Gaspari, R., Prota, A. E., Bargsten, K., Cavalli, A., Steinmetz, M. O. Structural basis of cis- and trans-Combretastatin binding to tubulin. Chem. 2 (1), 102-113 (2017).
- Thorn-Seshold, O., Meiring, J. Photocontrolling microtubule dynamics with photoswitchable chemical reagents. ChemRxiv. , (2021).
- Kopf, A., et al. Microtubules control cellular shape and coherence in amoeboid migrating cells. Journal of Cell Biology. 219 (6), 201907154 (2020).
- Sawada, M., et al. PlexinD1 signaling controls morphological changes and migration termination in newborn neurons. The EMBO Journal. 37 (4), 97404 (2018).
- Singh, A., et al. Polarized microtubule dynamics directs cell mechanics and coordinates forces during epithelial morphogenesis. Nature Cell Biology. 20 (10), 1126-1133 (2018).
- Kepiro, M., et al. Azidoblebbistatin, a photoreactive myosin inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 109 (24), 9402-9407 (2012).
- Zenker, J., et al. A microtubule-organizing center directing intracellular transport in the early mouse embryo. Science. 357 (6354), 925-928 (2017).
- White, M. D., Zenker, J., Bissiere, S., Plachta, N. Instructions for assembling the early mammalian embryo. Developmental Cell. 45 (6), 667-679 (2018).
- Zenker, J., et al. Expanding actin rings zipper the mouse embryo for blastocyst formation. Cell. 173 (3), 776-791 (2018).
- Theisen, U., et al. Microtubules and motor proteins support zebrafish neuronal migration by directing cargo. Journal of Cell Biology. 219 (10), 201908040 (2020).
- Rulicke, T. Pronuclear microinjection of mouse zygotes. Methods in Molecular Biology. 254, 165-194 (2004).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio-protocol. 11 (15), 4104 (2021).
- Subramanian, G. N., et al. Oocytes mount a noncanonical DNA damage response involving APC-Cdh1-mediated proteolysis. Journal of Cell Biology. 219 (4), 201907213 (2020).
- Mihajlovic, A. I., Bruce, A. W. The first cell-fate decision of mouse preimplantation embryo development: integrating cell position and polarity. Open Biology. 7 (11), 170210 (2017).
- Roostalu, J., et al. The speed of GTP hydrolysis determines GTP cap size and controls microtubule stability. Elife. 9, 51992 (2020).
- Gao, L., et al. In vivo photocontrol of microtubule dynamics and integrity, migration and mitosis, by the potent GFP-imaging-compatible photoswitchable reagents SBTubA4P and SBTub2M. BioRxiv. bioRxiv. , (2021).
- Tichy, A. M., Gerrard, E. J., Legrand, J. M. D., Hobbs, R. M., Janovjak, H. Engineering strategy and vector library for the rapid generation of modular light-controlled protein-protein interactions. Journal of Molecular Biology. 431 (17), 3046-3055 (2019).
- van Haren, J., Adachi, L. S., Wittmann, T. Optogenetic control of microtubule dynamics. Methods in Molecular Biology. 2101, 211-234 (2020).
- Adikes, R. C., Hallett, R. A., Saway, B. F., Kuhlman, B., Slep, K. C. Control of microtubule dynamics using an optogenetic microtubule plus end-F-actin cross-linker. Journal of Cell Biology. 217 (2), 779-793 (2018).
- Kogler, A. C., et al. Extremely rapid and reversible optogenetic perturbation of nuclear proteins in living embryos. Developmental Cell. 56 (16), 2348-2363 (2021).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Bukhari, S. N. A., Kumar, G. B., Revankar, H. M., Qin, H. L. Development of combretastatins as potent tubulin polymerization inhibitors. Bioorganic Chemistry. 72, 130-147 (2017).
- Gilazieva, Z., Ponomarev, A., Rutland, C., Rizvanov, A., Solovyeva, V. Promising applications of tumor spheroids and organoids for personalized medicine. Cancers (Basel). 12 (10), 2727 (2020).
- Scherer, K. M., et al. Three-dimensional imaging and uptake of the anticancer drug combretastatin in cell spheroids and photoisomerization in gels with multiphoton excitation. Journal of Biomedical Optics. 20 (7), 78003 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved