A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח האינטראקציה של חלבונים בעלי תווית פלואורסצנטית עם מיקרו-וסיקלים מלאכותיים של פוספוליפידים באמצעות ציטומטריה כמותית של זרימה
In This Article
Summary
כאן, אנו מתארים קבוצה של שיטות לאפיון האינטראקציה של חלבונים עם ממברנות של תאים או microvesicles.
Abstract
בגוף האדם, רוב התגובות הפיזיולוגיות העיקריות המעורבות בתגובה החיסונית ובקרישת הדם ממשיכות על קרומי התאים. צעד ראשון חשוב בכל תגובה התלויה בממברנה הוא קשירת חלבון על קרום הפוספוליפידים. גישה לחקר אינטראקציה של חלבונים עם ממברנות שומנים פותחה באמצעות חלבונים המסומנים באופן פלואורסצנטי וציטומטריית זרימה. שיטה זו מאפשרת לחקור אינטראקציות בין חלבונים לממברנה באמצעות תאים חיים ושלפוחיות פוספוליפיד טבעיות או מלאכותיות. היתרון של שיטה זו הוא הפשטות והזמינות של ריאגנטים וציוד. בשיטה זו, חלבונים מסומנים באמצעות צבעים פלואורסצנטיים. עם זאת, ניתן להשתמש הן בחלבונים מתוצרת עצמית והן באופן מסחרי, המסומנים באופן פלואורסצנטי. לאחר הצמדה עם צבע פלואורסצנטי, החלבונים מודגרים עם מקור של קרום פוספוליפידים (microvesicles או תאים), והדגימות מנותחות על ידי ציטומטריה של זרימה. ניתן להשתמש בנתונים המתקבלים כדי לחשב את הקבועים הקינטיים ואת שיווי המשקל Kd. בנוסף, ניתן להעריך את המספר המשוער של אתרי קשירת חלבונים על קרום הפוספוליפידים באמצעות חרוזי כיול מיוחדים.
Introduction
ביוממברנים מפרידים בין התוכן הפנימי של תאי בעלי החיים לבין החלל החוץ-תאי. שימו לב שממברנות מקיפות גם מיקרו-וסיקלים שנוצרו במהלך מחזור החיים של התא ובאברונים. קרום התא מורכב בעיקר מליפידים וחלבונים. חלבוני ממברנה מבצעים תפקודי איתות, מבניים, הובלה ודבקים. עם זאת, דו-שכבת השומנים חיונית גם ליחסי הגומלין של תא החיה עם המרחב החוץ-תאי. מאמר זה מציע שיטה לחקר האינטראקציה ההיקפית של חלבונים חיצוניים עם קרום השומנים.
הדוגמה הבולטת ביותר לתגובות המתרחשות בשכבת הממברנה החיצונית של תא בעל חיים היא תגובת קרישת הדם. תכונה חשובה של קרישת דם היא שכל התגובות העיקריות ממשיכות על ממברנות הפוספוליפידים של תאים ומיקרו-וסיקלים הנובעים מתאים אלה ולא בפלזמה 1,2,3. תגובות תלויות ממברנה כוללות את התהליך של קרישה התחלתית (על קרומי התאים של תת-האנדותל, אנדותל מודלק, או תאי חיסון פעילים, בהשתתפות גורם רקמה), כל התגובות של הפעלת המפל העיקרי של גורמים IX, X, פרותרומבין; הפעלה של גורם XI על ידי טרומבין (על הממברנות של טסיות מופעלות, אריתרוציטים, ליפופרוטאינים ומיקרו-וסיקלים); תגובות של מסלול חלבון C; אי-פעילות של אנזימי קרישה (על הממברנות של תאי האנדותל בהשתתפות קומפקטורים טרומבודולין, קולטן חלבון אנדותל C, הפארן סולפט); ותגובות מסלול מגע (על ממברנות של טסיות דם וכמה מיקרו-סיביות בהשתתפות גורמים משלימים לא ידועים). לכן, אי אפשר לחקור קרישת דם מבלי לחקור את האינטראקציה של חלבוני פלזמה שונים עם קרום תאי הדם.
מאמר זה מתאר שיטה מבוססת זרימה-ציטומטריה לאפיון האינטראקציה של חלבונים עם ממברנות ליפידים של תאים או מיקרו-וסיקלים. גישה זו הוצעה בתחילה כדי לחקור את האינטראקציה של פלזמה בדם עם טסיות דם ושלפוחיות פוספוליפיד מלאכותיות. יתר על כן, רוב החלבונים שנחקרו מתקשרים ישירות עם פוספוליפידים של ממברנה טעונה שלילית, במיוחד עם פוספטידיל-סרין 4,5. בנוסף, ישנם חלבונים שהאינטראקציה שלהם עם הממברנה מתווכת על ידי קולטנים מיוחדים6.
יכולת חשובה של ציטומטריית זרימה היא הבחנה בין ליגנדות חופשיות וכבולות ללא הפרדה נוספת. תכונה זו של ציטומטריה מאפשרת לחקור את קשירת שיווי המשקל של ליגנד בנקודת הקצה ומסייעת בביצוע מדידות קינטיות רציפות. הטכניקה אינה מתוחכמת ואינה דורשת הכנת דגימה מורכבת. ציטומטריית זרימה משמשת באופן פעיל כדי לחקור באופן כמותי את הדינמיקה של אינטראקציה בין פפטידים פלואורסצנטיים, קולטנים וחלבוני G בנויטרופילים שלמים וחדירי דטרגנטים7. גישה זו ישימה גם לחקר אינטראקציות חלבון-דנ"א והקינטיקה של פעילות אנדונוקלאז בזמן אמת8. עם הזמן, שיטה זו שימשה למחקר כמותי של אינטראקציות חלבון-חלבון בעלות זיקה גבוהה עם שלפוחיות שומניםמטוהרות 9, או, באופן כללי יותר, עם חלבוני ממברנה המתבטאים במערכת ביטוי יעילה ביותר של תאי Sf910. שיטות כמותיות תוארו גם לאפיון אינטראקציות חלבון-ליפוזום באמצעות ציטומטריה של זרימה עבור חלבוני טרנס-ממברנה11.
טכניקה זו משתמשת בחרוזי כיול מתוצרת עצמית כדי להימנע משימוש בחרוזים זמינים מסחרית7. חרוזי הכיול ששימשו בעבר7 נועדו לעבוד עם פלואורסציין, מה שהגביל באופן מהותי את מבחר הליגנדות הפלואורסצנטיות הנגישות על החלבונים. בנוסף, מאמר זה מציע דרך חדשה לרכוש ולנתח נתונים קינטיים לרזולוציה סבירה של זמן. למרות ששיטה זו מתוארת עבור שלפוחיות פוספוליפיד מלאכותיות, אין מגבלות ברורות על יכולת ההסתגלות שלה לתאים, בועיות טבעיות או שלפוחיות פוספוליפיד מלאכותיות עם הרכב שומנים שונה. השיטה המתוארת כאן מאפשרת הערכה של הפרמטרים של אינטראקציה (kon, koff) ושיווי משקל (Kd) ומאפשרת אפיון כמותי של מספר אתרי קשירת החלבונים על הממברנה. שים לב שטכניקה זו מספקת הערכה משוערת של מספר אתרי הקישור. היתרונות של השיטה הם הפשטות היחסית שלה, הנגישות ויכולת ההסתגלות שלה לתאים מקומיים ולמיקרו-ווסיקלים טבעיים ומלאכותיים.
Protocol
1. תיוג חלבונים פלואורסצנטיים
- הכנת חומרים
- הכן 1 M נתרן bicarbonate buffer, pH 9.0, לאחסן אותו ב 4 ° C, ולהשתמש בו בתוך שבוע אחד.
- מכינים 1.5 M הידרוקסילאמין הידרוכלוריד בופר, pH 8.5, מיד לפני השימוש.
- הכינו תמיסה של 10 מ"ג/מ"ל של צבע פלואורסצנטי (ראו טבלת החומרים) בדימתילסולפוקסיד.
הערה: ניתן לאחסן פתרון זה למשך חודש בטמפרטורה של -20 מעלות צלזיוס בחושך. - הכינו תמיסות של נוגדנים מטוהרים או חלבונים אחרים במינון של 1-10 מ"ג/מ"ל.
הערה: הימנעו ממאגרים המכילים יוני אמוניום או אמינים ראשוניים. החלף את המאגרים המכילים Tris או גליצרול במי מלח בעל מאגר פוספט (PBS) על ידי דיאליזה. לא נתרן אזיד (≤3 mM) ולא תימרוסל (≤1 mM) ישפיעו באופן משמעותי על תגובת ההצמדה. - דגירה של מדיום סינון הג'ל (ראו טבלת החומרים) לטיהור חלבונים ב-PBS למשך הלילה בטמפרטורת החדר או למשך שעתיים ב-60 מעלות צלזיוס. יש למרוח את מדיום סינון הג'ל על עמודי ספין עם ממברנות של 0.2 מיקרומטר.
- חשב את כמות הצבע הריאקטיבי שישמש לכל תגובה בהתאם לריכוז החלבון שיש לסמן באמצעות Eq (1).
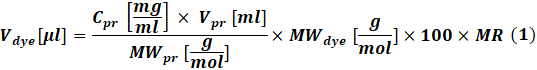
כאשרצבע V הוא נפח תמיסת מלאי הצבע; Cpr, Vpr ו- MWpr הוא הריכוז, הנפח והמשקל הטוחן של החלבון; צבע MW הוא משקל הטוחנות של הצבע; 100 הוא גורם המרת יחידה; MR הוא היחס הטוחן בין צבע לחלבון בתערובת התגובה.
הערה: ה- MRs הבאים מומלצים לתגובות תיוג IgG: MR = 40 אם הנוגדן הוא ב 1-3 מ"ג / מ"ל או MR = 30 אם הנוגדן הוא ב 4-10 מ"ג / מ"ל. עבור גורמי קרישה, MR = 5 משמש בדרך כלל. - תגובת ההצמדה
- בצינור תגובה, ערבבו את תמיסת החלבון עם נפח נמוך פי 10 של תמיסת ביקרבונט 1 M.
- הוסיפו את הכמות הנדרשת של צבע פלואורסצנטי (ראו שלב 1.2) עם ערבוב רציף.
- דגירה של תערובת התגובה בטמפרטורת החדר למשך כשעה, מוגנת מפני אור ועם ערבוב מתמשך.
- עבור כל תמיסת חלבון של 200 μL, יש להוסיף 5 μL של 1.5 M hydroxylamine hydrochloride.
- דגירה של תערובת התגובה בטמפרטורת החדר למשך כ-30 דקות, מוגנת מפני אור ועם ערבוב מתמשך.
- הכן את עמודת הספין.
- הוסיפו 500 μL של מדיום סינון ג'ל לטיהור חלבונים לעמודה. צנטריפוגה של העמודה במשך 3 דקות ב-1,000 × גרם.
- השליכו את המאגר מצינור האיסוף. אם העמודה אינה מלאה, הוסיפו עוד מדיום סינון ג'ל, וצנטריפוגה של העמודה למשך 3 דקות ב-1,000 × גרם. חזור על שלב זה עד שהעמודה תתמלא.
- טיהור
- צנטריפוגה של תערובת התגובה (משלב 1.3.5) למשך 5 דקות ב-17,000 × גרם והסירו את המזרז.
- מעבירים את הסופרנט לעמודת הספין עם מדיום סינון ג'ל. אפשרו לתמיסה להיספג במיטת הג'ל.
- השתמש בצינור איסוף ריק עבור עמודת הספין וצמצם אותו למשך 5 דקות ב- 1,000 × גרם. לאחר צנטריפוגה, אספו את החלבון המסומן מצינור האיסוף.
- קביעת מידת התיוג
- נכון לתרומת הצבע לספיגה ב-A280 על ידי מדידת הספיגה של צבע חופשי ב-280 ננומטר (A280) וה-λ max עבור הצבע (Amax) (ראו Eq (2)).
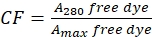 (2)
(2) - מדוד את הספיגה של צמד הצבעים-חלבוניים ב-280 ננומטר (A280) ואת ה-λmax עבור הצבע (Amax) וחשב את ההצמדה של החלבון באמצעות Eq (3).
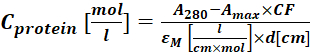 (3)
(3)
כאשר εM הוא מקדם ההכחדה הטוחנת של החלבון ב-280 ננומטר; d הוא אורך הנתיב האופטי במהלך מדידת הספיגה; CF הוא התרומה של הצבע לספיגה ב-A280 (שלב 1.6.1). - חשב את מידת הסימון (DOL) באמצעות Eq (4).
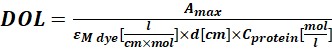 (4)
(4)
כאשר צבע M ε הוא מקדם ההכחדה הטוחנת של הצבע ב-λmax nm; d הוא אורך הנתיב האופטי במהלך מדידת הספיגה; חלבון C הוא ריכוז החלבון (שלב 1.6.2).
- נכון לתרומת הצבע לספיגה ב-A280 על ידי מדידת הספיגה של צבע חופשי ב-280 ננומטר (A280) וה-λ max עבור הצבע (Amax) (ראו Eq (2)).
2. הכנת שלפוחיות פוספוליפידים
- הכנה ואחסון של תערובת השומנים
- שלבו את השומנים ביחס המתאים (פוספטידיל-סרין/פוספטידילכולין ביחס של 20% מול% ל-80 מול%).
- מייבשים את תערובת השומנים לאחר ליופיליזציה או אידוי ומאחסנים אותה תחת אווירה אינרטית באמפולות זכוכית.
- הפקת סרט ליפידים
- פתחו את האמפולה, והחזירו את תערובת השומנים בכמות קטנה (כ-100 מיקרול') של כלורופורם.
הערה: אין להשתמש ביותר מדי כלורופורם מכיוון שהוא אינו מתאדה לחלוטין. - הוסף את DiIC16(3) באתנול ב- 0.2 mol%. מעבירים את תערובת השומנים לבקבוקון תחתון עגול. מורחים את התערובת דק על צידי הבקבוקון על ידי סיבובה. מייבשים את תערובת השומנים במשך 30 דקות מתחת לזרם ארגון.
- פתחו את האמפולה, והחזירו את תערובת השומנים בכמות קטנה (כ-100 מיקרול') של כלורופורם.
- לחות של תערובת השומנים
- הוסיפו חיץ מימי חם (כ-55 מעלות צלזיוס) (HEPES 20 mM, NaCl 140 mM, pH 7.4) בנפח המתאים לריכוז השומנים הצפוי בבקבוקון עם סרט השומנים. דגירה של התערובת עם מערבולת בטמפרטורה של 55 °С למשך 30 דקות לצורך הידרציה מלאה.
- הנחת צינור הדגימה במקפיא או בתרמוסטט חם כדי לגרום לתרחיף השומנים לעבור 3-5 מחזורי הפשרה בהקפאה.
- היווצרות שלפוחיות שומנים על ידי שחול
- הכן את האקסטרודר על פי הוראות היצרן. חממו את כל מרכיבי האקסטרודר לטמפרטורת מעבר הפאזה של תערובת השומנים.
- מלאו את אחד המזרקים של האקסטרודר בתערובת השומנים הלחים. יש להמתין 5-10 דקות עד שהטמפרטורה של תרחיף השומנים תתאזן עם טמפרטורת האקסטרודר.
- מוציאים את תערובת השומנים דרך הממברנה לפחות 10 פעמים. עבור ההבלטה הסופית, מניחים את מתלה השומנים במזרק החלופי ומחפשים שינוי במראה מתמיסה מעט ערפילית לתמיסה ברורה.
- אחסנו את התערובת המתקבלת של שלפוחיות שומנים בטמפרטורה של 4 מעלות צלזיוס, רצוי באטמוספרה אינרטית של ארגון או חנקן, למשך 3-4 ימים. אין לקפוא.
3. בידוד טסיות הדם מדם שלם
- אספו דם שלם מתורמים בריאים בצינורות המכילים 3.2% נתרן ציטראט.
- הוסיפו לדם פרוסטגלנדין E1 (PGE1) (1 μM) ואפסיס (0.1 U/mL), ולאחר מכן צנטריפוגה בטמפרטורת החדר ב-100 × גרם למשך 8 דקות.
- לאחר צנטריפוגה, קחו את הפלזמה העשירה בטסיות דם והוסיפו תמיסת נתרן ציטראט (106 mM, pH 5.5) ליחס פלזמה/ציטראט של 3:1. צנטריפוגה הפלזמה בטמפרטורת החדר ב 400 × גרם במשך 5 דקות.
- הסר את הסופרנטנט, והחזיר את הכדור ב-300 μL של המאגר של Tyrode ללא BSA (20 mM HEPES, 150 mM NaCl, 2.7 mM KCl, 1 mM MgCl2, 0.4 mM NaH2PO4, 2.5 mM CaCl2, 5 mM גלוקוז, pH 7.4). טהרו את הטסיות מחלבוני פלזמה על ידי כרומטוגרפיית ג'ל על מדיום סינון הג'ל לטיהור טסיות דם (ראו טבלת החומרים).
4. זיהוי של חלבון - אינטראקציה שומנים על ידי ציטומטריה זרימה
- ניסויי קשירה קינטית
- שלפוחיות פוספוליפידים מדוללות (משלב 2.4.4) במאגר של טירוד (20 mM HEPES, 150 mM NaCl, 2.7 mM KCl, 1 mM MgCl2, 0.4 mM NaH2PO4, 2.5 mM CaCl2, 5 mM גלוקוז, 0.5% BSA, pH 7.4) לריכוז של 1 μM ונפח כולל של 250 μL.
- ערבבו גורם קרישה בעל תווית פלואורסצנטית X (fX-fd) משלב 1 בריכוז של 500 ננומטר עם שלפוחיות הפוספוליפידים משלב 4.1.1 ביחס של 1:1 (ריכוז השלפוחית הסופי 0.5 μM, ריכוז fX-fd הוא 250 ננומטר של fX) לנפח כולל של 500 μL.
- הזריקו מיד את ה-500 μL של ההשעיה המעורבת (כ-20 דקות לניתוח עם קצב זרימה נמוך) לתוך ציטומטר הזרימה. השתמש בקצב זרימה נמוך וודא שהסף עבור ערוץ FL2 (אקספוזיציה 488 ננומטר, מסנן פליטה 585/42 ננומטר) הוא כערך 200. מדוד את הפלואורסצנציה הממוצעת בערוץ FL4 (אקסניטציה 633 ננומטר, מסנן פליטה 660/20) עבור הצבע הפלואורסצנטי מטבלת החומרים.
הערה: בחר ציטומטר ללא דגימה אוטומטית. זה יאיץ את תהליך ההזרקה של הדגימה לתוך תא המדידה. - כאשר מתבצעת רוויה של קשירת קשר (אין עלייה משמעותית בפלואורסצנציה תוך 5 דקות), דיללו במהירות את הדגימה פי 20 עם המאגר של טירוד, ועקבו אחר הדיסוציאציה עד להגעה לפלואורסצנציה הבסיסית (דיסוציאציה מוחלטת) או עד להגעה למישור (אין ירידה משמעותית בפלואורסצנציה תוך 5 דקות).
הערה: כבקרה, הוסף 10 μM EDTA ופקח על דיסוציאציה מלאה למשך 5 דקות.
- ניסויי קשירת שיווי משקל
הערה: השתמש בעקומה הקינטית של הכריכה כדי לקבוע את הזמן להגיע לרוויה; הזמן לרוויה עבור fX-fd ושלפוחית מלאכותית הוא 20 דקות.- דגירה שלפוחיות פוספוליפיד מלאכותיות (5 μM) לצורך בדיקת הקישור עם ריכוזים שונים של fX-fd (מ-0 עד 1,000 ננומטר) במאגר של טירוד למשך 20 דקות.
- דיללו כל דגימה משלב 4.2.1 על 20x לנפח סופי של 200 μL עם המאגר של Tyrode. נתח מיד את המדגם המדולל על ידי ציטומטריית זרימה תוך 30 שניות. השתמש בהגדרות משלב 4.1.3.
הערה: כבקרה לקשירת קשירה לא ספציפית, השתמש בדגימות דומות עם EDTA (10 μM) ודגירה שלהן למשך 5 דקות.
5. ניתוח נתוני ציטומטריה של זרימה
- ייצא ניסויים בפורמט FSC מתוכנת רכישת נתונים ציטומטריה לתוכנת ציטומטר לניתוח נתונים (ראה טבלת חומרים). בחר | קובץ ייצוא | קבצי FCS. פתח קבצי FSC בתוכנת ציטומטר לניתוח נתונים על ידי בחירת הקבצים במחשב וגרירתם לסביבת העבודה של התוכנית.
- עבור gating של microvesicles, לזהות את האזור של microvesicles על ידי פלואורסצנציה של צבע lipophilic DiIC16(3). השתמש בפקודות תפריט או בלחצן עלילה בגליון העבודה כדי ליצור SSC של תרשים נקודה מ- FL2 (צבע DilC16(3)) בקואורדינטות יומן. בחרו בלחצן 'שער מלבני' כדי לצייר אזור גידור כך שאירועים מדגימה ללא שלפוחיות לא ייכללו באזור זה (איור 1B,C).
- לנתח את הניסויים הקינטיים.
- יצירת תרשים נקודה באמצעות הקואורדינטות של פלואורסצנציה (FL4) לאורך זמן עבור אזור הבועיות (לחיצה כפולה באזור הבועיות בשלב 5.2)
- ייצא את הנתונים על השינוי בפלואורסצנציה לאורך זמן בפורמט csv. בחר | לדוגמה לחץ באמצעות לחצן העכבר הימני על | ייצוא | בחר FL4 ושעה בפרמטרים | בחר ספריה לשמירת | בחר תבנית CSV | ייצוא.
- פתח את קובץ ה- CSV בכל תוכנה סטטיסטית (ראה טבלת החומרים). חשב ממוצע נע פשוט של פלואורסצנציה וזמן עבור כל 1,000 אירועים.
- הערך גרף של התלות של הפלואורסצנציה הממוצעת הנעה הפשוטה בזמן תחת ההנחה של תלות מעריכית (ניתוח > התאמת >התאמה של עקומה ננו-ליניארית) והשתמש בו כדי לחשב את קבוע הקשר הקינטי באמצעות Eq (5).
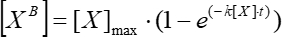 (5)
(5)
כאשר [XB] הוא ריכוז הגורם הכבול בכל רגע של זמן (יחידות המוגדרות על ידי המשתמש) על פי הממוצע הנע הפשוט משלב 5.3.3; [X] הוא ריכוז הגורם הנוסף; [X] מקסימום הוא ריכוז הגורם הכבול המרבי; k הוא קבוע האסוציאציה; t הוא הזמן. - חזור על אותה קבוצת פעולות (5.3.1-5.3.4) כדי לחשב את קבוע הדיסוציאציה הקינטית באמצעות Eq (6).
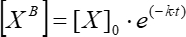 (6)
(6)
כאשר [XB] הוא ריכוז הגורם הכבול בכל רגע של זמן; [X]0 הוא ריכוז הגורם הכבול ברגע הזמן הראשוני; k הוא קבוע הדיסוציאציה; t הוא הזמן.
- מבחן איגוד שיווי משקל
- קבע את הפלואורסצנציה הממוצעת של fX-fd באזור הבועיות עבור כל ריכוז שנבחר של fX-fd.
- הערך את התלות של הפלואורסצנציה של הגורם הכבול מריכוז הגורם הנוסף בהנחה של קשירה פשוטה באתר יחיד. חשב את פרמטרי הכריכה הממוצעים באמצעות Eq (7) משלוש חזרות בלתי תלויות לכל הפחות.
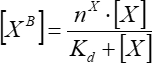 (7)
(7)
כאשר [XB] הוא ריכוז הגורם המאוגד; [X] הוא ריכוז הגורם הנוסף; nx הוא המספר הנראה לעין של אתרי קשירה לכל שלפוחית; Kd הוא קבוע הדיסוציאציה לכאורה.
6. המרת עוצמת הפלואורסצנציה למספר הממוצע של אתרי הקישור
- הכינו חרוזים מכוילים.
- טסיות אינקובציה מסוננות ג'ל (ראה שלב 3.3) עם A23187 (10 μM) בנוכחות CaCl2 (2.5 mM) למשך 10 דקות בטמפרטורת החדר.
- הוסיפו לטסיות המופעלות את הריכוזים השונים של fX-fd (0 עד 1,000 ננומטר). הוסיפו 2% v/v פורמלדהיד ודגירה למשך שעה אחת. עצרו את התגובה על ידי דגירה של הטסיות עם 3 M גליצין ו-5% BSA למשך 30 דקות בטמפרטורת החדר.
- לטהר את התערובת מהצבע שלא שוחזר. צנטריפוגה של הטסיות במשך 5 דקות ב-400 × גרם, הסר את הסופרנטנט והחזיר את הכדור למאגר של טירוד (המכיל 0.5% BSA).
הערה: חזור על שלב 6.1.3 שלוש פעמים.
- מדוד את רמת הפלואורסצנציה של חרוזי הכיול בכל דגימה תחילה באמצעות ספקטרופלואורומטר (עבור צבע פלואורסצנטי מטבלת החומרים, עירור 633 ננומטר, פליטה 670 ננומטר) ולאחר מכן באמצעות ציטומטר הזרימה (בערוץ FL4: עירור 633 ננומטר, מסנן פליטה 660/20). באמצעות מונה תאים, קבע את מספר החרוזים בכל דגימה.
- המר את עוצמת הפלואורסצנציה של כל דגימת חרוזים בהתאמה לריכוז של צבע פלואורסצנטי מסיס באמצעות ספקטרופלואורומטר. חישוב מחדש של ריכוז הצבע הפלואורסצנטי עבור מספר מולקולות הפלואורופור באמצעות Eq (8).
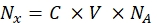 (8)
(8)
כאשר Nx הוא מספר מולקולות הפלואורופור; C הוא ריכוז הצבע הפלואורסצנטי; NA הוא קבוע אבוגדרו; NA = 6.02214076×1023 מול -1. - צור גרף תלות של הפלואורסצנציה הממוצעת של החרוזים בציטומטר זרימה (שלב 6.2) על מספר מולקולות הפלואורופור (ראה שלב 6.3) עבור כל דגימה באמצעות כל תוכנה סטטיסטית (ראה טבלת החומרים). הערך תלות זו לפי מידתיות קו (ניתוח | התאמת | התאמה ליניארית). מהקירוב ב- Eq (9), חשב את מקדם ההמרה של הפלואורסצנציה הממוצעת לאתרים מחייבים.
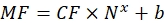 (9)
(9)
כאשר MF הוא הפלואורסצנציה הממוצעת של חרוזים על ידי ציטומטריה של זרימה; Nx הוא מספר מולקולות הפלואורופור לכל חרוז; CF מייצג את מקדם ההמרה של הפלואורסצנציה הממוצעת לאתרים מחייבים. CF ו- b מתקבלים מתוצאות התאמת הגרף על ידי מידתיות ליניארית. - חשב את המספר הנראה של אתרי קשירה לכל שלפוחית של עניין באמצעות Eq (10).
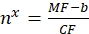 (10)
(10)
כאשר nx הוא המספר הנראה לעין של אתרי קשירה לכל שלפוחית של עניין; MF היא הפלואורסצנטיות הממוצעת של שלפוחיות העניין על ידי ציטומטריית זרימה; CF ו-b הם גורמי המרה מה-Eq (8).
תוצאות
שיטת ציטומטריית הזרימה המתוארת כאן משמשת לאפיון קשירת חלבוני קרישת פלזמה לטסיות דם מופעלות. בנוסף, שלפוחיות פוספוליפיד PS:PC 20:80 יושמו כמערכת מודל. מאמר זה מתמקד בעיקר בשלפוחיות פוספוליפידים מלאכותיות כדוגמה. הפרמטרים של הציטומטר, בפרט, מתח הצינור הפוטומולטיפלייר (PMT) והפיצוי חייבים להיבחר ...
Discussion
ניתן להתאים את השיטה המוצעת לאפיון גס של האינטראקציה של חלבונים עם ממברנות פוספוליפידיות ממקורות והרכבים שונים. הציטומטריה הכמותית של הזרימה המתוארת כאן מוותרת על תהודת פלסמון פני השטח (SPR) במספר פרמטרים. בפרט, יש לו רגישות נמוכה יותר ורזולוציית זמן והוא דורש תיוג פלואורסצנטי של חלבונים. ?...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
המחברים נתמכו על ידי מענק של הקרן הרוסית למדע 20-74-00133.
Materials
| Name | Company | Catalog Number | Comments |
| A23187 | Sigma Aldrich | C7522-10MG | |
| Alexa Fluor 647 NHS Ester (Succinimidyl Ester) | Thermo Fisher Scientific | A37573 | fluorescent dye |
| Apyrase from potatoes | Sigma Aldrich | A2230 | |
| BD FACSCantoII | BD Bioscience | ||
| bovine serum albumin | VWR Life Science AMRESCO | Am-O332-0.1 | |
| Calcium chloride, anhydrous, powder, ≥97% | Sigma Aldrich | C4901-100G | |
| Cary Eclipse Fluorescence Spectrometer | Agilent | ||
| D-(+)-Glucose | Sigma Aldrich | G7528-1KG | |
| DiIC16(3) (1,1'-Dihexadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Thermo Fisher Scientific | D384 | |
| DMSO | Sigma Aldrich | D8418 | |
| EDTA disodium salt | VWR Life Science AMRESCO | Am-O105B-0.1 | |
| FACSDiva | BD Bioscience | cytometry data acquisition software | |
| FlowJo | Tree Star | cytometer software for data analysis | |
| HEPES | Sigma Aldrich | H4034-500G | |
| Human Factor X | Enzyme research | HFX 1010 | |
| Hydroxylamine hydrochloride | Panreac | 141914.1209 | |
| L-α-phosphatidylcholine (Brain, Porcine) | Avanti Polar Lipids | 840053P | |
| L-α-phosphatidylserine (Brain, Porcine) (sodium salt) | Avanti Polar Lipids | 840032P | |
| Magnesium chloride | Sigma Aldrich | M8266-100G | |
| Mini-Extruder | Avanti Polar Lipids | 610020-1EA | |
| OriginPro 8 SR4 v8.0951 | OriginLab Corporation | Statistical software | |
| Phosphate Buffered Saline (PBS) Tablets, Biotechnology Grade | VWR Life Science AMRESCO | 97062-732 | |
| Potassium chloride | Sigma Aldrich | P9541-500G | |
| Prostaglandin E1 | Cayman Chemical | 13010 | |
| Sephadex G25 | GE Healthcare | GE17-0033-01 | gel filtration medium for protein purification |
| Sepharose CL-2B | Sigma Aldrich | CL2B300-500ML | gel filtration medium for platelet purification |
| Sodium bicarbonate | Corning | 61-065-RO | |
| Sodium chloride | Sigma Aldrich | S3014-500G | |
| Sodium phosphate monobasic | Sigma Aldrich | S3139-250G | |
| Spin collumns with membrane 0.2 µm | Sartorius | VS0171 | |
| Trisodium citrate dihydrate | Sigma Aldrich | S1804-1KG |
References
- Hoffman, M., Monroe, D. M. A cell-based model of hemostasis. Thrombosis and haemostasis. 85 (6), 958-965 (2001).
- Roberts, H. R., Hoffman, M., Monroe, D. M. A cell-based model of thrombin generation. Seminars in Thrombosis and Hemostasis. 32, 32-38 (2006).
- Panteleev, M. A., Dashkevich, N. M., Ataullakhanov, F. I. Hemostasis and thrombosis beyond biochemistry: roles of geometry, flow and diffusion. Thrombosis Research. 136 (4), 699-711 (2015).
- Podoplelova, N. A., et al. Hysteresis-like binding of coagulation factors X/Xa to procoagulant activated platelets and phospholipids results from multistep association and membrane-dependent multimerization. Biochimica et Biophysica Acta. 1858 (6), 1216-1227 (2016).
- Panteleev, M. A., Ananyeva, N. M., Greco, N. J., Ataullakhanov, F. I., Saenko, E. L. Two subpopulations of thrombin-activated platelets differ in their binding of the components of the intrinsic factor X-activating complex. Journal of Thrombosis and Haemostasis. 3 (11), 2545-2553 (2005).
- Kotova, Y., et al. Binding of coagulation factor XIII zymogen to activated platelet subpopulations: roles of integrin αIIbβ3 and fibrinogen. Thrombosis and Haemostasis. 119 (6), 906-915 (2019).
- Fay, S. P., Posner, R. G., Swann, W. N., Sklar, L. A. Real-time analysis of the assembly of ligand, receptor, and G protein by quantitative fluorescence flow cytometry. Biochemistry. 30 (20), 5066-5075 (2002).
- Nolan, J. P., Shen, B., Park, M. S., Sklar, L. A. Kinetic analysis of human flap endonuclease-1 by flow cytometry. Biochemistry. 35 (36), 11668-11676 (1996).
- Sarvazyan, N. A., Lim, W. K., Neubig, R. R. Fluorescence analysis of receptor−G protein interactions in cell membranes. Biochemistry. 41 (42), 12858-12867 (2002).
- Sarvazyan, N. A., Neubig, R. R. Analysis of molecular assemblies by flow cytometry: determinants of Gi1 and by binding. Advances in Optical Biophysics. 3256, 122-131 (1998).
- De Franceschi, N., et al. ProLIF - Quantitative integrin protein-protein interactions and synergistic membrane effects on proteoliposomes. Journal of Cell Science. 132 (4), (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved