Method Article
ניתוח מורפולוגיה מיטוכונדריאלית באמצעות סימולציה למידה מבוקרת
In This Article
Summary
מאמר זה מסביר כיצד להשתמש בלמידת מכונה בפיקוח סימולציה לניתוח מורפולוגיה של מיטוכונדריה בתמונות מיקרוסקופיה פלואורסצנטית של תאים קבועים.
Abstract
הניתוח הכמותי של אברונים תת-תאיים כגון מיטוכונדריה בתמונות מיקרוסקופיה פלואורסצנטית של תאים הוא משימה תובענית בגלל האתגרים המובנים בפילוח של מבנים קטנים ומגוונים מורפולוגית אלה. במאמר זה אנו מדגימים את השימוש בצינור סגמנטציה וניתוח בעזרת למידת מכונה לכימות מורפולוגיה מיטוכונדריאלית בתמונות מיקרוסקופיה פלואורסצנטית של תאים קבועים. כלי הפילוח מבוסס הלמידה העמוקה מאומן על תמונות מדומות ומבטל את הדרישה לביאורים של אמת קרקעית ללמידה עמוקה מפוקחת. אנו מדגימים את התועלת של כלי זה על תמונות מיקרוסקופיה פלואורסצנטית של קרדיומיובלסטים קבועים עם ביטוי יציב של סמני מיטוכונדריה פלואורסצנטיים ומשתמשים בתנאי תרבית תאים ספציפיים כדי לגרום לשינויים במורפולוגיה המיטוכונדריאלית.
Introduction
במאמר זה אנו מדגימים את התועלת של כלי למידת מכונה מבוסס פיזיקה לסגמנטציה תת-תאית1 בתמונות מיקרוסקופיה פלואורסצנטית של קרדיומיובלסטים קבועים המבטאים סמני מיטוכונדריה פלואורסצנטיים.
מיטוכונדריה הם האברונים העיקריים המייצרים אנרגיה בתאי יונקים. באופן ספציפי, מיטוכונדריה הם אברונים דינמיים מאוד והם נמצאים לעתים קרובות ברשתות המשתנות כל הזמן באורך ובהסתעפות. צורת המיטוכונדריה משפיעה על תפקודם, ותאים יכולים לשנות במהירות את המורפולוגיה המיטוכונדריאלית שלהם כדי להסתגל לשינוי בסביבה2. כדי להבין את התופעה, הסיווג המורפולוגי של המיטוכונדריה כנקודות, מוטות או רשתות הוא אינפורמטיבי מאוד3.
פילוח המיטוכונדריה חיוני לניתוח המורפולוגיה המיטוכונדריאלית בתאים. השיטות הנוכחיות לפלח ולנתח תמונות מיקרוסקופיה פלואורסצנטית של מיטוכונדריה מסתמכות על סגמנטציה ידנית או על גישות עיבוד תמונה קונבנציונליות. גישות מבוססות סף כגון Otsu4 הן פחות מדויקות בשל רמות הרעש הגבוהות בתמונות מיקרוסקופיה. בדרך כלל, תמונות לניתוח מורפולוגי של המיטוכונדריה כוללות מספר רב של מיטוכונדריה, מה שהופך את הפילוח הידני למייגע. גישות מתמטיות כמו MorphoLibJ5 וגישות למידת מכונה מפוקחות למחצה כמו Weka6 הן תובעניות מאוד ודורשות ידע מקצועי. סקירה של טכניקות ניתוח התמונה עבור מיטוכונדריה7 הראתה כי טכניקות מבוססות למידה עמוקה עשויות להיות שימושיות למשימה. ואכן, פילוח תמונות בתמונות מחיי היומיום עבור יישומים כגון נהיגה עצמית עבר מהפכה עם השימוש במודלים מבוססי למידה עמוקה.
למידה עמוקה היא תת-קבוצה של למידת מכונה המספקת אלגוריתמים שלומדים מכמויות גדולות של נתונים. אלגוריתמים מפוקחים של למידה עמוקה לומדים קשרים מקבוצות גדולות של תמונות המבוארות עם תוויות האמת הקרקעית (GT) שלהן. האתגרים בשימוש בלמידה עמוקה מפוקחת לפילוח מיטוכונדריה בתמונות מיקרוסקופיה פלואורסצנטית הם כפולים. ראשית, למידה עמוקה מפוקחת דורשת מערך נתונים גדול של תמונות אימון, ובמקרה של מיקרוסקופיה פלואורסצנטית, אספקת מערך נתונים גדול זה תהיה משימה נרחבת בהשוואה לשימוש בתמונות מסורתיות מבוססות מצלמה הזמינות בקלות רבה יותר. שנית, תמונות מיקרוסקופיה פלואורסצנטיות דורשות ביאורים GT של האובייקטים המעניינים בתמונות האימון, שהיא משימה מייגעת הדורשת ידע מקצועי. משימה זו יכולה בקלות לקחת שעות או ימים מזמנו של המומחה לתמונה אחת של תאים עם מבנים תת-תאיים המסומנים באופן פלואורסצנטי. יתר על כן, וריאציות בין ביאורים מהווים בעיה. כדי להסיר את הצורך בביאור ידני, וכדי להיות מסוגלים למנף את הביצועים המעולים של טכניקות למידה עמוקה, נעשה כאן שימוש במודל סגמנטציה מבוסס למידה עמוקה שהוכשר על תמונות מדומות. סימולטורים מבוססי פיזיקה מספקים דרך לחקות ולשלוט בתהליך היווצרות התמונה במיקרוסקופ, ומאפשרים יצירת תמונות של צורות ידועות. תוך שימוש בסימולטור מבוסס פיזיקה, נוצר לשם כך מערך נתונים גדול של תמונות מיקרוסקופיה פלואורסצנטיות מדומות של מיטוכונדריה.
הסימולציה מתחילה ביצירת גיאומטריה באמצעות עקומות פרמטריות ליצירת צורה. פולטים ממוקמים באופן אקראי על פני הצורה באופן מפוזר באופן אחיד כך שהצפיפות תואמת את ערכי הניסוי. פונקציית התפשטות נקודה תלת-ממדית (PSF) של המיקרוסקופ מחושבת באמצעות קירוב יעיל מבחינה חישובית8 של מודל גיבסון-לני9. כדי להתאים באופן הדוק את התמונות המדומות לתמונות ניסיוניות, הן הזרם הכהה והן רעש הצילום מדומים כדי להשיג ריאליזם של תמונות. ה- GT הפיזי נוצר בצורה של מפה בינארית. הקוד ליצירת מערך הנתונים ולאימון מודל הסימולציה זמין10, והשלב ליצירת מערך נתונים מדומה זה מתואר באיור 1.
אנו מציגים את התועלת של סגמנטציה מבוססת למידה עמוקה המאומנת כולה על מערך נתונים מדומה על ידי ניתוח תמונות מיקרוסקופיה קונפוקלית של קרדיומיובלסטים קבועים. קרדיומיובלסטים אלה ביטאו סמן פלואורסצנטי בקרום החיצוני של המיטוכונדריה, מה שאפשר הדמיה של המיטוכונדריה בתמונות המיקרוסקופיה הפלואורסצנטית. לפני ביצוע הניסוי שניתן כדוגמה כאן, התאים היו משוללים גלוקוז והותאמו לגלקטוז במשך 7 ימים בתרבית. החלפת גלוקוז במצע הגדילה בגלקטוז מאלצת את התאים בתרבית להפוך לחמצון יותר, ובכך להיות תלויים במיטוכונדריה שלהם לייצור אנרגיה11,12. יתר על כן, זה הופך את התאים לרגישים יותר לפגיעה במיטוכונדריה. שינויים במורפולוגיה של המיטוכונדריה יכולים להיות מושרים באופן ניסיוני על-ידי הוספת חומר אי-חיבור מיטוכונדריאלי כגון קרבוניל ציאניד m-כלורופניל הידרזון (CCCP) לתרבית התאים13. CCCP מוביל לאובדן הפוטנציאל של קרום המיטוכונדריה (ΔΨm) ובכך גורם לשינויים במיטוכונדריה ממורפולוגיה צינורית יותר (דמוית מוט) למורפולוגיה כדורית יותר (דמוית נקודה)14. בנוסף, המיטוכונדריה נוטה להתנפח במהלך טיפול CCCP15. אנו מציגים את ההתפלגות המורפולוגית של השינויים במיטוכונדריה כאשר הקרדיומיובלסטים המותאמים לגלקטוז טופלו ב-CCCP המיטוכונדריאלי. פילוחי הלמידה העמוקה של המיטוכונדריה אפשרו לנו לסווג אותם כנקודות, מוטות או רשתות. לאחר מכן גזרנו מדדים כמותיים כדי להעריך את אורכי הענפים ואת השפע של הפנוטיפים המיטוכונדריאליים השונים. שלבי הניתוח מתוארים באיור 2, והפרטים של תרבית התאים, ההדמיה, יצירת מערך הנתונים לסגמנטציה מבוססת למידה עמוקה, כמו גם הניתוח הכמותי של המיטוכונדריה, מובאים להלן.
Protocol
הערה: ניתן להשמיט את סעיפים 1-4 אם עובדים עם תמונות מיקרוסקופיה קיימות של מיטוכונדריה בתנאי ניסוי ידועים.
1. תרבית תאים
- לגדל את תאי H9c2 ב-DMEM ללא תוספת גלוקוז עם 2 mM L-גלוטמין, 1 mM נתרן פירובט, 10 mM גלקטוז, 10% FBS, 1% סטרפטומיצין/פניצילין, ו-1 מיקרוגרם/מ"ל פורומיצין. אפשרו לתאים להסתגל לגלקטוז במשך 7 ימים לפחות בתרבית לפני הניסויים.
הערה: תאי H9c2 המשמשים כאן הונדסו גנטית כדי לבטא מיטוכונדריה פלואורסצנטית ורכשו גם גן עמידות לפורומיצין. תוספת של אנטיביוטיקה זו מבטיחה את הצמיחה של תאים עם גן ההתנגדות, ובכך, מיטוכונדריה פלואורסצנטית. - זרעו את תאי H9c2 לניסוי כאשר מפגש התאים מגיע לכ-80% (בקבוקון תרבית T75, המוערך על ידי מיקרוסקופ ברייטפילד). מחממים מראש את המדיום וטריפסין ל-37 מעלות צלזיוס למשך 15 דקות לפחות לפני שממשיכים.
הערה: ניתן לבצע את הניסוי במקביל לשני תנאים שונים או יותר של תרביות תאים. מפגש תאי H9c2 לא צריך להיות מעל 80% כדי למנוע אובדן של תאים מיובלסטיים. במפגש של 100%, התאים יוצרים מיוטיובים ומתחילים להתמיין. - היכונו לזריעת התאים, הפועלים במכסה מנוע זרימה למינרית סטרילית, על ידי הצבת כיסוי זכוכית #1.5 לכל תנאי ניסוי בבאר של צלחת 12 באר. תייג כל תנאי ואת פרטי הניסוי על צלחת 12 הבאר.
- הזיזו את בקבוק תרבית התאים מהאינקובטור אל משטח העבודה במכסה המנוע. שאפו את המדיום באמצעות מערכת שאיפה או פיפטה אלקטרונית, ולאחר מכן לשטוף פעמיים עם 5 מ"ל של PBS (טמפרטורת החדר).
- להעביר את טריפסין מחומם מראש אל משטח העבודה, ולשאוף את שטיפת PBS הסופית; לאחר מכן, הוסף את הטריפסין שחומם מראש כדי לנתק את התאים (1 מ"ל עבור בקבוק תרבית T75). החזירו את בקבוק התרבית לחממה למשך 2-3 דקות בטמפרטורה של 37 מעלות צלזיוס.
- הזיזו את המדיום שחומם מראש אל משטח העבודה לקראת סוף הדגירה. ודא שהתאים התנתקו באמצעות מיקרוסקופ שדה בהיר.
- אם כל התאים לא התנתקו, יש למרוח מספר ברזים זהירים אך יציבים על צד הבקבוקון כדי לנתק את התאים הנותרים.
- החזירו את בקבוק התרבית למשטח העבודה. הוסף 4 מ"ל של מדיום תרבית תאים לבקבוקון התרבית באמצעות פיפטה אלקטרונית כדי לעצור את פעולת הטריפסין. בעת הוספת מדיום תרבית לבקבוקון, השתמש בפיפטה כדי לפזר שוב ושוב את המדיום על פני השטח כדי לנתק ולאסוף את התאים לתוך תרחיף תאים.
- צמחו את מתלה התא (5 מ"ל) מהבקבוקון לצינור של 15 מ"ל.
- צנטריפוגה התאים ב 200 x גרם במשך 5 דקות. פתח את הצינור במכסה המנוע, הסר את הסופר-נטנט על ידי שאיפה, והשהה את גלולת התא בעדינות ב-5 מ"ל של מדיה של תרבית תאים.
- הערך את מספר התאים על-ידי ניתוח נפח קטן של תרחיף התאים במונה תאים אוטומטי. שים לב למספר התאים החיים למיליליטר של מדיה תרבית.
- העבר את הנפח הרצוי (לדוגמה, 150 μL לכל באר) של תרחיף התא, המחושב עבור צפיפות זריעה של כ 2 x 104 תאים / ס"מ2, לתוך צינור צנטריפוגה מסומן מראש 15 מ"ל. הוסף את מדיום תרבית התאים המחוממת מראש לצינור הצנטריפוגה של 15 מ"ל בנפח מחושב מראש בהתבסס על מספר הבארות. עבור לוחות של 12 בארות, השתמש בנפח כולל של 1 מ"ל עבור כל באר.
- ודא כי מתלה התא המדולל מעורבב כראוי על ידי צינורית התוכן של צינור הצנטריפוגה למעלה ולמטה מספר פעמים לפני חלוקת הנפח המתאים לכל באר. לאחר חלוקת תרחיף התאים בבאר, נערו את הצלחת בצורה מבוקרת בקפידה לכל כיוון כדי לפזר טוב יותר את התאים ברחבי הבארות. הכניסו את צלחת 12 הבארות לתוך האינקובטור בטמפרטורה של 37 מעלות צלזיוס עד למחרת.
- בדוק את התאים עם מיקרוסקופ שדה בהיר כדי להעריך את הצמיחה. אם התאים השיגו צמיחה מספקת לכ-80% מפגש, המשך לשלבים הבאים; אחרת, חזור על ההערכה מדי יום עד להגעה לצמיחה מספקת.
2. הליך ניסיוני
- חשב את הכמויות הדרושות של החומרים לניסוי על פי ריכוזי התמיסה במלאי. הפשירו את החומרים הקפואים (תמיסת מלאי CCCP של 30 mM) בטמפרטורה של 37 מעלות צלזיוס, והגדירו את תרבית התאים לחום מקדים בטמפרטורה של 37 מעלות צלזיוס.
- לאחר ההפשרה, צור פתרון עובד של 10 μM CCCP על ידי דילול תמיסת המלאי (1:3,000) במדיום תרבית תאים.
הערה: אין לבצע פיפטה בנפחים הנמוכים מ- 1 μL. - התחל את הטיפולים הניסיוניים לאחר שכל החומרים הדרושים מוכנים ומחוממים מראש. שאפו את מדיום תרבית התאים מהבארות של צלחת 12 הבארות, ולאחר מכן החילו במהירות את המדיום הטרי שחומם מראש על בארות הבקרה ואת המדיום המחומם מראש עם תמיסת CCCP של 10 μM על בארות מצב הבדיקה.
- דגירה של צלחת 12 בארות באינקובטור התאים של 37 מעלות צלזיוס למשך שעתיים. במהלך תקופת הדגירה, הכינו את פתרון הקיבוע.
- להכנת תמיסת הקיבוע, השתמש בתמיסת פרפורמלדהיד 4% (PFA) מוכנה מראש כדי לדלל תמיסת מלאי של 25% גלוטראלדהיד (GA) ל-0.2% (1:125). הגדר את התמיסה לחימום מקדים בטמפרטורה של 37°C. עבור צלחת 12 באר, 500 μL מספיק לכל באר.
אזהרה: PFA ו-GA הם כימיקלים רעילים. עבוד במכסה מנוע כימי עם ציוד מגן. עיין ב- SDS המתאים שלהם לקבלת פרטים. - כאשר תקופת הדגירה הושלמה, הסר את צלחת 12 באר מן החממה, ומניחים אותו על משטח העבודה.
הערה: העבודה אינה דורשת עוד סביבה סטרילית. - שאפו את מדיום תרבית התאים מהבארות, והחלו את פתרון הקיבוע המחומם מראש. החזירו את צלחת ה-12 לאינקובטור של 37 מעלות צלזיוס למשך 20 דקות.
- שאפו את תמיסת הקיבוע עם השלמת הדגירה, ושטפו כל באר פעמיים עם PBS בטמפרטורת החדר. ניתן להשהות את הניסוי בשלב זה של הפרוטוקול ולהמשיך בהמשך.
- אם הניסוי מושהה, הוסיפו 1 מ"ל של PBS לכל באר, אטמו את צלחת 12 הבאר עם סרט פלסטיק (פרפילם), ואחסנו בטמפרטורה של 4 מעלות צלזיוס.
3. צביעה והרכבה של התאים על הכיסויים
- הפשירו את מלאי ה-DAPI (כתם גרעיני), והסתחררו במיני צנטריפוגה לפני הפתיחה. הכן תמיסת צביעה של DAPI על-ידי דילול מלאי DAPI ב-PBS (1:1,000).
- שאפו את ה-PBS מצלחת 12 הבארות, ומרחו 1 מ"ל של תמיסת צביעת DAPI על כל באר. לדגור בחושך בטמפרטורת החדר למשך 5 דקות.
- שאפו את תמיסת הכתמים DAPI. יש לשטוף פעמיים עם 2 מ"ל PBS לכל באר.
- הכינו שקופיות מיקרוסקופ מזכוכית חלבית (שקופיות זכוכית) על ידי שטיפתן ב-70% אתנול, ולאחר מכן שלוש שטיפות ב-PBS. ייבשו בזהירות את המגלשות באמצעות מגבות נייר ללא מוך, וכוונו אותן לכיוון האור כדי לבדוק אם יש סימני אבק או שומן.
הערה: כפפות נדרשות לשלב זה. - תייג את שקופיות הזכוכית עם הפרטים הניסיוניים. מעבירים את מדיום ההרכבה לצינור מיקרוצנטריפוגה, ומסתובבים במיני צנטריפוגה.
- התכוננו להרכבת הכיסויים על ידי סידור סביבת העבודה. שמור על צלחת של 12 בארות עם כיסויים, מגלשות זכוכית מסומנות, מדיום הרכבה, פיפטה, קצוות פיפטה של 10 μL, מגבות נייר ללא מוך ופינצטה מוכנה.
- יש למרוח 10 μL של מדיום הרכבה (זכוכית ProLong) על מגלשת זכוכית מוכנה כדי להרכיב כיסוי.
- הרימו את הכיסוי מצלחת 12 הבארות באמצעות פינצטה, והורידו את הלחות מהכיסוי על ידי נגיעה קצרה בקצה ובגב של הכיסוי למגבת הנייר המוכנה ללא מוך. הורידו בעדינות את הכיסוי כלפי מטה אל טיפת מדיום ההרכבה.
- חזור על שני השלבים לעיל עבור כל כיסוי. מקם את הטיפות הבינוניות להרכבה כדי לאפשר בין כיסוי אחד לארבעה כיסויים לכל מגלשת זכוכית.
- ודא ששקופיות הזכוכית נמצאות על משטח שטוח כדי למנוע את תזוזת הכיסויים המותקן. הניחו את מגלשות הזכוכית במיקום חשוך בטמפרטורת החדר למשך הלילה כדי לאפשר לאמצעי ההרכבה לשקוע. הדגימות מוכנות כעת להדמיה. ניתן להשהות את הניסוי בשלב זה של הפרוטוקול ולהמשיך מאוחר יותר.
- אם הניסוי מושהה בשלב זה, לאחר שאפשרו לדגימות להתייצב במשך הלילה בטמפרטורת החדר, כסו אותן ברדיד אלומיניום כדי להגן עליהן מפני אור, ואחסנו אותן בטמפרטורה של 4 מעלות צלזיוס.
4. מיקרוסקופיה והדמיה
- מכסים את הדגימות ברדיד אלומיניום להובלה (אם עדיין לא נעשה).
- עם ההגעה למתקן המיקרוסקופיה, השתמש בזיקוק כפול H2O עם נייר מסנן מיקרוסקופ כדי לנקות את שאריות ה- PBS מהכיסויים על שקופיות הזכוכית. בדוק שאין כתמים על הכיסויים על ידי החזקת הזכוכית מחליק לעבר אור בהיר.
- עברו את הליך ההפעלה של המיקרוסקופ. בחר את המטרה המתאימה (Plan-Apochromat 63x/1.40 Oil M27), והוסף מדיום טבילה.
- מקם את הדגימה במחזיק המדגם. בתוך תוכנת המיקרוסקופ, השתמש בכרטיסייה "אתר" כדי להפעיל את תאורת הפלואורסצנציה של EGFP, ובאמצעות העיניים, כוונן ידנית את רמת z כדי שהדגימה תהיה ממוקדת. כבה את התאורה הפלואורסצנטית עם מציאת המיקוד.
- עבור לכרטיסייה "רכישה" בתוך תוכנת המיקרוסקופ. השתמש ב"הגדרה חכמה" כדי לבחור את ערוצי הפלואורסצנציה שישמשו להדמיה. עבור ניסוי זה, נבחרו ההגדרות הקבועות מראש של ערוץ EGFP ו- DAPI.
- התאם את עוצמת כל ערוץ מההגדרות הראשוניות באמצעות היסטוגרמה של העוצמה כקו מנחה לעוצמת אות ממוטבת. כעת ניתן להתחיל בהדמיה.
- לצורך הדמיה, השתמש באפשרות של התוכנה כדי למקם את מיקומי ההדמיה במערך, ולמרכז את המערך באמצע הכיסוי עם 12 מיקומים בסך הכל לצילום. ודא שכל מיקום במערך מכיל תאים. אם אין תאים, התאם את המיקום לאזור עם תאים.
- כוונן את המיקוד של כל מיקום במערך באמצעות המיקוד האוטומטי של תוכנת המיקרוסקופ, ועקוב אחר כך עם כוונון עדין ידני כדי להבטיח שכמה שיותר מיטוכונדריה יהיו בפוקוס.
הערה: ערוץ EGFP משמש להתאמות ידניות אלה. - השג את התמונות בשיטה זו עבור כל כריכה. שמור את קבצי התמונה והמשך לשלבים לניתוח מורפולוגי.
5. הפקת נתוני אימון מדומים
- הורד את הקוד10, ופתח את התוכן. בצע את ההוראות README.md כדי להגדיר את הסביבה הנדרשת.
- נווט אל התיקיה בשם "src", שהיא תיקיית הבית עבור פרוייקט זה. התיקיות הממוספרות בפנים מכילות קודים ספציפיים לשלבים שונים של השימוש בכלי.
הערה: השתמש בפקודה "cd < - צור עותק או השתמש בתיקייה "2. סימולציית מיטוכונדריה אוורירי", ולשנות את שמה (איירי משמשת כאן מכיוון שהיא פונקציית PSF הקרובה ביותר למיקרוסקופ קונפוקלי, ששימש כמיקרוסקופ הנוכחי). היכנס לתיקייה בשם "סימולטור".
הערה: תיקייה זו מכילה את כל הקבצים הקשורים לסימולציה של נתוני האימון. ישנן שלוש קבוצות של פרמטרים שיש להגדיר עבור הסימולציה. - ראשית, עבור הסימולטור בקובץ תצורת האצווה "סימולטור/אצווה/bxx.csv", הגדר את הפרמטרים לגבי המדגם, כולל מספר המיטוכונדריה, טווח הקטרים ואורכי המבנים, טווח ציר ה-z שהמבנה מציג וצפיפות הפלואורופורים.
- לאחר מכן, הגדר את הפרמטרים הקשורים למערכת האופטית.
- קבוצה זו כוללת את סוג המיקרוסקופ (הקובע איזה מודל PSF נבחר), הצמצם המספרי (N.A.), ההגדלה (M), גודל הפיקסלים (ב- μm), אורך גל הפליטה של הפלואורופורים ופרמטר רעש הרקע וכו '.
- הגדר את הפרמטרים האופטיים של N.A., את ההגדלה ואת אורך הגל המינימלי של ערכת הנתונים בקובץ "סימולטור/microscPSFmod.py".
- הגדר את הערך הרצוי לגודל הפיקסלים, והגדר את אורך גל הפליטה של ערכת הנתונים כפרמטר לפונקציה "process_matrix_all_z" בקובץ "סימולטור/generate_batch_parallel.py".
- הגדר את שלושת הפרמטרים האחרונים של הפונקציה "save_physics_gt" בקובץ "סימולטור/generate_batch_parallel.py". הפרמטרים הם גודל פיקסלים (בננומטר), גודל תמונת הפלט ו- max_xy.
- הגדר את קבוצת הפרמטרים השלישית לגבי ערכת נתוני הפלט, כגון גודל תמונות הפלט, מספר האריחים בכל תמונה ומספר התמונות הכולל, בקובץ "סימולטור/generate_batch_parallel.py".
- הפעל את הקובץ "סימולטור/generate_batch_parallel.py" כדי להתחיל את הסימולציה.
- כדי להשיג את התמונה בגודל הסופי, צור עותק של התיקיה בשם "5. הכנת נתונים והדרכה/הכנת נתונים" בתיקיית הבית, ונווט לתוכה.
הערה: כל תמונה של ערכת הנתונים הסינתטית נוצרת על-ידי יצירת מונטאז' של ארבע תמונות מדומות של 128 פיקסלים x 128 פיקסלים, מה שנותן גודל תמונה סופי של 256 פיקסלים x 256 פיקסלים. ראשית, זה יוצר אריחים בודדים רבים (כ-12,000) הן עבור תמונות המיקרוסקופ (בתיקיית "פלט") והן עבור סגמנטציות האמת הקרקעית (בתיקיית "פלט/physics_gt").- הגדר את הפרמטרים של מספר האצווה, מספר התמונות לכל אצווה וטווח הרעש ב- "data_generator.py".
- הפעל את הקובץ "data_generator.py" כדי ליצור את תמונות המונטאז '.
- העתק את התיקיות בשם "תמונה" ו "קטע" לתוך "5. הכנת נתונים והדרכה / datatrain / רכבת" תיקייה מהתיקיה "5. הכנת נתונים והדרכה/הכנת נתונים/נתונים".
6. סגמנטציה מבוססת למידה עמוקה
- אמן את מודל הפילוח על התמונות המדומות באופן הבא:
- לאימון מודל הפילוח למיקרוסקופ חדש, נווט אל "5. תיקיית הכנת נתונים והדרכה/רכבת", והגדרת הפרמטרים של גודל האצווה, מודל עמוד השדרה לסגמנטציה, מספר התקופות וקצב הלמידה לאימון בקובץ "train_UNet.py".
- הפעל "train_UNet.py" כדי להתחיל את האימון. תהליך האימון מציג את המדד לביצועי הפילוח בערכת האימות המדומה.
הערה: לאחר השלמת האימון, המודל נשמר כ- "best_model.h5" ב- "5. תיקיית הכנת נתונים והדרכה/רכבת".
- בדוק את המודל על תמונות מיקרוסקופ אמיתיות המפוצלות לגודל הרצוי למודל המאומן באמצעות השלבים הבאים.
- נווט אל "6. הכן נתוני בדיקה", והעתק את ". png" קובץ בפורמט של הנתונים לתוך התיקייה "png".
- הפעל את הקובץ "split_1024_256.py" כדי לפצל את התמונות לגודל הרצוי עבור המודל המאומן. פעולה זו יוצרת חיתוך בגודל 256 פיקסלים x 256 פיקסלים של התמונות בתיקיית "נתונים".
- העתק את התיקייה "נתונים" שנוצרה לתוך "7. בדיקת סגמנטציה" תיקיה.
- נווט אל התיקיה "7. בדוק סגמנטציה", והגדר את שם הדגם שנשמר לשימוש.
- כדי לפלח את היבולים, הפעל את הקובץ "segment.py". התמונות המקוטעות נשמרות בתיקייה "פלט".
7. ניתוח מורפולוגי: ניתוח המורפולוגיה המיטוכונדריאלית של שתי קבוצות הנתונים, "גלוקוז" ו-"CCCP"
- סדר את הנתונים לניתוח (תיקיה אחת לכל תמונה, כאשר כל תיקיה מכילה את חיתוכי הפלט המפולחים של תמונה אחת).
- הורד והנח את הקובץ המשלים בשם "make_montage.py" בתיקייה בשם "7. סגמנטציה של בדיקות".
- הפעל את הקובץ "make_montage.py" כדי לתפור את הפלט המקוטע בחזרה לגודל המקורי של התמונה.
- צור תיקיה חדשה בשם "9. ניתוח מורפולוגי" בתוך התיקייה "src".
- התקן את חבילות Skan16 ו- Seaborn Python לסביבה באמצעות הפקודה "pip install seaborn[stats] skan".
הערה: מסכות הסגמנטציה עוברות שלד באמצעות ספרייה בשם Skan כדי לאפשר ניתוח של הטופולוגיה של כל מיטוכונדריה בנפרד. - מקם את הקובץ המשלים " analyze_mitochondria.py " לתיקייה "9. ניתוח מורפולוגי".
- סדר את התמונות של קבוצות שונות של הניסוי לתוך תיקיות שונות בתוך התיקייה "7. סגמנטציה של בדיקות".
- הגדר את הפרמטרים של "גודל פיקסל" ו"נתיב קלט "בקובץ "analyze_mitochondria.py".
- הפעל את הקובץ " analyze_mitochondria.py" כדי להפעיל את הקוד כדי שלד וליצור מגרשים של הניתוח.
תוצאות
התוצאות של פילוחי הלמידה העמוקה של המיטוכונדריה בתמונות קונפוקליות של קרדיומיובלסטים קבועים המבטאים סמני מיטוכונדריה פלואורסצנטיים ממחישות את התועלת של שיטה זו. שיטה זו תואמת לסוגי תאים אחרים ולמערכות מיקרוסקופיה, ודורשת הסבה בלבד.
קרדיומיובלסטים H9c2 המותאמים לגלקטוז עם מיטוכונדריה פלואורסצנטית טופלו עם או בלי CCCP במשך שעתיים. לאחר מכן תוקנו התאים, הוכתמו בצבע גרעיני והורכבו על שקופיות זכוכית לצורך ניתוח מיקרוסקופיה פלואורסצנטית. מיקרוסקופ קונפוקלי נוצל כדי לקבל תמונות של תאי הבקרה ושל התאים שטופלו ב-CCCP. ביצענו את הניתוח שלנו על 12 תמונות קונפוקליות, עם כ-60 תאים לכל תנאי. לאחר מכן נקבע וכמת המצב המורפולוגי של המיטוכונדריה בכל תמונה. מסכות הסגמנטציה שהתקבלו מהמודל המאומן עברו שלד כדי לאפשר ניתוח של הטופולוגיה של כל מיטוכונדריה בודדת לניסוי זה. אורך הענף של המיטוכונדריה הבודדת שימש כפרמטר לסיווג. המיטוכונדריה האינדיבידואלית סווגה למעמדות מורפולוגיים לפי הכלל הבא. באופן ספציפי, כל שלד מיטוכונדריאלי שאורכו פחות מ-1,500 ננומטר נחשב לנקודה, והמיטוכונדריה הארוכה יותר סווגה עוד יותר לרשת או למוט. אם היה לפחות צומת אחד שבו הצטלבו שני ענפים או יותר, זה הוגדר כרשת; אחרת, המיטוכונדריה סווגה כמוט. תמונה לדוגמה עם שלדי המיטוכונדריה המסומנים במחלקות המורפולוגיה מוצגת באיור 3.
סיווג המורפולוגיה המיטוכונדריאלית באיור 4A מראה שניתן לזהות שינויים משמעותיים כאשר CCCP מוחל במשך שעתיים; זה מודגם בצורה הברורה ביותר על ידי העלייה בנקודות עבור התאים שטופלו ב- CCCP.
אורך הענף הממוצע באיור 4B הוא אפיק נוסף להמחשת שינויים משמעותיים הניתנים לזיהוי במורפולוגיה. הן המוטות והן הרשתות היו, כצפוי, מופחתים באופן משמעותי ביחס לבקרה כאשר התאים טופלו ב- CCCP. העלייה המשמעותית באורך הענף הממוצע של הנקודות הייתה צפויה גם לאור הנפיחות שהמיטוכונדריה עוברת כאשר היא נחשפת ל-CCCP.

איור 1: צינור לסימולציה של תמונות מיקרוסקופיה פלואורסצנטית. הצינור כולל (i) יצירת גיאומטריה תלת-ממדית, (ii) פולטים והדמיית פוטוקינטיקה, (iii) קונבולוציה תלת-ממדית של PSF, (iv) תוספת רעש, ו-(v) בינאריזציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
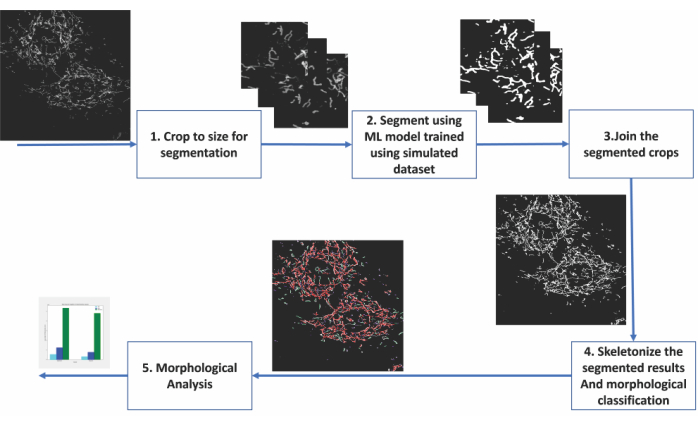
איור 2: שלבים של ניתוח מבוסס למידת מכונה של מורפולוגיה מיטוכונדריאלית . (1) התמונות שיש לפלח נחתכות תחילה לגדלים המקובלים במודל הסגמנטציה. (2) הסגמנטציה מבוססת הלמידה העמוקה מוחלת על גידולי התמונה. (3) גידולי הפלט המקוטעים נתפרים בחזרה לגודלם המקורי. (4) הסגמנטציות המונטאז'יות הן שלדיות. (6) ניתוח מורפולוגי מתבצע על סמך הטופולוגיה מהשלדים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

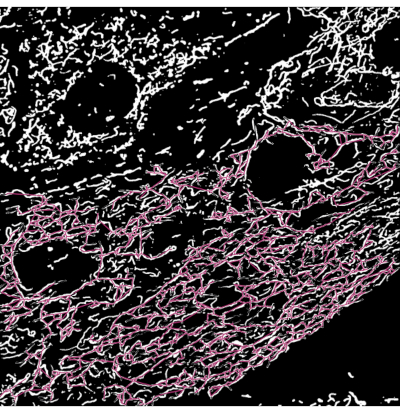
איור 3: שלד מיטוכונדריאלי מכוסה על פלט הסגמנטציה של תמונות מיקרוסקופיה. (A) פלט הסגמנטציה. (B) השלד בקו ישר (מרחק אוקלידי בין נקודות ההתחלה והסיום של ענף) מכוסה על גבי פלט הסגמנטציה. קידוד הצבעים של השלד מתאר את סוג המיטוכונדריה. הרשתות אדומות, המוטות ירוקים, והנקודות בצבע סגול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
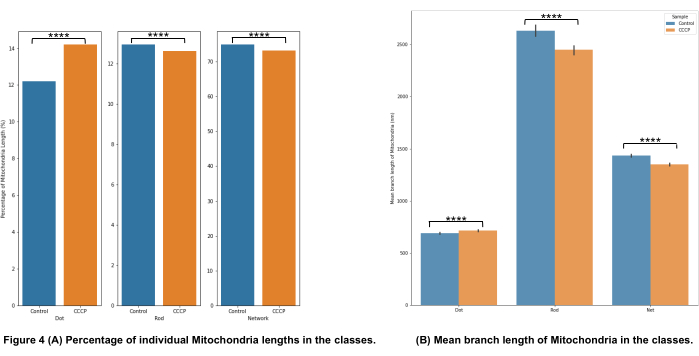
איור 4: ניתוח מורפולוגיה מיטוכונדריאלית. (A) סקירה כללית של האחוז היחסי של קטגוריות מורפולוגיות שונות בהתבסס על אורך המיטוכונדריה הכולל. (B) השוואת אורך הענף המיטוכונדריאלי הממוצע בין תנאי הניסוי ובין קטגוריות מורפולוגיות. ציר ה-x מציג את הסיווגים המורפולוגיים, וציר ה-y מציג את אורך הענף הממוצע של המיטוכונדריה בננומטרים (ננומטר). מובהקות סטטיסטית בצורה של ערכי p מוצגת כ- * p < 0.05, ** p < 0.01, *** p < 0.001, ו- **** p < 0.0001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור 5: מקרה כישלון של סגמנטציה. צפיפות גבוהה של מיטוכונדריה היא תרחיש מאתגר עבור מודל הסגמנטציה. השלד הצבעוני מציג את המיטוכונדריה היחידה הארוכה ביותר שזוהתה בתמונה. על ידי מעבר על מדידות האורך, ניתן לזהות תרחישים אלה ולעבוד עליהם כדי לשפר את תוצאות הסגמנטציה באמצעות האופרטור המורפולוגי שוחק (מרזב את השלד שזוהה). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
אנו דנים באמצעי זהירות הקשורים לשלבים הקריטיים בפרוטוקול בפסקאות על "יצירת גיאומטריה" ו"פרמטרים של סימולטור ". הפסקה שכותרתה "למידת העברה" דנה בשינויים לתפוקה גבוהה יותר בעת הסתגלות למיקרוסקופים מרובים. הפסקאות על "ניתוח חלקיקים" ו"יצירת מבנים תת-תאיים אחרים" מתייחסות ליישומים עתידיים של שיטה זו. הפסקה על "ההבדל מהאמת הביולוגית" דנה בסיבות השונות לכך שהסימולציות יכולות להיות שונות מנתונים אמיתיים והאם הסיבות הללו משפיעות על היישום שלנו. לבסוף, נדון בתרחיש מאתגר לשיטתנו בפסקה "מבנים צפופים".
יצירת גיאומטריה
כדי ליצור את הגיאומטריה התלת-ממדית של המיטוכונדריה, מבנה דו-ממדי פשוט שנוצר מעקומות b-spline כשלדים פועל היטב ליצירת מערך הנתונים הסינתטי. צורות סינתטיות אלה מחקות באופן הדוק את צורות המיטוכונדריה שנצפו בתרביות תאים דו-ממדיות. עם זאת, במקרה של רקמה תלת ממדית כגון רקמת לב, הצורה והסידור של המיטוכונדריה שונים למדי. במקרים כאלה, הביצועים של מודל הסגמנטציה עשויים להשתפר עם תוספת של כיווניות בתמונות המדומות.
פרמטרים של סימולטור
יש לנקוט משנה זהירות בעת הגדרת הפרמטרים של הסימולטור כדי לוודא שהם תואמים לאלה של הנתונים שעליהם יש להפעיל את ההסקה, שכן אי ביצוע פעולה זו עלול להוביל לביצועים נמוכים יותר בפילוח. פרמטר אחד כזה הוא טווח יחס האות לרעש (SNR). טווח ה- SNR של הנתונים שייבדקו צריך להתאים לערכים של ערכת הנתונים המדומה. בנוסף, ה-PSF שבו נעשה שימוש צריך להתאים לזה של נתוני בדיקת היעד. לדוגמה, אין להשתמש בתמונות שהוכשרו על-ידי מודלים מ-PSF קונפוקלי כדי לבדוק תמונות ממיקרוסקופ אפי-פלואורסצנטי. פרמטר נוסף שיש לשים לב אליו הוא השימוש בהגדלה נוספת בנתוני הבדיקה. אם נעשה שימוש בהגדלה נוספת בנתוני הבדיקה, יש להגדיר גם את הסימולטור כראוי.
העברת למידה
למידת העברה היא תופעה של מינוף מודל נלמד המאומן על משימה אחת לשימוש במשימה אחרת. תופעה זו חלה גם על הבעיה שלנו ביחס לסוגים שונים של נתוני מיקרוסקופ. המשקלים של מודל הסגמנטציה (המסופק עם קוד המקור) המאומן על סוג אחד של נתוני מיקרוסקופיה יכולים לשמש לאתחול מודל סגמנטציה לשימוש בסוג אחר של נתוני מיקרוסקופ אופטי. זה מאפשר לנו להתאמן על תת-קבוצה קטנה משמעותית של מערך נתוני האימון (3,000 תמונות לעומת 10,000), ובכך להפחית את העלויות החישוביות של הסימולציה.
ניתוח חלקיקים
ניתן לבצע ניתוח חלקיקים גם על המסכות המקוטעות. זה יכול לספק מידע על האזור והעקמומיות וכו ', של המיטוכונדריה הבודדת. מידע זה יכול לשמש גם כמדדים להשוואה כמותית של מיטוכונדריה (שאינה משמשת לניסוי זה). לדוגמה, כיום אנו מגדירים את מורפולוגיה של הנקודה באמצעות סף המבוסס על אורך המיטוכונדריה. זה עשוי להיות שימושי, במקרים מסוימים, לשלב אליפטיות כדי להפריד טוב יותר מיטוכונדריה קטנה דמוית מוט מפונקטה או מיטוכונדריה דמוית נקודה. לחלופין, אם תנאים ביולוגיים מסוימים גורמים למיטוכונדריה להתכרבל, אז כימות העקמומיות עשוי לעניין את ניתוח אוכלוסיית המיטוכונדריה.
יצירת מבנים תת-תאיים אחרים
סגמנטציה מבוססת פיזיקה של מבנים תת-תאיים הוכחה עבור מיטוכונדריה ובועיות1. אף על פי ששלפוחיות מציגות צורות שונות, גודלן קטן יותר, והן מופיעות ככדורים פשוטים כאשר הן נצפות דרך מיקרוסקופ פלואורסצנטי. לפיכך, הגיאומטריה של שלפוחית מדומה באמצעות מבנים כדוריים של טווח קוטר מתאים. משמעות הדבר היא ששינוי בפונקציה יוצר את הגיאומטריה (צילינדרים במקרה של מיטוכונדריה וכדורים במקרה של שלפוחית) של המבנים והפרמטרים המתאימים (שלב 5.4 בסעיף הפרוטוקול). מבחינה גאומטרית, הרשתית האנדופלסמית והמיקרוטובולים הודגמו גם הם כמבנים צינוריים17. מידול הרשתית האנדופלסמית בקוטר 150 ננומטר ומיקרוטובולים בקוטר חיצוני ממוצע של 25 ננומטר וצינור חלול פנימי בקוטר 15 ננומטר מספק קירובים של הצורות של מבנים אלה. פרמטר נוסף שישתנה עבור כל אחד מהמבנים התת-תאיים הללו הוא צפיפות הפלואורופור. זה מחושב על סמך התפלגות הביומולקולה שאליה נקשרים הפלואורופורים וההסתברות להיקשר.
הבדל מהאמת הביולוגית
הנתונים המדומים המשמשים לאימון בפיקוח סימולציה של מודל הלמידה העמוקה שונים מנתונים אמיתיים במובנים רבים. (i) היעדר תיוג לא ספציפי בנתונים המדומים שונה מנתונים אמיתיים, שכן לעתים קרובות יש פלואורופורים צפים חופשיים בנתונים האמיתיים. פעולה זו גורמת לערך רקע ממוצע גבוה יותר בתמונה האמיתית. הבדל זה מצטמצם על ידי התאמת ה- SNR והגדרת ערך הרקע כך שיתאים לערכים הממשיים שנצפו. (ii) התנועה של מבנים תת-תאיים ופוטוקינטיקה הם שני מקורות לדינמיקה במערכת. מבנים נעים בתאים חיים (הנעים בטווח של כמה אלפיות שניה) גורמים לטשטוש תנועה. זמן החשיפה מתקצר במהלך רכישת נתונים אמיתיים כדי למנוע את אפקט הטשטוש. מצד שני, איננו מדמים הילוך מהיר ומניחים מבנים חסרי תנועה; הנחה זו תקפה כאשר זמן החשיפה בנתונים האמיתיים קטן. עם זאת, הנחה זו עלולה לגרום לשגיאה בפלט אם זמן החשיפה של הנתונים האמיתיים גדול מספיק כדי להציג טשטוש תנועה. פוטוקינטיקה, לעומת זאת, היא בסדר גודל של ננו-שניות עד מיקרו-שניות וניתן להשמיט אותה בסימולציה, שכן זמני החשיפה הרגילים של ניסויים ארוכים מספיק (בסדר גודל של אלפיות השנייה) כדי לממוצע את ההשפעות של פוטוקינטיקה. (iii) לרעש בתמונות מיקרוסקופ יש מקורות שונים, ולמקורות אלה יש פונקציות צפיפות הסתברות שונות. במקום למדל את מקורות הרעש האינדיבידואליים האלה, אנו מעריכים אותו כרעש גאוס על רקע קבוע. הבדל זה אינו משנה באופן משמעותי את התפלגות הנתונים עבור התנאים של יחס אות לרקע נמוך (בטווח של 2-4) וכאשר מתמודדים עם צפיפות המאקרו של פלואורופורים1. (iv) ממצאים בהדמיה יכולים לנבוע מסטיות, סחף וטשטוש שיטתי. אנו מניחים שהמיקרוסקופ מיושר היטב ושהאזורים שנבחרו לניתוח בנתונים האמיתיים נטולי ממצאים אלה. קיימת גם אפשרות לדגמן חלק מהממצאים הללו ב- PSF18,19,20.
מבנים צפופים
הקשיים באי היכולת להבדיל בין מוטות חופפים לרשתות הם בעיה מתמשכת בפילוח נתוני מיקרוסקופיה דו-ממדית. תרחיש מאתגר ביותר מוצג באיור 5, שבו המיטוכונדריה ארוזה בצפיפות, מה שמוביל לתוצאות תת-אופטימליות במודל הסגמנטציה ובניתוח הבא. למרות האתגר הזה, שימוש באופרטורים מורפולוגיים במצבים כאלה כדי לרזות את השלד יכול לעזור לשבור את הרשתות המחוברות יתר על המידה הללו תוך מתן אפשרות לזהות שינויים משמעותיים בכל קטגוריות המורפולוגיה המיטוכונדריאלית. בנוסף, השימוש במיקרוסקופ קונפוקלי ולא במיקרוסקופ שדה רחב להדמיה הוא אחת השיטות למתן באופן חלקי בעיה זו על ידי סילוק אור מחוץ לממוקד. יתר על כן, בעתיד, יהיה זה שימושי לבצע סגמנטציה תלת-ממדית כדי להבדיל בין מיטוכונדריה המצטלבת (כלומר, יוצרת פיזית רשת) לבין מיטוכונדריה דמוית מוט שהקרנותיה במישור יחיד חופפות זו לזו.
פילוח למידה עמוקה הוא כלי מבטיח המציע להרחיב את יכולות הניתוח של משתמשי מיקרוסקופיה, ובכך לפתוח את האפשרות של ניתוח אוטומטי של נתונים מורכבים ומערכי נתונים כמותיים גדולים, אשר בעבר היה בלתי ניתן לניהול.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים הקשורים למאמר זה.
Acknowledgements
המחברים מודים על הדיון עם עריף אחמד סח'. זמברלאל בהוג'בל מוכר כמי שסייע בבניית תאי H9c2 היציבים. אנו מכירים במימון הבא: מענק התחלת ERC מס' 804233 (ל- K.A.), מענק מחקר להתחדשות מדעית מס' 325741 (ל- D.K.P.), מענק רשות הבריאות האזורית של צפון נורבגיה מס' HNF1449-19 (Å.B.B.), ופרויקט המימון התמטי של UiT VirtualStain עם 2061348 מזהה פרויקט כריסטין (D.K.P., Å.B.B., K.A., ו- A.H.).
Materials
| Name | Company | Catalog Number | Comments |
| 12-well plate | FALCON | 353043 | |
| Aqueous Glutaraldehyde EM Grade 25% | Electron Microscopy Sciences | 16200 | |
| Axio Vert.A1 | Zeiss | Brightfield microscope | |
| CCCP | Sigma-Aldrich | C2759 | |
| Computer | n/a | n/a | Must be running Linux/Windows Operating System having an NVIDIA GPU with at least 4GB of memory |
| Coverslips | VWR | 631-0150 | |
| DAPI (stain) | Sigma-Aldrich | D9542 | |
| DMEM | gibco | 11966-025 | |
| Fetal Bovine Serum | Sigma-Aldrich | F7524 | |
| Glass Slides (frosted edge) | epredia | AA00000112E01MNZ10 | |
| H9c2 mCherry-EGFP-OMP25 | In-house stable cell line derived from purchased cell line | ||
| Incubator | Thermo Fisher Scientific | 51033557 | |
| LSM 800 | Zeiss | Confocal Microscope | |
| Mounting Media (Glass) | Thermo Fisher Scientific | P36980 | |
| Paraformaldehyde Solution, 4% in PBS | Thermo Fisher Scientific | J19943-K2 | |
| Plan-Apochromat 63x oil (M27) objective with an NA of 1.4 | Zeiss | 420782-9900-000 | |
| Sterile laminar flow hood | Labogene | SCANLAF MARS | |
| Trypsin | Sigma-Aldrich | T4049 | |
| Vacusafe aspiration system | VACUUBRAND | 20727400 | |
| ZEN 2.6 | Zeiss |
References
- Sekh, A. A., et al. Physics-based machine learning for subcellular segmentation in living cells. Nature Machine Intelligence. 3, 1071-1080 (2021).
- Pernas, L., Scorrano, L. Mito-morphosis: Mitochondrial fusion, fission, and cristae remodeling as key mediators of cellular function. Annual Review of Physiology. 78, 505-531 (2016).
- Li, Y., et al. Imaging of macrophage mitochondria dynamics in vivo reveals cellular activation phenotype for diagnosis. Theranostics. 10 (7), 2897-2917 (2020).
- Xu, X., Xu, S., Jin, L., Song, E. Characteristic analysis of Otsu threshold and its applications. Pattern Recognition Letters. 32 (7), 956-961 (2011).
- MorphoLibJ: MorphoLibJ v1.2.0. Zenodo Available from: https://zenodo.org/record/50694#.Y8qfo3bP23A (2016)
- Trainable_Segmentation: Release v3.1.2. Zenodo Available from: https://zenodo.org/record/59290#.Y8qf13bP23A (2016)
- Chu, C. H., Tseng, W. W., Hsu, C. M., Wei, A. C. Image analysis of the mitochondrial network morphology with applications in cancer research. Frontiers in Physics. 10, 289 (2022).
- Xue, F., Li, J., Blu, T. Fast and accurate three-dimensional point spread function computation for fluorescence microscopy. Journal of the Optical Society of America A. 34 (6), 1029-1034 (2017).
- Lanni, F., Gibson, S. F. Diffraction by a circular aperture as a model for three-dimensional optical microscopy. Journal of the Optical Society of America A. 6 (9), 1357-1367 (1989).
- Sekh, A. A., et al. Physics based machine learning for sub-cellular segmentation in living cells. Nature Machine Intelligence. 3, 1071-1080 (2021).
- Liu, Y., Song, X. D., Liu, W., Zhang, T. Y., Zuo, J. Glucose deprivation induces mitochondrial dysfunction and oxidative stress in PC12 cell line. Journal of Cellular and Molecular Medicine. 7 (1), 49-56 (2003).
- Dott, W., Mistry, P., Wright, J., Cain, K., Herbert, K. E. Modulation of mitochondrial bioenergetics in a skeletal muscle cell line model of mitochondrial toxicity. Redox Biology. 2, 224-233 (2014).
- Ishihara, N., Jofuku, A., Eura, Y., Mihara, K. Regulation of mitochondrial morphology by membrane potential, and DRP1-dependent division and FZO1-dependent fusion reaction in mammalian cells. Biochemical and Biophysical Research Communications. 301 (4), 891-898 (2003).
- Miyazono, Y., et al. Uncoupled mitochondria quickly shorten along their long axis to form indented spheroids, instead of rings, in a fission-independent manner. Scientific Reports. 8, 350 (2018).
- Ganote, C. E., Armstrong, S. C. Effects of CCCP-induced mitochondrial uncoupling and cyclosporin A on cell volume, cell injury and preconditioning protection of isolated rabbit cardiomyocytes. Journal of Molecular and Cellular Cardiology. 35 (7), 749-759 (2003).
- Nunez-Iglesias, J., Blanch, A. J., Looker, O., Dixon, M. W., Tilley, L. A new Python library to analyse skeleton images confirms malaria parasite remodelling of the red blood cell membrane skeleton. PeerJ. 2018, 4312 (2018).
- Sage, D., et al. Super-resolution fight club: Assessment of 2D and 3D single-molecule localization microscopy software. Nature Methods. 16, 387-395 (2019).
- Yin, Z., Kanade, T., Chen, M. Understanding the phase contrast optics to restore artifact-free microscopy images for segmentation. Medical Image Analysis. 16 (5), 1047-1062 (2012).
- Malm, P., Brun, A., Bengtsson, E. Simulation of bright-field microscopy images depicting pap-smear specimen. Cytometry. Part A. 87 (3), 212-226 (2015).
- Bifano, T., Ünlü, S., Lu, Y., Goldberg, B. Aberration compensation in aplanatic solid immersion lens microscopy. Optical Express. 21 (23), 28189-28197 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved