Method Article
Analyse der mitochondrialen Morphologie durch simuliertes überwachtes Lernen
In diesem Artikel
Zusammenfassung
Dieser Artikel erklärt, wie man simulationsüberwachtes maschinelles Lernen zur Analyse der Mitochondrienmorphologie in fluoreszenzmikroskopischen Bildern fixierter Zellen einsetzt.
Zusammenfassung
Die quantitative Analyse subzellulärer Organellen wie Mitochondrien in zellfluoreszenzmikroskopischen Bildern ist aufgrund der inhärenten Herausforderungen bei der Segmentierung dieser kleinen und morphologisch vielfältigen Strukturen eine anspruchsvolle Aufgabe. In diesem Artikel demonstrieren wir die Verwendung einer maschinellen, lerngestützten Segmentierungs- und Analysepipeline zur Quantifizierung der mitochondrialen Morphologie in fluoreszenzmikroskopischen Bildern fixierter Zellen. Das Deep-Learning-basierte Segmentierungstool wird auf simulierten Bildern trainiert und macht Ground-Truth-Annotationen für überwachtes Deep Learning überflüssig. Wir demonstrieren den Nutzen dieses Werkzeugs auf fluoreszenzmikroskopischen Bildern von fixierten Kardiomyoblasten mit einer stabilen Expression fluoreszierender Mitochondrienmarker und verwenden spezifische Zellkulturbedingungen, um Veränderungen in der mitochondrialen Morphologie zu induzieren.
Einleitung
In diesem Artikel demonstrieren wir den Nutzen eines physikbasierten maschinellen Lernwerkzeugs für die subzelluläre Segmentierung1 in fluoreszenzmikroskopischen Bildern von fixierten Kardiomyoblasten, die fluoreszierende Mitochondrienmarker exprimieren.
Mitochondrien sind die wichtigsten energieproduzierenden Organellen in Säugetierzellen. Insbesondere Mitochondrien sind hochdynamische Organellen und befinden sich oft in Netzwerken, die sich ständig in Länge und Verzweigung ändern. Die Form der Mitochondrien beeinflusst ihre Funktion, und Zellen können ihre mitochondriale Morphologie schnell ändern, um sich an eine Veränderung in der Umgebung anzupassen2. Um dieses Phänomen zu verstehen, ist die morphologische Klassifizierung von Mitochondrien als Punkte, Stäbchen oder Netzwerke sehr informativ3.
Die Segmentierung von Mitochondrien ist entscheidend für die Analyse der mitochondrialen Morphologie in Zellen. Aktuelle Methoden zur Segmentierung und Analyse fluoreszenzmikroskopischer Bilder von Mitochondrien beruhen auf manueller Segmentierung oder konventionellen Bildverarbeitungsansätzen. Schwellenwertbasierte Ansätze wie Otsu4 sind aufgrund des hohen Rauschpegels in Mikroskopiebildern weniger genau. Typischerweise zeigen Bilder für die morphologische Analyse von Mitochondrien eine große Anzahl von Mitochondrien, was die manuelle Segmentierung mühsam macht. Mathematische Ansätze wie MorphoLibJ5 und semi-überwachte maschinelle Lernansätze wie Weka6 sind sehr anspruchsvoll und erfordern Expertenwissen. Eine Überprüfung der Bildanalysetechniken für Mitochondrien7 zeigte, dass Deep-Learning-basierte Techniken für die Aufgabe nützlich sein können. Tatsächlich wurde die Bildsegmentierung in Alltagsbildern für Anwendungen wie das autonome Fahren durch den Einsatz von Deep-Learning-basierten Modellen revolutioniert.
Deep Learning ist eine Teilmenge des maschinellen Lernens, die Algorithmen bereitstellt, die aus großen Datenmengen lernen. Überwachte Deep-Learning-Algorithmen lernen Beziehungen aus großen Mengen von Bildern, die mit ihren Ground Truth (GT)-Etiketten versehen sind. Die Herausforderungen bei der Verwendung von überwachtem Deep Learning zur Segmentierung von Mitochondrien in fluoreszenzmikroskopischen Bildern sind zweifach. Erstens erfordert überwachtes Deep Learning einen großen Datensatz von Trainingsbildern, und im Falle der Fluoreszenzmikroskopie wäre die Bereitstellung dieses großen Datensatzes eine umfangreiche Aufgabe im Vergleich zur Verwendung leichter verfügbarer herkömmlicher kamerabasierter Bilder. Zweitens erfordern fluoreszenzmikroskopische Bilder GT-Annotationen der interessierenden Objekte in den Trainingsbildern, was eine mühsame Aufgabe ist, die Expertenwissen erfordert. Diese Aufgabe kann leicht Stunden oder Tage der Zeit des Experten für ein einzelnes Bild von Zellen mit fluoreszierend markierten subzellulären Strukturen in Anspruch nehmen. Darüber hinaus stellen Unterschiede zwischen den Kommentatoren ein Problem dar. Um manuelle Annotationen überflüssig zu machen und die überlegene Leistung von Deep-Learning-Techniken nutzen zu können, wurde hier ein Deep-Learning-basiertes Segmentierungsmodell verwendet, das auf simulierten Bildern trainiert wurde. Physikbasierte Simulatoren bieten eine Möglichkeit, den Prozess der Bildentstehung in einem Mikroskop nachzuahmen und zu steuern, wodurch Bilder bekannter Formen erstellt werden können. Unter Verwendung eines physikbasierten Simulators wurde zu diesem Zweck ein großer Datensatz simulierter fluoreszenzmikroskopischer Bilder von Mitochondrien erstellt.
Die Simulation beginnt mit der Geometriegenerierung mittels parametrischer Kurven zur Formgenerierung. Emitter werden zufällig gleichmäßig verteilt auf der Oberfläche der Form platziert, so dass die Dichte den experimentellen Werten entspricht. Eine 3D-Punktspreizfunktion (PSF) des Mikroskops wird unter Verwendung einer rechnerisch effizienten Näherung8 des Gibson-Lanni-Modells9 berechnet. Um die simulierten Bilder eng mit experimentellen Bildern abzugleichen, werden sowohl der Dunkelstrom als auch das Aufnahmerauschen emuliert, um Fotorealismus zu erreichen. Der physische GT wird in Form einer binären Karte generiert. Der Code zum Generieren des Datasets und zum Trainieren des Simulationsmodells ist verfügbar10, und der Schritt zum Erstellen dieses simulierten Datasets ist in Abbildung 1 dargestellt.
Wir zeigen den Nutzen einer auf Deep Learning basierenden Segmentierung, die vollständig auf einem simulierten Datensatz trainiert wird, indem konfokale Mikroskopiebilder von fixierten Kardiomyoblasten analysiert werden. Diese Kardiomyoblasten exprimierten einen fluoreszierenden Marker in der mitochondrialen Außenmembran, der die Visualisierung der Mitochondrien in den fluoreszenzmikroskopischen Bildern ermöglichte. Vor der Durchführung des hier als Beispiel angeführten Experiments wurde den Zellen Glukose entzogen und 7 Tage lang in Kultur an Galaktose angepasst. Der Ersatz von Glukose in den Wachstumsmedien durch Galaktose zwingt die Zellen in Kultur, oxidativer zu werden und somit für die Energieproduktion von ihren Mitochondrien abhängig zu werden11,12. Darüber hinaus macht dies die Zellen empfindlicher für mitochondriale Schäden. Mitochondriale Morphologieänderungen können experimentell durch Zugabe eines mitochondrialen Entkopplungsmittels wie Carbonylcyanid m-Chlorphenylhydrazon (CCCP) zum Zellkulturmedium13 induziert werden. CCCP führt zu einem Verlust des mitochondrialen Membranpotentials (ΔΨm) und führt somit zu Veränderungen der Mitochondrien von einer eher röhrenförmigen (stäbchenartigen) zu einer kugelförmigeren (punktartigen) Morphologie14. Darüber hinaus neigen Mitochondrien dazu, während der CCCP-Behandlung anzuschwellen15. Wir zeigen die morphologische Verteilung der Mitochondrien, wenn die galaktoseadaptierten Kardiomyoblasten mit dem mitochondrialen Entkoppler CCCP behandelt wurden. Die Deep-Learning-Segmentierungen der Mitochondrien ermöglichten es uns, sie als Punkte, Stäbchen oder Netzwerke zu klassifizieren. Wir leiteten dann quantitative Metriken ab, um die Zweiglängen und die Häufigkeit der verschiedenen mitochondrialen Phänotypen zu bewerten. Die Schritte der Analyse sind in Abbildung 2 beschrieben, und die Details der Zellkultur, der Bildgebung, der Datensatzerstellung für die Deep-Learning-basierten Segmentierung sowie der quantitativen Analyse der Mitochondrien sind unten aufgeführt.
Protokoll
HINWEIS: Die Abschnitte 1-4 können weggelassen werden, wenn mit vorhandenen Mikroskopiebildern von Mitochondrien mit bekannten experimentellen Bedingungen gearbeitet wird.
1. Zellkultur
- Züchten Sie die H9c2-Zellen in DMEM ohne Glukose, ergänzt mit 2 mM L-Glutamin, 1 mM Natriumpyruvat, 10 mM Galaktose, 10% FBS, 1% Streptomycin / Penicillin und 1 μg / ml Puromycin. Lassen Sie die Zellen vor den Experimenten mindestens 7 Tage in Kultur an Galactose anpassen.
HINWEIS: Die hier verwendeten H9c2-Zellen wurden genetisch verändert, um fluoreszierende Mitochondrien zu exprimieren und haben auch ein Puromycin-Resistenzgen erworben. Die Zugabe dieses Antibiotikums sorgt für das Wachstum von Zellen mit dem Resistenzgen und damit fluoreszierenden Mitochondrien. - Aussaat der H9c2-Zellen für das Experiment, wenn die Zellkonfluenz etwa 80% erreicht (T75-Kulturkolben, beurteilt durch Hellfeldmikroskopie). Das Medium und das Trypsin mindestens 15 min auf 37 °C vorheizen, bevor Sie fortfahren.
HINWEIS: Es ist möglich, das Experiment parallel zu zwei oder mehr verschiedenen Zellkulturbedingungen durchzuführen. Der H9c2-Zellkonfluenz sollte nicht über 80% liegen, um den Verlust myoblastischer Zellen zu verhindern. Bei 100% Konfluenz bilden die Zellen Myotuben und beginnen sich zu differenzieren. - Bereiten Sie sich auf die Aussaat der Zellen vor, die in einer sterilen Laminar-Flow-Haube arbeiten, indem Sie ein # 1,5-Glasdeckglas für jede experimentelle Bedingung in eine Vertiefung einer 12-Well-Platte legen. Beschriften Sie jede Bedingung und die experimentellen Details auf der 12-Well-Platte.
- Bewegen Sie den Zellkulturkolben aus dem Inkubator auf die Arbeitsfläche in der Haube. Das Medium mit einem Absaugsystem oder einer elektronischen Pipette absaugen und dann zweimal mit 5 ml PBS (Raumtemperatur) waschen.
- Bewegen Sie das vorgewärmte Trypsin auf die Arbeitsfläche und saugen Sie die letzte PBS-Wäsche ab. Fügen Sie dann das vorgewärmte Trypsin hinzu, um die Zellen abzulösen (1 ml für einen T75-Kulturkolben). Den Kulturkolben für 2-3 min bei 37°C wieder in den Inkubator stellen.
- Bewegen Sie das vorgewärmte Medium gegen Ende der Inkubation auf die Arbeitsfläche. Überprüfen Sie mit einem Hellfeldmikroskop, ob sich die Zellen gelöst haben.
- Wenn sich nicht alle Zellen gelöst haben, wenden Sie mehrere vorsichtige, aber feste Klopfen an die Seite des Kolbens an, um die verbleibenden Zellen zu lösen.
- Bringen Sie den Kulturkolben wieder auf die Arbeitsfläche. Geben Sie 4 ml Zellkulturmedium mit einer elektronischen Pipette in den Kulturkolben, um die Trypsinwirkung zu stoppen. Wenn Sie Kulturmedium in den Kolben geben, verwenden Sie die Pipette, um das Medium wiederholt über die Oberfläche zu dispergieren, um die Zellen zu lösen und zu einer Zellsuspension zu sammeln.
- Die Zellsuspension (5 ml) wird aus dem Kolben in ein 15-ml-Röhrchen pipettiert.
- Zentrifugieren Sie die Zellen bei 200 x g für 5 min. Öffnen Sie das Röhrchen in der Haube, entfernen Sie den Überstand durch Aspiration und resuspendieren Sie das Zellpellet vorsichtig in 5 ml Zellkulturmedien.
- Bewerten Sie die Anzahl der Zellen, indem Sie ein kleines Volumen der Zellsuspension in einem automatisierten Zellzähler analysieren. Beachten Sie die Anzahl der lebenden Zellen pro Milliliter Kulturmedien.
- Das gewünschte Volumen (z. B. 150 μL pro Vertiefung) der Zellsuspension, berechnet für eine Aussaatdichte von ca. 2 x 104 Zellen/cm2, wird in ein vormarkiertes 15-ml-Zentrifugenröhrchen gegeben. Geben Sie das vorgewärmte Zellkulturmedium in das 15-ml-Zentrifugenröhrchen mit einem vorberechneten Volumen, das auf der Anzahl der Vertiefungen basiert. Verwenden Sie für 12-Well-Platten ein Gesamtvolumen von 1 ml für jede Vertiefung.
- Stellen Sie sicher, dass die verdünnte Zellsuspension richtig gemischt wird, indem Sie den Inhalt des Zentrifugenröhrchens mehrmals auf und ab pipettieren, bevor Sie das entsprechende Volumen in jede Vertiefung dosieren. Sobald die Zellsuspension in der Vertiefung abgegeben wurde, schütteln Sie die Platte sorgfältig kontrolliert in jede Richtung, um die Zellen besser in den Vertiefungen zu verteilen. Legen Sie die 12-Well-Platte bis zum nächsten Tag bei 37 °C in den Inkubator.
- Überprüfen Sie die Zellen mit einem Hellfeldmikroskop, um das Wachstum zu beurteilen. Wenn die Zellen ein ausreichendes Wachstum von etwa 80% Konfluenz erreicht haben, fahren Sie mit den nächsten Schritten fort. Andernfalls wiederholen Sie die Auswertung täglich, bis ein ausreichendes Wachstum erreicht ist.
2. Versuchsablauf
- Berechnen Sie die benötigten Mengen der Materialien für das Experiment entsprechend den Stammlösungskonzentrationen. Die gefrorenen Materialien (30 mM CCCP-Stammlösung) bei 37 °C auftauen und das Zellkulturmedium auf 37 °C vorheizen.
- Nach dem Auftauen wird eine Arbeitslösung von 10 μM CCCP hergestellt, indem die Stammlösung (1:3.000) in Zellkulturmedium verdünnt wird.
HINWEIS: Pipettenvolumina unter 1 μl dürfen nicht pipettiert werden. - Beginnen Sie mit den experimentellen Behandlungen, sobald alle notwendigen Materialien vorbereitet und vorgewärmt sind. Das Zellkulturmedium wird aus den Vertiefungen der 12-Well-Platte abgesaugt und dann schnell das frische vorgewärmte Medium auf die Kontrollmulden und das vorgewärmte Medium mit 10 μM CCCP-Lösung auf die Testbedingungsmulden aufgetragen.
- Inkubieren Sie die 12-Well-Platte im 37°C-Zellinkubator für 2 h. Bereiten Sie während der Inkubationszeit die Fixierlösung vor.
- Für die Herstellung der Fixierungslösung verwenden Sie vorgefertigtes 4% Paraformaldehyd (PFA), um 25% Glutaraldehyd (GA) Stammlösung auf 0,2% (1:125) zu verdünnen. Stellen Sie die Lösung auf 37 °C vor. Für eine 12-Well-Platte sind 500 μL pro Vertiefung ausreichend.
ACHTUNG: PFA und GA sind giftige Chemikalien. Arbeiten Sie in einer chemischen Haube mit Schutzausrüstung. Weitere Informationen finden Sie in den jeweiligen SDB. - Wenn die Inkubationszeit abgeschlossen ist, entfernen Sie die 12-Well-Platte aus dem Inkubator und legen Sie sie auf die Arbeitsfläche.
HINWEIS: Die Arbeit erfordert keine sterile Umgebung mehr. - Das Zellkulturmedium aus den Vertiefungen absaugen und die vorgewärmte Fixierlösung auftragen. Bringen Sie die 12-Well-Platte für 20 Minuten in den 37°C-Inkubator.
- Die Fixierungslösung nach Abschluss der Inkubation absaugen und jede Vertiefung zweimal mit PBS bei Raumtemperatur waschen. Es ist möglich, das Experiment in dieser Phase des Protokolls zu pausieren und später fortzusetzen.
- Wenn das Experiment pausiert ist, fügen Sie 1 ml PBS pro Vertiefung hinzu, verschließen Sie die 12-Well-Platte mit Kunststofffolie (Parafilm) und lagern Sie sie bei 4 °C.
3. Färbung und Montage der Zellen auf den Deckgläsern
- DAPI (nuklearer Fleck) Vorrat auftauen und vor dem Öffnen in einer Minizentrifuge herunterdrehen. Bereiten Sie die DAPI-Färbelösung vor, indem Sie DAPI-Material in PBS (1:1.000) verdünnen.
- Saugen Sie das PBS von der 12-Well-Platte ab und tragen Sie 1 ml DAPI-Färbelösung auf jede Vertiefung auf. Im Dunkeln bei Raumtemperatur 5 min inkubieren.
- Saugen Sie die DAPI-Färbelösung ab. Zweimal mit 2 ml PBS pro Vertiefung waschen.
- Bereiten Sie Milchglas-Objektträger (Glasobjektträger) vor, indem Sie sie in 70% Ethanol waschen, gefolgt von drei Wäschen in PBS. Trocknen Sie die Objektträger vorsichtig mit fusselfreien Papiertüchern ab und richten Sie sie auf das Licht, um nach Anzeichen von Staub oder Fett zu suchen.
HINWEIS: Für diesen Schritt sind Handschuhe erforderlich. - Beschriften Sie die Objektträger mit den experimentellen Details. Das Montagemedium wird in ein Mikrozentrifugenröhrchen überführt und in einer Minizentrifuge heruntergedreht.
- Bereiten Sie sich auf die Montage der Deckgläser vor, indem Sie den Arbeitsbereich anordnen. Halten Sie eine 12-Well-Platte mit Deckgläsern, beschrifteten Glasobjektträgern, Montagemedium, einer Pipette, 10 μL Pipettenspitzen, fusselfreien Papierhandtüchern und Pinzette bereit.
- Tragen Sie 10 μL Montagemedium (ProLong Glass) auf einen vorbereiteten Glasobjektträger auf, um ein Deckglas zu montieren.
- Nehmen Sie das Deckglas mit einer Pinzette von der 12-Well-Platte auf und tupfen Sie Feuchtigkeit vom Deckglas, indem Sie den Rand und die Rückseite des Deckglases kurz auf das vorbereitete fusselfreie Papiertuch berühren. Senken Sie das Deckglas vorsichtig auf den Tropfen des Montagemediums.
- Wiederholen Sie die beiden obigen Schritte für jedes Deckglas. Platzieren Sie die Tröpfchen des Montagemediums für ein bis vier Deckgläser pro Objektträger.
- Stellen Sie sicher, dass sich die Glasdias auf einer ebenen Oberfläche befinden, um zu verhindern, dass sich die montierten Deckgläser bewegen. Stellen Sie die Objektträger über Nacht an einem dunklen Ort bei Raumtemperatur auf, damit das Montagemedium aushärten kann. Die Proben sind nun bereit für die Bildgebung. Das Experiment kann in dieser Phase des Protokolls pausiert und später fortgesetzt werden.
- Wenn das Experiment in diesem Stadium pausiert wird, dann decken Sie die Proben, nachdem sie über Nacht bei Raumtemperatur aushärten lassen, mit Aluminiumfolie ab, um sie vor Licht zu schützen, und lagern Sie sie bei 4 ° C.
4. Mikroskopie und Bildgebung
- Decken Sie die Proben für den Transport in Aluminiumfolie ab (falls nicht bereits geschehen).
- Bei der Ankunft in der Mikroskopieanlage verwenden Sie doppelt destilliertes H2O mit Mikroskopfilterpapier, um die PBS-Rückstände von den Deckgläsern auf den Objektträgern zu entfernen. Überprüfen Sie, ob sich keine Flecken auf den Deckgläsern befinden, indem Sie die Glasdias in Richtung eines hellen Lichts halten.
- Führen Sie den Startvorgang für das Mikroskop durch. Wählen Sie das geeignete Objektiv (Plan-Apochromat 63x/1,40 Öl M27) und fügen Sie das Immersionsmedium hinzu.
- Legen Sie die Probe in den Probenhalter. Verwenden Sie in der Mikroskopsoftware die Registerkarte "Lokalisieren", um die EGFP-Fluoreszenzbeleuchtung zu aktivieren, und stellen Sie mit dem Okular die Z-Ebene manuell ein, um die Probe im Fokus zu haben. Schalten Sie die Fluoreszenzbeleuchtung aus, wenn Sie den Fokus gefunden haben.
- Wechseln Sie in der Mikroskopsoftware zur Registerkarte "Erfassen". Verwenden Sie das "Smart Setup", um die Fluoreszenzkanäle auszuwählen, die für die Bildgebung verwendet werden sollen. Für dieses Experiment wurden die EGFP- und DAPI-Kanal-Presets ausgewählt.
- Passen Sie die Intensität jedes Kanals anhand der Anfangseinstellungen an, indem Sie das Intensitätshistogramm als Leitfaden für eine optimierte Signalstärke verwenden. Die Bildgebung kann nun beginnen.
- Verwenden Sie für die Bildgebung die Option der Software, um die Bildpositionen in einem Array zu platzieren, und zentrieren Sie das Array in der Mitte des Deckglases mit 12 Gesamtpositionen, die abgebildet werden sollen. Stellen Sie sicher, dass jede Position im Array Zellen enthält. Wenn keine Zellen vorhanden sind, passen Sie die Position an einen Bereich mit Zellen an.
- Passen Sie den Fokus jeder Position im Array mit dem Autofokus der Mikroskopsoftware an und folgen Sie einer manuellen Feineinstellung, um sicherzustellen, dass so viele Mitochondrien wie möglich scharf sind.
HINWEIS: Für diese manuellen Einstellungen wird der EGFP-Kanal verwendet. - Erhalten Sie die Bilder mit dieser Methode für jedes Deckglas. Speichern Sie die Bilddateien und fahren Sie mit den Schritten zur morphologischen Analyse fort.
5. Generieren simulierter Trainingsdaten
- Laden Sie den Code10 herunter und entpacken Sie den Inhalt. Folgen Sie den Anweisungen in README.md, um die erforderliche Umgebung einzurichten.
- Navigieren Sie zum Ordner "src", dem Basisordner für dieses Projekt. Die nummerierten Ordner darin enthalten Codes, die für verschiedene Schritte der Verwendung des Tools spezifisch sind.
Hinweis: Verwenden Sie den Befehl "cd < - Erstellen Sie eine Kopie oder verwenden Sie den Ordner "2. Mitochondriensimulation Airy" und benennen Sie es um (Airy wird hier verwendet, da es die PSF-Funktion ist, die einem konfokalen Mikroskop am nächsten kommt, das als aktuelles Mikroskop verwendet wurde). Gehen Sie in den Ordner "simulator".
HINWEIS: Dieser Ordner enthält alle Dateien, die sich auf die Simulation der Trainingsdaten beziehen. Für die Simulation müssen drei Parametersätze eingestellt werden. - Stellen Sie zunächst für den Simulator in der Batch-Konfigurationsdatei "simulator/batch/bxx.csv" die Parameter für etwa die Probe ein, einschließlich der Anzahl der Mitochondrien, des Durchmesserbereichs und der Längen der Strukturen, des Bereichs der z-Achse, die die Struktur aufweist, und der Dichte der Fluorophore.
- Als nächstes stellen Sie die Parameter für das optische System ein.
- Dieser Satz enthält den Mikroskoptyp (der bestimmt, welches PSF-Modell ausgewählt wird), die numerische Apertur (N.A.), die Vergrößerung (M), die Pixelgröße (in μm), die Emissionswellenlänge der Fluorophore und den Hintergrundrauschparameter usw.
- Stellen Sie die optischen Parameter von N.A., die Vergrößerung und die minimale Wellenlänge des Datensatzes in der Datei "simulator/microscPSFmod.py" ein.
- Stellen Sie den gewünschten Wert für die Pixelgröße ein und setzen Sie die Emissionswellenlänge des Datensatzes als Parameter auf die Funktion "process_matrix_all_z" in der Datei "simulator/generate_batch_parallel.py".
- Stellen Sie die letzten drei Parameter der Funktion "save_physics_gt" in der Datei "simulator/generate_batch_parallel.py" ein. Die Parameter sind Pixelgröße (in nm), Größe des Ausgabebildes und max_xy.
- Legen Sie den dritten Satz von Parametern für das Ausgabedataset fest, z. B. die Größe der Ausgabebilder, die Anzahl der Kacheln in jedem Bild und die Anzahl der Gesamtbilder in der Datei "simulator/generate_batch_parallel.py".
- Führen Sie die Datei "simulator/generate_batch_parallel.py" aus, um die Simulation zu starten.
- Um das Bild in endgültiger Größe zu erhalten, erstellen Sie eine Kopie des Ordners mit dem Namen "5. Data Preparation and Training/Data Preparation" im Basisordner und navigieren Sie dorthin.
HINWEIS: Jedes Bild des synthetischen Datensatzes wird gebildet, indem eine Montage aus vier simulierten Bildern von 128 x 128 Pixeln erstellt wird, was eine endgültige Bildgröße von 256 Pixel x 256 Pixel ergibt. Dabei entstehen zunächst viele einzelne Kacheln (ca. 12.000) sowohl für die Mikroskopbilder (im Ordner "output") als auch für die Ground-Truth-Segmentierungen (im Ordner "output/physics_gt").- Legen Sie die Parameter der Chargennummer, die Anzahl der Bilder pro Stapel und den Rauschbereich in "data_generator.py" fest.
- Führen Sie die Datei "data_generator.py" aus, um die Montagebilder zu erstellen.
- Kopieren Sie die Ordner "image" und "segment" in die "5. Data Preparation and Training/datatrain/train" aus dem Ordner "5. Datenaufbereitung und Schulung/Datenaufbereitung/Daten".
6. Deep-Learning-basierte Segmentierung
- Trainieren Sie das Segmentierungsmodell für die simulierten Bilder wie folgt:
- Um das Segmentierungsmodell für ein neues Mikroskop zu trainieren, navigieren Sie zum "5. Datenvorbereitung und Training/Training" und legen Sie die Parameter der Losgröße, des Backbone-Modells für die Segmentierung, der Anzahl der Epochen und der Lernrate für das Training in der Datei "train_UNet.py" fest.
- Führen Sie "train_UNet.py" aus, um das Training zu starten. Der Trainingsprozess zeigt die Metrik für die Leistung der Segmentierung im simulierten Validierungssatz an.
HINWEIS: Nach Abschluss des Trainings wird das Modell als "best_model.h5" in der "5. Datenvorbereitung und Training/Training".
- Testen Sie das Modell anhand realer Mikroskopbilder, die in eine Größe aufgeteilt werden, die für das trainierte Modell wünschenswert ist, indem Sie die folgenden Schritte ausführen.
- Navigieren Sie zu "6. Testdaten vorbereiten" und kopieren Sie die ". PNG"-Formatdateien der Daten in den Ordner "png".
- Führen Sie die Datei "split_1024_256.py" aus, um die Bilder auf eine Größe aufzuteilen, die für das trainierte Modell wünschenswert ist. Dadurch werden 256 Pixel x 256 Pixel große Ausschnitte der Bilder im Ordner "data" erstellt.
- Kopieren Sie den erstellten Ordner "data" in den Ordner "7. Testsegmentierung".
- Navigieren Sie zum Ordner "7. Testsegmentierung" und legen Sie den Namen des zu verwendenden gespeicherten Modells fest.
- Um die Ausschnitte zu segmentieren, führen Sie die Datei "segment.py" aus. Die segmentierten Bilder werden im Ordner "output" gespeichert.
7. Morphologische Analyse: Analyse der mitochondrialen Morphologie der beiden Datengruppen "Glucose" und "CCCP"
- Ordnen Sie die zu analysierenden Daten an (ein Ordner für jedes Bild, wobei jeder Ordner die segmentierten Ausgabeausschnitte eines Bildes enthält).
- Laden Sie die ergänzende Datei mit dem Namen "make_montage.py" herunter und legen Sie sie im Ordner "7. Testsegmentierung".
- Führen Sie die Datei "make_montage.py" aus, um die segmentierte Ausgabe wieder auf die Originalgröße des Bildes zu setzen.
- Erstellen Sie einen neuen Ordner mit dem Namen "9. Morphological Analysis" im Ordner "src".
- Installieren Sie die Python-Pakete Skan16 und Seaborn mit dem Befehl "pip install seaborn[stats] skan" in die Umgebung.
HINWEIS: Die Segmentierungsmasken werden mithilfe der Bibliothek Skan skelettiert, um die Analyse der Topologie jedes einzelnen Mitochondriums zu ermöglichen. - Legen Sie die Zusatzdatei " analyze_mitochondria.py " in den Ordner "9. Morphologische Analyse".
- Ordnen Sie die Bilder verschiedener Gruppen des Experiments in verschiedenen Ordnern innerhalb des Ordners "7. Testsegmentierung".
- Stellen Sie die Parameter "Pixelgröße" und "Eingabepfad" in der Datei "analyze_mitochondria.py" ein.
- Führen Sie die Datei " analyze_mitochondria.py" aus, um den Code zum Skelettieren und Erstellen von Diagrammen der Analyse auszuführen.
Ergebnisse
Die Ergebnisse aus den Deep-Learning-Segmentierungen von Mitochondrien in konfokalen Bildern von fixierten Kardiomyoblasten, die fluoreszierende Mitochondrienmarker exprimieren, zeigen den Nutzen dieser Methode. Diese Methode ist mit anderen Zelltypen und Mikroskopiesystemen kompatibel und erfordert nur ein erneutes Training.
Galactose-adaptierte H9c2-Kardiomyoblasten mit fluoreszierenden Mitochondrien wurden mit oder ohne CCCP für 2 h behandelt. Die Zellen wurden dann fixiert, mit einem Kernfarbstoff angefärbt und zur fluoreszenzmikroskopischen Analyse auf Glasobjektträger montiert. Ein konfokales Mikroskop wurde verwendet, um Bilder sowohl der Kontroll- als auch der CCCP-behandelten Zellen aufzunehmen. Wir führten unsere Analyse an 12 konfokalen Bildern mit etwa 60 Zellen pro Bedingung durch. Der morphologische Zustand der Mitochondrien in jedem Bild wurde dann bestimmt und quantifiziert. Die aus dem trainierten Modell erhaltenen Segmentierungsmasken wurden skelettiert, um die Analyse der Topologie jedes einzelnen Mitochondriums für dieses Experiment zu ermöglichen. Die Zweiglänge der einzelnen Mitochondrien wurde als Parameter für die Klassifizierung verwendet. Die einzelnen Mitochondrien wurden nach folgender Regel in morphologische Klassen eingeteilt. Insbesondere wurde jedes mitochondriale Skelett mit einer Länge von weniger als 1.500 nm als Punkt betrachtet, und die längeren Mitochondrien wurden weiter in Netzwerk oder Stab kategorisiert. Wenn es mindestens eine Kreuzung gab, an der sich zwei oder mehr Zweige kreuzten, wurde dies als Netzwerk definiert; Ansonsten wurde das Mitochondrium als Stab klassifiziert. Ein Beispielbild mit den mitochondrialen Skeletten, die mit den Morphologieklassen markiert sind, ist in Abbildung 3 dargestellt.
Die Kategorisierung der mitochondrialen Morphologie in Abbildung 4A zeigt, dass es möglich ist, signifikante Veränderungen zu erkennen, wenn CCCP für 2 h angewendet wird; Dies zeigt sich am deutlichsten an der Zunahme der Punkte für die CCCP-behandelten Zellen.
Die mittlere Astlänge in Abbildung 4B ist ein weiterer Weg, um nachweisbare und signifikante Veränderungen in der Morphologie zu veranschaulichen. Sowohl Stäbchen als auch Netzwerke waren, wie erwartet, signifikant reduziert im Vergleich zur Kontrolle, wenn die Zellen mit CCCP behandelt wurden. Die signifikante Zunahme der mittleren Astlängen von Punkten wurde auch angesichts der Schwellung erwartet, die Mitochondrien erfahren, wenn sie CCCP ausgesetzt sind.

Abbildung 1: Pipeline zur Simulation fluoreszenzmikroskopischer Bilder. Die Pipeline umfasst (i) 3D-Geometriegenerierung, (ii) Emitter und photokinetische Emulation, (iii) 3D-PSF-Faltung, (iv) Rauschaddition und (v) Binarisierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
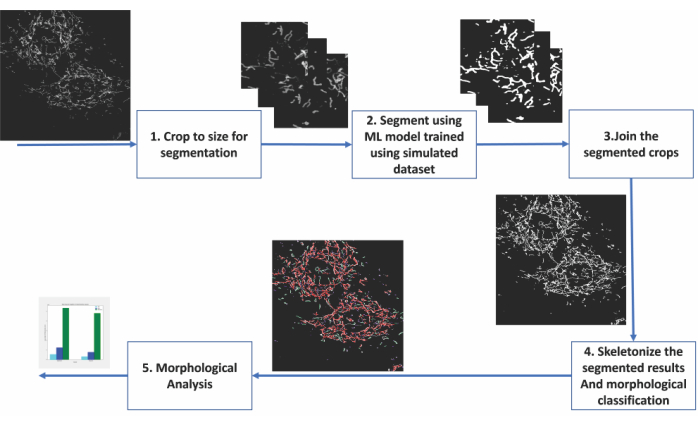
Abbildung 2: Schritte der maschinellen Lernanalyse der mitochondrialen Morphologie . (1) Die zu segmentierenden Bilder werden zunächst auf Größen zugeschnitten, die für das Segmentierungsmodell akzeptabel sind. (2) Die Deep-Learning-basierte Segmentierung wird auf die Bildausschnitte angewendet. (3) Die segmentierten Outputkulturen werden auf ihre ursprüngliche Größe zurückgenäht. (4) Die montierten Segmentierungen sind skelettiert. (6) Die morphologische Analyse wird basierend auf der Topologie der Skelettierungen durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Mitochondriales Skelett überlagert mit der Segmentierungsausgabe von Mikroskopiebildern . (A) Die Segmentierungsausgabe. (B) Das geradlinige Skelett (euklidischer Abstand zwischen Start- und Endpunkt eines Zweiges) wird über die Segmentierungsausgabe gelegt. Die Farbcodierung des Skeletts stellt die Klasse der Mitochondrien dar. Netzwerke sind rot, Stäbchen sind grün und Punkte sind lila. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
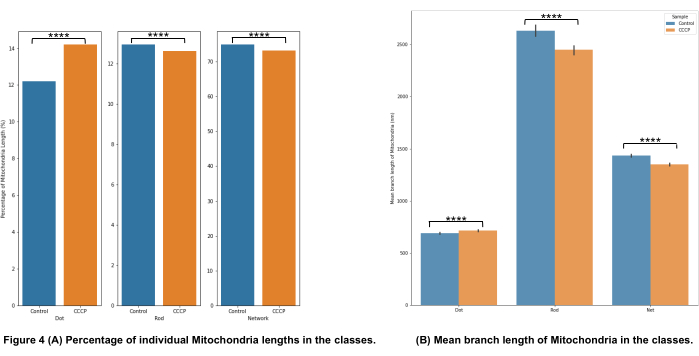
Abbildung 4: Analyse der mitochondrialen Morphologie. (A) Ein Überblick über den relativen Prozentsatz verschiedener morphologischer Kategorien basierend auf der gesamten mitochondrialen Länge. (B) Vergleich der mittleren mitochondrialen Zweiglänge zwischen den experimentellen Bedingungen und zwischen morphologischen Kategorien. Die x-Achse zeigt die morphologischen Kategorisierungen und die y-Achse die mittlere Verzweigungslänge der Mitochondrien in Nanometern (nm). Die statistische Signifikanz in Form von p-Werten wird als * p < 0,05, ** p < 0,01, *** p < 0,001 und **** p < 0,0001 angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
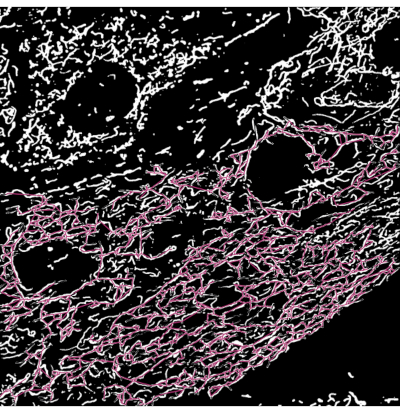
Abbildung 5: Fehlerfall der Segmentierung. Eine hohe Dichte von Mitochondrien ist ein herausforderndes Szenario für das Segmentierungsmodell. Das farbige Skelett zeigt die längsten einzelnen Mitochondrien, die im Bild nachgewiesen wurden. Durch das Durchlaufen der Längenmessungen können diese Szenarien erkannt und bearbeitet werden, um die Segmentierungsergebnisse mit dem morphologischen Operator erode zu verbessern (verschlankt das detektierte Skelett). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Wir diskutieren Vorsichtsmaßnahmen im Zusammenhang mit den kritischen Schritten im Protokoll in den Abschnitten "Geometriegenerierung" und "Simulatorparameter". Der Abschnitt mit dem Titel "Transfer Learning" diskutiert Modifikationen für einen höheren Durchsatz bei der Anpassung an mehrere Mikroskope. Die Abschnitte "Partikelanalyse" und "Erzeugung anderer subzellulärer Strukturen" beziehen sich auf zukünftige Anwendungen dieser Methode. Der Abschnitt über den "Unterschied zur biologischen Wahrheit" diskutiert die verschiedenen Gründe, warum die Simulationen von realen Daten abweichen können und ob diese Gründe unsere Anwendung beeinflussen. Abschließend diskutieren wir im Abschnitt "dicht gepackte Strukturen" ein herausforderndes Szenario für unsere Methode.
Geometriegenerierung
Um die 3D-Geometrie von Mitochondrien zu generieren, eignet sich eine einfache 2D-Struktur, die aus b-Spline-Kurven als Skelette erstellt wird, gut für die Erstellung des synthetischen Datensatzes. Diese synthetischen Formen emulieren genau die Formen von Mitochondrien, die in 2D-Zellkulturen beobachtet wurden. Bei 3D-Gewebe wie Herzgewebe sind Form und Anordnung der Mitochondrien jedoch ganz anders. In solchen Fällen kann sich die Leistung des Segmentierungsmodells verbessern, wenn die Direktionalität in den simulierten Bildern hinzugefügt wird.
Simulator-Parameter
Beim Festlegen der Parameter des Simulators ist Vorsicht geboten, um sicherzustellen, dass sie mit denen der Daten übereinstimmen, auf denen die Inferenz ausgeführt werden soll, da dies nicht zu einer geringeren Segmentierungsleistung führen kann. Ein solcher Parameter ist der Signal-Rausch-Bereich (SNR). Der Bereich des SNR der zu testenden Daten sollte mit den Werten des simulierten Datensatzes übereinstimmen. Darüber hinaus sollte die verwendete PSF mit der der Zieltestdaten übereinstimmen. Beispielsweise sollten modelltrainierte Bilder aus einem konfokalen PSF nicht zum Testen von Bildern aus einem Epifluoreszenzmikroskop verwendet werden. Ein weiterer Parameter, auf den man achten sollte, ist die Verwendung einer zusätzlichen Vergrößerung in den Testdaten. Wenn in den Testdaten eine zusätzliche Vergrößerung verwendet wurde, sollte auch der Simulator entsprechend eingestellt werden.
Transferlernen
Transferlernen ist das Phänomen der Nutzung eines gelernten Modells, das auf einer Aufgabe trainiert wurde, für die Verwendung in einer anderen Aufgabe. Dieses Phänomen ist auch auf unser Problem in Bezug auf verschiedene Arten von Mikroskopdaten anwendbar. Die Gewichte des Segmentierungsmodells (mit dem Quellcode bereitgestellt), das für eine Art von Mikroskopiedaten trainiert wird, können verwendet werden, um ein Segmentierungsmodell zu initialisieren, das für eine andere Art von Lichtmikroskopdaten verwendet werden soll. Dies ermöglicht es uns, mit einer deutlich kleineren Teilmenge des Trainingsdatensatzes zu trainieren (3.000 Bilder im Vergleich zu 10.000), wodurch die Rechenkosten der Simulation reduziert werden.
Partikelanalyse
Die Partikelanalyse kann auch an den segmentierten Masken durchgeführt werden. Dies kann Aufschluss über die Fläche und Krümmung usw. der einzelnen Mitochondrien geben. Diese Informationen können auch als Metriken für den quantitativen Vergleich von Mitochondrien dienen (nicht für dieses Experiment verwendet). Zum Beispiel definieren wir derzeit die Punktmorphologie mit einem Schwellenwert, der auf der Länge der Mitochondrien basiert. In einigen Fällen kann es sinnvoll sein, Elliptizität einzubauen, um kleine stäbchenartige Mitochondrien besser von Puncta oder punktartigen Mitochondrien zu trennen. Alternativ, wenn bestimmte biologische Bedingungen dazu führen, dass sich die Mitochondrien zusammenrollen, kann die Krümmungsquantifizierung von Interesse sein, um die mitochondriale Population zu analysieren.
Erzeugung anderer subzellulärer Strukturen
Die physikbasierte Segmentierung subzellulärer Strukturen wurde für Mitochondrien und Vesikel nachgewiesen1. Obwohl Vesikel unterschiedliche Formen aufweisen, sind ihre Größen kleiner und erscheinen als einfache Kugeln, wenn sie durch ein Fluoreszenzmikroskop beobachtet werden. Daher wird die Geometrie von Vesikeln mit sphärischen Strukturen eines geeigneten Durchmesserbereichs simuliert. Dies impliziert eine Änderung der Funktion erzeugt die Geometrie (Zylinder bei Mitochondrien und Kugeln bei Vesikel) der Strukturen und der jeweiligen Parameter (Schritt 5.4 im Protokollabschnitt). Geometrisch wurden auch das endoplasmatische Retikulum und die Mikrotubuli als röhrenförmige Strukturen simuliert17. Die Modellierung des endoplasmatischen Retikulums mit einem Durchmesser von 150 nm und Mikrotubuli mit einem durchschnittlichen Außendurchmesser von 25 nm und einem inneren Hohlrohr von 15 nm Durchmesser liefert Annäherungen an die Formen dieser Strukturen. Ein weiterer Parameter, der für jede dieser subzellulären Strukturen variiert, ist die Fluorophordichte. Dies wird basierend auf der Verteilung des Biomoleküls, an das die Fluorophore binden, und der Wahrscheinlichkeit der Bindung berechnet.
Unterschied zur biologischen Grundwahrheit
Die simulierten Daten, die für das simulationsüberwachte Training des Deep-Learning-Modells verwendet werden, unterscheiden sich in vielerlei Hinsicht von realen Daten. (i) Das Fehlen einer unspezifischen Markierung in den simulierten Daten unterscheidet sich von den realen Daten, da in den realen Daten häufig frei schwebende Fluorophore enthalten sind. Dies führt zu einem höheren durchschnittlichen Hintergrundwert im realen Bild. Dieser Unterschied wird gemildert, indem das SNR abgeglichen und der Hintergrundwert so eingestellt wird, dass er mit den beobachteten realen Werten übereinstimmt. (ii) Die Bewegung subzellulärer Strukturen und Photokinetik sind zwei Quellen der Dynamik im System. Bewegte Strukturen in lebenden Zellen (die sich im Bereich von wenigen Millisekunden bewegen) verursachen Bewegungsunschärfe. Die Belichtungszeit wird während der realen Datenerfassung reduziert, um den Unschärfeeffekt zu vermeiden. Auf der anderen Seite simulieren wir keinen Zeitraffer und gehen von bewegungslosen Strukturen aus; Diese Annahme ist gültig, wenn die Belichtungszeit in den realen Daten klein ist. Diese Annahme kann jedoch zu einem Fehler in der Ausgabe führen, wenn die Belichtungszeit der realen Daten groß genug ist, um Bewegungsunschärfe zu verursachen. Die Photokinetik hingegen liegt in der Größenordnung von Nanosekunden bis Mikrosekunden und kann in der Simulation weggelassen werden, da die üblichen Belichtungszeiten von Experimenten lang genug sind (in der Größenordnung von Millisekunden), um die Effekte der Photokinetik zu mitteln. (iii) Rauschen in Mikroskopbildern hat unterschiedliche Quellen, und diese Quellen haben unterschiedliche Wahrscheinlichkeitsdichtefunktionen. Anstatt diese einzelnen Rauschquellen zu modellieren, nähern wir es uns als Gaußsches Rauschen über einen konstanten Hintergrund an. Dieser Unterschied ändert die Datenverteilung für die Bedingungen mit niedrigem Signal-zu-Hintergrund-Verhältnis (im Bereich von 2-4) und bei der Makrodichte von Fluorophoren1 nicht signifikant. (iv) Artefakte in der Bildgebung können durch Aberrationen, Drift und systematische Unschärfen entstehen. Wir gehen davon aus, dass das Mikroskop gut ausgerichtet ist und dass die für die Analyse in den realen Daten ausgewählten Regionen frei von diesen Artefakten sind. Es besteht auch die Möglichkeit, einige dieser Artefakte in der PSF18,19,20 zu modellieren.
Dicht gepackte Strukturen
Die Schwierigkeit, überlappende Stäbchen nicht von Netzwerken unterscheiden zu können, ist ein hartnäckiges Problem bei der Segmentierung von 2D-Mikroskopiedaten. Ein äußerst herausforderndes Szenario ist in Abbildung 5 dargestellt, in dem die Mitochondrien dicht gepackt sind, was zu suboptimalen Ergebnissen im Segmentierungsmodell und der folgenden Analyse führt. Trotz dieser Herausforderung kann die Verwendung morphologischer Operatoren in solchen Situationen, um die Skelettierung zu verschlanken, dazu beitragen, diese übermäßig verbundenen Netzwerke zu durchbrechen, während signifikante Veränderungen in allen mitochondrialen Morphologiekategorien immer noch erkannt werden können. Darüber hinaus ist die Verwendung eines konfokalen anstelle eines Weitfeldmikroskops für die Bildgebung eine Methode, um dieses Problem teilweise zu mildern, indem unscharfes Licht eliminiert wird. Darüber hinaus wäre es in Zukunft nützlich, eine 3D-Segmentierung durchzuführen, um Mitochondrien, die sich schneiden (dh physisch ein Netzwerk bilden), von stäbchenartigen Mitochondrien zu unterscheiden, deren Projektionen in einer einzigen Ebene sich überlappen.
Die Deep-Learning-Segmentierung ist ein vielversprechendes Werkzeug, das die Analysemöglichkeiten von Mikroskopie-Anwendern erweitert und damit die Möglichkeit der automatisierten Analyse komplexer Daten und großer quantitativer Datensätze eröffnet, die bisher unüberschaubar gewesen wären.
Offenlegungen
Die Autoren erklären, dass es keine Interessenkonflikte im Zusammenhang mit diesem Artikel gibt.
Danksagungen
Die Autoren würdigen das Gespräch mit Arif Ahmed Sekh. Zambarlal Bhujabal ist anerkannt für seine Unterstützung beim Aufbau der stabilen H9c2-Zellen. Wir erkennen die folgende Finanzierung an: ERC Starting Grant Nr. 804233 (an K.A.), Researcher Project for Scientific Renewal Grant Nr. 325741 (an D.K.P.), Northern Norway Regional Health Authority grant no. HNF1449-19 (Å.B.B.) und UiT's thematisches Förderprojekt VirtualStain mit Cristin Project ID 2061348 (D.K.P., Å.B.B., K.A. und A.H.).
Materialien
| Name | Company | Catalog Number | Comments |
| 12-well plate | FALCON | 353043 | |
| Aqueous Glutaraldehyde EM Grade 25% | Electron Microscopy Sciences | 16200 | |
| Axio Vert.A1 | Zeiss | Brightfield microscope | |
| CCCP | Sigma-Aldrich | C2759 | |
| Computer | n/a | n/a | Must be running Linux/Windows Operating System having an NVIDIA GPU with at least 4GB of memory |
| Coverslips | VWR | 631-0150 | |
| DAPI (stain) | Sigma-Aldrich | D9542 | |
| DMEM | gibco | 11966-025 | |
| Fetal Bovine Serum | Sigma-Aldrich | F7524 | |
| Glass Slides (frosted edge) | epredia | AA00000112E01MNZ10 | |
| H9c2 mCherry-EGFP-OMP25 | In-house stable cell line derived from purchased cell line | ||
| Incubator | Thermo Fisher Scientific | 51033557 | |
| LSM 800 | Zeiss | Confocal Microscope | |
| Mounting Media (Glass) | Thermo Fisher Scientific | P36980 | |
| Paraformaldehyde Solution, 4% in PBS | Thermo Fisher Scientific | J19943-K2 | |
| Plan-Apochromat 63x oil (M27) objective with an NA of 1.4 | Zeiss | 420782-9900-000 | |
| Sterile laminar flow hood | Labogene | SCANLAF MARS | |
| Trypsin | Sigma-Aldrich | T4049 | |
| Vacusafe aspiration system | VACUUBRAND | 20727400 | |
| ZEN 2.6 | Zeiss |
Referenzen
- Sekh, A. A., et al. Physics-based machine learning for subcellular segmentation in living cells. Nature Machine Intelligence. 3, 1071-1080 (2021).
- Pernas, L., Scorrano, L. Mito-morphosis: Mitochondrial fusion, fission, and cristae remodeling as key mediators of cellular function. Annual Review of Physiology. 78, 505-531 (2016).
- Li, Y., et al. Imaging of macrophage mitochondria dynamics in vivo reveals cellular activation phenotype for diagnosis. Theranostics. 10 (7), 2897-2917 (2020).
- Xu, X., Xu, S., Jin, L., Song, E. Characteristic analysis of Otsu threshold and its applications. Pattern Recognition Letters. 32 (7), 956-961 (2011).
- MorphoLibJ: MorphoLibJ v1.2.0. Zenodo Available from: https://zenodo.org/record/50694#.Y8qfo3bP23A (2016)
- Trainable_Segmentation: Release v3.1.2. Zenodo Available from: https://zenodo.org/record/59290#.Y8qf13bP23A (2016)
- Chu, C. H., Tseng, W. W., Hsu, C. M., Wei, A. C. Image analysis of the mitochondrial network morphology with applications in cancer research. Frontiers in Physics. 10, 289 (2022).
- Xue, F., Li, J., Blu, T. Fast and accurate three-dimensional point spread function computation for fluorescence microscopy. Journal of the Optical Society of America A. 34 (6), 1029-1034 (2017).
- Lanni, F., Gibson, S. F. Diffraction by a circular aperture as a model for three-dimensional optical microscopy. Journal of the Optical Society of America A. 6 (9), 1357-1367 (1989).
- Sekh, A. A., et al. Physics based machine learning for sub-cellular segmentation in living cells. Nature Machine Intelligence. 3, 1071-1080 (2021).
- Liu, Y., Song, X. D., Liu, W., Zhang, T. Y., Zuo, J. Glucose deprivation induces mitochondrial dysfunction and oxidative stress in PC12 cell line. Journal of Cellular and Molecular Medicine. 7 (1), 49-56 (2003).
- Dott, W., Mistry, P., Wright, J., Cain, K., Herbert, K. E. Modulation of mitochondrial bioenergetics in a skeletal muscle cell line model of mitochondrial toxicity. Redox Biology. 2, 224-233 (2014).
- Ishihara, N., Jofuku, A., Eura, Y., Mihara, K. Regulation of mitochondrial morphology by membrane potential, and DRP1-dependent division and FZO1-dependent fusion reaction in mammalian cells. Biochemical and Biophysical Research Communications. 301 (4), 891-898 (2003).
- Miyazono, Y., et al. Uncoupled mitochondria quickly shorten along their long axis to form indented spheroids, instead of rings, in a fission-independent manner. Scientific Reports. 8, 350 (2018).
- Ganote, C. E., Armstrong, S. C. Effects of CCCP-induced mitochondrial uncoupling and cyclosporin A on cell volume, cell injury and preconditioning protection of isolated rabbit cardiomyocytes. Journal of Molecular and Cellular Cardiology. 35 (7), 749-759 (2003).
- Nunez-Iglesias, J., Blanch, A. J., Looker, O., Dixon, M. W., Tilley, L. A new Python library to analyse skeleton images confirms malaria parasite remodelling of the red blood cell membrane skeleton. PeerJ. 2018, 4312 (2018).
- Sage, D., et al. Super-resolution fight club: Assessment of 2D and 3D single-molecule localization microscopy software. Nature Methods. 16, 387-395 (2019).
- Yin, Z., Kanade, T., Chen, M. Understanding the phase contrast optics to restore artifact-free microscopy images for segmentation. Medical Image Analysis. 16 (5), 1047-1062 (2012).
- Malm, P., Brun, A., Bengtsson, E. Simulation of bright-field microscopy images depicting pap-smear specimen. Cytometry. Part A. 87 (3), 212-226 (2015).
- Bifano, T., Ünlü, S., Lu, Y., Goldberg, B. Aberration compensation in aplanatic solid immersion lens microscopy. Optical Express. 21 (23), 28189-28197 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten