A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניסוי אקראי ומבוקר דמה של גירוי חשמלי גולגולתי לכאבי פיברומיאלגיה ותפקוד גופני, תוך שימוש בסמנים ביולוגיים של הדמיה מוחית
In This Article
Summary
המחקר הנוכחי הוא ניסוי אקראי ומבוקר פלצבו כדי לקבוע את היעילות של גירוי חשמלי גולגולתי (CES) לשיפור כאב ותפקוד בפיברומיאלגיה ולפתח עוד יותר קישוריות תפקודית במנוחה דימות תהודה מגנטית (rs-fcMRI) ככלי קליני להערכת הקורלציות העצביות והמנגנונים של כאב כרוני ותגובה משככת כאבים.
Abstract
פיברומיאלגיה היא תסמונת כאב כרונית המציגה מערך של תסמינים רחבים, כולל ירידה בתפקוד הפיזי, עייפות, הפרעות קוגניטיביות ותלונות סומטיות אחרות. טיפולים זמינים לעתים קרובות אינם מספיקים בטיפול בתסמינים, עם שליטה לא מספקת בכאב המוביל בדרך כלל לשימוש באופיואידים לניסיון ניהול. גירוי חשמלי גולגולתי (CES) הוא אפשרות טיפול לא פרמקולוגית מבטיחה למצבי כאב המשתמשת בגירוי זרם חשמלי פועם כדי לשנות את תפקוד המוח באמצעות אלקטרודות טרנסעוריות. מנגנונים עצביים אלה והיישומים של CES בהקלה על תסמיני פיברומיאלגיה דורשים חקירה נוספת.
סך של 50 משתתפים ממערכת הבריאות לענייני חיילים משוחררים באטלנטה (VAHCS) שאובחנו עם פיברומיאלגיה נרשמו ולאחר מכן חולקו באופן אקראי לטיפול פלצבו פלוס סטנדרטי או CES פעיל בתוספת קבוצת טיפול סטנדרטית. הערכות בסיסיות התקבלו לפני תחילת הטיפול. שתי ההתערבויות התרחשו במשך 12 שבועות, והמשתתפים הוערכו לאחר 6 שבועות ו -12 שבועות לאחר תחילת הטיפול. התוצאה העיקרית חקרה אם כאב ושיפורים תפקודיים מתרחשים עם היישום של CES. בנוסף, התקבלו דימות תהודה מגנטית של קישוריות תפקודית במצב מנוחה (rs-fcMRI) בנקודות הזמן של 6 שבועות ו-12 שבועות כדי להעריך יישומים קליניים של סמנים ביולוגיים של קישוריות עצבית והקשרים העצביים הבסיסיים הקשורים להשפעות הטיפול.
זהו ניסוי אקראי ומבוקר פלצבו כדי לקבוע את היעילות של CES לשיפור כאב ותפקוד בפיברומיאלגיה ולהמשיך לפתח rs-fcMRI ככלי קליני להערכת הקורלציות העצביות והמנגנונים של כאב כרוני ותגובה משככת כאבים.
Introduction
מבין המצבים הרבים הקיימים של כאב כרוני, אחת המחלות הידועות לשמצה כקשות ביותר לאבחון, הערכה קלינית וטיפול היא פיברומיאלגיה. פיברומיאלגיה היא תסמונת כאב כרוני מתישה הכוללת כאב כרוני מפושט, ירידה בתפקוד הפיזי, עייפות, הפרעות פסיכו-רגשיות והפרעות שינה, ותלונות סומטיות שונות המשפיעות על כ 2-3% מהאוכלוסייה הכללית באמריקה (כ -8 מיליון אנשים בארה"ב) 1. אבחון המחלה מסתמך במידה רבה על הבנת המטופל את פרופיל הסימפטומים שלו ואת חוויית הכאב שלו, וללא הבנה נכונה זו הן על ידי המטפל והן על ידי המטופל של המחלה, שיטות הטיפול מאבדות יעילות ניכרת2. הגדרה טובה יותר של מקורות הפיברומיאלגיה והשפעתה וכן סמן ביולוגי קליני אמין שינחה אבחון וטיפול בפיברומיאלגיה נחוצים כדי לשרת בצורה הטובה ביותר את כל החולים.
גם עם אבחנה מאושרת, קשיים בתהליך הטיפול רק לגדול. ככלל, כאב כרוני משפיע על יותר אנשים מאשר מחלות לב, סוכרת וסרטן גם יחד. האופי הסובייקטיבי של הערכתו מציב אותו כמניע העיקרי למגפת האופיואידים, במיוחד בהתחשב בקושי להבחין בין כאב פיזי שלא טופל במלואו לבין הפרעת שימוש בחומרים והתנהגות של חיפוש סמים3. בשנת 2020 התרחשו בארה"ב 91,799 מקרי מוות כתוצאה ממנת יתר של סמים (עלייה של 30% משנת 2019), ואופיואידים נמצאו כגורם העיקרי למקרי מוות אלה (74.8% מכלל מקרי המוות ממנת יתר של סמים בשנת 2020)4. לפיכך, יש צורך בחלופות לא תרופתיות לטיפול בכאב כרוני ובפיברומיאלגיה כדי להאט את מגפת האופיואידים, שהיא חשובה במיוחד באוכלוסייה הוותיקה שבה הסיכון להתאבדות והפרעת שימוש באופיואידים גבוה יותר5. טיפולים לא תרופתיים ומשלימים משמשים אפוא לעתים קרובות כטיפולי קו ראשון6.
החיפוש אחר התערבויות פיברומיאלגיה חדשניות ויעילות הוביל חוקרים וקלינאים רבים לשיטות של גירוי מוחי לא פולשני, כולל גירוי גולגולתי. למרות שהמנגנונים הפתופיזיולוגיים הגורמים להתפתחות המחלה לא נקבעו באופן סופי, הראיות הקיימות תומכות ברעיון שפיברומיאלגיה היא הפרעה של תפקוד לקוי של מערכת העצבים האוטונומית ומנגנוני עיבוד כאב מרכזיים (כלומר, המוח וחוט השדרה) 7,8. גירוי של אזורים מסוימים במוח יכול להוביל לשיפור התפקוד באזורים אלה של עיבוד. גירוי מגנטי טרנס-גולגולתי חוזר (rTMS) וגירוי זרם ישיר תוך גולגולתי (tDCS) נמצאו בקורלציה עם הפחתת כאב, אך נקשרו גם לגירוי בקרקפת באתר ההפעלה, כאבי ראש וחוסר נגישות מחוץ למתקני הטיפול9. גירוי עצבי הואגוס לא פולשני (nVNS), שיכול לספק נוירומודולציה באמצעות גירוי על העור בצוואר או בגובה האוזן, הוא בעל פוטנציאל לטיפול בכאב כרוני, וגירוי עצבי הואגוס פולשני (VNS) הוכח כמשפר תסמיני כאב כרוני10. עם זאת, VNS פולשני או לא פולשני לא נחקרו מספיק בספרות או אומתו באופן מלא לשימוש בטיפול בפיברומיאלגיה 11,12,13,14.
גירוי חשמלי גולגולתי (CES) הוא טיפול לא תרופתי ולא פולשני לגירוי מוחי המורכב ממיקרו-זרם פועם לסירוגין (פחות מ -0.5 mA) המופעל באמצעות אלקטרודות טרנסעוריות הממוקמות על תנוכי האוזן15. הוא נגיש להפליא וניתן להעביר אותו באמצעות מכשירים ניידים המשמשים את המטופלים בתוך חללי המגורים שלהם. בהשוואה לשיטות אחרות לגירוי גולגולתי, האופי הלא פולשני והנוחות של יישום עצמי של המטופל בבית מגדילים את הפוטנציאל של CES כאופציה מועילה לשימוש נרחב בטיפול בפיברומיאלגיה וניהול עצמי של כאב. הוא אושר על ידי מנהל המזון והתרופות האמריקני (FDA) כטיפול לנדודי שינה, דיכאון, חרדה וכאב15.
המחקר הנוכחי מעריך את היעילות של CES כשיטת טיפול בפיברומיאלגיה על ידי השוואת CES פעיל (מנוהל על ידי מכשיר מחקר אמיתי) לעומת CES מזויף (מנוהל על ידי מכשיר מחקר דמה). ישנן כמה ראיות ראשוניות התומכות בשימוש ב- CES בטיפול במצבי כאב כגון פיברומיאלגיה16,17. מחקר משנת 2001 שנערך בקרב 60 משתתפים שחולקו באקראי ל-CES פעיל או מזויף במשך 3 שבועות של מפגשים יומיים בני 60 דקות גילה שיפור של 28% בציוני נקודות המכרז, שיפור של 27% בציוני הכאב הכלליים, וללא אפקט פלצבו18. CES לא הוערך באוכלוסייה ותיקה, וגם לא הוערך כראוי בגברים עם פיברומיאלגיה. סקירה שיטתית של CES במימון חיילים משוחררים (VA) שפורסמה בשנת 2018 הגיעה למסקנה כי ראיות אינן מספיקות כדי של- CES יהיו השפעות קליניות חשובות על פיברומיאלגיה, בהתחשב בכך שלרוב הניסויים היו דגימות קטנות, משכי זמן קצרים וסיכון גבוה להטיה עקב סינוור לקוי. עם זאת, הסקירה מציעה כי CES אינו גורם לתופעות לוואי חמורות, ויש ראיות נמוכות כדי להציע יתרונות צנועים בחולים עם חרדה ודיכאון19. לכן, יש צורך במחקר נוסף בנוגע לשימוש במכשיר זה שאושר על ידי ה- FDA, בסיכון נמוך, במיוחד בפיברומיאלגיה.
על מנת להעריך באופן מלא את היעילות, החוקרים העריכו את הכושר הגופני לצד סמנים ביולוגיים עצביים וחוויית כאב. מטרת הטיפול במצבי כאב כרוניים היא לשפר את התפקוד הגופני. פיברומיאלגיה נמצאת בקורלציה עקבית עם השפעות שליליות הן על התפקוד הגופני והן על תפיסת המטופלים את יכולותיהם הגופניות20. מחקרים קודמים השתמשו בהערכות כושר גופני פשוטות כדי לקבוע סיבולת וניידות, כגון מבחן 6 דקות הליכה (6MWT)20,21, חמש פעמים לשבת לעמוד (5TSTS)20, ומדדים שונים של כושר נשיאה וכוח בהקשר של פעילויות יומיומיות22. כדי להסביר את המדדים הסטנדרטיים תוך הפחתת כמות הפעילות המאומצת הנדרשת ממש לפני סריקת MRI, צוות המחקר השתמש במבחן עמידת כיסא של 30 שניות כמדד לסיבולת וניידות וגם תלתלי שריר הזרוע ומבחן אחיזת יד כמדדי כוח23. התנועות הנדרשות בכל אחת מההערכות הללו שכיחות מאוד בפעילויות יומיומיות, ולכן זהו מדד ברור לאופן שבו אנשים מתפקדים פיזית בחיי היומיום שלהם, עם וללא טיפול.
אפילו עם הערכות כאב סובייקטיביות ומדדי יעילות של תפקוד גופני, המנגנונים של CES אינם מובנים במלואם. מחקרי דימות מוחי קודמים חיפשו הבנה טובה יותר על ידי חקירת ההשפעה הישירה של CES על קישוריות הרשת במוח. Feusner et al.24 מצאו כי CES קשור לנטרול קליפת המוח עבור גירוי של 0.5 הרץ ו-100 μA של אזורי קו האמצע הקדמי, הקודקודי והאחורי הדו-צדדיים, והניחו כי לתדירות הגירוי עשויה להיות השפעה רבה יותר מאשר לעוצמת הזרם ביחס לנטרול קליפת המוח. הקבוצה שלהם מצאה השפעות משמעותיות על חלק מהצמתים של רשת ברירת המחדל (DMN), אך לא על כולם. המחברים מציעים כי בהתבסס על נתונים אלה, CES עשוי להשפיע על קישוריות תפקודית במצב מנוחה. פיברומיאלגיה ומצבי כאב כרוניים אחרים הוכחו כמשפיעים על קישוריות המוח הפנימית באזורים הקשורים לכאב ולתפיסה25,26, כך שטיפולים המשנים את הקישוריות התפקודית בתגובה יכולים להוכיח את עצמם כמועילים ויעילים. יש צורך בחקירה נוספת של ההשפעות ארוכות הטווח של הטיפול היומיומי ביחס לשיפור קליני, כמו גם כיצד הפעלה של נפטרים במוח קשורה לירידות שנצפו בעבר בתדרי האלקטרואנצפלוגרמה, כדי להבין עוד יותר את המנגנון הטיפולי של פעולה27.
דימות תהודה מגנטית של קישוריות תפקודית במצב מנוחה (rs-fcMRI) היא שיטת הדמיה מוחית המאפשרת תצפית על שינויי קישוריות תפקודיים אלה. fMRI מצב מנוחה אורכי מאפשר לרופאים ולחוקרים לקבוע קו בסיס של קישוריות מצב מנוחה ולעקוב אחר שינויים לאורך זמן בתגובה לשיטות הטיפול ב- CES. זה גם עוזר לקבוע כיצד שינויים בקישוריות תפקודית מתואמים עם הבדלים בחוויית הכאב. מחקרים ראשוניים של דימות מוחי עבור פיברומיאלגיה השתמשו בטומוגרפיה של פליטת פוזיטרונים (PET) ובטומוגרפיה ממוחשבת של פליטת פוטון יחיד (SPECT) כדי לבחון את המוח, אך ישנן בעיות בשתי הטכניקות בהקשר זה: ל- SPECT יש רזולוציה נמוכה יותר מאשר ל- PET, וסריקות PET הן פולשניות, דבר שאינו עדיף עבור חולים החווים כאב כרוני. סריקות דימות תהודה מגנטית תפקודי (fMRI) הן בעלות רזולוציה גבוהה יותר מאשר SPECT, אך הן בוחנות את פעילות המוח בתגובה לפעולות ספציפיות של מטופלים או תפיסות של גירויים28. סריקות rs-fcMRI יכולות לתאר קישוריות תפקודית בין אזורים במוח ועשויות להיות מסוגלות לקבוע היכן וכיצד קיימת פיברומיאלגיה, כמו גם את שיטות הטיפול הטובות ביותר28.
הערכת יעילותם של טיפולים לא תרופתיים במצבי כאב כגון פיברומיאלגיה היא בעלת חשיבות עליונה הן במצב הנוכחי של מגפת האופיואידים והן בבחינת כאב כרוני כגורם סיכון לאובדנות29,30, אשר גדל באופן משמעותי בקרב האוכלוסייה הוותיקה. בנוסף, היעדר סמנים ביולוגיים קליניים נאותים לכאב הוא פער ידע מוכר. שימוש בשילוב של מדדים התנהגותיים והדמיה מוחית בנקודות זמן מרובות כדי להעריך את התגובה לטיפול היא גישה חדשנית להערכת פיברומיאלגיה, כמו גם השימוש ב- CES אוריקולרי כטיפול.
הפרוטוקול נועד לטפל בפער במחקר פיברומיאלגיה על ידי חקירת ההשפעות של CES על כאב ותוצאות תפקוד גופני והערכת דימות מוחי ככלי לסמנים ביולוגיים לחיזוי ותגובה הקשורים לתוצאות הקליניות של טיפול CES31.
Protocol
המחקר נערך באישור אוניברסיטת אמורי (IRB 112768) ואטלנטה VA Institutional Review Boards (1585632-2; מספר סימוכין פנימי: 003) וכן ועדת המו"פ של אטלנטה VA (מספר סימוכין של מועצת המנהלים: 3881). כל הנבדקים נתנו את הסכמתם מדעת להכללה לפני שהשתתפו במחקר זה. לייצוג חזותי של ציר הזמן של פרוטוקול המחקר, ראו איור 1).
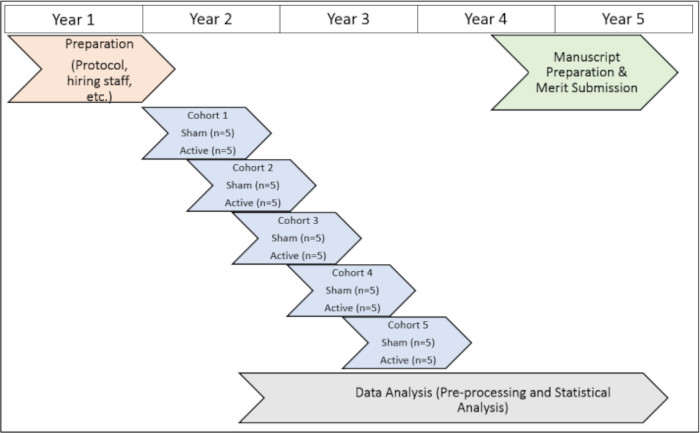
איור 1: ציר הזמן של המחקר. ייצוג חזותי של ציר הזמן לביצוע הליכי המחקר לאורך תקופת הניסיון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
1. גיוס משתתפים בשיטות זמינות
- פעל בהתאם להנחיות המוסדיות הנדרשות להפצת חומרי גיוס ללימוד (פליירים, פוסטים, מיילים, שיחות וכו ') ושיטות גיוס מאושרות.
הערה: המחקר הנוכחי גויס באמצעות דיוור מכתבי גיוס לקבוצות ספציפיות ושיחות טלפון מעקב למשתתפים פוטנציאליים. הפרטים לגבי הזמנת מכשירי CES למחקר כלולים בהוראות הזמנת מכשירי CES המשלימים (קובץ משלים 1). - כאשר מישהו מביע עניין בהשתתפות במחקר, סנן אותו בטלפון כדי לוודא שהוא עומד בכל קריטריוני ההכללה וההדרה.
- כלול משתתפים העונים על קריטריוני הזכאות: גילאי 20-60 (מגבלה שנקבעה במהלך מחקר ראשוני כדי למזער שינויים מבניים במוח עקב הזדקנות)31; אבחון פיברומיאלגיה על ידי המכללה האמריקאית לראומטולוגיה 2016 קריטריונים32; ימניות (על מנת לספק עקביות במבנה המוח ובתפקודו); ציון כאב של 4 ומעלה בסולם דירוג הכאב של ההגנה וחיילים משוחררים (DVPRS)33 בשלושת החודשים שקדמו לגיוס; תרופות עקביות ויציבות הקשורות ל- FM לפחות 4 שבועות לפני ההרשמה34; ויכולת לסבול MRI בבטחה.
- עבור החלק של בדיקת פיברומיאלגיה, מלא את הקריטריונים החדשים לאבחון פיברומיאלגיה קלינית32 עם המשתתף הפוטנציאלי כדי לקבל את ציון מדד הכאב הנרחב (WPI) ואת ציון החומרה (SS). ציון בהתאם להנחיות המפורטות בתחתית העמוד.
- עבור החלק של בדיקת ציון הכאב, בקשו מהמשתתפים הפוטנציאליים לדרג מילולית את הכאב הממוצע והעקבי שלהם במהלך 3 החודשים האחרונים בסולם מאפס עד עשר.
- עבור החלק של בדיקת MRI, מלא טופס בדיקת בטיחות MRI עם המשתתף הפוטנציאלי שסופק על ידי מוסד או מתקן הסורק עצמו.
- שאל את המשתתפים על כל קריטריוני ההדרה האפשריים. קריטריוני ההדרה כוללים היסטוריה של התקפים או מצבים נוירולוגיים המשנים את המוח; היריון; קלסטרופוביה, שתלים שאינם תואמים ל- MRI או מצבים אחרים שאינם תואמים ל- MRI; והיסטוריה של מחלה פסיכיאטרית בלתי נשלטת או מחלה אוטואימונית המובילה לכאב ויכולה להסביר טוב יותר את הסימפטומים31.
- אם אחד מקריטריוני ההחרגה חל עליהם, הם נכשלים במיון. אל תכלול אותם במחקר.
- כלול משתתפים העונים על קריטריוני הזכאות: גילאי 20-60 (מגבלה שנקבעה במהלך מחקר ראשוני כדי למזער שינויים מבניים במוח עקב הזדקנות)31; אבחון פיברומיאלגיה על ידי המכללה האמריקאית לראומטולוגיה 2016 קריטריונים32; ימניות (על מנת לספק עקביות במבנה המוח ובתפקודו); ציון כאב של 4 ומעלה בסולם דירוג הכאב של ההגנה וחיילים משוחררים (DVPRS)33 בשלושת החודשים שקדמו לגיוס; תרופות עקביות ויציבות הקשורות ל- FM לפחות 4 שבועות לפני ההרשמה34; ויכולת לסבול MRI בבטחה.
- כאשר מישהו עובר את הבדיקה, קבע לו פגישה להסכמה ולסריקת MRI בסיסית. קבע שעתיים לזמן ההסכמה והסריקה.
2. ניהול פגישות מחקר בסיסיות, בינוניות ופוסט-משתתפים (ראה טבלה 1)
הערה: כל הפגישות מתקיימות במיקום סורק MRI.
| זמן | פעילות מחקרית | |
| שלב 1 | שבוע 1 | גיוס, מיון, הרשמה |
| שלב 2 | שבוע 2–3 | הערכות בסיסיות, rs-fcMRI |
| שלב 3 | שבועות 2–14 | התערבות |
| שלב 4 | שבוע 6–10 | מעקב חריף, rs-fcMRI (6 שבועות לטיפול) |
| שלב 5 | שבוע 12–16 | מעקב ארוך טווח, rs-fcMRI (12 שבועות לטיפול) |
טבלה 1: תכנון מחקר. ציר זמן של שלבי ההשתתפות האישית במהלך 12 השבועות של המחקר.
- לפני כל ביקור בסיסי, הכן מכשיר CES להביא לכל משתתף.
- פתח את המארז כדי לוודא שהמכשיר נמצא בפנים (הוא צריך להיות בניילון בועות). הסר את גב ההתקן והכנס שתי סוללות AAA.
- החלף את ההתקן בחזרה. הפעל את המכשיר כדי לוודא שהוא פועל לפני הבאתו למשתתף. החזק את הלחצן העליון לחוץ למשך כ- 2 שניות עד שהמסך יידלק כדי להפעיל אותו, והחזק אותו למשך כ- 2 שניות עד שהמסך יתרוקן כדי לכבות אותו.
- ודא שכל כיסוי מכיל את המכשיר, סוללות נוספות, שרוך, מוליך תמיסה קטן ואטבי אוזניים. ודאו שהשקית שיש לתת למשתתפים מכילה את מארז המכשיר, בקבוק של תמיסת מוליך, פקק נוסף למילוי מוליך התמיסה הקטן ורפידות אלקטרודות אטב אוזניים נוספות.
- לאחר קביעת הסכמתו וסריקת ה- MRI הבסיסית, פגוש את המשתתף במיקום סורק ה- MRI לפגישה עם שני עותקים של טופס ההסכמה, מכשיר CES וחומריו, ניירת בדיקת זכאות וחבילת שאלונים למילוי. בנוסף, הביאו את מכשיר העברת הנתונים דרכו יועברו נתוני ה-MRI לאתר הניתוח.
הערה: במחקר זה נעשה שימוש בכונן USB מוצפן.- עבור ניירת הזכאות, כלול את הקריטריונים החדשים לאבחון פיברומיאלגיה קלינית32 ואת DVPRS33.
הערה: יש לכלול את DVPRS עבור כל ביקור. - עבור בדיקות התפקוד הפיזי, כלול טופס לרישום התוצאות של כל בדיקה 20,21,35.
- עבור השאלונים שהמשתתפים ימלאו, כלול את מדדי PROMIS המתאימים (סולם PROMIS v1.2 - בריאות גלובלית, Neuro-QOL בנק פריטים v2.0 - פונקציית קוגניציה - צורה קצרה, בנק פריטים PROMIS v1.0 - שימוש בחומרים / אלכוהול: שימוש באלכוהול, בנק פריטים PROMIS v1.0 - מצוקה רגשית - חרדה - טופס קצר 7a, בנק פריטים PROMIS v1.0 - מצוקה רגשית-דיכאון - טופס קצר 4a, בנק פריט PROMIS v1.0 - עייפות - טופס קצר 6א, PROMIS פריט בנק v1.0 - הפרעות כאב - טופס קצר 4a, PROMIS פריט בנק v1.2 - פונקציה פיזית - טופס קצר 8b, PROMIS פריט בנק v2.0 - בידוד חברתי - טופס קצר 4a)36.
- עבור ניירת הזכאות, כלול את הקריטריונים החדשים לאבחון פיברומיאלגיה קלינית32 ואת DVPRS33.
- במיקום MRI, נהל את הביקור הבסיסי. התקשר למשתתף מראש כדי לאשר.
- קרא את טופס ההסכמה המלא עם המשתתף כדי לוודא שהוא מבין את המידע. שאלו אותם אם הם רוצים להשתתף, ואם הם מסכימים, בקשו מהם להדפיס את שמם, לחתום ולתארך את הטופס.
- לאחר ההסכמה, אם המשתתף בוחר להשתתף במחקר, מלא איתו את ניירת בדיקת ההכללה. אם הם זכאים להמשיך, בצע את השלבים הבאים; אם הם אינם זכאים, להפסיק את השתתפותם במחקר בשלב זה.
- ודא שניירת בדיקת הזכאות כוללת את הקריטריונים החדשים לאבחון פיברומיאלגיה קלינית ואת DVPRS.
- אם משתתף זכאי לאחר בדיקת ההכללה, הסבר למשתתף כיצד להשתמש במכשיר CES.
- הסר את המכשיר מהמארז והראה למשתתפים כיצד להפעיל ולכבות אותו באמצעות הלחצן בחלק העליון. הזכירו למשתתפים שהמכשיר יושבת באופן אוטומטי לאחר שחלפו 60 דקות.
- הראה למשתתפים כיצד לחבר את חוט האטב לאוזן בצד. הקצה הנגדי של הכבל מהקליפסים מתחבר לחור קטן בצד שמאל של המכשיר המסומן ב- "1".
- הדגימו כיצד להסיר את רפידות האלקטרודות הישנות מהאטבים לאוזניים ולחבר חדשים. כדי להסיר רפידות ישנות, משכו את הדבק מהמקום שבו הוא מתחבר לקליפסים. כדי לחבר רפידות חדשות, יישרו את החור ברפידות האלקטרודות הרזרביות עם האזור המוגבה במרכז התפס ולחצו בחוזקה כלפי מטה.
הערה: אין למשוך את רפידות האלקטרודות בחלק הרך שלמעלה. הוא נוטה להיקרע וישאיר את הדבק דבוק לקליפסים. - הדגימו כיצד להצמיד את אטבי האוזניים לתנוכי האוזניים שלהם ובקשו מהם לנסות זאת פעם אחת. סחטו את הקצוות הירוקים של האטב כדי לפתוח אותו, מקמו את תנוך האוזן ביניהם וסגרו בעדינות את האטב כדי לחבר.
- הראה להם כיצד להסיר את ראש הפלסטיק מהמוליך הקטן של התמיסה ולמלא אותו בתמיסה מהבקבוק הגדול יותר (ראה שלבים 2.3.3.6-2.3.3.8). הזכירו להם שהפתרון הכרחי כדי שהמכשיר יפעל כראוי.
- כדי להסיר את החלק העליון של מוליך התמיסה הקטן, הסר את המכסה ולחץ בחוזקה על צד הקצה. קצה הפלסטיק יתנתק משאר הבקבוק.
- חברו את הפקק החלופי למילוי המוליך הקטן לחלק העליון של בקבוק התמיסה הגדול יותר. דוחפים את הזרבובית הקטנה, מחליקים אותה לתוך המוליך הקטן וסוחטים את הבקבוק הגדול למילוי.
- אמרו למשתתפים שעליהם להוסיף רק כ-1-2 טיפות של התמיסה לכל כרית אלקטרודה מהקליפ. יש להסיר כל תמיסה עודפת לפני השימוש.
- הנחו את המשתתפים להשתמש במכשיר בכל ימות השבוע במשך 60 דקות בערב, כשעה לפני השינה. הנחו את המשתתפים להשתמש במכשיר בזמן מנוחה (כלומר, לשבת בשקט או לשכב, לא לזוז).
הערה: הן בזמן והן במיקום, המשתתפים הורשו וריאציות נורמליות בסביבת השימוש הביתית שלהם כדי להגדיל את האופי המעשי של טיפול זה לשימוש ביתי. לא הוגדרו פרמטרים עבור צליל מותר בסביבה או אחסון המכשיר הנדרש. - תן למשתתפים יומן מכשירים ריק והסביר שעליהם להזין כל תאריך של שימוש במכשיר, את ציון הכאב שלהם לפני ואחרי השימוש במכשיר ואת זמן השימוש במכשיר.
- אם המשתתפים אינם מסוגלים להשתמש במכשיר שלהם במשך פרק זמן מסוים במהלך 6 השבועות שבין הפגישות אך מסוגלים לקבוע את פגישות המעקב, תן להם להישאר במחקר. אם הם אינם מסוגלים להשתמש במכשיר או להגיע לביקורי המחקר, סיים את השתתפותם. עיין ביומן ההתקנים המשלים של CES (קובץ משלים 2) לקבלת יומן ההתקן שבו השתמש מחקר זה.
הערה: השלבים הבאים יחזרו על עצמם במהלך כל שלושת הביקורים.
- לאחר הסבר המכשיר, בקשו מהמשתתף להשלים שלושה מבחני תפקוד גופני קצרים23. עבור כל מבחן יירשם מספר מקסימלי עבור הציון (סה"כ חזרות עבור שני הראשונים וחוזק לכל מבחן עבור השלישי).
הערה: שעון העצר ששימש למחקר זה היה Apple iPhone 12.- נהל את מבחן 30 הכיסא לשבת בעמידה. בצע את השלבים 2.3.4.2-2.3.4.6.
- הניחו כיסא עם גבו לקיר חדר הבדיקה. בקש מהמשתתף לשבת על הכיסא עם גבו לאחור הכיסא.
- הנחו את המתאמן לקום למצב עמידה מלא ואז לשבת כל הדרך חזרה למטה עם הגב לכיסא לאחור כמה שיותר פעמים ב-30 שניות.
הערה: אם הם מקישים על הכיסא אך לא מחזירים עליו את כובד משקלם במלואו בתנוחת ישיבה, החזרה אינה נחשבת. - אמור למשתתפים מתי להתחיל. הפעל את הטיימר כשהם מתחילים לנוע.
- בקש מהמשתתפים לעשות תלתלי זרועות עם משקולת בכל צד במשך 30 שניות לכל צד. התחל תחילה עם זרוע ימין ולאחר מכן עבור שמאלה.
- רשום את המספר הכולל של תלתלים בכל צד. השתמש במשקל של 5 ליברות לנשים ובמשקל של 8 ליברות לגברים. ודא שהמשתתפים יושבים למבחן תלתלי הזרוע.
- בקש מהמשתתפים לבצע שלושה מבחני חוזק אחיזה כאשר כל זרוע מונחת על דינמומטר. בצע את שלבים 2.3.4.8-2.3.4.11. התחל תחילה עם זרוע ימין ולאחר מכן עבור שמאלה.
- הניחו את הדינמומטר בידו של המשתתף. הם צריכים לסחוט את האחיזה בתחתית ולא לגעת בחוגה בחלק העליון.
- אמרו למשתתפים לסחוט את הדינמומטר חזק ככל שהם יכולים ואז לשחרר. המחט בחוגה תעצור ברמה הגבוהה ביותר של חוזק אחיזה שהם הציגו.
- רשום את תוצאות חוזק האחיזה שלהם על ידי כתיבת המספר שהמחט מגיעה אליו בחוגה. אפסו את החוגה בין החזרות על ידי סיבוב הידית הקטנה בחלק הקדמי של פני החוגה נגד כיוון השעון עד שהמחט נחה על אפס.
- ודא שהמשתתפים יושבים למבחן אחיזת היד.
הערה: בין כל סדרה, המשתתפים מקבלים כ 15-20 שניות של מנוחה כאשר הם מעבירים ציוד ליד השנייה שלהם. בין כל מבחן, המשתתפים יקבלו כ-2 דקות מנוחה בזמן הכנת הציוד והניירת למבחן.
- לאחר מבחני התפקוד הפיזי, בקשו מהמשתתפים למלא את חבילת השאלונים בעזרת עט. בדוק את החבילה לאחר מכן כדי לוודא שהם ענו על כל השאלות.
- לאחר השלמת כל הסקירות, הבדיקות והשאלונים, יש להוביל את המשתתפים לסורק ה-MRI עצמו (לכל המידע על פרוטוקול MRI, ראה סעיף 3). בדוק את טופס הבדיקה עם טכנאי MRI וודא שהמשתתפים הסירו את כל המתכת מגופם.
- ודא שלחברי צוות המחקר אין מתכת על גופם.
- עזור לטכנאי MRI להכניס את המשתתפים לסורק בנוחות. נהל את פרוטוקול סריקת MRI.
- הדריכו את המשתתפים לגבי נהלי הבטיחות (לחצן שיחה ורמקולים).
- הזכירו למשתתפים לא לזוז כלל במהלך הסריקה.
- הזכירו למשתתפים את משך הזמן הכולל של הסריקה, שאמור להיות 60 דקות.
- לאחר השלמת הסריקה, עזור למשתתפים לצאת מהסורק.
- לאחר הסריקה, סיימו את הביקור הבסיסי של המשתתפים ותזמנו את ביקורם באמצע למשך 6 שבועות מאוחר יותר. למשתתפים יהיו שלושה ביקורי מחקר בסך הכל, כל אחד בהפרש של 6 שבועות. דחפו נתוני MRI לשרתים המאובטחים של המחקר לצורך ניתוח.
- ביום המתוכנן, נהל את הביקור באמצע לאחר שלבי הביקור הבסיסי. התקשר למשתתף מראש כדי לאשר.
- נהל את DVPRS. בקש מהמשתתפים להחזיר את יומן המכשירים הראשון שהושלם ולספק להם יומן התקנים שני.
- בצע את שלבים 2.3.4-2.3.6 (כמו בביקור הבסיסי).
- סיימו את הביקור באמצע הביקור של המשתתפים ותזמנו את הביקור שלאחר הביקור למשך 6 שבועות לאחר מכן. דחפו נתוני MRI לשרתים המאובטחים של המחקר לצורך ניתוח.
- ביום המתוכנן, נהלו את הביקור שלאחר הביקור בעקבות השלבים של אמצע הביקור. התקשר למשתתף מראש כדי לאשר.
- נהל את DVPRS. בקש מהמשתתפים להחזיר את יומן המכשירים השני שהושלם.
- בצע את שלבים 2.3.4-2.3.6 (כמו בביקור הבסיסי ובאמצע הביקור). אין צורך בתזמון ביקורים נוסף לביקור האחרון.
- אם יש צורך במידע כלשהו כדי לפצות את המשתתפים, הכינו ובקשו מידע זה על ביקור זה.
הערה: מחקר זה דרש את שמם וכתובתם כדי להנפיק המחאות מאטלנטה VA לפיצוי. - סיימו את הביקור של המשתתפים. דחפו נתוני MRI לשרתים המאובטחים של המחקר לצורך ניתוח.
הערה: במהלך המחקר, הקפד להתקשר ולבדוק עם המשתתפים בין הביקורים כדי לוודא שהם משתמשים במכשיר, משלימים את יומני המכשיר ומודעים מתי יהיה הביקור הבא שלהם.
3. הגדרת פרוטוקולי סריקת MRI
- עבור פרוטוקול סריקת MRI, רכוש את BOLD rs-fMRI בסורק MRI 3T עם סליל ראש מערך פאזות של 32 ערוצים באמצעות רצף הדמיה אקופלנרית הדרגתית (EPI). השתמש בפרמטרים הבאים של MR: FOV (שדה ראייה) = 220 מ"מ2; TR (זמן חזרה)/TE (זמן הד) = 1500/25 אלפיות השנייה, גורם תאוצה רב-פס = 3; זווית היפוך = 50°; גודל מטריצה 110 x 110; עובי פרוסה = 2 מ"מ; גורם GRAPPA = 2; פורייה חלקית של 6/8; 34 קווי ייחוס בקידוד פאזה, 72 פרוסות ציריות משולבות המכסות את כל המוח, כ-350 נפחי סריקה כדי להפיק 8 דקות של נתוני fMRI במצב מנוחה להערכה יציבה של רשתות קישוריות.
- בפרוטוקול למגנטיזציה אנטומית T1w הכין הד שיפוע מהיר (MPRAGE), הגדר TR = 2530 אלפיות השנייה, TE = 3 אלפיות השנייה, זווית היפוך = 7°, עובי פרוסה = 0.8 מ"מ, רזולוציית פאזה של 1 מ"מ. רכישת T1w נמשכת כ-6 דקות.
- רכוש סריקות דימות משוקללות דיפוזיה (DWI) בסורק MRI 3T עם סליל ראש מערך פאזות של 32 ערוצים באמצעות סכימת דימות ספקטרום דיפוזיה. אסוף סך של 129 כיווני דגימת דיפוזיה עם ערך B מרבי של 3000 s/mm2, רזולוציה במישור של 2x2 מ"מ2 ועובי פרוסה של 2 מ"מ.
- קבל נתונים פיזיולוגיים (נתונים לב-ריאה באמצעות חגורת מוניטור נשימתי ואוקסימטריית דופק) בו זמנית (נעול בזמן) לנתוני fMRI.
- העבר באופן מאובטח את נתוני ה- MRI ממיקום הסורק לאתר מאובטח לצורך עיבוד מקדים וניתוח. המר DICOM ל- NIFTI כדי לעמוד בעיצוב BIDS באמצעות dc2bids v2.1.6.
- שפשף את הנתונים של מזהים בודדים. השתמש במספר נושא המחקר בכל הנתונים במידת הצורך. בצע בדיקת איכות כדי לוודא שלא התרחשו ממצאים חריגים, כגון תנועה מוגזמת, בנתונים באמצעות MRIQC v21.0.0.
4. עיבוד מקדים וניתוחים
- לאחר קבלת נתוני ה-MRI מהמחקר, השתמשו בשני צינורות נפרדים כדי לנתח אותם: אחד כדי לנתח את הקישוריות התפקודית בין המשתתפים והשני כדי לנתח טרקטוגרפיה של החומר הלבן.
- נתוני T1w ו-rsfMRI מבניים של נבדקים לפני התהליך באמצעות fMRIPrep v20.2.5, כולל חילוץ מוח, פילוח רקמות ונורמליזציה של תמונות משוקללות T1 (T1w), כמו גם הערכת נפח ייחוס, הערכת תנועת ראש, תיקון תזמון פרוסה ורישום ל-T1w עבור התמונות הפונקציונליות. תהליך זה גורם לכך שנתוני T1w ו- rsfMRI מנורמלים למרחב MNI152NLin2009cAsym.
- השתמש בנתוני MRI מעובדים מראש בניתוח קישוריות תפקודית (CONN).
- ראה מסמך fMRIPrep Boilerplate המשלים (קובץ משלים 337-56). לפרטים נוספים, עיין בקישור: https://fmriprep.org/en/stable/
- ייבא את ערכת הנתונים המעובדת מראש לתוך CONN Toolbox v22a לעיבוד נוסף.
הערה: ארגז הכלים של CONN עודכן מ-v21a ל-v22a במהלך מחקר זה.- בשלב ההתקנה, קבע משתנים משותפים ברמההשנייה כדי להגדיר את קבוצות המחקר (TRUE לעומת SHAM) לניתוח מאוחר יותר ולהבטיח את האיכות של תמונות T1w ו- rsfMRI. נתוני fMRI חלקים באמצעות ליבת גאוס 8 מ"מ.
- לאחר עיבוד מקדים, הסר את רעש הנתונים כדי להסיר רעש חיצוני ופיזיולוגי.
הערה: מחקר זה חישב את הניתוח ברמה הראשונה אך לא העריך או השתמש בו מכיוון שהחוקרים אינם מעוניינים בתוצאות בנושא יחיד. - בחר זרעים / ROI ומשתני נושא והגדר ניגודים. הפעל ניתוח זרעים לווקסל ברמת הקבוצה.
- לאחר השלמת שלבי ההגדרה, העיבוד המקדים והזיהוי עבור הצינורות, הגדר את ספי האשכול והווקסל כדי להציג דפוסי קישוריות.
- ראה איור משלים 1 ומסמך הוראות CES CONN המשלים (קובץ משלים 4).
- השתמש בטרקטוגרפיה קורלציונית57 כדי לקבוע שינויים אורכיים בשלמות החומר הלבן בקורלציה עם קבוצת הניסוי כדי לזהות צרורות דרכי ואזורים הקשורים לטיפול CES. להלן שלבי הניתוח העיקריים:
- המירו את תמונות ה-DWI הגולמיות מתבנית .dcm (DICOM) לתבנית .nii.gz (NIfTI).
- עבד מראש את התמונות כדי לתקן עיוותים הנגרמים על ידי רגישות באמצעות TOPUP58,59 של FSL (גרסה 6.0.6) ועבור עיוותי זרם מערבולת באמצעות הכלי EDDY60 של FSL.
- צור מדדי בקרת איכות תמונה (QC) של DWI הקשורים לתנועה ברמת הנושא היחיד וברמת המחקר באמצעות כלי EDDY QC של FSL.
- הפעל מדידה חוזרת דו-כיוונית ANOVA על מדדי QC אלה כדי לזהות כל שונות בין קבוצות שעלולה לבלבל תוצאות טרקטוגרפיה קבוצתית. אם מטריקה מראה שונות בין קבוצות שהיא משמעותית (p > 0.05), אז יש לקחת אותה בחשבון כמשתן משותף בניתוח הטרקטוגרפיה המתאמת.
- ייבא את הנתונים המעובדים מראש ל- DSI Studio (גירסה "חן", 21 בנובמבר 2022), שם הם מומרים לקבצי .src (מקור). לקבלת מידע נוסף אודות DSI Studio, עיין באתר האינטרנט של התוכנה (https://dsi-studio.labsolver.org).
- בנה מחדש את נתוני הדיפוזיה המיובאים באמצעות Q-Space Diffeomorphic Reconstruction (QSDR)61 כדי לקבוע את כיווני סיבי החומר הלבן במרחב תבנית MNI. קובץ .fib (כיוון סיבים) מופק לכל תמונה. אפשרויות הבחירה לשחזור הן:
שיטה (בחירת שיטת שחזור) - QSDR
Param0 (אורך דגימת דיפוזיה) - 1.25 (זוהי ברירת המחדל)
תבנית (לאיזה מרחב תבנית לבנות מחדש נתונים) - ICBM152
align_acpc (אם לסובב את עוצמת הקול של התמונה כדי ליישר AC-PC) - 0 (false) - צור מסד נתונים של קונקטומטריה מקבצי .fib אלה, אשר מחלץ את ערכי האנאיזוטרופיה הכמותית (QA) מנתוני הדיפוזיה המשוחזרים. חישוב השינוי האורכי ב- QA עבור כל נושא במסד הנתונים. הוסף נתונים דמוגרפיים כגון קבוצת ניסוי, גיל, מין, יחד עם משתנים משותפים שזוהו בשלב QC באמצעות קובץ .csv למסד הנתונים.
- לאחר מכן, טען את מסד הנתונים של הקונקטומטריה לתוך ממשק המשתמש הגרפי של ניתוח קונקטומטריה קבוצתית.
- בחר משתנים משותפים שיש לקחת בחשבון בניתוח. אחד ממשתני המשנה שנבחרו מוגדר כמשתנה המחקר.
- עבור ניתוח זה, בחר קבוצה כמשתנה המחקר. אסופות עם שינויים אורכיים ב- QA בקורלציה עם קבוצה יזוהו בעוד ההשפעה של משתנים משותפים אחרים שנבחרו תיסוג החוצה.
- אפשרויות הבחירה עבור ניתוח הקונטומטריה הקבוצתית הן:
- בקרת FDR (חיתוך קצב גילוי כוזב, רק קטעים עם מתאם משמעותי מתחת ל- FDR יוצאו) - 0.05
- סף אורך (ערך בווקסלים של אורך מערכת מינימלי המשמש כהשערת אפס) - 20 ווקסלים (או 40 מ"מ עבור גדלי ווקסל 2 מ"מ)
- סף T (סף מדידה t-stat לאפקט מתאם) - 2.5
- אזור מחקר (חלונית זו מאפשרת לכלול / לא לכלול אזורים בניתוח) - בחר מוח שלם עם - לא לכלול את המוח הקטן מסומן
הערה: במחקר זה, המוח הקטן לא נכלל בשל חלק מסריקות הדיפוזיה שחלקים מהמוח הקטן נחתכו במהלך הרכישה.
- לחץ על לחצן הפעל קונקטומטריה כדי לבצע את הניתוח, אשר מפיק מספר קבצים:
- קובץ .fib המאחסן את t-stats וניתן לפתוח אותו בסטודיו DSI כדי להמחיש את t-stats של אסופות עם QA גדל (מאוחסן כ- "inc_t") או QA יורד (מאוחסן כ- "dec_t"), אשר מתקשרים עם Group.
- .fdr_dist.values.txt, המפרט את ערכי FDR ביחס לאורך המסלול
- .inc.tt.gz שהוא קובץ טרקטוגרפיה המאחסן את האסופות עם QA אורכי מוגבר בקורלציה עם משתנה המחקר. (קבוצה במקרה שלנו). קובץ .dec.tt.gz מאחסן את האסופות עם QA אורכי מופחת בקורלציה עם משתנה המחקר.
- קובץ .report.html המדווח בנוחות על תוצאות הקונקטומטריה יחד עם תרשימי טרקטוגרפיה מוטבעים, תמונות, כמו גם את המידע על שלבי ניתוח הטרקטוגרפיה המתאמת לפרסום.
הערה: כדי לראות דוגמאות לקוד R המשמש למחקר זה, עיין בחלקות המשלימות של קוד CES R (קובץ משלים 5) ובקבצי ה- R Code המשלימים CES eddy-qc Anova (קובץ משלים 6).
תוצאות
מבחינת תוצאות הגיוס, המשתתפים גויסו בעיקר באמצעות דיוור של מכתבי גיוס ושיחות טלפון עוקבות המבוססות על התקנות המתוארות של מערכת הבריאות של אטלנטה VA. צוות המחקר גייס בסך הכל 50 משתתפים, מה שהוכיח את יעילות השיטות בהן נעשה שימוש כדי לעמוד ביעד הגיוס (ראו איור 2
Discussion
שיטות המחקר הנוכחי מספקות לא רק את האפשרות של שיטת טיפול יעילה ביותר עבור פיברומיאלגיה, אלא גם את ההזדמנות לשפר את תהליך האבחון של פיברומיאלגיה מהמופע הראשון של פרופיל תסמיני הכאב שלה. השימוש הן ב-CES פעיל והן ב-FES מזויף, כאשר גילוי הסוג של כל מכשיר בודד תלוי במספרים סידוריים ובמפתח נפרד, איפ?...
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים ידועים או קשרים אישיים שיכלו להשפיע לכאורה על העבודה המדווחת במאמר זה. הדעות המובעות במאמר זה הן של המחברים ואינן משקפות בהכרח את עמדתה או מדיניותה של המחלקה לענייני חיילים משוחררים או ממשלת ארצות הברית.
Acknowledgements
המחברים רוצים להודות על תמיכתם של חוקרים במרכז לשיקום חזותי ונוירו-קוגניטיבי, כולל ד"ר ברוס קרוסון וד"ר ליסה קרישנמורתי, על תרומתם לעבודה. המחברים גם מודים לגרייס אינגהם על עזרתה שלא תסולא בפז בתהליך הצילומים. עבודה זו נתמכה בחלקה על ידי פרס פיתוח הקריירה של שירות פיתוח הקריירה של המחלקה לענייני חיילים משוחררים של ארצות הברית IK2 RX003227 (אנה וודברי) ו- Center Grant 5I50RX002358. למממן אין תפקיד בעיצוב המחקר, איסוף הנתונים, ניהולו, ניתוחו, פרשנותו או דיווחו.
Materials
| Name | Company | Catalog Number | Comments |
| 3T Siemens MAGNETOM Prisma Scanner | Siemens Healthineers | N/A | From Emory's website: "The Siemens Magnetom Prisma 3T whole-body MR system is equipped with: a state-of-the art gradient system with a maximum (per axis) strength of 80 mT/m and slew rate of 200 T/m/sec 64 independent RF receiver channels capable of 204 receiver connections a 2-channel RF transmitter. Multiple coils are available, including: a 64-channel head/neck coil with 52 channels for imaging of the head region a 32-channel head-only coil a 20-channel head/neck coil with 16 channels for head spine array coil flexible chest coil large and small flexible coil for extremity imaging. |
| Alpha-Stim AID Kit | Electromedical Products International Inc. | SKU: 500KIT | A total of 50 devices ordered for research purposes. From the site: "A prescription or order from a licensed healthcare professional is required to purchase this device (within the USA). FDA cleared for anxiety, insomnia and pain only, with approval for depression outside of the United States." |
| CONN Toolbox v21a16 (RRID:SCR_009550) | Whitfield-Gabrieli and Nieto-Castanon | Version v21a16 (RRID:SCR_009550) | CONN is an open-source SPM-based cross-platform software for the computation, display, and analysis of functional connectivity Magnetic Resonance Imaging (fcMRI). CONN is used to analyze resting state data (rsfMRI) as well as task-related designs. |
| DSI Studio (RRID:SCR_009557) | Fang-Cheng (Frank) Yeh | RRID:SCR_009557 | DSI Studio is a tractography software tool that maps brain connections and correlates findings with neuropsychological disorders. It is a collective implementation of several diffusion MRI methods, including diffusion tensor imaging (DTI), generalized q-sampling imaging (GQI), q-space diffeomorphic reconstruction (QSDR), diffusion MRI connectometry, and generalized deterministic fiber tracking. |
| fMRIPrep 20.2.5 (RRID:SCR_016216) | NiPreps (NeuroImaging PREProcessing tools) | Version 20.2.5. (RRID:SCR_016216) | A functional magnetic resonance imaging (fMRI) data preprocessing pipeline that is designed to provide an easily accessible, state-of-the-art interface that is robust to variations in scan acquisition protocols and that requires minimal user input, while providing easily interpretable and comprehensive error and output reporting. It performs basic processing steps (coregistration, normalization, unwarping, noise component extraction, segmentation, skull-stripping, etc.) providing outputs that can be easily submitted to a variety of group level analyses, including task-based or resting-state fMRI, graph theory measures, and surface or volume-based statistics. |
| MRIQC | NiPreps (NeuroImaging PREProcessing tools) | MRIQC extracts no-reference IQMs (image quality metrics) from structural (T1w and T2w) and functional MRI (magnetic resonance imaging) data. (not directly used for analyses) | |
| Sammons Preston Jamar Hydraulic Hand Dynamometer | Alpha Med Inc. | SKU SAMP5030J1 | From the website: Ideal for routine screening of grip strength and initial and ongoing evaluation of clients with hand trauma and dysfunction. Unit comes with carrying/storage case, certificate of calibration and complete instructions. Warranted for one full year. The warranty does not cover calibration. Latex free. |
| SPRI 5-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (E) Dark Blue | 5-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
| SPRI 8-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (H) Black |8-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
References
- Heidari, F., Afshari, M., Moosazadeh, M. Prevalence of fibromyalgia in general population and patients, a systematic review and meta-analysis. Rheumatology International. 37 (9), 1527-1539 (2017).
- Dennis, N. L., Larkin, M., Derbyshire, S. W. G. 'A giant mess' - making sense of complexity in the accounts of people with fibromyalgia. British Journal of Health Psychology. 18 (4), 763-781 (2013).
- Woodbury, A. Opioids for nonmalignant chronic pain. AMA Journal of Ethics. 17 (3), 202-208 (2015).
- Hedegaard, H., Minino, A. M., Spencer, M. R., Warner, M. Drug overdose deaths in the United States, 1999-2020. NCHS Data Brief. 428, 1-8 (2021).
- . Report No.: 17-01846-316. Opioid prescribing to high-risk veterans receiving VA purchased care. Office of Healthcare Inspections. , (2017).
- Perry, R., Leach, V., Davies, P., Penfold, C., Ness, A., Churchill, R. An overview of systematic reviews of complementary and alternative therapies for fibromyalgia using both AMSTAR and ROBIS as quality assessment tools. Systematic Reviews. 6 (1), 97 (2017).
- Martinez-Lavin, M., Hermosillo, A. G. Dysautonomia in Gulf War syndrome and in fibromyalgia. The American Journal of Medicine. 118 (4), 446 (2005).
- Petersel, D. L., Dror, V., Cheung, R. Central amplification and fibromyalgia: disorder of pain processing. Journal of Neuroscience Research. 89 (1), 29-34 (2011).
- Marlow, N. M., Bonilha, H. S., Short, E. B. Efficacy of transcranial direct current stimulation and repetitive transcranial magnetic stimulation for treating fibromyalgia syndrome: A systematic review. Pain Practice. 13 (2), 131-145 (2013).
- Molero-Chamizo, A., et al. Noninvasive transcutaneous vagus nerve stimulation for the treatment of fibromyalgia symptoms: A study protocol. Brain sciences. 12 (1), 95 (2022).
- Cimpianu, C. L., et al. Vagus nerve stimulation in psychiatry: A systematic review of the available evidence. Journal of Neural Transmission. 124 (1), 145-158 (2017).
- Napadow, V., et al. Evoked pain analgesia in chronic pelvic pain patients using respiratory-gated auricular vagal afferent nerve stimulation. Pain Medicine (Malden, Mass). 13 (6), 777-789 (2012).
- Zhang, Y., et al. Transcutaneous auricular vagus nerve stimulation (taVNS) for migraine: an fMRI study. Regional Anesthesia and Pain. 46 (2), 145-150 (2021).
- Tassorelli, C., et al. Noninvasive vagus nerve stimulation as acute therapy for migraine: The randomized PRESTO study. Neurology. 91 (4), e364-e373 (2018).
- . NBC4 Washington - Electrotherapy Device Treats Anxiety, Insomnia, Depression. Alpha-Stim. , (2021).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Bourguignon, C. A randomized, controlled, double-blind pilot study of the effects of cranial electrical stimulation on activity in brain pain processing regions in individuals with fibromyalgia. Explore (NY). 9 (1), 32-40 (2013).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Kinser, P. A., Bourguignon, C. Cranial electrical stimulation improves symptoms and functional status in individuals with fibromyalgia. Pain Management Nursing. 14 (4), 327-335 (2013).
- Lichtbroun, A. S., Raicer, M. M., Smith, R. B. The treatment of fibromyalgia with cranial electrotherapy stimulation. Journal of Clinical Rheumatology. 7 (2), 72-78 (2001).
- Shekelle, P. G., Cook, I. A., Miake-Lye, I. M., Booth, M. S., Beroes, J. M., Mak, S. Benefits and harms of cranial electrical stimulation for chronic painful conditions, depression, anxiety, and insomnia: A systematic review. Annals of Internal Medicine. 168 (6), 414-421 (2018).
- Dailey, D. L., et al. Perceived function and physical performance are associated with pain and fatigue in women with fibromyalgia. Arthritis Research & Therapy. 18, 68 (2016).
- Gowans, S. E., deHueck, A., Voss, S., Silaj, A., Abbey, S. E., Reynolds, W. J. Effect of a randomized, controlled trial of exercise on mood and physical function in individuals with fibromyalgia. Arthritis & Rheumatism. 45 (6), 519-529 (2001).
- Jones, J., Rutledge, D. N., Jones, K. D., Matallana, L., Rooks, D. S. Self-Assessed physical function levels of women with fibromyalgia: A national survey. Women's Health Issues. 18 (5), 406-412 (2008).
- Rikli, R. E., Jones, C. J. Development and validation of criterion-referenced clinically relevant fitness standards for maintaining physical independence in later years. The Gerontologist. 53 (2), 255-267 (2013).
- Feusner, J. D., et al. Effects of cranial electrotherapy stimulation on resting state brain activity. Brain and Behavior. 2 (3), 211-220 (2012).
- Harris, R. E., et al. Pregabalin rectifies aberrant brain chemistry, connectivity, and functional response in chronic pain patients. Anesthesiology. 119 (6), 1453-1464 (2013).
- Napadow, V., Harris, R. E. What has functional connectivity and chemical neuroimaging in fibromyalgia taught us about the mechanisms and management of 'centralized' pain. Arthritis Research & Therapy. 16 (5), 425 (2014).
- Schroeder, M. J., Barr, R. E. Quantitative analysis of the electroencephalogram during cranial electrotherapy stimulation. Clinical Neurophysiology. 112 (11), 2075-2083 (2001).
- Cordes, D., et al. Mapping functionally related regions of brain with functional connectivity MR imaging. American Journal of Neuroradiology. 21 (9), 1636-1644 (2000).
- Hassett, A. L., Aquino, J. K., Ilgen, M. A. The risk of suicide mortality in chronic pain patients. Current Pain and Headache Reports. 18 (8), 436 (2014).
- Stenager, E., Christiansen, E., Handberg, G., Jensen, B. Suicide attempts in chronic pain patients. A register-based study. Scandinavian Journal of Pain. 5 (1), 4-7 (2014).
- Woodbury, A., et al. Feasibility of auricular field stimulation in fibromyalgia: Evaluation by functional magnetic resonance imaging, randomized trial. Pain Medicine. 22 (3), 715-726 (2021).
- Wolfe, F., et al. Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Seminars in Arthritis and Rheumatism. 46 (3), 319-329 (2016).
- Polomano, R. C., et al. Psychometric testing of the defense and veterans pain rating scale (DVPRS): A new pain scale for military population. Pain Medicine. 17 (8), 1505-1519 (2016).
- Electromedical Products International, Inc. . Scientific and clinical literature examination for the Alpha-Stim M microcurrent and cranial electrotherapy stimulator. , (2016).
- Lein, D. H., Alotaibi, M., Almutairi, M., Singh, H. Normative reference values and validity for the 30-second chair-stand test in healthy young adults. International Journal of Sports Physical Therapy. 17 (5), 907-914 (2022).
- Revicki, D. A., Cook, K. F., Amtmann, D., Harnam, N., Chen, W. H., Keefe, F. J. Exploratory and confirmatory factor analysis of the PROMIS pain quality item bank. Quality of Life Research. 23 (1), 245-255 (2014).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310-1320 (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Zhang, Y., Brady, M., Smith, S. Segmentation of brain MR images through a hidden Markov random field model and the expectation-maximization algorithm. IEEE Transactions on Medical Imaging. 20 (1), 45-57 (2001).
- Dale, A. M., Fischl, B., Sereno, M. I. Cortical surface-based analysis: I. Segmentation and surface reconstruction. NeuroImage. 9 (2), 179-194 (1999).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350 (2017).
- Fonov, V. S., Evans, A. C., McKinstry, R. C., Almli, C. R., Collins, D. L. Unbiased nonlinear average age-appropriate brain templates from birth to adulthood. NeuroImage. 47 (Supplement 1), S102 (2009).
- Evans, A. C., Janke, A. L., Collins, D. L., Baillet, S. Brain templates and atlases. NeuroImage. 62 (2), 911-922 (2012).
- Greve, D. N., Fischl, B. Accurate and robust brain image alignment using boundary-based registration. NeuroImage. 48 (1), 63-72 (2009).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Cox, R. W., Hyde, J. S. Software tools for analysis and visualization of fMRI data. NMR in Biomedicine. 10 (4-5), 171-178 (1997).
- Pruim, R. H. R., Mennes, M., van Rooij, D., Llera, A., Buitelaar, J. K., Beckmann, C. F. ICA-AROMA: A robust ICA-based strategy for removing motion artifacts from fMRI data. NeuroImage. 112, 267-277 (2015).
- Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., Petersen, S. E. Methods to detect, characterize, and remove motion artifact in resting state fMRI. NeuroImage. 84, 320-341 (2014).
- Behzadi, Y., Restom, K., Liau, J., Liu, T. T. A component based noise correction method (CompCor) for BOLD and perfusion based fMRI. NeuroImage. 37 (1), 90-101 (2007).
- Satterthwaite, T. D., et al. An improved framework for confound regression and filtering for control of motion artifact in the preprocessing of resting-state functional connectivity data. NeuroImage. 64, 240-256 (2013).
- Lanczos, C. Evaluation of noisy data. Journal of the Society for Industrial and Applied Mathematics Series B Numerical Analysis. 1 (1), 76 (1964).
- Oscar, E., et al. fMRIPrep: A robust preprocessing pipeline for functional MRI. Nature Methods. 16, 111-116 (2019).
- Oscar, E., et al. FMRIPrep. Software. Zenodo. , (2018).
- Gorgolewski, K. J., et al. Nipype: a flexible, lightweight and extensible neuroimaging data processing framework in python. Frontiers in Neuroinformatics. 5, 13 (2011).
- Gorgolewski, K. J., et al. Nipype. Software. Zenodo. , (2018).
- Abraham, A., et al. Machine learning for neuroimaging with scikit-learn. Frontiers in Neuroinformatics. 8, 14 (2014).
- Yeh, F. -. C., Badre, D., Verstynen, T. Connectometry: A statistical approach harnessing the analytical potential of the local connectome. NeuroImage. 125 (2016), 162-171 (2015).
- Andersson, J. L. R., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. NeuroImage. 20 (2), 870-888 (2003).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. 23 (S1), 208-219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. NeuroImage. 125, 1063-1078 (2016).
- Yeh, F. -. C., Tseng, W. -. Y. I. NTU-90: a high angular resolution brain atlas constructed by -q-space diffeomorphic reconstruction. Neuroimage. 58 (1), 91-99 (2011).
- Nieto-Castanon, A. Cluster-Level Inferences. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Hemington, K. S., Wu, Q., Kucyi, A., Inman, R. D., Davis, K. D. Abnormal cross-network functional connectivity in chronic pain and its association with clinical symptoms. Brain Structure & Function. 221 (8), 4203-4219 (2016).
- Ichesco, E., et al. Altered resting state connectivity of the insular cortex in individuals with fibromyalgia. Journal of Pain. 15 (8), 815-826 (2014).
- Kim, J., et al. The somatosensory link in fibromyalgia: functional connectivity of the primary somatosensory cortex is altered by sustained pain and is associated with clinical/autonomic dysfunction. Arthritis & Rheumatology. 67 (5), 1395-1405 (2015).
- Napadow, V., LaCount, L., Park, K., As-Sanie, S., Clauw, D. J., Harris, R. E. Intrinsic brain connectivity in fibromyalgia is associated with chronic pain intensity. Arthritis and Rheumatism. 62 (8), 2545-2555 (2010).
- Napadow, V., Kim, J., Clauw, D. J., Harris, R. E. Decreased intrinsic brain connectivity is associated with reduced clinical pain in fibromyalgia. Arthritis and Rheumatism. 64 (7), 2398-2403 (2012).
- Puiu, T., et al. Association of alterations in gray matter volume with reduced evoked-pain connectivity following short-term administration of pregabalin in patients with fibromyalgia. Arthritis & Rheumatology. 68 (6), 1511-1521 (2016).
- Fallon, N., Chiu, Y., Nurmikko, T., Stancak, A. Functional Connectivity with the default mode network is altered in fibromyalgia patients. PLoS One. 11 (7), e0159198 (2016).
- Wang, Y., Kang, J., Kemmer, P. B., Guo, Y. An efficient and reliable statistical method for estimating functional connectivity in large scale brain networks using partial correlation. Frontiers in Neuroscience. 10, 123 (2016).
- Mease, P. J., et al. Estimation of minimum clinically important difference for pain in fibromyalgia. Arthritis Care and Research (Hoboken). 63 (6), 821-826 (2011).
- Bingel, U., et al. Somatotopic organization of human somatosensory cortices for pain: a single trial fMRI study. NeuroImage. 23 (1), 224-232 (2004).
- Wager, T. D., et al. Pain in the ACC. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2474-E2475 (2016).
- Nieto-Castanon, A. . FMRI Denoising Pipeline. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Friston, K. J., Williams, S., Howard, R., Frackowiak, R. S., Turner, R. Movement-related effects in fMRI time-series. Magnetic Resonance in Medicine. 35 (3), 346-355 (1996).
- Hallquist, M. N., Hwang, K., Luna, B. The nuisance of nuisance regression: spectral misspecification in a common approach to resting-state fMRI preprocessing reintroduces noise and obscures functional connectivity. NeuroImage. 82, 208-225 (2013).
- Chai, X. J., Nieto-Castanon, A., Ongur, D., Whitfield-Gabrieli, S. Anticorrelations in resting state networks without global signal regression. NeuroImage. 59 (2), 1420-1428 (2012).
- Nieto-Castanon, A. General Linear Model. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Worsley, K. J., Marrett, S., Neelin, P., Vandal, A. C., Friston, K. J., Evans, A. C. A unified statistical approach for determining significant signals in images of cerebral activation. Human Brain Mapping. 4 (1), 58-73 (1996).
- Chumbley, J., Worsley, K., Flandin, G., Friston, K. Topological FDR for neuroimaging. NeuroImage. 49 (4), 3057-3064 (2010).
- Page, S. J., Persch, A. C. Recruitment, retention, and blinding in clinical trials. The American Journal of Occupational Therapy. 67 (2), 154-161 (2013).
- McGrath, R. E., Mitchell, M., Kim, B. H., Hough, L. Evidence for response bias as a source of error variance in applied assessment. Psychological Bulletin. 136 (3), 450-470 (2010).
- Robinson-Papp, J., George, M. C., Dorfman, D., Simpson, D. M. Barriers to chronic pain measurement: A qualitative study of patient perspectives. Pain Medicine. 16 (7), 1256-1264 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved