Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un essai randomisé, contrôlé par placebo, de la stimulation électrique crânienne pour la douleur et la fonction physique de la fibromyalgie, à l’aide de biomarqueurs d’imagerie cérébrale
Dans cet article
Résumé
L’étude actuelle est un essai randomisé, contrôlé par placebo, visant à déterminer l’efficacité de la stimulation électrique crânienne (CES) pour améliorer la douleur et la fonction dans la fibromyalgie et à développer davantage l’imagerie par résonance magnétique de connectivité fonctionnelle au repos (rs-fcMRI) en tant qu’outil clinique pour évaluer les corrélats neuronaux et les mécanismes de la douleur chronique et de la réponse analgésique.
Résumé
La fibromyalgie est un syndrome de douleur chronique qui se manifeste par une constellation de symptômes généraux, notamment une diminution de la fonction physique, de la fatigue, des troubles cognitifs et d’autres troubles somatiques. Les thérapies disponibles sont souvent insuffisantes pour traiter les symptômes, un contrôle inadéquat de la douleur conduisant généralement à l’utilisation d’opioïdes pour tenter de la gérer. La stimulation électrique crânienne (CES) est une option de traitement non pharmacologique prometteuse pour les affections douloureuses qui utilise la stimulation par courant électrique pulsé pour modifier la fonction cérébrale via des électrodes transcutanées. Ces mécanismes neuronaux et les applications du CES dans le soulagement des symptômes de la fibromyalgie nécessitent une exploration plus approfondie.
Au total, 50 participants du système de santé des anciens combattants d’Atlanta (VAHCS) diagnostiqués avec la fibromyalgie ont été recrutés, puis randomisés en bloc dans un groupe placebo plus traitement standard ou CES actif plus traitement standard. Des évaluations de base ont été obtenues avant le début du traitement. Les deux interventions ont duré plus de 12 semaines, et les participants ont été évalués 6 semaines et 12 semaines après le début du traitement. Le critère de jugement principal était de déterminer si la douleur et les améliorations fonctionnelles se produisent avec l’application de CES. De plus, l’imagerie par résonance magnétique de la connectivité fonctionnelle au repos (rs-fcMRI) de base et de suivi a été obtenue à des points de temps de 6 et 12 semaines pour évaluer les applications cliniques des biomarqueurs de connectivité neuronale et les associations neuronales sous-jacentes liées aux effets du traitement.
Il s’agit d’un essai randomisé, contrôlé par placebo, visant à déterminer l’efficacité du CES pour améliorer la douleur et la fonction dans la fibromyalgie et à développer davantage l’IRMrs en tant qu’outil clinique pour évaluer les corrélats neuronaux et les mécanismes de la douleur chronique et de la réponse analgésique.
Introduction
Parmi les nombreux états existants de douleur chronique, l’une des maladies les plus difficiles à diagnostiquer, à évaluer cliniquement et à traiter est la fibromyalgie. La fibromyalgie est un syndrome de douleur chronique débilitant qui implique une douleur chronique généralisée, une diminution de la fonction physique, de la fatigue, des troubles psycho-émotionnels et du sommeil, et diverses plaintes somatiques affectant environ 2 à 3% de la population générale des Amériques (environ 8 millions de personnes aux États-Unis) 1. Le diagnostic de la maladie dépend fortement de la compréhension par le patient de son propre profil de symptômes et de son expérience de la douleur, et sans cette bonne compréhension de la maladie par le clinicien et le patient, les méthodes de traitement perdent considérablement leur efficacité2. Une meilleure définition des origines et de l’impact de la fibromyalgie, ainsi qu’un biomarqueur clinique fiable pour guider le diagnostic et le traitement de la fibromyalgie, sont nécessaires pour mieux servir tous les patients.
Même avec un diagnostic confirmé, les difficultés avec le processus de traitement ne font que croître. Dans l’ensemble, la douleur chronique touche plus de personnes que les maladies cardiaques, le diabète et le cancer réunis. La nature subjective de son évaluation la place comme l’un des principaux moteurs de l’épidémie d’opioïdes, en particulier compte tenu de la difficulté à discerner la douleur physique incomplètement traitée des troubles liés à l’utilisation de substances et du comportement de recherche de drogues3. En 2020, 91 799 décès par surdose de drogue sont survenus aux États-Unis (une augmentation de 30 % par rapport à 2019), et les opioïdes se sont avérés être la principale cause de ces décès (74,8 % de tous les décès par surdose de drogue en 2020)4. Ainsi, des alternatives non pharmacologiques sont nécessaires pour le traitement de la douleur chronique et de la fibromyalgie afin de ralentir l’épidémie d’opioïdes, ce qui est particulièrement important dans la population des anciens combattants où le risque de suicide et de trouble de consommation d’opioïdes est plus élevé5. Les thérapies non pharmacologiques et complémentaires sont donc souvent utilisées comme traitements de première intention6.
La recherche de nouvelles interventions efficaces contre la fibromyalgie a conduit de nombreux chercheurs et cliniciens à des méthodes de stimulation cérébrale non invasives, y compris la stimulation crânienne. Même si les mécanismes physiopathologiques qui entraînent le développement de la maladie n’ont pas été déterminés de manière définitive, les preuves existantes soutiennent l’idée que la fibromyalgie est un trouble du dysfonctionnement du système nerveux autonome et des mécanismes centraux (c’est-à-dire le cerveau et la moelle épinière) de traitement de la douleur 7,8. La stimulation de certaines zones du cerveau pourrait conduire à une amélioration de la fonction dans ces zones de traitement. La stimulation magnétique transcrânienne répétitive (SMTr) et la stimulation transcrânienne à courant continu (tDCS) ont été corrélées à une réduction de la douleur, mais ont également été associées à une irritation du cuir chevelu au site d’activation, à des maux de tête et à une inaccessibilité en dehors des installations de traitement9. La stimulation non invasive du nerf vague (nVNS), qui peut fournir une neuromodulation par stimulation de la peau au niveau du cou ou au niveau de l’oreille, a le potentiel de traiter la douleur chronique, et il a été démontré que la stimulation invasive du nerf vague (VNS) améliore les symptômes de la douleur chronique10. Cependant, ni les SNV invasives ou non invasives n’ont été suffisamment explorées dans la littérature ou entièrement validées pour une utilisation dans le traitement de la fibromyalgie 11,12,13,14.
L’électrostimulation crânienne (CES) est un traitement de stimulation cérébrale non pharmacologique et non invasif qui consiste en un microcourant alternatif pulsé (inférieur à 0,5 mA) appliqué via des électrodes transcutanées placées sur les lobes d’oreille15. Il est remarquablement accessible et peut être délivré par le biais d’appareils portables utilisés par les patients dans leur propre espace de vie. Par rapport à d’autres méthodes de stimulation crânienne, la nature non invasive et la commodité de l’auto-application du patient à domicile augmentent le potentiel du CES en tant qu’option bénéfique pour l’utilisation généralisée du traitement de la fibromyalgie et l’autogestion de la douleur. Il a été autorisé par la Food and Drug Administration (FDA) des États-Unis comme traitement de l’insomnie, de la dépression, de l’anxiété et de la douleur15.
L’étude actuelle évalue l’efficacité du CES en tant que modalité de traitement de la fibromyalgie en comparant le CES actif (administré par un véritable dispositif d’étude) au CES simulé (administré par un dispositif d’étude fictif). Il existe des preuves préliminaires à l’appui de l’utilisation du CES dans le traitement de la douleur telle que la fibromyalgie16,17. Une étude de 2001 portant sur 60 participants randomisés pour un CES actif ou simulé pendant 3 semaines de séances quotidiennes de 60 minutes a révélé une amélioration de 28% des scores de points sensibles, une amélioration de 27% des scores de douleur générale et aucun effet placebo18. Le CES n’a pas été évalué dans une population d’anciens combattants, ni chez les hommes atteints de fibromyalgie. Une revue systématique du CES financée par le ministère des Anciens Combattants (VA) publiée en 2018 a conclu que les preuves sont insuffisantes pour que le CES ait des effets cliniquement importants sur la fibromyalgie, étant donné que la plupart des essais comportaient des échantillons de petite taille, de courtes durées et un risque élevé de biais dû à une mise en aveugle inadéquate. Cependant, la revue suggère que le CES ne provoque pas d’effets secondaires graves, et il existe des preuves de faible résistance suggérant des avantages modestes chez les patients souffrant d’anxiété et de dépression19. Par conséquent, des recherches supplémentaires sont nécessaires concernant l’utilisation de ce dispositif à faible risque approuvé par la FDA, en particulier dans la fibromyalgie.
Afin d’évaluer pleinement l’efficacité, les chercheurs ont évalué la forme physique ainsi que les biomarqueurs neuronaux et l’expérience de la douleur. Le but du traitement des états douloureux chroniques est d’améliorer la fonction physique. La fibromyalgie est constamment corrélée à des effets négatifs sur la fonction physique et la perception des patients de leurspropres capacités physiques. Des études antérieures ont utilisé des évaluations simples de la condition physique pour déterminer l’endurance et la mobilité, telles que le test de marche en 6 minutes (6MWT)20,21, le test de position assise à debout (5TSTS)20 et diverses mesures de la capacité de charge et de la force dans le contexte des activités quotidiennes22. Pour tenir compte des mesures standard tout en atténuant la quantité d’activité intense requise juste avant une IRM, l’équipe de l’étude a utilisé le test assis debout de 30 secondes comme mesure de l’endurance et de la mobilité, ainsi que les flexions des biceps et un test de préhension comme mesures de la force23. Les mouvements requis dans chacune de ces évaluations sont très courants dans les activités quotidiennes, il s’agit donc d’une mesure claire de la façon dont les gens fonctionnent physiquement dans leur vie quotidienne, avec et sans traitement.
Même avec des évaluations subjectives de la douleur et des mesures de l’efficacité de la fonction physique, les mécanismes du CES ne sont pas entièrement compris. Des études antérieures en neuroimagerie ont cherché à mieux comprendre en explorant l’effet direct du CES sur la connectivité du réseau dans le cerveau. Feusner et al.24 ont constaté que la CES est associée à une désactivation corticale pour 0,5 Hz et à une stimulation 100 μA des régions médianes frontales, pariétales et postérieures bilatérales et ont postulé que la fréquence de la stimulation peut avoir plus d’effet que l’intensité du courant par rapport à la désactivation corticale. Leur groupe a constaté des effets significatifs sur certains nœuds du réseau en mode par défaut (DMN), mais pas tous. Les auteurs suggèrent que, sur la base de ces données, le CES peut affecter la connectivité fonctionnelle à l’état de repos. Il a été démontré que la fibromyalgie et d’autres états de douleur chronique affectent la connectivité cérébrale intrinsèque dans les régions associées à la douleur et à la perception25,26, de sorte que les traitements qui modifient la connectivité fonctionnelle en réponse pourraient s’avérer à la fois bénéfiques et efficaces. Une exploration plus approfondie des effets à plus long terme du traitement quotidien en relation avec l’amélioration clinique, ainsi que de la relation entre l’activation décédée dans le cerveau et les diminutions précédemment observées des fréquences de l’électroencéphalogramme, est nécessaire pour mieux comprendre le mécanisme thérapeutique de l’action27.
L’imagerie par résonance magnétique de connectivité fonctionnelle à l’état de repos (rs-fcMRI) est la méthode de neuroimagerie qui permet d’observer ces changements de connectivité fonctionnelle. L’IRMf longitudinale à l’état de repos permet aux cliniciens et aux chercheurs d’établir une base de référence de la connectivité de l’état de repos et de suivre les altérations au fil du temps en réponse aux méthodes de traitement CES. Il aide également à déterminer comment les changements dans la connectivité fonctionnelle sont corrélés aux différences dans l’expérience de la douleur. Les études initiales de neuroimagerie pour la fibromyalgie ont utilisé la tomographie par émission de positrons (TEP) et la tomographie par émission de photons uniques (SPECT) pour examiner le cerveau, mais il y a des problèmes avec les deux techniques à cet égard : la SPECT a une résolution inférieure à celle de la TEP, et les scanners TEP sont invasifs, ce qui n’est pas préférable pour les patients souffrant de douleur chronique. L’imagerie par résonance magnétique fonctionnelle (IRMf) a une résolution supérieure à celle de la SPECT, mais elle examine l’activité cérébrale en réponse à des actions spécifiques des patients ou à des perceptions de stimuli28. Ce sont les IRMr rs-fc qui peuvent décrire la connectivité fonctionnelle entre les régions du cerveau et peuvent être en mesure de déterminer où et comment la fibromyalgie existe ainsi que les meilleures méthodes de traitement28.
L’évaluation de l’efficacité des traitements non pharmacologiques pour les affections douloureuses telles que la fibromyalgie est de la plus haute importance à la fois dans le contexte actuel de l’épidémie d’opioïdes et dans l’examen de la douleur chronique comme facteur de risque de suicide29,30, qui est considérablement accrue parmi la population des anciens combattants. De plus, le manque de biomarqueurs cliniques adéquats pour la douleur est une lacune reconnue dans les connaissances. L’utilisation d’une combinaison de mesures comportementales et de neuroimagerie à plusieurs moments pour évaluer la réponse au traitement est une nouvelle approche de l’évaluation de la fibromyalgie, tout comme l’utilisation du CES auriculaire comme traitement.
Le protocole vise à combler les lacunes de la recherche sur la fibromyalgie en étudiant les effets du CES sur les résultats de la douleur et de la fonction physique et en évaluant la neuroimagerie en tant qu’outil de biomarqueurs prédictifs et de réponse liés aux résultats cliniques de la thérapie CES31.
Protocole
L’étude a été menée avec l’approbation des comités d’examen institutionnel de l’Université Emory (IRB 112768) et de l’Atlanta VA (1585632-2 ; Numéro de référence interne : 003) ainsi que le comité de R&D de l’Atlanta VA (numéro de référence du conseil d’administration : 3881). Tous les sujets ont donné leur consentement éclairé à l’inclusion avant de participer à cette étude. Pour une représentation visuelle de la chronologie du protocole d’étude, voir la figure 1).
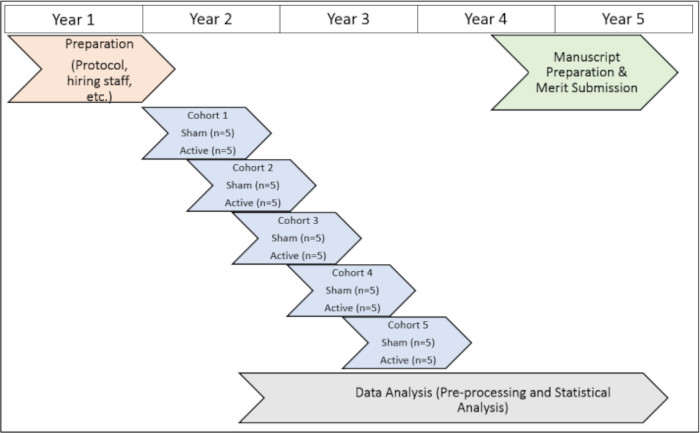
Figure 1 : Chronologie de l’étude. Une représentation visuelle de la chronologie de l’exécution des procédures d’étude pendant la période d’essai. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Recrutement des participants via les méthodes disponibles
- Suivre les directives institutionnelles respectives requises pour la diffusion des supports de recrutement des études (flyers, messages, e-mails, appels, etc.) et les méthodes de recrutement approuvées.
REMARQUE : La présente étude a recruté par le biais de lettres de recrutement envoyées par la poste à des cohortes spécifiques et d’appels téléphoniques de suivi aux participants potentiels. Les détails concernant la commande des appareils CES pour l’étude sont inclus dans les instructions supplémentaires de commande d’appareils CES (fichier supplémentaire 1). - Lorsqu’une personne exprime son intérêt pour participer à une étude, examinez-la par téléphone pour vous assurer qu’elle répond à tous les critères d’inclusion et d’exclusion.
- Inclure les participants qui répondent aux critères d’admissibilité : âgés de 20 à 60 ans (limite fixée lors de l’étude préliminaire pour minimiser les changements structurels cérébraux dus au vieillissement)31 ; diagnostic de fibromyalgie par l’American College of Rheumatology 2016 critères32 ; droitier (afin d’assurer la cohérence de la structure et de la fonction cérébrales) ; un score de douleur de 4 ou plus sur l’échelle d’évaluation de la douleur de la défense et des anciens combattants (DVPRS)33 au cours des 3 mois précédant l’inscription ; un traitement régulier et stable lié à la FM pendant au moins 4 semaines avant l’inscription34 ; et la capacité de tolérer en toute sécurité l’IRM.
- Pour la partie dépistage de la fibromyalgie, remplissez le nouveau critère de diagnostic clinique de la fibromyalgie32 avec le participant potentiel pour obtenir son score d’indice de douleur généralisée (WPI) et son score de gravité (SS). Marquez selon les directives énumérées au bas de la page.
- Pour la partie dépistage du score de douleur, demandez aux participants potentiels d’évaluer verbalement leur douleur moyenne et constante au cours des 3 derniers mois sur une échelle de zéro à dix.
- Pour la partie dépistage par IRM, remplissez un formulaire de dépistage de sécurité par IRM avec le participant potentiel fourni par un établissement ou l’installation de scanner elle-même.
- Demandez aux participants quels sont les critères d’exclusion possibles. Les critères d’exclusion comprennent des antécédents de convulsions ou d’affections neurologiques qui altèrent le cerveau ; grossesse; claustrophobie, implants incompatibles avec l’IRM ou autres affections incompatibles avec l’IRM ; et des antécédents de maladie psychiatrique non contrôlée ou de maladie auto-immune qui entraîne des douleurs et peut mieux expliquer les symptômes31.
- Si l’un des critères d’exclusion s’applique à eux, ils échouent au dépistage. Ne les incluez pas dans l’étude.
- Inclure les participants qui répondent aux critères d’admissibilité : âgés de 20 à 60 ans (limite fixée lors de l’étude préliminaire pour minimiser les changements structurels cérébraux dus au vieillissement)31 ; diagnostic de fibromyalgie par l’American College of Rheumatology 2016 critères32 ; droitier (afin d’assurer la cohérence de la structure et de la fonction cérébrales) ; un score de douleur de 4 ou plus sur l’échelle d’évaluation de la douleur de la défense et des anciens combattants (DVPRS)33 au cours des 3 mois précédant l’inscription ; un traitement régulier et stable lié à la FM pendant au moins 4 semaines avant l’inscription34 ; et la capacité de tolérer en toute sécurité l’IRM.
- Lorsqu’une personne réussit le dépistage, rendez-lui son rendez-vous de consentement et son IRM de base. Prévoyez 2 h pour le consentement et le temps de balayage.
2. Administration des rendez-vous de base, de milieu et de post-participation à l’étude (voir le tableau 1)
REMARQUE : Tous les rendez-vous ont lieu à l’emplacement de l’appareil d’IRM.
| Heure | Activité de recherche | |
| Phase 1 | Semaine 1 | Recrutement, présélection, inscription |
| Phase 2 | Semaines 2 et 3 | Évaluations de base, rs-fcMRI |
| Phase 3 | Semaines 2 à 14 | Intervention |
| Phase 4 | Semaines 6 à 10 | Suivi aigu, rs-fcMRI (6 semaines après le début du traitement) |
| Phase 5 | Semaines 12 à 16 | Suivi à long terme, IRMrs (12 semaines après le début du traitement) |
Tableau 1 : Conception de la recherche. Une chronologie des phases de participation individuelle au cours des 12 semaines de l’étude.
- Avant chaque visite de base, préparez un appareil CES à apporter à chaque participant.
- Ouvrez le boîtier pour vous assurer que l’appareil est à l’intérieur (il doit être dans du papier bulle). Retirez l’arrière de l’appareil et insérez deux piles AAA.
- Replacez l’appareil. Allumez l’appareil pour vous assurer qu’il fonctionne avant de l’apporter au participant. Maintenez le bouton supérieur enfoncé pendant environ 2 secondes jusqu’à ce que l’écran s’allume pour l’allumer, et maintenez-le enfoncé pendant environ 2 secondes jusqu’à ce que l’écran s’éteigne pour l’éteindre.
- Assurez-vous que chaque étui contient l’appareil, des piles supplémentaires, un cordon, un petit applicateur de solution et des clips d’oreille. Assurez-vous que le sac à remettre aux participants contient l’étui de l’appareil, une bouteille de solution conductrice, un capuchon supplémentaire pour remplir le petit applicateur de solution et des électrodes supplémentaires pour clip d’oreille.
- Une fois que leur consentement et leur IRM de base ont été programmés, rencontrez le participant à l’emplacement de l’appareil d’IRM pour le rendez-vous avec deux copies du formulaire de consentement, un appareil CES et son matériel, les documents de test d’admissibilité et un questionnaire à remplir. De plus, apportez le dispositif de transfert de données par lequel les données IRM seront transférées au site d’analyse.
REMARQUE : Cette étude a utilisé une clé USB cryptée.- Pour les documents d’éligibilité, incluez les nouveaux critères de diagnostic clinique de la fibromyalgie32 et le DVPRS33.
REMARQUE : Le DVPRS doit être inclus pour chaque visite. - Pour les tests de fonction physique, inclure un formulaire pour enregistrer les résultats de chaque test 20,21,35.
- Pour les questionnaires que les participants rempliront, inclure les mesures PROMIS appropriées (échelle PROMIS v1.2 - Santé mondiale, Banque d’items Neuro-QOL v2.0 - Fonction cognitive - Format abrégé, Banque d’items PROMIS v1.0 - Consommation de substances/alcool : consommation d’alcool, Banque d’items PROMIS v1.0 - Détresse émotionnelle - Anxiété - Formulaire abrégé 7a, Banque d’articles PROMIS v1.0 - Détresse émotionnelle-dépression - Formulaire abrégé 4a, Banque d’articles PROMIS v1.0 - Fatigue - Formulaire abrégé 6a, PROMIS Item Bank v1.0 - Interférence avec la douleur - Forme abrégée 4a, PROMIS Item Bank v1.2 - Fonction physique - Forme abrégée 8b, PROMIS Item Bank v2.0 - Isolement social - Forme abrégée 4a)36.
- Pour les documents d’éligibilité, incluez les nouveaux critères de diagnostic clinique de la fibromyalgie32 et le DVPRS33.
- À l’emplacement de l’IRM, administrez la visite de base. Appelez le participant à l’avance pour confirmer.
- Lisez le formulaire de consentement complet avec le participant en vous assurant qu’il comprend l’information. Demandez-leur s’ils aimeraient participer et, s’ils sont d’accord, demandez-leur d’écrire leur nom, de signer et de dater le formulaire.
- Après avoir donné son consentement, si le participant choisit de participer à l’étude, remplissez les documents de test d’inclusion avec lui. S’ils sont admissibles à continuer, suivez les étapes ci-dessous ; S’ils ne sont pas admissibles, mettre fin à leur participation à l’étude à ce stade.
- Assurez-vous que les documents de test d’éligibilité comprennent les nouveaux critères de diagnostic clinique de la fibromyalgie et le DVPRS.
- Si un participant est éligible après le test d’inclusion, expliquez-lui comment utiliser le dispositif CES.
- Retirez l’appareil de l’étui et montrez aux participants comment l’allumer et l’éteindre à l’aide du bouton situé en haut. Rappelez aux participants que l’appareil se désactivera automatiquement après 60 minutes.
- Montrez aux participants comment fixer le cordon du clip d’oreille sur le côté. L’extrémité opposée du cordon par rapport aux clips se branche dans un petit trou sur le côté gauche de l’appareil étiqueté avec un « 1 ».
- Montrez comment retirer les anciens électrodes des clips d’oreille et en fixer de nouveaux. Pour retirer les anciens tampons, tirez sur l’adhésif à partir de l’endroit où il se connecte aux clips. Pour fixer de nouveaux électrodes, alignez le trou des électrodes de rechange avec la zone surélevée au centre du clip et appuyez fermement.
REMARQUE : Ne tirez pas les électrodes par la partie molle sur le dessus. Il a tendance à se déchirer et laissera l’adhésif collé aux clips. - Montrez-lui comment fixer les clips d’oreille à ses lobes d’oreille et demandez-lui de l’essayer une fois. Pressez les pointes vertes du clip pour l’ouvrir, positionnez le lobe de l’oreille entre les deux et fermez doucement le clip pour le fixer.
- Montrez-leur comment retirer le couvercle en plastique du petit applicateur de solution et le remplir avec la solution du plus grand flacon (voir les étapes 2.3.3.6 à 2.3.3.8). Rappelez-leur que la solution est nécessaire au bon fonctionnement de l’appareil.
- Pour retirer le haut du petit applicateur de solution, retirez le capuchon et appuyez fermement contre le côté de l’embout. L’embout en plastique se délogera du reste de la bouteille.
- Fixez le capuchon alternatif pour remplir le petit applicateur au sommet du plus grand flacon de solution. Poussez la petite buse vers le haut, glissez-la dans le petit applicateur et pressez la grande bouteille pour la remplir.
- Dites aux participants qu’ils ne doivent ajouter qu’environ 1 à 2 gouttes de la solution à chaque électrode de clip d’oreille. Tout excès de solution doit être tamponné avant utilisation.
- Demandez aux participants d’utiliser l’appareil tous les jours de la semaine pendant 60 minutes le soir, environ 1 heure avant d’aller au lit. Demandez aux participants d’utiliser l’appareil au repos (c’est-à-dire assis ou couchés, sans bouger).
REMARQUE : Pour le temps et la position, les participants ont été autorisés à des variations normales dans leur environnement domestique d’utilisation afin d’augmenter la nature pratique de cette thérapie à domicile. Aucun paramètre n’a été défini pour le son autorisé dans l’environnement ou le stockage requis de l’appareil. - Donnez aux participants un registre vierge de l’appareil et expliquez-leur qu’ils doivent entrer chaque date d’utilisation de l’appareil, leur score de douleur avant et après l’utilisation de l’appareil et l’heure d’utilisation de l’appareil.
- Si les participants ne sont pas en mesure d’utiliser leur appareil pendant un certain temps au cours des 6 semaines entre les rendez-vous, mais qu’ils sont en mesure de prendre les rendez-vous de suivi, laissez-les rester dans l’étude. S’ils ne sont pas en mesure d’utiliser l’appareil ou de se rendre aux visites d’étude, mettez fin à leur participation. Voir le journal supplémentaire de l’appareil CES (fichier supplémentaire 2) pour le journal de l’appareil utilisé dans cette étude.
REMARQUE : Les étapes suivantes seront répétées au cours des trois visites.
- Après l’explication de l’appareil, demandez au participant de faire trois courts tests de fonction physique23. Pour chaque épreuve, un nombre maximal sera enregistré pour le score (nombre total de répétitions pour les deux premières et force par épreuve pour la troisième).
REMARQUE : Le chronomètre utilisé pour cette étude était un Apple iPhone 12.- Administrez le test 30 s assis debout. Suivez les étapes 2.3.4.2 à 2.3.4.6.
- Placez une chaise dos contre le mur de la salle de test. Demandez au participant de s’asseoir sur la chaise, le dos contre le dossier de la chaise.
- Demandez au participant de se lever en position debout, puis de s’asseoir complètement, le dos contre le dossier de la chaise, autant de fois que possible en 30 s.
REMARQUE : S’ils tapent sur la chaise mais ne remettent pas complètement leur poids dessus en position assise, la répétition ne compte pas. - Dites aux participants quand commencer. Démarrez le chronomètre lorsqu’ils commencent à bouger.
- Demandez aux participants de faire des flexions des bras avec un haltère de chaque côté pendant 30 secondes de chaque côté. Commencez par le bras droit d’abord, puis déplacez-vous vers la gauche.
- Enregistrez le nombre total de boucles par côté. Utilisez un poids de 5 lb pour les femmes et un poids de 8 lb pour les hommes. Assurez-vous que les participants sont assis pour le test de flexion des bras.
- Demandez aux participants de faire trois essais de force de préhension avec chaque bras sur un dynamomètre. Suivez les étapes 2.3.4.8 à 2.3.4.11. Commencez par le bras droit d’abord, puis déplacez-vous vers la gauche.
- Placez le dynamomètre dans la main du participant. Ils doivent serrer la poignée en bas et ne pas toucher le cadran en haut.
- Dites aux participants de presser le dynamomètre aussi fort qu’ils le peuvent, puis de le relâcher. L’aiguille sur le cadran s’arrêtera au plus haut niveau de force de préhension qu’ils ont affiché.
- Notez leurs résultats de force de préhension en notant le nombre que l’aiguille atteint sur le cadran. Réinitialisez le cadran entre les répétitions en tournant le petit bouton situé à l’avant du cadran dans le sens inverse des aiguilles d’une montre jusqu’à ce que l’aiguille repose à zéro.
- Assurez-vous que les participants sont assis pour le test de préhension.
REMARQUE : Entre chaque série, les participants reçoivent environ 15 à 20 secondes de repos pendant qu’ils déplacent l’équipement dans leur autre main. Entre chaque épreuve, les participants bénéficieront d’environ 2 minutes de repos pendant que l’équipement et les documents pour la prochaine seront préparés.
- Après les tests de fonction physique, demandez aux participants de remplir le questionnaire avec un stylo. Vérifiez ensuite le paquet pour vous assurer qu’ils ont répondu à toutes les questions.
- Une fois que tous les examens, tests et questionnaires sont remplis, accompagnez les participants jusqu’au scanner IRM lui-même (pour toutes les informations sur le protocole IRM, voir la section 3). Passez en revue le formulaire de dépistage avec les techniciens en IRM et assurez-vous que les participants ont enlevé tout métal de leur personne.
- Assurez-vous que les membres de l’équipe d’étude n’ont pas de métal sur eux.
- Aidez les techniciens en IRM à faire entrer confortablement les participants dans le scanner. Administrer le protocole d’imagerie par résonance magnétique.
- Instruire les participants sur les procédures de sécurité (bouton d’appel de test et haut-parleurs).
- Rappelez aux participants de ne pas bouger du tout pendant le balayage.
- Rappelez aux participants la durée totale du scan, qui doit être de 60 min.
- Une fois le balayage terminé, aidez les participants à sortir du scanner.
- Après l’échographie, terminez la visite de base des participants et planifiez leur visite à mi-parcours pour 6 semaines plus tard. Les participants auront trois visites d’étude au total, chacune à 6 semaines d’intervalle. Envoyez les données IRM vers les serveurs sécurisés de l’étude pour analyse.
- Le jour prévu, administrez la visite de mi-parcours en suivant les étapes de la visite de base. Appelez le participant à l’avance pour confirmer.
- Administrer le DVPRS. Demandez aux participants de retourner leur premier journal d’appareil terminé et de leur fournir un deuxième journal d’appareil.
- Effectuez les étapes 2.3.4 à 2.3.6 (comme lors de la visite de base).
- Terminez la visite des participants à mi-chemin et planifiez leur post-visite pour 6 semaines plus tard. Envoyez les données IRM vers les serveurs sécurisés de l’étude pour analyse.
- Le jour prévu, administrez la post-visite en suivant les étapes de la visite de mi-visite. Appelez le participant à l’avance pour confirmer.
- Administrer le DVPRS. Demandez aux participants de renvoyer leur deuxième journal d’appareil terminé.
- Effectuez les étapes 2.3.4 à 2.3.6 (comme lors de la visite de référence et à mi-parcours). Il n’est pas nécessaire de planifier une visite supplémentaire pour la dernière visite.
- Si des renseignements sont nécessaires pour indemniser les participants, préparez-les et demandez-les lors de cette visite.
REMARQUE : Cette étude nécessitait leur nom et leur adresse pour émettre des chèques de l’Atlanta VA pour l’indemnisation. - Terminer l’après-visite des participants. Envoyez les données IRM vers les serveurs sécurisés de l’étude pour analyse.
REMARQUE : Tout au long de l’étude, assurez-vous d’appeler et de vérifier auprès des participants entre les visites pour vous assurer qu’ils utilisent l’appareil, qu’ils remplissent les journaux de l’appareil et qu’ils savent quand aura lieu leur prochaine visite.
3. Configuration des protocoles d’IRM
- Pour le protocole d’imagerie par résonance magnétique, acquérez BOLD rs-fMRI sur un scanner IRM 3T doté d’une bobine de tête à réseau phasé à 32 canaux à l’aide d’une séquence d’imagerie échoplanaire à gradient (EPI). Utilisez les paramètres MR suivants : FOV (champ de vision) = 220 mm2 ; TR (temps de répétition)/TE (temps d’écho) = 1500/25 ms, facteur d’accélération multibande =3 ; angle de retournement = 50° ; taille de matrice 110 x 110 ; épaisseur de la tranche = 2 mm ; Facteur GRAPPA = 2 ; Fourier partiel de 6/8 ; 34 lignes de référence à codage de phase, 72 coupes axiales entrelacées couvrant l’ensemble du cerveau, environ 350 volumes de balayage pour produire 8 minutes de données IRMf à l’état de repos pour une estimation stable des réseaux de connectivité.
- Dans le protocole pour l’écho de gradient rapide préparé par magnétisation anatomique T1w (MPRAGE), régler TR = 2530 ms, TE = 3 ms, angle de retournement = 7°, épaisseur de la tranche = 0,8 mm, résolution de phase de 1 mm. L’acquisition du T1w dure environ 6 min.
- Acquérez des balayages d’imagerie pondérée en diffusion (DWI) sur un scanner IRM 3T doté d’une bobine de tête multiélément à 32 canaux à l’aide d’un schéma d’imagerie du spectre de diffusion. Collectez un total de 129 directions d’échantillonnage de diffusion avec une valeur b maximale de 3000 s/mm2, une résolution dans le plan de 2x2 mm2 et une épaisseur de coupe de 2 mm.
- Acquérir des données physiologiques (données cardiorespiratoires à l’aide d’un moniteur respiratoire, d’une ceinture et d’une oxymétrie de pouls) simultanément (verrouillées dans le temps) aux données IRMf.
- Transférez en toute sécurité les données IRM de l’emplacement du scanner vers un site sécurisé pour le prétraitement et l’analyse. Convertissez les DICOMS en NIFTI pour vous conformer au formatage BIDS à l’aide de dc2bids v2.1.6.
- Éliminez les données des identificateurs individuels. Utilisez un numéro de sujet d’étude sur toutes les données, le cas échéant. Effectuez un contrôle de qualité pour vous assurer qu’aucun artefact anormal, tel qu’un mouvement excessif, ne s’est produit dans les données via MRIQC v21.0.0.
4. Prétraitement et analyses
- Une fois que les données IRM de l’étude ont été reçues, utilisez deux pipelines distincts pour les analyser : l’un pour analyser la connectivité fonctionnelle entre les participants et l’autre pour analyser la tractographie de la substance blanche.
- Prétraitez les données structurelles T1w et rsfMRI des sujets via fMRIPrep v20.2.5, y compris l’extraction cérébrale, la segmentation tissulaire et la normalisation des images pondérées en T1 (T1w), ainsi que l’estimation du volume de référence, l’estimation du mouvement de la tête, la correction de la synchronisation des coupes et l’enregistrement à la T1w pour les images fonctionnelles. Ce processus aboutit à la normalisation des données T1w et rsfMRI dans l’espace MNI152NLin2009cAsym.
- Utilisez les données IRM prétraitées dans l’analyse de connectivité fonctionnelle (CONN).
- Voir le document supplémentaire fMRIPrep Boilerplate (Dossier supplémentaire 337-56). Pour plus de détails, consultez le lien : https://fmriprep.org/en/stable/
- Importez l’ensemble de données prétraité dans CONN Toolbox v22a pour un traitement ultérieur.
REMARQUE : La boîte à outils CONN a été mise à jour de la v21a à la v22a au cours de cette étude.- Dans la phase de configuration, établissez des covariables de 2ème niveau pour définir les groupes d’étude (TRUE vs. SHAM) pour une analyse ultérieure et assurez-vous de la qualité des images T1w et rsfMRI. Fluidifiez les données IRMf via un noyau gaussien de 8 mm.
- Après le prétraitement, débruitez les données pour éliminer les bruits parasites et physiologiques.
REMARQUE : Cette étude a calculé l’analyse de premier niveau, mais ne l’a pas évaluée ou utilisée, car les chercheurs ne s’intéressent pas aux résultats d’un seul sujet. - Choisissez des graines/ROI et des covariables de sujet et définissez des contrastes. Exécutez une analyse de la graine au voxel au niveau du groupe.
- Une fois les étapes de configuration, de prétraitement et de débruitage terminées pour les pipelines, définissez les seuils de cluster et de voxel pour afficher les modèles de connectivité.
- Voir la figure supplémentaire 1 et le document supplémentaire CES CONN Instructions (Supplementary File 4).
- Utiliser la tractographie corrélationnelle57 déterminer les changements longitudinaux de l’intégrité de la substance blanche corrélés avec le groupe d’expérience afin d’identifier les faisceaux de voies et les régions associées au traitement CES. Voici les principales étapes de l’analyse :
- Convertissez les images DWI brutes de .dcm (DICOM) au format .nii.gz (NIfTI).
- Pré-traitez les images pour corriger les distorsions induites par la susceptibilité à l’aide de TOPUP58,59 de FSL (version 6.0.6) et les distorsions par courants de Foucault à l’aide de l’outil EDDY60 de FSL.
- Générez des mesures de contrôle de la qualité de l’image (CQ) DWI liées au mouvement au niveau du sujet unique et de l’étude à l’aide des outils de contrôle de la qualité EDDY de FSL.
- Exécutez une ANOVA à mesures répétées bidirectionnelles sur ces mesures de CQ pour identifier toute variance entre les groupes susceptible de fausser les résultats de la tractographie de groupe. Si une métrique montre une variance entre les groupes qui est significative (p > 0,05), elle doit être prise en compte comme une covariable dans l’analyse de tractographie corrélationnelle.
- Importez les données prétraitées dans DSI Studio (version « Chen » du 21 novembre 2022) où elles sont converties en fichiers .src (source). Pour plus d’informations sur DSI Studio, reportez-vous au site Web du logiciel (https://dsi-studio.labsolver.org).
- Reconstruisez les données de diffusion importées à l’aide de la reconstruction difféomorphique Q-Space (QSDR)61 pour déterminer les orientations des fibres de matière blanche dans l’espace modèle MNI. Un fichier .fib (orientation de la fibre) est généré pour chaque image. Les options sélectionnées pour la reconstruction sont les suivantes :
méthode (sélection de la méthode de reconstruction) - QSDR
param0 (longueur d’échantillonnage de diffusion) - 1,25 (il s’agit de la valeur par défaut)
template (dans quel espace de modèle reconstruire les données) - ICBM152
align_acpc (si vous devez faire pivoter le volume de l’image pour aligner AC-PC) - 0 (false) - Créez une base de données de connectométrie à partir de ces fichiers .fib, qui extrait les valeurs d’anisotropie quantitative (QA) des données de diffusion reconstruites. Calculez la variation longitudinale de l’assurance qualité pour chaque sujet de la base de données. Ajoutez à la base de données des données démographiques telles que le groupe d’expérience, l’âge, le sexe, ainsi que toutes les covariables identifiées à l’étape de contrôle de la qualité via un fichier .csv.
- Ensuite, chargez la base de données de connectométrie dans l’interface graphique d’analyse de connectométrie de groupe.
- Sélectionnez les covariables à prendre en compte dans l’analyse. L’une de ces covariables sélectionnées est désignée comme la variable d’étude.
- Pour cette analyse, sélectionnez Groupe comme variable d’étude. Les secteurs où les changements longitudinaux de l’assurance qualité sont corrélés avec le groupe seront identifiés, tandis que l’effet des autres covariables sélectionnées sera régressé.
- Les options sélectionnées pour l’analyse de connectométrie de groupe sont les suivantes :
- Contrôle FDR (seuil du taux de fausses découvertes, seules les parcelles présentant une corrélation significative inférieure à FDR seront produites) - 0,05
- Seuil de longueur (valeur en voxels de la longueur minimale du tract utilisée comme hypothèse nulle) - 20 voxels (ou 40 mm pour les tailles de voxels de 2 mm)
- Seuil T (seuil de mesure t-stat pour l’effet de corrélation) - 2,5
- Région d’étude (ce volet permet d’inclure/exclure des régions de l’analyse) - sélectionnez Cerveau entier avec - Exclure le cervelet coché
REMARQUE : Pour cette étude, le cervelet a été exclu en raison de certaines des scintigraphies de diffusion ayant des parties du cervelet coupées lors de l’acquisition.
- Appuyez sur le bouton Exécuter la connectométrie pour effectuer l’analyse, qui génère plusieurs fichiers :
- Un fichier .fib qui stocke les t-stats et peut être ouvert dans DSI studio pour visualiser les t-stats des secteurs avec un QA croissant (stocké sous la forme « inc_t ») ou un QA décroissant (stocké comme « dec_t »), qui sont en corrélation avec Group.
- Un .fdr_dist.values.txt, qui répertorie les valeurs du FDR par rapport à la longueur de la parcelle
- Un .inc.tt.gz qui est un fichier de tractographie qui stocke les secteurs avec une QA longitudinale accrue corrélée avec la variable d’étude. (Groupe dans notre cas). Un fichier .dec.tt.gz stocke les secteurs où l’AQ longitudinal diminué est corrélé à la variable d’étude.
- Un fichier .report.html qui rapporte commodément les résultats de la connectométrie ainsi que les tracés de tractus intégrés, les images, ainsi que les informations standard sur les étapes d’analyse de la tractographie corrélationnelle pour la publication.
REMARQUE : Pour voir des exemples du code R utilisé pour cette étude, consultez les tracés supplémentaires du code R de la SCÉ (fichier supplémentaire 5) et les fichiers Anova supplémentaires du code R CES eddy-qc (fichier supplémentaire 6).
Résultats
En ce qui concerne les résultats du recrutement, les participants ont été principalement recrutés par l’envoi de lettres de recrutement et d’appels téléphoniques de suivi basés sur les réglementations définies du système de santé de l’Atlanta VA. L’équipe de recherche a recruté un total de 50 participants, ce qui prouve l’efficacité des méthodes utilisées pour atteindre l’objectif de recrutement (voir la figure 2). L’utilisation ...
Discussion
Les méthodes de l’étude actuelle offrent non seulement la possibilité d’une modalité de traitement très efficace pour la fibromyalgie, mais également la possibilité d’améliorer le processus de diagnostic de la fibromyalgie dès le premier instant de son profil de symptôme de douleur. L’utilisation à la fois du CES actif et du CES fictif, la découverte du type de chaque dispositif individuel dépendant des numéros de série et d’une clé distincte, a permis de mettre en aveugle les sujets et les cher...
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents connus ou de relations personnelles qui auraient pu sembler influencer les travaux rapportés dans cet article. Les opinions exprimées dans cet article sont celles des auteurs et ne reflètent pas nécessairement la position ou la politique du ministère des Anciens combattants ou du gouvernement des États-Unis.
Remerciements
Les auteurs tiennent à remercier les chercheurs du Center for Visual and Neurocognitive Rehabilitation, y compris le Dr Bruce Crosson et la Dre Lisa Krishnamurthy, pour leur contribution aux travaux. Les auteurs remercient également Grace Ingham pour son aide inestimable dans le processus de tournage. Ce travail a été soutenu en partie par le Rehabilitation Research and Development Service Career Development Award IK2 RX003227(Anna Woodbury) du département des Anciens Combattants des États-Unis (Anna Woodbury) et le Center Grant 5I50RX002358. Le bailleur de fonds n’a aucun rôle dans la conception de l’étude, la collecte de données, la gestion, l’analyse, l’interprétation ou la production de rapports.
matériels
| Name | Company | Catalog Number | Comments |
| 3T Siemens MAGNETOM Prisma Scanner | Siemens Healthineers | N/A | From Emory's website: "The Siemens Magnetom Prisma 3T whole-body MR system is equipped with: a state-of-the art gradient system with a maximum (per axis) strength of 80 mT/m and slew rate of 200 T/m/sec 64 independent RF receiver channels capable of 204 receiver connections a 2-channel RF transmitter. Multiple coils are available, including: a 64-channel head/neck coil with 52 channels for imaging of the head region a 32-channel head-only coil a 20-channel head/neck coil with 16 channels for head spine array coil flexible chest coil large and small flexible coil for extremity imaging. |
| Alpha-Stim AID Kit | Electromedical Products International Inc. | SKU: 500KIT | A total of 50 devices ordered for research purposes. From the site: "A prescription or order from a licensed healthcare professional is required to purchase this device (within the USA). FDA cleared for anxiety, insomnia and pain only, with approval for depression outside of the United States." |
| CONN Toolbox v21a16 (RRID:SCR_009550) | Whitfield-Gabrieli and Nieto-Castanon | Version v21a16 (RRID:SCR_009550) | CONN is an open-source SPM-based cross-platform software for the computation, display, and analysis of functional connectivity Magnetic Resonance Imaging (fcMRI). CONN is used to analyze resting state data (rsfMRI) as well as task-related designs. |
| DSI Studio (RRID:SCR_009557) | Fang-Cheng (Frank) Yeh | RRID:SCR_009557 | DSI Studio is a tractography software tool that maps brain connections and correlates findings with neuropsychological disorders. It is a collective implementation of several diffusion MRI methods, including diffusion tensor imaging (DTI), generalized q-sampling imaging (GQI), q-space diffeomorphic reconstruction (QSDR), diffusion MRI connectometry, and generalized deterministic fiber tracking. |
| fMRIPrep 20.2.5 (RRID:SCR_016216) | NiPreps (NeuroImaging PREProcessing tools) | Version 20.2.5. (RRID:SCR_016216) | A functional magnetic resonance imaging (fMRI) data preprocessing pipeline that is designed to provide an easily accessible, state-of-the-art interface that is robust to variations in scan acquisition protocols and that requires minimal user input, while providing easily interpretable and comprehensive error and output reporting. It performs basic processing steps (coregistration, normalization, unwarping, noise component extraction, segmentation, skull-stripping, etc.) providing outputs that can be easily submitted to a variety of group level analyses, including task-based or resting-state fMRI, graph theory measures, and surface or volume-based statistics. |
| MRIQC | NiPreps (NeuroImaging PREProcessing tools) | MRIQC extracts no-reference IQMs (image quality metrics) from structural (T1w and T2w) and functional MRI (magnetic resonance imaging) data. (not directly used for analyses) | |
| Sammons Preston Jamar Hydraulic Hand Dynamometer | Alpha Med Inc. | SKU SAMP5030J1 | From the website: Ideal for routine screening of grip strength and initial and ongoing evaluation of clients with hand trauma and dysfunction. Unit comes with carrying/storage case, certificate of calibration and complete instructions. Warranted for one full year. The warranty does not cover calibration. Latex free. |
| SPRI 5-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (E) Dark Blue | 5-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
| SPRI 8-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (H) Black |8-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
Références
- Heidari, F., Afshari, M., Moosazadeh, M. Prevalence of fibromyalgia in general population and patients, a systematic review and meta-analysis. Rheumatology International. 37 (9), 1527-1539 (2017).
- Dennis, N. L., Larkin, M., Derbyshire, S. W. G. 'A giant mess' - making sense of complexity in the accounts of people with fibromyalgia. British Journal of Health Psychology. 18 (4), 763-781 (2013).
- Woodbury, A. Opioids for nonmalignant chronic pain. AMA Journal of Ethics. 17 (3), 202-208 (2015).
- Hedegaard, H., Minino, A. M., Spencer, M. R., Warner, M. Drug overdose deaths in the United States, 1999-2020. NCHS Data Brief. 428, 1-8 (2021).
- . Report No.: 17-01846-316. Opioid prescribing to high-risk veterans receiving VA purchased care. Office of Healthcare Inspections. , (2017).
- Perry, R., Leach, V., Davies, P., Penfold, C., Ness, A., Churchill, R. An overview of systematic reviews of complementary and alternative therapies for fibromyalgia using both AMSTAR and ROBIS as quality assessment tools. Systematic Reviews. 6 (1), 97 (2017).
- Martinez-Lavin, M., Hermosillo, A. G. Dysautonomia in Gulf War syndrome and in fibromyalgia. The American Journal of Medicine. 118 (4), 446 (2005).
- Petersel, D. L., Dror, V., Cheung, R. Central amplification and fibromyalgia: disorder of pain processing. Journal of Neuroscience Research. 89 (1), 29-34 (2011).
- Marlow, N. M., Bonilha, H. S., Short, E. B. Efficacy of transcranial direct current stimulation and repetitive transcranial magnetic stimulation for treating fibromyalgia syndrome: A systematic review. Pain Practice. 13 (2), 131-145 (2013).
- Molero-Chamizo, A., et al. Noninvasive transcutaneous vagus nerve stimulation for the treatment of fibromyalgia symptoms: A study protocol. Brain sciences. 12 (1), 95 (2022).
- Cimpianu, C. L., et al. Vagus nerve stimulation in psychiatry: A systematic review of the available evidence. Journal of Neural Transmission. 124 (1), 145-158 (2017).
- Napadow, V., et al. Evoked pain analgesia in chronic pelvic pain patients using respiratory-gated auricular vagal afferent nerve stimulation. Pain Medicine (Malden, Mass). 13 (6), 777-789 (2012).
- Zhang, Y., et al. Transcutaneous auricular vagus nerve stimulation (taVNS) for migraine: an fMRI study. Regional Anesthesia and Pain. 46 (2), 145-150 (2021).
- Tassorelli, C., et al. Noninvasive vagus nerve stimulation as acute therapy for migraine: The randomized PRESTO study. Neurology. 91 (4), e364-e373 (2018).
- . NBC4 Washington - Electrotherapy Device Treats Anxiety, Insomnia, Depression. Alpha-Stim. , (2021).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Bourguignon, C. A randomized, controlled, double-blind pilot study of the effects of cranial electrical stimulation on activity in brain pain processing regions in individuals with fibromyalgia. Explore (NY). 9 (1), 32-40 (2013).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Kinser, P. A., Bourguignon, C. Cranial electrical stimulation improves symptoms and functional status in individuals with fibromyalgia. Pain Management Nursing. 14 (4), 327-335 (2013).
- Lichtbroun, A. S., Raicer, M. M., Smith, R. B. The treatment of fibromyalgia with cranial electrotherapy stimulation. Journal of Clinical Rheumatology. 7 (2), 72-78 (2001).
- Shekelle, P. G., Cook, I. A., Miake-Lye, I. M., Booth, M. S., Beroes, J. M., Mak, S. Benefits and harms of cranial electrical stimulation for chronic painful conditions, depression, anxiety, and insomnia: A systematic review. Annals of Internal Medicine. 168 (6), 414-421 (2018).
- Dailey, D. L., et al. Perceived function and physical performance are associated with pain and fatigue in women with fibromyalgia. Arthritis Research & Therapy. 18, 68 (2016).
- Gowans, S. E., deHueck, A., Voss, S., Silaj, A., Abbey, S. E., Reynolds, W. J. Effect of a randomized, controlled trial of exercise on mood and physical function in individuals with fibromyalgia. Arthritis & Rheumatism. 45 (6), 519-529 (2001).
- Jones, J., Rutledge, D. N., Jones, K. D., Matallana, L., Rooks, D. S. Self-Assessed physical function levels of women with fibromyalgia: A national survey. Women's Health Issues. 18 (5), 406-412 (2008).
- Rikli, R. E., Jones, C. J. Development and validation of criterion-referenced clinically relevant fitness standards for maintaining physical independence in later years. The Gerontologist. 53 (2), 255-267 (2013).
- Feusner, J. D., et al. Effects of cranial electrotherapy stimulation on resting state brain activity. Brain and Behavior. 2 (3), 211-220 (2012).
- Harris, R. E., et al. Pregabalin rectifies aberrant brain chemistry, connectivity, and functional response in chronic pain patients. Anesthesiology. 119 (6), 1453-1464 (2013).
- Napadow, V., Harris, R. E. What has functional connectivity and chemical neuroimaging in fibromyalgia taught us about the mechanisms and management of 'centralized' pain. Arthritis Research & Therapy. 16 (5), 425 (2014).
- Schroeder, M. J., Barr, R. E. Quantitative analysis of the electroencephalogram during cranial electrotherapy stimulation. Clinical Neurophysiology. 112 (11), 2075-2083 (2001).
- Cordes, D., et al. Mapping functionally related regions of brain with functional connectivity MR imaging. American Journal of Neuroradiology. 21 (9), 1636-1644 (2000).
- Hassett, A. L., Aquino, J. K., Ilgen, M. A. The risk of suicide mortality in chronic pain patients. Current Pain and Headache Reports. 18 (8), 436 (2014).
- Stenager, E., Christiansen, E., Handberg, G., Jensen, B. Suicide attempts in chronic pain patients. A register-based study. Scandinavian Journal of Pain. 5 (1), 4-7 (2014).
- Woodbury, A., et al. Feasibility of auricular field stimulation in fibromyalgia: Evaluation by functional magnetic resonance imaging, randomized trial. Pain Medicine. 22 (3), 715-726 (2021).
- Wolfe, F., et al. Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Seminars in Arthritis and Rheumatism. 46 (3), 319-329 (2016).
- Polomano, R. C., et al. Psychometric testing of the defense and veterans pain rating scale (DVPRS): A new pain scale for military population. Pain Medicine. 17 (8), 1505-1519 (2016).
- Electromedical Products International, Inc. . Scientific and clinical literature examination for the Alpha-Stim M microcurrent and cranial electrotherapy stimulator. , (2016).
- Lein, D. H., Alotaibi, M., Almutairi, M., Singh, H. Normative reference values and validity for the 30-second chair-stand test in healthy young adults. International Journal of Sports Physical Therapy. 17 (5), 907-914 (2022).
- Revicki, D. A., Cook, K. F., Amtmann, D., Harnam, N., Chen, W. H., Keefe, F. J. Exploratory and confirmatory factor analysis of the PROMIS pain quality item bank. Quality of Life Research. 23 (1), 245-255 (2014).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310-1320 (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Zhang, Y., Brady, M., Smith, S. Segmentation of brain MR images through a hidden Markov random field model and the expectation-maximization algorithm. IEEE Transactions on Medical Imaging. 20 (1), 45-57 (2001).
- Dale, A. M., Fischl, B., Sereno, M. I. Cortical surface-based analysis: I. Segmentation and surface reconstruction. NeuroImage. 9 (2), 179-194 (1999).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350 (2017).
- Fonov, V. S., Evans, A. C., McKinstry, R. C., Almli, C. R., Collins, D. L. Unbiased nonlinear average age-appropriate brain templates from birth to adulthood. NeuroImage. 47 (Supplement 1), S102 (2009).
- Evans, A. C., Janke, A. L., Collins, D. L., Baillet, S. Brain templates and atlases. NeuroImage. 62 (2), 911-922 (2012).
- Greve, D. N., Fischl, B. Accurate and robust brain image alignment using boundary-based registration. NeuroImage. 48 (1), 63-72 (2009).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Cox, R. W., Hyde, J. S. Software tools for analysis and visualization of fMRI data. NMR in Biomedicine. 10 (4-5), 171-178 (1997).
- Pruim, R. H. R., Mennes, M., van Rooij, D., Llera, A., Buitelaar, J. K., Beckmann, C. F. ICA-AROMA: A robust ICA-based strategy for removing motion artifacts from fMRI data. NeuroImage. 112, 267-277 (2015).
- Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., Petersen, S. E. Methods to detect, characterize, and remove motion artifact in resting state fMRI. NeuroImage. 84, 320-341 (2014).
- Behzadi, Y., Restom, K., Liau, J., Liu, T. T. A component based noise correction method (CompCor) for BOLD and perfusion based fMRI. NeuroImage. 37 (1), 90-101 (2007).
- Satterthwaite, T. D., et al. An improved framework for confound regression and filtering for control of motion artifact in the preprocessing of resting-state functional connectivity data. NeuroImage. 64, 240-256 (2013).
- Lanczos, C. Evaluation of noisy data. Journal of the Society for Industrial and Applied Mathematics Series B Numerical Analysis. 1 (1), 76 (1964).
- Oscar, E., et al. fMRIPrep: A robust preprocessing pipeline for functional MRI. Nature Methods. 16, 111-116 (2019).
- Oscar, E., et al. FMRIPrep. Software. Zenodo. , (2018).
- Gorgolewski, K. J., et al. Nipype: a flexible, lightweight and extensible neuroimaging data processing framework in python. Frontiers in Neuroinformatics. 5, 13 (2011).
- Gorgolewski, K. J., et al. Nipype. Software. Zenodo. , (2018).
- Abraham, A., et al. Machine learning for neuroimaging with scikit-learn. Frontiers in Neuroinformatics. 8, 14 (2014).
- Yeh, F. -. C., Badre, D., Verstynen, T. Connectometry: A statistical approach harnessing the analytical potential of the local connectome. NeuroImage. 125 (2016), 162-171 (2015).
- Andersson, J. L. R., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. NeuroImage. 20 (2), 870-888 (2003).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. 23 (S1), 208-219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. NeuroImage. 125, 1063-1078 (2016).
- Yeh, F. -. C., Tseng, W. -. Y. I. NTU-90: a high angular resolution brain atlas constructed by -q-space diffeomorphic reconstruction. Neuroimage. 58 (1), 91-99 (2011).
- Nieto-Castanon, A. Cluster-Level Inferences. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Hemington, K. S., Wu, Q., Kucyi, A., Inman, R. D., Davis, K. D. Abnormal cross-network functional connectivity in chronic pain and its association with clinical symptoms. Brain Structure & Function. 221 (8), 4203-4219 (2016).
- Ichesco, E., et al. Altered resting state connectivity of the insular cortex in individuals with fibromyalgia. Journal of Pain. 15 (8), 815-826 (2014).
- Kim, J., et al. The somatosensory link in fibromyalgia: functional connectivity of the primary somatosensory cortex is altered by sustained pain and is associated with clinical/autonomic dysfunction. Arthritis & Rheumatology. 67 (5), 1395-1405 (2015).
- Napadow, V., LaCount, L., Park, K., As-Sanie, S., Clauw, D. J., Harris, R. E. Intrinsic brain connectivity in fibromyalgia is associated with chronic pain intensity. Arthritis and Rheumatism. 62 (8), 2545-2555 (2010).
- Napadow, V., Kim, J., Clauw, D. J., Harris, R. E. Decreased intrinsic brain connectivity is associated with reduced clinical pain in fibromyalgia. Arthritis and Rheumatism. 64 (7), 2398-2403 (2012).
- Puiu, T., et al. Association of alterations in gray matter volume with reduced evoked-pain connectivity following short-term administration of pregabalin in patients with fibromyalgia. Arthritis & Rheumatology. 68 (6), 1511-1521 (2016).
- Fallon, N., Chiu, Y., Nurmikko, T., Stancak, A. Functional Connectivity with the default mode network is altered in fibromyalgia patients. PLoS One. 11 (7), e0159198 (2016).
- Wang, Y., Kang, J., Kemmer, P. B., Guo, Y. An efficient and reliable statistical method for estimating functional connectivity in large scale brain networks using partial correlation. Frontiers in Neuroscience. 10, 123 (2016).
- Mease, P. J., et al. Estimation of minimum clinically important difference for pain in fibromyalgia. Arthritis Care and Research (Hoboken). 63 (6), 821-826 (2011).
- Bingel, U., et al. Somatotopic organization of human somatosensory cortices for pain: a single trial fMRI study. NeuroImage. 23 (1), 224-232 (2004).
- Wager, T. D., et al. Pain in the ACC. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2474-E2475 (2016).
- Nieto-Castanon, A. . FMRI Denoising Pipeline. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Friston, K. J., Williams, S., Howard, R., Frackowiak, R. S., Turner, R. Movement-related effects in fMRI time-series. Magnetic Resonance in Medicine. 35 (3), 346-355 (1996).
- Hallquist, M. N., Hwang, K., Luna, B. The nuisance of nuisance regression: spectral misspecification in a common approach to resting-state fMRI preprocessing reintroduces noise and obscures functional connectivity. NeuroImage. 82, 208-225 (2013).
- Chai, X. J., Nieto-Castanon, A., Ongur, D., Whitfield-Gabrieli, S. Anticorrelations in resting state networks without global signal regression. NeuroImage. 59 (2), 1420-1428 (2012).
- Nieto-Castanon, A. General Linear Model. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Worsley, K. J., Marrett, S., Neelin, P., Vandal, A. C., Friston, K. J., Evans, A. C. A unified statistical approach for determining significant signals in images of cerebral activation. Human Brain Mapping. 4 (1), 58-73 (1996).
- Chumbley, J., Worsley, K., Flandin, G., Friston, K. Topological FDR for neuroimaging. NeuroImage. 49 (4), 3057-3064 (2010).
- Page, S. J., Persch, A. C. Recruitment, retention, and blinding in clinical trials. The American Journal of Occupational Therapy. 67 (2), 154-161 (2013).
- McGrath, R. E., Mitchell, M., Kim, B. H., Hough, L. Evidence for response bias as a source of error variance in applied assessment. Psychological Bulletin. 136 (3), 450-470 (2010).
- Robinson-Papp, J., George, M. C., Dorfman, D., Simpson, D. M. Barriers to chronic pain measurement: A qualitative study of patient perspectives. Pain Medicine. 16 (7), 1256-1264 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon