Method Article
הנדסה לא ויראלית של תאי T אנושיים ראשוניים באמצעות אינטגרציה ממוקדת בתיווך הומולוגיה של תבניות DNA גדולות
In This Article
Summary
פרוטוקול מפורט מסופק לשימוש בטכנולוגיית CRISPR/Cas9 כדי להשיג דפיקה ממוקדת יעילה ביותר של מבנים גדולים ומולטי-ציסטרוניים בתאי T אנושיים ראשוניים באמצעות מסלול תיקון ה-DNA בתיווך הומולוגיה (HMEJ). תאי T המהונדסים עם פרוטוקול זה הניתן להתאמה ל-cGMP שומרים על התרחבות תאים מצוינת, ציטוטוקסיות וייצור ציטוקינים.
Abstract
טיפולים תאיים מאמצים רבים כיום מסתמכים על וקטורים לנטיים או רטרו-ויראליים כדי להנדס תאי T לביטוי של קולטן אנטיגן כימרי (CAR) או קולטן תאי T אקסוגני (TCR) כדי להתמקד באנטיגן ספציפי הקשור לגידול. הסתמכות על וקטורים ויראליים לייצור תאי T טיפוליים מגדילה משמעותית את ציר הזמן, העלות והמורכבות של הייצור תוך הגבלת התרגום של טיפולים חדשים, במיוחד במסגרת האקדמית. מוצג תהליך להנדסה יעילה לא ויראלית של תאי T באמצעות CRISPR/Cas9 והצטרפות קצה בתיווך הומולוגיה להשגת אינטגרציה ממוקדת של מטען DNA גדול ומולטי-ציסטרוני. גישה זו השיגה תדרי אינטגרציה דומים לאלו של וקטורים נגיפיים תוך הפקת תאי T בעלי תפקוד גבוה המסוגלים ליעילות אנטי-גידולית חזקה הן במבחנה והן ב-vivo. יש לציין כי שיטה זו ניתנת להתאמה מהירה לשיטות ייצור טובות (cGMP) הנוכחיות ולהגדלה קלינית, ומספקת אפשרות לטווח הקרוב לייצור תאי T טיפוליים לשימוש בניסויים קליניים.
Introduction
תאי T הם מרכיב מרכזי במערכת החיסון הנרכשת, בעלי יכולת ציטוליטית ישירה, יכולת לווסת את התגובה החיסונית באמצעות ייצור ציטוקינים, רישוי של תאי B ותאים דנדריטיים, וביסוס זיכרון חיסוני1. הם ממלאים תפקידים קריטיים בהתפתחות חיסונית, הומאוסטזיס ומעקב, הגנה מפני פתוגנים ומניעה והגנה מפני סרטן, כמו גם אלרגיה ואוטואימוניות1. לתאי T יש מגוון עצום של קולטני תאי T (TCR) הנוצרים באמצעות רקומבינציה של V(D)J, המאפשרים לתאי T לזהות מגוון עצום של אנטיגנים ולהרכיב תגובות חיסוניות יעילות נגד פתוגנים שונים 1,2. תאי T יכולים להיות מסווגים בדרך כלל לשתי קטגוריות, תאי CD4 T, הידועים גם כתאי T עוזרים, המסייעים בעיקר לתאים חיסוניים אחרים, כגון תאי B, בתיאום התגובה החיסונית, ותאי CD8 T, או תאי T ציטוטוקסיים, שהורגים ישירות תאים נגועים או סרטניים על ידי זיהוי אנטיגנים ספציפיים המוצגים על פני השטחשלהם.
הפיתוח של קולטני אנטיגן כימריים (CAR) הוביל לעלייה מסיבית בעניין בהנדסת הגנום של תאי T לאימונותרפיה. CARs הם חלבונים מהונדסים הממזגים תחומי קשירת אנטיגן שמקורם בנוגדנים עם תחומי איתות של תאי T, ומאפשרים לתאי T לזהות ולמקד תאים המבטאים את האפיטופ הספציפי המזוהה על ידי חלק הנוגדנים של CAR3. קולטנים אלה שימשו למגוון אימונותרפיות, כולל מחלות זיהומיות ואוטואימוניות, אך הטכנולוגיה מתקדמת ביותר עבור אימונותרפיה לסרטן.
תאי CAR-T הצליחו מאוד בטיפול בלוקמיה ולימפומה, אך הראו יעילות מוגבלת לטיפול בגידולים מוצקים 4,5. זה הוביל לגל של פיתוח נוסף המבקש לשפר את היעילות של תאי CAR-T לאינדיקציות גידול מוצקות. פותחו גישות מרובות, כולל שריון ציטוקינים, נוקאאוט של גן מחסום, קולטנים שליליים דומיננטיים, קולטני כימוקין, ביטוי CARs מרובים בתא אחד, שינוי ה-CAR כדי לשפר את האיתות התוך-תאי, ושילוב בלוקוסים שנקבעו מראש, למשל, לוקוס TRAC, כדי לנצל מנגנוני ויסות מארח למניעת תשישות 6,7,8. רבות מהגישות הללו דורשות מטען גנטי גדול יותר ו/או אינטגרציה ספציפית לאתר. גישות חלופיות כוללות גם שימוש ב-TCRs טרנסגניים כדי לאפשר לתאי T להתמקד בניאו-אנטיגנים תוך-תאיים 9,10. עם זאת, יש לכך חיסרון משמעותי בכך שהוא דורש מה-TCR להיות ספציפי הן לאפיטופ הניאו-אנטיגן והן למולקולת HLA, מה שמגביל את השימוש במוצר הטיפולי הסופי לחולים המבטאים את ה-HLA הקוגנטי. יתר על כן, גידולים רבים משנים או מפחיתים את ביטוי HLA בתגובה לאימונותרפיה, מה שמפחית מאוד את היעילות של תאי T המבטאים TCRs טרנסגניים11.
רוב הטיפולים בתאי CAR-T או TCR-T בניסויים קליניים מיוצרים באמצעות וקטורים רטרו-ויראליים, כגון lentivirus או gammaretrovirus, ומשיגים תדירות אינטגרציה גבוהה עם מטען בגודל בינוני. עם זאת, וקטורים נגיפיים סובלים מלוחות זמנים ארוכים של ייצור עקב הדרישות הנוכחיות של תנאי ייצור נאותים (cGMP) ופרופילי אינטגרציה לא ספציפיים היוצרים סיכון למוטגנזה החדרתית12,13. יתר על כן, זה יכול להיות קשה לייצר רטרו-וירוס טרנסגני בטיטרים גבוהים אם המטען עולה על 5 kb14. וקטורים אחרים, כגון אלה שמקורם בנגיף אדנו-קשור רקומביננטי (rAAV), אינם משתלבים באופן טבעי אך יכולים להעביר תבנית תורם DNA לגרעין וניתן להשתמש בהם בשילוב עם CRISPR/Cas9 כדי להקל על הנדסת גנום מסורתית בתיווך הומולוגיה (HDR). עם זאת, לנגיפים אלה יש גם תהליכי ייצור ארוכים ומסובכים והם מוגבלים על ידי גודל המטען (<4.7 kb) והצורך לכלול זרועות הומולוגיה ארוכות (500-1000 bp)15,16,17,18.
הנדסת גנום לא ויראלית באמצעות טרנספוזונים או שילוב של נוקלאזות ממוקדות ותבנית תורם DNA דווחה בלימפוציטים אנושיים ראשוניים 8,19,20. עם זאת, גישות אלו מוגבלות על ידי התגובה הרעילה למולקולות DNA עירומות בציטופלזמה לאחר זיהוי על ידי חיישני DNA ציטופלזמיים המתבטאים בלימפוציטים21. נעשו ניסיונות להשתמש במעכבי מולקולות קטנות של מסלולי חישת DNA אלה במהלך טרנספקציה, אך היתירות של מסלולים אלה עלולה לסבך את השימוש בהם בפרוטוקולי cGMP22. יש לציין כי וקטורים של טרנספוזונים, כגון Sleeping Beauty, PiggyBac ו-Tc Buster, מאפשרים שילוב של מטען גנטי גדול עם יעילות גבוהה, אך יש להם פרופיל אינטגרציה לא ספציפי23,24. שילוב טרנסגנים לא ויראלי וממוקד באמצעות תבניות DNA פלסמיד, ליניאריות או חד-גדיליות בשילוב עם נוקלאז ממוקד ל-HDR הוא אלטרנטיבה מושכת, אך הוגבל על ידי יעילות ירודה, במיוחד עם מטענים גנטיים גדולים יותר ויותר, עם יעילות של פחות מ-10% שדווחה בעת שימוש במטען מעל 1.5 kb 8,19.
כאן, אנו מציגים את הפרוטוקול שלב אחר שלב להכנסת הצטרפות קצה לא ויראלית, בתיווך הומולוגיה (HMEJ) של מטענים גדולים של DNA בתאי T אנושיים ראשוניים, כמתואר ב- Webber, Johnson et al.25. HMEJ משתמש בזרועות הומולוגיה קצרות של 48 bp המוקפות באתרי יעד Cas9 gRNA כדי לאפשר אינטגרציה ממוקדת ביעילות גבוהה של מטען DNA גדול בהשוואה ל-HDR מסורתי. שיטה אחת להפחתת הציטוטוקסיות של DNA פלסמיד בתאי T ראשוניים היא שימוש בפלסמידים עם עמוד שדרה ממוזער, כגון מיני-עיגולים או ננו-פלסמידים25. מיני-עיגולים הם וקטורי פלסמיד ממוזערים המיוצרים על ידי כריתה של מקור השכפול וגן העמידות לאנטיביוטיקה באמצעות רקומבינציה לאחר הגברת פלסמיד; הם הוכחו כמשפרים את ההנדסה הלא ויראלית של תאי T ומפחיתים את רעילות התאים23,24. לננו-פלסמידים יש גם גודל כולל מופחת המושג באמצעות שימוש במקור מינימלי של שכפול וסמן בחירה לא מסורתי26. מניסיוננו, פלטפורמות וקטור מיני-מעגל וננו-פלסמיד מציעות שיפור דומה ביעילות ורעילות מופחתת על פני פלסמידים מסורתיים25.
כאן, אנו מציגים פרוטוקול מפורט המשלב אופטימיזציה זמנית של אספקת ריאגנטים והרכב ריאגנטים, כמו גם שימוש ב-HMEJ ו-CRISPR/Cas9 כדי להשיג יעילות גבוהה, הנדסת גנום ספציפית לאתר של תאי T אנושיים ראשוניים עם תבניות DNA מולטי-ציסטרוני גדולות (>6.3 kb) לשימוש באימונותרפיה ומגוון יישומים אחרים25. אנו משיגים אינטגרציה גבוהה יותר עם זרועות הומולוגיה HMEJ ו-48 bp מאשר עם HR מסורתי באמצעות זרועות הומולוגיה של 1 kb, במיוחד עם מטענים גנטיים >1.5 kb25,27. חשוב לציין, תאי T שהונדסו באמצעות תיקון HMEJ שומרים על התרחבות תאים מצוינת, ציטוטוקסיות וייצור ציטוקינים, תוך שמירה על פנוטיפ25 שאינו מותש. פרוטוקול זה ניתן להתאמה בקלות לתקני cGMP וניתן להרחבה למספרי תאים רלוונטיים מבחינה קלינית, ומאפשר מעבר מהיר לשימוש עתידי במגוון ניסויים קליניים25.
Protocol
כל הניסויים בוצעו עם אמצעי זהירות אוניברסליים לפתוגנים הנישאים בדם, בטכניקה סטרילית/אספטית, ציוד מגן אישי וציוד בטיחות ביולוגית מתאים ברמה 2 (BSL2). כל הניסויים המתוארים כאן אושרו על ידי הוועדה המוסדית לבטיחות ביולוגית (IBC) באוניברסיטת מינסוטה. פרטים על הריאגנטים והציוד המשמש במחקר זה מפורטים בטבלת החומרים.
1. הכנת מדיה
- הכינו תוספים למדיה שלמה של תאי T (TCM).
- להרכיב מחדש IL-2 אנושי רקומביננטי לריכוז של 12000 IU/mL על ידי הוספת חומצה אצטית מעוקרת בפילטר של 100 מ"מ ולערבב היטב על ידי פיפטינג. לאחר מכן, יש לדלל עוד יותר לריכוז של 6000 IU/mL עם אלבומין סרום בקר (BSA) מעוקר בפילטר ב-1x מי מלח עם חוצץ פוספט (1x PBS) ולערבב היטב על ידי פיפטינג ליצירת תמיסת אחסון מורחבת.
- הרכיבו מחדש IL-7 אנושי רקומביננטי לריכוז של 200 ננוגרם/מיקרוליטר עם מים סטריליים וערבבו היטב על ידי פיפטינג. לאחר מכן, יש לדלל עוד יותר לריכוז של 100 ננוגרם/מיקרוליטר עם עיקור מסנן של 0.2% BSA ב-PBS ולערבב היטב על ידי פיפטינג ליצירת פתרון אחסון מורחב.
- הרכיבו מחדש IL-15 אנושי רקומביננטי לריכוז של 200 ננוגרם/מיקרוליטר עם מים סטריליים וערבבו היטב על ידי פיפטינג. לאחר מכן, יש לדלל עוד יותר לריכוז של 100 ננוגרם/מיקרוליטר עם עיקור מסנן של 0.2% BSA ב-PBS ולערבב היטב על ידי פיפטינג ליצירת פתרון אחסון מורחב.
הערה: שמור כל ציטוקין בכמויות קטנות בטמפרטורה של -20 מעלות צלזיוס עד -80 מעלות צלזיוס למשך עד שישה חודשים והימנע ממחזורי הקפאה/הפשרה חוזרים ונשנים.
- הכן מדיית TCM.
- הכן את החומר הבסיסי על ידי הוספת 2.6% תוסף הרחבת תאי T ו-2.5% תחליף סרום תאי חיסון למדיום הבסיסי של הרחבת תאי T. ראה טבלת חומרים לפרטים.
- הכינו את הרפואה הסינית המסורתית על ידי הוספת 1% L-גלוטמין, 1% פניצילין/סטרפטומיצין, 10 מ"מ של N-אצטיל-L-ציסטאין, 300 יחב"ל/מ"ל IL-2 רקומביננטי אנושי, 5 ננוגרם/מ"ל IL-7 אנושי רקומביננטי ו-5 ננוגרם/מ"ל IL-15 אנושי רקומביננטי למצע הבסיסי.
- עקרו את הרפואה הסינית המסורתית על ידי העברת מדיה דרך מסנן של 0.22 מיקרומטר לתוך בקבוק מדיה סטרילי.
- יש לשמור על הרפואה הסינית המסורתית בטמפרטורה של 4 מעלות צלזיוס למשך עד שבועיים.
- הכן את החומר הבסיסי על ידי הוספת 2.6% תוסף הרחבת תאי T ו-2.5% תחליף סרום תאי חיסון למדיום הבסיסי של הרחבת תאי T. ראה טבלת חומרים לפרטים.
- הכן מדיית שחזור.
- הכן את החומר הבסיסי על ידי הוספת 2.6% תוסף הרחבת תאי T, ו-2.5% תחליף סרום תאי חיסון למדיום הבסיסי של הרחבת תאי T.
- הכן את מצע ההתאוששות על ידי הוספת 1% L-גלוטמין, 10 מ"מ של N-אצטיל-L-ציסטאין, 300 IU/mL IL-2 רקומביננטי אנושי, 5 ננוגרם/מ"ל IL-7 אנושי רקומביננטי, 5 ננוגרם/מ"ל IL-15 אנושי רקומביננטי למדיה הבסיסית ו-1 מיקרוגרם/מ"ל DNase.
הערה: אין להוסיף פניצילין/סטרפטומיצין למדיית ההתאוששות, מכיוון שהיא עלולה להפחית את התאוששות התאים לאחר אלקטרופורציה. - עקר את מדיית השחזור על ידי העברת מדיה דרך מסנן של 0.22 מיקרומטר לתוך בקבוק מדיה מעוקר.
- שמור על מדיית השחזור בטמפרטורה של 4 מעלות צלזיוס למשך עד שבועיים.
- הכן את מצע ההתאוששות על ידי הוספת 1% L-גלוטמין, 10 מ"מ של N-אצטיל-L-ציסטאין, 300 IU/mL IL-2 רקומביננטי אנושי, 5 ננוגרם/מ"ל IL-7 אנושי רקומביננטי, 5 ננוגרם/מ"ל IL-15 אנושי רקומביננטי למדיה הבסיסית ו-1 מיקרוגרם/מ"ל DNase.
- הכן את החומר הבסיסי על ידי הוספת 2.6% תוסף הרחבת תאי T, ו-2.5% תחליף סרום תאי חיסון למדיום הבסיסי של הרחבת תאי T.
2. בחירת אתר ועיצוב תבניות
- קבע מיקום יעד גנומי לדפיקה.
הערה: ניתן להשתמש במיקום נמל מבטחים, כגון AAVS1, אם רוצים השפעה מינימלית על תא המטרה. ניתן להשתמש באתר מטרה המשבש את ביטוי הגנים כדי להפיל בו זמנית את גן המטרה ולדפוק את המבנה המעניין בצעד אחד. אתר יעד ותורם שנועדו להשתלב בתוך המסגרת עם גן אנדוגני יכולים לשמש ליצירת איחוי גנים או בשילוב עם רצף דילוג ריבוזומלי 2A כדי למקם את המבנה תחת בקרת שעתוק של מקדם אנדוגני (איור 1). - תכנן את תבנית המטען כך שקלטת הביטוי מוקפת בזרועות הומולוגיה של 48 bp התואמות את אתר האינטגרציה ומשני צדיה אתרי יעד gRNA ליניאריים.
הערה: ה-gRNA הליניאריזציה של הפלסמיד יכול להיות gRNA28 אוניברסלי (UgRNA) (GGGAGGCGUUCGGGCCACAG) שנועד למקד לרצף (GGGAGGCGTTCGGGCCACAG) שאינו נמצא בגנום האנושי או העכברי25, או ברצף ה-gRNA של המטרה הגנומית, כך ש-gRNA יחיד יכול לחתוך באתר הדפיקה הגנומי וגם להפוך את תבנית המטען לליניארית (איור 1). ננו-פלסמידים או מיני-עיגולים יכולים לשמש כווקטורים לתבנית המטען. ניתן להשתמש בפלסמידים סטנדרטיים במקום ננו-פלסמידים או מיני-עיגולים עבור כמה קווים שעברו טרנספורמציה, אך יגרמו להפחתת הדפיקות והתרחבות התאים בתאים ראשוניים רגישים יותר כגון תאי T.
3. בידוד והפעלה של תאי T
- השג תאי T מספק מסחרי או בודד תאי T מ-PBMCs באמצעות מיון אימונומגנטי18.
- קבע את מספר תאי ה-T הדרושים לניסוי ולאחר מכן הפשר, שטוף והשהה מחדש תאי T בריכוז של 1 ×-106 תאים למ"ל ברפואה הסינית המסורתית. הוסף 1 מ"ל מהתערובת הזו לבארות של צלחת של 24 בארות.
- מערבולת חרוזי הפעלת תאי T כדי להשעות מחדש את החרוזים ולהוסיף את החרוזים ביחס של 2:1 חרוזים: תא לכל באר. דגרו על תאים אלה למשך 36 שעות בחממה של 37 מעלות צלזיוס ו-5% CO2 לפני שתתחילו בהנדסת תאי T.
הערה: זמן דגירה של פחות או יותר מ-36 שעות לאחר ההפעלה יפחית את יעילות הדפיקה, הכדאיות והתרחבות התאים לאחר ההנדסה25.
- מערבולת חרוזי הפעלת תאי T כדי להשעות מחדש את החרוזים ולהוסיף את החרוזים ביחס של 2:1 חרוזים: תא לכל באר. דגרו על תאים אלה למשך 36 שעות בחממה של 37 מעלות צלזיוס ו-5% CO2 לפני שתתחילו בהנדסת תאי T.
4. הנדסת תאי T
- לקבוע את תנאי הניסוי הנדרשים להשלמת הניסוי, כולל בקרות ניסוי.
הערה: חשוב לכלול מצב פלסמיד בלבד כבקרה לביטוי אפיזומלי. מצב אלקטרופורציה עם אתר המטרה השונה כימית gRNA28 ו/או Cas9 mRNA בהיעדר תורם פלסמיד יכול לשמש גם כבקרה שלילית. - הכן צלחת התאוששות.
- עבור כל תנאי ניסוי, כולל בקרות ניסיוניות, הוסף 300 מיקרוליטר של אמצעי התאוששות לבאר של צלחת תרבית רקמה של 24 בארות וחמם את הצלחת בחממה של 37 מעלות צלזיוס ו-5% CO2 .
הערה: עיין בטבלה 1 לקבלת מספרי תאים חלופיים, נפח שחזור ותנאים.
- עבור כל תנאי ניסוי, כולל בקרות ניסיוניות, הוסף 300 מיקרוליטר של אמצעי התאוששות לבאר של צלחת תרבית רקמה של 24 בארות וחמם את הצלחת בחממה של 37 מעלות צלזיוס ו-5% CO2 .
- הכן תאי T.
- קצרו את תערובת חרוזי ההפעלה של תאי T / תאי T מגורה, ספרו תאים ברי קיימא והשעו מחדש את חרוזי ההפעלה של תאי T / תאי T בריכוז של 1-5 × 106 תאים / מ"ל במדיה TCM בצינור מיקרוצנטריפוגה של 1.5 מ"ל.
- הנח את צינור המיקרו-צנטריפוגה במגנט (ראה טבלת חומרים) ואפשר לו לדגור למשך 3 דקות.
הערה: הסרת חרוזים נדרשת אם משתמשים בחרוזי הפעלת תאי T להפעלת תאי T. ייתכן שלא יהיה צורך בהסרת חרוזים אם נעשה שימוש בשיטת הפעלה חלופית. - לאחר הדגירה וללא הוצאה מהמגנט, העבירו את המדיה ותאי ה-T לצינור חדש. צינור זה מכיל תאי T מגורים עם חרוזי הפעלת תאי T שהוסרו. ספרו מחדש את תאי ה-T והניחו אותם בצינורות חרוטיים של 14 מ"ל או 50 מ"ל. מלאו את הצינור ב-1× PBS ושמרו את התאים בחממה של 37 מעלות צלזיוס ו-5% CO2 עד שהם מוכנים לצנטריפוגה.
- הכן תערובת תאי T.
- קבעו את כמות המאגר מיקס (82% תמיסת תאים ראשונית ו-18% תוסף) הדרושה על ידי הכפלת מספר תנאי האלקטרופורציה בתוספת אחד (n + 1). (למשל 6 תנאי אלקטרופורציה מתוכננים + 1 = 7. 7 × 18 מיקרוליטר לכל מצב = 126 מיקרוליטר של מאגר מיקס מאסטר).
הערה: נפחים אלה ספציפיים למערכת האלקטרופורציה 4D המשמשת במחקר זה (ראה טבלת חומרים). מערכות אלקטרופורציה אחרות ידרשו נפחים וריכוזים שונים. נפח תמיסת התא הראשוני = הנפח הכולל של מאגר מיקס מאסטר הדרוש × 0.82 ונפח התוסף = הנפח הכולל של מאגר מאסטר מיקס הדרוש x 0.18. (למשל 0.82 × 126 מיקרוליטר = 103.32 מיקרוליטר של תמיסת תא ראשונית ו-0.18 × 126 מיקרוליטר = 22.68 מיקרוליטר). - ערבבו את תמיסת התא הראשוני והתוסף יחד כדי ליצור מאגר מיקס.
- תאי צנטריפוגה T ב-1x PBS למשך 10 דקות ב-200 × גרם (בטמפרטורת החדר) ושואבים מהסופרנטנט.
- השעו מחדש את תאי ה-T במאגר Master Mix בריכוז של 1 ×-106 תאים לכל 18 מיקרוליטר של Master Mix Buffer.
- קבעו את כמות המאגר מיקס (82% תמיסת תאים ראשונית ו-18% תוסף) הדרושה על ידי הכפלת מספר תנאי האלקטרופורציה בתוספת אחד (n + 1). (למשל 6 תנאי אלקטרופורציה מתוכננים + 1 = 7. 7 × 18 מיקרוליטר לכל מצב = 126 מיקרוליטר של מאגר מיקס מאסטר).
- הכן ריאגנטים.
- באמצעות ריכוזי תמיסות המלאי, קבע את נפח הפלסמיד HMEJ, אתר היעד gRNA, gRNA ליניאריזציה של פלסמיד (UgRNA) ו-Cas9 mRNA הדרושים להשגת המסה המצוינת לכל אלקטרופורציה (טבלה 2).
- הוסף ריאגנטים לבאר של צלחת של 96 בארות על קרח לכל מצב.
- הכן תערובת אלקטרופורציה.
- הוסף 18 מיקרוליטר של תערובת תאי T לכל באר של צלחת 96 הבאר לפי הצורך.
- הוסיפו מאגר מיקס נוסף לפי הצורך כדי להבטיח שכל תנאי האלקטרופורציה יהיו בנפח כולל סופי של 22 מיקרוליטר.
הערה: נפח של 22 מיקרוליטר כולל נפח עודף של 10% כדי להסביר אובדן פיפטינג פוטנציאלי.
- בצע אלקטרופורציה.
- הפעל את הציוד וטען את התוכנית.
- קבע את מספר הקובטות הדרושות ופתח את מספר הקובטות הנדרש. סמנו קצה אחד של הקובט והפקק והסירו את הפקק מהקובטה.
הערה: ישנן 16 בארות לכל קובטה לתגובות של 20 מיקרוליטר. - פיפטה בעדינות 20 מיקרוליטר של תערובת האלקטרופורציה מבארות של 96 הבארות צלחת למעלה ולמטה 1-2 פעמים והעמיסו בקובטות.
- כסום את הקובט באמצעות הסימון שנעשה בשלב 4.7.2 כדי להימנע מהנחת המכסה לאחור. הקש על הקובט 3-5 פעמים כדי להסיר בועות אוויר פוטנציאליות, ולאחר מכן הנח את הציוד והחשמל את הקובטה.
- הסר בעדינות את הקובט מהציוד, הנח אותו במכסה המנוע ואפשר לתאים לנוח במשך 15 דקות בטמפרטורת החדר.
- לאחר השאר, משוך 80 מיקרוליטר של אמצעי התאוששות מחוממים מלוח השחזור והוסף לכל דגימה (הוסף לצד הקובטה, לא ישירות לתאים), פיפטה בעדינות רבה למעלה ולמטה פעם אחת, והעביר את הנפח הכולל של 100 מיקרוליטר בחזרה ללוחית השחזור.
הערה: תאים שבירים מאוד לאחר אלקטרופורציה. טיפול עדין הוא חשוב ביותר. - דגרו על התאים בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 למשך 30 דקות.
- הוסיפו את הרפואה הסינית המסורתית כדי לדלל את התאים לריכוז של 1 × 106 תאים/מ"ל. החליפו מחצית מהמדיה למחרת ולאחר מכן כל 3-4 ימים ברפואה הסינית המסורתית בריכוזי ציטוקינים של 2× למשך הניסוי.
- לאחר דילול ל-1 ×-106 תאים/מ"ל, עורר מחדש את התאים על ידי הוספת חרוזי הפעלת תאי T ביחס של 0.5:1 חרוזים: תא לכל באר.
הערה: ייתכן שהתאים מתרחבים במהירות. ייתכן שיהיה צורך לבצע שינויים בחצי מדיה, וייתכן שיהיה צורך להעביר תאים לבארות גדולות יותר. - ביום השלישי, הסר את חרוזי ההפעלה של תאי T.
- לאחר משך הצמיחה הרצוי, קצרו את התאים.
הערה: אם יש בארות שאינן בשימוש בקובטה, ניתן לסמן את הבארות המשומשות, ולמקם את הקובט כולו בחרוט של 50 מ"ל ולאחסן בטמפרטורה של 4 מעלות צלזיוס לשימוש עתידי.
תוצאות
כאן, תבנית מולטי-ציסטרונית גדולה (>6.3 קילו-בייט) הנקראת מבנה "מיני-מעגל ענק" שולבה בלוקוס TRAC בתאי T אנושיים ראשוניים באמצעות עריכת CRISPR/Cas9; gRNA ספציפי ל-TRAC (TCTCTCAGCTGGTACACGGC), ה-UgRNA וננו-פלזמיד HMEJ (איור 2A) עם מצב חסר gRNA ספציפי ל-TRAC, ה-gRNA האוניברסלי ו-Cas9 mRNA המשמש כבקרה שלילית. לדגימות הכוללות את מבנה ה-Giant Minicircle, gRNA ספציפי ל-TRAC, ה-gRNA האוניברסלי ו-Cas9 mRNA היה שיעור דפיקה ממוצע של 23.35% בעת מדידת ביטוי GFP (23.5% ±-5.247), בעוד שהביקורת השלילית לא הראתה ביטוי GFP (איור 2B). לא היו הבדלים משמעותיים בהתרחבות הקפל (איור 2C) ובכדאיות (איור 2D) בין תנאי הניסוי. תוצאות אלו מדגימות דפיקה ביעילות גבוהה של תבנית גדולה מאוד תוך שמירה על כדאיות תאים מצוינת והרחבת תאים.

איור 1: ייצוג סכמטי של תכנון מבנה HMEJ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
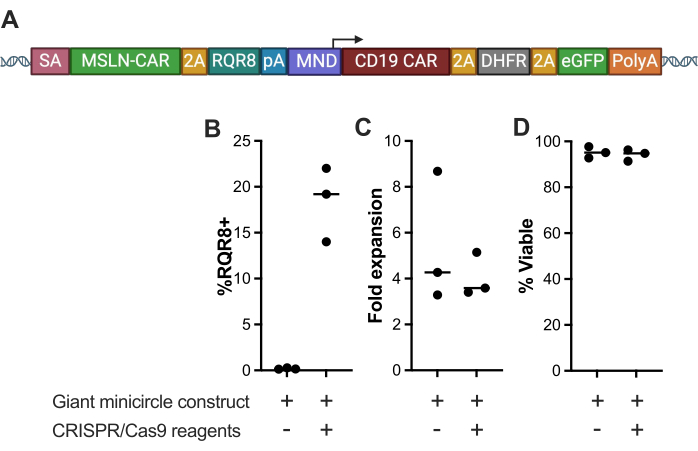
איור 2: אפיון של תאי T שעברו אלקטרופוטציה עם מבנה המיני-מעגל הענק. (A) ייצוג סכמטי של מבנה ה-Giant Minicircle, תבנית מולטי-ציסטרונית גדולה (>6.3 kb) המקודדת CAR אנטי-מזותלין ו-RQR8 תחת מקדם TRAC עם מקשר GSG, אנטי-CD19 CAR, ו-DHFR mutein ו-eGFP תחת מקדם MND. (B) אחוז ביטוי RQR8, (C) התרחבות קיפול, ו-(D) כדאיות של תאי T תשעה ימים לאחר האלקטרופורציה עם מבנה ה-Giant Minicircle וריאגנטים CRISPR-Cas9, בהשוואה לבקרה שלילית עם ה-Giant Minicircle חסר ריאגנטים של CRISPR-Cas9. (***p < 0.001). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| גודל צלחת | נפח קובט | תאים/באר | נפח מדיית השחזור | נפח של 1x TCM עם NAC | סה"כ נפח סופי |
| צלחת 24 בארות | 22/22 מיקרוליטר | 1-3 x 106 | 300 מיקרוליטר | 680 מיקרוליטר | 1 מ"ל |
| צלחת 6 בארות | 100/110 מיקרוליטר | 4-20 על 106 | 1 מ"ל | 2.9 מ"ל | 4 מ"ל |
| צלחת G-Rex 24 בארות | 20-110 מיקרוליטר | 1-20 על 106 | 400 מיקרוליטר | 5.6 מ"ל | 6 מ"ל |
טבלה 1: ריכוזי תאים עבור קובטות ולוחות התאוששות.
| גודל קובט | תבנית פלסמיד | אתר יעד gRNA | ליניאריזציה של פלסמיד gRNA | Cas9 mRNA |
| 20 מיקרוליטר | 1-2 מיקרוגרם (1 מיקרוגרם) | 1-3 מיקרוגרם (1 מיקרוגרם) | 1-3 מיקרוגרם (1 מיקרוגרם) | 1-3 מיקרוגרם (1.5 מיקרוגרם) |
| 100 מיקרוליטר | 5-10 מיקרוגרם (5 מיקרוגרם) | 5-15 מיקרוגרם (5 מיקרוגרם) | 5-15 מיקרוגרם (5 מיקרוגרם) | 5-15 מיקרוגרם (5 מיקרוגרם) |
טבלה 2: כמות ריאגנטים של CRISPR/Cas9 ותבנית DNA הדרושה.
Discussion
ככל שטיפול תאי מאמץ (ACT) ממשיך להתפתח, יש ביקוש הולך וגובר לשיטות יעילות ולא ויראליות להנדסת תאים חיסוניים ללא העלות והמורכבות הגבוהות הכרוכות בווקטורים מבוססי וירוסים. מטרה מרכזית בתחום זה היא השגת אינטגרציה ספציפית לאתר, המשפרת את העקביות, הבטיחות והתפקוד של מוצרים סלולריים מהונדסים. בעוד שמחקרים אחרונים הראו אינטגרציה לא ויראלית מוצלחת של מבנים גנטיים קטנים, כגון גנים מדווחים ורצפי CAR או TCR בודדים29, יש צורך להרחיב את השיטות הללו לקלטות ביטוי גדולות יותר ומרובות גנים. קלטות גדולות יותר אלה נחוצות לשיפור תפקוד תאי החיסון, כגון תוספת של קולטני כימוקין או שריון ציטוקינים, שיפור הספציפיות (למשל, מערכות שער לוגיות), או הגברת הבטיחות עם מתגי השבתה. לשם כך, ביקשנו לפתח גישות לא ויראליות המסוגלות לשלב באופן יעיל ספציפי לאתר של מטען גנטי גדול יותר25.
ישנם מספר שלבים קריטיים לאורך הפרוטוקול. נדרש ננו-פלזמיד או מיני-עיגול איכותי ונקי כדי למזער את הרעילות. במחקר זה, פלסמידים שהוכנו מסחרית ביצעו את הביצועים הטובים ביותר. פרק הזמן של 36 השעות בין הפעלת תאי T לאלקטרופורציה הוא גם קריטי לתוצאות אידיאליות. חשוב גם למזער את הטיפול והמניפולציה בתאים מיד לאחר האלקטרופורציה בזמן שהתאים מתאוששים. חשוב גם להוסיף מחדש חרוזי הפעלה חדשים של תאי T לתרבית לאחר האלקטרופורציה כדי להשיג את תדירות שילוב המטען הטובה ביותר האפשרית והרחבת התאים.
הפרוטוקול, כמתואר כאן, משתמש במערכת אלקטרופורציה זמינה מסחרית (ראה טבלת חומרים). מערכות אלקטרופורציה אחרות עשויות להתאים גם כן, אך סביר להניח שהן ידרשו אופטימיזציה של תנאי האלקטרופורציה הספציפיים למכשיר ואולי טיפול בתאים לאחר אלקטרופורציה.
ישנן מספר מגבלות להנדסה בתיווך HMEJ של תאי T אנושיים. הפרוטוקול יכול לעבוד עם פלסמיד, אך תוצאות אופטימליות דורשות שימוש בננו-פלסמידים או מיני-עיגולים למשלוח מטען, שאינם קלים לייצור כמו פלסמידים סטנדרטיים. יתר על כן, למרות שהודגמה אינטגרציה מוצלחת של קלטת מולטי-ציסטרונית גדולה מאוד, סביר להניח שיש גבול מטען עליון שבו תדירות שילוב הגנים תתחיל לרדת.
מחקר זה מציג את HMEJ כשיטה עוצמתית ויעילה להנדסת גנום לא ויראלית לייצור תאי T מהונדסים, במיוחד בהקשר של אימונותרפיה לסרטן. על ידי התגברות על המגבלות של וקטורים נגיפיים מסורתיים, גישה זו מציעה אלטרנטיבה חסכונית, ניתנת להרחבה ובטוחה יותר ליצירת תאי T מהונדסים גנטית עם פונקציונליות משופרת. היכולת לשלב קלטות גדולות ומרובות גנים בדיוק פותחת אפשרויות חדשות להנדסת תאים חיסוניים לטיפול במגוון רחב של מחלות, כולל סרטן, מחלות זיהומיות והפרעות אוטואימוניות. יתר על כן, התאימות של שיטת HMEJ לתהליכי ייצור ברמה קלינית מבטיחה את היישום המעשי שלה במסגרות טיפוליות בעולם האמיתי, וסוללת את הדרך לטיפולים מבוססי תאים נגישים ויעילים יותר בעתיד הקרוב.
Disclosures
B.R.W. ו-B.S.M. הם החוקרים העיקריים של הסכמי מחקר ממומנים הממומנים על ידי Intima Biosciences כדי לתמוך בעבודה בכתב יד זה. הוגשו פטנטים המכסים את השיטות והגישות המתוארות בכתב יד זה.
Acknowledgements
B.R.W. מכיר במימון ממשרד הגילוי והתרגום, מענקי NIH R21CA237789, R21AI163731, P01CA254849, P50CA136393, U54CA268069, R01AI146009, מענקי DOD HT9425-24-1-1005, HT9425-24-1-1002, HT9425-24-1-0231 וקרן מחקר סרטן ילדים, קרן המחקר לאנמיה של פנקוני וקרן הסרטן והקהילה של רנדי שייבר. B.S.M. מכיר במימון ממשרד הגילוי והתרגום, מענקי NIH R01AI146009, R01AI161017, P01CA254849, P50CA136393, U24OD026641, U54CA232561, P30CA077598, U54 CA268069, מענקי DOD HT9425-24-1-1005, HT9425-24-1-1002, HT9425-24-1-0231, והקרן לחקר סרטן ילדים, קרן המחקר לאנמיה של פנקוני וקרן הסרטן והקהילה של רנדי שייבר.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic Acid | Millipore Sigma | A6283 | |
| 1x DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190144 | |
| 2.5% CTS Immune Cell Serum Replacement | Thermo Fisher Scientific | A2596101 | |
| Amaxa P3 Primary Cell 4D-Nucleofactor X Kit L | Lonza | V4XP-3024 | |
| Amaxa P3 Primary Cell 4D-Nucleofactor X Kit S | Lonza | V4XP-3032 | |
| Bovine Serum Albumin | Thermo Fisher Scientific | 15561020 | |
| Chemically Modified Guide RNAs | Integrated DNA Technologies | na | Custom design |
| CleanCap Cas9 mRNA | Trilink | L-7206 | |
| CTS OpTmizer T cell Expansion Media SFM +OpTmizer T cell Expansion Supplement | Thermo Fisher Scientific | A1048501 | |
| DNase I | Stem Cell Technologies | 07900 | |
| Dynabeads Human T-Activator CD3/CD28 | Thermo Fisher Scientific | 11141D | |
| DynaMag-2 | Thermo Fisher Scientific | 12321D | |
| Human IL15 | PeproTech | 200-15 | |
| Human IL2 | PeproTech | 200-02 | |
| Human IL7 | PeproTech | 200-07 | |
| L-Glutamine | Thermo Scientific | 25030081 | |
| Lonza 4D nucelofector Core | Lonza | AAF-1003B | |
| Lonza 4D nucelofector X Unit | Lonza | AAF-1003X | |
| Minicircle | System Biosciences | MN910A-1 | Custom design |
| N-Acetyl-L-cysteine | MiliporeSigma | A9165 | |
| Nanoplasmid | Aldevron | na | Custom design |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15-140-122 |
References
- Sun, L., Su, Y., Jiao, A., Wang, X., Zhang, B. T cells in health and disease. Signal Transduct Target Ther. 8 (1), 235(2023).
- Takahama, Y. Journey through the thymus: stromal guides for T-cell development and selection. Nature reviews. Immunology. 6 (2), 127-135 (2006).
- Dotti, G., Gottschalk, S., Savoldo, B., Brenner, M. K. Design and development of therapies using chimeric antigen receptor-expressing T cells. Immunol Rev. 257 (1), 107-126 (2014).
- DeRenzo, C., Gottschalk, S. Genetic modification strategies to enhance CAR T cell persistence for patients with solid tumors. Front Immunol. 10, 218(2019).
- Liu, X., et al. A chimeric switch-receptor targeting PD1 augments the efficacy of second-generation CAR T cells in advanced solid tumors. Cancer Res. 76 (6), 1578-1590 (2016).
- Yeku, O. O., Purdon, T. J., Koneru, M., Spriggs, D., Brentjens, R. J. Armored CAR T cells enhance anti-tumor efficacy and overcome the tumor microenvironment. Sci Rep. 7 (1), 10541(2017).
- Schober, K., et al. Orthotopic replacement of T-cell receptor α- and β-chains with preservation of near-physiological T-cell function. Nat Biomed Eng. 3 (12), 974-984 (2019).
- Roth, T. L., et al. Reprogramming human T cell function and specificity with non-viral genome targeting. Nature. 559 (7714), 405-409 (2018).
- Chandran, S. S., Klebanoff, C. A. T cell receptor-based cancer immunotherapy: Emerging efficacy and pathways of resistance. Immunol Rev. 290 (1), 127-147 (2019).
- Rosenberg, S. A., Restifo, N. P. Adoptive cell transfer as personalized immunotherapy for human cancer. Science (New York, N.Y.). 348 (6230), 62-68 (2015).
- Campoli, M., Ferrone, S. HLA antigen and NK cell activating ligand expression in malignant cells: a story of loss or acquisition. Semin Immunopathol. 33 (4), 321-334 (2011).
- Walther, W., Stein, U. Viral vectors for gene transfer: a review of their use in the treatment of human diseases. Drugs. 60 (2), 249-271 (2000).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53(2021).
- Kumar, M., Keller, B., Makalou, N., Sutton, R. E. Systematic determination of the packaging limit of lentiviral vectors. Hum Gene Ther. 12 (15), 1893-1905 (2001).
- Samulski, R. J., Muzyczka, N. AAV-mediated gene therapy for research and therapeutic purposes. Annu Rev Virol. 1 (1), 427-451 (2014).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature reviews. Drug Discov. 18 (5), 358-378 (2019).
- Pomeroy, E. J., et al. a genetically engineered primary human natural killer cell platform for cancer immunotherapy. Mol Ther. 28 (1), 52-63 (2020).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Sci Rep. 8 (1), 12144(2018).
- Nguyen, D. N., et al. Polymer-stabilized Cas9 nanoparticles and modified repair templates increase genome editing efficiency. Nat Biotechnol. 38 (1), 44-49 (2020).
- Lock, D., et al. Automated, scaled, transposon-based production of CAR T cells. J Immunother Cancer. 10 (9), e005189(2022).
- Semenova, N., et al. Multiple cytosolic DNA sensors bind plasmid DNA after transfection. Nucleic Acids Res. 47 (19), 10235-10246 (2019).
- Wimberger, S., et al. Simultaneous inhibition of DNA-PK and Polϴ improves integration efficiency and precision of genome editing. Nat Comm. 14 (1), 4761(2023).
- Monjezi, R., et al. Enhanced CAR T-cell engineering using non-viral Sleeping Beauty transposition from minicircle vectors. Leukemia. 31 (1), 186-194 (2017).
- Kay, M. A., He, C. -Y., Chen, Z. -Y. A robust system for production of minicircle DNA vectors. Nat Biotechnol. 28 (12), 1287-1289 (2010).
- Webber, B. R., et al. Cas9-induced targeted integration of large DNA payloads in primary human T cells via homology-mediated end-joining DNA repair. Nat Biomed Eng. 8, 1553-1570 (2024).
- Williams, J. A., Paez, P. A. Improving cell and gene therapy safety and performance using next-generation Nanoplasmid vectors. Mol Ther Nucleic Acids. 32, 494-503 (2023).
- Wierson, W. A., et al. Efficient targeted integration directed by short homology in zebrafish and mammalian cells. eLife. 9, 53968(2020).
- Hendel, A., et al. Chemically modified guide RNAs enhance CRISPR-Cas genome editing in human primary cells. Nat Biotechnol. 33 (9), 985-989 (2015).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Front Immunol. 13, 867013(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved