Formula Massa di Composti Covalenti
Le formule chimiche rappresentano la composizione elementale delle sostanze. Per i composti covalenti, la formula rappresenta i numeri e i tipi di atomi che compongono una singola molecola della sostanza; pertanto, la massa della formula può essere correttamente indicata come una massa molecolare. La formula molecolare del cloroformio (CHCl3), un composto covalente, indica che una singola molecola contiene un atomo di carbonio, un atomo di idrogeno e tre atomi di cloro. La massa molecolare media di una molecola cloroformio è uguale alla somma delle masse atomiche medie di questi atomi:
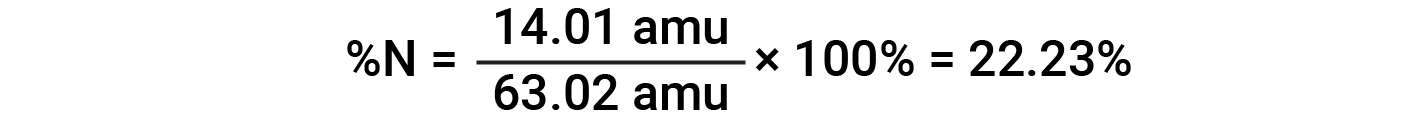
Formula Massa di Composti Ionici
I composti ionici sono composti da formazioni discrete e anioni che sono combinati in rapporti per produrre materia sfusa elettricamente neutra. La massa della formula per un composto ionico è calcolata allo stesso modo della massa della formula per i composti covalenti: sommando le masse atomiche medie di tutti gli atomi nella formula del composto. Tuttavia, la formula per un composto ionico non rappresenta la composizione di una molecola discreta, quindi non può essere correttamente definita "massa molecolare".
Ad esempio, il sale da tavola comune o cloruro di sodio (NaCl) è un composto ionico composto da formazioni di sodio (Na+) e anioni cloruro (Cl−) combinati in un rapporto 1:1. La massa della formula per questo composto è calcolata aggiungendo le masse atomiche medie dei suoi elementi costitutivi:
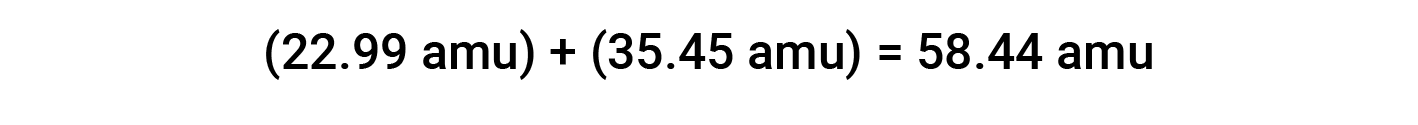
Quando si calcola la massa della formula di un composto ionico, sono state utilizzate le masse medie di atomi neutri di sodio e cloro, piuttosto che le masse per formazioni di sodio e anioni cloruro. Anche se un catione di sodio ha una massa leggermente più piccola di un atomo di sodio (dal momento che manca un elettrone), questa differenza sarà compensata dal fatto che un anione cloruro è leggermente più massiccio di un atomo di cloro (a causa dell'elettrone extra). Inoltre, la massa di un elettrone è trascurabilmente piccola rispetto alla massa di un atomo tipico.
Composizione percentuale di massa
La composizione elementale di un composto definisce la sua identità chimica e le formule chimiche sono il modo più conciso di rappresentare questo trucco elementale. La percentuale in massa di ogni elemento nel composto è chiamata percentuale di massa di quel particolare elemento. La composizione percentuale può essere calcolata dividendo la massa di ogni elemento per la massa complessiva del composto e quindi convertendosi in una percentuale.
La composizione percentuale è utile per valutare l'abbondanza relativa di un dato elemento in diversi composti di formule conosciute. Finché è nota la formula molecolare o empirica del composto in questione, la composizione percentuale può essere derivata dalle masse atomiche o molare degli elementi del composto.
Ad esempio, una molecola di acido nitrico (HNO 3 )contieneun atomo di azoto del peso di 14,01 amu, un atomo di idrogeno del peso di 1,008 amu e tre atomi di ossigeno del peso (3 × 16,00 amu) = 48,00 amu. La massa della formula dell'acido nitrico è quindi (14,01 amu + 1,008 amu + 48,00 amu) = 63,02 amu, ed è la composizione percentuale è:
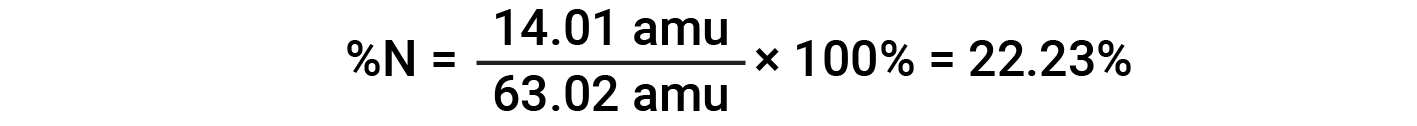
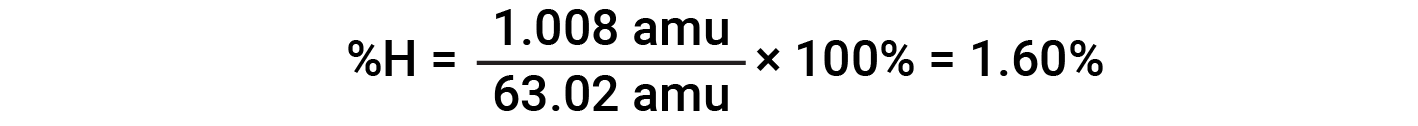
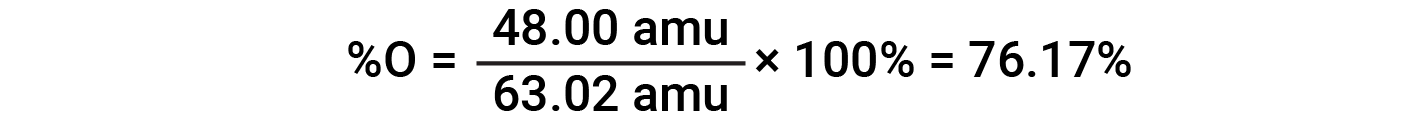
Questo testo è adattato da Openstax, Chemistry 2e, Section 3.1: Formula Mass and the Mole Concept and Openstax, Chemistry 2e, Section 3.2: Determining Empirical and Molecular Formulas.
Dal capitolo 3:

Now Playing
3.8 : Formula di Massa e Concetto di mole dei composti
Molecole, composti ed equazioni chimiche
62.8K Visualizzazioni

3.1 : Molecole e composti
Molecole, composti ed equazioni chimiche
52.1K Visualizzazioni

3.2 : Formule chimiche
Molecole, composti ed equazioni chimiche
48.3K Visualizzazioni

3.3 : Modelli molecolari
Molecole, composti ed equazioni chimiche
37.3K Visualizzazioni

3.4 : Classificazione di elementi e composti
Molecole, composti ed equazioni chimiche
64.1K Visualizzazioni

3.5 : Composti ionici: formule e nomenclatura
Molecole, composti ed equazioni chimiche
65.4K Visualizzazioni

3.6 : Composti molecolari: formule e nomenclatura
Molecole, composti ed equazioni chimiche
42.2K Visualizzazioni

3.7 : Composti organici
Molecole, composti ed equazioni chimiche
50.6K Visualizzazioni

3.9 : Determinazione sperimentale della formula chimica
Molecole, composti ed equazioni chimiche
36.9K Visualizzazioni

3.10 : Equazioni chimiche
Molecole, composti ed equazioni chimiche
61.7K Visualizzazioni